
YASMINIQ
DROSPIRENONA, ETINILESTRADIOL
Comprimidos recubiertos
1 Blíster , 28 Comprimidos recubiertos
INFORMACIÓN ADICIONAL:
Almacenamiento: No se exponga a temperaturas superiores a 30 °C.
Vida útil: La vida útil es 36 meses.
No utilizar después de la fecha de caducidad indicada en el envase.
Listado de excipientes:
— Lactosa monohidrato.
— Almidón de maíz.
— Povidona 25000 (Polividona 25).
— Estearato de magnesio.
— Hipromelosa (hidroxipropilmetilcelulosa).
— Talco.
— Dióxido de titanio (E171).
— Pigmento de óxido de hierro rojo (E172).
Vía de administración: Oral.
VENTA BAJO RECETA MÉDICA.
SmPC FDA_CCDS 16_Rev. Junio 2015
Fabricado por:
Schering do Brasil Química e Farmacêutica Ltda. São Paulo – Brasil.
Importado y distribuido por:
BAYER S.A., PERÚ
Av. Paseo de la República 3074,
Piso 10 – San Isidro
CONCENTRACIONES Y FORMA DE PRESENTACIÓN: YASMINIQ® (drospirenona/etinilestradiol) comprimidos se presenta en un envase blíster.
El blíster (28 comprimidos recubiertos) contiene lo siguiente:
— 24 comprimidos rosa claro, cada uno contiene 3 mg de drospirenona (DRSP) y 0,02 mg de etinilestradiol (EE) como clatrato de betadex.
— 4 comprimidos blancos inertes.
El listado de excipientes se encuentra en la sección Información Adicional.
INDICACIONES Y USO:
Anticonceptivo oral: YASMINIQ® está indicado para mujeres que desean prevenir el embarazo.
Trastorno disfórico premenstrual (TDPM): YASMINIQ® también está indicado para el tratamiento de los síntomas del trastorno disfórico premenstrual (TDPM) en mujeres que eligen utilizar un anticonceptivo oral como método anticonceptivo. No se ha evaluado la eficacia de YASMINIQ® en TDPM cuando se utiliza durante más de tres ciclos menstruales.
Las principales características del TDPM según el Manual de Diagnóstico y Estadística-4ta edición (Diagnostic and Statistical Manual-4th edition, DSM-IV) incluye marcado estado depresivo, ansiedad o tensión, inestabilidad afectiva e ira o irritabilidad persistente. Otras características son menor interés en actividades usuales, dificultad para concentrarse, falta de energía, cambio de apetito o sueño y sentimiento de fuera de control. Los síntomas físicos asociados al TDPM incluyen la sensibilidad mamaria, cefalea, dolor en músculos y articulaciones, hinchazón y aumento de peso. En este trastorno, estos síntomas se producen de manera regular durante la fase lútea y remiten a los pocos días después del inicio del perodo. El trastorno interfiere marcadamente con el trabajo o la escuela, o con las actividades sociales usuales y las relaciones con los demás. Los proveedores de atención médica realizan el diagnóstico siguiendo los criterios del DSM-IV, con la sintomatología evaluada prospectivamente durante al menos dos ciclos menstruales. Al efectuar el diagnóstico, se debe tener cuidado de descartar otros trastornos cíclicos del estado de ánimo.
YASMINIQ® no ha sido evaluado para el tratamiento del síndrome premenstrual (SPM).
Acné: YASMINIQ® está indicado para el tratamiento del acné vulgaris moderado en mujeres de al menos 14 años de edad, que no presentan contraindicaciones conocidas al tratamiento anticonceptivo oral y que han tenido su menarquía. YASMINIQ® debe utilizarse para el tratamiento del acné solo si la paciente desea tomar un anticonceptivo oral para la anticoncepción.
FARMACOCINÉTICA:
Absorción: La biodisponibilidad absoluta de la DRSP a partir de un comprimido de entidad única es de alrededor del 76%. La biodisponibilidad absoluta del EE es de aproximadamente el 40% como resultado de la conjugación presistémica y el metabolismo de primera pasada. No se ha evaluado la biodisponibilidad absoluta de YASMINIQ®, que es un comprimido combinado de DRSP y EE estabilizado con betadex en forma de clatrato (complejo de inclusión molecular). La biodisponibilidad de EE es similar cuando se administra la dosis mediante la formulación con clatrato de betadex comparada con cuando se administra como esteroide libre. Las concentraciones séricas de DRSP y de EE alcanzaron los niveles pico dentro de 1-2 horas después de la administración de YASMINIQ®.
La farmacocinética de DRSP es proporcional a la dosis siguiendo dosis únicas de 1 - 10 mg. Después de la administración diaria de YASMINIQ®, las concentraciones de estado estable de DRSP se observaron al cabo de 8 días. Se produjo una acumulación de aproximadamente 2 a 3 veces la Cmáx sérica y de los valores del ABC (0-24h) de DRSP después de la administración de múltiples dosis de YASMINIQ® (ver Tabla 2).
Las condiciones de estado estable del EE se alcanzan durante la segunda mitad de un ciclo de tratamiento. Después de la administración diaria de YASMINIQ® la Cmáx sérica y los valores del ABC(0-24h) del EE acumularon un factor de aproximadamente 1,5 a 2 (ver Tabla 2).
|
Tabla 2: Parámetros farmacocinéticos medios de YASMINIQ® (3 mg de DRSP y 0,02 mg de EE) |
|||||
|
DRSP |
|||||
|
Ciclo/Día |
Cant. de participantes |
Cmáxa |
Tmáxb |
ABC(0–24h)a |
t1/2 a |
|
1/1 |
23 |
38,4 (25) |
1,5 (1–2) |
268 (19) |
NDc |
|
1/21 |
23 |
70,3 (15) |
1,5 (1–2) |
763 (17) |
30,8 (22) |
|
EE |
|||||
|
Ciclo/Día |
Cant. de participantes |
Cmáxa |
Tmáxb |
ABC(0–24h)a |
t1/2 a |
|
1/1 |
23 |
32,8 (45) |
1,5 (1–2) |
108 (52) |
NDc |
|
1/21 |
23 |
45,1 (35) |
1,5 (1–2) |
220 (57) |
NDc |
|
a. Media geométrica (coeficiente geométrico de la variación). b. Mediana (rango). c. ND: No disponible. |
|||||
Efecto de los alimentos: La tasa de absorción de DRSP y de EE después de la administración única de una formulación similar a YASMINIQ® fue más lenta habiendo ingerido alimentos (comida con alto contenido graso) con una Cmáx sérica que se redujo en un 40 % en ambos componentes. Sin embargo, el grado de absorción de DRSP, no sufrió cambios. A diferencia, el grado de absorción de EE se redujo un 20% habiendo ingerido alimentos.
Distribución: Las concentraciones séricas de DRSP y EE declinan en dos fases. El volumen aparente de distribución de DRSP es de aproximadamente 4 L/kg y se informa que el del EE es de alrededor de 4 - 5 L/kg.
La DRSP no se une a la globulina fijadora de hormonas sexuales (SHBG) ni a la globulina fijadora de corticosteroides (corticosteroid binding globulin, CBG) pero se une a alrededor del 97% de otras proteínas séricas. La administración de dosis múltiples durante 3 ciclos no produjo cambios en la fracción libre (medida a concentraciones mínimas). Se informa que el EE tiene una gran unión, aunque no específica, a la albúmina sérica (aproximadamente el 98,5%) e induce un aumento en las concentraciones séricas tanto de SHBG como de CBG. Los efectos sobre SHBG y CBG inducidos por el EE no se vieron afectados por la variación en la dosis de DRSP en el rango de 2 a 3 mg.
Metabolismo: Los dos metabolitos principales de la DRSP encontrados en el plasma humano se identificaron como una forma ácida de la DRSP generada por la apertura del anillo de la lactona en el 4,5-dihidrodrospirenona-3-sulfato, formado por la reducción y su posterior sulfación. Estos metabolitos mostraron no ser farmacológicamente activos. La drospirenona también está sujeta al metabolismo oxidativo catalizado por CYP3A4.
Se ha informado que el EE se encuentra sujeto al metabolismo de primera pasada hepático e intestinal. El metabolismo de EE y sus metabolitos oxidativos se producen principalmente por conjugación con el glucurónido o sulfato. El CYP3A4 en el hígado es responsable de la 2-hidroxilación que es la principal reacción oxidativa. El 2-hidroxi metabolito se transforma adicionalmente por metilación y glucuronidación previa a la excreción urinaria y fecal.
Excreción: Las concentraciones séricas de DRSP se caracterizan por una vida media de fase de disposición terminal de aproximadamente 30 horas tanto para regímenes de dosis múltiples como de dosis únicas. La excreción de DRSP casi se completó al cabo de diez días y las cantidades excretadas fueron levemente mayores en heces que en orina. DRSP se metabolizó ampliamente y solo rastros de DRSP sin cambios se excretaron en orina y heces. Se observaron al menos 20 metabolitos diferentes en orina y heces. Alrededor del 38 - 47% de los metabolitos en orina fueron conjugados de sulfato y glucurónido. En heces, un 17 - 20% de los metabolitos se excretaron como glucurónidos y sulfatos.
Se ha informado una vida media de fase de disposición terminal para EE de aproximadamente 24 horas. EE no se excretó sin cambios. EE se excretó en orina y heces como conjugados de glucurónido y sulfato y atraviesa la circulación entero hepática.
• Uso en poblaciones específicas
Uso pediátrico: Se ha establecido la seguridad y la eficacia de YASMINIQ® en mujeres en edad reproductiva. Se espera que la eficacia sea la misma para las adolescentes post puberal de menos de 18 años y para las usuarias de 18 años y más. No está indicado el uso de este producto antes de la menarca.
Uso geriátrico: No se ha estudiado YASMINIQ® en mujeres posmenopáusicas y no está indicado para esta población.
Raza: No se ha observado una diferencia de importancia clínica entre la farmacocinética de DRSP o de EE en mujeres japonesas versus caucásicas (25 - 35 años de edad) cuando se administró 3 mg de DRSP/0,02 mg de EE diariamente por 21 días. No se han estudiado específicamente otros grupos étnicos.
Insuficiencia renal: YASMINIQ® está contraindicado en pacientes con insuficiencia renal.
El efecto de la insuficiencia renal en la farmacocinética de la DRSP (3 mg diarios durante 14 días) y el efecto de la DRSP sobre las concentraciones séricas del potasio se investigaron en tres grupos separados de participantes del sexo femenino (n=28, 30-65 años de edad). Todas las participantes cumplían una dieta baja en potasio. Durante el estudio, 7 participantes continuaron utilizando fármacos preservadores del potasio para el tratamiento de su enfermedad de base. El día 14 (estado estable) del tratamiento con DRSP, las concentraciones séricas de DRSP en el grupo con un CLcr de 50 - 79 mL/min fueron comparables con las del grupo control que tenía una CLcr ≥ 80 mL/min. Las concentraciones séricas de DRSP fueron en promedio un 37 % superiores en el grupo con una CLcr de 30 - 49 mL/min comparadas con aquellas de las del grupo control. El tratamiento con DRSP no mostró ningún efecto de importancia clínica sobre la concentración sérica de potasio. Aunque no se informó la hiperpotasemia en el estudio, en cinco de siete participantes que continuaron recibiendo fármacos preservadores del potasio durante el estudio, las concentraciones medias séricas de potasio aumentaron en hasta un 0,33 mEq/L. (Ver Contraindicaciones y Advertencias y precauciones - Hiperpotasemia).
Insuficiencia hepática: YASMINIQ® está contraindicado en pacientes con enfermedad hepática.
La exposición media a DRSP en mujeres con insuficiencia hepática moderada es aproximadamente tres veces mayor que la exposición en mujeres con función hepática normal. YASMINIQ® no se ha estudiado en mujeres con insuficiencia hepática severa. (Ver Contraindicaciones y Advertencias y precauciones - Enfermedad hepática).
Interacciones farmacológicas: Consultar la etiqueta de todos los medicamentos que se utilizan en forma concurrente para obtener información adicional sobre las interacciones con los anticonceptivos orales o su potencial de alteraciones de las enzimas.
• Efectos de otros medicamentos sobre los anticonceptivos orales combinados
Sustancias que disminuyen la eficacia de los AOC: Los medicamentos o los productos a base de hierbas que inducen ciertas enzimas, incluido CYP3A4, pueden reducir la eficacia de los AOC o aumentar el sangrado intermenstrual.
Sustancias que aumentan las concentraciones plasmáticas de AOC: La coadministración de atorvastatina y de ciertos AOC que contienen EE aumentan los valores del ABC (Área Bajo la Curva) para EE en aproximadamente un 20%. El ácido ascórbico y el acetaminofeno pueden aumentar las concentraciones plasmáticas de EE, posiblemente por inhibición de la conjugación. En un estudio clínico de interacción medicamentosa llevado a cabo en 20 mujeres premenopáusicas, la coadministración de DRSP (3 mg)/EE (0,02 mg) con un potente inhibidor del CYP3A4, el ketoconazol (200 mg dos veces al día) durante 10 días aumentó el ABC(0-24h) de la DRSP y del EE en 2,68 veces (90 % de IC: 2,44; 2,95) y 1,40 veces (90 % de IC: 1,31; 1,49), respectivamente. Los aumentos en la Cmáx fueron de 1,97 veces (90 % de IC: 1,79; 2,17) y de 1,39 veces (90 % de IC: 1,28; 1,52) para DRSP y EE, respectivamente. Aunque no se observaron efectos de relevancia clínica en la seguridad o en los parámetros de laboratorio incluido el potasio sérico, este estudio solo evaluó sujetos durante 10 días. Se desconoce el impacto clínico para una paciente que toma un AOC que contienen DRSP concomitantemente con el uso crónico de un inhibidor de CYP3A4/5 (ver Advertencias y precauciones - Hiperpotasemia).
Inhibidores de la proteasa del VIH/VHC e inhibidores no nucleósidos de la transcriptasa inversa: Se han observado cambios significativos (aumento o reducción) en las concentraciones plasmáticas del estrógeno y de la progestina en algunos casos de coadministración con inhibidores de la proteasa de VIH/VHC o inhibidores no nucleósidos de la transcriptasa inversa.
Antibióticos: Se han presentado informes sobre embarazo durante el uso de anticonceptivos hormonales y antibióticos, pero estudios farmacocinéticos no han demostrado el efecto consistente de los antibióticos en las concentraciones plasmáticas de los esteroides sintéticos.
• Efectos de los anticonceptivos orales combinados sobre otros medicamentos
Los AOC que contienen EE puede inhibir el metabolismo de otros compuestos. Los AOC han mostrado disminuir de manera significativa las concentraciones plasmáticas de lamotrigina, probablemente debido a la inducción de la glucurodinación de la lamotrigina. Esto puede reducir el control de las convulsiones, por lo tanto, es posible que sea necesario realizar ajustes en la posología de la lamotrigina. Consultar la etiqueta de todos los medicamentos que se utilizan en forma concurrente para obtener información adicional sobre las interacciones con los AOc o su potencial de alteración de las enzimas.
In vitro, el EE es un inhibidor reversible de CYP2C19, CYP1A1 y de CYP1A2 así como un inhibidor basado en el mecanismo de CYP3A4/5, CYP2C8, y de CYP2J2. Se ha investigado el metabolismo de la DRSP y los posibles efectos de DRSP en las enzimas CYP hepáticas en estudios in vitro e in vivo. En los estudios in vitro la DRSP no afectó el rendimiento de los sustratos de CYP1A2 y de CYP2D6 del modelo, pero tuvo una influencia inhibitoria sobre el rendimiento de los sustratos de CYP1A1, CYP2C9, CYP2C19, y CYP3A4 del modelo con CYP2C19 siendo la enzima más sensible. El posible efecto de DRSP sobre la actividad de CYP2C19 fue investigado en un estudio clínico de farmacocinética que utilizaba omeprazol como sustrato marcador. En el estudio llevado a cabo en 24 mujeres posmenopáusicas [incluidas 12 mujeres con genotipo de CYP2C19 homozigota (tipo natural) y 12 mujeres con genotipo de CYP2C19 heterozigota] la administración oral diaria de 3 mg de DRSP durante 14 días no afectó la depuración oral del omeprazol (40 mg, dosis oral única) y del producto de CYP2C19 5-hidroxi omeprazol. Es más, no se encontró ningún efecto significativo de la DRSP sobre la depuración sistémica del producto de CYP3A4 sulfona de omeprazol. Estos resultados muestran que la DRSP no inhibió ni el CYP2C19 ni el CYP3A4 in vivo.
Dos estudios clínicos adicionales de interacción medicamentosa con simvastatina y midazolam como sustratos marcadores para CYP3A4 se llevaron a cabo cada uno en 24 mujeres posmenopáusicas sanas. Los resultados de estos estudios demostraron que la farmacocinética de los sustratos de CYP3A4 no se vieron influenciados por las concentraciones de estado estable de DRSP logradas después de la administración de 3 mg de DRSP/día.
Las mujeres que reciben tratamiento de reemplazo de hormona tiroidea pueden necesitar mayores dosis de hormona tiroidea debido al aumento de las concentraciones séricas de la globulina de unión a la tiroxina con el uso de AOC.
Interacciones con medicamentos que tienen el potencial de aumentar la concentración sérica de potasio: Existe un potencial de aumento en la concentración sérica de potasio en mujeres que toman YASMINIQ® con otros medicamentos que pueden aumentar la concentración sérica de potasio (ver Advertencias y precauciones - Hiperpotasemia).
Se llevó a cabo un estudio de interacción medicamentosa con 3 mg de DRSP/1 mg de estradiol (E2) versus placebo en 24 mujeres posmenopáusicas levemente hipertensas que tomaban 10 mg de maleato de enalapril dos veces al día. Se tomaron las concentraciones de potasio día por medio durante un total de 2 semanas en todos los sujetos. Las concentraciones medias séricas del potasio en el grupo de tratamiento con DRSP/E2 respecto del inicio fueron de 0,22 mEq/L mayores que las del grupo placebo. Las concentraciones séricas del potasio también se midieron en múltiples momentos durante 24 horas al inicio y en el día 14 del ciclo. El día 14, los índices para la Cmáx sérica de potasio y el ABC en el grupo de DRSP/E2 comparados con los del grupo placebo fueron de 0,955 (90 % de IC: 0,914; 0,999) y de 1,010 (90 % de IC: 0,944; 1,08), respectivamente. Ninguna paciente de ninguno de los grupos de tratamiento desarrolló hiperpotasemia (concentraciones séricas de potasio > 5,5 mEq/L).
FARMACODINÁMICA: La drospirenona es un análogo de la espironolactona con actividad antimineralocorticoide y antiandrogénica. El estrógeno en YASMINIQ® es el etinilestradiol.
Anticoncepción: Dos estudios evaluaron el efecto de combinaciones de 3 mg de DRSP/0,02 mg de sobre la supresión de la actividad ovárica evaluado mediante la medición del tamaño del folículo por ecografía transvaginal y pruebas hormonales en suero (progesterona y estradiol) durante dos ciclos de tratamiento (periodo de 21 días con el comprimido activo más periodo de 7 días sin píldora). Más del 90% de las participantes en estos estudios mostraron inhibición de la ovulación. Un estudio comparó el efecto de combinaciones de 3 mg DRSP/0,02 mg de EE con dos regímenes diferentes (periodo de 24 días con comprimido activo más periodo de 4 días sin píldora versus periodo de 21 días con comprimido activo más periodo de 7 días sin píldora) sobre la supresión de la actividad ovárica durante dos ciclos de tratamiento. Durante el primer ciclo de tratamiento, no hubo ninguna participante (0/49, 0%) del régimen de 24 días que ovulara en comparación con 1 participante (1/50, 2%) con el régimen de 21 días. Después de introducir intencionalmente errores en la dosis (se dejaron de tomar 3 comprimidos activos los Días 1 a 3) durante el segundo ciclo de tratamiento, hubo 1 participante (1/49, 2%) con el régimen de 24 días, que ovuló en comparación con 4 participantes (4/50, 8%) del régimen de 21 días.
Acné: El acné vulgaris es una afección de la piel de etiología multifactorial que incluye la estimulación androgénica de la producción del sebo. Mientras que la combinación de EE y DRSP aumenta la globulina ligada a las hormonas sexuales (sex hormone binding globulin, SHBG) y reduce la testosterona libre, no se ha establecido la relación entre estos cambios y la disminución de la severidad del acné facial en mujeres sanas con esta afección cutánea. Se desconoce el impacto que tiene la actividad antiandrogénica de la DRSP sobre el acné.
CONTRAINDICACIONES:
No indicar YASMINIQ® a mujeres que se sabe que padecen:
• Insuficiencia renal.
• Insuficiencia de suprarrenales.
• Un riesgo alto de enfermedades trombóticas venosas o arteriales. Los ejemplos incluyen a las mujeres de quienes se sabe que
— Fuman, si tienen más de 35 años (ver las Advertencias y Precauciones que se encuentran en el recuadro - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan trombosis venosa profunda o embolismo pulmonar en este momento o en el pasado (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan enfermedad cerebrovascular (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan enfermedad de las arterias coronarias (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan trastornos del ritmo o trastornos valvulares trombogénicas del corazón (p. ej., endocarditis bacteriana subaguda con enfermedad valvular o fibrilación auricular) (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan hipercoagulopatías heredadas o adquiridas (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Presentan hipertensión arterial no controlada (ver Advertencias y precauciones - Presión arterial elevada).
— Presentan diabetes mellitus con enfermedad vascular (ver Advertencias y precauciones - Efectos metabólicos en lípidos y carbohidratos).
— Presentan cefalea con síntomas neurológicos focales o presentan cefaleas migrañosas con o sin aura si tienen más de 35 años de edad (ver Advertencias y precauciones - Cefalea).
• Sangrado uterino anormal de causa no diagnosticada (ver Advertencias y precauciones - Irregularidades en el sangrado).
• Cáncer de mama u otro cáncer sensible a la progestina o al estrógeno, en este momento o en el pasado (ver Advertencias y precauciones - Cáncer de mama y de órganos reproductivos).
• Tumor hepático (benigno o maligno) o enfermedad hepática (ver Advertencias y precauciones - Enfermedad hepática y Uso en poblaciones específicas - Pacientes con insuficiencia hepática).
• Embarazo, porque no existe motivo para utilizar AOC durante el embarazo (ver Advertencias y precauciones - Uso de AOC antes o durante la primera etapa del embarazo y Uso en poblaciones específicas - Embarazo).
REACCIONES ADVERSAS:
Las siguientes reacciones adversas serias con el uso de los AOC se describen en alguna parte de la etiqueta:
— Eventos cardiovasculares serios y accidente cerebrovascular (ver Advertencia y Advertencias y precauciones que figura en el recuadro - Trastornos tromboembólicos y otros problemas vasculares).
— Eventos vasculares (ver Advertencias y precauciones - Trastornos tromboembólicos y otros problemas vasculares).
— Enfermedad hepática (ver Advertencias y precauciones - Enfermedad hepática).
Las reacciones adversas informadas con frecuencia por las usuarias de AOC son:
— Sangrado uterino irregular.
— Náuseas.
— Sensibilidad mamaria.
— Cefalea.
Experiencia de ensayos clínicos: Debido a que los ensayos clínicos se realizan bajo diversas condiciones, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas de los ensayos clínicos de otro fármaco, y pueden no reflejar las tasas observadas en la práctica.
Ensayos clínicos de anticoncepción y acné: Los datos provistos reflejan la experiencia con el uso de YASMINIQ® en estudios adecuados y bien controlados para la anticoncepción (N=1056) y para acné vulgaris moderado (N=536).
Para la anticoncepción, se llevó a cabo un estudio de Fase 3, multicéntrico, multinacional, abierto para evaluar la seguridad y la eficacia de hasta un año en 1.027 mujeres de 17 - 36 años de edad que tomaron al menos una dosis de YASMINIQ®. Un segundo estudio de Fase 3 consistió en un estudio de centro único, abierto, controlado con ingrediente activo para evaluar el efecto de 7 ciclos de 28 días de YASMINIQ® en el metabolismo de los carbohidratos, los lípidos y la hemostasia en 29 mujeres de 18 - 35 años de edad. Para el acné, dos estudios multicéntricos, doble ciego, aleatorizados, controlados con placebo, en 536 mujeres de 14 - 45 años de edad con acné vulgaris moderado que tomaron al menos una dosis de YASMINIQ®, evaluaron la seguridad y la eficacia hasta por 6 ciclos.
Las reacciones adversas observadas en las 2 indicaciones se superpusieron y se informaron utilizando las frecuencias de grupos de datos acumulados. Las reacciones adversas más frecuentes (≥ 2 % de las usuarias) fueron: Cefalea/migraña (6,7 %), irregularidades menstruales (incluida la hemorragia vaginal [principalmente manchado] y metrorragia (4,7 %), náuseas/vómitos (4,2 %), dolor/sensibilidad mamaria (4 %) y cambios en el estado de ánimo (cambios de ánimo, depresión, estado depresivo e inestabilidad afectiva) (2,2 %).
Ensayos clínicos de TDPM: Los datos de seguridad de ensayos para la indicación de TDPM se informaron por separado debido a diferencias en el diseño y contexto del estudio en los estudios de Anticoncepción y Acné, comparados con el programa clínico de TDPM.
Dos ensayos (uno de diseño cruzado y otro paralelo) multicéntricos, doble ciego, aleatorizados, controlados con placebo para la indicación secundario de tratamiento de los síntomas de TDPM evaluaron la seguridad y la eficacia de YASMINIQ® por hasta 3 ciclos en 285 mujeres de 18 - 42 años de edad, con diagnóstico de TDPM y que tomaron al menos una dosis de YASMINIQ®.
Las reacciones adversas frecuentes (≥ 2% de las usuarias) incluyeron: Irregularidades menstruales (incluida hemorragia vaginal [principalmente manchado] y metrorragia) (24,9%), náuseas (15,8%), cefalea (13,0%), sensibilidad mamaria (10,5%), fatiga (4,2%), irritabilidad (2,8%), disminución de la libido (2,8%), aumento de peso (2,5%), e inestabilidad afectiva (2,1%).
• Reacciones adversas (≥ 1 %) que llevan a la discontinuación del estudio
Ensayos clínicos de anticoncepción: De las 1056 mujeres, el 6,6% fue discontinuado de los ensayos clínicos debido a una reacción adversa; las reacciones adversas más frecuentes que llevaron a la discontinuación fueron cefalea/migraña (1,6%) y náuseas/vómitos (1,0%).
Ensayos clínicos de acné: De 536 mujeres, el 5,4 % fue separado de los ensayos clínicos debido a una reacción adversa. La reacción adversa más frecuente que llevó a la discontinuación fue la irregularidad menstrual (esto incluye la menometrorragia, la menorragia, la metrorragia y la hemorragia vaginal) (2,2%).
Ensayos clínicos de TDPM: De 285 mujeres, el 11,6% fue separada de los ensayos clínicos debido a una reacción adversa. Las reacciones adversas más frecuentes que llevaron a la discontinuación fueron: Náuseas/vómitos (4,6%), irregularidad menstrual (esto incluye la hemorragia vaginal, la menorragia, el trastorno menstrual, menstruación irregular y metrorragia) (4,2%), fatiga (1,8%), sensibilidad mamaria (1,4%), depresión (1,4%), cefalea (1,1%), e irritabilidad (1,1%).
• Reacciones adversas serias
Ensayos clínicos de anticoncepción: Migraña y displasia cervical.
Ensayos clínicos en tratamiento de acné: No se informó ninguna en los ensayos clínicos.
Ensayos clínicos en tratamiento de TDPM: Displasia cervical.
• Experiencia post comercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de YASMINIQ®. Puesto que el informe de tales reacciones es voluntario y proviene de una población de tamaño incierto, no siempre es posible estimar de modo confiable su frecuencia, ni establecer una relación causal con la exposición al medicamento.
Las reacciones adversas se agrupan en Clase de sistema u órgano y se ordenan por frecuencia.
Trastornos vasculares: Eventos tromboembólicos arteriales y venosos (incluidos los embolismos pulmonares, trombosis venosa profunda, trombosis cerebral, trombosis retiniana, infarto de miocardio y accidente cerebrovascular), hipertensión arterial (incluida la crisis hipertensiva).
Trastornos hepatobiliares: Enfermedad vesicular, trastornos de la función hepática, tumores hepáticos.
Trastornos del sistema inmunitario: Hipersensibilidad (incluida la reacción anafiláctica).
Trastornos del metabolismo y de la nutrición: Hiperpotasemia, hipertrigliceridemia, cambios en la tolerancia en la glucosa o efecto sobre la resistencia periférica a la insulina (incluida la diabetes mellitus).
Trastornos de la piel y del tejido subcutáneo: Cloasma, angioedema, eritema nudoso, eritema multiforme.
Trastornos gastrointestinales: Enfermedad intestinal inflamatoria.
Trastornos musculoesqueléticos y del tejido conjuntivo: Lupus eritematoso sistémico.
INTERACCIONES FARMACOLÓGICAS: Consultar la etiqueta de todos los medicamentos que se utilizan en forma concurrente para obtener información adicional sobre las interacciones con los anticonceptivos hormonales o su potencial de alteraciones enzimáticas.
Efectos de otros medicamentos sobre los anticonceptivos orales combinados:
Sustancias que disminuyen la eficacia de los AOC: Los medicamentos o los productos a base de hierbas que inducen ciertas enzimas, incluido el citocromo P450 3A4 (CYP3A4) pueden reducir la eficacia de los AOC o aumentar el sangrado intermenstrual. Algunos medicamentos o productos a base de hierbas que pueden disminuir la eficacia de los anticonceptivos hormonales son la fenitoína, los barbitúricos, la carbamazepina, el bosentan, el felbamato, la griseofllvina, la oxcarbazepina, la rifampina, el topiramato y los productos que contienen hierba de San Juan. Las interacciones entre los anticonceptivos orales y otros medicamentos pueden producir sangrado intermenstrual y/o falla en la anticoncepción. Aconsejar a las mujeres utilizar un método de anticoncepción alternativo o un método de respaldo cuando se utilicen inductores enzimáticos con AOC, y continuar con la anticoncepción de respaldo durante los 28 días posteriores a la discontinuación del inductor enzimático para garantizar la confiabilidad del anticonceptivo.
Sustancias que aumentan las concentraciones plasmáticas de AOC: La coadministración de atorvastatina y de ciertos AOC que contienen EE aumentan los valores del ABC (Área Bajo la Curva) para EE en aproximadamente un 20 %. El ácido ascórbico y el acetaminofeno pueden aumentar las concentraciones plasmáticas de EE, posiblemente por inhibición de la conjugación.
La administración concomitante de potentes o moderados inhibidores de CYP3A4, como los antimicóticos azólicos (p. ej., ketoconazol, itraconazol, voriconazol, fluconazol), el verapamilo, los macrólidos (p. ej., claritromicina, eritromicina), el diltiazem y el jugo de toronja pueden aumentar las concentraciones plasmáticas del estrógeno o de la progestina o de ambos. En un estudio de interacción medicamentosa llevado a cabo en mujeres premenopáusicas, la coadministración una vez al día de comprimidos que contienen 3 mg de DRSP/0,02 mg de EE con un potente inhibidor de CYP3A4, ketoconazol 200 mg dos veces al día durante 10 días produjo un aumento moderado de la exposición sistémica a DRSP. La exposición a EE se vio levemente aumentada (ver Advertencias y precauciones - Hiperpotasemia y Farmacología clínica - Farmacocinética).
Inhibidores de la proteasa del Virus de inmunodeficiencia humana (VIH)/Hepatitis C (VHC) e inhibidores no nucleósidos de la transcriptasa inversa: Se han observado cambios significativos (aumento o reducción) en las concentraciones plasmáticas del estrógeno y de la progestina en algunos casos de coadministración con inhibidores de la proteasa de VIH/VHC o inhibidores no nucleósidos de la transcriptasa inversa.
Antibióticos: Se han presentado informes sobre embarazo durante el uso concomitante de anticonceptivos hormonales y antibióticos, pero estudios farmacocinéticos no han demostrado el efecto consistente de los antibióticos en las concentraciones plasmáticas de los esteroides sintéticos.
• Efectos de los anticonceptivos orales combinados sobre otros medicamentos
Los AOC que contienen EE puede inhibir el metabolismo de otros compuestos. Los AOC han mostrado disminuir de manera significativa las concentraciones plasmáticas de lamotrigina, probablemente debido a la inducción de la glucurodinación de la lamotrigina. Esto puede reducir el control de las convulsiones, por lo tanto, es posible que sea necesario realizar ajustes en la posología de la lamotrigina. Consultar la etiqueta de todos los medicamentos que se utilizan en forma concurrente para obtener información adicional sobre las interacciones con los AOC o su potencial de alteración de las enzimas.
Aumento de las concentraciones plasmáticas de las enzimas de CYP450 debido a los AOC: En estudios clínicos, la administración de un anticonceptivo hormonal que contiene EE no produjo ningún aumento o solo un débil aumento en las concentraciones plasmáticas de los sustratos de CYP3A4 (p. ej., midazolam) mientras que los sustratos de CYP2C19 (p. ej., omeprazol y voriconazol) y los sustratos de CYP1A2 (p. ej., teofilina y tizanidina) pueden presentar un aumento débil o moderado.
Los estudios clínicos no indicaron un potencial inhibitorio de DRSP hacia las enzimas CYP a concentraciones de relevancia clínica (ver Farmacología clínica - Farmacocinética).
Las mujeres que reciben tratamiento de reemplazo de hormona tiroidea pueden necesitar mayores dosis de hormona tiroidea debido al aumento de las concentraciones séricas de la globulina de unión a la tiroxina con el uso de AOC.
Potencial de aumento de la concentración sérica de potasio: Existe un potencial de aumento en la concentración sérica de potasio en mujeres que toman YASMINIQ® con otros medicamentos que pueden aumentar la concentración sérica de potasio (ver Advertencias y precauciones - Hiperpotasemia y Farmacología clínica - Farmacocinética).
• Interferencia con pruebas de laboratorio
El uso de esteroides anticonceptivos puede cambiar los resultados de algunas pruebas de laboratorio tales como factores de coagulación, lípidos, tolerancia a la glucosa y proteínas de unión. La DRSP produce un aumento en la actividad sérica de la renina y en la aldosterona plasmática inducido por su leve actividad antimineralocorticoide. (Ver Advertencias y precauciones - Interferencia con pruebas de laboratorio e Interacciones farmacológicas - Efectos de los anticonceptivos orales combinados sobre otros medicamentos).
ESTUDIOS CLÍNICOS:
Ensayo clínico de anticonceptivos orales: En el estudio de eficacia anticonceptiva primaria de YASMINIQ® (3 mg de DRSP/0,02 mg de EE) de hasta 1 año de duración, se enroló a 1.027 participantes y se completaron 11.480 ciclos de 28 días de uso. El rango etario fue de 17 a 36 años. La demografía racial fue: 87,8% caucásicas, 4,6 % hispánicas, 4,3% negras, 1,2% asiáticas, y 2,1% otra. Las mujeres con un IMC (índice de masa corporal) mayor a 35 fueron excluidas del ensayo. La tasa de embarazo (Índice Pearl) fue de 1,41 (95% de IC [0,73, 2,47]) cada 100 mujeres-año de uso basándose en 12 embarazos que se produjeron después del inicio del tratamiento y dentro de los 14 días después de la última dosis de YASMINIQ® en mujeres de 35 años de edad o menores durante ciclos en los que no se utilizó ninguna otro método anticonceptivo.
Ensayos clínicos sobre trastorno disfórico premenstrual: Se llevaron a cabo dos estudios multicéntricos, aleatorizados, doble ciego, controlados por placebo para evaluar la eficacia de YASMINIQ® en el tratamiento de los síntomas de TDPM. Se enrolaron mujeres de 18 - 42 años de edad que cumplían los criterios de DSM-IV para TDPM, confirmados por las clasificaciones prospectivas diarias de sus síntomas. Ambos estudios midieron el efecto del tratamiento de YASMINIQ® utilizando una escala de Registro Diario de Severidad de los Problemas, un instrumento calificado por el paciente que evalúa los síntomas que conforman los criterios de diagnóstico de DSM-IV. El estudio primario fue de diseño de grupos paralelos que incluyó 384 mujeres evaluables en edad reproductiva con TDPM que fueron asignadas al azar a recibir tratamiento con YASMINIQ® o placebo durante 3 ciclos menstruales. El estudio de respaldo, de diseño cruzado, fue finalizado de manera anticipada antes de alcanzar los objetivos de reclutamiento debido a las dificultades de la inclusión. Inicialmente, se trató un total de 64 mujeres en edad reproductiva, que presentaban TDPM, con YASMINIQ® o placebo por hasta 3 ciclos seguido de un ciclo de reposo del fármaco y luego un cruzamiento a un medicamento alternativo durante 3 ciclos.
Se evaluó la eficacia en ambos estudios por variación desde el inicio durante el tratamiento utilizando un sistema de puntaje basado en los primeros 21 puntos del Registro diario de la severidad de los problemas. Cada uno de los 21 puntos se calificó en una escala de 1 (para nada) a 6 (extremo); de esta manera, era posible obtener un puntaje máximo de 126. En ambos estudios, las mujeres que recibieron YASMINIQ® presentaron una mejoría de importancia estadística mayor en sus puntajes en el Registro Diario de Severidad de los Problemas. En el estudio primario, la disminución promedio (mejoría) desde el inicio fue de 37,5 puntos en las mujeres que toman YASMINIQ®, en comparación con los 30,0 puntos de las mujeres que toman placebo.
Ensayos clínicos sobre acné: En dos estudios multicéntricos, doble ciegos, aleatorizados, controlados con placebo, 889 participantes, de 14 a 45 años de edad, con acné moderado, recibieron YASMINIQ® o placebo durante seis ciclos de 28 días. Los criterios de valoración de la eficacia primaria fueron el porcentaje de cambio en lesiones inflamatorias, lesiones no inflamatorias, lesiones totales y porcentaje de participantes con calificación de “sin lesiones” o “casi sin lesiones” en la escala de Evaluación Global Estática del Investigador (Investigator’s Static Global Assessment, ISGA) el día 15 del ciclo 6, según se muestra en la Tabla 3
|
Tabla 3: Resultados de eficacia para los ensayos de acné* |
||||
|
Estudio 1 |
Estudio 2 |
|||
|
YASMINIQ® |
Placebo |
YASMINIQ® |
Placebo |
|
|
N = 228 |
N = 230 |
N = 218 |
N = 213 |
|
|
Índice de éxito ISGA |
35 (15 %) |
10 (4 %) |
46 (21 %) |
19 (9 %) |
|
Lesiones inflamatorias Recuento medio al inicio Reducción de la media absoluta (%) |
33 15 (48 %) |
33 11 (32 %) |
32 16 (51 %) |
32 11 (34 %) |
|
Lesiones no inflamatorias Recuento medio al inicio Reducción de la media absoluta (%) |
47 18 (39 %) |
47 10 (18 %) |
44 17 (42 %) |
44 11 (26 %) |
|
Lesiones totales Recuento medio al inicio Reducción de la media absoluta (%) |
80 33 (42 %) |
80 21 (25 %) |
76 33 (46 %) |
76 22 (31 %) |
|
* Evaluado al día 15 del ciclo 6, última observación llevada a cabo para la población con Intención de tratar |
||||
TOXICOLOGÍA NO CLÍNICA:
Carcinogénesis, mutagénesis, alteración de la fertilidad: En un estudio sobre carcinogénesis con administración por vía oral, de 24 meses de duración, en ratones que recibieron una dosis de 10 mg/kg/día de DRSP sola o 1 + 0,01, 3 + 0,03 y 10 + 0,1 mg/kg/día de DRSP y de EE, 0,1 a 2 veces la exposición (ABC de DRSP) de las mujeres que toman una dosis anticonceptiva, se produjo un aumento en cánceres de glándula harderiana en el grupo que recibió una dosis alta de solo DRSP. En un estudio similar en ratas que recibieron 10 mg/kg/día de DRSP sola o 0,3 + 0,003, 3 + 0,03 y 10 + 0,1 mg/kg/día de DRSP y EE, 0,8 a 10 veces la exposición de las mujeres que toman una dosis anticonceptiva, se produjo una mayor incidencia de feocromocitomas de glándulas suprarrenales totales (benignos y malignos) y benignos en el grupo que recibió una alta dosis de DRSP. Los estudios de mutagénesis para DRSP se llevaron a cabo in vivo e in vitro y no se observó evidencia de actividad mutagénica.
ADVERTENCIA
Lea todo el prospecto detenidamente antes de tomar este medicamento:
— Conserve este prospecto. Puede tener que volver a leerlo.
— Si tiene alguna duda, pregunte a su médico o farmacéutico.
— Este medicamento se le ha recetado a usted personalmente. No debe darlo a otras personas. Puede perjudicarles, incluso si sus signos o síntomas son los mismos que los suyos.
— Si considera que cualquiera de los efectos adversos que sufre es serio o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
|
ADVERTENCIA: FUMAR CIGARRILLOS Y EVENTOS CARDIOVASCULARES SERIOS Fumar cigarrillos aumenta el riesgo de eventos cardiovasculares serios debido al uso de anticonceptivos orales combinados (AOC). Este riesgo aumenta con la edad, en particular en mujeres de más de 35 años y con el número de cigarrillos que se fuman. Por este motivo, las mujeres de más de 35 años de edad y que fuman no deben utilizar AOC [consultar Contraindicaciones (4)]. |
ADVERTENCIAS Y PRECAUCIONES:
Trastornos tromboembólicos y otros problemas vasculares: Interrumpir YASMINIQ® si se produce un evento trombótico venoso o arterial (TEV).
Según la información actualmente disponible sobre los AOC que contienen DRSP con 0,03 mg de etinilestradiol (es decir, YASMIN®), los AOc que contienen DRSP pueden estar asociados a un mayor riesgo de tromboembolismo venoso (TEV) que los AOC que contienen levonorgestrel u otras progestinas. Los estudios epidemiológicos que compararon el riesgo de TEV informaron desde un no aumento hasta un aumento de tres veces el riesgo. Antes de indicar YASMINIQ® a una nueva usuaria de AOC o a una mujer que cambia de un anticonceptivo que no contiene DRSP, evaluar los riesgos y beneficios de un AOC que contiene DRSP a la luz del riesgo de TEV. Los factores de riesgo conocidos para TEV son tabaquismo, obesidad y antecedentes familiares de TEV, además de otros factores que contraindican el uso de AOC (ver Contraindicaciones).
Varios estudios han comparado el riesgo de TEV para usuarias de YASMIN® (que contiene 0,03 mg de EE y 3 mg de DRSP) con el riesgo para las usuarias de otros AOC, incluidos los AOC que contienen levonorgestrel. Aquellos solicitados o patrocinados por organismo reguladores se resumen en la Tabla 1.
|
Tabla 1: Estimaciones (Índices de Riesgo) del riesgo de tromboembolismo venoso en usuarias actuales de YASMIN ® versus usuarias de anticonceptivos orales que contienen otras progestinas |
||
|
Estudio epidemiológico |
Producto comparador |
Índice de riesgos (Hazard Ratio, HR) |
|
i3 Ingenix (Seeger 2007) Iniciadores, incluidas las nuevas usuariasa |
Todos los AOC disponibles en los EE.UU. durante la realización del estudio b |
HR: 0,9 (0,5-1,6) |
|
EURAS (Dinger 2007) Iniciadoras, incluidas las nuevas usuariasa |
Todos los AOC disponibles en Europa durante la realización del estudioc Levonorgestrel/EE |
HR: 0,9 (0,6-1,4) HR: 1,0 (0,6-1,8) |
|
“Estudio financiado por la FDA” (2011) Nuevas usuariasa |
Otros AOC disponibles durante el transcurso del estudiod Levonorgestrel/0,03 mg EE |
HR: 1,8 (1,3-2,4) HR: 1,6 (1,1-2,2) |
|
Todas los usuarias (es decir, inicio y continuación del uso de la anticoncepción hormonal combinada del estudio) |
Otros AOC disponibles durante el transcurso del estudiod Levonorgestrel/0,03 mg EE |
HR: 1,7 (1,4-2,1) HR: 1,5 (1.2-1.8) |
|
a. “Nuevas usuarias”: Sin uso de anticoncepción hormonal combinada durante al menos los 6 meses previos. b. Incluye AOC a bajas dosis que contienen las siguientes progestinas: Norgestimato, noretindrona, levonorgestrel, desogestrel, norgestrel, medroxiprogesterona o diacetato de etinodiol. c. Incluye AOC a bajas dosis que contienen las siguientes progestinas: Levonorgestrel, desogestrel, dienogest, acetato de clormadinona, gestodeno, acetato de ciproterona, norgestimato o noretindrona. d. Incluye AOC a bajas dosis que contienen las siguientes progestinas: Norgestimato, noretindrona o levonorgestrel. |
||
Además de estos “estudios reguladores,” se han llevado a cabo otros estudios de diversos diseños. En general, existen dos estudios prospectivos de cohortes (ver Tabla 1): El estudio de seguridad posaprobación en los EE.UU. Ingenix [Seeger 2007], el estudio de seguridad posaprobación en Europa EURAS (European Active Surveillance Study, Estudio europeo de vigilancia activa) [Dinger 2007]. Una extensión del estudio EURAS, el Estudio de Vigilancia Activa a Largo Plazo (Long-Term Active Surveillance Study, LASS), no enroló sujetos adicionales pero continuó evaluando el riesgo de TEV. Existen tres estudios retrospectivos de cohorte, un estudio en los EE.UU financiado por la FDA (ver Tabla 1), y dos de Dinamarca [Lidegaard 2009, Lidegaard 2011]. Existen dos estudios con control de casos: El análisis del estudio holandés MEGA [van Hylckama Vlieg 2009] y el estudio alemán con control de casos [Dinger 2010]. Existen dos estudios anidados con control de casos que evaluaron el riesgo de TEV idiopática no fatal: El estudio PharMetrics [Jick 2011] y el estudio GPRD [Parkin 2011]. Los resultados de todos estos estudios se presentan en la Figura 1.
Figura 1: Riesgo de TEV con YASMIN® relativo a AOC que contienen LNG (riesgo ajustado#)
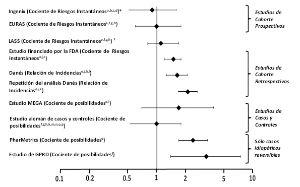
Las relaciones de riesgo exhibidas en escala logarítmica: Relación de riesgo < 1 indica un riesgo menor de TEV para DRSP, > 1 indica un riesgo mayor de TEV para DRSP.
*“ Otros AOC” comparadores, incluidos los AOC que contienen LNG
† LASS es una extensión del estudio EURAS.
# Algunos factores de ajustes aparecen indicados en letras en superíndice: a) En la actualidad fuma mucho, b) hipertensión arterial, c) obesidad, d) antecedentes familiares, e) edad, f) IMC (Índice de masa corporal), g) duración del uso, h) antecedentes de TEV, i) periodo de inclusión, j) año calendario, k) educación, l) periodo de uso, m) paridad, n) enfermedad crónica, o) medicación concomitante, p) tabaquismo, q) duración de la exposición, r) centro
(Referencias: Ingenix [Seeger 2007]1, EURAS (Estudio europeo de vigilancia activa) [Dinger 2007]2, LASS (Estudio de vigilancia activa a largo plazo) [Dinger, documento no publicado en archivo], estudio financiado por la FDA [Sidney 2011]3, Danish [Lidegaard 2009]4, Danish re-analysis [Lidegaard 2011]5, estudio MEGA [van Hylckama Vlieg 2009]6, estudio aleman con control de casos [Dinger 2010]7, PharMetrics [Jick 2011]8, estudio GPRD [Parkin 2011]9)
Aunque las tasas absolutas de TEV son mayores para las usuarias de anticonceptivos hormonales comparadas con las de las no usuarias, las tasas durante el embarazo son incluso mayores, en especial, durante el periodo posparto (ver Figura 2). Se ha estimado que el riesgo de TEV en mujeres que utilizan AOC es del 3 al 9 por cada 10.000 mujer-año. El riesgo de TEV es mayor durante el primer año de uso. Los datos provenientes de un gran estudio de seguridad prospectivo de cohortes de varios AOC sugieren que este mayor riesgo, comparado con el de las usuarias que no reciben AOC, es mayor durante los primeros 6 meses de uso de AOC. Los datos de este estudio de seguridad indican que el mayor riesgo está presente después de comenzar el tratamiento inicialmente con un AOC o de reanudar el tratamiento (tras un intervalo de 4 semanas o más sin tomar la píldora) con el mismo AOC u otro distinto.
El riesgo de enfermedad tromboembólica asociado al uso de anticonceptivos orales desaparece gradualmente después de interrumpido el uso de AOC.
La Figura 2 muestra el riesgo de desarrollar TEV en mujeres que no están embarazadas y que no utilizan anticonceptivos orales, en mujeres que utilizan anticonceptivos orales, en mujeres embarazadas y en mujeres en periodo de posparto. Para poner en perspectiva el riesgo de desarrollar TEV: Si 10.000 mujeres que no están embarazadas y que no utilizan anticonceptivos orales reciben seguimiento durante un año, de 1 a 5 de estas mujeres desarrollarán TEV.
Figura 2: Probabilidad de desarrollar TEV.
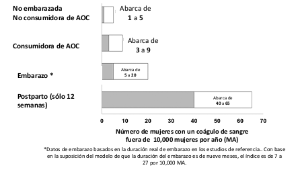
De ser posible, interrumpir YASMINIQ® durante al menos 4 semanas antes y 2 semanas después de una cirugía mayor o de otras cirugías conocidas por su gran riesgo de tromboembolismo.
Comenzar YASMINIQ® no antes de las 4 semanas posteriores al nacimiento, en mujeres que no estén amamantando. El riesgo de tromboembolismo posparto disminuye después de la tercera semana posparto, mientras que el riesgo de ovulación aumenta después de la tercera semana posparto.
Además, el uso de AOC aumenta el riesgo de trombosis arteriales tales como accidentes cerebrovasculares e infartos de miocardio, en especial, en mujeres con otros factores de riesgo para estos eventos.
Se ha demostrado que los AOC aumentan tanto los riesgos relativos como los atribuibles de eventos cerebrovasculares (accidentes cerebrovasculares trombóticos y hemorrágicos), aunque, en general, el riesgo es mayor entre las mujeres mayores (> 35 años), con hipertensión arterial y que además fuman. Los AOC también aumentan el riesgo de accidente cerebrovascular en mujeres con otros factores de riesgo de base.
Los anticonceptivos orales deben utilizarse con precaución en mujeres con factores de riesgo de enfermedad cardiovascular.
Interrumpir YASMINIQ® en caso de pérdida inexplicable de la visión, proptosis, diplopia, edema papilar o lesiones vasculares de la retina. Evaluar de inmediato trombosis de la vena retiniana. (Ver Reacciones adversas)
Hiperpotasemia: YASMINIQ® contiene 3 mg de progestina DRSP, que presenta actividad antiminarolocorticoide, esto incluye potencial de hiperpotasemia en pacientes de alto riesgo, comparable a una dosis de 25 mg de espironolactona. YASMINIQ® está contraindicado en pacientes con condiciones que predisponen a la hiperpotasemia (es decir, insuficiencia renal, insuficiencia hepática e insuficiencia de glándulas suprarrenales). Las mujeres que reciben tratamiento diario, a largo plazo por enfermedades o cuadros crónicos con medicamentos que pueden aumentar la concentración sérica de potasio deberían realizarse pruebas para determinar la concentración sérica de potasio durante el primer ciclo del tratamiento. Los medicamentos que pueden aumentar la concentración sérica de potasio son los inhibidores de la enzima convertidora de angiotensina (angiotensin-converting enzyme, ACE), antagonistas de los receptores de la angiotensina II, diuréticos preservadores de potasio, suplementos de potasio, heparina, antagonistas de la aldosterona y AINEs. Considerar el control de la concentración sérica de potasio en pacientes de alto riesgo que toman un potente inhibidor de CYP3A4 a largo plazo y en forma concomitante. Potentes inhibidores de CYP3A4 son los antimicóticos azólicos (p. ej., ketoconazol, itraconazol, voriconazol), inhibidores de la proteasa del VIH/VHC (p. ej., indinavir, boceprevir), y claritromicina (ver Farmacologia clínica - Farmacocinética).
Cáncer de mama y de órganos reproductivos: Las mujeres que en la actualidad padecen o han padecido cáncer de mama no deben utilizar YASMINIQ® porque el cáncer de mama es un tumor sensible a las hormonas.
Existe evidencia sustancial de que los AOC no aumentan la incidencia del cáncer de mama. Aunque algunos estudios pasados han sugerido que los AOC podrían aumentar la incidencia del cáncer de mama, estudios más recientes no han confirmado dichos hallazgos.
Algunos estudios sugieren que los AOC están asociados a un aumento en el riesgo de cáncer de cuello uterino o neoplasia intraepitelial. Sin embargo, existe controversia en cuanto a la magnitud por la cual estos hallazgos pueden deberse a diferencias en el comportamiento sexual y a otros factores.
Enfermedad hepática: Discontinuar YASMINIQ® en caso de ictericia. Es posible que las hormonas esteroides se metabolicen escasamente en pacientes con insuficiencia hepática. Las alteraciones agudas o crónicas del funcionamiento hepático pueden requerir la interrupción del uso de AOC hasta que los marcadores del funcionamiento hepático regresen a la normalidad y se haya excluido que el AOC sea la causa.
Los adenomas hepáticos se encuentran asociados al uso de AOC. Una estimación del riesgo atribuible establece 3,3 casos/100.000 usuarias de AOC. La ruptura de los adenomas hepáticos puede causar la muerte a través de una hemorragia intraabdominal.
Los estudios han demostrado un mayor riesgo de desarrollar cáncer hepatocelular en usuarias de AOC a largo plazo (> 8 años). Sin embargo, el riesgo atribuible de cánceres de hígado en usuarias de AOC es menos de un caso por un millón de usuarias.
La colestasia asociada a los anticonceptivos orales puede producirse en mujeres con antecedentes de colestasia relacionada con el embarazo. Las mujeres con antecedentes de colestasia relacionada con AOC puede presentar repetición del cuadro con el uso consecutivo de AOC.
Presión arterial elevada: En mujeres con hipertensión arterial bien controlada, controlar la presión arterial e interrumpir YASMINIQ® si la presión arterial aumenta de manera significativa. Las mujeres con hipertensión arterial no controlada o hipertensión arterial con enfermedad vascular no deberían utilizar AOC.
Se ha informado un aumento en la presión arterial en mujeres que toman AOC y este aumento es más probable en mujeres de mayor edad y con una duración de uso prolongada. La incidencia de hipertensión arterial aumenta con el aumento en la concentración de la progestina.
Enfermedad vesicular: Los estudios sugieren un pequeño aumento en el riesgo relativo de desarrollo de enfermedad vesicular en usuarias de AOC.
Efectos metabólicos en lípidos y carbohidratos: Controlar atentamente a las mujeres diabéticas y prediabéticas que toman YASMINIQ®. Los AOC pueden disminuir la tolerancia a la glucosa de manera proporcional a la dosis.
Evaluar un método anticonceptivo alternativo en mujeres con dislipidemias no controladas. Una pequeña proporción de mujeres presentarán cambios adversos en los lípidos mientras reciban AOC.
Las mujeres con hipertrigliceridemia, o antecedentes familiares de esta afección, pueden estar expuestas a un riesgo mayor de pancreatitis con el uso de AOC.
Cefalea: Si una mujer que toma YASMINIQ® desarrolla nuevas cefaleas que son recurrentes, persistentes o severas, evaluar la causa y discontinuar YASMINIQ® si correspondiera.
Un aumento en la frecuencia o intensidad de las migrañas durante el uso de un AOC (lo que puede ser prodrómico de un evento cerebrovascular) puede justificar la interrupción inmediata del fármaco.
Irregularidades en el sangrado: El sangrado no programado (intermenstrual o intracíclico) y el manchado a veces se producen en pacientes que toman AOC, en especial, durante los tres primeros meses de uso. Si el sangrado persiste o si se produce después de ciclos que previamente fueron regulares, verificar las causas, p. ej., embarazo o cáncer. Si se excluye una enfermedad o embarazo, las irregularidades de sangrado pueden resolverse con el tiempo o cambiando a un AOC diferente.
Según los diarios de pacientes de dos ensayos clínicos de YASMINIQ® sobre anticonceptivos, del 8 al 25 % de las mujeres presentaron sangrado no programado por ciclo de 28 días. Un total de 12 participantes de 1056 (1,1 %) discontinuaron el tratamiento debido a trastornos menstruales, esto incluyó sangrado intermenstrual, menorragia y metrorragia.
Las mujeres que utilizan YASMINIQ® pueden presentar ausencia de sangrado por privación, incluso si no están embarazadas. Según los diarios de participantes de ensayos de anticoncepción de hasta 13 ciclos, del 6 al 10 % de las mujeres presentaron ciclos sin sangrado por privación. Algunas mujeres pueden presentar oligomenorrea o amenorrea posterior a la píldora, en especial cuando dicho cuadro era preexistente.
Si no se produce sangrado por privación, se debe considerar la posibilidad de embarazo. Si la paciente no ha cumplido con el esquema de administración de dosis indicado (dejó de tomar un comprimido activo o más o ha comenzado a tomarlos un día después de lo indicado), evaluar la posibilidad de embarazo cuando se produce la primera falta de periodo y tomar las medidas de diagnóstico correspondientes. Si la paciente ha cumplido el régimen indicado y no presenta dos perodos consecutivos, descartar el embarazo.
Uso de AOC antes o durante la primera etapa del embarazo: Estudios epidemiológicos extensivos no han revelado mayor riesgo de defectos de nacimiento en mujeres que han tomado anticonceptivos orales antes del embarazo. Los estudios tampoco sugieren un efecto teratogénico cuando se toman AOC accidentalmente durante la primera etapa del embarazo, en particular en lo relativo a anomalías cardiacas y defectos en reducción de miembros.
La administración de anticonceptivos orales para inducir sangrado por privación no deben utilizarse como prueba de embarazo (ver Uso en poblaciones específicas - Embarazo).
Depresión: Las pacientes con antecedentes de depresión deben permanecer bajo observación cuidadosa y se debe interrumpir YASMINIQ® si la depresión regresa a un grado serio.
Interferencia con pruebas de laboratorio: El uso de AOC puede cambiar los resultados de algunas pruebas de laboratorio tales como factores de coagulación, lípidos, tolerancia a la glucosa y proteínas de unión. Las mujeres que reciben tratamiento de reemplazo de hormona tiroidea pueden necesitar mayores dosis de hormona tiroidea debido al aumento de las concentraciones séricas de la globulina de unión a la tiroxina con el uso de AOC (ver Interacciones farmacológicas - Efectos de los anticonceptivos orales combinados sobre otros medicamentos).
La DRSP produce un aumento en la actividad de la renina plasmática y en la aldosterona plasmática inducido por su leve actividad antimineralocorticoide.
Control: Una mujer que toma AOC debe realizar una visita anual a su proveedor de atención médica para realizarse un control de la presión arterial y para otros controles que indique el profesional.
Otras afecciones: En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema. En ocasiones puede producirse cloasma, en especial en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia a desarrollar cloasma deben evitar exponerse al sol o a radiación ultravioleta mientras estén tomando AOC.
POSOLOGÍA Y ADMINISTRACIÓN:
2.1 Administración de YASMINIQ®: Tomar un comprimido diario por vía oral todos los días a la misma hora. La tasa de falla puede aumentar cuando no se toma el comprimido o se lo toma de manera incorrecta.
Para lograr la máxima eficacia anticonceptiva, YASMINIQ® debe tomarse como se indica, en el orden establecido en el blíster. Cada comprimido que no se administra, debe tomarse tan pronto como se recuerde hacerlo.
Comienzo de la administración de YASMINIQ®: Indicar a la paciente que comience a tomar YASMINIQ® el primer día de su periodo menstrual (Inicio el Día 1) o el primer domingo posterior al inicio de su periodo menstrual (Inicio el Día Domingo).
Inicio el día 1: Durante el primer ciclo de uso de YASMINIQ®, indicarle a la paciente que tome un comprimido rosa claro de YASMINIQ® por día, comenzando el Día 1 de su ciclo menstrual. (El primer día de menstruación es el Día 1.) Debe tomar un comprimido rosa claro de YASMINIQ® todos los días durante 24 días consecutivos, seguido de un comprimido blanco inerte, los Días 25 a 28. YASMINIQ® debe tomarse en el orden establecido en el envase, todos los días a la misma hora, preferentemente después de la cena o al acostarse con un poco de líquido, según sea necesario. YASMINIQ® puede tomarse sin tener en cuenta las comidas. Si YASMINIQ® se tomara por primera vez después del primer día del ciclo menstrual, no debe considerarse eficaz como anticonceptivo hasta después de los primeros 7 días consecutivos de la administración del producto. Indicar a la paciente que utilice un anticonceptivo no hormonal como respaldo durante los primeros 7 días. Es necesario considerar la posibilidad de ovulación y concepción antes de iniciar el medicamento.
Inicio el día domingo: Durante el primer ciclo de uso de YASMINIQ®, indicarle a la paciente que tome un comprimido rosa claro de YASMINIQ® por día, el primer domingo después del inicio de su periodo menstrual. Debe tomar un comprimido rosa claro de YASMINIQ® todos los días durante 24 días consecutivos, seguido de un comprimido blanco inerte, los días 25 a 28. YASMINIQ® debe tomarse en el orden establecido en el envase, todos los días a la misma hora, preferentemente después de la cena o al acostarse con un poco de líquido, según sea necesario. YASMINIQ® puede tomarse sin tener en cuenta las comidas. YASMINIQ® no debe considerarse eficaz como anticonceptivo hasta después de los primeros 7 días consecutivos de la administración del producto. Indicar a la paciente que utilice un anticonceptivo no hormonal como respaldo durante los primeros 7 días. Es necesario considerar la posibilidad de ovulación y concepción antes de iniciar el medicamento.
La paciente debe comenzar su siguiente régimen y todos los regímenes posteriores de 28 días de YASMINIQ® el mismo día de la semana en que comenzó el primer régimen, siguiendo el mismo esquema. Debe comenzar a tomar los comprimidos rosa claro el día siguiente a haber tomado el último comprimido blanco, independientemente de si presenta su periodo menstrual o se encuentra en curso. Cada vez que en un ciclo posterior se comience a tomar YASMINIQ® después del día siguiente a la administración del último comprimido blanco, la paciente debe utilizar otro método anticonceptivo hasta después de haber tomado el comprimido rosa claro de YASMINIQ® durante siete días consecutivos.
Cambio a partir de una píldora anticonceptiva diferente: Cuando se realiza el cambio a partir de otra píldora anticonceptiva, YASMINIQ® puede iniciarse el mismo día en que se iniciaba el nuevo envase del anticonceptivo oral anterior.
Cambio a partir de un método que no es la píldora anticonceptiva: Cuando se realiza el cambio de un parche transdérmico o anillo vaginal, YASMINIQ® debe iniciarse cuando se deba realizar la siguiente aplicación. Cuando se realiza el cambio a partir de una inyección, YASMINIQ® debe iniciarse cuando se deba aplicar la siguiente dosis. Cuando se realiza el cambio a partir de un anticonceptivo intrauterino o un implante, YASMINIQ® debe iniciarse el día en que se lo retira.
Generalmente el sangrado por privación se presenta dentro de los 3 días posteriores a la toma del último comprimido rosa claro. En caso de presentar manchado o sangrado intermenstrual mientras se toma YASMINIQ®, indicarle a la paciente que continúe tomando YASMINIQ® según el régimen descripto anteriormente. Informar a la paciente que este tipo de sangrado generalmente es transitorio y sin importancia, sin embargo, es necesario aconsejarle que si el sangrado es persistente o prolongado, debe consultar a su proveedor de atención médica.
Aunque la ocurrencia de embarazo es baja si se toma YASMINIQ® de acuerdo con las instrucciones, si no se produce sangrado por privación, evalúe la posibilidad de embarazo. Si la paciente no ha cumplido con el esquema de administración de dosis indicado (dejó de tomar uno o más de los comprimidos activos o ha comenzado a tomarlos un día después de lo indicado), evaluar la posibilidad de embarazo cuando se produce la primera falta de periodo y tomar las medidas de diagnóstico correspondientes. Si la paciente ha cumplido el régimen indicado y no presenta dos perodos consecutivos, descartar el embarazo. Discontinuar YASMINIQ® si se confirma el embarazo.
El riesgo de embarazo aumenta con cada comprimido rosa claro activo que no se toma. Si se produce sangrado intermenstrual después de no haber tomado los comprimidos, en general es transitorio y sin consecuencias. Si la paciente no toma uno o más comprimidos blancos, continuará protegida de la posibilidad de embarazo siempre que comience a tomar un nuevo ciclo de comprimidos rosa claro el día correspondiente.
En el caso de las mujeres posparto, que no se encuentren amamantando o después de un aborto en el segundo trimestre, comenzar YASMINIQ® no antes de las 4 semanas posparto debido a un mayor riesgo de tromboembolismo. Si la paciente comienza a tomar YASMINIQ® posparto y todavía no ha tenido su período, evaluar la posibilidad de embarazo e indicar a la paciente que utilice un método de anticonceptivo adicional hasta que haya tomado YASMINIQ® durante 7 días consecutivos.
Consejo en caso de trastornos gastrointestinales: En caso de vómitos o diarrea grave, es posible que la absorción no sea completa y se deberán tomar medidas anticonceptivas adicionales. Si se producen vómitos dentro de las 3 - 4 horas después de la toma del comprimido, se puede considerar este hecho como falta de toma del comprimido.
USO EN POBLACIONES ESPECÍFICAS:
Embarazo: Existe poco o ningún aumento en el riesgo de defectos de nacimiento en las mujeres que accidentalmente utilizan AOC durante la primera etapa del embarazo. Los estudios epidemiológicos y los meta-análisis no han encontrado un mayor riesgo de defectos genitales o no genitales de nacimiento (esto incluye anomalías cardiacas y defectos en la reducción de miembros) después de la exposición a bajas dosis de AOC antes de la concepción o durante la primera etapa del embarazo.
La administración de AOC para inducir un sangrado por privación no debe utilizarse como prueba de embarazo. Los AOC no deben utilizarse durante el embarazo para tratar la amenaza de o un aborto común.
Las mujeres que no desean amamantar pueden comenzar a tomar AOC no antes de las cuatro semanas posparto.
Madres en periodo de lactancia: De ser posible, aconsejar a la madre en periodo de lactancia que utilice otras formas de anticoncepción hasta el momento en que deje de amamantar a su hijo. Los AOC que contienen estrógeno pueden reducir la producción de leche en las madres en periodo de lactancia. Esto es menos probable una vez bien establecida la lactancia, sin embargo, en algunas mujeres, puede producirse en cualquier momento. Pequeñas cantidades de esteroides y/o metabolitos anticonceptivos orales están presentes en la leche materna.
Después de la administración oral de comprimidos de 3 mg de DRSP/0,03 mg de EE (YASMIN®), un 0,02 % de la dosis de DRSP se excreta en la leche materna de mujeres posparto, dentro de las 24 horas. Esto produce una dosis máxima diaria de unos 0,003 mg de DRSP en un lactante.
Uso pediátrico: Se ha establecido la seguridad y la eficacia de YASMINIQ® en mujeres en edad reproductiva. Se espera que la eficacia sea la misma para las adolescentes pospubertad de menos de 18 años y para las usuarias de 18 años y más. No está indicado el uso de este producto antes de la menarquia.
Uso geriátrico: No se ha estudiado YASMINIQ® en mujeres posmenopáusicas y no está indicado para esta población.
Pacientes con insuficiencia renal: YASMINIQ® está contraindicado en pacientes con insuficiencia renal (ver Contraindicaciones y Advertencias y precauciones - Hiperpotasemia).
En participantes con una depuración de creatinina (CLcr) de 50 - 79 ml/min, las concentraciones séricas de DRSP fueron comparables con las del grupo control con CLcr ≥ 80 ml/min. En participantes con una CLcr de 30 - 49 ml/min, las concentraciones séricas de DRSP fueron en promedio un 37% mayor que las del grupo control. Además, existe el potencial de desarrollo de hiperpotasemia en las participantes con insuficiencia renal cuyo potasio sérico se encuentre en el rango superior de referencia y que estén utilizando fármacos preservadores de potasio en forma concomitante (ver Farmacología clínica - Farmacocinética).
Pacientes con insuficiencia hepática: YASMINIQ® está contraindicado en pacientes con insuficiencia hepática (ver Contraindicaciones y Advertencias y precauciones - Enfermedad hepática). La exposición media a DRSP en mujeres con insuficiencia hepática moderada es aproximadamente tres veces mayor que la exposición en mujeres con función hepática normal. YASMINIQ® no se ha estudiado en mujeres con insuficiencia hepática severa.
Raza: No se observaron diferencias de importancia clínica entre la farmacocinética de DRSP o de EE en mujeres japonesas versus caucásicas (ver Farmacología clínica - Farmacocinética).
SOBREDOSIS: No se han informado efectos serios por sobredosis, incluida su ingestión por parte de niños. La sobredosis puede producir sangrado por privación y náuseas en las mujeres.
La DRSP es un análogo de la espironolactona que presenta propiedades antimineralocorticoides. La concentración sérica de potasio y del sodio, y la evidencia de acidosis metabólica debe controlarse en casos de sobredosis.
DESCRIPCIÓN: YASMINIQ® (comprimidos de drospirenona/etinilestradiol) brinda un régimen anticonceptivo oral que consta de 24 comprimidos recubiertos rosa claro activos que contienen 3 mg de drospirenona y 0,02 mg de etinilestradiol estabilizados por betadex en forma de clatrato (complejo de inclusión molecular) y 4 comprimidos blancos recubiertos inertes.
Los ingredientes inactivos de los comprimidos rosa claro son el monohidrato de lactosa NF, el almidón de maíz NF, el estearato de magnesio NF, la hipromelosa USP, el talco USP, el dióxido de titanio USP, pigmento de óxido férrico, rojo NF. Los comprimidos blancos, recubiertos, inertes contienen monohidrato de lactosa NF, celulosa microcristalina NF, estearato de magnesio NF, hipromelosa USP, talco USP, dióxido de titanio USP.
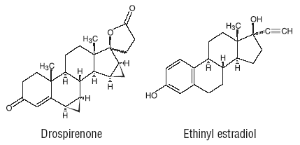
Drospirenona (6R,7R,8R,9S,10R,13S,14S,15S,16S,17S)-1,3’,4’,6,6a,7,8,9,10,11, 12,13,14,15,15a,16-hexadecahidro-10,13-dimetillspiro-[17H-diciclopropa- [6,7:15,16]ciclopenta[a]fenantreno-17,2’(5H)-furan]-3,5’(2H)-diona) es un compuesto progestacional sintético y presenta un peso molecular de 366,5 y una fórmula molecular de C24H30O3.
Etinilestradiol (19-nor-17α-pregna 1,3,5(10)-triene-20-ine-3, 17-diol) es un compuesto estrogénico sintético y presenta un peso molecular de 296,4 y una fórmula molecular de C20H24O2.
Las fórmulas estructurales son las siguientes:
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción: Los AOC previenen el embarazo principalmente suprimiendo la ovulación. Otros posibles mecanismos pueden incluir cambios en el moco del cuello uterino que inhiben la penetración del esperma.