
TYGACIL
TIGECICLINA
Polvo liofilizado para solución inyectable
1 Caja, 10 Vial (vidrio de tipo I) con tapón (caucho bromobutilo) y un sello (aluminio) con cápsula levadiza, Polvo liofilizado para solución inyectable, 50 Miligramos
1 Caja, 1 Vial (vidrio de tipo I) con tapón (caucho bromobutilo) y un sello (aluminio) con cápsula levadiza, Polvo liofilizado para solución inyectable, 50 Miligramos
1 Caja, 5 Vial (vidrio de tipo I) con tapón (caucho bromobutilo) y un sello (aluminio) con cápsula levadiza, Polvo liofilizado para solución inyectable, 50 Miligramos
INDICACIONES Y USO: TYGACIL® es un antibacteriano de la clase tetraciclinas indicado para el tratamiento de infecciones causadas por cepas aisladas susceptibles de los microorganismos designados en las condiciones enumeradas más adelante para pacientes de 18 años de edad o más:
Infecciones complicadas de la piel y tejidos blandos: Infecciones complicadas de la piel y tejidos blandos causadas por Escherichia coli, Enterococcus faecalis (cepas aisladas susceptibles a la vancomicina), Staphylococcus aureus (cepas aisladas susceptibles y resistentes a la meticilina), Streptococcus agalactiae, grupo Streptococcus anginosus (incluye S.anginosus, S. intermedius y S. constellatus), Streptococcus pyogenes, Enterobacter cloacae, Klebsiella pneumoniae y Bacteroides fragilis.
Infecciones intra-abdominales complicadas: Infecciones intra-abdominales complicadas causadas por Citrobacter freundii, Enterobacter cloacae, Escherichia coli, Klebsiella oxytoca, Klebsiella pneumoniae, Enterococcus faecalis (cepas aisladas susceptibles a la vancomicina), Staphylococcus aureus (cepas aisladas susceptibles y resistentes a la meticilina), grupo Streptococcus anginosus (incluye S. anginosus, S. intermedius y S. constellatus), Bacteroides fragilis, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides vulgatus, Clostridium perfringens y Peptostreptococcus micros.
Neumonía bacteriana adquirida en la comunidad: Neumonía bacteriana adquirida en la comunidad causada por Streptococcus pneumoniae (cepas aisladas susceptibles a la penicilina), incluyendo casos con bacterias concurrentes, Haemophilus influenzae (cepas aisladas beta-lactamasa negativas) y Legionella pneumophila.
Uso: Para reducir el desarrollo de las bacterias resistentes a los medicamentos y mantener la efectividad de TYGACIL® y otros medicamentos antibacterianos, debe utilizarse TYGACIL® sólo para tratar o prevenir las infecciones de las que se ha probado o se tiene una fuerte sospecha que son ocasionadas por bacterias susceptibles. Cuando el cultivo y la información sobre la susceptibilidad estén disponibles, éstos deberán considerarse al seleccionar o modificar el tratamiento antibacteriano. En ausencia de dichos datos, los patrones epidemiológicos y de susceptibilidad locales pueden contribuir a la selección empírica del tratamiento.
Deberá obtenerse especímenes apropiados para examen bacteriológico con el fin de aislar e identificar los organismos causantes y determinar su susceptibilidad a la tigeciclina. Se puede iniciar la administración de TYGACIL® como monoterapia empírica antes de conocerse los resultados de estas pruebas.
CONTRAINDICACIONES: TYGACIL® está contraindicado para uso en pacientes con hipersensibilidad conocida a la tigeciclina.
REACCIONES ADVERSAS
Experiencia en ensayos clínicos: Debido a que los ensayos clínicos son conducidos bajo condiciones muy variadas, las tasas de reacciones adversas observados en los ensayos clínicos de un fármaco no pueden ser comparadas directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
En los ensayos clínicos, se trató a 2514 pacientes con TYGACIL®. Se descontinuó TYGACIL® debido a reacciones adversas en 7% de los pacientes comparado con 6% para todos los comparadores. El Cuadro 1 muestra la incidencia de reacciones adversas emergentes del tratamiento mediante una prueba de curación en ≥2% de los pacientes en estos ensayos.
Cuadro 1. Incidencia (%) de reacciones adversas mediante una prueba de curación reportada en ≥2% de pacientes tratados en ensayos clínicos
|
Sistema corporal Reacciones adversas |
TYGACIL® (N=2514) |
Comparadoresa (N=2307) |
|
Cuerpo como un todo |
||
|
Dolor abdominal |
6 |
4 |
|
Absceso |
2 |
2 |
|
Astenia |
3 |
2 |
|
Dolor de cabeza |
6 |
7 |
|
Infección |
7 |
5 |
|
Sistema cardiovascular |
||
|
Flebitis |
3 |
4 |
|
Sistema digestivo |
||
|
Diarrea |
12 |
11 |
|
Dispepsia |
2 |
2 |
|
Náusea |
26 |
13 |
|
Vómitos |
18 |
9 |
|
Sistema hemático y linfático |
||
|
Anemia |
5 |
6 |
|
Metabólico y nutricional |
||
|
Aumento de fosfatasa alcalina |
3 |
3 |
|
Aumento de amilasa |
3 |
2 |
|
Bilirrubinemia |
2 |
1 |
|
Aumento de BUN |
3 |
1 |
|
Curación anormal |
3 |
2 |
|
Hiponatremia |
2 |
1 |
|
Hipoproteinemia |
5 |
3 |
|
Aumento de SGOTb |
4 |
5 |
|
Aumento de SGPTb |
5 |
5 |
|
Sistema respiratorio |
||
|
Neumonía |
2 |
2 |
|
Sistema nervioso |
||
|
Mareos |
3 |
3 |
|
Piel y apéndices |
||
|
Rash |
3 |
4 |
|
a. Vancomicina/Aztreonam, Imipenem/Cilastatina, Levofloxacina, Linezolid. b. Se reportaron anormalidades de LFT en pacientes tratados con TYGACIL®,con más frecuencia en el periodo post-tratamiento que aquellas en pacientes tratados con comparadores, que ocurrieron más frecuentemente en la terapia. |
||
En los 13 ensayos de Fase 3 y Fase 4 que incluyeron un comparador, ocurrieron muertes en 4,0% (150/3788) de los pacientes que recibieron TYGACIL® y 3,0% (110/3646) de los pacientes que recibieron fármacos comparadores. En un análisis combinado de estos ensayos, basado en un modelo de efectos aleatorios por peso de ensayo, una diferencia de riesgo ajustada de la mortalidad por todas las causas fue 0,6% (95% CI 0,1, 1,2) entre pacientes tratados con TYGACIL® y comparadores (véase Cuadro 2). No se ha establecido la causa del desequilibrio. En general, las muertes fueron el resultado de empeoramiento de infecciones, complicaciones de infecciones o co-morbilidades subyacentes.
Cuadro 2. Pacientes con resultado de muerte por tipo de infección
|
Tipo de infección |
TYGACIL® |
Comparador |
Diferencia de riesgo* |
||
|
n/N |
% |
n/N |
% |
% (IC 95%) |
|
|
cSSSI |
12/834 |
1,4 |
6/813 |
0,7 |
0,7(-0,3, 1,7) |
|
cIAI |
42/1382 |
3,0 |
31/1393 |
2,2 |
0,8 (-0,4, 2,0) |
|
CAP |
12/424 |
2,8 |
11/422 |
2,6 |
0,2 (-2,0, 2,4) |
|
HAP |
66/467 |
14,1 |
57/467 |
12,2 |
1,9 (-2,4, 6,3) |
|
No VAPa |
41/336 |
12,2 |
42/345 |
12,2 |
0,0 (-4,9, 4,9) |
|
VAPa |
25/131 |
19,1 |
15/122 |
12,3 |
6,8 (-2,1, 15,7) |
|
RP |
11/128 |
8,6 |
2/43 |
4,7 |
3,9 (-4,0, 11,9) |
|
DFI |
7/553 |
1,3 |
3/508 |
0,6 |
0,7 (-0,5, 1,8) |
|
Global ajustado |
150/3788 |
4,0 |
110/3646 |
3,0 |
0,6 (0,1, 1,2)** |
|
CAP = Neumonía adquirida en la comunidad; cIAI = Infecciones intraabdominales complicadas. cSSSI = Infecciones cutáneas y de estructura cutánea complicadas; HAP = Neumonía adquirida en el hospital; VAP = Neumonía asociada al ventilador; RP = Patógenos resistentes; DFI = Infecciones de pie diabético. * La diferencia entre el porcentaje de pacientes que murieron en grupos de tratamiento con TYGACIL® y comparador. Se calculó un IC de 95% por cada tipo de infección usando el método de aproximación normal sin corrección de continuidad. ** Estimado de diferencia de riesgo ajustado (modelo de efectos aleatorios por peso de ensayo) global e IC de 95%. a. Estos son subgrupos de la población HAP. Nota: Los estudios incluyen 300, 305, 900 (cSSSI), 301, 306, 315, 316, 400 (cIAI), 308 y 313 (CAP), 311 (HAP), 307 [Estudio de patógenos Gram positivos resistentes en pacientes con MRSA o Enterococo Resistente a Vancomicina (VRE)] y 319 (DFI con y sin osteomielitis). |
|||||
En estudios clínicos comparativos, se reportaron eventos adversos graves relacionados con infecciones para los sujetos tratados con TYGACIL® (7%) con más frecuencia que para los tratados con comparadores (6%).
Se reportaron eventos adversos graves de sepsis/shock séptico para los sujetos tratados con TYGACIL® (2%) con más frecuencia que para los tratados con comparadores (1%). Debido a diferencias basales entre los grupos de tratamiento en este subconjunto de pacientes, no se puede establecer la relación de este resultado al tratamiento (ver Advertencias y precauciones: Pacientes con perforación intestinal).
Las reacciones adversas más comunes causadas por el tratamiento fueron náuseas y vómitos que generalmente ocurrieron durante los primeros 1 – 2 días del tratamiento. La mayoría de casos de náuseas y vómitos asociados con TYGACIL® y comparadores fueron de severidad leve o moderada. En pacientes tratados con TYGACIL®, la incidencia de las náuseas fue de 26% (17% leve, 8% moderada, 1% severa) y la incidencia de vómitos fue de 18% (11% leve, 6% moderada, 1% severa).
En pacientes tratados por infecciones complicadas de piel y estructura cutánea (cSSSI), la incidencia de náuseas fue de 35% para TYGACIL® y 9% para vancomicina/aztreonam, la incidencia de vómitos fue de 20% para TYGACIL® y 4% para vancomicina/aztreonam. En pacientes tratados por infecciones intraabdominales complicadas (cIAI), la incidencia de náuseas fue de 25% para TYGACIL® y 21% para imipenem/cilastatina; la incidencia de vómitos fue de 20% para TYGACIL® y 15% para imipenem/cilastatina. En pacientes tratados por neumonía bacteriana adquirida en la comunidad (CABP), la incidencia de náuseas fue de 24% para TYGACIL® y 8% para levofloxacina; la incidencia de vómitos fue de 16% para TYGACIL® y 6% para levofloxacina.
La descontinuación de tigeciclina estuvo asociado más frecuentemente con náuseas (1%) y vómitos (1%).
Para los comparadores, la descontinuación estuvo asociada más frecuentemente con las náuseas (<1%).
Las siguientes reacciones adversas fueron reportadas con poca frecuencia (<2%) en pacientes que recibieron TYGACIL® en estudios clínicos.
• Cuerpo como un todo: Inflamación en el área de inyección, dolor en el área de inyección, reacción en el área de inyección, shock séptico, reacción alérgica, escalofríos, edema en el área de inyección, flebitis en el área de inyección.
• Sistema cardiovascular: Tromboflebitis.
• Sistema digestivo: Anorexia, ictericia, heces anormales.
• Sistema Metabólico/Nutricional: Aumento de creatinina, hipocalcemia, hipoglicemia.
• Sentidos especiales: Perversión del gusto.
• Sistema hemático y linfático: Tiempo de tromboplastina parcial (aPTT), tiempo de protrombina prolongado (PT), eosinofilia, aumento de relación normalizada internacional (INR), trombocitopenia.
• Piel y apéndices: Prurito.
• Sistema urogenital: Moniliasis vaginal, vaginitis, leucorrea.
Experiencia post-comercialización: Se ha identificado las siguientes reacciones adversas durante el uso post-aprobación de TYGACIL®. Debido a que estas reacciones son reportadas voluntariamente desde una población de tamaño indeterminado, no siempre es posible estimar con seguridad su frecuencia o establecer relaciones causales con la exposición al fármaco.
• Reacciones anafilácticas/anafilactoides.
• Pancreatitis aguda.
• Colestasis hepática e ictericia.
• Reacciones severas de la piel, incluyendo el Síndrome de Stevens-Johnson.
INTERACCIONES MEDICAMENTOSAS
Warfarina: Deberá monitorearse el tiempo de protrombina u otra prueba de anticoagulación apropiada si se administra tigeciclina con warfarina (ver Farmacología clínica: Microbiología).
Anticonceptivos orales: El uso concurrente de fármacos antibacterianos con anticonceptivos orales puede hacer menos efectivos los anticonceptivos orales.
TOXICOLOGÍA NO CLÍNICA
Carcinogénesis, mutagénesis, deterioro de la fertilidad: No se ha realizado estudios en animales que duren toda la vida para evaluar el potencial carcinogénico de tigeciclina. No se encontró potencial mutagénico o clastogénico en una serie de pruebas, incluyendo ensayo de aberraciones cromosómicas in vitro en células de ovario de hámster chino (CHO), ensayo de mutación frontal in vitro de células CHO (locus HGRPT), ensayos de mutación frontal in vitro en células de linfoma de ratón y en ensayos de micronúlceo in vivo de ratón. La tigeciclina no afectó el apareamiento o la fertilidad en ratas a exposiciones 5 veces la dosis diaria en humanos basada en el AUC (28 mcg• hr/mL a 12 mg/kg/día). En ratas hembras, no hubo efectos relacionados con el compuesto sobre los ovarios o ciclos estrales a exposiciones hasta 5 veces la dosis diaria en humanos basada en el AUC.
Toxicología y/o Farmacología animal: En estudios de dos semanas, se han observado reducciones en eritrocitos, reticulocitos, leucocitos y plaquetas, en asociación con hipocelularidad de médula ósea, con tigeciclina a exposiciones 8 y 10 veces la dosis diaria en humanos basada en el AUC en ratas y perros, (AUC de aproximadamente 50 y 60 mcg• hr/mL a dosis de 30 y 12 mg/kg/día) respectivamente. Estas alteraciones mostraron ser reversibles después de 2 semanas de dosificación.
ADVERTENCIAS Y PRECAUCIONES
Mortalidad por todas las causas: Se ha observado un aumento en la mortalidad por todas las causas en los ensayos clínicos de Fase 3 y Fase 4 en pacientes tratados con TYGACIL® frente a pacientes tratados con comparadores. En los 13 ensayos clínicos Fase 3 y 4 que incluyeron un comparador, ocurrieron muertes en 4,0% (150/3788) de los pacientes que recibieron TYGACIL® y 3.0% (110/3646) de los pacientes que recibieron fármacos comparadores. En un análisis combinado de estos ensayos, basado en un modelo de efectos aleatorios por peso de ensayo, una diferencia de riesgo ajustada de mortalidad por todas las causas fue 0,6% (95% CI 0,1, 1,2) entre pacientes tratados con TYGACIL® y comparadores. No se ha establecido la causa de este incremento. Deberá considerarse este incremento al seleccionar entre opciones de tratamiento (ver Advertencias y precauciones: Desequilibrio de mortalidad y menores índices de cura en neumonía asociada al ventilador y Reacciones adversas: Experiencia en ensayos clínicos).
Reacciones anafilácticas/anafilactoides: Se ha reportado reacciones anafilácticas/anafilactoides con casi todos los agentes antibacterianos, incluyendo TYGACIL®, que pueden ser potencialmente mortales. TYGACIL® es estructuralmente similar a los antibióticos de clase tetracicilina y debe ser administrado con cuidado en pacientes con hipersensibilidad conocida a los antibióticos de de clase tetracicilina.
Efectos hepáticos: Se ha observado aumentos en la concentración total de bilirrubina, tiempo de protrombina y transaminasas en pacientes tratados con tigeciclina. Se ha reportado casos aislados de disfunción hepática significativa e insuficiencia hepática en pacientes tratados con tigeciclina. Algunos de estos pacientes estaban recibiendo múltiples medicamentos concomitantes. Los pacientes que desarrollan pruebas de función hepática anormales durante el tratamiento con tigeciclina deberán ser monitoreados para detectar evidencias de empeoramiento de la función hepática y que sean evaluados para decidir los riesgos/beneficios de continuar con el tratamiento con tigeciclina. Pueden ocurrir eventos adversos después de haberse descontinuado el fármaco.
Desequilibrio de mortalidad y menores índices de cura en neumonía asociada al ventilador: Un estudio de pacientes con neumonía adquirida en el hospital no pudo demostrar la eficacia de TYGACIL®.
En este estudio, los pacientes fueron aleatorizados para recibir TYGACIL® (100 mg inicialmente, luego 50 mg cada 12 horas) o un comparador. Además, se permitió a los pacientes recibir terapias complementarias específicas. El subgrupo de pacientes con neumonía asociada al ventilador que recibieron TYGACIL® tuvo menores índices de curación (47,9% frente a 70,1% para la población clínicamente evaluable).
En este estudio, se observó mayor mortalidad en pacientes con neumonía asociada al ventilador que recibieron TYGACIL® (25/131 [19,1%] frente a 15/122 [12,3%] en pacientes tratados con comparadores) [ver Reacciones adversas: Experiencia en ensayos clínicos)]. Se observó una alta mortalidad en particular entre pacientes tratados con TYGACIL® con neumonía asociada al ventilador y bacteriemia en la basal (9/18 [50,0%] frente a 1/13 [7,7%] en pacientes tratados con comparadores.
Pancreatitis: Casos de pancreatitis aguda, incluyendo casos fatales, han ocurrido en asociación con el tratamiento con tigeciclina. Deberá considerarse el diagnóstico de la pancreatitis aguda en pacientes que tomen tigeciclina y desarrollen síntomas o señales clínicas o anormalidades de laboratorios que sugieran pancreatitis aguda. Se ha reportado casos en pacientes sin factores de riesgo conocidos de pancreatitis. Los pacientes normalmente mejoran después de la descontinuación de tigeciclina. Deberá considerarse el cese del tratamiento con tigeciclina en casos en los que se sospeche el desarrollo de pancreatitis (ver Reacciones adversas: Experiencia post-comercialización)].
Uso durante embarazo: TYGACIL® puede causar daño fetal si se administra a una mujer embarazada. Si la paciente queda embarazada mientras toma tigeciclina, deberá ponerse en conocimiento de la paciente el peligro potencial para el feto. Resultados de estudios en animales indican que la tigeciclina cruza la placenta y se encuentra en los tejidos fetales. Se ha observado una disminución del peso fetal en ratas y conejos (con demoras asociadas en la osificación) y pérdida fetal en conejos con la tigeciclina (ver Uso en poblaciones específicas: Embarazo).
Desarrollo dentario: El uso de TYGACIL® durante el desarrollo dentario (última mitad del embarazo, infancia y niñez hasta la edad de 8 años) puede ocasionar decoloración permanente de los dientes (amarillo-grismarrón).
Resultados de estudios en ratas con TYGACIL® han mostrado decoloración ósea. No debe utilizarse TYGACIL® durante el desarrollo dentario a menos que otros fármacos no sean probablemente efectivos o estén contraindicados.
Diarrea asociada a Clostridium difficile: Se ha reportado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluyendo TYGACIL®, y pueden variar en severidad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon conduciendo a una proliferación
de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Cepas de C. difficile productoras de hipertoxinas causan un aumento de morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Debe considerarse la CDAD en todos los pacientes que presentan diarrea después del uso de antibióticos. Es necesaria una historia médica cuidadosa ya que se ha reportado la ocurrencia de CDAD dos meses después de la administración de agentes antibacterianos.
Si se sospecha o confirma la presencia de CDAD, puede ser necesario descontinuar el uso de antibióticos no dirigidos a combatir C. difficile. Deberá iniciarse un suministro apropiado de líquidos y electrolitos y suplementos proteicos, un tratamiento antibiótico de C. difficile y una evaluación quirúrgica según indicación clínica.
Pacientes con perforación intestinal: Deberá tenerse cuidado al considerar la monoterapia con TYGACIL® en pacientes con infecciones intraabdominales complicadas (cIAI) secundarias a la perforación intestinal clínicamente aparente. En estudios de cIAI (n=1642), 6 pacientes tratados con TYGACIL® y 2 pacientes tratados con imipenem/cilastatina presentaron perforaciones intestinales y desarrollaron sepsis/shock séptico. Los 6 pacientes tratados con TYGACIL® tuvieron mayores puntuaciones de APACHE II (mediana = 13) frente a los 2 pacientes tratados con imipenem/cilastatina (puntuaciones APACHE II = 4 y 6). Debido a diferencias en las puntuaciones de APACHE II en la basal entre grupos de tratamiento y números pequeños en general, no se puede establecer la relación de este resultado al tratamiento.
Efectos de clase tetraciclina: TYGACIL® es estructuralmente similar a los antibióticos de clase tetraciclina y puede tener efectos adversos similares. Dichos efectos pueden incluir: fotosensibilidad, pseudotumor cerebral y acción antianabólica (que ha conducido a aumento de BUN, azotemia, acidosis e hiperfosfatemia). Al igual que con las tetraciclinas, se ha reportado pancreatitis con el uso de TYGACIL® (ver Advertencias y precauciones: Pancreatitis).
Sobreinfección: Al igual que con otros fármacos antibacterianos, el uso de TYGACIL® puede resultar en la proliferación de organismos no susceptibles, incluyendo hongos. Deberá monitorearse a los pacientes de cerca durante el tratamiento. Si ocurre una sobreinfección, deberá tomarse medidas apropiadas.
Desarrollo de bacterias resistentes al fármaco: La prescripción de TYGACIL® en ausencia de una infección probada o sobre la que exista una fuerte sospecha es poco probable que produzca algún beneficio al paciente y aumenta el riesgo de desarrollo de bacterias resistentes al fármaco.
DOSIS Y ADMINISTRACIÓN
Dosis y administración general: El régimen de dosis recomendado para TYGACIL® es una dosis inicial de 100 mg, seguida por 50 mg cada 12 horas. Las infusiones intravenosas de TYGACIL® deben administrarse durante aproximadamente 30 a 60 minutos cada 12 horas.
La duración recomendada del tratamiento con TYGACIL® para infecciones complicadas de piel y estructura cutánea o para infecciones intraabdominales complicadas es de 5 a 14 días. La duración recomendada del tratamiento con TYGACIL® para la neumonía bacteriana adquirida en la comunidad es de 7 a 14 días. La duración de la terapia deberá estar guiada por la severidad y área de la infección y el progreso clínico y bacteriológico del paciente.
Pacientes con insuficiencia hepática: No se requiere ningún ajuste de dosis en pacientes con insuficiencia hepática leve a moderada (Child Pugh A y Child Pugh B). En pacientes con insuficiencia hepática severa (Child Pugh C), la dosis inicial de TYGACIL® deberá ser de 100 mg seguida de una dosis de mantenimiento reducida de 25 mg cada 12 horas.
Los pacientes con insuficiencia hepática severa (Child Pugh C) deberán ser tratados cuidadosamente y su respuesta al tratamiento deberá ser monitoreada (ver Farmacología clínica: Microbiología y Uso en poblaciones específicas: Insuficiencia hepática).
Preparación y manejo: Cada vial de TYGACIL® deberá ser reconstituido con 5,3 mL de Inyección de Cloruro de Sodio 0,9%, USP, Inyección de Dextrosa 5%, USP, o Inyección de Lactato de Ringer, USP para alcanzar una concentración de 10 mg/mL de tigeciclina. (Nota: Cada vial contiene una sobredosificación de 6%. Por tanto, 5 mL de solución reconstituida es equivalente a 50 mg del fármaco). Deberá agitarse suavemente el vial hasta que se disuelva el fármaco. Retire 5 mL de la solución reconstituida del vial y añada a una bolsa de 100 mL intravenosa para infusión (para una dosis de 100 mg, reconstituya dos viales; para una dosis de 50 mg, reconstituya un vial). La concentración máxima en la bolsa intravenosa deberá ser 1 mg/mL. La solución reconstituida deberá ser de color amarillo a naranja; de no ser así, deberá descartarse la solución. Deberá inspeccionarse visualmente los productos farmacéuticos parenterales para detectar materia particulado o decoloración (p. ej. verde o negro) antes de la administración. Después de reconstituido conservar a una temperatura no mayor a 30 °C hasta por 6 horas. No congelar TYGACIL® puede ser administrado intravenosamente a través de una línea exclusiva o un conector Y. Si la misma línea intravenosa es utilizada para la infusión secuencial de varios medicamentos, deberá lavarse la línea antes y después de la infusión de TYGACIL® con Inyección de Cloruro de Sodio 0,9% , USP, Inyección de Dextrosa 5%, USP, o Inyección de Lactato de Ringer, USP. La inyección deberá estar preparada con una solución de infusión compatible con tigeciclina y con cualquier otro fármaco o fármacos administrados a través de esta línea común.
• Compatibilidades: Las soluciones intravenosas compatibles incluyen Inyección de Cloruro de Sodio 0,9%, USP, Inyección de Dextrosa 5%, USP, e Inyección de Lactato de Ringer, USP. Al ser administrado a través de un conector Y, TYGACIL® es compatible con los siguientes fármacos o diluyentes cuando se utiliza con Inyección de Cloruro de Sodio 0,9%, USP, Inyección de Dextrosa 5%, USP: amikacina, dobutamina, dopamina HCI, gentamicina, haloperidol, Lactato de Ringer, lidocaína HCI, metoclopramida, morfina, norepinefrina, piperacilina/tazobactam (formulación EDTA), cloruro de potasio, propofol, ranitidina HCI, teofilina y tobramicina.
• Incompatibilidades: Los siguientes fármacos no deben administrarse simultáneamente a través del mismo conector Y que TYGACIL®: Anfotericina B, anfotericina B complejo lipídico, diazepán, esomeprazol y omeprazol.
USO EN POBLACIONES ESPECÍFICAS
Embarazo: Efectos Teratogénicos en el Embarazo—Embarazo Categoría D (ver Advertencias y precauciones: Uso durante embarazo).
La tigeciclina no fue teratogénica en la rata o el conejo. En estudios de seguridad preclínicos, la tigeciclina marcada con 14C cruzó la placenta y se encontró en tejidos fetales, incluyendo estructuras óseas fetales. La administración de tigeciclina estuvo asociada con ligeras reducciones en los pesos fetales y aumento de la incidencia de anomalías esqueléticas menores (retardo en la osificación de los huesos) a exposiciones de 5 veces y 1 vez la dosis humana diaria basada en AUC en ratas y conejos, respectivamente (28 mcg• hr/mL y 6 mcg• hr/mL a 12 y 4 mg/kg/día). Se observó un aumento de la incidencia de pérdida fetal a dosis materno tóxicas en los conejos con exposiciones equivalentes a la dosis humana.
No existen estudios adecuados y bien controlados de tigeciclina en mujeres embarazadas. Sólo deberá usarse TYGACIL® durante el embarazo si el beneficio potencial justifica el riesgo potencial al feto.
Madres lactantes: Los resultados de estudios en animales usando tigeciclina marcada con 14C indican que la tigeciclina es excretada fácilmente por la leche de las ratas lactantes. Consistente con la biodisponibilidad oral limitada de tigeciclina, hay poca o ninguna exposición sistémica a tigeciclina en las crías lactantes como resultado de la exposición vía la leche materna.
Se desconoce si este fármaco es excretado en la leche humana. Debido a que muchos fármacos son excretados en la leche humana, deberá tenerse cuidado cuando se administra TYGACIL® a una mujer lactante (ver Advertencias y precauciones: Desarrollo dentario).
Uso pediátrico: No se ha establecido la seguridad y efectividad en pacientes pediátricos menores de 18 años. Debido a los efectos sobre el desarrollo de los dientes, no se recomienda el uso en pacientes menores de 8 años (ver Advertencias y precauciones: Desarrollo dentario).
Uso geriátrico: Del número total de sujetos que recibieron TYGACIL® en los estudios clínicos de Fase 3 (n=2514), 664 tenían 65 años o más, mientras que 288 tenían 75 o más. No se observaron diferencias globales inesperadas en seguridad o efectividad entre estos sujetos y sujetos más jóvenes, pero no se puede descartar una mayor sensibilidad a eventos adversos en algunos individuos de mayor edad.
No se observó ninguna diferencia significativa en la exposición a la tigeciclina entre sujetos de edad avanzada saludables y sujetos más jóvenes luego de una dosis de 100 mg de tigeciclina (ver Farmacología clínica: Microbiología).
Insuficiencia hepática: No se justifica un ajuste de dosificación en pacientes con insuficiencia hepática leve a moderada (Child Pugh A y Child Pugh B). En pacientes con insuficiencia hepática severa (Child Pugh C), la dosis inicial de tigeciclina deberá ser de 100 mg seguida de una dosis de mantenimiento reducida de 25 mg cada 12 horas.
Los pacientes con insuficiencia hepática severa (Child Pugh C) deberán ser tratados cuidadosamente y su respuesta al tratamiento deberá ser monitoreada (ver Farmacología clínica: Microbiología y Dosificación y administración: Pacientes con insuficiencia hepática).
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES: Cada vial de vidrio de 5 mL y cada vial de vidrio de 10 mL de dosis única contienen 50 mg de tigecicilina como un polvo liofilizado anaranjado para reconstitución y excipientes c.s.p.
SOBREDOSIS: No existe información específica disponible sobre el tratamiento de la sobredosis con tigeciclina. La administración intravenosa de TYGACIL® a una dosis única de 300 mg durante 60 minutos en voluntarios saludables dio como resultado un aumento de la incidencia de náuseas y vómitos. En estudios de toxicidad intravenosa de dosis única conducidos con tigeciclina en ratones, la dosis letal mediana estimada (LD50) fue de 124 mg/kg en machos y 98 kg/kg en hembras. En las ratas, la LD50 fue de 106 mg/kg para ambos sexos. La tigeciclina no se elimina en cantidades significativas por hemodiálisis.
DESCRIPCIÓN: TYGACIL® (tigeciclina) es un derivado de la tetraciclina (una glicilciclina) para infusión intravenosa. El nombre químico de tigeciclina es (4S,4aS,5aR,12aS)-9-[2-(tert-butilamino)acetamido]- 4,7bis(dimetilamino)-1,4,4a,5,5a,6,11,12a-octahidro-3,10,12,12a-tetrahidroxi-1,11-dioxo-2naftacenocarboxamida. La fórmula empírica es C29H39N5O8 y el peso molecular es 585,65.
La siguiente representa la estructura química de la tigeciclina:
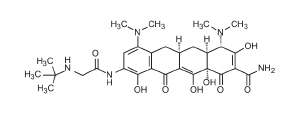
La tigeciclina para inyección está disponible en viales de vidrio Tipo 1, monodosis de 5 mL,que contienen 50 mg de polvo liofilizado para infusión.
Excipientes: Cada vial contiene lactosa monohidrato, ácido clorhídrico, hidróxido de sodio, agua para inyección y nitrógeno.
El pH es ajustado con ácido clorhídrico y si es necesario con hidróxido de sodio.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción: Tigeciclina es un fármaco antibacteriano (ver Farmacología clínica).
Farmacocinética: Los parámetros farmacocinéticos medios de tigeciclina después de dosis intravenosas únicas y múltiples basados en datos combinados de estudios farmacológicos clínicos son resumidos en el Cuadro 3. Las infusiones intravenosas de tigeciclina fueron administradas durante aproximadamente 30 a 60 minutos.
Cuadro 3. Parámetros farmacocinéticos Medios /CV%) de tigeciclina
|
Dosis única 100 mg (N=224) |
Dosis múltiplea 50 mg cada 12h (N=103) |
|
|
Cmax (mcg/mL)b |
1,45 (22%) |
0,87 (27%) |
|
Cmax (mcg/mL)c |
0,90 (30%) |
0,63 (15%) |
|
AUC (mcg• h/mL) |
5,19 (36%) |
-- |
|
AUC0-24h (mcg• h/mL) |
-- |
4,70 (36%) |
|
Cmin (mcg/mL) |
-- |
0,13 (59%) |
|
t1/2 (h) |
27,1 (53%) |
42,4 (83%) |
|
CL (L/h) |
21,8 (40%) |
23,8 (33%) |
|
CLr (mL/min) |
38,0 (82%) |
51,0 (58%) |
|
Vss (L) |
568 (43%) |
639 (48%) |
|
a. 100 mg inicialmente, seguida de 50 mg cada 12 horas b. Infusión de 30 minutos. c. Infusión de 60 minutos. |
||
• Distribución: La unión a proteínas plasmáticas in vitro de tigeciclina varía de aproximadamente 71% a 89% en concentraciones observadas en estudios clínicos (0,1 a 1,0 mcg/mL). El volumen de estado estable de distribución de tigeciclina promedió 500 a 700 L (7 a 9 L/kg), indicando que la tigeciclina es distribuida ampliamente más allá del volumen de plasma y hacia los tejidos.
Luego de la administración de tigeciclina 100 mg seguida de 50 mg cada 12 horas a 33 voluntarios saludables, el AUC0-12h de tigeciclina (134 mcg• h/mL) en células alveolares fue aproximadamente 78 veces mayor que el AUC0-12h en el suero, y el AUC0-12h (2,28 mcg• h/mL) en líquido de revestimiento epitelial fue aproximadamente 32% mayor que el AUC0-12h en el suero. El AUC0-12h (1,61 mcg• h/mL) de tigeciclina en fluido de ampollas cutáneas fue aproximadamente 26% menor que el AUC0-12h en el suero de 10 sujetos saludables.
En un estudio de dosis única, se administró tigeciclina 100 mg a sujetos antes de someterse a cirugía electiva o procedimiento médico para extracción de tejido. Las concentraciones a 4 horas después de la administración de tigeciclina fueron más elevadas en la vesícula (38 veces, n=6), pulmón (3,7 veces, n=5) y colon (2,3 veces, n=6), y menor en líquido sinovial (0,58 veces, n=5) y hueso (0,35 veces, n=6) en relación al suero. La concentración de tigeciclina en estos tejidos después de dosis múltiples no ha sido estudiada.
• Metabolismo: La tigeciclina no es ampliamente metabolizada. Estudios in vitro con tigeciclina usando microsomas de hígado humano, cortes de hígado, y hepatocitos condujeron a la formación de sólo cantidades mínimas de metabolitos. En voluntarios masculinos saludables que recibieron tigeciclina 14C, la tigeciclina fue el principal material marcado con 14C recuperado en la orina y las heces, pero también estuvieron presentes un glucurónido, un metabolito N-acetil y un epímero de tigeciclina (cada uno a no más de 10% de la dosis administrada).
• Eliminación: La recuperación de la radiactividad total en heces y orina luego de la administración de tigeciclina 14C indica que 59% de la dosis es eliminada por excreción biliar/fecal, y 33% es excretada en la orina. Aproximadamente 22% de la dosis total es excretada como tigeciclina inalterada en la orina. En conjunto, la ruta primaria de eliminación para tigeciclina es la excreción biliar de tigeciclina inalterada y sus metabolitos. La glucuronidación y la excreción renal de tigeciclina son rutas secundarias.
• Poblaciones específicas:
– Pacientes con insuficiencia hepática: En un estudio que comparó a 10 pacientes con insuficiencia hepática leve (Child Pugh A), 10 pacientes con insuficiencia hepática moderada (Child Pugh B) y 5 pacientes con insuficiencia hepática severa (Child Pugh C) con 23 sujetos de control saludables de edad y peso equivalentes, la disposición farmacocinética de dosis única de tigeciclina no fue alterada en pacientes con insuficiencia hepática leve. Sin embargo, la eliminación sistémica de tigeciclina se redujo en 25% y la semivida de tigeciclina se prolongó en 23% en pacientes con insuficiencia hepática moderada (Child Pugh B). La eliminación sistémica de tigeciclina se redujo en 55% y la semivida de tigeciclina se prolongó en 43% en pacientes con insuficiencia hepática severa (Child Pugh C). Es necesario un ajuste de dosis en pacientes con insuficiencia hepática severa (Child Pugh C) (ver Uso en poblaciones específicas: Insuficiencia hepática y Dosis y administración: Pacientes con insuficiencia hepática).
– Pacientes con insuficiencia renal: Un estudio de dosis única comparó 6 sujetos con insuficiencia renal severa (eliminación de creatinina <30 mL/min), 4 pacientes con enfermedad renal en etapa terminal (ESRD) que recibieron tigeciclina 2 horas antes de la hemodiálisis, 4 pacientes con ESRD que recibieron tigeciclina 1 hora después de la hemodiálisis y 6 sujetos de control saludables. El perfil farmacocinético de la tigeciclina no se vio significativamente alterado en ninguno de los grupos de pacientes con insuficiencia renal, ni la tigeciclina fue eliminada por la hemodiálisis. No es necesario ningún ajuste de dosis de TYGACIL® en pacientes con insuficiencia renal o en pacientes sometidos a hemodiálisis.
– Pacientes geriátricos: No se observó diferencias significativas en la farmacocinética entre sujetos de edad avanzada saludables (n=15, edad 65-75; n=13, edad >75) y sujetos más jóvenes (n=18) que recibieron una dosis única de 100 mg de TYGACIL®. Por tanto, no es necesario ningún ajuste de dosis según la edad (ver Uso en poblaciones específicas: Uso geriátrico).
– Género: En un análisis combinado de 38 mujeres y 298 hombres que participaron en estudios farmacológico clínicos, no hubo una diferencia significativa en la eliminación media (±SD) de tigeciclina entre mujeres (20,7±6,5 L/h) y hombres (22,8±8,7 L/h). Por tanto, no es necesario ningún ajuste de dosis según el género.
– Raza: En un análisis combinado de 73 sujetos asiáticos, 53 sujetos de raza negra, 15 pacientes hispánicos, 190 sujetos de raza blanca y 3 sujetos clasificados como “otros” que participaron en estudios farmacológicos clínicos, no hubo ninguna diferencia significativa en la eliminación media (±SD) de tigeciclina entre los sujetos asiáticos (28,8±8,8 L/h), sujetos de raza negra (23,0±7,8 L/h), sujetos hispanos (24,3±6,5 L/h), sujetos de raza blanca (22,1±8,9 L/h) y “otros” sujetos (25,0±4,8 L/h). Por tanto, no es necesario ningún ajuste de dosis según la raza.
• Interacciones medicamentosas: TYGACIL® (100 mg seguido de 50 mg cada 12 horas) y digoxina (0,5 mg seguido de 0,25 mg, por vía oral, cada 24 horas) fueron coadministradas a sujetos saludables en un estudio de interacción medicamentosa.
Tigeciclina disminuyó ligeramente la Cmax de digoxina en 13%, pero no afectó el AUC o la eliminación de digoxina. Este pequeño cambio en Cmax no afectó los efectos farmacodinámicos de estado estable de digoxina según la medición de los cambios en intervalos ECG. Además, digoxina no afectó el perfil farmacocinético de tigeciclina. Por tanto, no es necesario ajustar la dosis de ninguno de los fármacos al administrarse TYGACIL® con digoxina.
La administración concomitante de TYGACIL® (100 mg seguido de 50 mg cada 12 horas) y warfarina (dosis única de 25 mg) a sujetos saludables resultó en una disminución de la eliminación de R-warfarina y S-warfarina en 40% y 23%, un aumento en Cmax en 38% y 43% y un aumento en AUC en 68% y 29%, respectivamente. Tigeciclina no alteró significativamente los efectos de warfarina en INR. Además, warfarina no afectó el perfil farmacocinético de tigeciclina. Sin embargo, deberá monitorearse el tiempo de protrombina u otra prueba de anticoagulación apropiada si se administra tigeciclina con warfarina.
Estudios in vitro en microsomas hepáticos humanos indican que tigeciclina no inhibe el metabolismo mediado por ninguna de de las siguientes 6 isoformas del citocromo P450 (CYP): 1A2, 2C8, 2C9, 2C19, 2D6 y 3A4. Por tanto, no se espera que TYGACIL® altere el metabolismo de los fármacos metabolizados por estas enzimas. Además, debido a que la tigeciclina no es ampliamente metabolizada, no se espera que la depuración de tigeciclina sea afectada por fármacos que inhiban o induzcan la actividad de estas isoformas CYP450.
Microbiología:
• Mecanismo de acción: Tigeciclina, una glicilciclina, inhibe la transferencia de proteínas en las bacterias al unirse a la subunidad ribosómica 30S y bloquear la entrada de moléculas aminoacil-tRNA al sitio A del ribosoma. Esto impide la incorporación de residuos de aminoácidos a cadenas peptídicas elongadas. Tigeciclina contiene una fracción de glicilamido adjunta a la posición 9 de minociclina. El patrón de sustitución no está presente en ninguna tetraciclina natural o semisintética e imparte ciertas propiedades microbiológicas a la tigeciclina. En general, la tigeciclina se considera bacteriostática; sin embargo, TYGACIL® ha demostrado actividad bactericida contra cepas aisladas de S. pneumoniae y L. pneumophila.
• Mecanismo(s) de resistencia: A la fecha no se ha observado resistencia cruzada entre tigeciclina y otros antibacterianos. Tigeciclina no es afectada por los dos mecanismos principales de resistencia a la tetraciclina, protección ribosómica y eflujo. Además, tigeciclina no es afectada por mecanismos de resistencia tales como beta-lactamasas (incluyendo beta-lactamasas de espectro extendido), modificaciones en el sitio objetivo, bombas de eflujo de macrólido o cambios en el objetivo de enzimas (p. ej. girasa/topoimerasas). La resistencia a la tigeciclina en algunas bacterias (p. ej. complejo . Acinetobacter calcoaceticus-Acinetobacter baumannii) está asociada con bombas de eflujo resistentes a múltiples fármacos (MDR).
• Interacción con otros antimicrobianos: Estudios in vitro no han demostrado antagonismo entre tigeciclina y otros antibacterianos utilizados comúnmente.
Se ha mostrado que tigeciclina es activa contra la mayoría de las siguientes bacterias, tanto en infecciones in vitro como clínicas (ver Indicaciones y uso).
– Bacterias Gram positivas facultativas:
– Enterococcus faecalis (cepas aisladas susceptibles a vancomicina).
– Staphylococcus aureus (cepas aisladas susceptibles y resistentes a meticilina).
– Streptococcus agalactiae.
– Grupo Streptococcus anginosus (incluye S. anginosus, S. intermedius y S. constellatus).
– Streptococcus pneumoniae (cepas aisladas susceptibles a penicilina).
– Streptococcus pyogenes.
– Bacterias Gram negativas facultativas:
– Citrobacter freundii.
– Enterobacter cloacae.
– Escherichia coli.
– Haemophilus influenzae (cepas aisladas negativas de beta-lactamasa).
– Klebsiella oxytoca.
– Klebsiella pneumoniae.
– Legionella pneumophila.
– Bacterias anaeróbicas:
– Bacteroides fragilis.
– Bacteroides thetaiotaomicron.
– Bacteroides uniformis.
– Bacteroides vulgatus.
– Clostridium perfringens.
– Peptostreptococcus micros.
Por lo menos 90% de las siguientes bacterias exhiben concentraciones inhibitorias mínimas in vitro (MIC) que están en concentraciones que son alcanzables usando los regímenes de dosificación prescritos. Sin embargo, la significancia clínica de esto es desconocida debido a que no se ha establecido la seguridad y efectividad de la tigeciclina en el tratamiento de infecciones clínicas debido a estas bacterias en estudios clínicos adecuados y bien controlados.
– Bacterias Gram positivas facultativas:
– Enterococcus avium.
– Enterococcus casseliflavus.
– Enterococcus faecalis (cepas aisladas susceptibles a vancomicina).
– Enterococcus faecium (cepas aisladas susceptibles y resistentes a vancomicina).
– Enterococcus gallinarum.
– Listeria monocytogenes.
– Staphylococcus epidermidis (cepas aisladas susceptibles y resistentes a meticilina)
– Staphylococcus haemolyticus.
– Bacterias Gram negativas facultativas:
– Acinetobacter baumannii*.
– Aeromonas hydrophila.
– Citrobacter koseri.
– Enterobacter aerogenes.
– Haemophilus influenzae (resistente a ampicilina).
– Haemophilus parainfluenzae.
– Pasteurella multocida.
– Serratia marcescens.
– Stenotrophomonas maltophilia.
– Bacterias anaeróbicas:
– Bacteroides distasonis.
– Bacteroides ovatus.
– Peptostreptococcus spp.
– Porphyromonas spp.
– Prevotella spp.
– Otras bacterias:
– Mycobacterium abscessus.
– Mycobacterium fortuitum.
* Ha habido reportes del desarrollo de resistencia a la tigeciclina en infecciones por Acinetobacter observada durante el curso del tratamiento estándar. Dicha resistencia parece ser atribuible a un mecanismo de bomba de eflujo de MDR. Aunque monitorear la recaída de la infección es importante para todos los pacientes infectados, se sugiere un monitoreo más frecuente en este caso. Si se sospecha una recaída, deberá obtenerse y cultivarse sangre y otros especímenes para detectar la presencia de bacterias. Todas las cepas aisladas deberán ser identificadas y sometidas a prueba para detectar su susceptibilidad a tigeciclina y otros antimicrobianos apropiados.
• Métodos de prueba de susceptibilidad: Cuando estén disponibles, el laboratorio de microbiología clínica deberá proporcionar los resultados acumulados de la prueba de susceptibilidad in vitro para los fármacos antimicrobianos utilizados en los hospitales locales y áreas de práctica al médico como informes periódicos que describan el perfil de susceptibilidad a patógenos adquiridos en la comunidad y nosocomios. Estos informes deberán ayuda al médico a seleccionar el antimicrobiano más efectivo.
– Técnicas de dilución: Se utilizan métodos cuantitativos para determinar concentraciones inhibitorias antimicrobianas mínimas (MIC). Estas MIC proporcionan estimados de la susceptibilidad de las bacterias a compuestos antimicrobianos. Las MIC deberán ser determinadas usando un procedimiento estandarizado basado en métodos de dilución (caldo, agar o microdilución)1,3,4 o equivalentes usando inoculo y concentraciones de tigeciclina estandarizadas. Para las pruebas de dilución en caldo para organismos aeróbicos, deberán determinarse las MIC en un medio de prueba que sea fresco (<12h). Deberán interpretarse los valores de MIC de acuerdo a los criterios proporcionados en el Cuadro 4.
– Técnicas de difusión: Los métodos cuantitativos que requieren medición de diámetros de zona también proporcionan estimados reproducibles de la susceptibilidad de las bacterias a compuestos antimicrobianos. El procedimiento estandarizado2,4 requiere el uso de concentraciones de inoculo estandarizadas. Este procedimiento utiliza discos de papel impregnados con 15 mcg de tigeciclina para probar la susceptibilidad de las bacterias a tigeciclina. La interpretación involucra correlación del diámetro obtenido en la prueba de disco con la MIC para tigeciclina. Los informes del laboratorio que proporcionen resultados de la prueba estándar de susceptibilidad de disco único deberán interpretarse de acuerdo a los criterios del Cuadro 4.
– Técnicas anaeróbicas: La prueba de susceptibilidad anaeróbica con tigeciclina deberá realizarse mediante el método de dilución en agar3 ya que los parámetros de control de calidad para la dilución en caldo no están establecidos.
Cuadro 4. Criterios de interpretación de resultados de pruebas de susceptibilidad para tigeciclina
|
Concentraciones mínimas inhibitorias (mcg/mL) |
Difusión de disco (diámetros de zona en mm) |
|||||
|
S |
I |
R |
S |
I |
R |
|
|
Staphylococcus aureus (incluyendo cepas aisladas de meticilina) |
≤0.5a |
- |
- |
≤19 |
- |
- |
|
Streptococcus spp. diferente a S. pneumoniae |
≤0,25a |
- |
- |
≤19 |
- |
- |
|
Streptococcus pneumoniae |
≤0,06a |
- |
- |
≤19 |
- |
- |
|
Enterococcus faecalis (cepas aisladas suceptibles a vancomicina) |
≤0.25a |
- |
- |
≤19 |
- |
- |
|
Enterobacteriáceasb |
≤2 |
4 |
≥8 |
≤19 |
15-18 |
≤14 |
|
Haemophilus influenza |
≤0,25a |
- |
- |
≤19 |
- |
- |
|
Anaerobiosc |
≤4 |
8 |
≥16 |
n/a |
n/a |
n/a |
|
a. La actual ausencia de cepas aisladas resistentes excluye definir cualquier resultado que no sea “Susceptible”. Las cepas aisladas que producen resultados MIC que sugieren la categoría “No susceptible” deberán ser enviadas al laboratorio de referencia para más pruebas. b. La tigeciclina ha disminuido la actividad in vitro contra Morganella spp., Proteus spp. y Providencia spp. c. Dilución en agar |
||||||
Un informe de “Susceptible” indica que es probable que el patógeno sea inhibido si el compuesto antimicrobiano alcanza las concentraciones normalmente alcanzables. Un informe de “intermedio” indica que el resultado deberá considerarse equívoco y, si el microorganismo no es totalmente susceptible a fármacos alternativos clínicamente factibles, deberá repetirse la prueba. Esta categoría implica posible aplicabilidad clínica en sitios del cuerpo donde el fármaco está fisiológicamente concentrado o en situaciones donde pueda utilizarse una dosis elevada del fármaco. Esta categoría también proporciona una zona de amortiguación que impide que pequeños factores técnicos no controlados causen discrepancias importantes en la interpretación. Un informe de “Resistente” indica que no es probable que el patógeno sea inhibido si el compuesto antimicrobiano alcanza las concentraciones usualmente alcanzables; deberá seleccionarse otro tratamiento.
• Control de calidad: Al igual que con otras técnicas de susceptibilidad, se requiere el uso de microorganismos de control de laboratorio para controlar los aspectos técnicos de los procedimientos estandarizados de laboratorio1,2,3,4. El polvo de tigeciclina estándar deberá proporcionar los valores MIC proporcionados en el Cuadro 5. Para la técnica de difusión que utiliza el disco de tigeciclina de 15 mcg deberá alcanzarse los criterios proporcionados en el Cuadro 5.
Cuadro 5. Rangos de control de calidad aceptables para la prueba de susceptibilidad
|
Organismo QC |
Concentraciones mínimas inhibitorias (mcg/mL) |
Difusión de disco (diámetros de zona en mm) |
|
Staphylococcus aureus |
No aplicable |
20-25 |
|
Staphylococcus aureus |
0,03-0,25 |
No aplicable |
|
Escherichia coli ATCC 25922 |
0,03-0,25 |
20-27 |
|
Enterococcus faecalis |
0,03-0,12 |
No aplicable |
|
Streptococcus pneumoniae |
0,016-0,12 |
23-29 |
|
Haemophilus influenzae ATCC 49247 |
0,06-0,5 |
23-31 |
|
Bacteroides fragilisa |
0,12-1 |
No aplicable |
|
Bacteroides thetaiotaomicrona ATCC 29741 |
0,5-2 |
No aplicable |
|
Eubacterium lentuma ATCC 43055 |
0,06-0,5 |
No aplicable |
|
Clostridium difficilea ATCC 70057 |
0,12-1 |
No aplicable |
|
ATCC = American Type Culture Collection a. Dilución en agar |
||
FORMA DE PRESENTACIÓN: Caja de cartón conteniendo 1, 5, y 10 viales de vidrio tipo I incoloro conteniendo 50 mg de Polvo liofilizado para solución inyectable.
Recurrir a su médico o farmacéutico, para cualquier aclaración sobre la utilización del producto.
Importado por:
PFIZER S.A.
Av. Javier Prado Este 6230, 2do piso
Lima 12 - Perú
Teléfono: 615-2100, Fax: 615-2106
LLD basado en USPI (20Dec2012)V3.
ALMACENAMIENTO Y VIDA ÚTIL: La tigeciclina debe almacenarse a una temperatura igual o por debajo de 30 °C antes de su reconstitución. La solución reconstituida debe ser transferida posteriormente y diluida para la infusión I.V. Después de reconstituido conservar a una temperatura no mayor a 30 °C hasta por 6 horas. No congelar.
Tiempo de vida útil: 24 meses. No utilizar el producto al sobrepasar la fecha de expira.