
SYMBICORT TURBUHALER
BUDESONIDA, FORMOTEROL
Polvo para inhalación
1 Frasco(s), 1 Inhalador de polvo, 320 /9 µg
COMPOSICIÓN
Cada dosis administrada (es decir, la dosis que sale de la boquilla) contiene 320 microgramos de budesonida y 9 microgramos de fumarato de formoterol dihidratado por inhalación.
SYMBICORT TURBUHALER (320/9 microgramos por inhalación) suministra la misma cantidad de budesonida y formoterol que los productos individuales respectivos en TURBUHALER, es decir, 400 microgramos de budesonida por inhalación (dosis medida) y 12 microgramos de formoterol por inhalación (dosis medida); esta última dosis también puede indicarse de la siguiente manera: 9 microgramos por inhalación (dosis administrada).
LISTA DE EXCIPIENTES
Lactosa monohidratada (que contiene proteínas lácteas).
INDICACIONES TERAPÉUTICAS
Asma: SYMBICORT TURBUHALER está indicado para el tratamiento regular del asma, cuando es conveniente utilizar una combinación (un corticosteroide y un agonista beta2 de acción prolongada inhalados) en:
• Pacientes que no han logrado un control adecuado con corticosteroides inhalados y agonistas beta2 de acción corta inhalados “según las necesidades”
o
• Pacientes que han logrado un control adecuado con corticosteroides y agonistas beta2 de acción prolongada inhalados.
Enfermedad pulmonar obstructiva crónica (EPOC): Tratamiento sintomático de pacientes con EPOC severa (VEF1 <50% del valor normal previsto) y antecedentes de exacerbaciones repetidas, que presentan síntomas significativos pese a un tratamiento regular con broncodilatadores de acción prolongada.
PROPIEDADES FARMACOCINÉTICAS
Absorción: Se ha demostrado que SYMBICORT TURBUHALER y los productos individuales correspondientes son bioequivalentes con respecto a la exposición sistémica a la budesonida y al formoterol, respectivamente. Aún así, en comparación con los productos individuales, después de la administración de SYMBICORT TURBUHALER se observó un pequeño aumento de la supresión de cortisol. Se consideró que esta diferencia no afecta la seguridad clínica.
No se detectaron indicios de interacciones farmacocinéticas entre la budesonida y el formoterol.
Los parámetros farmacocinéticos de la budesonida y el formoterol fueron comparables después de administrar estos medicamentos solos y combinados en forma de SYMBICORT TURBUHALER. En el caso de la budesonida, el área bajo la curva de la concentración plasmática fue ligeramente mayor y la velocidad de absorción y la concentración plasmática máxima fueron mayores después de la administración de la combinación fija. Por su parte, la concentración plasmática máxima del formoterol fue similar después de la administración de la combinación fija. La budesonida inhalada se absorbe rápidamente y la concentración plasmática máxima se alcanza en los 30 minutos siguientes a la inhalación. En los estudios, la cantidad media de budesonida depositada en los pulmones después de la inhalación con el TURBUHALER fluctuó entre el 32 y el 44% de la dosis administrada. La biodisponibilidad sistémica es de alrededor del 49% de la dosis administrada.
El formoterol inhalado se absorbe rápidamente y la concentración plasmática máxima se alcanza en los 10 minutos siguientes a la inhalación. En los estudios, la cantidad media de formoterol depositada en los pulmones después de la inhalación con el TURBUHALER fluctuó entre el 28 y el 49% de la dosis administrada. La biodisponibilidad sistémica es de alrededor del 61% de la dosis administrada.
Distribución y metabolismo: La unión a las proteínas plasmáticas representa aproximadamente un 50% en el caso del formoterol y un 90% en el caso de la budesonida. El volumen de distribución es de alrededor de 4 litros/kg para el formoterol, y de 3 litros/kg para la budesonida. El formoterol es inactivado mediante reacciones de conjugación (se forman metabolitos activos O-desmetilado y desformilado, que se detectan principalmente en forma de conjugados inactivados). La budesonida es objeto de una extensa biotransformación hepática de primer paso (aproximadamente, el 90%), convirtiéndose en metabolitos con una baja actividad glucocorticosteroide. La actividad glucocorticosteroide de los principales metabolitos, la 6 beta-hidroxi-budesonida y la 16-alfa-hidroxi-prednisolona, es inferior al 1% de la actividad de la budesonida. No existen indicaciones de interacciones metabólicas o de reacciones de desplazamiento entre el formoterol y la budesonida.
Eliminación: La mayor parte de la dosis de formoterol se transforma por metabolismo hepático, seguida por una eliminación renal. Después de la inhalación, del 8 al 13% de la dosis de formoterol administrada se elimina en la orina sin metabolizarse. El formoterol presenta una alta depuración sistémica (aproximadamente 1,4 litros/min) y su vida media de eliminación terminal es de 17 horas en promedio.
La budesonida se elimina por metabolismo, siendo catalizada principalmente por la enzima CYP3A4. Los metabolitos de la budesonida se eliminan en la orina en forma intacta o conjugada. Sólo se han detectado cantidades insignificantes de budesonida intacta en la orina. La budesonida muestra una alta depuración sistémica (aproximadamente 1,2 litros/min) y su vida media de eliminación plasmática después de la administración intravenosa es de 4 horas en promedio.
Se desconoce la farmacocinética de la budesonida y del formoterol en niños y en pacientes con insuficiencia renal. La concentración de budesonida y formoterol podría aumentar en los pacientes con insuficiencia hepática.
PROPIEDADES FARMACODINÁMICAS
Grupo farmacoterapéutico: Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias.
Código ATC: R03AK07
Mecanismos de acción y efectos farmacodinámicos: SYMBICORT contiene formoterol y budesonida, los cuales tienen distintos mecanismos de acción y ejercen efectos aditivos de reducción de las exacerbaciones del asma. A continuación se presentan los mecanismos de acción de estos dos principios activos.
Budesonida: La budesonida es un glucocorticosteroide que, al administrarse por inhalación, ejerce efectos antiinflamatorios en función de la dosis en las vías respiratorias, provocando una reducción de los síntomas y de las exacerbaciones del asma. La budesonida inhalada tiene efectos adversos menos graves que los corticosteroides sistémicos. Se desconoce el mecanismo exacto responsable del efecto antiinflamatorio de los glucocorticosteroides.
Formoterol: El formoterol es un agonista selectivo de los adrenoceptores beta2 que, al administrarse por inhalación, produce una relajación rápida y prolongada del músculo liso bronquial de los pacientes con obstrucción reversible de las vías respiratorias. El efecto broncodilatador depende de la dosis, tarda de 1 a 3 minutos en manifestarse y tiene una duración de 12 horas después de la administración de una dosis única.
SYMBICORT TURBUHALER:
• Asma: Los estudios clínicos realizados en adultos han demostrado que la adición del formoterol a la budesonida mejoró los síntomas asmáticos y la función pulmonar y redujo las exacerbaciones. En dos estudios de 12 semanas, el efecto de SYMBICORT en la función pulmonar fue equivalente al de la combinación libre de budesonida y formoterol, y superior al de la budesonida sola. Todos los grupos de tratamiento utilizaron agonistas beta2 de acción corta, según las necesidades. No se observaron signos de atenuación del efecto antiasmático con el tiempo.
En un estudio pediátrico de 12 semanas, 85 niños de 6 a 11 años recibieron dosis de mantenimiento de SYMBICORT TURBUHALER (2 inhalaciones de 80/4,5 microgramos por inhalación dos veces al día) y un agonista beta2 de acción corta según las necesidades. Se observó una mejoría de la función pulmonar y el tratamiento fue bien tolerado con respecto a la dosis correspondiente de budesonida TURBUHALER.
• EPOC: Dos estudios de 12 meses evaluaron el efecto sobre la función pulmonar y la frecuencia de exacerbaciones (definidas como la necesidad de recibir un tratamiento con esteroides orales y/o con antibióticos y/o la hospitalización) en pacientes con EPOC severa. La mediana del VEF1 en el momento de la admisión en los estudios fue del 36% del valor normal previsto. La media del número de exacerbaciones al año (según la definición anterior) disminuyó de manera significativa con SYMBICORT con respecto al tratamiento con formoterol solo o con un placebo (frecuencia media de 1,4 contra 1,8-1,9 en los grupos de placebo/formoterol). La media del número de días de tratamiento con corticosteroides orales por paciente durante el periodo de 12 meses disminuyó ligeramente en el grupo de SYMBICORT (7-8 días por paciente y por año contra 11-12 y 9-12 días en los grupos del placebo y del formoterol, respectivamente). En cuanto a los cambios de los parámetros de la función pulmonar como el VEF1, SYMBICORT no fue superior al formoterol solo.
CONTRAINDICACIONES
Hipersensibilidad (alergia) a la budesonida, al formoterol o a la lactosa inhalada.
EMBARAZO Y LACTANCIA
No se dispone de información clínica sobre la exposición de SYMBICORT durante el embarazo, o al tratamiento concomitante con formoterol y budesonida. No se han realizado estudios en animales sobre la toxicidad de la combinación en la reproducción.
No existe información adecuada sobre el uso del formoterol en mujeres embarazadas. En los estudios en animales, el formoterol provocó efectos adversos en la reproducción con exposiciones sistémicas muy altas (ver Información preclínica sobre la seguridad).
Los datos sobre la exposición de aproximadamente 2000 animales durante la gestación indican que con la budesonida inhalada no aumenta el riesgo de teratogenicidad. En los estudios en animales se ha demostrado que los glucocorticosteroides provocan malformaciones (ver Información preclínica sobre la seguridad). Es improbable que esto tenga alguna implicación en las mujeres que reciben las dosis recomendadas.
Los estudios en animales también han indicado que el exceso de glucocorticoides durante el periodo prenatal aumenta el riesgo de retraso del crecimiento intrauterino, enfermedad cardiovascular a la edad adulta y alteraciones permanentes de la densidad de los receptores de glucocorticoides, así como de la renovación y del comportamiento de los neurotransmisores, con exposiciones inferiores a las dosis teratogénicas.
Durante el embarazo, SYMBICORT debe utilizarse únicamente cuando los beneficios superen los riesgos potenciales. Debe administrarse la mínima dosis eficaz de budesonida que mantenga un control adecuado del asma.
No se sabe si el formoterol o la budesonida se secretan en la leche materna humana. En ratas, se han detectado pequeñas cantidades de formoterol en la leche materna. La administración de SYMBICORT durante la lactancia sólo debe considerarse si el beneficio esperado para la madre es mayor que los posibles riesgos para el lactante.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS
SYMBICORT no afecta, o sólo de manera insignificante, la capacidad para conducir y utilizar máquinas.
EFECTOS INDESEABLES
Ya que SYMBICORT TURBUHALER contiene tanto budesonida como formoterol, su perfil de efectos indeseables corresponderá al de cada una de estas sustancias individuales. No se ha observado un aumento de la incidencia de reacciones adversas después de la administración concomitante de los dos compuestos. Las reacciones adversas más comunes al medicamento consisten en los efectos secundarios previsibles en vista de la farmacología de los agonistas beta2, tales como temblor y palpitaciones; estos tienden a ser leves y normalmente desaparecen después de unos cuantos días de tratamiento. En un estudio clínico de 3 años sobre la budesonida en la EPOC se observaron equimosis y neumonía con frecuencias del 10% y 6%, respectivamente, contra el 4% y el 3% en el grupo placebo (p < 0,001 y p < 0,01, respectivamente).
A continuación figuran las reacciones adversas que se han observado con la budesonida o el formoterol, clasificadas por sistema orgánico y por frecuencia. Las categorías de frecuencia se definen de la siguiente manera: muy frecuentes (≥1/10), frecuentes (≥1/100 y <1/10), poco frecuentes (≥1/1000 y <1/100), raras (≥1/10 000 y <1/1000) y muy raras (<1/10 000).
|
Trastornos cardiacos |
|
|
Frecuentes |
Palpitaciones |
|
Poco frecuentes |
Taquicardia |
|
Raros |
Fibrilación auricular, taquicardia supraventricular, extrasístoles |
|
Muy raros |
Angina de pecho |
|
Trastornos endocrinos |
|
|
Muy raros |
Signos o síntomas de efectos sistémicos de los glucocorticosteroides (lo cual incluye hipofunción suprarrenal) |
|
Trastornos gastrointestinales |
|
|
Poco frecuentes |
Náuseas |
|
Trastornos del sistema inmunológico |
|
|
Raros |
Exantema, urticaria, prurito, dermatitis, angioedema |
|
Infecciones e infestaciones |
|
|
Frecuentes |
Candidiasis orofaríngea |
|
Trastornos del metabolismo y de la nutrición |
|
|
Raros |
Hipopotasemia |
|
Muy raros |
Hiperglucemia |
|
Trastornos musculoesqueléticos, del tejido conjuntivo y de los huesos |
|
|
Poco frecuentes |
Calambres musculares |
|
Trastornos del sistema nervioso |
|
|
Frecuentes |
Cefalea, temblor |
|
Poco frecuentes |
Mareo |
|
Muy raros |
Disgeusia |
|
Trastornos psiquiátricos |
|
|
Poco frecuentes |
Agitación, inquietud, nerviosismo, trastornos del sueño |
|
Muy raros |
Depresión, trastornos del comportamiento (sobre todo en niños) |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Frecuentes |
Irritación leve de la garganta, tos, ronquera |
|
Raros |
Broncospasmo |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Poco frecuentes |
Equimosis |
|
Trastornos vasculares |
|
|
Muy raros |
Variaciones de la presión arterial |
Como con otros tratamientos inhalados, en casos muy raros puede presentarse broncospasmo paradójico (ver Advertencias y precauciones especiales de uso).
Pueden presentarse efectos sistémicos característicos de los corticosteroides inhalados, sobre todo con la administración de dosis altas durante periodos prolongados. Estos efectos pueden incluir supresión suprarrenal, retraso del crecimiento de niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma (ver Advertencias y precauciones especiales de uso).
El tratamiento con agonistas beta2 puede provocar un aumento de las concentraciones sanguíneas de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
INCOMPATIBILIDADES
No procede.
INTERACCIONES
Las sustancias metabolizadas por la enzima 3A4 del citocromo P450 (p. ej., el itraconazol y el ritonavir) impiden la transformación metabólica de la budesonida. La coadministración de estos potentes inhibidores de la CYP3A4 puede elevar las concentraciones plasmáticas de budesonida. Debe evitarse el uso concomitante de estos medicamentos a menos que el beneficio esperado compense el aumento del riesgo de efectos adversos sistémicos.
Los bloqueadores beta-adrenérgicos pueden atenuar o inhibir el efecto del formoterol. Por lo tanto, SYMBICORT no debe administrarse junto con bloqueadores beta-adrenérgicos (lo cual incluye los colirios), a menos que sea indispensable.
El tratamiento concomitante con quinidina, disopiramida, procainamida, fenotiazinas, antihistamínicos (terfenadina), inhibidores de la monoaminooxidasa y antidepresivos tricíclicos, puede prolongar el intervalo QTc y elevar el riesgo de arritmias ventriculares.
Por otro lado, la L-dopa, la L-tiroxina, la oxitocina y el alcohol pueden reducir la tolerancia cardiaca a los simpaticomiméticos beta2.
El tratamiento concomitante con inhibidores de la monoaminooxidasa, lo cual incluye a los medicamentos que poseen propiedades similares, como la furazolidona y la procarbazina, puede precipitar reacciones hipertensivas.
Existe un mayor riesgo de arritmias en pacientes que reciben una anestesia concomitante con hidrocarburos halogenados.
El uso concomitante de otros medicamentos beta-adrenérgicos podría producir un efecto aditivo.
La hipopotasemia puede aumentar la predisposición a las arritmias en los pacientes tratados con glucósidos digitálicos.
No se han observado otras interacciones de la budesonida con medicamentos utilizados para el tratamiento del asma.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO
Se recomienda disminuir paulatinamente la dosis al suspender el tratamiento, ya que no debe cesarse abruptamente su administración.
Si el paciente considera que el tratamiento es ineficaz o rebasa la dosis recomendada máxima de SYMBICORT, debe buscar atención médica (ver Posología y forma de administración). Un aumento del uso de broncodilatadores de rescate significa que ha empeorado la enfermedad subyacente y que debe evaluarse nuevamente el tratamiento antiasmático. El deterioro repentino y progresivo del control del asma o de la EPOC puede ser fatal, por lo que el paciente debe someterse urgentemente a una evaluación médica. En este caso debe considerarse la necesidad de aumentar la dosis de corticosteroides; por ejemplo, podría prescribirse un tratamiento con corticosteroides orales o uno con antibióticos si existe una infección.
Se debe advertir a los pacientes que deben tener siempre al alcance de la mano su inhalador de rescate,
Debe recordarse a los pacientes que deben tomar sus dosis de mantenimiento de SYMBICORT aunque no tengan síntomas.
El tratamiento con SYMBICORT no debe empezarse durante una exacerbación.
Al igual que con otros tratamientos inhalados, puede presentarse un broncospasmo paradójico, con un aumento inmediato del jadeo después de la administración. En este caso debe suspenderse la administración de SYMBICORT y el tratamiento debe evaluarse nuevamente, prescribiendo uno diferente si es necesario.
Pueden ocurrir efectos sistémicos con cualquier corticosteroide inhalado, en particular cuando se prescriben dosis altas durante periodos prolongados. Estos efectos son mucho menos probables con el tratamiento inhalado que con los corticosteroides orales. Los efectos sistémicos pueden consistir en supresión suprarrenal, retraso del crecimiento en los niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma.
Se recomienda medir regularmente la estatura de los niños que reciben un tratamiento prolongado con corticosteroides inhalados. Si se observa un retraso del crecimiento, debe evaluarse nuevamente el tratamiento con el objetivo de reducir la dosis del corticosteroide inhalado. Los beneficios del tratamiento con corticosteroides deben sopesarse detenidamente con respecto a los posibles riesgos de supresión del crecimiento. Además, debe considerarse la posibilidad de dirigir al paciente con un pediatra neumólogo.
La información limitada proveniente de estudios a largo plazo sugiere que la mayoría de los niños y adolescentes tratados con la budesonida inhalada alcanzan finalmente la estatura prevista a la edad adulta. Sin embargo, se ha observado una pequeña disminución inicial y transitoria del crecimiento (de, aproximadamente, 1 cm), normalmente durante el primer año de tratamiento.
Deben tomarse en cuenta los efectos potenciales en la densidad ósea, sobre todo en los pacientes con factores de riesgo de osteoporosis coexistentes que reciben dosis altas durante periodos prolongados. Los estudios a largo plazo con dosis diarias medias de budesonida inhalada de 400 microgramos (dosis medida) en niños o con dosis diarias de 800 microgramos (dosis medida) en adultos no han revelado efectos significativos en la densidad mineral ósea. Se carece de información sobre el efecto de dosis mayores de SYMBICORT.
Si se sospecha de una alteración de la función suprarrenal a raíz de un tratamiento previo con esteroides sistémicos, debe tenerse cuidado al momento de cambiar al paciente a un tratamiento con SYMBICORT.
El tratamiento inhalado con la budesonida normalmente minimizará la necesidad de esteroides orales, pero en los pacientes que cambian de esteroides orales a SYMBICORT podría persistir el riesgo de alteración de las reservas suprarrenales durante un tiempo considerable. También existe este riesgo en los pacientes que han requerido en el pasado un tratamiento urgente con dosis altas de corticosteroides o un tratamiento prolongado con dosis altas de corticosteroides inhalados. Debe considerarse la posibilidad de brindar una protección adicional con corticosteroides sistémicos durante los periodos de estrés o antes de una cirugía programada.
A fin de minimizar el riesgo de candidiasis orofaríngea, debe indicarse al paciente que se enjuague la boca con agua después de inhalar la dosis de mantenimiento.
Debe evitarse el tratamiento concomitante con el itraconazol y el ritonavir u otros potentes inhibidores de la enzima CYP3A4 (ver Interacciones). Si esto es imposible, el intervalo entre la administración de los productos que provocan interacciones medicamentosas debe ser lo más largo posible.
Se recomienda administrar SYMBICORT con precaución en los pacientes con tirotoxicosis, feocromocitoma, diabetes mellitus, hipopotasemia no tratada, miocardiopatía obstructiva hipertrófica, estenosis aórtica subvalvular idiopática, hipertensión severa, aneurismas u otros trastornos cardiovasculares graves, tales como cardiopatía isquémica, taquiarritmias o insuficiencia cardiaca severa.
Debe tenerse precaución al tratar a pacientes con una prolongación del intervalo QTc. El formoterol en sí puede prolongar el intervalo QTc.
En los pacientes con tuberculosis pulmonar activa o silenciosa, o con infecciones micóticas o virales de las vías respiratorias, debe evaluarse nuevamente la necesidad de administrar corticosteroides inhalados, así como la dosis de los mismos.
El tratamiento con altas dosis de agonistas beta2 puede provocar una hipopotasemia que puede ser grave. El tratamiento concomitante con medicamentos que pueden inducir hipopotasemia o potenciar un efecto hipopotasémico, como por ejemplo derivados xantínicos, esteroides y diuréticos, puede intensificar el posible efecto hipopotasémico del agonista beta2. Se recomienda una precaución especial en el asma inestable asociada con una utilización variable de broncodilatadores de rescate, así como en el asma aguda severa, ya que el riesgo puede aumentar debido a la hipoxia o a otras afecciones que pueden incrementar la probabilidad de efectos adversos relacionados con la hipopotasemia. En tales circunstancias, se recomienda vigilar las concentraciones séricas de potasio.
Como con todos los agonistas beta2, se recomienda efectuar verificaciones complementarias de la glucosa sanguínea en los pacientes diabéticos.
SYMBICORT TURBUHALER contiene lactosa (< 1 mg por inhalación). Normalmente, esta cantidad no provoca problemas en los pacientes que sufren de intolerancia a la lactosa.
INSTRUCCIONES DE USO Y MANIPULACIÓN
Lea detenidamente las instrucciones completas antes de empezar el tratamiento.
El TURBUHALER es un inhalador multidosis que permite administrar cantidades muy pequeñas de polvo (Figura 1). Cuando Ud. inspira por el inhalador TURBUHALER, el polvo llega a los pulmones; por lo tanto, es muy importante inhalar enérgica y profundamente por la boquilla.

Figura 1
Preparación de un nuevo inhalador
El inhalador TURBUHALER debe prepararse antes de utilizarlo por primera vez.
1. Destornille y retire la tapa; escuchará un traqueteo al destornillarla.
2. Sostenga el inhalador en forma vertical, con la rueda dosificadora roja hacia abajo (Figura 2). No sostenga la boquilla mientras gira la rueda. Gire la rueda hasta el tope hacia un lado y luego hacia el otro, empezando en cualquier sentido. Durante esta operación escuchará un “clic”. Efectúe esta operación dos veces.
El inhalador ya está listo para usarse y usted ya no tiene que repetir este procedimiento. Para administrar una dosis, siga las instrucciones que aparecen a continuación:
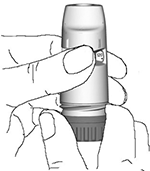
Figura 2
Modo de empleo de SYMBICORT TURBUHALER
Para administrar una dosis, siga las instrucciones a continuación:
1. Destornille y retire la tapa; escuchará un traqueteo al destornillarla.
2. Sostenga el inhalador en forma vertical, con la rueda dosificadora roja hacia abajo (Figura 2). No sostenga la boquilla mientras gira la rueda. Para cargar una dosis en el inhalador, gire la rueda hasta el tope hacia un lado y luego hacia el otro, empezando en cualquier sentido. Durante esta operación escuchará un “clic”.
3. Espire, pero no por la boquilla.
4. Ponga suavemente la boquilla entre sus dientes, cierre los labios e inspire enérgica y profundamente por la boca (Figura 3). No mastique ni muerda la boquilla.
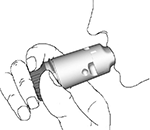
Figura 3
5. Antes de espirar, retire el inhalador de su boca.
6. Si le prescribieron varias inhalaciones, repita los pasos 2 a 5.
7. Coloque nuevamente la tapa y ciérrela bien.
8. Enjuáguese la boca con agua después de las dosis de la mañana y de la noche, sin deglutirla.
Nota: No intente retirar la boquilla ya que está unida al inhalador. Es posible dar vuelta a la boquilla, pero evite torcerla innecesariamente.
Ya que la cantidad de polvo administrada es muy pequeña, quizás no logre percibir su sabor después de la inhalación. Sin embargo, aun así, si siguió las instrucciones puede estar seguro de haber inhalado la dosis.
Si por error efectúa más de una vez el procedimiento de carga antes de administrar la dosis, recibirá de todas formas una sola dosis. En cambio, el indicador de dosis contará todas las dosis cargadas.
El ruido que se escucha al agitar el inhalador no proviene del medicamento sino de un deshidratante.
¿Cuándo debo cambiar el inhalador?
El indicador de dosis (Figura 4) marca aproximadamente cuántas dosis quedan en el inhalador, empezando desde el número 60 o 120 cuando está lleno.

Figura 4
El indicador está graduado en intervalos de 10 dosis, por lo que no muestra la carga de cada dosis individual.
Puede estar seguro de que el TURBUHALER ha suministrado la dosis, aunque no observe ningún movimiento en el indicador de dosis.
El indicador señala con un fondo rojo las últimas 10 dosis. Cuando el cero llegue al centro de la ventanilla (Figura 5), deseche el inhalador.

Figura 5
Nótese que, aunque el indicador de dosis marque cero, podrá seguir girando la rueda dosificadora. Sin embargo, el indicador ya no se moverá y el cero quedará en la ventanilla.
Limpieza: Limpie la boquilla por fuera regularmente (una vez a la semana) con un paño seco. No use agua ni otro líquido para limpiar la boquilla.
Cómo desechar el inhalador: Asegúrese de desechar el inhalador TURBUHALER usado de manera responsable/siguiendo el procedimiento recomendado, ya que quedará un poco de medicamento en el interior. Pregunte a su farmacéutico cómo hacerlo.
AstraZeneca AB, Södertälje, Suecia
SYMBICORT y TURBUHALER son marcas registradas del grupo Astra Zeneca
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
Asma
SYMBICORT TURBUHALER no está indicado para el tratamiento inicial del asma. La dosis de cada uno de los componentes de SYMBICORT debe individualizarse y ajustarse en función de la intensidad del asma. Esto debe tomarse en cuenta no sólo al iniciar un tratamiento combinado sino también al ajustar la dosis de mantenimiento. Si un paciente determinado requiere una combinación de dosis que no existe en forma de un inhalador combinado, deben prescribirse dosis adecuadas de agonistas beta2 y/o de corticosteroides en inhaladores individuales.
• Dosis recomendadas:
– Adultos (mayores de 18 años): 1 inhalación dos veces al día. Algunos pacientes pueden necesitar hasta un máximo de 2 inhalaciones dos veces al día.
– Adolescentes (de 12 a 17 años): 1 inhalación dos veces al día.
Un médico o profesional sanitario debe evaluar regularmente a los pacientes para mantener una dosis óptima de SYMBICORT. La dosis debe ajustarse al nivel mínimo que permita mantener un control eficaz de los síntomas. Una vez que se haya logrado mantener un buen control de los síntomas con la mínima dosis recomendada, la siguiente etapa puede consistir en intentar una monoterapia con un corticosteroide inhalado.
En la práctica normal, una vez que se hayan controlado los síntomas con el régimen de administración de dos veces al día, puede considerarse la administración de SYMBICORT una vez al día para ajustar el tratamiento a la dosis mínima eficaz, si el médico considera que se necesita un broncodilatador de acción prolongada para mantener el control.
• Niños menores de 12 años: No se han investigado perfectamente la eficacia y la seguridad en niños (ver Propiedades farmacodinámicas). No se recomienda usar SYMBICORT 320/9 microgramos/inhalación en niños menores de 12 años.
SYMBICORT 320/9 microgramos/inhalación debe usarse únicamente como tratamiento de mantenimiento. Existen dosis más bajas para el tratamiento de mantenimiento y de alivio con SYMBICORT.
EPOC
• Dosis recomendadas:
– Adultos: 1 inhalación dos veces al día.
SOBREDOSIS
Una sobredosis de formoterol provocará probablemente los efectos característicos de los agonistas adrenérgicos beta2 tales como temblor, cefalea y palpitaciones. En casos aislados se han observado taquicardia, hiperglucemia, hipopotasemia, prolongación del intervalo QTc, arritmia, náuseas y vómito. Puede estar indicado un tratamiento de apoyo y sintomático. La administración durante tres horas de una dosis de 90 microgramos a pacientes con obstrucción bronquial aguda no planteó problemas de seguridad.
No se prevé que una sobredosis aguda de budesonida, incluso con dosis excesivas, representará un problema clínico. Cuando se utilizan dosis excesivas de manera crónica, pueden aparecer efectos glucocorticosteroides sistémicos, tales como hipercortisolismo y supresión suprarrenal.
Si es necesario suspender el tratamiento con SYMBICORT a raíz de una sobredosis de formoterol, debe considerarse la administración de un tratamiento adecuado con corticosteroides inhalados.
INFORMACIÓN PRECLÍNICA SOBRE LA SEGURIDAD
La toxicidad observada en los estudios con animales sobre la budesonida y el formoterol administrados en combinación y separados consistió en efectos relacionados con una exageración de la actividad farmacológica.
Los estudios sobre la reproducción animal han demostrado que los corticosteroides como la budesonida provocan malformaciones (paladar hendido, malformaciones del esqueleto); sin embargo, los resultados de estos experimentos en animales no parecen ser relevantes para el ser humano al utilizar las dosis recomendadas. Los estudios sobre el formoterol en la reproducción animal han demostrado una ligera disminución de la fecundidad en ratas machos con altas exposiciones sistémicas, así como pérdidas de implantaciones y disminución del peso al nacer y de la supervivencia posnatal inicial con exposiciones sistémicas considerablemente mayores que las que se alcanzan durante la utilización clínica. Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para el ser humano.
INFORMACIÓN GENERAL
Grupos de pacientes especiales: No se requieren ajustes especiales de la dosis en los pacientes de edad avanzada. No se dispone de información sobre el uso de SYMBICORT en pacientes con insuficiencia renal o hepática. Dado que la budesonida y el formoterol se eliminan principalmente por metabolismo hepático, puede preverse un aumento de la exposición en los pacientes con cirrosis hepática severa.
Instrucciones para utilizar correctamente el TURBUHALER: El medicamento suministrado por el dispositivo TURBUHALER es transportado por el flujo inspiratorio, es decir que cuando el paciente inhala por la boquilla, la sustancia llega a las vías respiratorias junto con el aire inspirado.
Nota: Es importante señalar al paciente que:
• Debe leer cuidadosamente las instrucciones de uso y manipulación que se encuentran al final de este prospecto.
• Debe inspirar con fuerza y profundamente por la boquilla de manera que una dosis óptima llegue a los pulmones.
• Nunca debe espirar por la boquilla.
• Debe enjuagarse la boca con agua después de inhalar la dosis de mantenimiento a fin de minimizar el riesgo de aftas orofaríngeas.
Es posible que el paciente no perciba el sabor ni sienta el medicamento al utilizar el TURBUHALER debido a la pequeña cantidad de medicamento administrada.
TAMAÑO DEL ENVASE
Véase el envase externo.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN
No se conserve a una temperatura superior a 30 ºC. Conservar el envase bien cerrado.
PLAZO DE CADUCIDAD
Véase la fecha de caducidad en la caja de cartón.