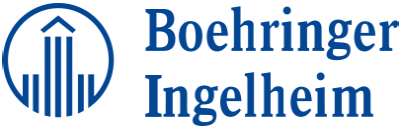
STRIVERDI RESPIMAT
OLODATEROL
Solución para inhalación
Inhalador , Solución para inhalación , 5 µg
COMPOSICIÓN
Cada dosis contiene:
Clorhidrato de olodaterol (Olodaterol) 5 µg (2 puffs es una dosis medicinal)
Excipientes: (Solución de cloruro de benzalconio,edetato disódico, ácido cítrico anhidro y agua purificada ) c.s.p.
FORMA FARMACÉUTICA: Solución para inhalación.
VIDA ÚTIL EN USO: 3 meses.
INDICACIONES TERAPÉUTICAS: STRIVERDI RESPIMAT® está indicado como tratamiento broncodilatador de mantenimiento para pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
INSTRUCCIONES DE USO Y MANIPULACIÓN PARA EL PACIENTE
Inhalador STRIVERDI RESPIMAT® y cartucho STRIVERDI RESPIMAT®
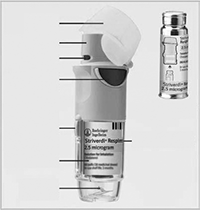
1) Inserción del cartucho
Antes de usar el dispositivo por primera vez, debe seguir los 6 pasos siguientes.
1. Con la tapa amarilla (A) cerrada, presione el cierre de seguridad (E) y retire la base transparente (G)
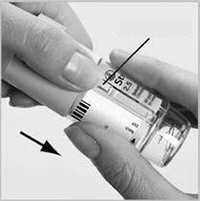
2a. Retire el cartucho (H) de la caja. Inserte el extremo más angosto del cartucho en el inhalador hasta que haga clic, lo que indica de que está correctamente colocado.
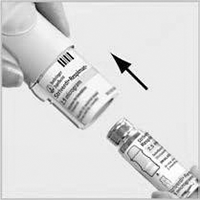
2b. Presione con firmeza el cartucho contra una superficie dura para comprobar que haya entrado totalmente.
El cartucho no quedará oculto por el inhalador, y quedará visible el anillo plateado del extremo inferior (del cartucho).
Una vez que haya introducido el cartucho en el inhalador, no lo retire.
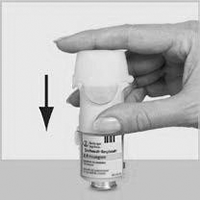
3. Coloque nuevamente la base transparente (G).
Una vez que haya colocado la base transparente, no la retire.
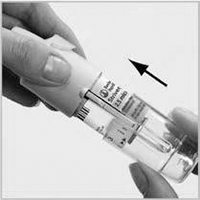
2) Preparación del inhalador STRIVERDI RESPIMAT® para usarlo por primera vez
4. Sostenga el inhalador STRIVERDI RESPIMAT® en posición vertical, con la tapa amarilla (A) cerrada. Gire la base (G) en el sentido de las flechas negras de la etiqueta hasta que haga clic (media vuelta).

5. Abra la tapa amarilla (A) completamente.
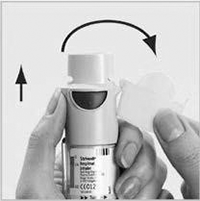
6. Apunte el inhalador STRIVERDI RESPIMAT® al suelo. Presione el botón de liberación de dosis (D). Cierre la tapa amarilla (A).

Repita los pasos 4, 5 y 6 hasta que aparezca una nube.
Repita los pasos 4, 5 y 6 tres veces más para comprobar que el inha- lador esté listo para usar.
El inhalador STRIVERDI RESPIMAT® ahora está listo para usar.
Estos pasos no afectarán el número de dosis disponibles. Una vez pre- parado, el inhalador STRIVERDI RESPIMAT® podrá suministrar 60 pulsaciones (30 dosis).
Uso diario del inhalador STRIVERDI RESPIMAT®
Puede usar el inhalador SOLAMENTE UNA VEZ POR DÍA.
Cada vez que lo use, inhale DOS PULSACIONES.
I. Sostenga el inhalador STRIVERDI RESPIMAT® en posición vertical, con la tapa amarilla (A) cerrada para evitar la liberación accidental de la dosis.
Gire la base (G) en el sentido de las flechas negras de la etiqueta hasta que haga clic (media vuelta).

II. Abra la tapa amarilla (A) completamente. Exhale lenta y profundamente, coloque los labios alrededor del extremo de la boquilla sin cubrir los orificios de ventilación (C). Apunte el inhalador STRIVERDI RESPIMAT® hacia la parte posterior de la garganta.
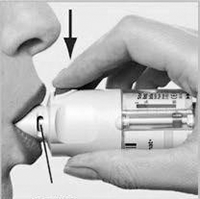
Mientras inhala lenta y profundamente por la boca, presione el botón de liberación de dosis (D) y continúe inhalando en forma lenta durante todo el tiempo que pueda. Contenga la respiración 10 segundos o todo el tiempo que pueda sin sentir molestia.
III. Repita los pasos I y II para recibir la dosis completa.
Puede usar el inhalador SOLAMENTE UNA VEZ POR DÍA. Coloque la tapa y manténgala cerrada hasta que vuelva a usar el inhalador STRIVERDI RESPIMAT®.
Si no lo usa durante más de 7 días, antes de volver a usarlo descargue una pulsación apuntando al suelo. Si no lo usa durante más de 21 días, repita los pasos 4 a 6 hasta que aparezca una nube. Repita los pasos 4 a 6 tres veces más.
Cuándo adquirir un nuevo inhalador STRIVERDI RESPIMAT®
El inhalador STRIVERDI RESPIMAT® contiene 60 pulsaciones (30 dosis). El indicador de dosis muestra la cantidad aproximada de medicación que queda. Cuando el indicador llega a la zona roja del indicador, queda medicación para aproximadamente 7 días (14 pulsaciones). En este momento usted debe obtener una nueva receta para el inhalador STRIVERDI RESPIMAT®.
Una vez que el indicador de dosis haya alcanzado el extremo final de la zona roja (es decir que se han usado las 30 dosis), el inhalador STRIVERDI RESPIMAT® está vacío, se traba automáticamente, y ya no se puede girar la base.
El inhalador STRIVERDI RESPIMAT® se debe desechar, como máximo, a los tres meses de haberlo usado aunque no se haya consumido toda la medicación.
Cuidado del inhalador
Al menos una vez por semana, debe limpiar toda la boquilla, también la parte metálica interna, solamente con un paño o pañuelo de papel húmedo.
La boquilla puede presentar un ligero cambio de color, pero esto no afecta el funcionamiento del inhala- dor STRIVERDI RESPIMAT®.
De ser necesario, limpie la parte externa del inhalador STRIVERDI RESPIMAT® con un paño húmedo.
PROPIEDADES FARMACOCINÉTICAS
Introducción general: Los datos farmacocinéticos sobre olodaterol se obtuvieron de sujetos sanos, sujetos con EPOC y con asma con inhalación de dosis iguales y mayores que las dosis terapéuticas.
El olodaterol mostró farmacocinética lineal con aumento de la exposición sistémica proporcional a la dosis después de inhalar dosis únicas de 5 a 70 µg, y dosis múltiples de 2 a 20 µg una vez por día.
Con la inhalación una vez por día repetida, se alcanzó el equilibrio de la concentración plasmática de olodaterol a los 8 días, y el grado de exposición aumentó hasta 1,8 veces comparado con la dosis única.
Características generales del principio activo después de administrar el fármaco:
• Absorción: Las concentraciones plasmáticas máximas de olodaterol generalmente se alcanzan entre 10 y 20 minutos después de la inhalación. En los voluntarios sanos, la biodisponibilidad absoluta de olodaterol después de la inhalación se estimó en un valor aproximado del 30%, mientras que la biodisponibilidad absoluta fue inferior al 1% cuando el fármaco se administró como solución oral. Por consiguiente, la disponibilidad sistémica de olodaterol después de la inhalación se determina principalmente por la absorción pulmonar.
• Distribución: El olodaterol tiene una cinética multicompartimental de la disposición tanto después de la inhalación como de la administración intravenosa. El volumen de distribución es alto (1110 l), lo que indica amplia distribución en los tejidos. El grado de unión in vitro de olodaterol [C14] a las proteínas de plasma humano no depende de la concentración y es de aproximadamente 60%.
El olodaterol es un sustrato de los transportadores P-gp, OAT1, OAT3 y OCT1. No es un sustrato de los transportadores BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 y OCT3.
• Biotransformación: El olodaterol se metaboliza principalmente por glucuronidación directa y O-desmetilación de la fracción metoxi, seguidas de conjugación. De los seis metabolitos identificados, únicamente el producto de desmetilación no conjugado se une a los receptores ß2. Este metabolito, sin embargo, no es detectable en el plasma tras la inhalación crónica de la dosis terapéutica recomendada, o bien de dosis hasta 4 veces más altas que la dosis terapéutica recomendada. Por consiguiente, se considera que el olodaterol es el único compuesto relevante de la acción farmacológica.
Las isoenzimas CYP2C9 y CYP2C8 del citocromo P450, con una contribución insignificante de la CYP3A4, están comprometidas en la O-desmetilación de olodaterol, mientras que, según se ha comprobado, las isoformas uridina difosfato glucosil transferasas UGT2B7, UGT1A1, 1A7 y 1A9 están comprometidas en la formación de los glucurónidos del olodaterol.
• Eliminación: La depuración total del olodaterol en los voluntarios sanos es 872 ml/min, y la depuración renal es 173 ml/min.
Después de la administración intravenosa de olodaterol radiomarcado con [C14], el 38% de la dosis radioactiva se recuperó en la orina y el 53% se recuperó en las heces. La cantidad de olodaterol inalterado que se recuperó en la orina después de la administración intravenosa fue del 19%. Después de la administración vía oral, se recuperó solamente el 9% de la radioactividad en la orina (el 0,7% de olodaterol inalterado), mientras que la mayor parte se recuperó en las heces (84%). Más del 90% de la dosis se excretó dentro de los 6 días y los 5 días subsiguientes a la administración vía intravenosa y oral respectivamente. Después de la inhalación, la excreción de olodaterol inalterado en la orina dentro del intervalo de administración en los voluntarios en estado de equilibrio representó el 5-7% de la dosis.
La concentración plasmática de olodaterol después de la inhalación cae en forma multifacética, con una vida media terminal aproximada de 45 horas.
Características en los pacientes: Se realizó un metanálisis farmacocinético con datos de dos estudios clínicos comparativos en 405 pacientes con EPOC y 296 pacientes con asma que recibieron STRIVERDI RESPIMAT®.
El análisis indicó que no es necesario ajustar la dosis en función de los efectos de edad, sexo o peso corporal en la exposición sistémica en los pacientes con EPOC después de inhalar STRIVERDI RESPIMAT®.
• Insuficiencia renal: No hubo aumento clínicamente relevante de la exposición sistémica en los pacientes con insuficiencia renal.
• Insuficiencia hepática: No hubo datos de diferencias en la eliminación de olodaterol ni en la unión proteica en los sujetos que tenían insuficiencia hepática leve o moderada y los controles sanos. No se han realizado estudios en sujetos con insuficiencia hepática severa.
• Raza: Al comparar los datos farmacocinéticos en cada estudio y entre los estudios, se observó una tendencia a mayor exposición sistémica en sujetos japoneses y otros asiáticos que en caucásicos.
No se identificaron problemas de seguridad en estudios clínicos en caucásicos y asiáticos de hasta un año de duración con STRIVERDI RESPIMAT® a dosis máximas del doble de la dosis terapéutica recomendada.
PROPIEDADES FARMACODINÁMICAS
Grupo farmacoterapéutico: Medicamentos para enfermedades obstructivas de las vías aéreas; agonistas selectivos de los ß2 adrenoceptores, código ATC: R03AC19.
Mecanismo de acción: El olodaterol tiene alto grado de afinidad y de selectividad respecto de los ß2 adrenoceptores humanos. Los estudios in vitro han demostrado que en los ß2 adrenoceptores tienen una actividad agonista 241 veces mayor que la que ejercen en los ß1 adrenoceptores, y 2299 veces mayor que la ejercida en los ß3 adrenoceptores.
El compuesto ejerce sus efectos farmacológicos mediante la unión a los ß2 adrenoceptores y su consiguiente activación después de la administración tópica por inhalación.
La activación de estos receptores en las vías aéreas deriva en la estimulación de la adenilciclasa intracelular, una enzima que participa como mediadora en la síntesis de la adenosina 3’,5’-monofosfato cíclica (cAMP). Los niveles elevados de cAMP causan broncodilatación por relajación de las células de la musculatura lisa de las vías aéreas.
El olodaterol tiene el perfil preclínico de un agonista selectivo de los ß2 adrenoceptores de acción prolongada (LABA), con un comienzo de acción rápido y una duración de acción de 24 horas como mínimo.
Los adrenoceptores ß se dividen en tres subtipos: los ß1 adrenoceptores, que se expresan predominantemente en la musculatura lisa cardíaca, los ß2 adrenoceptores, que se expresan predominantemente en la musculatura lisa de las vías aéreas, y los ß3 adrenoceptores, que se expresan predominantemente en el tejido adiposo. Los agonistas ß2 causan broncodilatación. Si bien los ß2 adrenoceptores son el tipo de receptor adrenérgico predominante en la musculatura lisa de las vías aéreas, también están presentes en la superficie de otras células, como las células epiteliales y las células endoteliales del pulmón, y en el corazón. No se sabe cuál es la función exacta de los receptores ß2 en el corazón, pero su presencia da lugar a la posibilidad de que incluso los agonistas ß2 adrenérgicos muy selectivos tengan efectos cardíacos.
• Efectos en la fisiología eléctrica del corazón: El efecto del olodaterol en el intervalo QT/QTc del ECG se investigó en 24 voluntarios sanos de sexo masculino y femenino en un estudio doble ciego, aleatorizado, comparativo con placebo y con control activo (moxifloxacina). El olodaterol a dosis únicas de 10, 20, 30 y 50 µg mostró similitud con el placebo en la media de la variación de los valores iniciales del intervalo QT en un lapso de 20 min utos a 2 horas de la administración de la dosis, que aumentó con dependencia de la dosis de 1,6 ms (10 µg de olodaterol) a 6,5 ms (50 µg de olodaterol), con un límite superior para los intervalos de confianza del 90% bilaterales menores que 10 ms en todos los niveles de dosis en el cada intervalo QT corregido (QTcl).
El efecto de 5 µg y de 10 µg de STRIVERDI RESPIMAT® en la frecuencia y el ritmo cardíacos se evaluó mediante un estudio electrocardiográfico continuo de 24 horas (monitoreo Holter) en un subconjunto de 772 pacientes en estudios de fase 3 comparativos con placebo, de 48 semanas de duración. No se observó tendencia ni patrón relacionado con la dosis o el tiempo respecto de la magnitud de la media de las variaciones de frecuencia cardíaca y latidos prematuros. La variación de los valores iniciales hasta el fin del tratamiento en los latidos prematuros no indicó ninguna diferencia significativa entre olodaterol 5 µg, olodaterol 10 µg y placebo.
Datos clínicos de eficacia y seguridad: El programa de desarrollo clínico de fase III de STRIVERDI RESPIMAT® incluyó cuatro pares de ensayos replicados, aleatorizados, doble ciegos, comparativos con placebo, en 3533 pacientes con EPOC (1281 tratados con la dosis de 5 µg, y 1284, con la dosis de 10 µg):
1. Dos ensayos replicados, comparativos con placebo y con tratamiento activo, de grupo paralelo, de 48 semanas, con formoterol 12 µg dos veces por día como comparador activo (Ensayos 1 y 2).
2. Dos ensayos replicados, comparativos con placebo, de grupo paralelo, de 48 semanas (Ensayos 3 y 4).
3. Dos ensayos replicados, comparativos con placebo y con tratamiento activo, cruzados de 6 semanas, con formoterol 12 µg dos veces por día como comparador activo (Ensayos 5 y 6).
4. Dos ensayos replicados, comparativos con placebo y con tratamiento activo, cruzados de 6 semanas, con tiotropio Handihaler, 18 µg una vez por día como comparador activo (Ensayos 7 y 8).
En todos los estudios se controló la función pulmonar (volumen espiratorio forzado en 1 segundo, VEF1); en los estudios de 48 semanas se evaluaron las respuestas máxima (AUC0-3) y mínima de la función pulmonar, y en los de 6 semanas se evaluó el perfil de la función pulmonar durante un intervalo ininte- rrumpido de 24 horas de administración de dosis. En los dos estudios replicados, comparativos con placebo y con tratamiento activo, de 48 semanas de duración, también se controló el índice transicional de disnea (ITD) para medir la disnea, y se hizo el Cuestionario Respiratorio de St. George (EGRQ) para medir la calidad de vida relacionada con la salud.
Los pacientes incluidos en el programa de fase III tenían 40 años de edad como mínimo, diagnóstico clínico de EPOC, antecedentes de tabaquismo de más de 10 paquetes-año e insuficiencia pulmonar entre moderada y muy severa (valor de VEF1 posbroncodilatador menor que el 80% del valor normal predictivo (Estadio GOLD II-IV); razón VEF1-CVF posbroncodilatador menor que 70%).
• Características de los pacientes: La mayoría de los 3104 pacientes incluidos en los ensayos internacionales de 48 semanas de duración [Ensayos 1 y 2, Ensayos 3 y 4] eran sujetos de sexo masculino (77%), de raza blanca (6%) o asiática (32%), con edad promedio de 64 años. La media de VEF1 posbroncodilatador fue 1,38 l (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). La media de la reactividad a los agonistas ß2 fue el 15% del valor inicial (0,160 l). Se permitió usar todo tipo de medicación pulmonar concomitante, salvo otros agonistas ß2 de acción prolongada (por ej. tiotropio [24%], ipratropio [25%], esteroides inhalados [45%], xantinas [16%]); la inclusión de pacientes se estratificó según el uso de tiotropio. En los cuatro ensayos, los criterios primarios de valoración de eficacia de la función pulmonar fueron la variación del AUC0-3 del VEF1 inicial pretratamiento y la variación del VEF1 mínimo inicial pretratamiento (pre- dosis) (a las 24 semanas en los Ensayos 1 y 2; a las 12 semanas en los Ensayos 3 y 4).
Los ensayos de 6 semanas de duración (Ensayos 5 y 6, Ensayos 7 y 8) se realizaron en Europa y América del Norte. En los Ensayos 5 y 6, la mayoría de los 199 pacientes eran hombres (53%) de raza blanca (93%), y edad media de 63 años. La media del VEF1 posbroncodilatador fue 1,43 l (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). La media de la reactividad a los agonistas ß2 fue el 17% del valor inicial (0,187 l). Se permitió usar todo tipo de medicación pulmonar concomi- tante, salvo otros agonistas ß2 de acción prolongada (por ej., tiotropio [24%], ipratropio [16%], es- teroides inhalados [31%], xantinas [0,5%]). En los Ensayos 7 y 8, la mayoría de los 230 pacientes eran hombres (69%) de raza blanca (99,6%), y edad media de 62 años. La media del VEF1 posbron- codilatador fue 1,55 l (GOLD II [57%], GOLD III [35%], GOLD IV [7%]). La media de la reactivi- dad a los agonistas ß2 fue el 18% del valor inicial (0,203 l). Se permitió usar todo tipo de medicación pulmonar concomitante, salvo otros agonistas ß2 de acción prolongada y anticolinérgicos (por ej., esteroides inhalados [49%], xantinas [7%]).
• Función pulmonar: En los estudios de 48 semanas, STRIVERDI RESPIMAT® 5 ug administrado una vez por día a la mañana mejoró significativamente (p <0,0001) la función pulmonar dentro de los 5 minutos posteriores a la primera dosis (media de aumento del VEF1, 0,130 l, comparado con el valor inicial pretratamiento de 1,18 l). La mejora significativa de la función pulmonar se mantuvo 24 horas (media de aumento del AUC0-3 del VEF1,0,162 l, comparado con placebo, p <0,0001; media de aumento del VEF1 mínimo en 24 horas, 0,071 l, comparado con placebo, p <0,0001); la mejora de la función pulmonar fue evidente tanto en quienes recibieron tiotropio como en quienes no lo recibieron. La magnitud del efecto broncodilatador del olodaterol (respuesta AUC0-3 del VEF1) dependió del grado de reversibilidad del valor inicial de la limitación del flujo de aire (medido por broncodilatación con agonistas ß de corta acción); los pacientes que mostraron mayor grado de reversibilidad del valor inicial tuvieron, por lo general, mayor respuesta al broncodilatador con olodaterol que los pacientes que mostraron menor grado de reversibilidad del valor inicial. El efecto broncodilatador (medido en l) fue menor en los pacientes con EPOC más severa tanto con olodaterol como con el comparador activo. Los efectos broncodilatadores de STRIVERDI RESPIMAT® se mantuvieron durante el período de tratamiento de 48 horas. STRIVERDI RESPIMAT® también mejoró el PFE (pico de flujo espiratorio) matutino y vespertino frente al placebo, según el registro diario de los pacientes.
En los ensayos de 6 semanas, STRIVERDI RESPIMAT® mostró respuesta VEF1 significativamente mayor que el placebo (p <0,0001) durante el intervalo de administración de 24 horas (media de aumento del AUC0-3 del VEF1, 0,175 l [Ensayos 5 y 6] y 0,211 l [Ensayos 7 y 8] frente al placebo, p <0,0001; media de aumento del AUC0-24 del VEF1, 0,137 l [Ensayos 5 y 6] y 0,168 l [Ensayos 7 y 8] frente al placebo, p<0,0001; media de aumento del VEF1 mínimo en 24 horas, 0,102 l [Ensayos 5 y 6] y 0,134 l [Ensayos 7 y 8] frente al placebo, p <0,0001). La mejora de la función pulmonar fue similar a la observada con la administración de formoterol dos veces por día [Ensayos 5 y 6; media de aumento del AUC0-3 del VEF1, 0,205 l frente al placebo; media de aumento del VEF1 mínimo en 24 horas, 0,108 l frente al placebo (p <0,0001)] y de tiotropio HandHaler una vez por día [Ensayos 7 y 8; media de aumento del AUC0-3 del VEF1, 0,211 l frente al placebo; media de aumento del VEF1 mínimo en 24 horas, 0,129 l frente al placebo (p <0,0001)].
• Disnea, calidad de vida relacionada con la salud, medicación de rescate, percepción general del paciente: Se incluyó también el ITD y el SGRQ en los ensayos replicados, comparativos con placebo y con tratamiento activo, de 48 semanas de duración [Ensayos 1 y 2].
A las 24 semanas, no había diferencias significativas entre STRIVERDI RESPIMAT®, formoterol y placebo debido a una mejora inesperada en el grupo placebo de un estudio (Tabla 1); en un análisis a posterior que dio cuenta de la interrupción del tratamiento, la diferencia entre STRIVERDI RESPIMAT® y placebo fue significativa.
|
Tabla 1: Puntaje focal de TDI a las 24 semanas de tratamiento |
|||
|
Media terapéutica |
Diferencia con placebo |
||
|
Media (valor p) |
|||
|
Análisis primario |
Placebo |
1,5 (0,2) |
|
|
Olodaterol 5 µg 1 vez por día |
1,9 (0,2) |
0,3 (p=0,1704) |
|
|
Formoterol 12 µg 2 veces por día |
1,8 (0,2) |
0,2 (p=0,3718) |
|
|
Análisis a posteriori |
Placebo |
1,5 (0,2) |
|
|
Olodaterol 5 µg 1 vez por día |
2,0 (0,2) |
0,5 (p=0,0270) |
|
|
Formoterol 12 µg 2 veces por día |
1,8 (0,2) |
0,4 (p=0,1166) |
|
A las 24 semanas, STRIVERDI RESPIMAT® mostró mejoras estadísticamente significativas en el puntaje to- tal del SGRQ comparado con el placebo (Tabla 2); la mejora se observó en los tres dominios (sínto- mas, actividades, repercusiones). Un número mayor de pacientes tratados con STRIVERDI RESPIMAT® tuvo mejora en el puntaje total del SGRQ mayor que en la DMCI (4 unidades) comparada con el resultado obtenido con el placebo (50,2% vs. 36,4%, p <0,0001).
|
Tabla 2: Puntaje total de SGRQ a las 24 semanas de tratamiento |
|||
|
Media del tratamiento (variación del valor inicial) |
Diferencia con placebo |
||
|
Media (valor p) |
|||
|
Puntaje total |
Inicial |
44,4 |
|
|
Placebo |
41,6 (-2,8) |
||
|
Olodaterol 5 µg 1 vez por día |
38,8 (-5,6) |
-2,8 (p=0,0034) |
|
|
Formoterol 12 µg 2 veces por día |
40,4 (-4,0) |
-1,2 (p=0,2009) |
|
Los pacientes tratados con STRIVERDI RESPIMAT® consumieron menos salbutamol como medicación de rescate diurna y nocturna que los pacientes tratados con placebo.
En cada ensayo de 48 semanas de duración, los pacientes tratados con STRIVERDI RESPIMAT® percibieron una mejora superior en la enfermedad respiratoria que los pacientes tratados con placebo, según el puntaje de PGP.
Población pediátrica: La Agencia Europea de Medicamentos ha relevado de la obligación de presentar los resultados de los estudios con STRIVERDI RESPIMAT® en todos los subgrupos de poblaciones pediátricas con EPOC (ver Dosis y vía de administración, que contiene información de la población pediátrica).
CONTRAINDICACIONES: STRIVERDI RESPIMAT® está contraindicado en pacientes con hipersensibilidad al olodaterol o a los excipientes.
PRECAUCIONES ESPECIALES PARA ELIMINACIÓN Y MANIPULACIÓN: La eliminación del medicamento no usado o de material de desecho se realizará de acuerdo con la normativa local.
Venta bajo receta médica.
Manténgase fuera del alcance de los niños
BOEHRINGER INGELHEIM PERÚ S.A.C
Av. Canaval y Moreyra 480, Piso 20
San Isidro - Telf.: (51-1) 212-4132
FERTILIDAD, EMBARAZO Y LACTANCIA
Embarazo: No existen datos clínicos disponibles de la exposición al olodaterol durante el embarazo.
Los estudios con animales de laboratorio no indican efectos nocivos directos ni indirectos en lo que respecta a la toxicidad reproductiva a dosis clínicamente relevantes (ver Datos preclínicos sobre seguridad).
Como medida precautoria, es preferible evitar el uso de STRIVERDI RESPIMAT® durante el embarazo.
Como sucede con otros agonistas ß2 adrenérgicos, olodaterol puede inhibir el parto por el efecto rela- jante en el músculo liso uterino.
Lactancia: No existen datos clínicos disponibles de la exposición al olodaterol en la mujer en período de lactancia. No se sabe si el olodaterol o sus metabolitos se excretan en la leche materna. Existen datos farmacocinéticos o toxicológicos de estudios en animales de laboratorio que indican la excreción de olodaterol o sus metabolitos en la leche materna.
Considerando que la exposición sistémica de la mujer lactante al olodaterol o sus metabolitos es ínfima a la dosis humana de 5 µg por día, no se espera observar efectos relevantes en el recién nacido y el niño amamantado.
Tomando en cuenta el beneficio de la alimentación del niño con leche materna, por un lado, y el beneficio del tratamiento para la madre, por el otro, se debe tomar una decisión al respecto: interrumpir el amamantamiento o suspender/evitar el tratamiento con STRIVERDI RESPIMAT®.
Fertilidad: No existen datos clínicos disponibles sobre la fertilidad con la administración de STRIVERDI RESPIMAT®. Los estudios preclínicos con olodaterol mostraron ausencia de efectos adversos en la fertilidad.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y UTILIZAR MÁQUINAS: No se han realizado estudios sobre los efectos de este producto en la capacidad para conducir vehículos y utilizar máquinas.
No obstante, se debe advertir a los pacientes que se han informado casos de mareo en ensayos clínicos. Por lo tanto, se les debe recomendar que tengan cuidado al conducir vehículos u utilizar máquinas. Si los pacientes tienen mareos, deben evitar tareas de riesgo como conducir vehículos u utilizar máquinas.
REACCIONES ADVERSAS
Resumen del perfil de seguridad: Los reacciones adversas más comunes a la dosis recomendada fueron nasofaringitis, mareo, hipertensión, exantema y artralgia. La mayoría fue leve o moderado en grado de intensidad.
Resumen tabulado de los efectos adversos: Las frecuencias asignadas a las reacciones adversas enumerados en la lista a continuación se basan en los porcentajes sin procesar de incidencia de las reacciones adversas al medicamento (es decir, eventos atribuidos al olodaterol) observadas en el grupo olodaterol 5 µg (1035 pacientes) agrupados a partir de 6 ensayos clínicos comparados con placebo, de grupo paralelo, en pacientes con EPOC con períodos de tratamiento de 4 a 48 semanas.
La frecuencia de las reacciones adversas se definió por medio de la siguiente convención:
Muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); poco frecuentes (≥1/1000 a <1/100); esporádicas (≥1/10 000 a <1/1000); muy esporádicas (<1/10 000), frecuencia desconocida (no se puede estimar a partir de los datos disponibles).
|
Clasificación por órgano y sistema/ |
Frecuencia |
|
Infecciones e infestaciones |
|
|
Nasofaringitis |
Poco frecuente |
|
Trastornos del sistema nervioso |
|
|
Mareos |
Poco frecuente |
|
Trastornos vasculares |
|
|
Hipertensión |
Esporádico |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Exantema |
Poco frecuente |
|
Enfermedades reumáticas y del tejido conectivo |
|
|
Artralgia |
Esporádico |
Descripción de las reacciones adversas seleccionados: La aparición de exantema se puede considerar como reacción de hipersensibilidad a STRIVERDI RESPIMAT®; como sucede con todos los medicamentos de uso tópico por absorción, se pueden producir otras reacciones de hipersensibilidad.
Perfil del efecto adverso de los agonistas ß2: STRIVERDI RESPIMAT® pertenece a la clase terapéutica de agonistas ß2 adrenérgicos de efecto prolongado; por lo tanto, se deben tomar en cuenta los efectos indeseados de la clase de los agonistas ß adrenérgicos, como taquicardia, arritmia, palpitaciones, isquemia de miocardio, angina de pecho, hipertensión o hipotensión, temblores, dolor de cabeza, nerviosismo, insomnio, mareos, sequedad de la boca, náuseas, espasmos musculares, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
Información de sospecha de reacciones adversas: Es importante informar la sospecha de reacciones adversas una vez que el fármaco ha sido autorizado porque permite seguir monitoreando el equilibrio entre riesgo y beneficio. Se solicita a los profesionales de la salud que informen los casos de sospecha de reacción adversa al Instituto.
INCOMPATIBILIDADES: No corresponde.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Adrenérgicos: La administración concomitante de otros agentes adrenérgicos (solos o como tratamiento combinado) puede potenciar los efectos indeseables de STRIVERDI RESPIMAT®.
Derivados xantínicos, esteroides o diuréticos: El tratamiento concomitante con derivados xantínicos, esteroides o diuréticos no ahorradores de potasio puede potenciar el efecto hipopotasémico de los agonistas adrenérgicos (ver Advertencias y precauciones especiales de empleo).
Betabloqueantes: Los bloqueantes adrenérgicos ß pueden debilitar o ser contrarios al efecto del olodaterol. Por lo tanto, STRIVERDI RESPIMAT® se puede administrar solamente con betabloqueantes adrenérgicos (gotas oculares) si existen razones fundadas para ello. En este contexto, se pueden considerar los betabloqueantes cardioselectivos, aunque se deben administrar con precaución.
Inhibidores de la MAO y antidepresivos tricíclicos, fármacos que prolongan el QTc: Los inhibidores de la monoamino oxidasa, los antidepresivos tricíclicos u otros fármacos cuyo efecto de prolongación del intervalo QTc es conocido pueden potenciar la acción de STRIVERDI RESPIMAT® en el sistema cardiovascular.
Interacciones medicamentosas farmacocinéticas: No se observaron efectos relevantes en la exposición sistémica a olodaterol en los estudios de interacción medicamentosa con coadministración de fluconazol usado como modelo inhibidor de CYP2C9.
La coadministración de ketoconazol como inhibidor potente de P-gp y CYP aumentó la exposición sistémica a olodaterol alrededor del 70%. No es necesario ajustar la dosis.
La coadministración de olodaterol y tiotropio no tuvo efectos relevantes en la exposición sistémica a ninguno de los dos fármacos.La investigación in vitro demostró que el olodaterol no inhibe las enzimas CYP ni los transportadores del principio activo a la concentración plasmática obtenida en la clínica.
DATOS PRECLÍNICOS DE SEGURIDAD: En los estudios no clínicos, se observaron efectos solamente con la exposición que se consideró que excedía con suficiencia la exposición máxima en el hombre, lo que tiene escasa relevancia clínica.
Los estudios de genotoxicidad y potencial carcinógeno no mostraron riesgos particulares para el hombre. Se observó mayor incidencia de leiomioma mesovárico en ratas y de leiomioma uterino y leiomiosarcoma en ratones. Se considera que se trata de un efecto de clase observado en los roedores después de la exposición prolongada a dosis altas de agonistas ß2. Los agonistas ß2 no se han asociado al cáncer en el hombre hasta la fecha.
En las ratas, no se produjeron efectos teratógenos tras la inhalación de dosis de 1054 µg/kg/día (aproxima- damente 1600 veces la máxima dosis inhalada diaria recomendada para el hombre (MDIDRH) en adultos (a la dosis de 5 ug) en mg/m2). En conejas NZW hembra, una dosis inhalada de 2489 ug/kg/día (exposición múltiple vs. MDIDRH >3500 en el AUC0-24) de olodaterol mostró la toxicidad fetal que caracte-rísticamente se produce como consecuencia de la estimulación de los adrenoceptores ß; la toxicidad se manifestó en osificación irregular, huesos cortos/curvos, apertura ocular incompleta, paladar hendido y anomalías cardiovasculares.
No se produjeron efectos significativos a dosis inhalada de 974 ug/kg/día (aproximadamente 1580 veces la MDIDRH en adultos en mg/m2).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO
Asma: STRIVERDI RESPIMAT® no se debe usar para el asma. La eficacia y la seguridad a largo plazo del olodaterol para el asma no han sido objeto de estudio.
Broncoespasmo agudo: STRIVERDI RESPIMAT® como tratamiento broncodilatador de mantenimiento una vez por día no se debe usar para tratar los episodios agudos de broncoespasmo, es decir, como tratamiento de rescate.
Hipersensibilidad: Como sucede con todos los medicamentos, existe la posibilidad de que se produzcan reacciones de hipersensibilidad después de administrar STRIVERDI RESPIMAT®.
Broncoespasmo paradójico: Como sucede con otros medicamentos inhalados, existe la posibilidad de que STRIVERDI RESPIMAT® cause broncoespasmo paradójico potencialmente fatal. En el caso de producirse un broncoespasmo paradójico, se debe suspender la administración de STRIVERDI RESPIMAT® de inmediato y aplicar tratamiento de reemplazo.
Efectos sistémicos: Los agonistas ß2 adrenérgicos de acción prolongada se deben administrar con precaución en los pacientes con trastornos cardiovasculares, específicamente cardiopatía isquémica, descompensación cardíaca severa, arritmias cardíacas, miocardiopatía obstructiva (hipertrófica), hipertensión y aneurisma; en los pacientes con trastornos convulsivos o tirotoxicosis, en los pacientes con prolongación conocida o sospecha de prolongación del intervalo QT (por ej., QT >0,44 s), y en los pacientes que, por lo general, no responden a las aminas simpaticomiméticas.
Los pacientes con antecedentes de infarto de miocardio en el curso del año anterior, arritmia cardíaca inestable o potencialmente fatal, internación hospitalaria por insuficiencia cardíaca en el curso del año anterior o diagnóstico de taquicardia paradójica (>100 latidos por minuto) fueron excluidos de los ensayos clínicos. Por esa razón, la experiencia obtenida de estos grupos de pacientes es limitada. STRIVERDI RESPIMAT® se debe usar con precaución en ellos.
Efectos cardiovasculares: Como sucede con otros agonistas ß2 adrenérgicos, el olodaterol puede producir un efecto cardiovascular clínicamente significativo en algunos pacientes, según se observó en las variables aumento del pulso, aumento de la presión arterial o síntomas. De producirse estos efectos, puede ser necesario suspender el tratamiento. Asimismo, se han informado alteraciones electrocardiográficas (ECG) producidas por los agonistas ß adrenérgicos, como aplanamiento de la onda T y depresión del segmento ST, si bien se desconoce la relevancia clínica de estas observaciones.
Hipopotasemia: Los agonistas ß2 adrenérgicos pueden producir grados significativos de hipopotasemia en algunos pacientes, con potencial para provocar efectos cardiovasculares adversos. El descenso provocado en los niveles séricos de potasio es usualmente transitorio y no necesita suplementos. En los pacientes con EPOC severa, la hipopotasemia puede verse potenciada por hipoxia y el tratamiento concomitante (ver Interacción con otros medicamentos y otras formas de interacción), lo que puede aumentar la propensión a arritmias cardíacas.
Hiperglucemia: La inhalación de dosis elevadas de agonistas ß2 adrenérgicos puede aumentar el nivel plasmático de glucosa.
Anestesia: En los casos de intervenciones quirúrgicas programadas, se debe tener particular precaución con los hidrocarburos halogenados anestésicos debido a la mayor propensión a los efectos adversos cardíacos de los broncodilatadores agonistas ß.
STRIVERDI RESPIMAT® no se debe usar en forma conjunta con otros medicamentos que contengan agonistas ß2 adrenérgicos de acción prolongada.
A los pacientes que hayan estado recibiendo agonistas ß2 adrenérgicos de corta acción inhalados periódicamente (por ej., cuatro veces por día) se les debe indicar que los usen únicamente para el alivio sintomático de los síntomas respiratorios agudos.
La administración de STRIVERDI RESPIMAT® puede dar resultado positivo en pruebas de control de estupefacientes.
DOSIS Y VÍA DE ADMINISTRACIÓN
Dosis: El medicamento se debe administrar únicamente por inhalación. El cartucho se puede insertar y usar solamente en el inhalador Respimat.
Dos pulsaciones del inhalador Respimat equivalen a una dosis.
• Adultos: La dosis recomendada para adultos es de 5 µg de olodaterol administrada en dos pulsaciones del in- halador Respimat una vez por día, siempre a la misma hora.
No se debe exceder la dosis recomendada.
• Pacientes geriátricos: Los pacientes geriátricos pueden usar STRIVERDI RESPIMAT® a la dosis recomendada.
• Insuficiencia hepática: Los pacientes con insuficiencia hepática de leve a moderada pueden usar STRIVERDI RESPIMAT® a la dosis recomendada.
No hay datos relevantes de uso de STRIVERDI RESPIMAT® en pacientes con insuficiencia hepática severa.
• Insuficiencia renal: Los pacientes con insuficiencia renal pueden usar STRIVERDI RESPIMAT® a la dosis recomendada. No hay datos suficientes de uso de STRIVERDI RESPIMAT® en pacientes con insuficiencia renal severa.
• Población pediátrica: No hay datos relevantes de uso de STRIVERDI RESPIMAT® en pacientes pediátricos (menores de 18 años).
Via de administración: Para la correcta administración del medicamento, un médico u otro profesional de la salud debe guiar al paciente en el uso del inhalador.
SOBREDOSIS
Síntomas: La sobredosis de olodaterol probablemente produzca efectos exagerados característicos de los agonistas ß2 adrenérgicos, por ejemplo, isquemia de miocardio, hipertensión o hipotensión, taquicardia, arritmias, palpitaciones, mareos, nerviosismo, insomnio, ansiedad, dolor de cabeza, temblores, sequedad de la boca, espasmos musculares, náuseas, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
Tratamiento: El tratamiento con STRIVERDI RESPIMAT® se debe suspender. Se indica la instauración de tratamiento complementario y sintomático. Los casos serios requieren internación hospitalaria. Se puede considerar la administración de betabloqueantes cardioselectivos, pero únicamente con suma precaución, porque el uso de medicación bloqueante ß adrenérgica puede provocar broncoespasmos.
PERÍODO DE VALIDEZ: 36 meses.
CONDICIONES DE CONSERVACIÓN Y ALMACENAMIENTO: No almacenar a temperatura superior a 30 °C.
No congelar.