SPIRIVA RESPIMAT
TIOTROPIO
Solución para inhalación
Envase(s) , 1 Cartucho(s) , 4.0 mL Solución para inhalación
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
La dosis liberada es de 2,5 microgramos de tiotropio por pulsación (una dosis son 2 pulsaciones) y es equivalente a 3,124 microgramos de bromuro de tiotropio monohidrato.
La dosis liberada es la dosis disponible para el paciente después de pasar por la boquilla.
Para consultar la lista completa de excipientes, ver Excipientes.
LISTA DE EXCIPIENTES
• Cloruro de benzalconio.
• Edetato disódico.
• Agua purificada.
• Ácido clorhídrico (para ajuste del pH).
INDICACIONES TERAPÉUTICAS
EPOC: El tiotropio está indicado como tratamiento broncodilatador de mantenimiento para aliviar los síntomas en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
Asma: SPIRIVA® RESPIMAT® está indicado como tratamiento broncodilatador adicional de mantenimiento en pacientes adultos con asma que estén siendo tratados con la combinación de mantenimiento de corticosteroides inhalados (≥800 µg budesonida/día o equivalente) y agonistas ß2 de acción prolongada y que hayan experimentado una o más exacerbaciones graves en el último año.
INSTRUCCIONES DE USO Y MANIPULACIÓN PARA EL PACIENTE
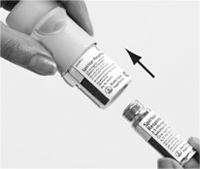
Inhalador SPIRIVA® RESPIMAT® y cartucho SPIRIVA® RESPIMAT®
1) Introducción del cartucho
Antes de la primera utilización son necesarios los pasos del 1 al 6:
1. Con la tapa verde (A) cerrada, presione el cierre de seguridad (E) y retire la base transparente (G).
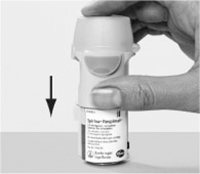
2. Sacar el cartucho (H) de la caja. Empujar el extremo estrecho del cartucho dentro del inhalador hasta que haga click. El cartucho debe empujarse firmemente contra una superficie firme para asegurar de que ha entrado por completo.
El cartucho no estará a ras del inhalador, verá la anilla plateada del extremo inferior del cartucho.
No sacar el cartucho una vez se ha introducido en el inhalador.
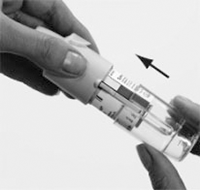
3. Colocar nuevamente la base transparente (G).
No volver a retirar la base transparente.

2) Preparación del inhalador SPIRIVA® RESPIMAT® para la primera utilización
4. Sujetar el inhalador SPIRIVA® RESPIMAT® en posición vertical, con la tapa verde (A) cerrada. Girar la base (G) en dirección de las flechas rojas de la etiqueta hasta que haga click (media vuelta).
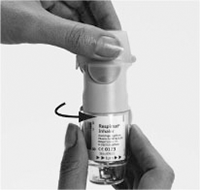
5. Abrir completamente la tapa verde (A) .
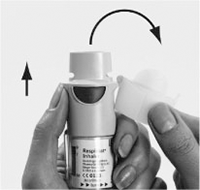
6. Dirigir el inhalador SPIRIVA® RESPIMAT® hacia el suelo. Presionar el botón de liberación de dosis (D). Cerrar la tapa verde (A).

Repita los pasos 4, 5 y 6 hasta observar una nube.
Después, repetir los pasos 4, 5 y 6 tres veces más para asegurar que el inhalador está listo para ser utlizado.
Ahora su inhalador SPIRIVA® RESPIMAT® está listo para ser utilizado.
Estos pasos no afectan el número de dosis disponibles. Después de la preparación, su inhalador SPIRIVA® RESPIMAT® podrá liberar 60 pulsaciones (30 dosis).
Utilización diaria de su inhalador SPIRIVA® RESPIMAT®
Necesitará usar este inhalador SÓLO UNA VEZ AL DÍA.
Cada vez que lo use, realice DOS PULSACIONES.
I. Sujetar el inhalador SPIRIVA® RESPIMAT® en posición vertical, con la tapa verde (A) cerrada, para evitar la liberación accidental de dosis. Girar la base (G) en la dirección de las flechas rojas de la etiqueta hasta que haga click (media vuelta).
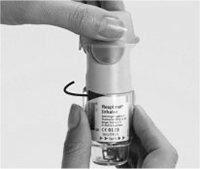
II. Abrir completamente la tapa verde (A). Espirar lenta y profundamente, luego cerrar los labios alrededor del final de la boquilla sin cubrir los válvulas de aire (C). Dirigir el inhalador SPIRIVA® RESPIMAT® hacia la parte posterior de su garganta.
Presionar el botón de liberación de la dosis (D) mientras inspira lenta y profundamente a través de la bocay continuar inspirando lentamente tanto tiempo que pueda. Mantenga la respiración durante 10 segundos o hasta que le sea posible.
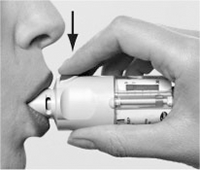
III. Repetir los pasos I y II para completar la dosis.
Necesitará usar este lanzador sólo una vez al día.
Cierre la tapa verde hasta que vuelva a utilizar su inhalador SPIRIVA® RESPIMAT®.
Si no ha utlizado el inhalador SPIRIVA® RESPIMAT® durante más de 7 días, libere un pulsación hacia el suelo. Si no ha utilizado el inhalador SPIRIVA® RESPIMAT® durante más de 21 días, repita los pasos 4 a 6 hasta que observe una nube. Entonces repita los pasos 4 a 6, tres veces más.
Cuándo cambiar el inhalador SPIRIVA® RESPIMAT®
El inhalador SPIRIVA® RESPIMAT® contiene 60 pulsaciones (30 dosis). El indicador de dosis marca, aproximadamente, cuánta medicación queda. Cuando el indicador alcanze la zona roja de la escala, aproximadamente queda medicación para 7 días (14 pulsaciones). En este momento necesita una nueva receta médica de SPIRIVA® RESPIMAT®.
Una vez que el indicador de dosis ha alcanzado el final de la zona roja (es decir, se han utilizado las 30 dosis), el inhalador SPIRIVA® RESPIMAT® está vacío y se bloquea automáticamente. En este punto ya no se puede girarse más.
Como máximo, tres meses después de haber sido utilizado, el inhalador SPIRIVA® RESPIMAT® debe desecharse aunque no se haya sido utilizado todo el medicamento.

Cómo cuidar su inhalador: Limpiar la boquilla incluyendo la parte metálica que se encuentra dentro de la misma, sólo con un trapo húmedo o un pañuelo, al menos una vez a la semana.
Cualquier pequeña decoloración de la boquilla no afecta el funcionamiento del inhalador SPIRIVA® RESPIMAT®.
Si es necesario, limpiar con un trapo húmedo la parte exterior del inhalador SPIRIVA® RESPIMAT®.
PROPIEDADES FARMACOCINÉTICAS
Introducción general: El bromuro de tiotropio es un compuesto de amonio cuaternario no quiral y escasamente soluble en agua. El bromuro de tiotropio está disponible como solución para inhalación administrada mediante el inhalador Respimat®. Aproximadamente el 40% de la dosis inhalada se deposita en los pulmones, órgano diana, el resto de la dosis se deposita en el tracto gastrointestinal. Algunos de los datos farmacocinéticos que se describen a continuación se obtuvieron con dosis superiores a las recomendadas para el tratamiento.
Características generales del principio activo después de la administración del medicamento:
• Absorción: Después de la inhalación de la solución en voluntarios jóvenes sanos, los datos de excreción urinaria sugieren que aproximadamente el 33% de la dosis inhalada alcanza la circulación sistémica. De la estructura química del compuesto (amonio cuaternario) y de los ensayos in vitro, se espera que el bromuro de tiotropio sea poco absorbido en el tracto gastrointestinal (10-15%). Las soluciones orales de bromuro de tiotropio tienen una biodisponibilidad absoluta del 2-3%. No es de esperar una influencia del alimento sobre la absorción de este compuesto de amonio cuaternario.
En el estado de equilibrio estacionario, los niveles plasmáticos máximos de bromuro de tiotropio en pacientes con EPOC fueron de 10,5-11,7 pg/ml cuando se midieron 10 minutos después de la administración de una dosis de 5 microgramos liberados por el inhalador Respimat® y disminuyeron rápidamente según un modelo multicompartimental. Las concentraciones plasmáticas valle en el estado de equilibrio estacionario fueron de 1,49-1,68 pg/ml. La concentración plasmática máxima de tiotropio de 5,15 pg/ml en el estado de equilibrio estacionario se alcanzó 5 minutos después de la administración de la misma dosis a los pacientes con asma.
• Distribución: El fármaco se une en un 72% a las proteínas plasmáticas y muestra un volumen de distribución de 32 l/kg. Se desconocen las concentraciones locales en el pulmón pero la forma de administración sugiere concentraciones sustancialmente superiores en este órgano. Los estudios en ratas han mostrado que el bromuro de tiotropio no atraviesa la barrera hematoencefálica en un grado significativo.
• Biotransformación: El grado de biotransformación es bajo. Ello se hace evidente por una excreción urinaria del 74% de la sustancia inalterada, después de una dosis intravenosa en voluntarios jóvenes sanos. El éster del bromuro de tiotropio se fragmenta de manera no enzimática al alcohol (N-metilescopina) y al ácido (ácido ditienilglicólico), que son inactivos sobre los receptores muscarínicos. Los ensayos in vitro en microsomas hepáticos humanos y hepatocitos humanos sugieren que alguna proporción adicional del fármaco (<20% de la dosis después de la administración intravenosa) se metaboliza mediante oxidación dependiente del citocromo P450 (CYP) y posterior conjugación con glutatión, a varios metabolitos de Fase II.
Los estudios in vitro en microsomas hepáticos revelan que la vía enzimática puede ser inhibida por los inhibidores del CYP 2D6 (y 3A4), quinidina, ketoconazol y gestodeno. Así pues, el CYP 2D6 y 3A4 están implicados en la vía metabólica responsable de la eliminación de una fracción inferior de la dosis.
Incluso a concentraciones supraterapéuticas, el bromuro de tiotropio no inhibe el CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 o 3A en microsomas hepáticos humanos.
• Eliminación: La semivida de eliminación terminal del bromuro de tiotropio es de entre 5 y 6 días después de la inhalación en voluntarios sanos y en pacientes con EPOC. La semivida efectiva fue de 34 horas en pacientes con asma. El aclaramiento total fue de 880 ml/min después de la administración de una dosis intravenosa en voluntarios jóvenes sanos con una variabilidad interindividual del 22%. El bromuro de tiotropio administrado intravenosamente se excreta inalterado principalmente en la orina (74%). Después de la inhalación de la solución en voluntarios sanos, la excreción urinaria es del 20,1-29,4% de la dosis, permaneciendo el resto del fármaco sin absorber en el intestino, eliminándose por las heces. En pacientes con asma, el 11,9% de la dosis (0,595 µg) se excreta inalterada en la orina durante 24 horas después de la dosificación en el estado estacionario. El aclaramiento renal de bromuro de tiotropio es superior al aclaramiento de creatinina, indicando la existencia de una secreción a la orina.
• Linealidad/No linealidad: El bromuro de tiotropio muestra una farmacocinética lineal en el intervalo terapéutico después de la administración intravenosa, la inhalación del polvo seco y la inhalación de la solución.
Características en pacientes:
• Pacientes geriátricos: Tal como era de esperar para todos los fármacos excretados predominantemente por vía renal, la edad avanzada se asoció a una reducción del aclaramiento renal de bromuro de tiotropio (de 326 ml/min en pacientes con EPOC <58 años hasta 163 ml/min en pacientes con EPOC >70 años), que se puede explicar por una función renal disminuida. La excreción de bromuro de tiotropio en la orina tras la inhalación disminuyó de un 14% (voluntarios jóvenes sanos) hasta aproximadamente un 7% (pacientes con EPOC); sin embargo, las concentraciones plasmáticas no cambiaron de forma significativa con el aumento de la edad en pacientes con EPOC, si se compara con la variabilidad inter e intraindividual (43% de incremento en la AUC0-4h después de la inhalación del polvo seco). La exposición a tiotropio en pacientes con asma no difirió con la edad.
• Pacientes con insuficiencia renal: De forma parecida a otros fármacos que sufren una excreción predominantemente renal, la insuficiencia renal se asoció a concentraciones plasmáticas del fármaco aumentadas y aclaramiento renal del fármaco reducido, tanto después de la infusión intravenosa como de la inhalación del polvo seco. La insuficiencia renal leve (CLCR 50-80 ml/min) que se observa con frecuencia en los pacientes ancianos incrementó ligeramente las concentraciones plasmáticas de bromuro de tiotropio (incremento del 39% en la AUC0-4h después de la infusión intravenosa). En los pacientes con EPOC y con una insuficiencia renal de moderada a grave (CLCR <50 ml/min), la administración intravenosa de bromuro de tiotropio produjo unas concentraciones plasmáticas dobles (incremento del 82% en la AUC0-4h), lo que fue confirmado por las concentraciones plasmáticas después de la inhalación de polvo seco y también por la inhalación de la solución con el inhalador Respimat®. En pacientes asmáticos con insuficiencia renal leve (CLCR 50-80 ml/min) la inhalación de tiotropio no produjo aumentos relevantes en la exposición en comparación con pacientes con función renal normal.
• Pacientes con insuficiencia hepática: No se espera que la insuficiencia hepática tenga ninguna influencia importante sobre la farmacocinética del bromuro de tiotropio. El bromuro de tiotropio se aclara predominantemente por eliminación renal (un 74% en los voluntarios jóvenes sanos) y por una fragmentación simple no enzimática del éster a productos farmacológicamente inactivos.
• Pacientes pediátricos: No hubo pacientes pediátricos en el programa de EPOC (ver Posología y forma de administración). Los pacientes pediátricos se estudiaron como parte del programa clínico de FQ que también incluyó adultos.
Tras la inhalación de 5 ug de bromuro de tiotropio, los niveles plasmáticos de tiotropio en pacientes con FQ de 5 años o más, fueron de 10,1 pg/ml a los 5 minutos de la dosificación en el estado estacionario y disminuyeron rápidamente. La fracción de dosis disponible en pacientes menores de 5 años con FQ que utilizaron un dispositivo espaciador y máscara fue aproximadamente de 3 a 4 veces más baja que la observada en pacientes con FQ de 5 años o más. La exposición a tiotropio se relacionó con el peso corporal en los pacientes con FQ menores de 5 años.
Relación(es) farmacocinética/farmacodinamia: No existe relación directa entre la farmacocinética y la farmacodinamia.
PROPIEDADES FARMACODINÁMICAS
Grupo farmacoterapéutico: Otros agentes contra padecimientos obstructivos de las vías respiratorias, inhalatorios, anticolinérgicos
Código ATC: R03B B04
Mecanismo de acción: El bromuro de tiotropio es un antagonista específico de los receptores muscarínicos de acción prolongada. Tiene una afinidad similar por los diferentes subtipos M1 a M5. En las vías aéreas, el bromuro de tiotropio se une, de forma competitiva y reversible a los receptores M3 de la musculatura lisa bronquial, antagonizando el efecto colinérgico (broncodilatador) de la acetilcolina, provocando relajación de la musculatura lisa bronquial. El efecto fue dependiente de la dosis y duró más de 24 horas. Como anticolinérgico N-cuaternario, el bromuro de tiotropio es tópicamente (bronco-) selectivo cuando se administra por inhalación, demostrando un rango terapéutico aceptable antes de que aparezcan efectos anticolinérgicos sistémicos.
Efectos farmacodinámicos: La disociación del tiotropio especialmente de los receptores M3 es muy lenta, mostrando una semivida de disociación significativamente mayor que el ipratropio. La disociación de los receptores M2 es más rápida que la de los M3, hecho que en los estudios funcionales in vitro fue considerado como una selectividad (controlado cinéticamente) del subtipo de receptor, M3 sobre M2. La potencia elevada, la disociación muy lenta del receptor y la selectividad tópica por inhalación mostraron su correlación clínica en forma de una broncodilatación significativa y de larga duración en los pacientes con EPOC y asma.
Eficacia clínica y seguridad en EPOC: El programa de desarrollo clínico en fase III incluyó dos estudios de 1 año, dos estudios de 12 semanas y dos estudios de 4 semanas, aleatorizados, doble ciego en 2901 pacientes con EPOC (1038 pacientes recibieron una dosis de 5 µg de tiotropio). El programa de 1 año consistió en dos ensayos controlados con placebo. Los dos ensayos de 12 semanas fueron ambos controlados con placebo y activo (ipratropio). En los seis estudios se incluyeron determinaciones de la función pulmonar. Además, los estudios de 1 año incluyeron mediciones de los resultados de salud por lo que respecta a la disnea, calidad de vida relacionada con la salud y efecto sobre las exacerbaciones.
En los estudios anteriormente mencionados, la solución para inhalación de tiotropio, administrada una vez al día, produjo una mejoría significativa de la función pulmonar (volumen espiratorio forzado en un segundo y capacidad vital forzada) en los 30 minutos posteriores a la administración de la primera dosis comparado con placebo (mejoría media del FEV1 a los 30 minutos: 0,113 litros; Intervalo de confianza (IC) 95%: 0,102 a 0,125 litros, p<0,0001). La mejoría de la función pulmonar se mantuvo durante un periodo de 24 horas en estado estacionario comparado con placebo (mejoría media del FEV1 : 0,122 litros; IC 95%: 0,106 a 0,138 litros, p<0,0001).
El estado de equilibrio farmacodinámico se alcanzó en una semana.
SPIRIVA® RESPIMAT® mejoró de forma significativa el PEFR (tasa de flujo espiratorio máximo) matinal y nocturno medido en los registros diarios de los pacientes comparado con placebo (mejoría media del PEFR: mejoría media por la mañana 22 l/min; IC 95%: 18 a 55 l/min, p<0,0001; noche 26 l/min; IC 95%: 23 a 30 l/min, p<0,0001). El uso de SPIRIVA® RESPIMAT® produjo una reducción del uso de broncodilatadores de rescate comparado con placebo (reducción media en la utilización en rescate 0,66 veces al día, IC 95%: 0,51 a 0,81 veces por día, p<0,0001).
Los efectos broncodilatadores de SPIRIVA® RESPIMAT® se mantuvieron durante todo el periodo de administración de 1 año sin que se observaran signos de tolerancia.
En los estudios a largo plazo de 1 año se demostraron los siguientes efectos sobre los resultados de salud:
(a) SPIRIVA® RESPIMAT® mejoró de forma significativa la disnea (tal como se evaluó utilizando el Índice de Transición de Disnea de Mahler) comparado con placebo (mejoría media 1,05 unidades; IC 95%: 0,73 a 1,38 unidades, p<0,0001). La mejoría se mantuvo durante todo el periodo de tratamiento.
(b) La mejoría media total de la evaluación de la Calidad de Vida de los pacientes (utilizando para su evaluación el Cuestionario Respiratorio de St. George) entre SPIRIVA® RESPIMAT® frente a placebo al final de los dos estudios de 1 año de duración fue de 3,5 unidades (IC 95%: 2,1 a 4,9, p<0,0001). Una reducción de 4 unidades se considera clínicamente relevante.
(c) Exacerbaciones de la EPOC
En tres ensayos clínicos de un año controlados con placebo, aletorizados, doble-ciego, el tratamiento con SPIRIVA® RESPIMAT® resultó en una reducción significativa del riesgo de exacerbación de la EPOC en comparación con el placebo. La exacerbación de la EPOC se define como un complejo de al menos dos acontecimientos/síntomas respiratorios con una duración de 3 días o más que requieran un cambio en el tratamiento (prescripción de antibióticos y/o corticosteroides sistémicos y/o un cambio significativo en la medicación respiratoria prescrita).
El tratamiento con SPIRIVA® RESPIMAT® resultó en una reducción del riesgo de hospitalización por exacerbación de la EPOC (que es significativa en el ensayo clínico suficientemente extenso sobre exacerbación).
En la Tabla 1 se muestra el análisis de datos recopilados en 2 ensayos clínicos fase III y un análisis separado del ensayo adicional de exacerbación. Se permitió el tratamiento simultáneo con otros medicamentos respiratorios excepto anticolinérgicos y beta-agonistas de larga acción, es decir, beta-agonistas de acción rápida, corticosteroides inhalados y xantinas. Los beta-agonistas de larga acción estaban permitidos adicionalmente en el ensayo de exacerbación.
|
Tabla 1: Análisis estadístico de exacerbaciones de la EPOC y hospitalizaciones por exacerbaciones de la EPOC en pacientes con EPOC moderada a muy severa. |
|||||
|
Estudio (NSpiriva, Nplacebo) |
Criterio de valoración |
SPIRIVA® RESPIMAT® |
Placebo |
% Reducción del Riesgo (95% IC)a |
Valor p |
|
Análisis recopilado de los estudios fase III de 1 añod (670, 653) |
Días hasta la primera exacerbación de la EPOC |
160a |
86a |
29 (16 a 40)b |
<0,0001b |
|
Tasa de incidencia promedio de exacerbaciones por paciente por año |
0,78c |
1,00c |
22 (8 a 33)c |
0,002c |
|
|
Tiempo hasta la primera hospitalización por exacerbación de la EPOC |
25 (-16 a 51)b |
0,20b |
|||
|
Tasa de incidencia promedio de hospitalización por exacerbación de EPOC |
20 (-4 a 38)c |
0,096c |
|||
|
Estudio de 1 año fase IIIb de exacerbación (1939, 1953) |
Días hasta la primera exacerbación de la EPOC |
169a |
119a |
31 (23 a 37)b |
<0,0001b |
|
Tasa de incidencia promedio de exacerbaciones por paciente por año |
0,69c |
0,87c |
21 (13 a 28)c |
<0,0001c |
|
|
Tiempo hasta la primera hospitalización por exacerbación de la EPOC |
27 (10 a 41)b |
0,003b |
|||
|
Tasa de incidencia promedio de hospitalización por exacerbación de EPOC |
0,12c |
0,15c |
19 (7 a 30)c |
0,004c |
|
|
a. Tiempo hasta el primer acontecimiento: días de tratamiento hasta que el 25% de los pacientes tuvo al menos una exacerbación de la EPOC/hospitalización por exacerbación de la EPOC. En el estudio A el 25% de los pacientes tratados con placebo tuvo una exacerbación el día 112, mientras que con SPIRIVA® RESPIMAT® el 25% tuvo una exacerbación el día 173, p=0,09; en el estudio B, el 25% de los pacientes tratados con placebo tuvo una exacerbación el día 74, mientras que con SPIRIVA® RESPIMAT® el 25% tuvo una exacerbación el día 149 (p<0,0001). b. La razón de riesgo se estimó según el modelo de riesgo proporcional de Cox. El porcentaje de reducción de riesgo es 100 (1 – razón de riesgo). c. Regresión de Poisson: Reducción del riesgo es 100 (1 – razón de tasas). d. La recopilación se especificó cuando se diseñaron los ensayos. Los criterios de valoración de exacerbación mejoraban significativamente en el análisis individual de los dos estudios de 1 año. |
|||||
En un análisis recopilatorio retrospectivo de 3 ensayos clínicos controlados con placebo de 1 año y otro de 6 meses con SPIRIVA® RESPIMAT® incluyendo 6096 pacientes con EPOC, se observó un incremento numérico de la mortalidad por cualquier causa en los pacientes tratados con SPIRIVA® RESPIMAT® (68; tasa de incidencia (IR) 2,64 casos por 100 pacientes-año) comparado con placebo (51, IR 1,98) mostrando una razón de la tasa (95% de intervalo de confianza) de 1,33 (0,93, 1,92) para el período de tratamiento planificado; el exceso de mortalidad se observó en pacientes con trastornos del ritmo cardíaco conocidos.
Eficacia clínica y seguridad en asma: El programa clínico de fase III para el asma persistente incluyó dos estudios de 1 año de duración, aleatorizados, doble ciego y controlados con placebo en un total de 907 pacientes con asma (453 recibieron SPIRIVA® RESPIMAT®) tratados con una combinación de ICS (≥800 mg budesonida/día o equivalente) y LABA. Los estudios incluyeron como principales criterios de valoración mediciones de la función pulmonar y de las exacerbaciones graves.
Estudios PrimoTinA- asma: En los dos estudios de 1 año en pacientes sintomáticos en tratamiento de mantenimiento con al menos ICS (≥800 mg budesonida/día o equivalente) más LABA, SPIRIVA® RESPIMAT® mostró una mejoría clínicamente relevante de la función pulmonar frente al placebo cuando se administró como terapia adicional al tratamiento de base.
En la semana 24, la mejoría media en FEV1 pico y valle fue de 0,110 litros (IC 95%: 0,063 a 0,158 litros, p<0,0001) y 0,093 litros (IC 95%: 0,050 a 0,137 litros, p<0,0001), respectivamente. La mejora de la función pulmonar en comparación con placebo se mantuvo durante 24 horas.
En los estudios PrimoTinA- asma, el tratamiento de los pacientes sintomáticos (N=453) con ICS más LABA más tiotropio redujo el riesgo de exacerbaciones graves de asma en un 21% con respecto al tratamiento de los pacientes sintomáticos (N=454) con ICS más LABA más placebo. La reducción del riesgo en el promedio de exacerbaciones graves de asma/paciente-año fue del 20%.
Esto fue respaldado por una reducción del 31% en el riesgo de empeoramiento del asma y una reducción del riesgo del 24% en el promedio de empeoramientos del asma/paciente-año (ver Tabla 2).
|
Tabla 2: Exacerbaciones en pacientes sintomáticos con ICS (≥800 mg budesonida/día o equivalente) más LABA (estudios de PrimoTinA- asma) |
|||||
|
Estudio |
Criterios de valoración |
SPIRIVA® RESPIMAT®, como tratamiento adicional a ICSa/LABA (N=453) |
Placebo, como tratamiento adicional a ICSa/LABA (N=454) |
% Reducción del riesgo (95% CI) |
Valor - p |
|
Dos estudios de un año de fase III, análisis agrupados |
Días hasta la 1ª exacerbación graves de asma |
282c |
226c |
21b (0, 38) |
0,0343 |
|
Promedio de exacerbaciones graves de asma/paciente-año |
0,530 |
0,663 |
20d (0, 36) |
0,0458 |
|
|
Días hasta el 1º empeoramiento del asma |
315c |
181c |
31b (18, 42) |
<0,0001 |
|
|
Promedio de empeoramientos del asma/paciente-año |
2,145 |
2,835 |
24d (9, 37) |
0,0031 |
|
|
a. ≥800 µg budesonide/día o equivalente. b. Razón de riesgo, intervalo de confianza y valor-p obtenido según el modelo de riesgo proporcional de Cox con solo el tratamiento como efecto. El porcentaje de reducción de riesgo es 100 (1 – razón de riesgo). c .Tiempo hasta el primer acontecimiento: días de tratamiento hasta que el 25%/50% de los pacientes tuvo al menos una exacerbación grave de asma/empeoramiento del asma. d. La razón de tasas se obtuvo mediante la regresión de Poisson con una exposición log (en años) como compensación. El porcentaje de reducción de riesgo es 100 (1 – razón de riesgo). |
|||||
Población pediátrica:
• EPOC: La Agencia Europea del Medicamento ha eximido de la obligación de presentar los resultados de los estudios con SPIRIVA® RESPIMAT® en todos los subgrupos de población pediátrica en EPOC (ver Posología y forma de administración para consultar la información sobre el uso en población pediátrica).
• Asma: La Agencia Europea de medicamentos ha concedido un aplazamiento para presentar los resultados de los ensayos realizados con SPIRIVA® RESPIMAT® en uno o más grupos de la población pediátrica en el tratamiento del asma (ver Posología y forma de administración para consultar la información sobre el uso en la población pediátrica)
Eficacia clínica y seguridad en fibrosis quística (FQ): El programa de desarrollo clínico en FQ incluyó 3 estudios multicéntricos en 959 pacientes con edades de 5 meses o más. Los pacientes menores de 5 años utilizaron un dispositivo espaciador (AeroChamber Plus®) con una máscara y fueron incluidos solamente para la evaluación de seguridad. Los dos estudios principales (un estudio de fase II de determinación de dosis y un estudio confirmatorio de fase III) compararon los efectos de la función pulmonar (porcentaje predicho FEV1 AUC0-4h y FEV1 valle) de SPIRIVA® RESPIMAT® (5 ug de tiotropio: 469 pacientes) frente a placebo (315 pacientes) en periodos de 12 semanas, aleatorizados y doble ciego; el estudio de fase III también incluyó una extensión abierta a largo plazo de hasta 12 meses. En estos estudios se permitían todas las medicaciones respiratorias, excepto anticolinérgicos, como tratamiento concomitante, p.ej. agonistas beta de acción prolongada, mucolíticos o antibióticos.
En la Tabla 3 se muestran los efectos sobre la función pulmonar. No se han observado mejorías significativas en los síntomas y en el estado de salud (exacerbaciones por el cuestionario de síntomas sistémicos y respiratorios y calidad de vida por el cuestionario de fibrosis quística).
|
Tabla 3: Diferencia media ajustada de placebo para cambios absolutos en el valor basal tras 12 semanas |
||||||
|
Fase II |
Fase III |
|||||
|
Todos los pacientes |
Todos los pacientes |
≤ 11 años (NSpiriva = 95, Nplacebo = 47) |
≥12 años (NSpiriva = 198, Nplacebo = 100) |
|||
|
media (95% IC) |
Valor p |
media (95% IC) |
Valor p |
media (95% IC) |
media (95% IC) |
|
|
FEV1 AUC0-4h (% predicho)a |
3,39 (1,67; 5,12) |
<0,001 |
1,64 |
0,092 |
-0,63 |
2,58 |
|
FEV1 AUC0-4h (litros) Cambios absolutos |
0,09 (0,05; 0,14) |
<0,001 |
0,07 |
0,010 |
0,01 |
0,10 |
|
FEV1 valle (% predicho)a |
2,22 (0,38; 4.06) |
0,018 |
1,40 |
0,150 |
-1,24 |
2,56 |
|
FEV1 valle (litros) |
0,06 (0,01; 0,11) |
0,028 |
0,07 |
0,012 |
-0,01 |
0,10 |
|
a. Variables de eficacia co-primarias. |
||||||
Todas las reacciones adversas (RA) observadas en los ensayos en FQ son efectos secundarios conocidos de tiotropio (ver Reacciones adversas). Las reacciones adversas observadas más comúnmente durante las 12 semanas del periodo doble ciego fueron tos (4,1%) y sequedad de boca (2,8%).
En la Tabla 4 se muestra el número y el porcentaje de pacientes que han notificado acontecimientos adversos de especial interés en fibrosis quística con independencia de su relación. Los signos y síntomas considerados manifestaciones de fibrosis quística aumentaron numéricamente con tiotropio, aunque sin significación estadística, especialmente en pacientes con 11 años o menos.
|
Tabla 4: Porcentaje de pacientes con acontecimientos adversos de especial interés en fibrosis quística por grupo de edad tras 12 semanas de tratamiento con independencia de su relación (recopilación de fase II y fase III) |
||||
|
≤11 años |
≥12 años |
|||
|
Nplacebo=96 |
NSpriva=158 |
Nplacebo=215 |
NSpriva=307 |
|
|
Dolor abdominal |
7,3 |
7,0 |
5,1 |
6,2 |
|
Estreñimiento |
1,0 |
1,9 |
2,3 |
2,6 |
|
Síndrome de obstrucción intestinal distal |
0,0 |
0,0 |
1,4 |
1,3 |
|
Infecciones del tracto respiratorio |
34,4 |
36,7 |
28,4 |
28,3 |
|
Aumento del esputo |
1,0 |
5,1 |
5,6 |
6,2 |
|
Exacerbaciones |
10,4 |
14,6 |
18,6 |
17,9 |
El síndrome de obstrucción intestinal distal y el aumento de esputo son términos preferentes MedDRA. Las infecciones del tracto respiratorio pertenecen al nivel superior de términos MedDRA. El dolor abdominal, el estreñimiento y las exacerbaciones son colecciones de términos preferidos por MedDRA.
Treinta y cuatro (10,9%) de los pacientes aleatorizados a placebo y 56 (12,0%) de los pacientes aleatorizados a SPIRIVA® RESPIMAT® experimentaron acontecimientos adversos graves.
La Agencia Europea del Medicamento ha eximido de la obligación de presentar los resultados de los ensayos con SPIRIVA® RESPIMAT® en los subgrupos de población pediátrica menores de 1 año.
CONTRAINDICACIONES: SPIRIVA® RESPIMAT® está contraindicado en pacientes con hipersensibilidad al bromuro de tiotropio, a la atropina o a sus derivados, p.ej. ipratropio u oxitropio, o a cualquiera de los excipientes.
FERTILIDAD, EMBARAZO Y LACTANCIA
Embarazo: Los datos sobre el uso de tiotropio en mujeres embarazadas es muy limitado. Los estudios en animales no muestran efectos nocivos directos o indirectos respecto a toxicidad reproductiva a dosis clínicamente relevantes (ver Datos preclínicos sobre seguridad). Como medida de precaución, es preferible evitar el uso de SPIRIVA® RESPIMAT® durante el embarazo.
Lactancia: Se desconoce si el bromuro de tiotropio se excreta en la leche materna. A pesar de que los estudios en roedores muestran que el bromuro de tiotropio se excreta sólo en pequeñas cantidades en la leche materna, el uso de SPIRIVA® RESPIMAT® no se recomienda durante la lactancia. El bromuro de tiotropio es un compuesto de acción prolongada. La decisión en cuanto a continuar/suspender la lactancia o continuar/suspender el tratamiento con SPIRIVA® RESPIMAT® debe tomarse considerando el beneficio de la lactancia para el niño y el beneficio del tratamiento con SPIRIVA® RESPIMAT® para la mujer.
Fertilidad: No se dispone de datos clínicos de tiotropio sobre la fertilidad. Un estudio preclínico con tiotropio no mostró indicios de ningún efecto adverso sobre la fertilidad (ver Datos preclínicos sobre seguridad).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. La aparición de mareo o visión borrosa puede influir la capacidad para conducir y utilizar maquinaria.
REACCIONES ADVERSAS
Resumen del perfil de seguridad: Muchas de las reacciones adversas listadas pueden atribuirse a las propiedades anticolinérgicas del bromuro de tiotropio.
Resumen tabulado de reacciones adversas: Las frecuencias asignadas a las reacciones adversas listadas a continuación se basan en porcentajes de incidencia bruta de reacciones adversas al fármaco (es decir, acontecimientos atribuidos a tiotropio) observadas en el grupo de tiotropio recopiladas de 5 ensayos clínicos controlados con placebo en EPOC (2802 pacientes) y 6 ensayos clínicos controlados con placebo en asma (1256 pacientes) con períodos de tratamiento en un rango desde 12 semanas a 1 año.
Las reacciones adversas han sido ordenadas según sus frecuencias utilizando la siguiente clasificación: muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); poco frecuentes (≥1/1000 a <1/100); raras (≥1/10 000 a <1/1000); muy raras (<1/10 000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación por órganos y sistemas/Término preferente MedDRA |
Frecuencia EPOC |
Frecuencia Asma |
|
Trastornos del metabolismo y de la nutrición |
||
|
Deshidratación |
No conocida |
No conocida |
|
Trastornos del sistema nervioso |
||
|
Mareos |
Poco frecuente |
Poco frecuente |
|
Cefalea |
Poco frecuente |
Poco frecuente |
|
Insomnio |
No conocida |
Poco frecuente |
|
Trastornos oculares |
||
|
Glaucoma |
Rara |
No conocida |
|
Aumento de la presión intraocular |
Rara |
No conocida |
|
Visión borrosa |
Rara |
No conocida |
|
Trastornos cardíacos |
||
|
Fibrilación auricular |
Poco frecuente |
No conocida |
|
Palpitaciones |
Poco frecuente |
Poco frecuente |
|
Taquicardia supraventricular |
Poco frecuente |
No conocida |
|
Taquicardia |
Poco frecuente |
No conocida |
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Tos |
Poco frecuente |
Poco frecuente |
|
Epistaxis |
Poco frecuente |
No conocida |
|
Faringitis |
Poco frecuente |
Poco frecuente |
|
Disfonía |
Poco frecuente |
Poco frecuente |
|
Broncoespasmo |
Rara |
Poco frecuente |
|
Laringitis |
Rara |
No conocida |
|
Sinusitis |
No conocida |
No conocida |
|
Trastornos gastrointestinales |
||
|
Sequedad de boca |
Frecuente |
Frecuente |
|
Estreñimiento |
Poco frecuente |
Rara |
|
Candidiasis orofaríngea |
Poco frecuente |
Poco frecuente |
|
Disfagia |
Poco frecuente |
No conocida |
|
Reflujo gastroesofágico |
Rara |
No conocida |
|
Caries dental |
Rara |
No conocida |
|
Gingivitis |
Rara |
Rara |
|
Glositis |
Rara |
No conocida |
|
Estomatitis |
Rara |
Rara |
|
Obstrucción intestinal, incluyendo íleo paralítico |
No conocida |
No conocida |
|
Náuseas |
No conocida |
No conocida |
|
Trastornos de la piel y del tejido subcutáneo, trastornos del sistema inmunológico |
||
|
Erupción |
Poco frecuente |
Rara |
|
Prurito |
Poco frecuente |
Rara |
|
Edema angioneurótico |
Rara |
Rara |
|
Urticaria |
Rara |
Rara |
|
Infección de la piel/úlcera en la piel |
Rara |
No conocida |
|
Piel seca |
Rara |
No conocida |
|
Hipersensibilidad (incluyendo reacciones inmediatas) |
No conocida |
Rara |
|
Reacción anafiláctica |
No conocida |
No conocida |
|
Trastornos musculoesquléticos y del tejido conjuntivo |
||
|
Tumefacción en articulación |
No conocida |
No conocida |
|
Trastornos renales y urinarios |
||
|
Retención urinaria |
Poco frecuente |
No conocida |
|
Disuria |
Poco frecuente |
No conocida |
|
Infección del tracto urinario |
Rara |
No conocida |
Descripción de reacciones adversas seleccionadas: Las reacciones adversas observadas frecuentemente en ensayos clínicos controlados en EPOC fueron las reacciones adversas de los anticolinérgicos, tales como la sequedad de boca que ocurre en aproximadamente el 3,2% de los pacientes. En asma la incidencia de sequedad de boca fue del 1,2%.
En cinco ensayos clínicos en EPOC, la sequedad de boca provocó el abandono de los estudios en 3 de los 2802 pacientes tratados con tiotropio (0,1%). En los 6 ensayos clínicos en asma (1256 pacientes) no se notificaron abandonos debidos a la sequedad de boca.
Reacciones adversas graves relacionadas con efectos anticolinérgicos incluyen glaucoma, estreñimiento, obstrucción intestinal incluyendo íleo paralítico y retención urinaria.
Otra población especial: Puede darse un incremento de los efectos anticolinérgicos al aumentar la edad.
“Por favor comunicarse con su médico o farmacéutico en caso se presente cualquier reacción adversa que no este descrita en este inserto”.
INCOMPATIBILIDADES: No procede.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: Aunque no se han llevado a cabo estudios formales de interacción con otros fármacos, el bromuro de tiotropio ha sido utilizado conjuntamente con otros medicamentos habitualmente utilizados en el tratamiento de la EPOC y asma, incluyendo broncodilatadores simpaticomiméticos, metilxantinas, corticoides orales e inhalados, antihistamínicos, mucolíticos, modificadores de leucotrienos, cromonas, tratamiento con anti-IgE sin evidencia clínica de interacciones.
La administración simultánea de bromuro de tiotropio con otros medicamentos conteniendo anticolinérgicos no se ha estudiado y por lo tanto, no se recomienda.
DATOS PRECLÍNICOS SOBRE SEGURIDAD: Muchos de los efectos observados en los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y toxicidad para la reproducción podrían explicarse por las propiedades anticolinérgicas del bromuro de tiotropio. En animales normalmente se observó reducción del consumo de alimentos, inhibición del aumento de peso corporal, sequedad de boca y nariz, reducción del lagrimeo y la salivación, midriasis y aumento de la frecuencia cardíaca. Otros efectos relevantes observados en los estudios de toxicidad de dosis repetidas fueron: irritación leve del tracto respiratorio en ratas y ratones, puesta de manifiesto por aparición de rinitis y cambios en el epitelio de la cavidad nasal y la laringe, y prostatitis junto con depósitos de proteínas y litiasis de la vejiga en ratas.
En ratas jóvenes expuestas desde los 7 días tras el nacimiento hasta la madurez sexual se observaron los mismos cambios farmacológicos directos e indirectos que en los estudios de toxicidad a dosis repetidas así como rinitis. No se observó toxicidad sistémica ni efectos toxicológicos relevantes en los parámetros principales del desarrollo, ni en el desarrollo traqueal o de órganos diana.
Los efectos nocivos sobre la gravidez, desarrollo embrional/fetal, parto o desarrollo postnatal únicamente se pudieron demostrar a niveles de dosis tóxicas para las madres. El bromuro de tiotropio no fue teratogénico en ratas ni conejos. En un estudio general de reproducción y fertilidad en ratas no se observaron indicios de ningún efecto adverso en la fertilidad o la conducta de apareamiento tanto en los progenitores tratados y su descendencia a ninguna dosis.
Los cambios respiratorios (irritación) y urogenitales (prostatitis) y la toxicidad sobre la reproducción, fueron observados con la exposición local o sistémica a dosis cinco veces superiores a la dosis terapéutica. Los estudios sobre genotoxicidad y potencial carcinogénico no mostraron un peligro especial para el ser humano.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO: El bromuro de tiotropio, como broncodilatador de mantenimiento de administración una vez al día, no debe ser utilizado para el tratamiento inicial de los episodios agudos de broncoespasmo, o para el alivio de los síntomas agudos. En caso de ataque agudo, debe utilizarse un agonista-beta-2 de acción rápida.
SPIRIVA® RESPIMAT® no debe ser utilizado como monoterapia (primera línea) para el asma. Los pacientes con asma deben continuar tomando el tratamiento antiinflamatorio, es decir corticosteroides inhalados, sin cambios después de la introducción de SPIRIVA® RESPIMAT®, aun cuando sus síntomas mejoren.
Después de la administración de bromuro de tiotropio, solución para inhalación, pueden aparecer reacciones de hipersensibilidad inmediata.
De acuerdo con su actividad anticolinérgica, el bromuro de tiotropio debe utilizarse con precaución en pacientes con glaucoma de ángulo estrecho, hiperplasia prostática u obstrucción del cuello de la vejiga.
Los medicamentos inhalados pueden provocar broncoespasmo inducido por la inhalación.
SPIRIVA® RESPIMAT® debe utilizarse con precaución en pacientes con trastornos del ritmo cardíaco conocidos (ver sección Propiedades farmacodinámicas).
En pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina <50 ml/min), el bromuro de tiotropio sólo debe utilizarse si el beneficio esperado supera el riesgo potencial, ya que la concentración plasmática aumenta cuando la función renal está disminuida. No existe experiencia a largo plazo en pacientes con insuficiencia renal grave (ver Propiedades farmacocinéticas).
Debe advertirse a los pacientes que eviten la introducción de la pulsación en los ojos. Se les debe indicar que ello puede provocar o empeorar un glaucoma de ángulo estrecho, dolor o molestia ocular, visión borrosa transitoria, halos visuales o imágenes coloreadas, junto con enrojecimiento ocular por congestión de la conjuntiva y edema de la córnea. Si se desarrolla alguna combinación de estos síntomas oculares, los pacientes deben interrumpir el uso de bromuro de tiotropio y consultar inmediatamente a un especialista.
La sequedad de boca, observada con el tratamiento anticolinérgico, a largo plazo puede asociarse con caries dental.
El bromuro de tiotropio no debe utilizarse con una frecuencia superior a una vez al día (ver Sobredosis).
No se recomienda utilizar SPIRIVA® RESPIMAT® en fibrosis quística (FQ). Si se utiliza SPIRIVA® RESPIMAT® en pacientes con FQ los signos y síntomas de la FQ (por ejemplo reacciones adversas graves, exacerbaciones pulmonares, infecciones del tracto respiratorio) pueden aumentar.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN: La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizarán de acuerdo con la normativa local.
“Consulte a su médico o farmacéutico, según proceda, para cualquier aclaración sobre la utilización del producto”.
Fabricado por:
Boehringer Ingelheim Pharma GmbH & CO. KG. - Alemania
Importado por:
BOEHRINGER INGELHEIM PERÚ S.A.C
Av. Canaval y Moreyra 480, Piso 20
San Isidro - Telf.: (51-1) 212-4132
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
Posología: Este medicamento es únicamente para uso por vía inhalatoria. El cartucho sólo puede introducirse y utilizarse con el inhalador Respimat® (ver Posología y forma de administración).
Una dosis son dos pulsaciones del inhalador Respimat®.
La dosis recomendada para adultos es de 5 microgramos de tiotropio administrados en dos pulsaciones del inhalador Respimat® una vez al día y a la misma hora.
No debe superarse la dosis recomendada.
En el tratamiento del asma el beneficio completo será evidente después de varias dosis del medicamento.
Poblaciones especiales: Los pacientes geriátricos pueden utilizar el bromuro de tiotropio a la dosis recomendada.
Los pacientes con insuficiencia renal pueden utilizar el bromuro de tiotropio a la dosis recomendada. En pacientes con insuficiencia de moderada a grave (aclaramiento de creatinina <50 ml/min) ver Advertencias y precauciones especiales de empleo y Propiedades farmacocinéticas.
Los pacientes con insuficiencia hepática pueden utilizar el bromuro de tiotropio a la dosis recomendada (ver Propiedades farmacocinéticas).
Población pediátrica:
EPOC: No existe un uso relevante de SPIRIVA® RESPIMAT® en niños y adolescentes menores de 18 años.
Fibrosis quística: No se ha establecido la seguridad y eficacia de Spiriva Respimat (ver Advertencias y precauciones especiales de empleo y Propiedades farmacodinámicas).
Asma: No se ha establecido todavía la seguridad y eficacia de SPIRIVA® RESPIMAT® en niños y adolescentes.
Forma de administración: Para asegurar la correcta administración del medicamento, el paciente debe ser instruido por un médico u otros profesionales sanitarios en cómo usar el inhalador.
SOBREDOSIS: Dosis elevadas de bromuro de tiotropio pueden provocar la aparición de signos y síntomas anticolinérgicos.
No obstante, después de la administración de una dosis única inhalada de hasta 340 microgramos de bromuro de tiotropio en voluntarios sanos, no se observaron efectos adversos anticolinérgicos sistémicos. Adicionalmente, no se han observado reacciones adversas relevantes, a parte de sequedad de boca/garganta y sequedad de la mucosa nasal, en voluntarios sanos que recibieron hasta 40 microgramos de solución de tiotropio para inhalación durante 14 días, con la excepción de una reducción pronunciada del flujo salivar a partir del séptimo día.
La intoxicación aguda por ingestión oral accidental de solución para inhalación de tiotropio del cartucho es poco probable, debido a su baja biodisponibilidad oral.
PERIODO DE VALIDEZ EN USO: 3 meses.
“No consumir el producto una vez alcanzada la fecha de vencimiento indicada en los rotulados“.
CONDICIONES DE ALMACENAMIENTO: Consérvese a una temperatura no superior a 30 °C.
NATURALEZA Y CONTENIDO DEL ENVASE
Tipo de envase y material en contacto con el medicamento:
• Solución contenida en un cartucho (envase de polietileno interno/cubierta externa de polipropileno) en un cilindro de aluminio.
Tamaño de envases y dispositivos disponibles:
• Envase individual: 1 inhalador Respimat® y 1 cartucho x 4 mL que proporciona 60 pulsaciones (30 dosis).
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: No congelar.
No dejar los medicamentos al alcance de los niños.
VIDA ÚTIL: 3 años