SPIRIVA
TIOTROPIO
Cápsulas
Cápsulas duras , 18 mcg
Caja , Cápsulas con polvo para inhalar , 18 mcg
COMPOSICIÓN
1 CÁPSULA DURA contiene:
Tiotropio (equivalente a 22,5 mcg de bromuro de tiotropio monohidrato) 18 mcg
Excipientes c.s.p.
INDICACIONES: SPIRIVA® está indicado para el tratamiento de mantenimiento a largo plazo del broncoespasmo asociado con la enfermedad pulmonar obstructiva crónica (EPOC), incluyendo bronquitis crónica y enfisema.
No está indicado para el tratamiento inicial de episodios agudos de broncoespasmo.
ACCIÓN FARMACOLÓGICA: Tiotropio es un agente antimuscarínico específico de larga duración, llamado frecuentemente un anticolinérgico en medicina clínica. Tiene una afinidad similar para los subtipos de receptores muscarínicos M1 a M5. En las vías aéreas, la inhibición de los receptores M3 en el músculo liso resulta en relajación. La naturaleza competitiva y reversible del antagonismo fue demostrada con receptores de origen humano y animal y en preparaciones de órganos aislados. En estudios pre-clínicos in vitro así como in vivo los efectos bronco-protectores fueron dependientes de la dosis y duraron más de 24 horas. Es probable que la larga duración del efecto se deba a su muy lenta disociación de los receptores M3, exhibiendo una vida media de disociación significativamente más larga que la observada con ipratropio.
Como un anticolinérgico N-cuaternario, tiotropio es localmente (bronco-) selectivo cuando se administra por inhalación, demostrando un rango terapéutico aceptable antes de dar paso a efectos anticolinérgicos sistémicos. La disociación de los receptores M2 es más rápida que de los receptores M3, lo cual en estudios funcionales in vitro causó una selectividad (cinéticamente controlada) para el subtipo de receptor M3 sobre M2. La alta potencia y la lenta disociación del receptor hallaron su correlación clínica en una broncodilatación significativa y de larga duración en pacientes con EPOC.
La broncodilatación que se produce después de la inhalación de tiotropio es principalmente un efecto local (sobre las vías aéreas), no un efecto sistémico.
CONTRAINDICACIONES: SPIRIVA® esta contraindicado en pacientes con historia de hipersensibilidad a la atropina o sus derivados, incluyendo ipratropio, tiotropio u oxitropio o a cualquier componente del producto, incluyendo la lactosa inhalada.
EMBARAZO Y LACTANCIA
• No existen estudios adecuados y bien controlados en mujeres embarazadas.
• Se desconoce si tiotropio se excreta en la leche materna humana, sin embargo tiotropio se excreta en la leche de roedores.
• Por lo tanto, SPIRIVA® no debe ser usado en mujeres embarazadas o en periodo de lactancia a menos que el beneficio esperado sea mayor a cualquier posible riesgo para el feto o el lactante.
EFECTOS EN LA HABILIDAD PARA CONDUCIR Y OPERAR MAQUINARIA: No existen estudios respecto a la habilidad para conducir y operar maquinaria. La aparición de mareos o visión borrosa puede alterar la habilidad para conducir y operar maquinaria.
REACCIONES ADVERSAS: La mayoría de los efectos no deseados listados pueden asignarse a las características anticolinérgicas de SPIRIVA®. Las frecuencias presentadas debajo se basan en la incidencia neta de las reacciones adversas observadas en el grupo de tiotropio (5437 pacientes) recopilados de 19 estudios controlados con placebo con períodos de tratamiento comprendidos entre cuatro semanas y un año.
• Trastornos cardiacos:
— ≥0,1% y < 1%: Taquicardia, palpitaciones, angina de pecho (incluyendo angina de pecho agravada).
— Otros*: Taquicardia supraventricular, fibrilación atrial.
• Trastornos gastrointestinales:
— ≥1% y <10%: Sequedad de boca, dispepsia.
— ≥0,1% y <1%: Candidiasis oral.
— ≥0,01% y <0,1%: Constipación, reflujo gastroesofágico, estomatitis (incluyendo estomatitis ulcerativa), dolor abdominal, vómitos.
— Otros*: Obstrucción intestinal incluyendo íleo paralítico, disfagia.
• Trastornos metabólicos y nutricionales:
— Otros*: Hipercolesterolemia, hiperglicemia.
• Trastornos músculo-esqueléticos:
— Otros*: Dolor de piernas, mialgias, dolor óseo.
• Trastornos renales y urinarios:
— ≥0,01% y <0,1%: Disuria y retención urinaria (usualmente en varones con factores predisponentes), infección del tracto urinario.
• Trastornos respiratorios, torácicos y mediastinales:
— ≥0,1% y <1%: Disfonia, dolor del pecho, faringitis, rinitis, laringitis, sinusitis, infección del tracto respiratorio superior. Como ocurre con otros inhaladores: broncoespasmo, tos, irritación de garganta y otras irritaciones en el lugar de aplicación.
— ≥0,01% y <0.1%: Epistaxis.
• Trastornos del sistema nervioso:
— ≥0,1% y <1%: Mareos.
— Otros*: Depresión, parestesia.
• Trastornos visuales:
— ≥0,01% y <0,1%: Visión borrosa, incremento de la presión intraocular.
— Otros*: Glaucoma.
• Trastornos de la piel y el tejido subcutáneo, trastornos del sistema inmune:
— ≥0,01% y <0,1%: Rash, urticaria, prurito, y otras reacciones alérgicas (incluyendo reacciones inmediatas).
— Otros*: Angioedema, edema, herpes zoster, moniliasis.
* Frecuencia desconocida, ningún evento adverso observado en 5437 pacientes.
INTERACCIONES: La co-administración de medicamentos anticolinérgicos (como ipratropio) con SPIRIVA® no ha sido estudiada y por lo tanto no se recomienda.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES
• SPIRIVA®, como un broncodilatador de mantenimiento una vez al día, no debe ser usado para el tratamiento inicial de episodios agudos de broncoespasmo, es decir terapia de rescate.
• Pueden ocurrir reacciones de hipersensibilidad inmediata luego de la administración de SPIRIVA®, incluyendo angioedema; en estos casos debe detenerse la terapia y considerar otros tratamientos alternativos.
• Como sucede con otros medicamentos anticolinérgicos, SPIRIVA® debe ser usado con cuidado en pacientes con glaucoma de ángulo estrecho, hiperplasia prostática u obstrucción de cuello vesical.
• Las medicinas inhaladas pueden causar broncoespasmo paradojal, en estos casos el tratamiento debe detenerse inmediatamente y considerar otros tratamientos alternativos.
• Como sucede con todos los medicamentos de excreción predominantemente renal, SPIRIVA® debe ser monitorizado de cerca en pacientes con insuficiencia renal moderada a severa (depuración de creatinina de ≤50 mL/min).
• Se debe tener cuidado de no permitir que el polvo ingrese a los ojos, ya que podría causar visión borrosa y dilatación de la pupila. El dolor o molestia en los ojos, visión borrosa, halos visuales o imágenes coloreadas asociados con enrojecimiento de los ojos por congestión conjuntival y edema corneal pueden ser signos de glaucoma de ángulo estrecho. De desarrollarse cualquier combinación de estos síntomas se deberá buscar el consejo de un especialista inmediatamente. Las gotas oculares mióticas no son consideradas como un tratamiento efectivo.
• Los pacientes deben recibir instrucciones sobre la correcta administración de las cápsulas de SPIRIVA®.
• SPIRIVA® no debe ser usado más de la dosis prescrita.
• Las cápsulas de SPIRIVA son para ser usadas únicamente con el dispositivo HandiHaler®.
• Este producto contiene 5,5 mg de lactosa monohidrato por cápsula.
DOSIS Y VÍA DE ADMINISTRACIÓN
Adultos: Para el tratamiento de la bronquitis, enfisema y enfermedad obstructiva crónica (EPOC), la dosis recomendada es la inhalación oral de 18 mcg de tiotropio contenido en una cápsula de SPIRIVA® una vez al día, con el dispositivo de inhalación HandiHaler® a la misma hora del día (ver Instrucciones de uso).
Las cápsulas de SPIRIVA® no deben ser ingeridas.
Los pacientes con insuficiencia renal moderada a severa deben ser monitorizados de cerca.
Personas de edad avanzada: Ver Dosis usual para adultos.
INSTRUCCIONES DE USO
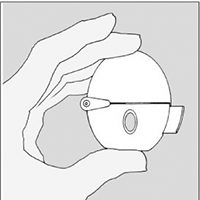
Recuerde seguir cuidadosamente las instrucciones de su doctor. El dispositivo HandiHaler® está diseñado especialmente para la inhalación de SPIRIVA®. No debe ser usado para tomar ningún otro medicamento. Usted puede usar su dispositivo HandiHalerSPIRIVA® para tomar su medicamento hasta por un año.
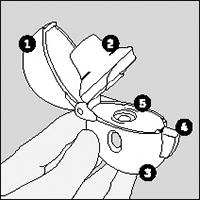
1. Para abrir la tapa, presione el botón perforador completamente.
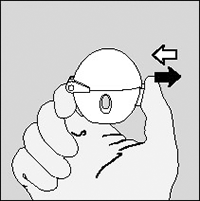
2. Abra la tapa jalándola hacia arriba. Luego abra la boquilla.
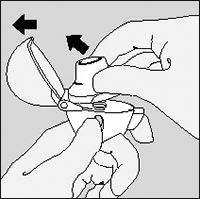
3. Retire una cápsula de SPIRIVA® del blister (sólo inmediatamente antes de su uso, ver manipulación del blister) y colóquela en la cámara central, como se muestra. No importa en que sentido coloca usted la cápsula en la cámara.
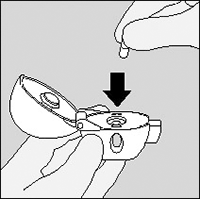
4. Cierre la boquilla firmemente hasta que escuche un “click”, dejando la tapa abierta.
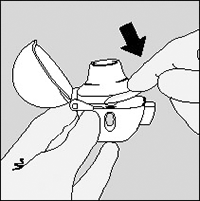
5. Sostenga el dispositivo HandiHaler® con la boquilla hacia arriba y presione completamente el botón perforador sólo una vez, y suelte.
Esto hace agujeros en la cápsula y permite que el medicamento sea liberado cuando usted inhale.
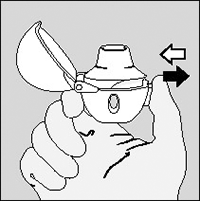
6. Bote el aire (exhale) completamente.
Importante: Evite exhalar en la boquilla en todo momento.
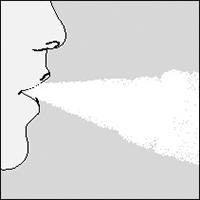
7. Lleve el dispositivo HandiHaler® a su boca y cierre los labios ajustando alrededor de la boquilla. Mantenga su cabeza en posición erguida y tome aire lenta y profundamente pero a una velocidad suficiente para oír o sentir que la cápsula vibra.
Tome aire hasta que sus pulmones se llenen; luego mantenga la respiración lo más que le sea cómodo hacerlo y al mismo tiempo retire el dispositivo HandiHaler® de su boca. Vuelva a respirar normalmente.
Repita los pasos 6 y 7 una vez, esto vaciará completamente la cápsula.
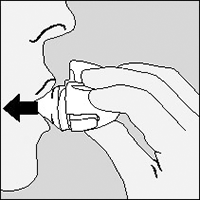
8. Abra la boquilla nuevamente. Deje caer la cápsula usada y descártela.
Cierre la boquilla y la tapa para guardar su dispositivo HandiHaler®.
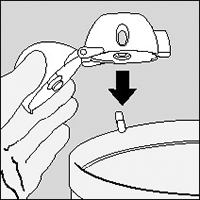
Limpieza del dispositivo HandiHaler®
Limpie el dispositivo HandiHaler® una vez al mes.
Abra la tapa y la boquilla. Luego abra la base levantando el botón perforador. Enjuague todo el inhalador con agua tibia para remover cualquier polvo. Seque el dispositivo HandiHaler® completamente dejando caer el exceso de agua en papel toalla y luego secando al aire, dejando abiertas la tapa, la boquilla y la base. Toma 24 horas el secar al aire, así que límpielo justo después de usarlo y estará listo para su próxima dosis. Por fuera de la boquilla puede limpiarse con un material húmedo, mas no mojado, si es necesario.
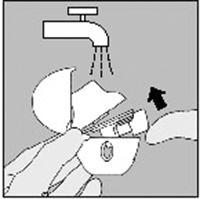
Manipulación del blister
A. Separe las tiras del blister rompiéndolas a lo largo de la perforación.
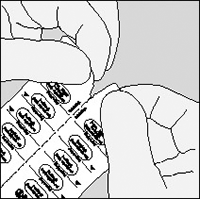
B. Retire la cubierta (sólo inmediatamente antes de su uso) usando el apéndice hasta que una cápsula sea totalmente visible.
En caso de que una segunda cápsula sea expuesta al aire sin querer, ésta tiene que ser desechada.
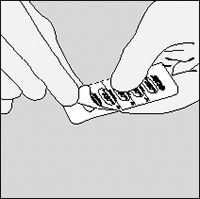
C. Saque la cápsula.
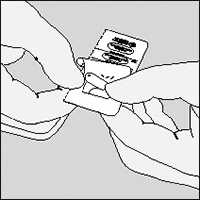
Las cápsulas no deberán ser expuestas, ni en el blister ni en el inhalador, a temperaturas extremas, es decir, no deberán ser expuestas a la luz solar ni al calor.
Las cápsulas de SPIRIVA® contienen sólo una pequeña cantidad de polvo por lo que está llena parcialmente.
TRATAMIENTO EN CASO DE SOBREDOSIS: Dosis altas de SPIRIVA® pueden llevar a signos y síntomas anticolinérgicos.
La intoxicación aguda por ingestión oral de tiotropio es poco probable debido a que no se absorbe bien sistémicamente.
Los pacientes en los cuales se confirme o se sospeche sobredosis intencional, deben recibir atención siquiátrica.
PRESENTACIÓN: Cápsulas duras con polvo para inhalación.
Importado por:
BOEHRINGER INGELHEIM PERÚ S.A.C
Av. Canaval y Moreyra 480, Piso 20
San Isidro - Telf.: (51-1) 212-4132
CONDICIONES DE ALMACENAMIENTO: No almacenar a temperatura superior a 25 ºC. Proteger de la luz y la humedad.
Luego de abrir por primera vez el blister, usar dentro de los 9 días.