
SERETIDE DISKUS
FLUTICASONA, SALMETEROL
Inhalador
Inhalador , 60 Dosis , 250 mcg
Inhalador , 60 Dosis , 500 mcg
Caja, 1 Diskus inhalador, 60 Dosis
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
SERETIDE® DISKUS® 50 mcg + 100 mcg/dosis:
Cada dosis contiene: Salmeterol (como xinafoato) 50 mcg, propionato de fluticasona 100 mcg, excipientes c.s.p.
SERETIDE® DISKUS® 50 mcg + 250 mcg/dosis:
Cada dosis contiene: Salmeterol (como xinafoato) 50 mcg, propionato de fluticasona 250 mcg , excipientes c.s.p.
SERETIDE® DISKUS® 50 mcg + 500 mcg/dosis:
Cada dosis contiene: Salmeterol (como xinafoato) 50 mcg, propionato de fluticasona 500 mcg, excipientes c.s.p.
Para consultar la lista completa de excipientes, ver Lista de excipientes.
LISTA DE EXCIPIENTES: Lactosa monohidratada.
INDICACIONES TERAPÉUTICAS:
Asma: SERETIDE® DISKUS® está indicado para el tratamiento regular del asma cuando la administración de una combinación (un agonista ß2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada:
• Pacientes insuficientemente controlados con corticosteroides inhalados y agonistas ß2 de acción corta administrados "a demanda".
• Pacientes adecuadamente controlados con un agonista ß2 de acción prolongada y con un corticosteroide por vía inhalatoria.
Nota: SERETIDE® DISKUS® 50 mcg + 100 mcg/dosis no se considera adecuado para el tratamiento del asma grave en niños y adultos.
Enfermedades pulmonar obstructiva crónica (EPOC): SERETIDE® DISKUS® está indicado en el tratamiento sintomático de pacientes con EPOC, con un VEMS <60% del normal (pre-broncodilatador) y un historial de exacerbaciones repetidas, que continúan presentando síntomas significativos a pesar del uso regular de una terapia broncodilatadora.
PROPIEDADES FARMACOCINÉTICAS:
Cuando salmeterol y propionato de fluticasona se administraron en combinación por vía inhalatoria, la farmacocinética de cada componente fue similar a la observada cuando los fármacos se administraron por separado. Por consiguiente, en lo que respecta a farmacocinética, cada componente puede considerarse separadamente.
Salmeterol: Salmeterol actúa localmente en el pulmón, por lo que los niveles plasmáticos no son predictivos del efecto terapéutico. Además, se dispone solo de datos limitados sobre la farmacocinética de salmeterol, a causa de la dificultad técnica de la determinación del fármaco en plasma, debido a las bajas concentraciones plasmáticas a dosis terapéuticas (aproximadamente 200 picogramos/ml o menos) alcanzadas tras la inhalación.
Propionato de fluticasona: La biodisponibilidad absoluta de una dosis única del propionato de fluticasona inhalado en personas sanas varía entre aproximadamente 5-11% de la dosis nominal, dependiendo del dispositivo para inhalación utilizado. Se ha observado un menor grado de exposición sistémica al propionato de fluticasona inhalado, en pacientes con asma o EPOC.
La absorción sistémica tiene lugar principalmente a través de los pulmones, siendo inicialmente rápida y posteriormente prolongada. El resto de la dosis inhalada puede ingerirse, contribuyendo mínimamente sin embargo a la exposición sistémica, debido a la baja solubilidad acuosa y a un metabolismo pre-sistémico, dando como resultado una disponibilidad por vía oral de menos del 1%. Hay un aumento lineal en la exposición sistémica con el aumento de la dosis inhalada.
La disposición del propionato de fluticasona se caracteriza por un aclaramiento plasmático elevado (1150 mL/min), un gran volumen de distribución en el estado de equilibrio (aproximadamente 300 L) y una semivida terminal de aproximadamente 8 horas.
La unión a proteínas plasmáticas es del 91%.
El propionato de fluticasona se elimina muy rápidamente de la circulación sistémica, principalmente metabolizado por la enzima CYP3A4 del citocromo P450 a un metabolito carboxílico inactivo. Se han hallado también en las heces otros metabolitos no identificados.
El aclaramiento renal del propionato de fluticasona es insignificante. Menos del 5% de la dosis se excreta en orina, principalmente en forma de metabolitos. La parte principal de la dosis se excreta en heces como metabolitos y fármaco inalterado.
PROPIEDADES FARMACODINÁMICAS:
Grupo Farmacoterapéutico: Adrenérgicos y otros antiasmáticos.
Código ATC: R03AK06
Ensayos clínicos con SERETIDE® en Asma: Se ha realizado un estudio de 12 meses de duración (GOAL – “Gaining Optimal Asthma ControL”), en 3416 pacientes adultos y adolescentes con asma persistente, en el que se ha comparado la eficacia y seguridad de SERETIDE® frente a corticosteroides inhalados solos (propionato de fluticasona) para determinar si los niveles predefinidos de control del asma eran alcanzables. Se fue aumentando el tratamiento cada 12 semanas hasta alcanzar un “Control total”** o la dosis máxima de fármaco. El estudio GOAL mostró que había más pacientes tratados con SERETIDE®
que alcanzaban un control del asma que pacientes tratados con corticoides inhalados (CI) solos y este control se alcanzó a dosis más bajas de corticoides.
Un “Buen Control” del asma fue alcanzado más rápidamente con SERETIDE® que con corticosteroides inhalados solos. El tiempo de tratamiento en el que el 50% de los pacientes alcanzaron su primera semana de “Buen Control” fue de 16 días para el grupo tratado con SERETIDE® comparado con 37 días para el grupo en tratamiento con corticosteroides inhalados solos. En el subconjunto de pacientes con asma que no habían sido tratados con esteroides previamente, el tiempo en el que se alcanzó su semana de “Buen Control” fue de 16 días en el grupo tratado con SERETIDE® comparado con 23 días en el grupo tratado con corticosteroides inhalados solos.
Los resultados generales del estudio mostraron:
|
Porcentaje de pacientes que alcanzan Buen Control* (BC) o Control Total** (CT) del asma durante los 12 meses de duración del estudio |
||||
|
Tratamiento previo al estudio |
Salmeterol/Fluticasona |
Propionato de fluticasona |
||
|
BC |
CT |
BC |
CT |
|
|
No CI (solo agonistas beta adrenérgicos de corta duración) |
78% |
50% |
70% |
40% |
|
Dosis bajas de CI (≤500 microgramos de dipropionato de beclometasona/día o equivalente) |
75% |
44% |
60% |
28% |
|
Dosis medias de CI (>500-1000 microgramos de dipropionato de beclometasona/día o equivalente). |
62% |
29% |
47% |
16% |
|
Resultados conjuntos en los 3 niveles de tratamiento |
71% |
41% |
59% |
28% |
|
* “Buen control” del asma: síntomas ocasionales , o utilización de agonistas ß2 de corta duración de acción, o menos del 80% de la función pulmonar predicha, sin despertares nocturnos, ni exacerbaciones ni efectos adversos que obliguen a modificar el tratamiento. ** “Control total” del asma: ausencia de síntomas, sin necesidad de utilizar agonistas ß2 de corta duración de acción, función pulmonar igual o superior al 80% de la predicha, sin despertares nocturnos, ni exacerbaciones ni efectos adversos que obliguen a modificar el tratamiento. |
||||
Los resultados de este estudio sugieren que 50/100 microgramos de SERETIDE® dos veces al día puede ser utilizado como terapia inicial de mantenimiento en pacientes con asma persistente moderado en los que se considere esencial alcanzar el control del asma rápidamente (ver Posología y forma de administración).
Se ha realizado un estudio doble ciego, randomizado, de grupos paralelos, de 318 pacientes con asma persistente, de edad igual o superior a 18 años, para evaluar la seguridad y tolerabilidad de la administración de dos inhalaciones dos veces al día (dosis dobles) de SERETIDE® durante dos semanas. Este estudio mostró que al doblar las dosis de cada concentración de SERETIDE® durante un máximo de 14 días se observa un pequeño aumento de acontecimientos adversos relacionados con el beta agonista [temblor: 1 paciente (1%) vs 0 pacientes; palpitaciones: 6 (3%) vs 1 (<1%); calambres musculares: 6 (3%) vs 1 (<1%)] y una incidencia similar de acontecimientos adversos relacionados con el corticosteroide inhalado [ej, candidiasis oral: 6 (6%) vs 16 (8%), ronquera: 2 (2%) vs 4 (2%)] cuando se compara con la pauta posológica habitual de una inhalación dos veces al día. Este pequeño aumento de acontecimientos adversos relacionados con el beta agonista debe tenerse en cuenta si se considera doblar la dosis de SERETIDE® en pacientes adultos que requieran terapia adicional con corticoides inhalados a corto plazo (hasta 14 días).
Ensayos clínicos con SERETIDE® en EPOC: TORCH ha sido un estudio de 3 años de duración para valorar el efecto del tratamiento con SERETIDE® ACCUHALER® 50/500 microgramos, dos veces al día, salmeterol Accuhaler® 50 microgramos dos veces al día, propionato de fluticasona (PF) Accuhaler® 500 microgramos dos veces al día o placebo sobre mortalidad por todas las causas en pacientes con EPOC. Los pacientes con EPOC con valores basales (pre-broncodilatador) de VEMS <60% del predicho fueron aleatorizados al tratamiento bajo doble ciego. Durante el estudio, a los pacientes se les permitió la terapia habitual de EPOC a excepción de otros corticosteroides inhalados, broncodilatadores de larga duración y corticosteroides sistémicos a largo plazo. Se determinó la supervivencia a los 3 años de todos los pacientes, con independencia de la posible retirada del estudio. El criterio de valoración primario fue la reducción de la mortalidad por todas las causas a los 3 años para SERETIDE® vs Placebo.
|
Placebo |
Salmeterol 50 |
PF 500 |
SERETIDE® 50/500 |
|
|
Mortalidad por todas las causas a los 3 años |
||||
|
Número de muertes (%) |
231 (15,2%) |
205 (13,5%) |
246 (16,0%) |
193 (12,6%) |
|
Cociente de riesgos vs placebo (ICs) valor p |
N/A |
0,879 (0,73; 1,06) |
1,060 (0,89; 1,27) |
0,825 (0,68; 1,00) |
|
Cociente de riesgos SERETIDE® 50/500 vs componentes (ICs) valor p |
N/A |
0,932 (0,77; 1,13) |
0,774 (0,64; 0,93) |
N/A |
|
1. Valor p no significativo después de ajustar para 2 análisis intermedios en la comparación de la valoración primaria de eficacia mediante un análisis log-rank, estratificado por la condición de fumador. |
||||
Hubo una tendencia hacia una mayor supervivencia en sujetos tratados con SERETIDE® comparado con placebo durante 3 años, sin embargo esta no logró el nivel de significación estadística p≤0,05.
El porcentaje de pacientes que murieron durante los 3 años debido a causas relacionadas con EPOC fue 6,0% para el placebo, 6,1% para el salmeterol, 6,9% para PF y 4,7% para SERETIDE®.
La media de exacerbaciones moderadas a graves por año disminuyó significativamente con SERETIDE® cuando se comparó con el tratamiento con salmeterol, PF y el placebo (tasa media en el grupo de SERETIDE® 0,85 comparado con 0,97 en el grupo de salmeterol, 0,93 en el grupo de PF y 1,13 en el placebo). Esto se traduce en una reducción en la tasa de exacerbaciones moderadas a graves del 25% (IC 95%: 19% a 31%; p<0,001) comparado con placebo, un 12% comparado con salmeterol (IC 95%: 5% a 19%, p=0,002) y 9% comparado con PF (IC 95%: 1% a 16%, p=0,024). Salmeterol y PF redujeron significativamente las tasas de exacerbación comparadas con placebo en un 15% (IC 95%: 7% a 22%; p<0,001) y 18% (IC 95%: 11% a 24%; p<0,001) respectivamente.
La Calidad de Vida Relacionada con la Salud, evaluada mediante el Cuestionario Respiratorio de St. George (SGRQ) mejoró con todos los tratamientos activos en comparación con placebo. La mejora media a los tres años para SERETIDE® comparado con placebo fue -3,1 unidades (IC 95%: -4,1 a -2,1; p<0,001), comparado con salmeterol fue -2,2 unidades (p<0,001) y comparado con PF fue -1,2 unidades (p=0,017). Una disminución de 4 unidades se considera clínicamente relevante.
La probabilidad estimada a 3 años de padecer neumonía, notificada como acontecimiento adverso, fue del 12,3% para el grupo placebo, 13,3% para salmeterol, 18,3% para PF y 19,6% para SERETIDE® (cociente de riesgos para SERETIDE® vs placebo: 1,64, IC 95%: 1,33 a 2,01, p<0,001). No hubo incremento de las muertes relacionadas con neumonía; el número de muertes atribuidas a neumonía mientras duró el tratamiento fue de 7 para el grupo placebo, 9 para salmeterol, 13 para PF y 8 para SERETIDE®. No se produjo una diferencia significativa en la probabilidad de fractura ósea (5,1% placebo, 5,1% salmeterol, 5,4% PF y 6,3% SERETIDE®; cociente de riesgos para SERETIDE® vs placebo: 1,22, IC 95%: 0,87 a 1,72, p=0,248).
Los ensayos clínicos controlados con placebo de 6 a 12 meses de duración han mostrado que el uso regular de SERETIDE® ACCUHALER® 50/500 microgramos mejora la función pulmonar y reduce la sensación de ahogo y la utilización de medicación de rescate.
Los estudios SCO40043 y SCO100250 fueron estudios aleatorizados, doble ciego, de grupos paralelos y duplicados que comparaban el efecto de SERETIDE® 50/250 microgramos dos veces al día (una dosis no autorizada para el tratamiento de la EPOC en la Unión Europea) con salmeterol 50 microgramos dos veces al día en la tasa anual de exacerbaciones moderadas/graves en pacientes con EPOC con VEMS inferior al 50% del teórico e historia de exacerbaciones. Las exacerbaciones moderadas/graves fueron definidas como empeoramiento de los síntomas que requirieron tratamiento con corticosteroides orales y/o antibióticos u hospitalización de los pacientes.
Los ensayos tuvieron un periodo de pre-inclusión de 4 semanas en el que todos los pacientes recibieron tratamiento abierto con salmeterol/PF 50/250 microgramos para estandarizar el tratamiento farmacológico de la EPOC y estabilizar la enfermedad antes de la aleatorización a la fase ciega de 52 semanas. Los pacientes fueron aleatorizados 1:1 con salmeterol/PF 50/250 microgramos (total ITT n=776) o salmeterol (total ITT n=778). Antes de la pre-inclusión, los pacientes suspendieron el uso de la medicación previa para la EPOC excepto los broncodilatadores de acción corta. El uso concomitante de broncodilatadores inhalados de acción prolongada (agonistas beta2 y anticolinérgicos), la combinación ipratropio/salbutamol, agonistas beta2 orales, y preparaciones con teofilina no fueron permitidos durante el periodo de tratamiento. Se permitió el uso de corticosteroides orales y antibióticos para el tratamiento agudo de las exacerbaciones de la EPOC según las directrices específicas para su uso. Los pacientes utilizaron salbutamol cuando fue necesario a lo largo de los estudios.
Los resultados de ambos estudios mostraron que el tratamiento con SERETIDE® 50/250 microgramos produjo una tasa anual de exacerbaciones moderadas/graves en pacientes con EPOC significativamente menor en comparación con salmeterol (SCO40043: 1,06 y 1,53 por paciente y año, respectivamente, razón de riesgos de 0,70, IC 95%: 0,58 a 0,83, p<0,001; SCO100250: 1,10 y 1,59 por paciente y año, respectivamente, razón de riesgos de 0,70, IC 95%: 0,58 a 0,83, p<0,001). Los hallazgos para las variables secundarias de eficacia (tiempo hasta la primera exacerbación moderada/grave, la tasa anual de exacerbaciones que requirieron corticosteroides orales, y VEMS previo a la dosis de la mañana (AM)) favorecieron significativamente a SERETIDE® 50/250 microgramos dos veces al día frente a salmeterol. El perfil de acontecimientos adversos fue similar con la excepción de una mayor incidencia de neumonías y efectos adversos locales conocidos (candidiasis y disfonía) en el grupo de SERETIDE® 50/250 microgramos dos veces al día en comparación con salmeterol. Los acontecimientos relacionados con neumonía fueron notificados para 55 pacientes (7%) en el grupo de SERETIDE® 50/250 microgramos dos veces al día y 25 (3%) en el grupo de salmeterol. El aumento de incidencia de neumonía notificada con SERETIDE® 50/250 microgramos dos veces al día parece ser de similar magnitud a la incidencia notificada en el estudio TORCH tras el tratamiento con SERETIDE® 50/500 microgramos dos veces al día.
“Salmeterol Multi-Center Asthma Research Trial” (SMART): El estudio SMART es un estudio multi-céntrico, randomizado, doble ciego, controlado con placebo en grupos paralelos, de 28 semanas de duración, realizado en EEUU, en el que se trataron aleatoriamente 13 176 pacientes con salmeterol (50 microgramos dos veces al día) y 13 179 pacientes con placebo, además de recibir su tratamiento habitual para el asma. Los pacientes fueron incluidos en el ensayo si tenían al menos 12 años, asma, y si actualmente estaban usando medicación para el asma (pero no LABAs). Se recogieron los datos del uso basal de corticosteroides inhalados en el momento de comenzar el estudio, aunque no era necesario para el mismo. El criterio de eficacia primario en el estudio SMART fue la determinación, de forma combinada, del número de muertes relacionadas con problemas respiratorios y de acontecimientos respiratorios con riesgo para la vida.
|
Hallazgos fundamentales del estudio SMART: Criterio de eficacia primario |
|||
|
Grupo de pacientes |
Número de criterios de eficacia primarios/Número de pacientes |
Riesgo relativo (intervalo de confianza 95%) |
|
|
Salmeterol |
Placebo |
||
|
Todos los pacientes |
50/13 176 |
36/13 179 |
1,40 |
|
Pacientes que utilizan corticosteroides inhalados |
23/6127 |
19/6138 |
1,21 |
|
Pacientes que no utilizan corticosteroides inhalados |
27/7049 |
17/7041 |
1,60 |
|
Pacientes afro-americanos |
20/2366 |
5/2319 |
4,10 |
|
El riesgo en negrita es estadísticamente significativo con un IC del 95%. |
|||
|
Hallazgos fundamentales del estudio SMART en función del uso de corticosteroides inhalados en el periodo basal: Criterios de eficacia secundarios |
|||
|
Número de criterios de eficacia secundarios/Número de pacientes |
Riesgo relativo (intervalo de confianza 95%) |
||
|
Salmeterol |
Placebo |
||
|
Muertes relacionadas con problemas respiratorios |
|||
|
Pacientes que utilizan corticosteroides inhalados |
10/6127 |
5/6138 |
2,01 |
|
Pacientes que no utilizan corticosteroides inhalados |
14/7049 |
6/7041 |
2,28 |
|
Combinación de muertes relacionadas con asma y acontecimientos respiratorios con riesgo para la vida |
|||
|
Pacientes que utilizan corticosteroides inhalados |
16/6127 |
13/6138 |
1,24 |
|
Pacientes que no utilizan corticosteroides inhalados |
21/7049 |
9/7041 |
2,39 |
|
Muertes relacionadas con el asma |
|||
|
Pacientes que utilizan corticosteroides inhalados |
4/6127 |
3/6138 |
1,35 |
|
Pacientes que no utilizan corticosteroides inhalados |
9/7049 |
0/7041 |
* |
|
*= No se puede calcular porque no hay acontecimientos en el grupo tratado con placebo. El riesgo en negrita es estadísticamente significativo con un IC del 95% .Los criterios de eficacia secundarios recogidos en la tabla son estadísticamente significativos en toda la población). Los criterios de eficacia secundarios combinados de todas las causas de muerte o acontecimientos con riesgo para la vida, todas las causas de muerte, o todas las causas de hospitalización, no alcanzaron significación estadística en toda la población. |
|||
Mecanismo de acción: SERETIDE® DISKUS® contiene salmeterol y propionato de fluticasona que tienen diferentes mecanismos de acción. A continuación se exponen los respectivos mecanismos de acción de ambos fármacos:
• Salmeterol: Salmeterol es un agonista selectivo de acción prolongada (12 horas) de los receptores beta-2 adrenérgicos, con una cadena lateral larga que se une a la zona externa del receptor.
Salmeterol da lugar a una broncodilatación más prolongada, que dura por lo menos 12 horas, en comparación con las dosis recomendadas para los agonistas de los receptores beta-2 adrenérgicos convencionales de corta duración de acción.
• Propionato de fluticasona: El propionato de fluticasona administrado por vía inhalatoria a las dosis recomendadas tiene una acción antiinflamatoria glucocorticoidea a nivel pulmonar que se traduce en una reducción de los síntomas y de las exacerbaciones del asma, sin las reacciones adversas observadas cuando los corticosteroides se administran por vía sistémica.
CONTRAINDICACIONES:
SERETIDE® DISKUS® está contraindicado en pacientes con hipersensibilidad (alergia) a cualquiera de los principios activos o al excipiente (ver Lista de excipientes).
FERTILIDAD, EMBARAZO Y LACTANCIA:
Fertilidad: No hay datos en humanos. Sin embargo, los estudios realizados en animales no mostraron efectos del salmeterol o propionato de fluticasona en la fertilidad.
Embarazo: Existen algunos datos en mujeres embarazadas (entre 300-1000 embarazos) que indican que salmeterol y propionato de fluticasona no producen malformaciones ni toxicidad fetal/neonatal. Los estudios realizados en animales han mostrado toxicidad para la reproducción tras la administración de agonistas de receptores beta-2-adrenérgicos y glucocorticosteroides (ver Datos preclínicos sobre seguridad).
Solo se debe considerar la administración de SERETIDE® DISKUS® a mujeres embarazadas si el beneficio esperado para la madre supera cualquier posible riesgo para el feto.
En mujeres embarazadas se debe utilizar la dosis mínima eficaz de propionato de fluticasona requerida para mantener un control adecuado del asma.
Lactancia: Se desconoce si salmeterol y propionato de fluticasona/metabolitos se excretan en la leche materna.
Los estudios han demostrado que salmeterol y propionato de fluticasona, y sus metabolitos, se excretan en la leche de ratas lactantes.
No se puede excluir el riesgo en recién nacidos lactantes/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con SERETIDE® DISKUS® tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
REACCIONES ADVERSAS:
Como SERETIDE® DISKUS® contiene salmeterol y propionato de fluticasona, es de esperar que aparezcan reacciones adversas de naturaleza y gravedad similares a las atribuidas a cada uno de los compuestos. No aparecen reacciones adversas adicionales tras la administración conjunta de los dos compuestos.
A continuación se indican las reacciones adversas asociadas con salmeterol/propionato de fluticasona, clasificadas por órganos y frecuencia. Las frecuencias se han definido de la siguiente forma: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1000 a <1/100), raras (≥1/10 000 a <1/1000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las frecuencias se han identificado a partir de los datos de ensayos clínicos. No se tuvo en cuenta la incidencia en el grupo placebo.
|
Clasificación de órganos |
Reacciones adversas |
Frecuencia |
|
Infecciones e infestaciones |
Candidiasis en la boca y garganta |
Frecuentes |
|
Neumonía |
Frecuentes1,3,5 |
|
|
Bronquitis |
Frecuentes1,3 |
|
|
Transtornos del sistema inmunológico |
Reacciones de hipersensibilidad con las siguientes manifestaciones: |
|
|
Reacciones de hipersensibilidad cutánea |
Poco frecuentes |
|
|
Angioedema (principalmente edema facial y orofaríngeo) |
Raras |
|
|
Síntomas respiratorios (disnea) |
Poco frecuentes |
|
|
Síntomas respiratorios (broncoespasmo) |
Raras |
|
|
Reacciones anafilácticas incluyendo shock anafiláctico |
Raras |
|
|
Transtornos endocrinos |
Síndrome de Cushing, aspecto cushingoide, supresión suprarrenal, retraso en el crecimiento de niños y adolescentes, disminución de la densidad mineral del hueso |
Raras4 |
|
Transtornos del metabolismo y de la nutrición |
Hipocaliemia |
Frecuentes3 |
|
Hiperglucemia |
Poco frecuentes4 |
|
|
Transtornos psiquiatrícos |
Ansiedad |
Poco frecuentes |
|
Trasntornos del sueño |
Poco frecuentes |
|
|
Cambios en el comportamiento, incluídos hiperactividad psicomotora e irritabilidad (predominante en niños) |
Raras |
|
|
Depresión, agresividad (predominantemente en niños) |
Fecuencia no conocida |
|
|
Transtornos del sistema nervioso |
Cefalea |
Muy frecuentes1 |
|
Temblor |
Poco frecuentes |
|
|
Transtornos oculares |
Cataratas |
Poco frecuentes |
|
Glaucoma |
Raras4 |
|
|
Transtornos cardíacos |
Palpitaciones |
Poco frecuentes |
|
Taquicardia |
Poco frecuentes |
|
|
Arritmias cardíacas (incluyendo, taquicardia supraventricular y extrasístoles) |
Raras |
|
|
Fibrilación auricular |
Poco frecuentes |
|
|
Angina de pecho |
Poco frecuentes |
|
|
Transtornos respiratorios, toráxicos y mediastínicos |
Nasofaringitis |
Muy frecuentes2,3 |
|
Irritación de garganta |
Frecuentes |
|
|
Ronquera/disfonía |
Frecuentes |
|
|
Sinusitis |
Frecuentes 1,3 |
|
|
Broncoespasmo paradójico |
Raras4 |
|
|
Transtornos de la piel y del tejido subcutáneo |
Contusiones |
Frecuentes1,3 |
|
Transtornos musculoesqueléticos y del tejido conjuntivo |
Calambres musculares |
Frecuentes |
|
Fracturas traumáticas |
Frecuentes1,3 |
|
|
Artralgia |
Frecuentes |
|
|
Mialgia |
Frecuentes |
|
|
1. Notificado frecuentemente con placebo. 2. Notificado muy frecuentemente con placebo. 3. Notificado durante un estudio de EPOC de 3 años. 4. Ver Advertencias y precauciones especiales de empleo. 5. Ver Propiedades farmacodinámicas. |
||
Descripción de algunas de las reacciones adversas: Se han comunicado las reacciones adversas farmacológicas de un tratamiento con un agonista beta-2, tales como temblor, palpitaciones y cefalea, pero tienden a ser transitorias y a disminuir con el tratamiento regular.
Debido al componente propionato de fluticasona, algunos pacientes pueden padecer ronquera y candidiasis (afta) en boca y garganta. Tanto la ronquera como la incidencia de candidiasis pueden aliviarse haciendo gargarismos con agua tras utilizar este producto. La candidiasis sintomática puede tratarse mediante una terapia antifúngica tópica mientras se continúa el tratamiento con SERETIDE® DISKUS®.
Población pediátrica: Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoide, supresión suprarrenal y retraso en el crecimiento de niños y adolescentes (ver Advertencias y precauciones especiales de empleo). Los niños también pueden experimentar ansiedad, trastornos del sueño y cambios en el comportamiento, incluidos hiperactividad e irritabilidad.
INCOMPATIBILIDADES: No aplicable.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
• Debe evitarse la utilización de fármacos beta bloqueantes tanto selectivos como no selectivos a menos que haya razones que obliguen a ello.
• El uso concomitante de otros fármacos que contengan agonistas beta adrenérgicos puede tener un efecto potencialmente aditivo.
Propionato de fluticasona: En circunstancias normales, se obtienen bajas concentraciones plasmáticas de propionato de fluticasona después de la inhalación, debido a un intenso metabolismo de primer paso hepático y a un alto aclaramiento sistémico producido por el citocromo P450 3A4 en el intestino e hígado. Por lo tanto, es improbable que se produzcan interacciones medicamentosas clínicamente significativas en las que intervenga el propionato de fluticasona.
En un estudio sobre interacción llevado a cabo con propionato de fluticasona intranasal en sujetos sanos, se ha demostrado que 100 mg dos veces al día de ritonavir (potente inhibidor del citocromo P450 3A4) puede aumentar varios cientos de veces las concentraciones de propionato de fluticasona en plasma, originando unas concentraciones de cortisol sérico marcadamente reducidas. Se carece de información relativa a esta interacción para el propionato de fluticasona inhalado, pero se espera un importante aumento en los niveles plasmáticos de propionato de fluticasona. Se han notificado casos de síndrome de Cushing y de supresión suprarrenal. Debería evitarse el uso de la combinación, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo glucocorticoide.
En un pequeño estudio realizado en voluntarios sanos, ketoconazol, inhibidor ligeramente menos potente del CYP3A, produjo un aumento de la exposición de propionato de fluticasona tras una única inhalación del 150%. Esto produjo una mayor reducción de los niveles de cortisol plasmático en comparación con el propionato de fluticasona solo. También se espera que el tratamiento concomitante con otros inhibidores potentes del CYP3A, como itraconazol, aumente la exposición sistémica de propionato de fluticasona y el riesgo de efectos adversos sistémicos. Se recomienda tener precaución y evitar, en la medida de lo posible, el tratamiento a largo plazo con estos fármacos.
Salmeterol:
• Inhibidores potentes del CYP3A4: La administración conjunta de ketoconazol (400 mg una vez al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 7 días, produjo un aumento significativo de la exposición de salmeterol en plasma (1,4 veces la Cmáx y 15 veces el AUC). Esto puede conducir a un aumento de la incidencia de otros efectos sistémicos del tratamiento con salmeterol (p.ej. prolongación del intervalo QTc y palpitaciones) en comparación con el tratamiento con salmeterol o ketoconazol solo (ver Advertencias y precauciones especiales de empleo).
No se han observado efectos clínicamente significativos sobre la presión sanguínea, la frecuencia cardiaca y los niveles de potasio y glucosa en sangre. La administración concomitante con ketoconazol no aumentó la semivida de eliminación de salmeterol ni aumentó la acumulación de salmeterol con dosis repetidas.
Se debe evitar la administración concomitante de ketoconazol, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos adversos sistémicos del tratamiento con salmeterol. Es probable que exista un riesgo similar de interacción con otros inhibidores potentes del CYP3A4 (p.ej. itraconazol, telitromicina, ritonavir).
• Inhibidores moderados del CYP3A4: La administración conjunta de eritromicina (500 mg tres veces al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 6 días produjo un aumento pequeño, pero no estadísticamente significativo, de la exposición de salmeterol (1,4 veces la Cmáx y 1,2 veces el AUC). La administración concomitante con eritromicina no se asoció con ningún efecto adverso grave.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
El único aspecto importante acerca de la seguridad del uso en humanos procedente de los estudios realizados con animales con xinafoato de salmeterol y propionato de fluticasona administrados por separado, fue la aparición de efectos atribuidos a acciones farmacológicas exageradas.
En los estudios de reproducción con animales, los glucocorticosteroides han demostrado inducir malformaciones (paladar hendido, malformaciones esqueléticas). Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para humanos a las dosis recomendadas. Los estudios realizados en animales con xinafoato de salmeterol han mostrado la aparición de toxicidad embriofetal solamente con niveles de exposición elevados. Tras la administración conjunta, se hallaron mayores incidencias de transposición de la arteria umbilical y de osificación incompleta del hueso occipital en ratas que recibieron dosis asociadas a anormalidades conocidas inducidas por glucocorticoides.
RECOMENDACIONES: No emplear este producto una vez que haya sobrepasado la fecha de expiración señalada en el empaque.
Cualquier aclaración sobre la utilización del producto consultar a su médico o al farmacéutico.
Basado en: AEMPS Abril 2013, GDS 30 (08 de Mayo 2012)
SERETIDE® DISKUS® es una marca comercial del grupo de compañías GlaxoSmithKline
GLAXOSMITHKLINE PERÚ S.A.
Av. Javier Prado Oeste 995, San Isidro
Telf.: 211-9700 Fax: 211-9717
Lima 27-Perú
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
• SERETIDE® DISKUS® no debe utilizarse para el tratamiento de los síntomas agudos del asma para los que se requiere el uso de un broncodilatador de inicio rápido y corta duración de acción. Se advertirá a los pacientes que dispongan de su medicación para el alivio de sus síntomas en un ataque agudo de asma en todo momento.
• Los pacientes no deben iniciar el tratamiento con SERETIDE® DISKUS® durante una exacerbación, o si están sufriendo un empeoramiento significativo o un deterioro agudo del asma.
• Durante el tratamiento con SERETIDE® DISKUS® pueden producirse acontecimientos adversos graves relacionados con el asma y exacerbaciones. Se debe pedir a los pacientes que continúen el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran tras comenzar el tratamiento con SERETIDE® DISKUS®.
• La utilización creciente de broncodilatadores de corta duración de acción para aliviar los síntomas indica un empeoramiento en el control y los pacientes deben ser examinados por un médico.
• Un empeoramiento repentino y progresivo en el control del asma puede poner en peligro la vida del paciente, por lo que se le debe hacer una evaluación inmediata. Debe considerarse el hecho de aumentar la terapia corticosteroidea.
• Una vez que se hayan controlado los síntomas del asma, se puede tener en cuenta la posibilidad de reducir gradualmente la dosis de SERETIDE® DISKUS®. Es importante controlar de forma regular a los pacientes a los que se les está disminuyendo el tratamiento. Debe utilizarse la dosis mínima eficaz de SERETIDE® DISKUS® (ver Posología y forma de administración).
• Para los pacientes con EPOC que padecen exacerbaciones, normalmente está indicado un tratamiento con corticosteroides sistémicos, por lo que se les debe indicar a los pacientes que soliciten atención médica si notan que los síntomas empeoran con SERETIDE® DISKUS®.
• El tratamiento con SERETIDE® DISKUS® no debe suspenderse bruscamente en pacientes con asma debido al riesgo de aparición de exacerbaciones. Debe realizarse un ajuste descendente de la dosis bajo supervisión médica. Los pacientes con EPOC que suspendan el tratamiento pueden sufrir una descompensación de los síntomas y deben ser supervisados por un médico.
• Como en el caso de todos los medicamentos administrados por vía inhalatoria que contienen corticosteroides, SERETIDE® DISKUS® se administrará con precaución a pacientes con tuberculosis pulmonar.
• Raramente, SERETIDE® DISKUS® puede causar arritmias cardiacas, tales como taquicardia supraventricular, extrasístoles y fibrilación auricular, y un leve descenso transitorio de los niveles de potasio en sangre a dosis terapéuticas elevadas. Por este motivo, SERETIDE® DISKUS® debe emplearse con precaución en pacientes con alteraciones cardiovasculares graves, alteraciones del ritmo cardiaco, diabetes mellitus, tirotoxicosis, hipocaliemia no corregida o en pacientes con predisposición a tener niveles bajos de potasio en sangre.
• Se han notificado casos muy raros de aumento de los niveles de glucosa en sangre (ver Reacciones adversas), lo cual debe tenerse en cuenta cuando se prescriba a pacientes con antecedentes de diabetes mellitus.
• Al igual que con otros tratamientos de administración por vía inhalatoria, puede aparecer broncoespasmo paradójico, aumentando de forma inmediata la sibilancia tras la administración. Debe interrumpirse inmediatamente la administración de SERETIDE® DISKUS®, examinar al paciente e instituir una terapia alternativa si fuera necesario.
• SERETIDE® DISKUS® contiene hasta 12,5 miligramos/dosis de lactosa. Puede provocar reacciones alérgicas en pacientes con alergia a la proteína de la leche de vaca. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben usar este medicamento.
• Pueden aparecer efectos sistémicos con cualquier corticosteroide administrado por vía inhalatoria, especialmente a dosis elevadas prescritas durante largos periodos. La probabilidad de que estos efectos aparezcan es mucho menor que con corticosteroides administrados por vía oral. Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, disminución de la densidad mineral del hueso, cataratas y glaucoma y más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños). Por lo tanto, es importante someter a los pacientes a controles periódicos y reducir la dosis de corticosteroide inhalado a la dosis mínima con la que se mantenga un control eficaz del asma.
• El tratamiento prolongado con altas dosis de corticosteroides inhalados puede causar supresión suprarrenal y crisis suprarrenal aguda. Se han descrito casos muy raros de supresión suprarrenal y crisis suprarrenal aguda con dosis de propionato de fluticasona superiores a 500 microgramos e inferiores a 1000 microgramos. Las situaciones que podrían potencialmente desencadenar una crisis suprarrenal aguda, incluyen trauma, cirugía, infección o cualquier reducción rápida de la dosis. Los síntomas que aparecen son habitualmente vagos y pueden incluir anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, hipotensión, disminución del nivel de conciencia, hipoglucemia y convulsiones. Se debe considerar la administración adicional de corticosteroides por vía sistémica durante periodos de estrés o cirugía electiva.
• Los beneficios del tratamiento con propionato de fluticasona por vía inhalatoria deben reducir la necesidad de administrar esteroides por vía oral, pero los pacientes transferidos que recibían terapia con esteroides por vía oral pueden seguir estando en situación de riesgo de alteración de la reserva suprarrenal durante un tiempo considerable. Los pacientes que han requerido una terapia corticosteroidea de emergencia con dosis altas en el pasado, pueden también estar en situación de riesgo. Esta posibilidad de alteración residual deberá siempre tenerse en cuenta en situaciones de emergencia y electivas que probablemente produzcan estrés, debiéndose considerar la instauración de un tratamiento corticosteroideo apropiado. El grado de insuficiencia suprarrenal puede requerir el consejo de un especialista antes de los procedimientos electivos.
• Ritonavir puede aumentar de manera considerable las concentraciones de propionato de fluticasona en plasma. Por lo tanto, debería evitarse el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo corticosteroide. También hay un aumento del riesgo de que aparezcan efectos adversos sistémicos cuando se combina el propionato de fluticasona con otros inhibidores potentes del CYP3A (ver Interacción con otros medicamentos y otras formas de interacción).
• Hubo un aumento de notificaciones de infecciones de las vías respiratorias bajas (especialmente neumonía y bronquitis) en el estudio TORCH en pacientes con EPOC que recibieron SERETIDE® 50/500 microgramos dos veces al día comparado con placebo así como en los estudios SCO40043 y SCO100250 que comparan una dosis más baja de SERETIDE® no autorizada para el tratamiento de la EPOC, 50/250 microgramos dos veces al día, con 50 microgramos de salmeterol solo dos veces al día (ver Reacciones adversas y Propiedades farmacodinámicas). En todos los estudios se observó una incidencia de neumonía similar en el grupo SERETIDE®. En el estudio TORCH, los pacientes de edad avanzada, pacientes con un índice de masa corporal bajo (<25 kg/m2) y los pacientes clasificados como muy graves (VEMS<30% del normal) tuvieron mayor riesgo de desarrollar neumonía con independencia del tratamiento. Los médicos deben permanecer alerta ante el posible desarrollo de neumonía y otras infecciones de las vías respiratorias bajas en pacientes con EPOC, ya que las características clínicas de tales infecciones se superponen con frecuencia con las de las exacerbaciones. Si un paciente con EPOC grave ha experimentado neumonía, se debe reevaluar el tratamiento con SERETIDE® DISKUS®.
• Los datos de un amplio ensayo clínico (“Salmeterol Multi-Center Asthma Research Trial”, SMART) sugirieron que los pacientes afro-americanos presentaban un mayor riesgo de padecer acontecimientos graves relacionados con el sistema respiratorio o de muertes durante la utilización de salmeterol en comparación con placebo (ver Propiedades farmacodinámicas). No se conoce si era debido a factores farmacogenéticos u otros factores. Por lo tanto, se debe pedir a los pacientes con ascendencia africana o afro-caribeña que continúen con el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran durante el tratamiento con SERETIDE® DISKUS®.
• El uso concomitante de ketoconazol por vía sistémica aumenta significativamente la exposición sistémica a salmeterol. Esto puede conducir a un aumento de la incidencia de los efectos sistémicos (p.ej. prolongación del intervalo QTc y palpitaciones). Por tanto, se debe evitar el uso concomitante de ketoconazol u otros inhibidores potentes del CYP3A4, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos adversos sistémicos del tratamiento con salmeterol (ver Interacción con otros medicamentos y otras formas de interacción).
Población pediátrica: Los niños y adolescentes menores de 16 años que reciben dosis altas de propionato de fluticasona (habitualmente ≥1000 microgramos/día) pueden estar, en particular, en situación de riesgo. Pueden aparecer efectos sistémicos, especialmente a dosis elevadas prescritas durante largos periodos. Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, crisis suprarrenal aguda y retraso en el crecimiento de niños y adolescentes y más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad.
Se recomienda controlar de forma regular la altura de los niños que reciben tratamiento prolongado con corticosteroides inhalados. Se debe reducir la dosis de corticosteroide inhalado a la dosis mínima con la que se mantenga un control eficaz del asma.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN Y OTRAS MANIPULACIONES:
El inhalador DISKUS® libera un polvo que se inhala en los pulmones.
Un indicador de dosis en el DISKUS® señala el número de dosis que quedan.
Para disponer de instrucciones detalladas ver Instrucciones para su uso.
INSTRUCCIONES PARA SU USO:
Su médico, enfermera o farmacéutico deberán enseñarle cómo utilizar su DISKUS®. Periódicamente deberían verificar cómo lo utiliza. El no utilizar SERETIDE® DISKUS® apropiadamente ni como se le ha prescrito, puede tener como resultado que su asma o EPOC no mejore como debiera.
El inhalador DISKUS® libera un polvo que se inhala en los pulmones.
El inhalador DISKUS® se abre y se prepara deslizando la palanca. Luego, se coloca la boquilla en la boca y se cierran los labios a su alrededor. Después, la dosis puede ser inhalada y el inhalador DISKUS®, cerrado.
Un contador de dosis en el DISKUS® indica el número de dosis que quedan.
Instrucciones para el uso de su SERETIDE® DISKUS®
• Cerrado: Cuando usted saca su DISKUS® de su caja, éste estará en posición cerrada.
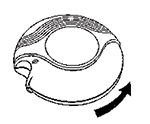
• Abierto: Un DISKUS® nuevo contiene 60 dosis de su medicamento, en forma de polvo y protegidas de manera individual. El contador de dosis le indica cuántas dosis quedan disponibles.
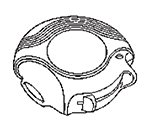
Cada dosis es medida en forma precisa y está protegida higiénicamente. No requiere mantenimiento ni recarga.
El contador de dosis en la parte superior de su DISKUS® le informa cuantas dosis quedan disponibles.
Para advertirle cuando sólo queden unas cuantas dosis, los números del 5 al 0 aparecerán en rojo. Una vez que el contador marca 0 , su inhalador estará vacio.
El DISKUS® es fácil de usar. Cuando necesite una dosis, simplemente siga los cuatro pasos sencillos que aparecen en las ilustraciones:
1. Abrir
2. Deslizar
3. Inhalar
4. Cerrar
Como funciona su DISKUS®
Al deslizar la palanca de su DISKUS®, se abre un pequeño orificio en la boquilla y se libera una dosis para que usted pueda inhalarla. Cuando cierra su DISKUS®, la palanca regresa automáticamente a su posición original, quedando lista para cuando requiera la próxima dosis. La cubierta exterior protege su DISKUS® cuando no lo esté usando.
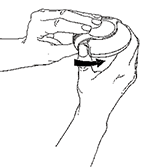
1. Abrir
Para abrir su DISKUS®, sostenga la cubierta exterior con una mano y ponga el pulgar de su otra mano en el apoyo diseñado para este dedo. Empujar con el dedo, alejándolo de usted , hasta donde llegue. Oira un “clic”. Esto dejará al descubierto la boquilla.
2. Deslizar
Sostenga su DISKUS® con la boquilla apuntando hacia usted. Empuje la palanca alejándola de usted, hasta donde llegue. Esto colocará la dosis de medicamento en la boquilla.
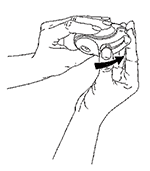
Cada vez que usted empuja la palanca, se prepara una dosis para inhalación. Esto es señalado por el contador de dosis. No juegue con la palanca pues esto libera dosis que serán desperdiciadas.
3. Inhalar
• Antes que empiece a inhalar la dosis, lea detenidamente esta sección.
• Sostenga el DISKUS® alejado de su boca. Expulse el aire hasta donde pueda sin sentirse mal. Recuerde que nunca debe exhalar dentro de su DISKUS®.
• Ponga la boquilla en sus labios. Inhale en forma constante y profunda a través del DISKUS®, no por la nariz.
• Retire el DISKUS® de su boca.
• Contenga la respiración aproximadamente 10 segundos o durante tanto tiempo como pueda hacerlo sin sentirse mal.
• Expulse el aire lentamente.
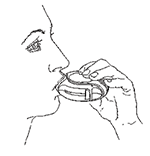
Después enjuague su boca con agua y escúpala. Esto puede ayudarle a prevenir ulceraciones en la boca y ronquera.
4. Cerrar
Para cerrar su DISKUS®, ponga su pulgar en el apoyo diseñado para este dedo y deslícelo hacia usted hasta donde llegue. Oirá un “clic”.
La palanca vuelve automáticamente a su posición original. Ahora, su DISKUS® está listo para que lo use otra vez.
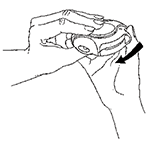
Si le han dado instrucciones de que tome dos inhalaciones, debe cerrar el DISKUS® y repetir los pasos 1 a 4.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
SERETIDE® DISKUS® se administrará solamente por vía inhalatoria.
Se hará saber a los pacientes que deben usar diariamente SERETIDE® DISKUS®, a fin de obtener un beneficio óptimo, aun cuando no tengan síntomas.
Los pacientes deben ser reevaluados regularmente por un médico, de manera que la concentración de SERETIDE® DISKUS® que reciban siga siendo la óptima y sólo se modifique por consejo médico. Debe ajustarse la dosis a fin de que se administre la más baja con la que se mantenga un control eficaz de los síntomas. Cuando el control de los síntomas se mantenga con la concentración más baja de la combinación administrada dos veces al día, entonces el siguiente paso podría consistir en probar el tratamiento exclusivamente con un corticosteroide por vía inhalatoria. Como alternativa, aquellos pacientes que precisaran de un agonista ß2 de acción prolongada podrían recibir SERETIDE® DISKUS® una vez al día si, a criterio de su médico, éste fuera el tratamiento adecuado para mantener el control de la enfermedad. En caso que la pauta posológica de una vez al día se administre a un paciente con antecedentes de síntomas nocturnos, la dosis debe ser administrada por la noche, mientras que si el paciente presenta un historial de síntomas principalmente diurnos, la dosis debe administrarse por la mañana.
Los pacientes deben recibir la dosis de SERETIDE® DISKUS® que contenga la cantidad apropiada de propionato de fluticasona adecuada a la gravedad de su enfermedad. Los médicos deben conocer que, en pacientes con asma, el propionato de fluticasona es tan eficaz como otros esteroides inhalados a la mitad aproximadamente de la dosis diaria en microgramos. Por ejemplo, 100 microgramos de propionato de fluticasona equivalen aproximadamente a 200 microgramos de dipropionato de beclometasona (conteniendo CFC) o budesonida. Si un paciente individual necesitara una posología no incluida en el régimen recomendado, se deberán prescribir las dosis apropiadas de beta-agonista y/o corticosteroide.
Dosis recomendadas:
• Asma:
— Adultos y adolescentes de 12 años en adelante:
— Una inhalación de 50 microgramos de salmeterol y 100 microgramos de propionato de fluticasona dos veces al día o bien:
— Una inhalación de 50 microgramos de salmeterol y 250 microgramos de propionato de fluticasona dos veces al día o bien:
— Una inhalación de 50 microgramos de salmeterol y 500 microgramos de propionato de fluticasona dos veces al día.
Se puede probar, durante un periodo de tiempo limitado, la utilización de SERETIDE® DISKUS® como terapia inicial de mantenimiento en adultos y adolescentes con asma persistente moderada (definidos como pacientes con síntomas diarios, utilización de medicación de rescate diaria y obstrucción de las vías respiratorias de moderada a grave) para los que es esencial un control rápido del asma. En estos casos, la dosis inicial recomendada es una inhalación de 50 microgramos de salmeterol y 100 microgramos de propionato de fluticasona dos veces al día. Una vez que se ha alcanzado el control del asma, se debe revisar el tratamiento y considerar si los pacientes deben ser tratados con corticosteroides inhalados únicamente. Es importante controlar de forma regular a los pacientes a los que se les esté disminuyendo el tratamiento.
No se ha observado un beneficio claro al compararlo con propionato de fluticasona inhalado solo, usado como terapia inicial de mantenimiento, cuando no se cumplen uno o dos de los criterios de gravedad. En general los corticosteroides inhalados continúan como primera línea de tratamiento para la mayoría de los pacientes. SERETIDE® DISKUS® no está destinado al tratamiento inicial del asma leve. SERETIDE® DISKUS® en dosis de 50 mcg+100 mcg, no es apropiado en adultos y niños con asma grave; se recomienda establecer la dosis apropiada de corticosteroides inhalados antes de utilizar cualquier combinación fija en pacientes con asma grave.
• Niños de 4 años en adelante: Una inhalación de 50 microgramos de salmeterol y 100 microgramos de propionato de fluticasona dos veces al día.
La dosis máxima permitida en niños es de 100 microgramos de propionato de fluticasona dos veces al día.
No se dispone de datos acerca del uso de SERETIDE® DISKUS® en niños menores de 4 años.
EPOC:
• Adultos: Una inhalación de 50 microgramos de salmeterol y 500 microgramos de propionato de fluticasona dos veces al día.
Grupos especiales de pacientes: No es necesario ajustar la dosis en pacientes ancianos o en aquéllos con insuficiencia renal. No se dispone de datos para usar SERETIDE® DISKUS® en pacientes con insuficiencia hepática.
Utilización del inhalador DISKUS®: El dispositivo se abre y se prepara deslizando la palanca. La boquilla se coloca entonces en la boca y se cierran los labios a su alrededor. La dosis puede inhalarse a continuación. Posteriormente cerrar el dispositivo.
RECUERDE
• Mantener seco su DISKUS®.
• Mantenerlo cerrado cuando no lo use.
• Nunca exhalar dentro de su DISKUS®.
• Deslizar solamente la palanca cuando esté listo para tomar una dosis.
• No inhalar una dosis mayor a la indicada.
• Mantenerlo fuera del alcance de los niños.
SOBREDOSIS:
No se dispone de datos procedentes de ensayos clínicos relativos a la sobredosis con SERETIDE® DISKUS®; no obstante, a continuación se facilitan datos acerca de la sobredosis con ambos fármacos:
Los signos y síntomas de una sobredosis con salmeterol son temblor, cefalea, y taquicardia. Los antídotos preferidos son fármacos bloqueantes beta adrenérgicos cardioselectivos, los cuales deben usarse con precaución en pacientes con antecedentes de broncoespasmo. Si el tratamiento con SERETIDE® DISKUS® ha de interrumpirse debido a una sobredosis del componente agonista beta, debe considerarse la administración de un tratamiento esteroideo de sustitución adecuado. También puede aparecer hipocaliemia y debe considerarse la reposición de potasio.
Aguda: La inhalación de forma aguda de dosis de propionato de fluticasona, superiores a las recomendadas, puede conducir a una supresión temporal de la función suprarrenal. Esto no hace necesario tomar ninguna acción de emergencia ya que la función suprarrenal se recupera en algunos días, como se comprueba en las determinaciones de cortisol en plasma.
Sobredosificación crónica de propionato de fluticasona inhalado: Ver Advertencias y precauciones especiales de empleo: Riesgo de supresión suprarrenal. Puede ser necesario realizar un seguimiento de la reserva suprarrenal. En casos de sobredosificación de propionato de fluticasona, puede continuarse la terapia con SERETIDE® DISKUS® con una posología adecuada para el control de los síntomas.
NATURALEZA Y CONTENIDO DEL ENVASE:
Caja conteniendo dispositivo de plástico (inhalador DISKUS®) con polvo para inhalación x 60 dosis en tira de PVC/Al/OPA-Al/PET/Papel.
PERIODO DE VALIDEZ: 18 meses.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: Consérvese a temperatura no mayor a 30 °C.