
PIEMONTE
MONTELUKAST
Comprimidos masticables
Caja, Blíster, 30 Comprimidos masticables, 4 Miligramos
Caja, Blíster, 30 Comprimidos masticables, 5 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
PIEMONTE 4 mg:
Cada COMPRIMIDO MASTICABLE contiene:
Montelukast 4,0 mg
(Como montelukast sódico)
Excipientes c.s.p. 1 comprimido masticable
PIEMONTE 5 mg:
Cada COMPRIMIDO MASTICABLE contiene:
Montelukast 5,0 mg
(Como montelukast sódico)
Excipientes c.s.p. 1 comprimido masticable
Para consultar la lista completa de excipientes, ver Lista de excipientes.
FORMA FARMACÉUTICA:
Comprimido masticable.
INDICACIONES TERAPÉUTICAS:
Asma: Montelukast está indicado para la profilaxis y el tratamiento crónico del asma en adultos y pacientes pediátricos de 12 meses de edad o mayores.
Broncoconstricción inducida por el ejercicio (BIE): Montelukast está indicado para la prevención de broncoconstricción inducida por el ejercicio (BIE) en pacientes de 6 años de edad o mayores.
Rinitis alérgica: Montelukast está indicado para el alivio de los síntomas de la rinitis alérgica estacional en pacientes de 2 años de edad y mayores, y rinitis alérgica perenne en pacientes de 6 meses de edad o mayores.
DATOS FARMACÉUTICOS:
Lista de excipientes:
• PIEMONTE 4 mg comprimido masticable: Povidona, lactosa monohidrato, crospovidona (o povidona Crosslinked), Ludiflash (polivinilacetato + povidona + crospovidona + D-manitol), croscarmelosa sódica, óxido férrico, sucralosa, aroma de cereza, manitol, alcohol etílico y estearato de magnesio.
• PIEMONTE 5 mg comprimido masticable: Povidona, Lactosa, crospovidona (o povidona Crosslinked), ludiflash CD (polivinilacetato + povidona+crospovidona+D-manitol), croscarmelosa sódica, óxido de hierro rojo, sucralosa, aroma artificial de cereza silvestre, manitol, alcohol etílico y estearato de magnesio.
Incompatibilidades: No aplica.
Periodo de validez: Consumir antes de la fecha de expira indicada en el envase.
Precauciones especiales de conservación: Conservar a temperatura entre 15 °C y 30 °C.
Proteger de la luz y humedad.
Importado por:
EUROFARMA PERÚ S.A.C.
Av. Bolivia N° 1161 Breña, Lima - Perú.
Teléfono: 610-3100
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Otros agentes contra padecimientos obstructivos de las vías respiratorias, antagonistas de los receptores de leucotrienos.
Código ATC: R03DC03
Montelukast sódico, el ingrediente activo de PIEMONTE, es un antagonista selectivo y oralmente activo del receptor de leucotrieno que inhibe el receptor CysLT1 de los leucotrienos cisteinílicos.
El montelukast sódico se describe químicamente como [R-(E)]-1-[[[1-[3-[2-(7-cloro-2- quinolinil) etenil]fenil]-3-[2-(1- hidroxi-1- metiletil)fenil]propil]tio]metil]ácido ciclopropano, sal monosódica.
La fórmula bruta es C35H35ClNNaO3S, y su peso molecular es 608.18. La fórmula estructural es:
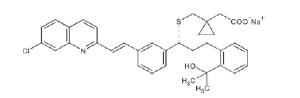
Montelukast sódico es un polvo higroscópico, ópticamente activo, de color blanco a blanquecino. Montelukast sódico es fácilmente soluble en etanol, metanol y agua y prácticamente insoluble en acetonitrilo.
CONTRAINDICACIONES:
Montelukast está contraindicado en pacientes con: Hipersensibilidad a cualquier componente de este producto.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
No aplica.
REACCIONES ADVERSAS:
Experiencia en ensayos clínicos: Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacción adversa observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco, y no pueden reflejar las tasas observadas en la práctica clínica. En la siguiente descripción de la experiencia de ensayos clínicos se enumeran las reacciones adversas, independientemente de la evaluación de la causalidad.
Las reacciones adversas más frecuentes (incidencia ≥ 5% y mayor que el placebo, enumeradas en orden descendente de frecuencia) en ensayos clínicos controlados fueron: infección respiratoria superior, fiebre, dolor de cabeza, faringitis, tos, dolor abdominal, diarrea, otitis media, influenza, rinorrea, sinusitis, otitis.
Adultos y adolescentes con asma de 15 años de edad y mayores: Montelukast ha sido evaluado por seguridad en ensayos clínicos en aproximadamente 2950 pacientes adultos y adolescentes de 15 años de edad y mayores. En los ensayos clínicos controlados con placebo, las siguientes experiencias adversas reportadas con montelukast ocurrieron en mayor o igual medida al 1% de pacientes y con una incidencia mayor que en los pacientes tratados con placebo:
|
Tabla 1. Experiencias adversas que ocurren en ≥1% de los pacientes con una incidencia mayor que en los pacientes tratados con placebo |
||
|
Montelukast 10 mg/día (%) (n=1955) |
Placebo (%) (n=1180) |
|
|
El cuerpo como un todo |
||
|
Dolor, abdominal |
2.9 |
2.5 |
|
Astenia/fatiga |
1.8 |
1.2 |
|
Fiebre |
1.5 |
0.9 |
|
Trauma |
1.0 |
0.8 |
|
Desordenes del sistema digestivo |
||
|
Dispepsia |
2.1 |
1.1 |
|
Dolor, dental |
1.7 |
1.0 |
|
Gastroenteritis, infecciosa |
1.5 |
0.5 |
|
Sistema nervioso/psiquiátrico |
||
|
Dolor de cabeza |
18.4 |
18.1 |
|
Mareos |
1.9 |
1.4 |
|
Desórdenes del sistema respiratorio |
||
|
Influenza |
4.2 |
3.9 |
|
Tos |
2.7 |
2.4 |
|
Congestión, nasal |
1.6 |
1.3 |
|
Piel/Trastornos de los apéndices de la piel |
||
|
Salpullido |
1.6 |
1.2 |
|
Experiencias adversas de laboratorio* |
||
|
Aumento de ALT |
2.1 |
2.0 |
|
Aumento de AST |
1.6 |
1.2 |
|
Piuria |
1.0 |
0.9 |
|
*Número de pacientes evaluados (Montelukast y placebo, respectivamente): ALT y AST, 1935, 1170; piuria, 1924, 1159. |
||
La frecuencia de efectos adversos menos comunes fue comparable entre montelukast y placebo. El perfil de seguridad de montelukast, cuando se administró como una dosis única para la prevención del BIE en pacientes adultos y adolescentes de 15 años de edad o mayores, era compatible con el perfil de seguridad descrito anteriormente para montelukast.
De manera acumulativa, 569 pacientes fueron tratados con montelukast durante al menos 6 meses, 480 durante un año y 49 durante dos años en ensayos clínicos. El perfil de experiencia adversa no cambió significativamente con el tratamiento prolongado.
Pacientes pediátricos con asma de 6 a 14 años de edad: Montelukast ha sido evaluado por seguridad en 476 pacientes pediátricos de 6 a 14 años de edad. De manera acumulada, 289 pacientes pediátricos fueron tratados con montelukast durante al menos 6 meses y 241 durante un año o más en ensayos clínicos. El perfil de seguridad de montelukast en el ensayo de eficacia pediátrica, doble ciego de 8 semanas, fue generalmente similar al perfil de seguridad para adultos. En pacientes pediátricos de 6 a 14 años de edad que recibieron montelukast se produjeron los siguientes efectos con una frecuencia ≥ 2% y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: faringitis, influenza, fiebre, sinusitis, náuseas, diarrea, dispepsia, otitis, infección viral y laringitis. La frecuencia de eventos adversos menos comunes fue comparable entre montelukast y placebo. Con el tratamiento prolongado, el perfil de experiencia adversa no cambió significativamente.
Cuando el perfil de seguridad de montelukast se administró como una dosis única para la prevención de BIE en pacientes pediátricos de 6 años de edad y mayores era compatible con el perfil de seguridad descrito anteriormente para montelukast.
En los estudios que evaluaron la tasa de crecimiento, el perfil de seguridad en estos pacientes pediátricos fue compatible con el perfil de seguridad previamente descrito para montelukast. En un estudio doble ciego de 56 semanas que evaluó la tasa de crecimiento en pacientes pediátricos de 6 a 8 años de edad que recibieron montelukast, los siguientes efectos no observados previamente con el uso de montelukast en este grupo de edad ocurrieron con una frecuencia ≥2% y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: dolor de cabeza, rinitis (infecciosa), varicela, gastroenteritis, dermatitis atópica, bronquitis aguda, infección dental, infección de la piel y miopía.
Pacientes pediátricos con asma de 2 a 5 años de edad: Se ha evaluado la seguridad de montelukast en 573 pacientes pediátricos de 2 a 5 años de edad en estudios de dosis única y múltiple. De manera acumulada, 426 pacientes pediátricos de 2 a 5 años de edad fueron tratados con montelukast durante por lo menos 3 meses, 230 por 6 meses o más, y 63 pacientes durante un año o más en ensayos clínicos. Los siguientes efectos ocurrieron en pacientes pediátricos de 2 a 5 años de edad que recibieron montelukast, con una frecuencia ≥ 2% y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: fiebre, tos, dolor abdominal, diarrea, dolor de cabeza, rinorrea, sinusitis, otitis, influenza, sarpullido, dolor de oído, gastroenteritis, eczema, urticaria, varicela, neumonía, dermatitis y conjuntivitis.
Pacientes pediátricos con asma de 6 a 23 meses de edad: No se ha establecido seguridad y eficacia en pacientes pediátricos menores de 12 meses de edad con asma. Montelukast ha sido evaluado por seguridad en 175 pacientes pediátricos de 6 a 23 meses de edad. El perfil de seguridad de montelukast en un estudio clínico de 6 semanas, doble ciego, controlado con placebo, fue generalmente similar al perfil de seguridad en adultos y pacientes pediátricos de 2 a 14 años de edad. En pacientes pediátricos de 6 a 23 meses de edad que recibieron montelukast, los siguientes eventos ocurrieron con una frecuencia ≥ 2% y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: infección de las vías respiratorias superiores, sibilancias; otitis media; faringitis, amigdalitis, tos y rinitis. La frecuencia de los efectos adversos menos comunes fue comparable entre montelukast y placebo.
Adultos y adolescentes de 15 años de edad a más con rinitis alérgica estacional: Montelukast ha sido evaluado por seguridad en 2199 pacientes adultos y adolescentes de 15 años de edad y mayores en ensayos clínicos. Montelukast administrado una vez al día en la mañana o en la noche tenía un perfil de seguridad similar al del placebo. En ensayos clínicos controlados con placebo, se informó el siguiente efecto con montelukast con una frecuencia ≥1 % y con una incidencia mayor que el placebo: infección respiratoria superior, el 1,9% de los pacientes que recibieron montelukast frente al 1,5% de los pacientes que recibieron placebo. En un estudio clínico controlado con placebo de 4 semanas, el perfil de seguridad fue compatible con el que se observó en estudios de 2 semanas. La incidencia de somnolencia fue similar a la del placebo en todos los estudios.
Pacientes pediátricos de 2 a 14 años de edad con rinitis alérgica estacional: Montelukast ha sido evaluado en 280 pacientes pediátricos de 2 a 14 años de edad en un estudio de seguridad multicéntrico, doble ciego, controlado con placebo, de grupos paralelos. Montelukast administrado una vez al día durante la noche tenía un perfil de seguridad similar al del placebo. En este estudio, los siguientes eventos ocurrieron con una frecuencia ≥2 % y con una incidencia mayor que placebo: dolor de cabeza, otitis media, faringitis e infección respiratoria superior.
Adultos y adolescentes de 15 años de edad a más con rinitis alérgica perenne: Montelukast ha sido evaluado por seguridad en 3357 pacientes adultos y adolescentes de 15 años de edad y mayores con rinitis alérgica perenne, de los cuales 1632 recibieron montelukast en dos estudios clínicos de 6 semanas. Montelukast administrado una vez al día tenía un perfil de seguridad consistente con el observado en pacientes con rinitis alérgica estacional y similar al del placebo. En estos dos estudios, se informaron los siguientes efectos con montelukast con una frecuencia ≥1 % y con una incidencia mayor que el placebo: sinusitis, infección respiratoria superior, cefalea sinusal, tos, epistaxis y aumento de ALT. La incidencia de somnolencia fue similar a la del placebo.
Pacientes pediátricos de 6 meses a 14 años de edad con rinitis alérgica perenne: La seguridad en pacientes de 2 a 14 años de edad con rinitis alérgica perenne está respaldada por la seguridad en pacientes de 2 a 14 años de edad con rinitis alérgica estacional. La seguridad en pacientes de 6 a 23 meses de edad está respaldada por datos de estudios farmacocinéticos eficaces y seguros para el asma en esta población pediátrica y en estudios farmacocinéticos para adultos.
Experiencia post-comercialización: Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de montelukast. Debido a que estas reacciones son reportadas voluntariamente de una población de tamaño incierto, no siempre es posible estimar con seguridad su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: Mayor posibilidad de sangrado, trombocitopenia.
Trastornos del sistema inmunológico: Reacciones de hipersensibilidad incluyendo anafilaxis, infiltración eosinofílica hepática.
Trastornos psiquiátricos: Agitación, incluyendo comportamiento agresivo u hostilidad, ansiedad, depresión, desorientación, perturbación de la atención, anomalías del sueño, alucinaciones, insomnio, irritabilidad, deterioro de la memoria, intranquilidad, sonambulismo, pensamiento y comportamiento suicida (incluyendo el suicidio), contracción nerviosa y temblor.
Trastornos del sistema nervioso: Somnolencia, parestesia/hipoestesia, convulsiones.
Trastornos cardiacos: Palpitaciones.
Trastornos respiratorios, torácicos y mediastínicos: Epistaxis, eosinofilia pulmonar.
Trastornos gastrointestinales: diarrea, dispepsia, náuseas, pancreatitis, vómitos.
Trastornos hepatobiliares: Se han reportado casos de hepatitis colestásica, hepatocelular hepática y lesión hepática de patrón mixto en pacientes tratados con montelukast. La mayoría de estos casos ocurrieron en combinación con otros factores de confusión, como el uso de otros medicamentos o cuando se administró montelukast a pacientes que tenían un potencial subyacente de enfermedad hepática, como el consumo de alcohol u otras formas de hepatitis.
Trastornos de la piel y del tejido subcutáneo: Angioedema, hematomas, eritema multiforme, eritema nodoso, prurito, síndrome de Stevens-Johnson/necrólisis epidérmica tóxica, urticaria.
Trastornos musculoesqueléticos y del tejido conectivo: Artralgia, mialgia incluyendo calambres musculares.
Trastornos renales y urinarios: Enuresis en niños.
Trastornos generales y alteraciones en el lugar de administración: edema.
Los pacientes con asma en terapia con montelukast pueden presentar eosinofilia sistémica, presentando a veces características clínicas de vasculitis compatibles con el síndrome de Churg-Strauss, una condición que a menudo se trata con corticosteroides sistémicos. Estos eventos se han asociado a veces con la reducción del tratamiento con corticosteroides orales. Los médicos deben estar alertas a la eosinofilia, rash vasculítico, empeoramiento de los síntomas pulmonares, complicaciones cardíacas y/o neuropatía en sus pacientes.
Notificación de sospechas de reacciones adversas: Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
No es necesario ajustar la dosis cuando montelukast se coadministra con teofilina, prednisona, prednisolona, anticonceptivos orales, terfenadina, digoxina, warfarina, gemfibrozilo, itraconazol, hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos e inductores enzimáticos del citocromo P450 (CYP).
ESTUDIOS CLÍNICOS:
Asma:
Adultos y adolescentes con asma de 15 años de edad o mayores: Los ensayos clínicos en adultos y adolescentes de 15 años de edad a más demostraron que no hay ningún beneficio clínico adicional a las dosis de montelukast por encima de 10 mg una vez al día.
La efectividad de montelukast para el tratamiento crónico del asma en adultos y adolescentes de 15 años de edad a más se demostró en dos ensayos (EE.UU. y Multinacional) controlados con placebo, doble ciego, de diseño similar y aleatorizados, de 12 semanas de duración, en 1576 pacientes (795 tratados con montelukast, 530 tratados con placebo y 251 tratados con control activo). El promedio de edad fue de 33 años (rango de 15 a 85); 56,8% fueron mujeres y 43,2% hombres. La distribución étnica/racial en estos estudios fue 71,6% de caucásicos, 17,7% de hispanos, 7,2% de otros orígenes y 3,5% de negros. Los pacientes tenían asma leve o moderada y fueron no fumadores los que requirieron aproximadamente 5 inhalaciones de ß-agonista inhalado por día, sobre una base "según sea necesario". Los pacientes presentaron un porcentaje inicial medio del volumen espiratorio forzado, previsto en 1 segundo (FEV1) de 66% (rango aproximado, 40 a 90%). Las variables co-principales de valoración en estos ensayos fueron FEV1 y síntomas de asma durante el día. En ambos estudios después de 12 semanas, un subgrupo aleatorio de pacientes que recibieron montelukast se cambió a placebo durante 3 semanas adicionales de tratamiento doble ciego para evaluar posibles efectos de rebote.
En el gráfico 2 se muestran los resultados del ensayo estadounidense sobre el criterio de valoración principal, FEV1 de la mañana, expresado como un cambio porcentual medio respecto al valor basal promediado durante el período de tratamiento de 12 semanas. En comparación con placebo, el tratamiento con una tableta diaria de montelukast de 10 mg en la noche resultó en un aumento estadísticamente significativo en el cambio de porcentaje FEV1 desde el nivel basal (cambio de 13,0% en el grupo tratado con montelukast frente al cambio de 4,2% en el grupo placebo, p <0,001); el cambio desde el valor basal en FEV1 para montelukast fue 0.32 litros comparado con 0.10 litros para placebo, lo que corresponde a una diferencia entre grupos de 0.22 litros (p <0,001; 95 % CI 0.17 litros, 0.27 litros). Los resultados del ensayo multinacional sobre FEV1 fueron similares.
Gráfico 2. Cambio porcentual medio en base al valor inicial
(Prueba estadounidense: Montelukast N=406; Placebo N=270)
(Modelo ANOVA)
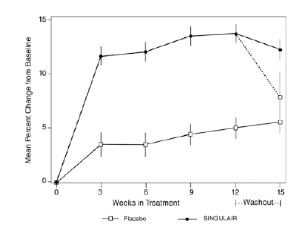
[Mean Percent Change from Baseline= Cambio porcentual medio en base al valor inicial | Weeks in Treatment=semanas de tratamiento]
En la TABLA 2 se muestra el efecto de montelukast en otros criterios de valoración principales y secundarios, representado por el estudio Multinacional. Los resultados de estos criterios de valoración fueron similares en el estudio estadounidense.
Tabla 2. Efecto de montelukast sobre criterios de valoración principales y secundarios en una prueba Multinacional controlada con placebo (modelo ANOVA)
|
Montelukast |
Placebo |
|||||
|
Criterio de valoración |
N |
Línea base |
Cambio medio desde la línea base |
N |
Línea base |
Cambio medio desde la línea base |
|
Síntomas del asma durante el día (escala de 0 a 6) |
372 |
2.35 |
-0.49* |
245 |
2.40 |
-0.26 |
|
ß-agonista (bocanadas por día) |
371 |
5.35 |
-1.65* |
241 |
5.78 |
-0.42 |
|
AM PEFR (L/min) |
372 |
339.57 |
25.03* |
244 |
335.24 |
1.83 |
|
PM PEFR (L/min) |
372 |
355.23 |
20.13* |
244 |
354.02 |
-0.49 |
|
Despertares nocturnos |
285 |
5.46 |
-2.03* |
195 |
5.57 |
-0.78 |
|
* p<0.001, comparado con placebo |
||||||
Ambos estudios evaluaron el efecto de montelukast en los resultados secundarios, incluido el ataque de asma (utilización de recursos de salud, como una visita no programada a un consultorio médico, sala de emergencias u hospital; o el tratamiento con corticosteroides oral, intravenoso o intramuscular) y el uso de corticosteroides orales para el rescate del asma. En el estudio Multinacional, significativamente menos pacientes (15.6% de los pacientes) con montelukast experimentaron ataques de asma en comparación con los pacientes con placebo (27.3%, p<0,001). En el estudio estadounidense, el 7.8% de los pacientes tratados con montelukast y el 10.3% de los pacientes tratados con placebo experimentaron ataques de asma, pero la diferencia entre los dos grupos de tratamiento no fue significativa (p = 0.334). En el estudio multinacional, significativamente menos pacientes (14.8% de los pacientes) con montelukast se les recetó corticoesteroides orales para el rescate del asma en comparación con los pacientes con placebo (25.7%, p <0.001). En el estudio estadounidense, el 6.9% de los pacientes tratados con montelukast y el 9.9% de los pacientes tratados con placebo recibieron corticosteroides orales para el rescate del asma, pero la diferencia entre los dos grupos de tratamiento no fue significativa (p = 0.196).
Inicio de la acción y conservación de los efectos: En cada ensayo controlado con placebo en adultos, el efecto del tratamiento con montelukast — medido por los parámetros del historial diario, incluyendo las puntuaciones de los síntomas, el uso de ß-agonistas "según sea necesario " y las medidas PEFR — se logró después de la primera dosis y se mantuvo el intervalo de dosificación (24 horas). No se observó ningún cambio significativo en el efecto del tratamiento durante la administración nocturna continua de una vez al día en ensayos de extensión no controlados con placebo durante un año como máximo. El retiro de montelukast en pacientes asmáticos después de 12 semanas de uso continuo no provocó un empeoramiento del rebote de asma.
Pacientes pediátricos con asma de 6 a 14 años de edad: La eficacia de montelukast en pacientes pediátricos de 6 a 14 años de edad se demostró en un ensayo doble ciego controlado con placebo de 8 semanas en 336 pacientes (201 tratados con montelukast y 135 tratados con placebo) utilizando un ß-agonista inhalado bajo el criterio de “según sea necesario”. Los pacientes tenían un porcentaje inicial medio previsto FEV1 de 72 % (rango aproximado, 45 a 90 %) y un requerimiento diario medio de ß-agonista inhalado de 3.4 bocanadas de albuterol. Aproximadamente el 36 % de los pacientes estaban con corticosteroides inhalados. La edad promedio fue de 11 años (rango 6 a 15); 35.4% eran mujeres y 64.6% hombres. La distribución étnica/racial en este estudio fue 80.1% de caucásicos, 12.8% de negros, 4.5% de hispanos y 2.7% de otros orígenes.
En comparación con placebo, el tratamiento con una tableta diaria masticable de 5 mg de montelukast resultó en una mejora significativa en el cambio porcentual respecto al valor inicial de media mañana FEV1 (8.7% en el grupo tratado con montelukast frente al 4.2% del cambio respecto al valor basal en el grupo placebo, p <0.001). Se observó una disminución significativa en el cambio porcentual medio en el uso de ß-agonistas inhalados a diario “según sea necesario” (disminución del 11.7% respecto al valor inicial en el grupo tratado con montelukast frente al 8.2% de la línea base en el grupo placebo, p <0.05). Este efecto representa una disminución media desde la línea de base de 0.56 y 0.23 bocanadas por día para los grupos montelukast y placebo, respectivamente. Los análisis de subgrupos indicaron que los pacientes pediátricos más jóvenes de 6 a 11 años presentaban resultados efectivos comparables con los pacientes pediátricos mayores de 12 a 14 años.
Al igual que en los estudios de adultos, no se observó ningún cambio significativo en el efecto del tratamiento durante la administración continua de una vez al día en un ensayo de extensión abierto sin un grupo placebo simultáneo durante un período de hasta 6 meses.
Pacientes pediátricos con asma de 2 a 5 años de edad: La eficacia de montelukast para el tratamiento crónico del asma en pacientes pediátricos de 2 a 5 años de edad se exploró en un estudio de seguridad y tolerabilidad, controlado con placebo de 12 semanas de duración en 689 pacientes, de los cuales 461 fueron tratados con montelukast. La edad promedio fue de 4 años (rango 2 a 6); 41.5% eran mujeres y 58.5% eran hombres. La distribución étnica/racial en este estudio fue 56.5% de caucásicos, 20.9% de hispanos, 14.4% de otros orígenes y 8.3% de negros.
Aunque el objetivo principal era determinar la seguridad y tolerabilidad de montelukast en este grupo etario, el estudio incluyó evaluaciones exploratorias de eficacia, incluyendo puntuaciones sobre los síntomas de asma durante el día y la noche, el uso de ß-agonistas, el rescate oral con corticosteroides y la evaluación general del médico. Las conclusiones de estas evaluaciones exploratorias de eficacia, junto con la farmacocinética y la extrapolación de datos de eficacia en pacientes de edad avanzada, apoyan la conclusión general de que montelukast es eficaz en el tratamiento de mantenimiento del asma en pacientes de 2 a 5 años de edad.
Efectos en pacientes con corticosteroides inhalados concomitantes: Las pruebas independientes en adultos evaluaron la capacidad de montelukast de aumentar el efecto clínico de los corticosteroides inhalados y de permitir la disminución gradual de los corticosteroides inhalados cuando se usan concomitantemente.
Un ensayo aleatorizado, controlado con placebo, de grupos paralelos (n = 226) incluyó adultos con asma estable con un FEV1 medio de aproximadamente 84% de lo previsto que se mantuvieron previamente en varios corticosteroides inhalados (administrados por aerosoles de dosis medidas o inhaladores de polvo seco). La edad promedio fue de 41.5 años (rango 16 a 70); 52.2% eran mujeres y 47.8% hombres. La distribución étnica-racial en este estudio fue 92.0% caucásicos, 3.5% negros, 2.2% hispanos y 2.2% asiáticos. Los tipos de corticosteroides inhalados y sus requerimientos basales medios incluyeron dipropionato de beclometasona (dosis media, 1203 mcg/día), acetónido de triamcinolona (dosis media, 2004 mcg/día), flunisolida (dosis media, 1971 mcg/día), propionato de fluticasona (dosis media, 1083 mcg/día), o budesonida (dosis media, 1192 mcg/día). Algunos de estos corticosteroides inhalados fueron formulaciones no aprobadas por los Estados Unidos, y las dosis expresadas pueden no ser aplicables. Los requerimientos de corticosteroides inhalados previos al estudio se redujeron en aproximadamente un 37% durante un período de administración de placebo de 5 a 7 semanas, diseñados para tratar a los pacientes con la dosis efectiva más baja de corticosteroides inhalada. El tratamiento con montelukast resultó en una reducción adicional de 47% en la dosis media de corticosteroides inhalados en comparación con una reducción media del 30% en el grupo placebo durante el período de tratamiento activo de 12 semanas (p≤0.05). No se sabe si los resultados de este estudio se pueden extender a pacientes con asma que requieran dosis más altas de corticosteroides inhalados o sistémicos.
En otro ensayo aleatorizado, de grupo paralelo, controlado con placebo (n = 642) en una población similar de pacientes adultos previamente conservados, pero no controlados adecuadamente, con corticosteroides inhalados (beclometasona 336 mcg/día), se añadió montelukast a beclometasona dando lugar a mejoras estadísticamente significativas en FEV1 en comparación con aquellos pacientes que continuaron solo con beclometasona o aquellos pacientes que se les retiró la beclometasona y fueron tratados solo con montelukast o placebo durante las últimas 10 de un período de 16 semanas de tratamiento ciego. Los pacientes que fueron aleatorizados en los grupos de tratamiento que contenían beclometasona tuvieron un control asmático estadísticamente significativo, mejor que aquellos pacientes aleatorizados solo con montelukast o placebo según se indica en FEV1, los síntomas de asma durante el día, PEFR, los despertares nocturnos debidos al asma y los requerimientos ß-agonistas "según sea necesario".
Casi todos los pacientes adultos con asma con y con sensibilidad a la aspirina recibieron corticosteroides inhalados y/u orales concomitantes. Un ensayo aleatorizado de 4 semanas de grupo paralelo (n = 80) demostró que montelukast comparado con placebo resultó en la mejora significativa en los parámetros de control del asma. La magnitud del efecto de montelukast en pacientes sensibles a la aspirina fue similar al efecto observado en la población general de pacientes asmáticos analizados. No se ha evaluado el efecto de montelukast sobre la respuesta broncoconstrictora a la aspirina u otros fármacos antiinflamatorios no esteroideos en pacientes asmáticos sensibles a la aspirina.
Broncoconstricción inducida por el ejercicio (BIE): Broncoconstricción inducida por el ejercicio (adultos, adolescentes, y pacientes pediátricos de 6 años de edad a más) :
La eficacia de montelukast 10 mg cuando se administró como una dosis única 2 horas antes del ejercicio para la prevención del BIE, se investigó en tres estudios cruzados, aleatorizados, doble ciego, controlados con placebo (EE.UU. y Multinational), que incluyeron un total de 160 adultos y adolescentes de 15 años de edad a más con BIE. Se realizaron pruebas de desafío de ejercicio a las 2 horas, 8.5 o 12 horas y 24 horas después de la administración de una dosis única de fármaco de estudio (montelukast 10 mg o placebo). El criterio de valoración principal fue la disminución del porcentaje máximo de FEV1 tras el desafío de ejercicios de 2 horas después de la dosis en los tres estudios (Estudio A, Estudio B y Estudio C). En el estudio A, una dosis única de montelukast 10 mg demostró un beneficio protector estadísticamente significativo contra el BIE cuando se tomó 2 horas antes del ejercicio. Algunos pacientes fueron protegidos del BIE a las 8.5 y 24 horas después de la administración; sin embargo, algunos pacientes no lo fueron. Los resultados para la disminución del porcentaje máximo en cada momento del Estudio A se muestran en la TABLA 3 y son representativos de los resultados de los otros dos estudios.
Tabla 3: Disminución máxima del porcentaje en FEV1 siguiendo el desafío de ejercicio en el estudio A (N=47)
Modelo ANOVA
|
Tiempo del desafío de ejercicio después de la administración del medicamento |
Disminución máxima del porcentaje en FEV1* |
Diferencia del tratamiento % para Montelukast versus placebo (95% CI)* |
|
|
Montelukast |
Placebo |
||
|
2 horas |
13 |
22 |
-9 (-12, -5) |
|
8.5 horas |
12 |
17 |
-5 (-9, -2) |
|
24 horas |
10 |
14 |
-4 (-7, -1) |
|
*Mínimos cuadrados-media |
|||
Se investigó la eficacia de las tabletas masticables de montelukast de 5 mg cuando se administra como una dosis única 2 horas antes del ejercicio para la prevención de BIE en un estudio multinacional, aleatorizado, doble ciego, controlado con placebo, cruzado que incluyó un total de 64 pacientes pediátricos de 6 a 14 años de edad con BIE. Se realizaron pruebas de desafío de ejercicio a las 2 horas y 24 horas después de la administración de una dosis única del fármaco de estudio (montelukast 5 mg o placebo). El criterio de valoración principal fue el descenso del porcentaje máximo de FEV1 luego de 2 horas de ejercicio después de la dosis. Una dosis única de montelukast 5 mg demostró un beneficio protector estadísticamente significativo contra el BIE cuando se tomó 2 horas antes del ejercicio (TABLA 4). Resultados similares se mostraron 24 horas después de la dosis (criterio de valoración secundario). Algunos pacientes fueron protegidos del BIE a las 24 horas luego de la administración; sin embargo, algunos pacientes no lo fueron. No se evaluaron los puntos temporales entre 2 y 24 horas después de la dosis.
Tabla 4: Disminución máxima del porcentaje en FEV1 siguiendo el desafío de ejercicio en pacientes pediátricos (N=64)
Modelo ANOVA
|
Tiempo del desafío de ejercicio después de la administración del medicamento |
Disminución máxima del porcentaje en FEV1* |
Diferencia del tratamiento % para Montelukast versus placebo (95% CI)* |
|
|
Montelukast |
Placebo |
||
|
2 horas |
15 |
20 |
-5 (-9, -1) |
|
24 horas |
13 |
17 |
-4 (-7, -1) |
|
*Mínimos cuadrados-media |
|||
No se ha establecido la eficacia de montelukast para la prevención del BIE en pacientes menores de 6 años de edad.
La administración diaria de montelukast para el tratamiento crónico del asma no ha sido establecida para prevenir episodios agudos de BIE.
En un estudio de 12 semanas, aleatorizado, doble ciego, de grupos paralelos de 110 asmáticos adultos y adolescentes de 15 años de edad a más, con un porcentaje inicial medio FEV1 previsto de 83 % y con exacerbación del asma inducida por el ejercicio, el tratamiento con montelukast de 10 mg, una vez al día en la noche, resultó en una reducción estadísticamente significativa en la caída del porcentaje máximo de FEV1 y el tiempo medio de recuperación dentro del 5% del FEV1 previo al ejercicio. El desafío de ejercicio se llevó a cabo al final del intervalo de dosificación (es decir, 20 a 24 horas después de la dosis anterior). Este efecto se mantuvo durante todo el período de tratamiento de 12 semanas, lo que indica que no se produjo tolerancia. Sin embargo, montelukast no evitó un deterioro clínicamente significativo del descenso de porcentaje máximo de FEV1 después del ejercicio (es decir, una disminución ≥20% respecto a la línea de base antes del ejercicio) en 52% de los pacientes estudiados. En un estudio cruzado separado en adultos, se observó un efecto similar después de dos dosis diarias de 10 mg de montelukast.
En un estudio cruzado de 2 días se demostró efectos similares en los pacientes pediátricos de 6 a 14 años de edad que utilizan la tableta masticable de 5 mg, y efectos similares observados en adultos cuando se realizó el desafío de ejercicio al final del intervalo de dosificación (es decir, 20 a 24 horas después de la dosis anterior).
Rinitis alérgica (estacional y perenne):
Rinitis alérgica estacional: La eficacia de las tabletas de montelukast para el tratamiento de la rinitis alérgica estacional se investigó en cinco ensayos aleatorizados, doble ciego, de grupos paralelos, controlados con placebo y con comparador activo (loratadina), diseñados de forma similar, realizados en Norteamérica. Los 5 ensayos incluyeron un total de 5029 pacientes, de los cuales 1799 fueron tratados con las tabletas de montelukast. Los pacientes tenían de 15 a 82 años de edad con un historial de rinitis alérgica estacional, una prueba cutánea positiva y por lo menos un alérgeno estacional relevante y síntomas activos de rinitis alérgica estacional al inicio del estudio.
El período de tratamiento aleatorizado fue de 2 semanas en 4 ensayos, y 4 semanas en un ensayo.
La variable principal de resultados fue el cambio promedio desde la línea de base en la puntuación de los síntomas nasales diurnos (el promedio de puntuaciones individuales de congestión nasal, rinorrea, picazón nasal, estornudos) evaluados por los pacientes en una escala categórica de 0-3. Cuatro de los cinco ensayos mostraron una reducción significativa en las puntuaciones de los síntomas nasales durante el día con tabletas montelukast de 10 mg en comparación con placebo. Los resultados de la prueba se muestran a continuación. La edad promedio en esta prueba fue de 35.0 años (rango 15 a 81); 65.4% eran mujeres y 34.6% hombres. La distribución étnica/racial en este estudio fue 83,1% de caucásicos, 6,4% de otros orígenes, 5,8% de negros y 4,8% de hispanos. En la TABLA 5 se muestran los cambios medios desde la línea de base en la puntuación de los síntomas nasales diurnos, y en los grupos de tratamiento que recibieron tabletas de Montelukast, loratadina y placebo. Los tres ensayos restantes que demostraron efectividad mostraron resultados similares.
Tabla 5: Efectos de Montelukast en la puntuación de los síntomas nasales durante el día* en una prueba controlada con placebo y con comparador activo en pacientes con rinitis alérgica estacional (modelo ANCOVA)
|
Grupo tratado (N) |
Puntuación media inicial |
Cambio medio desde la línea de base |
Diferencia entre tratamiento y placebo (95 % CI) Media de los mínimos cuadrados |
|
Montelukast 10 mg (344) |
2.09 |
-0.39 |
-0.13† (-0.21, -0.06) |
|
Placebo (351) |
2.10 |
-0.26 |
N.A. |
|
Control activo‡ (Loratadina 10 mg) (599) |
2.06 |
-0.46 |
-0.24† (-0.31, -0.17) |
|
* Promedio de puntuaciones individuales de congestión nasal, rinorrea, picazón nasal, estornudos según lo evaluado por los pacientes en una escala categórica de 0-3. † Estadísticamente diferente del placebo (p≤0.001). ‡ El estudio no fue diseñado para la comparación estadística entre Montelukast y el control activo (loratadina). |
|||
Rinitis alérgica perenne: La eficacia de las tabletas de montelukast para el tratamiento de la rinitis alérgica perenne se investigó en 2 estudios aleatorizados, doble ciego, controlados con placebo, realizados en Norteamérica y Europa. Los dos estudios incluyeron un total de 3357 pacientes, de los cuales 1632 recibieron tabletas montelukast de 10 mg. Fueron inscritos los pacientes de 15 a 82 años de edad con rinitis alérgica perenne confirmada en su historial y una prueba cutánea positiva de por lo menos un alérgeno perenne relevante (ácaros de polvo, caspa animal y/o esporas de moho) y que tenían síntomas activos al inicio del estudio.
En el estudio donde se demostró eficacia, la edad promedio fue de 35 años (rango 15 a 81); 64.1% eran mujeres y 35.9% eran varones. La distribución étnica-racial en este estudio fue 83,2% de caucásicos, 8,1% de negros, 5,4% de hispanos, 2,3% de asiáticos y 1,0% de otros orígenes. Las tabletas diarias de montelukast de 10 mg demostraron reducir significativamente los síntomas de rinitis alérgica perenne durante un período de tratamiento de 6 semanas (TABLA 6); en este estudio, la variable principal de resultados fue el cambio medio desde la línea de base en la puntuación de síntomas nasales durante el día (el promedio de puntuaciones individuales de congestión nasal, rinorrea y estornudo).
Tabla 6. Efectos de montelukast en la puntuación de los síntomas nasales durante el día* en una prueba controlada con placebo en pacientes con rinitis alérgica perenne (modelo ANCOVA)
|
Grupo tratado (N) |
Puntuación media inicial |
Cambio medio desde la línea de base |
Diferencia entre tratamiento y placebo (95 % CI) Media de los mínimos cuadrados |
|
Montelukast 10 mg (1000) |
2.09 |
-0.42 |
-0.08† (-0.12, -0.04) |
|
Placebo (980) |
2.10 |
-0.35 |
N.A. |
|
* Promedio de puntuaciones individuales de congestión nasal, rinorrea, estornudos según lo evaluado por los pacientes en una escala categórica de 0-3. † Estadísticamente diferente del placebo (p≤0.001). |
|||
El otro estudio de 6 semanas evaluó montelukast 10 mg (n = 626), placebo (n = 609) y un control activo (cetirizina 10 mg; n = 120). El análisis principal comparó el cambio medio con respecto al valor basal en la puntuación de los síntomas nasales diurnos para montelukast frente a placebo durante las primeras 4 semanas de tratamiento. El estudio no fue diseñado para la comparación estadística entre Montelukast y el control activo. La variable principal de resultados incluía picazón nasal además de congestión nasal, rinorrea y estornudos. La diferencia estimada entre montelukast y placebo fue de -0,04 con un 95% CI de (-0,09, 0,01). La diferencia estimada entre el control activo y placebo fue de -0,10 con un 95% CI de (-0,19, -0,01).
TOXICOLOGÍA NO CLÍNICA:
Carcinogénesis, mutagénesis, alteración de la fertilidad: No se observó evidencia de tumorigenicidad en estudios de carcinogenicidad de dos años en ratas Sprague-Dawley o de 92 semanas en ratones, con dosis de administración oral de hasta 200 mg/kg/día o 100 mg/kg/día, respectivamente. La exposición estimada en ratas fue de aproximadamente 120 y 75 veces el AUC para adultos y niños, respectivamente, en la dosis oral diaria máxima recomendada. La exposición estimada en ratones fue de aproximadamente 45 y 25 veces el AUC para adultos y niños, respectivamente, en la dosis oral diaria máxima recomendada.
Montelukast no demostró evidencia de actividad mutagénica o clastogénica en las siguientes pruebas: El ensayo de mutagénesis microbiana, el ensayo de mutagénesis de células de mamífero V-79, el ensayo de elución alcalina en hepatocitos de rata, el ensayo de aberración cromosómica en células de ovario de hámster chino, y en el ensayo de aberración cromosómica de médula ósea de ratón in vivo.
En los estudios de fertilidad en ratas hembras, montelukast produjo reducciones en los índices de fertilidad y fecundidad en una dosis oral de 200 mg/kg (la exposición estimada era aproximadamente 70 veces el AUC para adultos, en la dosis oral diaria máxima recomendada). No se observaron efectos sobre la fertilidad o fecundidad femenina con una dosis oral de 100 mg/kg (la exposición estimada fue aproximadamente 20 veces el AUC para adultos en la dosis oral diaria máxima recomendada). Montelukast no tuvo efectos sobre la fertilidad en ratas macho en dosis orales de hasta 800 mg/kg (la exposición estimada fue aproximadamente 160 veces el AUC para adultos en la dosis oral diaria máxima recomendada).
Toxicología y/o Farmacología animal:
Estudios de toxicología reproductiva: No se observó teratogenicidad en dosis orales de hasta 400 mg/kg/día, y 300 mg/kg/día en ratas y conejos, respectivamente. Estas dosis fueron aproximadamente 100 y 110 veces la dosis oral diaria máxima recomendada en adultos, respectivamente, basándose en los AUC. Montelukast cruza la placenta luego de la administración oral en ratas y conejos.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Asma agudo: El uso de montelukast no está indicado para la anulación del broncoespasmo en los ataques agudos de asma, incluida la crisis asmática. Se debe aconsejar a los pacientes que dispongan de medicamentos de rescate adecuados. La terapia con montelukast puede continuar durante las exacerbaciones agudas del asma. Los pacientes que tienen exacerbaciones asmáticas después del ejercicio deben tener disponible para el rescate un agonista ß inhalado de acción corta.
Uso concomitante de corticosteroides: Si bien la dosis de corticosteroide inhalado puede reducirse gradualmente bajo supervisión médica, montelukast no debe sustituirse abruptamente por corticosteroides inhalados u orales.
Sensibilidad a la aspirina: Los pacientes con conocida sensibilidad a la aspirina deben continuar evitando la aspirina o los antiinflamatorios no esteroideos mientras tomen montelukast. Aunque montelukast es eficaz para mejorar la función de las vías respiratorias en los asmáticos con sensibilidad documentada a la aspirina, no se ha demostrado que trunque la respuesta broncoconstrictora a la aspirina y a otros fármacos antiinflamatorios no esteroideos en pacientes asmáticos sensibles a la aspirina.
Efectos neuropsiquiátricos: Los efectos neuropsiquiátricos han sido reportados en adultos, adolescentes y pacientes pediátricos que toman montelukast. El uso de informes posteriores a la comercialización de montelukast incluye agitación, comportamiento agresivo u hostilidad, ansiedad, depresión, desorientación, trastornos de la concentración, anomalías del sueño, alucinaciones, insomnio, irritabilidad, pérdida de memoria, intranquilidad, sonambulismo, pensamiento o comportamiento suicida (incluido el suicidio), contracción nerviosa y temblor. Los detalles clínicos de algunos informes posteriores a la comercialización que involucran a montelukast parecen coherentes con un efecto inducido por el fármaco.
Los pacientes y médicos deben estar alerta para los efectos neuropsiquiátricos. Los pacientes deben ser instruidos para notificar a su médico si se producen estos cambios. Los médicos deben evaluar cuidadosamente los riesgos y beneficios de continuar el tratamiento con montelukast si se producen dichos efectos.
Condiciones eosinofílicas: Los pacientes con asma en terapia con montelukast pueden presentar eosinofilia sistémica, presentando a veces características clínicas de vasculitis consistentes con el síndrome de Churg-Strauss, una condición que a menudo es tratada con corticosteroides sistémicos. Estos efectos han sido a veces asociados con la reducción de la terapia oral con corticosteroides. Los médicos deben estar alertas a la eosinofilia, rash vasculítico, el empeoramiento de los síntomas pulmonares, las complicaciones cardiacas y/o la neuropatía en sus pacientes. No se ha establecido una asociación causal entre montelukast y estas condiciones subyacentes.
POSOLOGÍA Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Asma: Montelukast se debe tomar una vez al día por la noche. Se recomiendan las siguientes dosis:
• Para pacientes pediátricos de 6 a 14 años de edad: una tableta masticable de 5 mg.
• Para pacientes pediátricos de 2 a 5 años de edad: una tableta masticable de 4 mg.
No se ha establecido seguridad y efectividad en pacientes pediátricos menores de 12 meses de edad con asma.
No se han realizado ensayos clínicos en pacientes con asma para evaluar la eficacia relativa de la dosificación de la mañana frente a la noche. La farmacocinética de montelukast es similar si se dosifica en la mañana o en la noche. Se ha demostrado la eficacia para el asma cuando el montelukast se administró por la noche sin tener en cuenta el tiempo de ingestión de los alimentos.
Broncoconstricción inducida por el ejercicio (BIE): Para la prevención de BIE, se debe tomar una sola dosis de montelukast por lo menos 2 horas antes del ejercicio.
Se recomiendan las siguientes dosis:
• Para pacientes pediátricos de 6 a 14 años de edad: una tableta masticable de 5 mg.
No se debe tomar una dosis adicional de montelukast dentro de las 24 horas a una dosis anterior. Los pacientes que ya toman montelukast diariamente para otra indicación (incluyendo el asma crónico) no deben tomar una dosis adicional para prevenir la BIE. Todos los pacientes deben tener disponible para el salvamento un agonista ß de acción corta.
No se ha establecido la seguridad y eficacia en pacientes menores de 6 años de edad. La administración diaria de montelukast para el tratamiento crónico del asma no ha sido establecida para prevenir episodios agudos de BIE.
Rinitis alérgica: Se debe tomar montelukast una vez al día para la rinitis alérgica. Se ha demostrado la eficacia de la rinitis alérgica estacional cuando montelukast se administró por la mañana o por la noche sin tener en cuenta el tiempo de ingestión de los alimentos. El tiempo de administración puede individualizarse para satisfacer las necesidades del paciente.
Se recomiendan las siguientes dosis para el tratamiento de los síntomas de rinitis alérgica estacional:
• Para pacientes pediátricos de 6 a 14 años de edad: una tableta masticable de 5 mg.
• Para pacientes pediátricos de 2 a 5 años de edad: una tableta masticable de 4 mg.
No se ha establecido seguridad y eficacia en pacientes pediátricos menores de 2 años de edad con rinitis alérgica estacional.
Se recomiendan las siguientes dosis para el tratamiento de síntomas de rinitis alérgica perenne:
• Para pacientes pediátricos de 6 a 14 años de edad: una tableta masticable de 5 mg.
• Para pacientes pediátricos de 2 a 5 años de edad: una tableta masticable de 4 mg.
No se ha establecido seguridad y eficacia en pacientes pediátricos menores de 6 meses de edad con rinitis alérgica perenne.
Asma y rinitis alérgica: Los pacientes con asma y rinitis alérgica deben tomar solo una dosis diaria de montelukast por la noche.
SOBREDOSIS:
No se dispone de información específica sobre el tratamiento de sobredosificación con montelukast. En estudios de asma crónica, montelukast se ha administrado en dosis de hasta 200 mg/día a pacientes adultos durante 22 semanas y, en estudios a corto plazo, hasta 900 mg/día a pacientes durante aproximadamente una semana sin experiencias adversas clínicamente importantes. En caso de sobredosificación, es razonable emplear las medidas habituales de apoyo; por ejemplo, eliminar el material no absorbido del tracto gastrointestinal, emplear la monitorización clínica e instituir terapia de apoyo, si es necesario.
Ha habido informes de sobredosificación aguda en la experiencia post-comercialización y estudios clínicos con montelukast. Estos incluyen informes en adultos y niños con una dosis tan alta como de 1000 mg. Los hallazgos clínicos y de laboratorio observados fueron compatibles con el perfil de seguridad en adultos y pacientes pediátricos. No hubo efectos adversos en la mayoría de los informes de sobredosificación. Las experiencias adversas más frecuentes fueron compatibles con el perfil de seguridad de montelukast e incluyeron dolor abdominal, somnolencia, sed, dolor de cabeza, vómitos e hiperactividad psicomotora.
No se sabe si montelukast se elimina por diálisis peritoneal o hemodiálisis.
EMBARAZO/LACTANCIA/POBLACIONES ESPECIALES:
Embarazo:
Embarazo Categoría B: No hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción animal no son siempre predictivos de la respuesta humana, montelukast debe utilizarse durante el embarazo sólo si es claramente necesario.
Efecto teratogénico: No se observó teratogenicidad en ratas y conejos en dosis de aproximadamente 100 y 110 veces, respectivamente, la dosis oral máxima recomendada a diario en adultos basada en AUCs.
Durante la experiencia de marketing en todo el mundo, los defectos de las extremidades congénitas han sido raramente reportados en la descendencia de mujeres tratadas con montelukast durante el embarazo. La mayoría de estas mujeres también estaban tomando otros medicamentos para el asma durante el embarazo. No se ha establecido una relación causal entre estos efectos y montelukast.
Lactancia: Los estudios en ratas han demostrado que el montelukast se excreta en la leche. No se sabe si montelukast se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, se debe tener cuidado cuando se administra montelukast a una madre que da de lactar.
Pediatría: Se ha establecido la seguridad y eficacia de montelukast en estudios adecuados y bien controlados en pacientes pediátricos con asma de 6 a 14 años de edad. Los perfiles de seguridad y eficacia en este grupo etario son similares a los observados en los adultos.
La eficacia de montelukast para el tratamiento de la rinitis alérgica estacional en pacientes pediátricos de 2 a 14 años de edad y para el tratamiento de la rinitis alérgica perenne en pacientes pediátricos de 6 meses a 14 años de edad está respaldada por la extrapolación de la eficacia demostrada en pacientes de 15 años de edad y mayores con rinitis alérgica, así como la suposición de que el curso de la enfermedad, la fisiopatología y el efecto del fármaco son sustancialmente similares entre estas poblaciones.
La seguridad de las tabletas masticables de montelukast de 4 mg en pacientes pediátricos de 2 a 5 años de edad con asma ha sido demostrada mediante datos adecuados y bien controlados. La eficacia de montelukast en este grupo etario se extrapola a partir de la eficacia demostrada en pacientes de 6 años de edad y mayores con asma y se basa en datos farmacocinéticos similares, así como la suposición de que el curso de la enfermedad, la fisiopatología y el efecto del fármaco son sustancialmente similares entre estas poblaciones. La eficacia en este grupo etario está respaldada por evaluaciones exploratorias de eficacia de un gran estudio de seguridad bien controlado, llevado a cabo en pacientes de 2 a 5 años de edad.
La seguridad de las tabletas masticables de montelukast de 4 mg y 5 mg en pacientes pediátricos de 2 a 14 años con rinitis alérgica se apoya en los datos de estudios realizados en pacientes pediátricos de 2 a 14 años con asma. Un estudio de seguridad en pacientes pediátricos de 2 a 14 años de edad con rinitis alérgica estacional demostró un perfil de seguridad similar.
No se ha establecido seguridad y eficacia en pacientes pediátricos menores de 12 meses con asma, 6 meses con rinitis alérgica perenne y 6 años con broncoconstricción inducida por el ejercicio.
Tasa de crecimiento en pacientes pediátricos: Se realizó un estudio de 56 semanas, multicéntrico, doble ciego, aleatorio, activo y controlado con placebo y de grupo paralelo para evaluar el efecto de montelukast sobre la tasa de crecimiento en 360 pacientes con asma leve, entre 6 a 8 años. Los grupos de tratamiento incluyeron montelukast 5 mg una vez al día, placebo y dipropionato de beclometasona administrado como 168 mcg dos veces al día con un dispositivo espaciador. Para cada sujeto, se definió una tasa de crecimiento como la pendiente de una línea de regresión lineal ajustada a las medidas de altura durante más de 56 semanas. La comparación principal fue la diferencia en las tasas de crecimiento entre montelukast y los grupos de placebo. Las tasas de crecimiento, expresadas como mínimos cuadrados (LS) significan (95% CI) en cm/año, para montelukast, placebo, y los grupos de tratamiento con beclometasona fueron 5.67 (5.46, 5.88), 5.64 (5.42, 5.86), and 4.86 (4.64, 5.08), respectivamente. Las diferencias en las tasas de crecimiento, expresadas como mínimos cuadrados (LS) significan (95% CI) en cm/año, para montelukast menos placebo, beclometasona menos placebo, y los grupos de tratamiento con menos beclometasona montelukast fueron 0.03 (-0.26, 0.31), -0.78 (-1.06, -0.49); y 0.81 (0.53, 1.09), respectivamente. La tasa de crecimiento (expresada como cambio medio de altura en el tiempo) para cada grupo de tratamiento se muestra en el GRÁFICO 1.
Gráfico 1: Cambio de altura (cm) de la visita de
randomización por semana programada
(Promedio del grupo de tratamiento ± Error* estándar del Promedio)
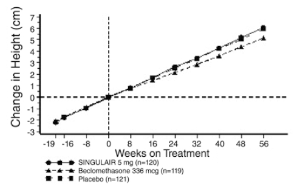
[Weeks on treatment = semanas de tratamiento | Change in Height = cambio de altura]
*Los errores estándar del grupo de tratamiento quieren decir que en el cambio de altura son demasiado pequeños para ser visibles en el gráfico.
Geriatría: Del total de pacientes en estudios clínicos de montelukast, el 3,5% tenía 65 años de edad a más, y el 0,4% tenía 75 años de edad a más. No se observaron diferencias generales en la seguridad o efectividad entre estos pacientes y los pacientes más jóvenes, y la otra experiencia clínica no ha identificado diferencias en las respuestas entre los pacientes ancianos y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores. El perfil farmacocinético y la biodisponibilidad oral de una única dosis oral de 10 mg de montelukast son similares en adultos mayores y adultos jóvenes. La semivida plasmática de montelukast es ligeramente más extensa en los ancianos. No se requiere un ajuste de la dosificación en los ancianos.
Insuficiencia hepática: No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve a moderada.
Insuficiencia renal: No se recomienda un ajuste de la dosis en pacientes con insuficiencia renal.
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción: Los leucotrienos cisteinílicos (LTC4, LTD4, LTE4) son productos del metabolismo del ácido araquidónico y se liberan de varias células, incluyendo los mastocitos y eosinófilos. Estos eicosanoides se unen a los receptores de los leucotrienos cisteinílicos (CysLT). El receptor CysLT tipo 1 (CysLT1) se encuentra en las vías respiratorias humanas (incluyendo las células del músculo liso de las vías respiratorias y los macrófagos de las vías respiratorias) y en otras células proinflamatorias (incluyendo los eosinófilos y ciertas células madre mieloides). Los CysLTs se han correlacionado con la patofisiología del asma y la rinitis alérgica. En el asma, los efectos mediados por leucotrienos incluyen el edema de las vías respiratorias, la contracción del músculo liso y la alteración de la actividad celular asociada con el proceso inflamatorio. En la rinitis alérgica, los CysLTs se liberan de la mucosa nasal después de la exposición de alérgenos durante las reacciones de fase temprana y tardía y se asocian con síntomas de rinitis alérgica.
Montelukast es un compuesto oralmente activo que se une con alta afinidad y selectividad al receptor CysLT1 (preferentemente a otros receptores de las vías respiratorias farmacológicamente importantes, tales como el receptor prostanoide, colinérgico o ß-adrenérgico). Montelukast inhibe las acciones fisiológicas de LTD4 en el receptor CysLT1 sin ninguna actividad agonista.
Farmacodinamia: Montelukast causa la inhibición de los receptores de los leucotrienos cisteinílicos de las vías respiratorias como se demuestra por la capacidad de inhibir la broncoconstricción debido al LTD4 inhalado en asmáticos. Las dosis tan bajas como de 5 mg causan un bloqueo sustancial de la broncoconstricción inducida por LTD4. En un estudio cruzado controlado con placebo (n=12), Montelukast inhibió la broncoconstricción de la fase temprana y tardía debido al desafío de antígeno en un 75% y 57%, respectivamente. El efecto de montelukast sobre los eosinófilos en la sangre periférica se examinó en ensayos clínicos. En pacientes con asma de 2 años o más que recibieron montelukast, se observó una disminución en los conteos medios de eosinófilos de sangre periférica que oscilaron entre 9% y 15%, en comparación con placebo, durante los períodos de tratamiento doble ciego. En los pacientes con rinitis alérgica estacional de 15 años o más que recibieron montelukast, se observó un aumento medio del 0,2% en los recuentos de eosinófilos en la sangre periférica, en comparación con un aumento medio del 12,5% en los pacientes tratados con placebo durante los períodos de tratamiento doble ciego. Esto refleja una diferencia media del 12,3% a favor de montelukast. No se conoce la relación entre estas observaciones y los beneficios clínicos del montelukast observados en los ensayos clínicos.
Farmacocinética:
Absorción: Para la tableta masticable de 5 mg, la Cmax media se alcanza de 2 a 2.5 horas después de la administración a adultos en estado de ayuno. La biodisponibilidad oral media es de 73% en estado de ayuno frente al 63% cuando se administra con una comida normal por la mañana.
Para la tableta masticable de 4 mg, la Cmax media se alcanza 2 horas después de la administración en pacientes pediátricos de 2 a 5 años de edad en ayunas.
La seguridad y eficacia de montelukast en pacientes con asma se demostraron en ensayos clínicos en los que las formulaciones de tabletas masticables de 5 mg se administraron por la noche sin tener en cuenta el tiempo de ingestión de los alimentos. La seguridad de montelukast en pacientes con asma también se demostró en ensayos clínicos en los que las tabletas masticables de 4 mg, se administraron por la noche sin tener en cuenta el tiempo de ingestión de los alimentos. La seguridad y eficacia de montelukast en pacientes con rinitis alérgica estacional se demostraron en ensayos clínicos en los que la tableta recubierta con película de 10 mg se administró por la mañana o por la noche sin tener en cuenta el tiempo de ingestión de los alimentos. No se evaluó la farmacocinética comparativa del montelukast cuando se administró como dos tabletas masticables de 5 mg frente a una tableta recubierta con película de 10 mg.
Distribución: Montelukast está más del 99% ligado a proteínas plasmáticas. El volumen de distribución en estado estacionario de montelukast tiene un promedio de 8 a 11 litros. Los estudios en ratas con montelukast radiomarcado indican una distribución mínima a través de la barrera hematoencefálica. Además, las concentraciones de material radiomarcado a las 24 horas después de la dosis eran mínimas en todos los demás tejidos.
Metabolismo: Montelukast se metaboliza extensamente. En estudios con dosis terapéuticas, las concentraciones plasmáticas de metabolitos de montelukast son indetectables en estado estacionario en adultos y pacientes pediátricos. Los estudios in vitro que utilizan microsomas hepáticos humanos indican que CYP3A4, 2C8 y 2C9 están involucrados en el metabolismo de montelukast. En concentraciones clínicamente importantes, 2C8 parece desempeñar un papel importante en el metabolismo de montelukast.
Eliminación: El aclaramiento plasmático de montelukast es de 45 mL/min en adultos sanos. Después de una dosis oral de montelukast radiomarcado, el 86% de la radioactividad se recuperó en colecciones fecales de 5 días y <0,2% se recuperó en la orina. Junto con las estimaciones de la biodisponibilidad oral de montelukast, este indica que montelukast y sus metabolitos se excretan casi exclusivamente a través de la bilis.
En varios estudios, la vida media plasmática de montelukast osciló entre 2.7 y 5.5 horas en adultos jóvenes sanos. La farmacocinética de montelukast es casi lineal para las dosis orales de hasta 50 mg. Durante una dosis diaria de 10 mg de montelukast, hay poca acumulación del fármaco original en el plasma (14%).
Poblaciones especiales:
Insuficiencia hepática: Los pacientes con insuficiencia hepática leve a moderada y evidencia clínica de cirrosis tenían evidencia de disminución del metabolismo de montelukast, dando como resultado un 41% (90% CI=7%, 85%) mayor AUC de montelukast después de una dosis única de 10 mg. La eliminación de montelukast fue ligeramente prolongada en comparación con la de pacientes sanos (vida media, 7.4 Horas). No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve a moderada. No ha sido evaluada la farmacocinética de montelukast en pacientes con insuficiencia hepática más grave o con hepatitis.
Insuficiencia renal: Dado que montelukast y sus metabolitos no se excretan en la orina, la farmacocinética de montelukast no se evaluó en pacientes con insuficiencia renal. No se recomienda un ajuste de la dosis en estos pacientes.
Género: La farmacocinética de montelukast es similar en hombres y mujeres.
Raza: No se han estudiado las diferencias farmacocinéticas por motivos de raza.
Adolescentes y pacientes pediátricos: Los estudios farmacocinéticos evaluaron la exposición sistémica de la formulación de las tabletas masticables de 4 mg en pacientes pediátricos de 2 a 5 años de edad, las tabletas masticables de 5 mg en pacientes pediátricos de 6 a 14 años de edad.
La exposición sistémica media de la tableta masticable de 4 mg en pacientes pediátricos de 2 a 5 años de edad y las tabletas masticables de 5 mg en pacientes pediátricos de 6 a 14 años de edad es similar a la exposición sistémica media de la tableta recubierta con película de 10 mg en adultos. La tableta masticable de 5 mg debe usarse en pacientes pediátricos de 6 a 14 años de edad y la tableta masticable de 4 mg debe usarse en pacientes pediátricos de 2 a 5 años de edad.
En niños de 6 a 11 meses de edad, la exposición sistémica a montelukast y la variabilidad de las concentraciones plasmáticas de montelukast fueron mayores que las observadas en los adultos. Basado en análisis poblacionales, el AUC medio (4296 ng• hr/mL [rango de 1200 a 7153]) fue 60 % más alto, y el Cmax medio (667 ng/mL [rango de 201 a 1058]) fue 89 % más alto que aquellos observados en los adultos (AUC medio 2689 ng• hr/mL [rango de 1521 a 4595]) y Cmax medio (353 ng/mL [rango de 180 a 548]). La exposición sistémica en niños de 12 a 23 meses de edad fue menos variable, pero aún mayor que la observada en adultos. El AUC medio (3574 ng• hr/mL [rango de 2229 a 5408]) fue 33 % más alto y el Cmax medio (562 ng/mL [rango de 296 a 814]) fue 60 % más alto que aquellos observados en los adultos. La seguridad y la tolerabilidad del montelukast en un estudio farmacocinético de dosis única en 26 niños de 6 a 23 meses de edad fueron similares a las de los pacientes de dos años o más.
Interacciones farmacológicas: Teofilina, prednisona y prednisolona: Montelukast ha sido administrado con otros tratamientos utilizados habitualmente en la profilaxis y el tratamiento crónico del asma sin aparente aumento de reacciones adversas. En estudios de interacción farmacológica, la dosis clínica recomendada de montelukast no tuvo efectos clínicamente importantes en la farmacocinética de los siguientes fármacos: teofilina, prednisona y prednisolona.
Montelukast en una dosis de 10 mg una vez al día, dosificada al estado estacionario farmacocinético, no causó cambios clínicamente significativos en la cinética de una dosis intravenosa única de teofilina [predominantemente un sustrato de citocromo P450 (CYP) 1A2]. Montelukast en dosis de ≥ 100 mg diarios administrados en estado estacionario farmacocinético, no causó ningún cambio clínicamente significativo en los perfiles plasmáticos de prednisona o prednisolona después de la administración de prednisona oral o prednisolona intravenosa.
Anticonceptivos orales, Terfenadina, Digoxina y Warfarina: En los estudios de interacción farmacológica, la dosis clínica recomendada de montelukast no tuvo efectos clínicamente importantes en la farmacocinética de los siguientes medicamentos: anticonceptivos orales (noretindrona 1 mg/etinilestradiol 35 mcg), terfenadina, digoxina y warfarina. Montelukast en dosis de ≥ 100 mg diarios administrados en estado estacionario farmacocinético no alteró significativamente las concentraciones plasmáticas de cualquiera de los componentes de un anticonceptivo oral que contiene noretindrona 1 mg/etinilestradiol 35 mcg. Montelukast en una dosis de 10 mg una vez al día administrada en estado estacionario fármacocinético no cambió el perfil de concentración plasmática de terfenadina (un sustrato de CYP3A4) o fexofenadina, el metabolito carboxilado, y no prolongó el intervalo QTc después de la administración con terfenadina de 60 mg dos veces al día; no cambió el perfil farmacocinético ni la excreción urinaria de digoxina inmunorreactiva; No alteró el perfil farmacocinético de la warfarina (principalmente un sustrato de CYP2C9, 3A4 y 1A2) ni influyó en el efecto de una sola dosis oral de 30 mg de warfarina sobre el tiempo de protrombina ni sobre el Cociente Normalizado Internacional (INR).
Hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos, benzodiazepinas y descongestionantes: aunque no se realizaron estudios adicionales de interacción específicos, montelukast se usó conjuntamente con una amplia gama de fármacos comúnmente recetados en estudios clínicos sin evidencia de interacciones adversas clínicas. Estos medicamentos incluyeron hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos, benzodiazepinas y descongestionantes.
Citocromo P450 (CYP) inductores enzimáticos: El fenobarbital, que induce el metabolismo hepático, disminuyó el área bajo la curva de concentración plasmática (AUC) de montelukast aproximadamente 40% después de una única dosis de 10 mg de montelukast. No se recomienda regular la dosis de montelukast. Es razonable emplear un monitoreo clínico apropiado cuando se coadministran con montelukast los potentes inductores enzimáticos CYP, tales como fenobarbital o rifampicina.
Efecto de montelukast sobre las enzimas del citocromo P450 (CYP): Montelukast es un potente inhibidor de CYP2C8 in vitro. Sin embargo, los datos de un estudio clínico de interacción farmacológica con montelukast y rosiglitazona (un sustrato de prueba representativo de fármacos metabolizados principalmente por CYP2C8) en 12 individuos sanos demostraron que la farmacocinética de la rosiglitazona no se altera cuando los medicamentos son coadministrados, lo que indica que montelukast no inhibe el CYP2C8 in vivo. Por lo tanto, no se anticipa que el montelukast altere el metabolismo de fármacos metabolizados por esta enzima (por ejemplo, paclitaxel, rosiglitazona y repaglinida). Basándose en otros resultados in vitro en microsomas hepáticos humanos, las concentraciones plasmáticas terapéuticas de montelukast no inhiben CYP 3A4, 2C9, 1A2, 2A6, 2C19 o 2D6.
Citocromo P450 (CYP) Inhibidores de enzimas: Los estudios in vitro han demostrado que el montelukast es un sustrato de CYP 2C8, 2C9 y 3A4. La coadministración de montelukast con itraconazol, un fuerte inhibidor de CYP 3A4, no dio lugar a un aumento significativo de la exposición sistémica de montelukast. Los datos de un estudio clínico de interacción farmacológica que involucran a Montelukast y gemfibrozilo (un inhibidor de CYP 2C8 y 2C9) demostraron que el gemfibrozilo, en dosis terapéuticas, aumentaba la exposición sistémica de montelukast en 4,4 veces. La coadministración de itraconazol, gemfibrozilo y montelukast no siguió aumentando aún más la exposición sistémica de montelukast. Basándose en la experiencia clínica disponible, no se requiere un ajuste de dosis de montelukast luego de la coadministración de gemfibrozilo.