
ONBRIZE BREEZHALER
INDACATEROL
Cápsulas
Caja , Inhalador , Polvo para inhalación , 150 µg
Caja , Inhalador , Polvo para inhalación , 300 µg
DESCRIPCIÓN Y COMPOSICIÓN:
Forma farmacéutica: Polvo para inhalación en cápsulas duras.
Sustancia farmacéutica:
• 150 µg de polvo para inhalación en cápsulas duras:
Cada CÁPSULA contiene 194 µg de maleato de indacaterol, equivalentes a 150 µg de indacaterol.
La dosis administrada (la emitida por la boquilla del inhalador ONBRIZE® BREEZHALER®) es de 120 µg de indacaterol.
• 300 µg de polvo para inhalación en cápsulas duras:
Cada CÁPSULA contiene 389 µg de maleato de indacaterol, equivalentes a 300 µg de indacaterol.
La dosis administrada (la emitida por la boquilla del inhalador ONBRIZE® BREEZHALER®) es de 240 µg de indacaterol.
Principio activo: Indacaterol.
Excipientes: Lactosa monohidrato y gelatina.
INSTRUCCIONES ESPECIALES DE USO Y MANIPULACIÓN: Las instrucciones sobre la correcta administración y uso del producto figuran en el apartado Posología y administración.
INDICACIONES:
ONBRIZE® BREEZHALER®es un agonista adrenérgico ß2 de acción prolongada que se administra una vez al día como tratamiento broncodilatador de mantenimiento a largo plazo de la obstrucción de las vías respiratorias en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas: Grupo farmacoterapéutico: Medicamentos contra alteraciones obstructivas de las vías respiratorias, agonistas beta-2-adrenoreceptor selectivo, código ATC: R03AC18.
Mecanismo de acción: Los efectos farmacológicos de los agonistas de los adrenorreceptores ß2, son atribuibles, al menos en parte, a la estimulación de la adenil-ciclasa intracelular, la enzima que cataliza la conversión del trifosfato de adenosina (ATP) en 3’,5’-monofosfato de adenosina (AMP) cíclico (monofosfato cíclico). Al aumentar la concentración de AMP cíclico el músculo liso bronquial se relaja. Estudios in vitro han demostrado que la actividad agonista del indacaterol en los adrenorreceptores ß2 es más de 24 veces superior a la observada en los ß1 y 20 veces mayor que la registrada en los ß3. Cuando se inhala, el indacaterol actúa localmente en los pulmones como broncodilatador. El indacaterol es un agonista casi total del adrenorreceptor ß2 humano con una potencia de orden nanomolar. En bronquios humanos aislados, la actividad del indacaterol se inicia rápidamente y es prolongada.
Aunque los ß2 son los adrenorreceptores predominantes en el músculo liso bronquial y los ß1 son los predominantes en el corazón humano, en este órgano existen también receptores ß2 que representan entre el 10 y el 50% del total de los adrenorreceptores. No se conoce con exactitud la función de los adrenorreceptores ß2 en el corazón, pero su presencia plantea la posibilidad de que incluso los agonistas muy selectivos de dichos receptores tengan efectos cardíacos.
Efectos farmacodinámicos: La administración de 150 y 300 microgramos de ONBRIZE® BREEZHALER® una vez al día, mejoró la función pulmonar de forma clínicamente significativa (medida como el volumen espiratorio forzado durante el primer segundo, FEV1) a lo largo de 24 horas en varios ensayos clínicos de eficacia y farmacodinamia. Se produjo un inicio rápido de la acción en los 5 minutos siguientes a la inhalación, con un incremento del FEV1 con respecto al valor basal de 110-160 ml, comparable al efecto de 200 microgramos de salbutamol, agonista beta2 de acción rápida, y significativamente más rápido que 50/500 microgramos de salmeterol/fluticasona. Los valores máximos promedio del FEV1 respecto al valor basal fueron de 250-330 ml en el estado estacionario.
El efecto broncodilatador no dependía de la hora de administración, mañana o tarde.
ONBRIZE® BREEZHALER® demostró que reducía la hiperinsuflación pulmonar, dando como resultado un aumento de la capacidad inspiratoria durante el ejercicio y en reposo, comparado con placebo.
Efectos sobre la electrofisiología cardíaca: En un ensayo doble ciego controlado con placebo y fármaco activo (moxifloxacino), de dos semanas de duración en 404 voluntarios sanos, que recibieron dosis múltiples de 150 microgramos, 300 microgramos y 600 microgramos respectivamente. Ello demuestra que, a las dosis terapéuticas recomendadas o dos veces la dosis máxima recomendada, el medicamento no tiene potencial arritmogénico relacionado con la prolongación del intervalo QT. No hubo evidencia de una relación entre la concentración y el QTc delta en el intervalo de dosis estudiado.
En un ensayo de fase III, doble ciego, controlado con placebo, de 26 semanas de duración y con 605 pacientes con EPOC, se demostró que no hubo diferencias clínicamente relevantes en el desarrollo de acontecimientos arritmogénicos durante el seguimiento de 24 horas al inicio del ensayo y hasta tres veces durante el periodo de tratamiento de 26 semanas, entre los pacientes que recibieron las dosis recomendadas de ONBRIZE® BREEZHALER® y aquellos pacientes que recibieron placebo o tiotropio.
Eficacia clínica y seguridad: El programa de desarrollo clínico incluyó varios ensayos controlados y randomizados en pacientes con diagnóstico clínico de EPOC, uno de 12 semanas, dos de seis meses (uno de los cuales con fase de extensión de un año para evaluar la seguridad y tolerabilidad) y uno de un año. Los ensayos incluyeron determinaciones de la función pulmonar y resultados de salud tales como disnea, exacerbaciones y aspectos de calidad de vida relacionados con la salud.
Función pulmonar: La administración una vez al día de 150 microgramos y 300 microgramos de ONBRIZE® BREEZHALER®, demostró mejorías clínicamente significativas de la función pulmonar. La variable principal a las 12 semanas (FEV1 valle a las 24 horas) mostró un incremento de 130-180 ml respecto a placebo (p<0,001) con la dosis de 150 microgramos y un incremento de 60 ml respecto a 50 microgramos de salmeterol dos veces al día (p<0,001). Con la dosis de 300 microgramos se produjo un incremento de 170-180 ml respecto a placebo (p<0,001) y de 100 ml respecto a 12 microgramos de formoterol administrados dos veces al día (p<0,001). Ambas dosis produjeron un incremento de 40-50 ml, en un ensayo abierto, comparado con una dosis de 18 microgramos una vez al día de tiotropio (150 microgramos, p=0,004; 300 microgramos, p=0,01). El efecto broncodilatador a las 24 horas de ONBRIZE® BREEZHALER® se mantuvo desde la primera dosis hasta un año de tratamiento sin signos de pérdida de eficacia (taquifilaxia).
Beneficios sintomáticos: Ambas dosis demostraron una mejoría estadísticamente significativa en el alivio de los síntomas (Tabla 2) frente a placebo con respecto a la disnea y estado de salud (evaluados mediante el Índice Transicional de Disnea [ITD] y el Cuestionario Respiratorio de St. George [SGRQ], respectivamente). La magnitud de la respuesta fue generalmente superior a la observada con comparadores activos (Tabla 2). Además, los pacientes tratados con Onbrize Breezhaler necesitaron significativamente menos medicación de rescate, disfrutaron de más días sin requerir medicación de rescate comparado con placebo y presentaron un porcentaje significativamente mayor de días sin síntomas diurnos.
El análisis de eficacia conjunto de 6 meses de tratamiento demostró que la tasa de exacerbaciones de EPOC fue inferior, de forma estadísticamente significativa, respecto a la de placebo. La comparación del tratamiento con respecto a placebo mostró una relación de tasas de 0,68 (95% CI [0,47, 0,98]; valor-p 0,036) y 0,74 (95% CI [0,56, 0,96]; valor-p 0,026) para 150 microgramos y 300 microgramos, respectivamente.
Se dispone de experiencia limitada sobre el tratamiento en individuos de descendencia Africana.
|
Tabla 2. Mejoría de los síntomas a los 6 meses de tratamiento |
||||||
|
Tratamiento Dosis (microgramos) |
Indacaterol 150 una vez al día |
Indacaterol 300 una vez al día |
Tiotropio 18 una vez al día |
Salmeterol 50 dos veces al día |
Formoterol 12 dos veces al día |
Placebo |
|
Porcentaje de pacientes que consiguieron DMCI en ITD† |
57 a 62 b |
71 b 59 c |
57 b |
54 a |
54 c |
45 a 47 b 41 c |
|
Porcentaje de pacientes que consiguieron DMCI en SGRQ† |
53 a 58 b |
53 b 55 c |
47 b |
49 a |
51 c |
38 a |
|
Reducción del nº de pulsaciones/día de medicación de rescate respecto al periodo basal |
1,3 a 1,5 b |
1,6 b |
1,0 b |
1,2 a |
n/e |
0,3 a 0,4 b |
|
Porcentaje de días sin medicación de rescate |
60 a 57 b |
58 b |
46 b |
55 a |
n/e |
42 a 42 b |
|
Diseño del ensayo con a: Indacaterol 150 microgramos, salmeterol y placebo; b: Indacaterol 150 y 300 microgramos, tiotropio y placebo; c: indacaterol 300 microgramos, formoterol y placebo † DMCI = diferencia mínima clínicamente importante (cambio ≥1 punto en ITD, cambio ≥4 puntos en SGRQ) n/e= No evaluado a los seis meses. |
||||||
Población pediátrica: La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con ONBRIZE® BREEZHALER® en los diferentes grupos de la población pediátrica en enfermedad pulmonar obstructiva crónica (EPOC).
Propiedades farmacocinéticas: Indacaterol es una molécula quiral con configuración-R.
Los datos farmacocinéticos se obtuvieron de un número de ensayos clínicos realizados con voluntarios sanos y pacientes con EPOC.
Absorción: La mediana del tiempo transcurrido hasta alcanzar la concentración sérica máxima de indacaterol era de 15 minutos aproximadamente tras la inhalación de dosis únicas o repetidas.
La exposición sistémica al indacaterol aumentaba al aumentar la dosis (de 150 µg a 600 µg) de manera proporcional a ésta. La biodisponibilidad absoluta del indacaterol tras una dosis inhalada era, en promedio, de entre el 43 y el 45%. La exposición sistémica es consecuencia de una absorción mixta, pulmonar y gastrointestinal; el 75% aproximadamente de la exposición sistémica fue por absorción pulmonar y el 25% aproximadamente por absorción gastrointestinal.
Las concentraciones séricas de indacaterol aumentaron con la administración repetida de una dosis al día. El estado estacionario se alcanzaba al cabo de 12 a 14 días. La media de la razón de acumulación del indacaterol, es decir, el AUC a lo largo del intervalo de administración de 24 horas del día 14 comparado con el del día 1, se encontraba comprendido entre 2,9 y 3,5 para dosis únicas diarias inhaladas entre 150 µg y 600 µg.
Distribución: Tras la infusión intravenosa, el volumen de distribución del indacaterol era de 2557 litros, lo que indica una distribución muy amplia. La unión in vitro a proteínas séricas y plasmáticas humanas estaba comprendida entre el 94,1 y el 95,3% y entre el 95,1 y el 96,2%, respectivamente.
Biotransformación: Tras la administración oral de indacaterol radioactivo en un estudio de absorción, distribución, metabolismo y excreción (ADME) en el ser humano, el indacaterol inalterado era el principal componente en el suero, y representaba aproximadamente una tercera parte de toda el AUC de 24 horas relacionada con el fármaco. El metabolito más abundante en el suero era un derivado hidroxilado. Otros metabolitos importantes eran un O-glucurónido fenólico del indacaterol y el indacaterol hidroxilado. Se identificaron, asimismo, otros metabolitos: Un diastereoisómero del derivado hidroxilado, un N-glucurónido del indacaterol y productos resultantes de la C-desalquilación y la N-desalquilación.
Estudios in vitro indicaron que la UGT1A1 es la única isoenzima de la UGT que cataliza la conjugación del indacaterol a O-glucurónido fenólico. Se hallaron metabolitos oxidativos en incubaciones con CYP1A1, CYP2D6 y CYP3A4 recombinantes. Se concluyó que CYP3A4 es la principal isoenzima responsable de la hidroxilación del indacaterol. Estudios in vitro indicaron, asimismo, que el indacaterol es un sustrato de baja afinidad de la bomba de expulsión P-gp.
Eliminación: En los ensayos clínicos en los que se recogieron muestras de orina, la cantidad de indacaterol que se excretaba inalterado por vía renal era generalmente inferior al 2% de la dosis. La depuración renal del indacaterol estaba comprendida, en promedio, entre 0,46 y 1,20 l/h. Comparada con la depuración sérica del indacaterol, de 23,3 l/h, es evidente que la depuración renal desempeña un papel menor (aproximadamente entre el 2 y el 5% de la depuración sistémica) en la eliminación del indacaterol disponible sistémicamente.
En un estudio de ADME en el ser humano en el que se administró indacaterol por vía oral, predominó la excreción fecal sobre la urinaria. El indacaterol se excretaba en las heces humanas fundamentalmente como fármaco original inalterado (el 54% de la dosis) y, en menor grado, en forma de metabolitos hidroxilados (el 23% de la dosis). El balance de masas era completo: se recuperaba al menos el 90% de la dosis en las excretas.
El descenso de las concentraciones séricas de indacaterol era multifásico, con una semivida terminal media comprendida entre 45,5 y 126 horas. La semivida efectiva, calculada a partir de la acumulación de indacaterol tras dosis repetidas, estaba comprendida entre 40 y 52 horas, lo que es coherente con los aproximadamente 12 a 14 días que se tarda en alcanzar el estado estacionario.
Poblaciones especiales: Un análisis farmacocinético de la población mostró que no existe un efecto clínicamente relevante de la edad (adultos hasta 88 años), sexo, peso (32-168 kg) o raza sobre la farmacocinética de indacaterol. No indicó ninguna diferencia entre subgrupos étnicos en esta población.
Los pacientes con insuficiencia hepática leve o moderada no mostraron modificaciones significativas de la Cmáx o el AUC del indacaterol, ni la unión a proteínas difirió entre dichos pacientes y los controles sanos. No se llevaron a cabo estudios en sujetos con insuficiencia hepática grave.
Debido a la muy escasa contribución de la vía renal a la eliminación corporal total, no se llevaron a cabo estudios en pacientes con insuficiencia renal.
CONTRAINDICACIONES: ONBRIZE® BREEZHALER® está contraindicado en pacientes con hipersensibilidad al indacaterol o a cualquiera de los excipientes.
INFORMACIÓN PARA LOS PACIENTES:
En esta sección del prospecto se explica el uso y mantenimiento del inhalador ONBRIZE® BREEZHALER®. Por favor, lea y siga al pie de la letra estas instrucciones.
Si tiene dudas, consulte a su médico o farmacéutico.
Su caja de ONBRIZE® BREEZHALER®:
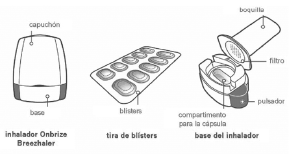
Cada caja de ONBRIZE® BREEZHALER® contiene:
• Un inhalador ONBRIZE® BREEZHALER®
• Blísteres que contienen cápsulas de ONBRIZE® BREEZHALER® para utilizarlas en el inhalador.
No ingiera las cápsulas de ONBRIZE® BREEZHALER®: El inhalador ONBRIZE® BREEZHALER® le permite inhalar el medicamento contenido en una cápsula de ONBRIZE® BREEZHALER®.
Utilice únicamente el inhalador ONBRIZE® BREEZHALER® incluido en esta caja.
No utilice las cápsulas de ONBRIZE® BREEZHALER® con ningún otro inhalador, y no utilice el inhalador ONBRIZE® BREEZHALER® para tomar ningún otro medicamento en cápsulas.
Cómo utilizar el inhalador:
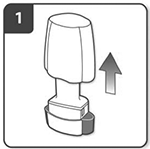
Retire el capuchón protector.
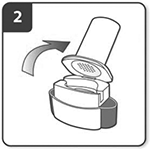
Abra el inhalador:
Sujete firmemente la base del inhalador e incline la boquilla para abrirlo.
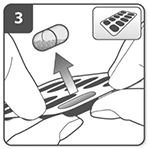
Prepare la cápsula:
Inmediatamente antes de su uso, con las manos secas extraiga una cápsula del blíster.
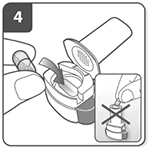
Introduzca la cápsula:
Coloque la cápsula en el compartimento correspondiente.
No coloque nunca la cápsula directamente en la boquilla.
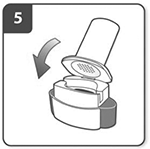
Cierre el inhalador:
Cierre por completo el inhalador. Deberá oír un «clic» en el momento en que se cierre totalmente.
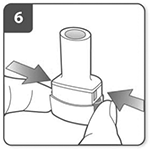
Perfore la cápsula:
Sujete el inhalador en posición vertical con la boquilla hacia arriba.
Presione a fondo ambos pulsadores una vez. Deberá oír un «clic» en el momento en que se perfore la cápsula.
No presione más de una vez los pulsadores.
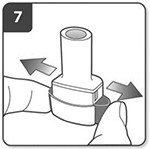
Suelte del todo los pulsadores.
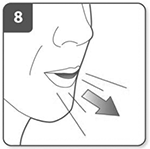
Espire (expulse el aire):
Antes de introducir la boquilla en la boca, espire (expulse el aire) profundamente.
No sople nunca dentro de la boquilla.
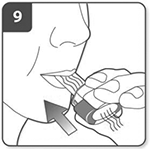
Inhale el medicamento:
Antes de inspirar (tomar aire), introduzca la boquilla en la boca y cierre los labios firmemente en torno a ella. Sujete el inhalador con los pulsadores situados a la derecha y a la izquierda (no arriba y abajo).
Inspire (tome aire) de forma rápida y constante, y tan profundamente como pueda. No presione los pulsadores.
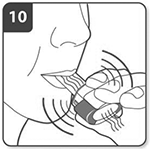
Nota: Cuando inspire a través del inhalador, la cápsula girará en la cámara y usted deberá oír un zumbido. Notará un gusto dulzón cuando el medicamento penetre en los pulmones.
Si no oye un zumbido, puede que la cápsula esté atascada en el compartimento. Si es así, abra el inhalador y libérela con cuidado dando golpecitos en la base del aparato. No intente liberar la cápsula presionando los pulsadores. En caso necesario, repita los pasos 8 y 9.
Contenga la respiración:
Contenga la respiración unos 5 o 10 segundos como mínimo mientras no le resulte incómodo, al tiempo que extrae el inhalador de la boca. Seguidamente espire (expulse el aire).
Abra el inhalador para comprobar si queda polvo en la cápsula.
Si queda, cierre el inhalador y repita los pasos 8 a 11. La mayoría de las personas son capaces de vaciar la cápsula con una o dos inhalaciones.
Algunas personas ocasionalmente tosen al poco de inhalar el medicamento. En caso de que le ocurra, no se preocupe: si la cápsula está vacía, es que ha recibido la dosis completa.
Extraiga la cápsula:
Cuando haya terminado de inhalar su dosis diaria de ONBRIZE® BREEZHALER®, abra de nuevo la boquilla, incline el inhalador para Que la cápsula vacía salga y deseche ésta. Cierre el inhalador y Coloque de nuevo el capuchón.
No conserve las cápsulas en el inhalador ONBRIZE® BREEZHALER®.
Marque el indicador diario de dosis: En el interior del envase hay un indicador diario de dosis.
Ponga una marca en la celdilla del día de hoy si ello le ayuda a recordar cuándo debe tomar la próxima dosis.
Recuerde:
• No ingiera las cápsulas de ONBRIZE® BREEZHALER®.
• Utilice únicamente el inhalador ONBRIZE® BREEZHALER® incluido en esta caja.
• Las cápsulas de ONBRIZE® BREEZHALER® han de conservarse siempre en el blíster, y sólo deben sacarse inmediatamente antes de utilizarlas.
• No coloque nunca una cápsula de ONBRIZE® BREEZHALER® directamente en la boquilla del inhalador ONBRIZE® BREEZHALER®.
• No presione los pulsadores de perforación más de una vez.
• No sople nunca en la boquilla del inhalador ONBRIZE® BREEZHALER®.
• Suelte siempre los pulsadores antes de inhalar.
• No lave nunca el inhalador ONBRIZE® BREEZHALER® con agua. Manténgalo seco. Véase más adelante Cómo limpiar el inhalador.
• No desmonte nunca el inhalador ONBRIZE® BREEZHALER®.
• Utilice siempre el inhalador ONBRIZE® BREEZHALER® nuevo incluido en cada caja nueva del medicamento ONBRIZE® BREEZHALER®.
• No conserve las cápsulas en el inhalador ONBRIZE® BREEZHALER®.
• Mantenga siempre el inhalador ONBRIZE® BREEZHALER® y las cápsulas de ONBRIZE® BREEZHALER®en un lugar seco.
Información complementaria: Ocasionalmente, fragmentos muy pequeños de la cápsula pueden atravesar el filtro y penetrar en la boca.
Si lo atraviesan, puede que note esos fragmentos en la lengua. No es peligroso ingerirlos ni inhalarlos.
Las probabilidades de que la cápsula se fragmente aumentan si se perfora más de una vez (paso 6).
Cómo limpiar el inhalador: Limpie el inhalador una vez por semana. Frote la boquilla por dentro y por fuera con un paño limpio y seco que no deje pelusa para eliminar los restos de polvo. No lave nunca el inhalador con agua.
Manténgalo seco.
Vida útil: 2 años.
Revisión de texto: Septiembre de 2013.
Fabricante: Novartis Pharma Stein AG - Suiza
NOVARTIS PHARMA AG, Basilea (Suiza)
® Marca registrada
FERTILIDAD, EMBARAZO Y LACTANCIA
Embarazo: No se dispone de datos clínicos sobre exposición de pacientes con EPOC embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción a una exposición clínicamente relevante (ver Datos preclínicos sobre seguridad). Al igual que otros agonistas adrenérgicos ß2, indacaterol puede inhibir el parto debido al efecto relajante sobre el músculo liso uterino. ONBRIZE® BREEZHALER® solo debe utilizarse durante el embarazo si los beneficios esperados superan los riesgos potenciales.
Lactancia: No se sabe si el indacaterol/metabolitos se excreta en la leche materna humana. Los datos farmacocinéticos/toxicológicos disponibles en animales muestran que indacaterol/metabolitos se excretan en la leche (ver Datos preclínicos sobre seguridad). No se puede excluir el riesgo en lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con ONBRIZE® BREEZHALER® tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad: Se ha observado en ratas un descenso en la tasa de embarazos. Sin embargo, se considera improbable que la inhalación de indacaterol a las dosis máximas recomendadas afecte la reproducción o fertilidad en seres humanos (ver Datos preclínicos sobre seguridad).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: La influencia de ONBRIZE® BREEZHALER® sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
REACCIONES ADVERSAS:
Resumen del perfil toxicológico: Las reacciones adversas más frecuentes con las dosis recomendadas consistieron en rinofaringitis (14,3%), infección de las vías respiratorias altas (14,2%), tos (8,2%), cefalea (3,7%) y espasmos musculares (3,5%). La gran mayoría fueron de carácter leve o moderado y su frecuencia disminuyó al continuar el tratamiento.
Con las dosis recomendadas, el conjunto de las reacciones adversas a ONBRIZE® BREEZHALER® en pacientes con EPOC pone de manifiesto unos efectos sistémicos de la estimulación adrenérgica ß2 carentes de trascendencia clínica. La variación media de la frecuencia cardíaca era inferior a un latido por minuto, y la taquicardia era infrecuente y se notificó con una frecuencia similar a la registrada con el placebo. No se detectaron prolongaciones significativas del intervalo QTcF en comparación con el placebo. La frecuencia de intervalos QTcF apreciablemente prolongados [es decir, >450 ms (hombres) y >470 ms (mujeres)] y las notificaciones de hipopotasemia fueron similares a las registradas con placebo. La media de las variaciones máximas de la glucemia era similar con ONBRIZE® BREEZHALER® y con placebo.
Resumen tabulado de las reacciones adversas observadas en los ensayos clínicos: El programa de desarrollo clínico de fase III de ONBRIZE® BREEZHALER® incluyó pacientes con un diagnóstico clínico de EPOC entre moderada y grave. En él, se han tratado 4764 pacientes con dosis de indacaterol de hasta dos veces la dosis máxima recomendada y hasta un año de tratamiento. De estos pacientes, 2611 recibieron 150 microgramos una vez al día y 1157 recibieron 300 µg una vez al día. Aproximadamente el 41% de los pacientes padecían EPOC grave. La media de edad de los pacientes era de 64 años, el 48% tenían 65 años o más, y la mayoría (80%) eran de raza caucásica.
Las reacciones adversas de la tabla 1 proceden de la mencionada base de datos agrupados de seguridad en la EPOC y se citan según la clasificación de órganos, aparatos o sistemas del MedDRA y se ordenan por orden decreciente de frecuencia en la pauta diaria de 150 µg de indacaterol. En cada clase de órgano, aparato o sistema, las reacciones adversas se enumeran por orden de frecuencia, primero las más frecuentes. Además, para cada reacción adversa se indica la categoría de frecuencia correspondiente según la convención siguiente (CIOMS III): muy frecuente (≥ 1/10); frecuente (≥ 1/100, < 1/10); infrecuente (≥ 1/1000, < 1/100); rara (≥ 1/10 000, < 1/1000); muy rara (< 1/10 000), frecuencia no conocida (no puede estimarse de los datos disponibles).
|
Tabla 1. Reacciones adversas |
|
|
Reacciones adversas |
Categoría de frecuencia |
|
Infecciones e infestaciones |
|
|
Rinofaringitis |
Frecuente |
|
Infección de las vías respiratorias altas |
Frecuente |
|
Sinusitis |
Frecuente |
|
Trastornos del sistema inmunitario |
|
|
Hipersensibilidad1 |
Poco frecuente |
|
Trastornos del metabolismo y de la nutrición |
|
|
Diabetes mellitus e hiperglucemia |
Poco frecuente |
|
Trastornos del sistema nervioso |
|
|
Cefalea |
Frecuente |
|
Mareos |
Frecuente |
|
Parestesia |
Poco frecuente |
|
Trastornos cardíacos |
|
|
Isquemia coronaria |
Poco frecuente |
|
Palpitaciones |
Poco frecuente |
|
Fibrilación auricular |
Poco frecuente |
|
Taquicardia |
Poco frecuente |
|
Trastornos respiratorios, torácicos y del mediastino |
|
|
Tos |
Frecuente |
|
Dolor orofaríngeo, incluida la irritación de la garganta |
Frecuente |
|
Rinorrea |
Frecuente |
|
Broncoespasmo paradójico |
Poco frecuente |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Prurito/erupción cutánea |
Poco frecuente |
|
Trastornos osteomusculares y del tejido conectivo |
|
|
Espasmos musculares |
Frecuente |
|
Dolor osteomuscular |
Poco frecuente |
|
Mialgia |
Poco frecuente |
|
Trastornos generales y afecciones en el sitio de la administración |
|
|
Dolor torácico |
Frecuente |
|
Edema periférico |
Frecuente |
|
1 Se han notificado casos de hipersensibilidad asociados al uso de ONBRIZE® BREEZHALER® después de la aprobación del producto. Como estos casos fueron notificados de forma espontánea por una población de tamaño incierto no siempre es posible estimar su frecuencia, ni establecer una relación causal con el uso del medicamento, de modo que su frecuencia se calculó a partir de la experiencia recabada en los ensayos clínicos. |
|
Con una dosis 600 µg administrados una vez al día, las reacciones adversas a ONBRIZE® BREEZHALER® eran, en conjunto, similares a las observadas con las dosis recomendadas. También se registraron temblores (frecuente).
Reacciones adversas específicas: En ensayos clínicos de fase III, profesionales sanitarios observaron que, en las visitas al consultorio, una media del 17-20% de los pacientes presentaba tos esporádica que solía aparecer en los 15 segundos posteriores a la inhalación y generalmente duraba 5 segundos (aproximadamente 10 segundos en fumadores). Se observó con mayor frecuencia en mujeres que en hombres y en fumadores que en exfumadores. Esta tos que aparecía tras la inhalación se toleraba bien, y en los estudios en los que se administraron las dosis recomendadas no obligó a ningún paciente a dejar el tratamiento (la tos es un síntoma de EPOC y hasta el 8,2% de los pacientes refirieron tos como acontecimiento adverso). No hay pruebas de que la tos que aparece tras la inhalación se asocie a broncoespasmo, exacerbaciones, agravamiento de la enfermedad o pérdida de eficacia.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización.
Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento.
INCOMPATIBILIDADES: No procede.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Medicamentos simpaticomiméticos: La administración concurrente de otros simpaticomiméticos (solos o como integrantes de una politerapia) puede potenciar los efectos adversos de ONBRIZE® BREEZHALER® (véase Advertencias y precauciones especiales de uso).
ONBRIZE® BREEZHALER® no debe utilizarse junto con otros agonistas adrenérgicos ß2 de larga duración ni con medicamentos que los contengan.
Tratamiento hipopotasemico: La coadministración de derivados metilxantínicos, corticoides o diuréticos no ahorradores de potasio puede intensificar el posible efecto hipopotasemiante de los agonistas adrenérgicos ß2 (véase Advertencias y precauciones especiales de uso).
Bloqueantes beta-adrenérgicos: Los bloqueantes beta-adrenérgicos y los agonistas adrenérgicos ß2 pueden debilitar o antagonizar el efecto del uno al otro cuando se administran de forma conjunta. Por ello, no debe administrarse ONBRIZE® BREEZHALER® junto con betabloqueantes (incluidos los colirios) a menos que su uso esté claramente justificado. Cuando sean necesarios, se optará preferentemente por betabloqueantes cardioselectivos, aunque deben administrarse con precaución.
Interacciones asociadas al metabolismo y a transportadores: La inhibición de los principales responsables de la depuración del indacaterol, el CYP3A4 y la glucoproteína P (P-gp) aumenta hasta dos veces la exposición sistémica del fármaco. La magnitud de los aumentos de la exposición como consecuencia de interacciones, si bien no afecta a la seguridad de acuerdo con la experiencia adquirida con el tratamiento de ONBRIZE® BREEZHALER® en los ensayos clínicos de hasta un año de duración y utilizando la dosis de hasta el doble de la dosis máxima terapéutica recomendada.
No se han observado interacciones farmacológicas entre ONBRIZE® BREEZHALER® y medicamentos coadministrados. Los estudios in vitro han indicado que la capacidad del indacaterol de causar interacciones metabólicas con medicamentos es insignificante en los niveles de exposición sistémica que se alcanzan en la práctica clínica.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Los efectos sobre el sistema cardiovascular atribuibles a las propiedades agonistas beta2 de indacaterol incluyeron taquicardia, arritmias y lesiones miocárdicas en perros. En roedores se observó una leve irritación de las fosas nasales y laringe. Todos estos hallazgos se observaron con exposiciones suficientemente superiores a las esperadas en humanos.
Aunque el indacaterol no afectó a la capacidad reproductora general en un estudio de fertilidad en ratas, se observó un descenso en el número de descendientes de la progenie F1 en un estudio peri y post-desarrollo a una exposición 14 veces más elevada que en humanos tratados con ONBRIZE® BREEZHALER®. Indacaterol no fue embriotóxico o teratogénico en ratas o conejos.
Los estudios de genotoxicidad no revelaron ningún poder mutagénico o clastógenico. Se evaluó la carcinogenicidad en un estudio de dos años en ratas y en un estudio transgénico de seis meses en ratones. El aumento de la incidencia de leiomiomas de ovarios benignos e hiperplasia focal del músculo liso de ovarios en ratas fue consistente con hallazgos similares observados con otros agonistas beta2-adrenérgicos. No se observó evidencia de carcinogenicidad en ratones. En estos estudios, las exposiciones sistémicas (AUC) en ratas y ratones a niveles de efecto adverso no observable fueron como mínimo 7 y 49 veces superiores, respectivamente, a las observadas en humanos tratados con ONBRIZE® BREEZHALER® una vez al día a la dosis de 300 microgramos
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO:
Asma: ONBRIZE® BREEZHALER® es un agonista beta2-adrenérgico de larga duración el cual está indicado únicamente para EPOC y no debe utilizarse en asma debido a la ausencia de datos sobre resultados a largo plazo en esta indicación.
Los agonistas adrenérgicos ß2 de acción prolongada pueden aumentar el riesgo de que se produzcan acontecimientos adversos graves relacionados con el asma, incluyendo muertes, cuando se utilizan para el tratamiento del asma.
Hipersensibilidad: Tras la administración de ONBRIZE® BREEZHALER® se han notificado reacciones inmediatas de hipersensibilidad. Ante la aparición de signos indicativos de una reacción alérgica (a saber, dificultad para respirar o deglutir, hinchazón de la lengua, los labios y el rostro, urticaria o exantema) se debe retirar de inmediato el tratamiento con ONBRIZE® BREEZHALER® e instituir un tratamiento alternativo.
Broncoespasmo paradójico: Como ocurre con otros tratamientos inhalatorios, la administración de ONBRIZE® BREEZHALER® puede causar un broncoespasmo paradójico que puede ser amenazante para la vida. En caso de producirse, deberá interrumpirse de inmediato la administración de ONBRIZE® BREEZHALER® y se instaurará un tratamiento alternativo.
Agravamiento de la enfermedad: ONBRIZE® BREEZHALER® no está indicado para el tratamiento inicial de los episodios agudos de broncoespasmo, es decir, como tratamiento de rescate. Si la EPOC se agrava durante el tratamiento con ONBRIZE® BREEZHALER®, es preciso volver a examinar al paciente y reconsiderar el tratamiento de EPOC. No es adecuado aumentar la dosis diaria de ONBRIZE® BREEZHALER® por encima de la dosis máxima de 300 microgramos.
Efectos sistémicos: Aunque no suelen observarse efectos clínicamente significativos sobre el aparato cardiovascular después de administrar ONBRIZE® BREEZHALER® en las dosis recomendadas, como ocurre con otros agonistas adrenérgicos ß2, el indacaterol debe utilizarse con cautela en pacientes con trastornos cardiovasculares (insuficiencia coronaria, infarto agudo de miocardio, arritmias cardíacas e hipertensión), con trastornos convulsivos o tirotoxicosis, y en pacientes que responden de forma inusual a los agonistas adrenérgicos ß2.
Efectos cardiovasculares: Al igual que otros agonistas adrenérgicos ß2, el indacaterol puede tener efectos cardiovasculares clínicamente significativos en algunos pacientes, objetivables por el aumento de la frecuencia del pulso, la presión sanguínea o los síntomas. Si aparecen estos efectos, puede que haya que suspender el tratamiento. Se ha observado, asimismo, que los agonistas adrenérgicos ß inducen alteraciones del ECG, como aplanamiento de la onda T, prolongación del intervalo QT y depresión del segmento ST, si bien se desconoce la trascendencia clínica de estas observaciones.
Por lo tanto, los agonistas adrenérgicos ß2 de larga duración como ONBRIZE® BREEZHALER® se deben utilizar con precaución en pacientes con conocimiento o sospecha de prolongación del intervalo QT o tratados con medicamentos que afectan al intervalo QT.
No se han observado efectos clínicamente relevantes sobre la prolongación del intervalo QTc en ensayos clínicos con ONBRIZE® BREEZHALER® a las dosis terapéuticas recomendadas (véase Propiedades farmacológias).
Hipopotasemia: En algunos pacientes, los agonistas adrenérgicos ß2 pueden inducir una hipopotasemia importante, capaz de provocar efectos adversos cardiovasculares. El descenso del potasio sérico suele ser transitorio y no requiere administrar suplementos. En pacientes con EPOC grave, la hipoxia y el tratamiento concomitante pueden intensificar la hipopotasemia (véase Interacciones), lo que puede aumentar la propensión a las arritmias cardíacas.
Hiperglucemia: La inhalación de dosis elevadas de agonistas adrenérgicos ß2 puede acrecentar la concentración plasmática de glucosa. Al iniciar un tratamiento con ONBRIZE® BREEZHALER®, dicha concentración debe vigilarse más estrechamente en los pacientes diabéticos.
En los ensayos clínicos, las variaciones clínicamente significativas de la glucemia fueron por lo general entre un 1 y un 2% más frecuentes con ONBRIZE® BREEZHALER® administrado en las dosis recomendadas que con el placebo. ONBRIZE® BREEZHALER® no ha sido estudiado en pacientes con diabetes mellitus no controlada.
Excipientes: Las cápsulas contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
POSOLOGÍA Y ADMINISTRACIÓN:
Adultos: La posología recomendada para ONBRIZE® BREEZHALER® consiste en la inhalación una vez al día del contenido de una cápsula de 150 µg utilizando el inhalador ONBRIZE® BREEZHALER®. La dosis sólo debe aumentarse por prescripción facultativa.
Se ha constatado que la inhalación una vez al día del contenido de una cápsula de 300 µg utilizando el inhalador ONBRIZE® BREEZHALER® ofrece beneficios clínicos adicionales en algunos pacientes, por ejemplo, en lo que concierne a la dificultad para respirar, especialmente en los pacientes afectados de EPOC grave. La dosis máxima es de 300 µg una vez al día.
ONBRIZE® BREEZHALER® debe administrarse a la misma hora cada día.
Si se olvida una dosis, la próxima dosis debe administrarse el día siguiente a la hora habitual.
Posología en poblaciones especiales:
• Población de edad avanzada: La concentración plasmática máxima y la exposición sistémica global aumentan con la edad pero no se requiere ajuste de dosis en pacientes de edad avanzada.
• Insuficiencia hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. No se dispone de datos sobre el uso de ONBRIZE® BREEZHALER® en pacientes con insuficiencia hepática grave.
• Insuficiencia renal: No se requiere ajuste de dosis en pacientes con insuficiencia renal.
• Población pediátrica: No existe una recomendación de uso específica para ONBRIZE® BREEZHALER® en la población pediátrica (menores de 18 años).
Modo de administración: Las cápsulas de ONBRIZE® BREEZHALER® sólo deben administrarse por vía inhalatoria bucal y utilizando exclusivamente el inhalador ONBRIZE® BREEZHALER®. Las cápsulas de ONBRIZE® BREEZHALER® no deben ingerirse.
Las cápsulas de ONBRIZE® BREEZHALER® deben conservarse siempre en el blíster y extraerse inmediatamente antes de usarlas. Las instrucciones de uso del inhalador ONBRIZE® BREEZHALER® figuran en el apartado Información para el paciente, al final de este prospecto.
Se debe enseñar a los pacientes la forma de administrar correctamente el producto. Si los pacientes no sienten una mejoría en la respiración, hay que preguntarles si no han ingerido el medicamento en lugar de inhalarlo.
Para consultar las instrucciones de uso del medicamento antes de la administración, ver Instrucciones especiales de uso y manipulación.
SOBREDOSIS: En pacientes con EPOC, dosis únicas 10 veces superiores a la dosis terapéutica máxima recomendada se asociaron a un aumento moderado de la frecuencia del pulso, la tensión arterial sistólica y el intervalo QTc.
Es probable que una sobredosis de indacaterol cause los efectos excesivos típicos de los agonistas adrenérgicos ß2, es decir, taquicardia, temblor, palpitaciones, cefalea, náuseas, vómitos, somnolencia, arritmias ventriculares, acidosis metabólica, hipopotasemia e hiperglucemia.
Está indicado prescribir tratamiento sintomático y complementario. En los casos graves se debe hospitalizar al paciente. Se puede considerar la posibilidad de emplear betabloqueantes cardioselectivos, pero sólo bajo la supervisión de un médico y con suma cautela, ya que los bloqueantes adrenérgicos ß pueden provocar broncoespasmo.
CONSERVACIÓN: Consérvese a menos de 30 °C.
No debe utilizarse ONBRIZE® BREEZHALER® después de la fecha de caducidad que figura en el envase.
ONBRIZE® BREEZHALER® debe conservarse fuera del alcance y la vista de los niños.