
NOVORAPID FLEXPEN
INSULINA
Solución inyectable
Envase(s) , 1 Pluma prellenada , Solución inyectable vía subcutánea , 3 Mililitros
Envase(s) , 5 Pluma prellenada , Solución inyectable vía subcutánea , 3 Mililitros
Envase(s) , 10 Pluma prellenada , Solución inyectable vía subcutánea , 3 Mililitros
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
1 ml de la SOLUCIÓN contiene: 100 U de insulina asparto* (que equivale a 3,5 mg).
1 lapicera prellenada contiene: 3 ml equivalentes a 300 U.
* Insulina asparto producida por medio de la tecnología del ADN recombinante en Saccharomyces cerevisiae.
FORMA FARMACÉUTICA: Solución transparente, incolora y acuosa para inyección en lapicera prellenada. FlexPen®.
LISTA DE EXCIPIENTES: Glicerol, fenol, metacresol, cloruro de zinc, fosfato disódico dihidrato, cloruro de sodio, ácido clorhídrico/hidróxido de sodio (para ajustar el pH) y agua para inyección.
INDICACIONES TERAPÉUTICAS: Tratamiento de la diabetes mellitus en pacientes adultos, adolescentes y niños a partir de los 2 años de edad.
INSTRUCCIONES DE USO PARA EL PACIENTE:
No use NOVORAPID®:
• Si es alérgico (hipersensible) a la insulina asparto o a alguno de los demás ingredientes de NOVORAPID®.
• Si sospecha que está comenzando un episodio de hipoglucemia (bajo nivel de azúcar en sangre).
• Si FlexPen® se cae, se daña o se rompe.
• Si no ha sido conservado correctamente o si fue congelado.
• Si la insulina no tiene un aspecto transparente e incoloro.
Antes de usar NOVORAPID®:
• Controle la etiqueta para asegurarse de que sea el tipo de insulina correcto.
• Siempre use una aguja nueva en cada inyección para evitar la contaminación.
• No se deben compartir las agujas ni NOVORAPID® FlexPen®.
Método de administración: NOVORAPID® se inyecta debajo de la piel (por vía subcutánea) o por infusión continua en un sistema de bomba. NOVORAPID® también puede ser inyectado directamente en una vena (por vía endovenosa) por un profesional del ámbito de la salud. La insulina nunca debe inyectarse directamente en un músculo (por vía intramuscular).
Siempre cambie el sitio de inyección dentro de la misma región para reducir el riesgo de desarrollar endurecimiento o bultos en la piel. Los mejores lugares para inyectarse son: el frente de la cintura (abdomen); la parte superior de los brazos y el frente de los muslos. La insulina actuará más rápidamente si la inyecta alrededor de la cintura. Siempre debe medir el nivel de azúcar en sangre en forma regular.
Cómo manipular NOVORAPID® FlexPen®: Lea minuciosamente las Instrucciones para uso incluidas en NOVORAPID® FlexPen®. La lapicera debe utilizarse como se describe en las Instrucciones para su uso.
INSTRUCCIONES DE USO PARA EL PACIENTE: Lea las siguientes instrucciones con atención antes de utilizar NOVORAPID® FlexPen®.
FlexPen® es una lapicera de insulina para marcar la dosis única. Puede seleccionar dosis de 1 a 60 unidades en incrementos de a 1 unidad.
FlexPen® está diseñada para ser utilizada con agujas descartables NovoFine® o NovoTwist® de una longitud de hasta 8 mm. Como medida de precaución, siempre lleve un aplicador de insulina de repuesto en caso de que se pierda o se dañe FlexPen®.
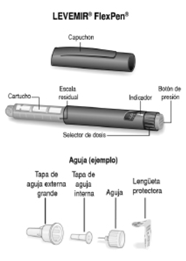
Preparación de NOVORAPID® FlexPen®: Controle la etiqueta para asegurarse de que FlexPen® contenga el tipo de insulina correcto
A. Retire el capuchón de la lapicera.
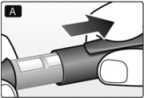
B. Retire la lengüeta protectora de la nueva aguja descartable.
Enrosque la aguja en forma recta y con firmeza en la FlexPen®.
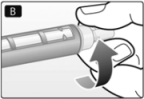
C. Retire la tapa externa grande de la aguja y consérvela para más tarde.
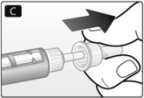
D. Retire la tapa interna de la aguja y deséchela.
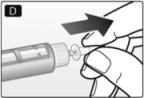
• Siempre utilice una nueva aguja para cada inyección para evitar la contaminación.
• Tenga cuidado de no torcer o dañar la aguja antes de usarla.
• Para reducir el riesgo de pinchazos de aguja inesperados, nunca coloque la tapa interna de la aguja después de retirarla de la aguja.
Mantenimiento:
• FlexPen® está diseñada para funcionar con exactitud y seguridad. Se la debe manipular con cuidado. Si se cae o si se golpea, existe riesgo de que se dañe y pierda insulina.
• Puede limpiar el exterior de la FlexPen® pasándole un paño medicinal. No sumerja la lapicera, no la lave ni la lubrique ya que podría dañarla.
• No rellene la FlexPen®.
Control del flujo de insulina: Antes de cada inyección, se pueden acumular pequeñas cantidades de aire en el cartucho durante el uso normal. Para evitar la inyección de aire y asegurar una dosis adecuada:
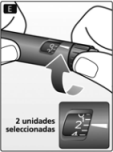
E. Gire el selector de dosis para aplicar 2 unidades.
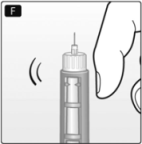
F. Sostenga la FlexPen® con la aguja apuntando hacia arriba y golpee el cartucho suavemente con el dedo varias veces para que suban las burbujas de aire a la parte superior del cartucho.
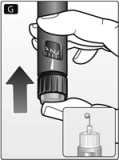
G. Con la aguja hacia arriba, presione el botón a presión hasta el fondo. El selector de dosis volverá a 0.
Deberá aparecer una gota de insulina en la punta de la aguja. En caso contrario, cambie de aguja y repita el procedimiento no más de 6 veces.
Si aún así no aparece la gota de insulina, la lapicera está dañada y debe utilizar una lapicera nueva.
Selección de la dosis: Controle que el selector de dosis esté en 0.
H. Gire el selector de dosis para seleccionar el número de unidades que desea inyectar.
La dosis se puede corregir hacia arriba o hacia abajo girando el selector de dosis en la dirección que corresponda hasta que el indicador marque la dosis correcta.
Cuando gire el selector de dosis, tenga cuidado de no presionar el botón a presión ya que saldría la insulina.
No se puede seleccionar una dosis mayor que el número de unidades que quedan en el cartucho.

• No utilice la escala residual para medir la dosis de insulina.
Aplicación de la inyección: Inserte la aguja en la piel. Utilice la técnica de inyección que le indique el médico o la enfermera.
I. Inyecte la dosis presionando el botón a presión hasta el fondo hasta que el indicador marque 0. Tenga cuidado de presionar solamente el botón a presión al inyectar.
El solo hecho de girar el selector de dosis no inyecta la insulina.
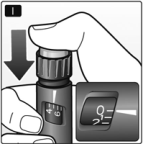
J. Mantenga el botón a presión completamente presionado después de la inyección hasta retirar la aguja de la piel.
La aguja debe permanecer en la piel durante 6 segundos como mínimo.
Esto asegura que se haya inyectado toda la dosis.
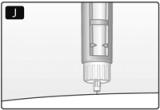
K. Lleve la aguja hacia adentro de la tapa externa grande sin tocar la tapa externa grande. Cuando la aguja esté cubierta, con cuidado empuje la tapa externa grande completamente hacia adentro y luego desenrosque la aguja.
Descártela con cuidado y coloque el capuchón de la lapicera en su posición.
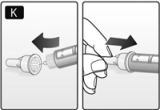
• Siempre retire la aguja después de cada inyección y guarde la FlexPen® sin la aguja incorporada. De lo contrario, el líquido podría derramarse, lo cual puede generar dosis inexactas.
• Los profesionales de la salud deben tener mucho cuidado al manipular agujas usadas para evitar pinchazos de aguja.
• Descarte la FlexPen® usada con cuidado sin la aguja incorporada.
• No se deben compartir las agujas ni NOVORAPID® FlexPen®.
Elaborado por:
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsværd, Dinamarca
NovoRapid®, FlexPen®, NovoFine® y NovoTwist® son marcas registradas propiedad de
Novo Nordisk A/S, Dinamarca
NOVO NORDISK
PROPIEDADES FARMACOCINÉTICAS: En NOVORAPID®, la sustitución del aminoácido prolina por ácido aspártico en la posición B28 reduce la tendencia a formar hexámeros como se observa con la insulina humana soluble. Por lo tanto, NOVORAPID® se absorbe más rápidamente desde la capa subcutánea que la insulina humana soluble.
El tiempo transcurrido hasta alcanzar la concentración máxima es, en promedio, la mitad del tiempo transcurrido con la insulina humana soluble. Se alcanzó una media de la concentración plasmática máxima de 492 pmol/l 40 minutos después de una dosis subcutánea de 0,15 U/kg de peso corporal en pacientes con diabetes tipo 1. Las concentraciones de insulina retornaron al nivel basal alrededor de 4 a 6 horas después de la dosis. La velocidad de absorción fue algo más lenta en pacientes con diabetes tipo 2, dando como resultado una Cmáx menor (352 ± 240 pmol/l) y más tarde tmáx (60 minutos).
La variabilidad intraindividual en el tiempo transcurrido hasta la concentración máxima es significativamente menor para NOVORAPID® que para la insulina humana soluble, mientras que la variabilidad intraindividual en la Cmáx para NOVORAPID® es mayor.
Niños y adolescentes: Las propiedades farmacocinéticas y farmacodinámicas de NOVORAPID® fueron investigadas en niños y adolescentes con diabetes tipo 1. La insulina asparto se absorbió rápidamente en ambos grupos de edad, con una tmax similar como en los adultos. Sin embargo, la Cmáx difirió entre los grupos de edad, enfatizando la importancia del ajuste individual de NOVORAPID®.
Pacientes de edad avanzada: Las diferencias relativas en las propiedades farmacocinéticas entre la insulina asparto y la insulina humana soluble en los pacientes de edad avanzada con diabetes tipo 2, fueron similares a las observadas en los pacientes sanos y en los pacientes más jóvenes con diabetes. Se observó una menor velocidad de absorción en los pacientes de edad avanzada, que causó un tmáx posterior (82 minutos), mientras que el nivel de Cmáx fue similar al observado en pacientes más jóvenes con diabetes tipo 2 y levemente menor que el de los pacientes con diabetes tipo 1.
Deterioro de la función hepática: En pacientes con deterioro de la función hepática, el tmáx se demoró hasta alrededor de 85 min (50 min. en pacientes con función hepática normal) mientras que el AUC, la Cmáx y el CL/F fueron similares.
Deterioro de la función renal: Se realizó un estudio de farmacocinética de dosis única con insulina asparto en 18 pacientes con función renal normal a deterioro severo de la función renal. No se hallaron efectos evidentes en los valores del clearance de creatinina sobre el AUC, la Cmáx, el CL/F y el tmax de la insulina asparto. Los datos fueron limitados en pacientes con deterioro moderado y severo de la función renal. No se investigaron pacientes con insuficiencia renal que requieren tratamiento con diálisis.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Drogas utilizadas en la diabetes. Insulinas y análogos para inyección, de acción rápida. Código ATC: A10AB05.
Mecanismo de acción: NOVORAPID® produce un inicio de acción más rápido en comparación con la insulina soluble humana, conjuntamente con una concentración menor de glucosa, según lo evaluado dentro de las cuatro primeras horas después de una comida. NOVORAPID® tiene una duración de acción más corta en comparación con la insulina soluble humana después de la inyección subcutánea.
Cuando se inyecta NOVORAPID® por vía subcutánea, el inicio de la acción se produce dentro de los 10 a 20 minutos de la inyección. El efecto máximo se alcanza entre 1 y 3 horas después de la inyección.
La duración de la acción es de 3 a 5 horas.
La insulina asparto es equivalente a la insulina humana en términos molares.
• Adultos: Estudios clínicos realizados en pacientes con diabetes tipo I demostraron un nivel menor de glucosa en sangre postprandial con NOVORAPID® comparado con la insulina humana soluble. En dos estudios a etiqueta abierta a largo plazo realizados en pacientes con diabetes tipo 1 que comprendieron a 1070 y 884 pacientes, respectivamente, NOVORAPID® redujo la hemoglobina glicosilada en 0,12 y en 0,15 puntos porcentuales comparado con la insulina humana soluble; una diferencia de significación clínica dudosa.
• Pacientes de edad avanzada: En un estudio PK/PD, las diferencias relativas en las propiedades PD entre la insulina asparto y la insulina humana soluble en los pacientes de edad avanzada con diabetes tipo 2 fueron similares a las observadas en pacientes sanos y en pacientes más jóvenes con diabetes.
• Niños y adolescentes: Cuando se administró a niños, NOVORAPID® mostró un control de la glucosa a largo plazo similar comparado con la insulina humana soluble.
En estudios clínicos realizados en niños y adolescentes de 2 a 17 años de edad, el perfil farmacodinámico de la insulina asparto en niños fue similar al que se observó en adultos.
Estudios clínicos realizados en pacientes con diabetes tipo 1 demostraron una reducción del riesgo de hipoglucemia nocturna con la insulina asparto comparado con la insulina humana soluble. El riesgo de hipoglucemia diurna no aumentó de manera significativa.
• Embarazo: Un estudio clínico que comparó la seguridad y la eficacia de la insulina asparto vs. la insulina humana soluble en el tratamiento de mujeres embarazadas con diabetes tipo 1 (322 embarazos expuestos) no indicó ningún efecto adverso con la insulina asparto en el embarazo o en la salud del feto/neonato.
Además, los datos provenientes de un estudio clínico que incluyó a 27 mujeres con diabetes gestacional randomizadas al tratamiento con insulina asparto vs. insulina humana soluble mostraron perfiles de seguridad similares entre los tratamientos así como una mejoría significativa en el control de la glucosa postprandial en el grupo tratado con insulina asparto.
CONTRAINDICACIONES: Hipersensibilidad a la sustancia activa o a cualquiera de sus excipientes.
PRECAUCIONES ESPECIALES PARA LA CONSERVACIÓN:
• Conservar en refrigerador (2-8 °C). Mantener alejado del elemento enfriador. No congelar.
• Mantener el capuchón de la lapicera colocado en NOVORAPID® FlexPen® para protegerlo de la luz.
• NOVORAPID® debe estar protegido del calor y la luz excesivos.
• Después de abrirlo por primera vez o si se lleva como repuesto: No refrigerar. Conservar a una temperatura inferior a 30 °C.
• La vida útil del producto mientras está en uso es de 4 semanas.
EMBARAZO Y LACTANCIA:
Embarazo: NOVORAPID® (insulina asparto) puede utilizarse durante el embarazo.
Los datos provenientes de dos estudios clínicos controlados randomizados no indican la aparición de efectos adversos de la insulina asparto en el embarazo o en la salud del feto/neonato en comparación con la insulina humana soluble (ver Propiedades farmacodinámicas).
Se recomienda un control más intenso de la glucosa en sangre y el monitoreo de la mujer embarazada con diabetes durante todo el embarazo y cuando se contemple la posibilidad de un embarazo. Por lo general, los requerimientos de insulina disminuyen en el primer trimestre y aumentan luego durante el segundo y el tercer trimestre.
Después del parto, los requerimientos de insulina normalmente vuelven rápidamente a los valores previos al embarazo.
Lactancia: No hay restricciones sobre el tratamiento con NOVORAPID® durante la lactancia. El tratamiento con insulina de la madre que está en período de lactancia no presenta riesgos para el bebé. Sin embargo, probablemente haya que ajustar la dosis de NOVORAPID®.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: La capacidad del paciente para concentrarse y reaccionar puede verse deteriorada como consecuencia de una hipoglucemia. Esto puede constituir un riesgo en aquellas situaciones en las cuales estas capacidades tienen especial importancia (por ejemplo, conducir un vehículo u operar maquinarias).
Se debe advertir a los pacientes que adopten precauciones para evitar la hipoglucemia mientras conducen. Esto es particularmente importante en quienes presentan reducción o ausencia de consciencia de los signos de advertencia de la hipoglucemia o que tienen frecuentes episodios de hipoglucemia.
REACCIONES ADVERSAS: Las reacciones adversas observadas en los pacientes que utilizan NOVORAPID® son generalmente dosis-dependiente y se deben principalmente al efecto farmacológico de la insulina.
La hipoglucemia es la reacción adversa informada con mayor frecuencia durante el tratamiento. Puede presentarse si la dosis de insulina es demasiado alta respecto de la necesidad de insulina. La hipoglucemia severa puede causar inconsciencia y/o convulsiones y puede dar origen a un deterioro temporario o permanente de la función cerebral o incluso la muerte.
En ensayos clínicos y durante la comercialización, la frecuencia varía según el tipo de paciente y el régimen de dosis, por lo que la frecuencia con que se presenta es variable. Durante los ensayos clínicos, la frecuencia general de hipoglucemias no difiere si consideramos pacientes tratados con insulina asparto comparado con los tratados con insulina humana.
Las reacciones adversas que se enumeran a continuación se basan en los datos de estudios clínicos y están clasificadas de acuerdo con la clase de sistemas y órganos del MedDRA. Las categorías de la frecuencia se definen de acuerdo con la siguiente convención: Muy común (≥1/10); común (≥1/100 a <1/10); poco común (≥1/1000 a <1/100); raro (≥1/10 000 a <1/1000); muy raro (<1/10 000); desconocido (no se puede estimar a partir e los datos disponibles).
|
Trastornos del sistema nervioso |
|
|
Raro |
Neuropatía periférica (neuropatía dolorosa): Una rápida mejora del control de la glucosa en sangre puede estar asociada a un trastorno denominado “neuropatía dolorosa aguda” que normalmente es reversible. |
|
Trastornos oculares |
|
|
Poco común |
Trastornos de la refracción: Pueden aparecer anomalías de la refracción al iniciar la terapia con insulina. Estos síntomas son en general de carácter transitorio. |
|
Poco común |
Retinopatía diabética: Un buen control glucémico prolongado disminuye el riesgo de la progresión de la retinopatía diabética. Sin embargo, una intensificación de la terapia con insulina que produzca una repentina mejora del control glucémico puede estar asociada a un empeoramiento temporal de la retinopatía diabética. |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Poco común |
Lipodistrofia: La lipodistrofia se informa como poco común. Puede presentarse lipodistrofia en el sitio de la inyección como consecuencia de no rotar los sitios de inyección dentro de un área. |
|
Trastornos generales y condiciones del sitio de administración |
|
|
Poco común |
Reacciones en el sitio de inyección: Pueden aparecer reacciones de hipersensibilidad locales (dolor, enrojecimiento, ronchas, inflamación, hinchazón y picazón en el sitio de la inyección) durante el tratamiento con insulina. Estas reacciones son generalmente de naturaleza transitoria y normalmente desaparecen durante el tratamiento. |
|
Poco común |
Edema: Puede aparecer edema al iniciar la terapia con insulina. Estos síntomas son normalmente de naturaleza transitoria. |
|
Trastornos del sistema inmune |
|
|
Poco común |
Urticaria, exantema, erupciones. |
|
Muy raro |
Reacciones anafilácticas: La aparición de reacciones generalizadas de hipersensibilidad (que incluyen exantema cutáneo generalizado, picazón, sudoración, malestar gastrointestinal, edema angioneurótico, dificultades para respirar, palpitaciones y disminución de la tensión arterial) es muy rara pero puede ser potencialmente mortal. |
|
Trastornos del metabolismo y de la nutrición |
|
|
Muy común |
Hipoglucemia. |
INCOMPATIBILIDADES: Las sustancias agregadas a NOVORAPID® pueden provocar la degradación de la insulina asparto, por ejemplo, si el producto contiene tiol o sulfitos.
Este producto no debe mezclarse con otros productos. Las excepciones son la insulina NPH (Neutral Protamine Hagedorn-Protamina Neutra Hagedorn) y los líquidos para infusión, tal como se describe en la sección Posología.
INTERACCIÓN CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN: Se sabe que un número determinado de productos medicinales interactúan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
• Antidiabéticos orales, inhibidores de la monoaminooxidasa (IMAO), betabloqueantes, inhibidores de la enzima convertidora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente:
• Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpatomiméticos, hormona de crecimiento y danazol.
• Los agentes betabloqueantes pueden enmascarar los síntomas de hipoglucemia.
• El octreótido/lanreótido pueden tanto aumentar como disminuir los requerimientos de insulina.
• El consumo de alcohol puede intensificar o reducir los efectos hipoglucémicos de la insulina.
DATOS PRECLÍNICOS DE SEGURIDAD: Los datos no clínicos no revelan riesgos especiales para los seres humanos en base a estudios convencionales de farmacología de seguridad, toxicidad de dosis reiteradas, genotoxicidad y toxicidad en la reproducción.
En los análisis in vitro, incluidos los sitios de unión a insulina y al receptor de IGF-1 y los efectos sobre el crecimiento celular, la insulina asparto se comportó de una manera que se asemejaba mucho a la de la insulina humana. Los estudios también demuestran que la disociación de la unión al receptor de insulina de la insulina asparto es equivalente a la de la insulina humana.
PRECAUCIONES Y ADVERTENCIAS ESPECIALES PARA SU USO: Antes de viajar a zonas con diferentes husos horarios, el paciente debe procurar asesoramiento médico ya que esto puede significar que el paciente tenga que recibir la insulina y las comidas a distintas horas.
Hiperglucemia: La administración de dosis inadecuadas o la interrupción del tratamiento, especialmente en la diabetes tipo 1, pueden producir hiperglucemia y cetoacidosis diabética.
Hipoglucemia: La omisión de una comida o la realización de alguna actividad física extenuante no planificada pueden causar hipoglucemia.
La hipoglucemia puede presentarse si la dosis de insulina es demasiado alta con respecto a los requerimientos de insulina.
Los pacientes en los cuales el control de la glucosa en sangre ha mejorado notablemente, por ejemplo, con la intensificación de la terapia con insulina, pueden presentar un cambio en los síntomas de advertencia habituales de la hipoglucemia y se les debe dar recomendaciones al respecto. Los síntomas de advertencia habituales pueden desaparecer en los pacientes con diabetes de larga data.
Una consecuencia de las propiedades farmacodinámicas de los análogos de la insulina de acción rápida es que si se produce una hipoglucemia, ésta puede ocurrir más rápidamente después de la inyección que en el caso de la insulina humana soluble.
Dado que NOVORAPID® debe administrarse en relación inmediata con las comidas, debe tenerse en cuenta el rápido inicio de la acción en los pacientes con enfermedades o medicamentos concomitantes en los cuales se podría esperar una absorción más lenta de los alimentos.
Las enfermedades concomitantes, especialmente las infecciones y las condiciones febriles, en general aumentan los requerimientos de insulina del paciente. Las enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, pituitaria o tiroidea pueden requerir cambios en la dosis de insulina.
Cuando los pacientes cambian a distintos tipos de productos que contienen insulina, los síntomas de advertencia tempranos de hipoglucemia pueden atenuarse respecto de los que se presentaron con la insulina utilizada previamente.
Cambio desde otros productos que contienen insulina: El cambio de un paciente a otro tipo o marca de insulina (por ejemplo, en la concentración o el fabricante) se debe realizar bajo estricta supervisión médica y puede requerir cambios en la dosis o en el número de inyecciones diarias en comparación con la dosis utilizada con los productos habituales que contenían insulina. En caso de ser necesario un ajuste, éste se puede realizar con la primera dosis o bien durante las primeras semanas o meses.
Reacciones en el sitio de la inyección: Como con cualquier terapia con insulina, pueden producirse reacciones en el sitio de la inyección que incluyen dolor, enrojecimiento, sarpullido, inflamación, hematomas, hinchazón y picazón. La rotación continua del sitio de la inyección dentro de un área determinada puede ayudar a reducir o impedir estas reacciones. Las reacciones por lo general se resuelven en pocos días o pocas semanas. En raras ocasiones, las reacciones en el sitio de la inyección pueden requerir la interrupción del tratamiento con NOVORAPID®.
Combinación de tiazolidinedionas y productos medicinales que contienen insulina: Se han reportado casos de insuficiencia cardíaca congestiva cuando se utilizaron tiazolidinedionas en combinación con insulina, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardíaca congestiva. Esto debe tenerse en cuenta si se considera el tratamiento combinado con tiazolidinedionas y productos medicinales que contienen insulina. Si se usa esa combinación, se debe observar a los pacientes para detectar signos y síntomas de insuficiencia cardíaca congestiva, aumento de peso y edema. En caso de presentarse algún tipo de deterioro de los síntomas cardíacos, debe interrumpirse la administración de tiazolidinedionas.
PRECAUCIONES ESPECIALES PARA DESECHO Y OTRAS MANIPULACIONES:
• No se deben compartir las agujas de NOVORAPID®, FlexPen®. No se debe rellenar el cartucho.
• No se debe utilizar NOVORAPID® si no se ve transparente e incoloro o si fue congelado.
• Se debe advertir al paciente sobre la necesidad de descartar la aguja después de cada inyección.
• NOVORAPID® puede utilizarse en un sistema de bomba para infusión (ISCI), tal como se describe en la sección Método de administración. Se evaluaron los tubos cuyos materiales de la superficie interna están fabricados con polietileno o poliolefina y se halló que son compatibles con el uso de la bomba.
• En caso de emergencia para quienes estén utilizando NOVORAPID® actualmente (hospitalización o funcionamiento incorrecto de la lapicera de insulina), NOVORAPID® puede extraerse de la FlexPen® con una jeringa para insulina U100.
MÉTODO DE ADMINISTRACIÓN: NOVORAPID® se administra por vía subcutánea mediante una inyección en la pared abdominal, el muslo, la parte superior del brazo, la región deltoide o la región glútea. Los sitios de la inyección siempre deben rotarse dentro de la misma región a fin de reducir el riesgo de lipodistrofia. Al igual que con todos los productos que contienen insulina, la inyección subcutánea en la pared abdominal asegura una absorción más rápida que otros sitios de inyección.
La duración de la acción variará de acuerdo con la dosis, el sitio de la inyección, el flujo sanguíneo, la temperatura y el nivel de actividad física. Sin embargo, el inicio de acción más rápido comparado con la insulina humana soluble se mantiene independientemente del sitio de la inyección.
NOVORAPID® FlexPen® es una lapicera prellenada diseñada para ser utilizada con las agujas descartables NovoFine® o NovoTwist® de una longitud de hasta 8 mm.
NOVORAPID® FlexPen® está codificada por color y viene acompañada por un prospecto que contiene las instrucciones detalladas que deben seguirse para su uso.
Infusión subcutánea continua de insulina (ISCI): NOVORAPID® puede ser utilizada para Infusión Subcutánea Continua de Insulina (ISCI) en sistemas de bombas adecuados para la infusión de insulina. La ISCI debe administrarse en la pared abdominal. Los sitios de infusión deben rotarse.
Cuando se la utiliza con una bomba de infusión de insulina, NOVORAPID® no debe mezclarse con ningún otro producto que contenga insulina.
A los pacientes que utilicen ISCI se los debe instruir en forma exhaustiva con respecto al uso del sistema de bomba, el uso del reservorio y del tubo para la bomba correctos. El equipo de infusión (tubo y cánula) deben cambiarse de acuerdo con las instrucciones que figuran en la información del producto suministrada con el equipo de infusión.
Los pacientes que se administran NOVORAPID® por medio de ISCI deben disponer de insulina alternativa en caso de que falle el sistema de bomba.
Uso endovenoso: En caso de ser necesario, NOVORAPID® puede ser administrado por vía endovenosa sólo por profesionales del ámbito de la salud.
Para el uso endovenoso, los sistemas de infusión con NOVORAPID® 100 U/ml a concentraciones de 0,05 U/ml a 1,0 U/ml de insulina asparto en los líquidos de infusión cloruro de sodio al 0,9%, dextrosa al 5% o dextrosa al 10% inclusive cloruro de potasio 40 mmol/l que utilizan las bolsas de polipropileno para infusión, son estables a temperatura ambiente durante 24 horas.
Si bien permanece estable a través del tiempo, una cierta cantidad de insulina será adsorbida inicialmente por la bolsa de infusión.
Es necesario efectuar el monitoreo de la glucosa en sangre durante la infusión de insulina.
POSOLOGÍA: NOVORAPID® es un análogo de la insulina de acción rápida. La dosificación de NOVORAPID® es individual y se determina de acuerdo con las necesidades del paciente. Normalmente, debería utilizarse en combinación con insulina de acción intermedia o insulina de acción prolongada administrada por lo menos una vez por día. Se recomienda realizar el monitoreo de la glucosa en sangre y ajustes de la dosis de insulina para lograr el control glucémico óptimo.
Los requerimientos individuales de insulina en adultos y niños se encuentran por lo general entre 0,5 y 1,0 U/kg/día. En un régimen de tratamiento bolo/basal, 50-70% de este requerimiento puede ser suministrado por NOVORAPID® y el resto por insulina de acción intermedia o insulina de acción prolongada. El ajuste de la dosis puede ser necesario en caso de que los pacientes aumenten su actividad física, modifiquen su dieta habitual o en el transcurso de una enfermedad concomitante.
NOVORAPID® tiene un inicio de acción más rápido y una duración más corta que la insulina humana soluble.
Debido al inicio de acción más rápido, NOVORAPID® por lo general debe administrarse inmediatamente antes de una comida.
Cuando sea necesario, NOVORAPID® puede administrarse inmediatamente después de una comida.
Debido a la duración más corta, NOVORAPID® tiene un menor riesgo de causar episodios hipoglucémicos nocturnos.
Poblaciones especiales: Al igual que con todos los productos que contienen insulina, en los pacientes de edad avanzada y en los pacientes con deterioro de la función renal o hepática, debe intensificarse el control de la glucosa y la dosis de insulina asparto debe ajustarse en base a los requerimientos individuales.
Población pediátrica: No se han realizado estudios en niños menores de 2 años. Solo debe utilizarse NOVORAPID® en esta población bajo una cuidadosa supervisión médica.
Es preferible utilizar NOVORAPID® en niños en lugar de utilizar la insulina humana soluble cuando un inicio de acción rápido podría ser beneficioso. Por ejemplo, en las horas de administración de las inyecciones en relación con las comidas.
Cambio desde otros productos que contienen insulina: Cuando se cambia a un paciente de un producto que contiene insulina a otro, puede ser necesario realizar un ajuste de la dosis de NOVORAPID® y de la dosis de la insulina basal.
SOBREDOSIS: No se puede definir una sobredosis específica para la insulina, sin embargo, se puede desarrollar hipoglucemia durante estadios secuenciales si se administran dosis demasiado altas respecto de la necesidad del paciente:
• Los episodios hipoglucémicos leves se pueden tratar con la administración oral de glucosa o productos con azúcar. Por lo tanto, se recomienda que el paciente con diabetes siempre lleve consigo productos que contengan azúcar.
• Los episodios hipoglucémicos severos, en los que el paciente queda inconsciente, se pueden tratar con glucagón (0,5 a 1 mg) por vía intramuscular o subcutánea administrado por una persona capacitada, o con glucosa por vía endovenosa administrada por un profesional de la salud. Debe administrarse glucosa por vía endovenosa si el paciente no responde al glucagón dentro de los 10 a 15 minutos. Al recuperar la consciencia, se recomienda administrar al paciente carbohidratos orales para prevenir una recaída.
NATURALEZA Y CONTENIDO DEL ENVASE: Cartucho con solución de 3 ml (vidrio tipo 1) con un émbolo (bromobutilo) y un tapón (bromobutilo/poliisopreno) contenidos en una lapicera prellenada multidosis descartable fabricada con polipropileno en una caja de cartón.
Tamaños de envases de 1, 5 y 10 lapiceras prellenadas. Es posible que no todos los tamaños de envase se comercialicen en el mercado.