
NORVASC
AMLODIPINO
Tabletas
30 Tabletas , 5 Miligramos
10 Tabletas , 10 Miligramos
Tabletas , 5 Miligramos
Tabletas , 10 Miligramos
Tabletas , 10 Miligramos
10 Tabletas , 10 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada TABLETA de NORVASC 5 mg contiene: Besilato de amlodipino equivalente a 5 mg de amlodipino; Excipientes c.s.p.
Cada TABLETA de NORVASC 10 mg contiene: Besilato de amlodipino equivalente a 10 mg de amlodipino; Excipientes c.s.p.
INDICACIONES Y USOS
Hipertensión: NORVASC está indicado para el tratamiento de hipertensión. Se puede utilizar solo o en combinación con otros agentes antihipertensivos.
Enfermedad de las arterias coronarias (EAC):
• Angina estable crónica: NORVASC está indicado para el tratamiento sintomático de angina estable crónica. NORVASC puede ser utilizado solo o en combinación con otros agentes antianginosos.
• Angina vasoespástica (angina variante o de prinzmetal): NORVASC está indicado para el tratamiento de angina vasoespástica sospechada o confirmada.
NORVASC puede ser utilizada como monoterapia o en combinación con otros agentes antianginosos.
• EAC documentada angiográficamente: En pacientes con EAC recientemente documentada mediante angiografía y sin insuficiencia cardíaca o con una fracción de eyección de <40%, NORVASC está indicado para reducir el riesgo de hospitalización por angina y para reducir el riesgo de un procedimiento de revascularización coronaria.
CONTRAINDICACIONES: NORVASC está contraindicado en pacientes con sensibilidad conocida al amlodipino.
REACCIONES ADVERSAS
Experiencia en estudios clínicos: Debido a que los estudios clínicos se realizan bajo condiciones ampliamente variables, los índices de reacciones adversas observados en los estudios clínicos de un medicamento no pueden ser comparados directamente con los índices de los estudios clínicos de otro medicamento y pueden no reflejar los índices observados en la práctica. NORVASC fue evaluado en cuanto a su seguridad en más de 11 000 pacientes en EE.UU. y estudios clínicos en otros países. En general, el tratamiento con NORVASC fue bien tolerado con dosis de hasta 10 mg al día. La mayoría de reacciones adversas reportadas durante la terapia con NORVASC fueron de gravedad media o moderada. En estudios clínicos controlados en los que se compara directamente NORVASC (N=1730), en dosis de hasta 10 mg, con el placebo (N=1250), se debió discontinuar NORVASC debido a las reacciones adversas solo en aproximadamente 1,5% de pacientes, lo que no fue significativamente diferente del placebo (aproximadamente 1%). Los efectos adversos más comunes son dolor de cabeza y edema. La incidencia (%) de efectos adversos dependientes de la dosis fueron las siguientes:
|
Evento adverso |
2,5 mg N=275 |
5,0 mg N=296 |
10,0 mg N=268 |
Placebo N=520 |
|
Edema |
1,8 |
3,0 |
10,8 |
0,6 |
|
Vértigo |
1,1 |
3,4 |
3,4 |
1,5 |
|
Ruboración |
0,7 |
1,4 |
2,6 |
0,0 |
|
Palpitaciones |
0,7 |
1,4 |
4,5 |
0,6 |
Otras experiencias adversas que no estuvieron claramente relacionadas con la dosis pero que fueron reportadas con una incidencia mayor a 1,0% en los estudios clínicos controlados por placebo incluyeron las siguientes:
Estudios controlados por placebo
|
NORVASC (%) (N=1730) |
Placebo (%) (N=1250) |
|
|
Dolor de cabeza |
7,3 |
7,8 |
|
Fatiga |
4,5 |
2,8 |
|
Náuseas |
2,9 |
1,9 |
|
Dolor abdominal |
1,6 |
0,3 |
|
Somnolencia |
1,4 |
0,6 |
Para otras experiencias adversas que parecen ser dependientes de la dosis y medicamento, hubo una incidencia mayor en mujeres que en hombres asociada con el tratamiento con amlodipino, tal como se muestra en la siguiente tabla:
|
Evento adverso |
NORVASC |
Placebo |
||
|
Masc.=% (N=1218) |
Fem.=% (N=512) |
Masc.=% (N=914) |
Fem.=% (N=336) |
|
|
Edema |
5,6 |
14,6 |
1,4 |
5,1 |
|
Ruboración |
1,5 |
4,5 |
0,3 |
0,9 |
|
Palpitaciones |
1,4 |
3,3 |
0,9 |
0,9 |
|
Somnolencia |
1,3 |
1,6 |
0,8 |
0,3 |
Los siguientes eventos se presentaron en <1% pero >0.1% de pacientes en estudios clínicos controlados, o bajo condiciones de estudios clínicos abiertos, o experiencia durante la comercialización, en los que no se puede establecer una relación causal. Estos se muestran para alertar al médico sobre una posible relación:
• Cardiovascular: Arritmia (incluida taquicardia ventricular y fibrilación auricular), bradicardia, dolor torácico, hipotensión, isquemia periférica, síncope, taquicardia, vértigo postural, hipotensión postural, vasculitis.
• Sistema nervioso central y periférico: Hipoestesia, neuropatía periférica, parestesia, temblor, vértigo.
• Gastrointestinal: Anorexia, estreñimiento, dispepsia1, disfagia, diarrea, flatulencia, pancreatitis, vómitos, hiperplasia gingival.
• General: Reacción alérgica, astenia1, dolor de espalda, ruboración con sensación de calor, malestar, dolor, escalofríos, aumento de peso, disminución de peso.
• Sistema musculoesquelético: Artralgia, artrosis, calambres musculares1, mialgia.
• Psiquiatría: disfunción sexual (masculina1 y femenina), insomnio, nerviosismo, depresión, sueños anormales, ansiedad, despersonalización.
• Sistema respiratorio: Disnea1, epistaxis.
• Piel y apéndices: Angioedema, eritema multiforme, prurito1, erupción1, erupción eritematosa, erupción maculopapular.
• Sentidos especiales: Visión anormal, conjuntivitis, diplopía, dolor ocular, tinnitus.
• Sistema urinario: Aumento de la frecuencia urinaria, alteración de la micción, nocturia.
• Sistema nervioso autónomo: Sequedad de boca, aumento de la sudoración.
• Sistema metabólico y nutricional: Hiperglicemia, sed.
• Sistema hematopoyético: Leucopenia, púrpura, trombocitopenia.
1. Estos eventos se presentaron en menos del 1% en estudios clínicos controlados por placebo, pero la incidencia de estos efectos adversos se encontró entre 1% y 2% en todos los estudios de dosis múltiple.
Los siguientes eventos se presentaron en <0,1% de pacientes: insuficiencia cardíaca, pulso irregular, extrasístoles, decoloración de la piel, urticaria, sequedad de la piel, alopecia, dermatitis, debilidad muscular, espasmo, ataxia, hipertonía, migraña, piel fría y húmeda, apatía, agitación, amnesia, gastritis, aumento del apetito, heces líquidas, tos, rinitis, disuria, poliuria, parosmia, alteración del gusto, acomodación visual anormal y xeroftalmia.
Se presentaron otras reacciones de forma esporádica que no pudieron ser distinguidas de medicamentos o estados de enfermedad concurrentes, tales como, infarto de miocardio y angina.
La terapia con NORVASC no ha sido asociada con cambios clínicamente significativos en las pruebas de laboratorio de rutina. No se observaron cambios clínicamente relevantes en el potasio sérico, glucosa sérica, triglicéridos totales, colesterol total, colesterol HDL, ácido úrico, nitrógeno ureico sanguíneo o creatinina.
En los estudios CAMELOT y PREVENT (ver Estudios clínicos: Efectos en la enfermedad arterial coronaria documentada), el perfil de eventos adversos fue similar al reportado previamente (véase antes), siendo el evento más común el edema periférico.
Experiencia post comercialización: Debido a que estas reacciones son reportadas de forma voluntaria por una población de tamaño indefinido, no siempre es posible estimar de forma confiable su frecuencia o establecer una relación causal a la exposición del medicamento.
El siguiente evento post comercialización se reportó como infrecuente y no se pudo establecer una relación causal: ginecomastia. Durante la experiencia post comercialización se reportó ictericia y elevación de las enzimas hepáticas (en su mayoría conformes con colestasis o hepatitis) en asociación con el uso de amlodipino, en algunos casos lo suficientemente graves para necesitar hospitalización
NORVASC fue utilizado de forma segura en pacientes con enfermedad pulmonar obstructiva crónica, insuficiencia cardíaca congestiva bien compensada, enfermedad cardíaca coronaria, enfermedad vascular periférica, diabetes mellitus y perfiles anormales de lípidos.
INTERACCIONES MEDICAMENTOSAS
Datos in vitro: Los datos in vitro indican que NORVASC no tiene efecto en la unión a las proteínas plasmáticas humanas de la digoxina, fenitoína, warfarina e indometacina.
Cimetidina: La coadministración de NORVASC con cimetidina no modificó la farmacocinética de NORVASC.
Jugo de toronja: La coadministración de 240 mL de jugo de toronja con una sola dosis oral de amlodipino de 10 mg en 20 voluntarios sanos no tuvo efecto significativo en la farmacocinética del amlodipino.
Antiácidos con magnesio e hidróxido de aluminio: La coadministración de un antiácido con magnesio e hidróxido de aluminio con una sola dosis de NORVASC no tuvo efecto significativo en la farmacocinética de NORVASC.
Sildenafilo: Una sola dosis de 100 mg de sildenafilo en sujetos con hipertensión esencial no tuvo efecto en los parámetros de farmacocinética de NORVASC. Cuando NORVASC y sildenafilo fueron utilizados en combinación, cada agente ejerció su efecto de forma independiente en la disminución de la presión arterial.
Atorvastatina: La coadministración de múltiples dosis de 10 mg de NORVASC con 80 mg de atorvastatina no originó cambios significativos en los parámetros farmacocinéticos en el estado estacionario de la atorvastatina.
Simvastatina: La coadministración de dosis múltiples de 10 mg de amlodipino con 80 mg de simvastatina causó un aumento del 77% en la exposición de simvastatina en comparación con simvastatina sola.
Límite de la dosis de simvastatina en pacientes con amlodipino a 20 mg diarios.
Digoxina: La coadministración de NORVASC con digoxina no modificó las concentraciones séricas de digoxina o el aclaramiento renal de digoxina en voluntarios normales.
Etanol (alcohol): Las dosis únicas y múltiples de 10 mg de NORVASC no tuvieron efecto significativo en la farmacocinética del etanol.
Warfarina: La coadministración de NORVASC con warfarina no modificó el tiempo de protrombina en respuesta a la warfarina.
Inhibidores del CYP3A4: La coadministración de una dosis diaria de 180 mg de diltiazem con amlodipino 5 mg en adultos mayores hipertensos resultó en un aumento del 60% en la exposición sistémica con amlodipino.
La coadministración de eritromicina en voluntarios sanos no modifico significativamente la exposición sistémica de amlodipino. Sin embargo, los inhibidores potentes de CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir) pueden aumentar las concentraciones plasmáticas de amlodipino en mayor medida. Monitorear los síntomas de hipotensión y edema cuando se administra conjuntamente amlodipino con inhibidores del CYP3A4.
Inductores CYP3A4: No hay información disponible sobre los efectos cuantitativos de inductores de CYP3A4 sobre amlodipino. La presión arterial debe estar estrechamente monitoreada cuando amlodipino es coadministrado con inductores CYP3A4.
Interacciones con medicamentos/pruebas de laboratorio: No se conocen.
ESTUDIOS CLÍNICOS
Efectos en la hipertensión:
• Pacientes adultos: La eficacia antihipertensiva de NORVASC ha sido demostrada en un total de 15 estudios controlados por placebo, doble ciegos, aleatorizados, incluyendo 800 pacientes con NORVASC y 538 con placebo. La administración una vez al día produjo reducciones estadísticamente significativas corregidas por placebo en las presiones arteriales en posición supina y de pie a las 24 horas post dosis, con un promedio de aproximadamente 12/6 mm Hg de pie y 13/7 mm Hg en la posición supina, en pacientes con hipertensión leve a moderada. Se observó el mantenimiento del efecto sobre la presión arterial en el intervalo de dosificación de 24 horas, con una pequeña diferencia en el efecto máximo y mínimo. No se demostró tolerancia en pacientes estudiados hasta por 1 año. Los tres estudios dosis respuesta, con dosis fija, paralelos, mostraron que la reducción de las presiones arteriales en posición supina y de pie estuvieron relacionadas con la dosis dentro del rango de dosis recomendado. Los efectos sobre la presión arterial fueron similares en los pacientes jóvenes y mayores. El efecto sobre la presión sistólica fue mayor en pacientes mayores, quizás debido a una presión sistólica basal mayor. Los efectos fueron similares en pacientes de raza negra y blanca.
• Pacientes pediátricos: Doscientos sesenta y ocho pacientes hipertensos de 6 a 17 años fueron aleatorizados primero para recibir NORVASC 2,5 mg o 5 mg una vez al día durante 4 semanas y luego aleatorizados nuevamente para recibir la misma dosis o placebo durante otras 4 semanas. Los pacientes que recibieron 2,5 mg o 5 mg al final de las 8 semanas tuvieron una presión arterial significativamente menor que los que fueron aleatorizados de forma secundaria al placebo. La magnitud del efecto del tratamiento es difícil de interpretar, pero es probablemente menor a 5 mm Hg sistólica con la dosis de 5 mg y 3,3 mm Hg sistólica con la dosis de 2,5 mg. Los eventos adversos fueron similares a los observados en los adultos.
Efectos en la angina crónica estable: La efectividad de la dosis 5–10 mg/día de NORVASC en la angina inducida por el ejercicio se evaluó en 8 estudios clínicos controlados por placebo, doble ciegos, de hasta 6 semanas de duración, incluyendo 1038 pacientes (684 con NORVASC, 354 con placebo) con angina estable crónica. En 5 de los 8 estudios se observaron aumentos significativos en el tiempo de ejercicio (bicicleta o cinta corredora) con la dosis de 10 mg. Los aumentos en el tiempo del ejercicio limitado por los síntomas fue en promedio 12,8% (63 seg.) para NORVASC de 10 mg, y fue en promedio 7,9% (38 seg.) para NORVASC de 5 mg. NORVASC de 10 mg también incrementó el tiempo para la desviación del segmento ST en 1 mm en diversos estudios y disminuyó el índice de ataques de angina. La eficacia sostenida de NORVASC en los pacientes con angina se demostró con las dosis a largo plazo. En pacientes con angina, no hubo reducciones clínicamente significativas en las presiones arteriales (4/1 mm Hg) o cambios en la frecuencia cardíaca (+0.3 lpm).
Efectos en la angina vasoespástica: En un estudio clínico controlado por placebo, doble ciego, de 4 semanas de duración, en 50 pacientes, la terapia con NORVASC disminuyó los ataques en aproximadamente 4/semana, comparado con una disminución del placebo de aproximadamente 1/semana (p< 0,01). Dos de los 23 pacientes que recibieron NORVASC y 7 de los 27 pacientes que recibieron placebo fueron retirados del estudio debido a que no hubo mejora clínica.
Efectos en la enfermedad arterial coronaria documentada: En el estudio PREVENT, 825 pacientes con enfermedad de las arterias coronarias documentada angiográficamente fueron aleatorizados para recibir NORVASC (5–10 mg una vez al día) o placebo y continuaron durante 3 años. Aunque el estudio no mostró significancia en el objetivo principal de cambio en el diámetro luminal coronario evaluado por angiografía coronaria cuantitativa, los datos indicaron un resultado favorable con respecto a menos hospitalizaciones para los procedimientos de angina y revascularización en los pacientes con EAC.
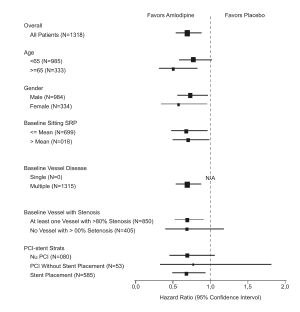
En el estudio CAMELOT se incluyó a 1318 pacientes con EAC recientemente documentada por angiografía, sin enfermedad coronaria principal izquierda y sin insuficiencia cardíaca o una fracción de eyección <40%. Los pacientes (76% varones, 89% caucásicos, 93% incluidos en los sitios de EE.UU., 89% con historia de angina, 52% sin ICP, 4% con ICP y sin stent, y 44% con un stent) fueron aleatorizados para recibir el tratamiento doble ciego con NORVASC (5–10 mg una vez al día) o placebo, además del tratamiento estándar que incluía ácido acetilsalicílico (89%), estatinas (83%), bloqueadores beta (74%), nitroglicerina (50%), anticoagulantes (40%), y diuréticos (32%), pero excluyó otros bloqueadores de los canales de calcio. La duración promedio del seguimiento fue 19 meses. El parámetro principal fue el tiempo de la primera presentación de uno de los siguientes eventos: hospitalización por angina de pecho, revascularización coronaria, infarto de miocardio, muerte cardiovascular, paro cardíaco con reanimación, hospitalización por insuficiencia cardíaca, accidente cerebrovascular/AIT o enfermedad vascular periférica. Un total de 110 (16,6%) y 151 (23,1%) de los primeros eventos ocurrió en los grupos que recibieron NORVASC y placebo, respectivamente, con un índice de riesgo de 0,691 (IC 95%: 0,540–0,884, p = 0,003). El parámetro inicial se resume en el gráfico 1 que se muestra a continuación. El resultado de este estudio proviene en su mayoría de la prevención de hospitalizaciones para angina y la prevención de los procedimientos de revascularización (véase la tabla 1). Los efectos en diversos subgrupos se muestran en el Gráfico 2.
En un sub estudio angiográfico (n=274) realizado dentro de CAMELOT, no hubo diferencia significativa entre el amlodipino y el placebo en el cambio del volumen del ateroma en la arteria coronaria, evaluado por ultrasonido intravascular.
Gráfico 1 - Análisis Kaplan-Meier de los resultados clínicos con el compuesto para NORVASC versus Placebo
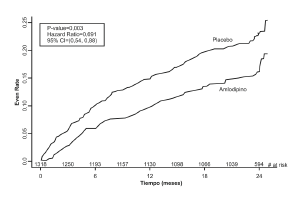
Gráfico 2 – Efectos en el parámetro primario de NORVASC versus Placebo en los sub grupos
En la Tabla 1 que se muestra a continuación se resume el parámetro significativo del compuesto y los resultados clínicos de los compuestos del parámetro primario. Los otros componentes del parámetro principal que incluyen muerte cardiovascular, paro cardíaco con reanimación, infarto del miocardio, hospitalización por insuficiencia cardíaca, accidente cerebrovascular/AIT o enfermedad vascular periférica no demostraron una diferencia signficativa entre NORVASC y el placebo.
Tabla 1. Incidencia de los resultados clínicos significativos para CAMELOT
|
Resultado clínico N (%) |
NORVASC (N=663) |
Placebo (N=655) |
Reducción del riesgo (valor p) |
|
Compuesto CV Parámetro |
110 (16,6) |
151 (23,1) |
31% (0,003) |
|
Hospitalización por Angina* |
51 (7.7) |
84 (12,8) |
42% (0,002) |
|
Revascularización coronaria* |
78 (11.8) |
103 (15,7) |
27 (0,033) |
|
* Total de pacientes con estos eventos |
|||
Estudios en pacientes con insuficiencia cardíaca: NORVASC fue comparado con el placebo en cuatro estudios de 8–12 semanas en pacientes con insuficiencia cardíaca clase NYHA II/III, incluyendo un total de 697 pacientes. En estos estudios no hubo empeoramiento de la insuficiencia cardíaca en base a las medidas de tolerancia al ejercicio, clasificación NYHA, síntomas, o fracción de eyección del ventrículo izquierdo. En un estudio de mortalidad/morbilidad, a largo plazo (seguimiento de al menos 6 meses, promedio 13,8 meses), controlado por placebo, con NORVASC de 5–10 mg en 1153 pacientes con insuficiencia cardíaca clases NYHA III (n=931) o IV (n=222) con dosis estables de diuréticos, digoxina, e inhibidores del ECA, NORVASC no tuvo efecto en el parámetro principal del estudio, que fue el parámetro combinado de morbilidad cardíaca y mortalidad por todas las causas (definido por arritmia que pone en riesgo la vida, infarto agudo de miocardio u hospitalización por empeoramiento de la insuficiencia cardíaca), o en la clasificación NYHA, o síntomas de insuficiencia cardíaca. Los eventos totales de morbilidad cardíaca y mortalidad por todas las causas combinados fueron 222/571 (39%) para pacientes que recibieron NORVASC y 246/583 (42%) para los pacientes que recibieron placebo. Los eventos de morbidez cardíaca representaron aproximadamente 25% de los parámetros en el estudio.
En otro estudio (PRAISE-2) se aleatorizó a los pacientes con insuficiencia cardíaca clase NYHA III (80%) o IV (20%) sin síntomas clínicos o evidencia objetiva de enfermedad isquémica subyacente, con dosis estables de los inhibidores de la ECA (99%), digitálicos (99%) y diuréticos (99%), para que recibieran placebo (n=827) o NORVASC (n=827) y recibieron seguimiento durante un promedio de 33 meses. No hubo diferencia estadísticamente significativa entre NORVASC y el placebo en el parámetro principal de la mortalidad por todas las causas (límite de confianza 95% de una reducción de 8% a un incremento de 29% con NORVASC). Con NORVASC hubo más reportes de edema pulmonar.
Fabricado por:
Pfizer Manufacturing Deutschland GmbH - Alemania
Importado por:
PFIZER S.A.
Av. Javier Prado este 6230, 2do Piso
La Molina, Lima Perú
Teléfono: 615-2100, Fax: 615-2106
LLD basado en USPI (31-10-2011) V.1
TOXICOLOGÍA NO CLÍNICA
Carcinogénesis, mutagénesis, deterioro de la fertilidad: Las ratas y ratones tratados con amlodipino maleato en la dieta hasta por dos años, con concentraciones calculadas para proporcionar concentraciones diarias de 0,5, 1,25 y 2,5 de amlodipino mg/kg/día, no mostraron evidencia de un efecto carcinogénico del medicamento. En el ratón, la dosis más alta fue, en una base mg/m2, similar a la máxima dosis recomendada de 10 mg de amlodipino/día3. Para las ratas, la dosis más alta fue, en una base de mg/m2, aproximadamente la máxima dosis recomendada3.
Los estudios de mutagenicidad realizados con amlodipino maleato mostraron que los efectos no estuvieron relacionados a nivel de genes o cromosomas.
No hubo efecto en la fertilidad de las ratas tratadas con amlodipino maleato (machos durante 64 días y hembras durante 14 días antes del apareamiento) en dosis de hasta 10 mg de amlodipino/kg/día (8 veces la máxima dosis recomendada en humanos3 de 10 mg/día en una base de mg/m2).
3. En base al peso del paciente de 50 kg.
ADVERTENCIAS Y PRECAUCIONES
Hipotensión: Es posible que se presente hipotensión sintomática, en particular en pacientes con estenosis aórtica grave. Debido al inicio gradual de acción, es poco probable que se presente hipotensión aguda.
Aumento de la presencia de angina o infarto de miocardio: Se puede desarrollar empeoramiento de la angina e infarto de miocardio luego del inicio o aumento de la dosis de NORVASC, particularmente en pacientes con enfermedad obstructiva crónica de las arterias coronarias.
Retiro de beta bloqueadores: NORVASC no es un beta bloqueador y, por ello, no ofrece protección contra los daños que produce el retiro abrupto de beta bloqueadores. Todo retiro debe ser hecho por reducción gradual de la dosis del beta bloqueador.
Pacientes con insuficiencia hepática: Debido a que NORVASC es altamente metabolizado en el hígado y el tiempo de vida media de eliminación plasmática (t1/2) es 56 horas en pacientes con deterioro de la función hepática, se debe ajustar lentamente la dosis cuando se administre NORVASC a pacientes con deterioro grave de la función hepática.
DOSIS Y ADMINISTRACIÓN
Adultos: La dosis oral inicial de NORVASC para el tratamiento antihipertensivo es normalmente 5 mg una vez al día, con una dosis máxima de 10 mg una vez al día.
Los pacientes pequeños, débiles o adultos mayores, o pacientes con insuficiencia hepática pueden iniciar con 2,5 mg una vez al día y esta dosis puede ser utilizada cuando se adiciona NORVASC a otra terapia antihipertensiva.
Ajustar la dosis de acuerdo a la necesidad de cada paciente. En general, el ajuste debe hacerse entre 7 a 14 días para que el médico pueda evaluar completamente la respuesta del paciente a cada concentración de dosis. Sin embargo, se puede realizar el ajuste de forma más rápida si existe justificación clínica y el paciente es evaluado de forma frecuente.
La dosis recomendada para angina vasoespástica o estable crónica es 5-10 mg, prefiriéndose la dosis inferior en los adultos mayores y en pacientes con insuficiencia hepática. La mayoría de pacientes necesitará 10 mg para un efecto adecuado (ver Reacciones adversas).
El rango de dosis recomendada para pacientes con enfermedad cardíaca coronaria es 5–10 mg una vez al día. En estudios clínicos, la mayoría de pacientes necesitó 10 mg (ver Estudios clínicos: Efectos en la enfermedad arterial coronaria documentada).
Niños: La dosis oral efectiva para el tratamiento antihipertensivo en pacientes pediátricos entre 6–17 años es 2,5 mg a 5 mg, una vez al día. Las dosis mayores a 5 mg al día no han sido estudiadas en pacientes pediátricos (ver Farmacología clínica: Pacientes pediátricos y Estudios clínicos: Efectos en la hipertensión).
USO EN POBLACIONES ESPECÍFICAS
Embarazo: Embarazo, categoría C.
No se cuenta con estudios adecuados y bien controlados en mujeres embarazadas. El amlodipino debe ser utilizado durante el embarazo solo si el beneficio justifica el riesgo potencial al feto.
No se encontró evidencia de teratogenicidad u otra toxicidad embrio/fetal cuando se administró el amlodipino maleato por vía oral a ratas y conejas preñadas en dosis de hasta 10 mg de amlodipino/kg/día (respectivamente, 8 veces2 y 23 veces2 la máxima dosis recomendada en humanos de 10 mg en una base de mg/m2) durante sus periodos respectivos de organogénesis principal. Sin embargo, el tamaño de la camada disminuyó de forma significativa (en aproximadamente 50%) y el número de muertes intrauterinas aumentó significativamente (aproximadamente 5 veces) en ratas que recibieron amlodipino maleato a una dosis equivalente a 10 mg de amlodipino/kg/día durante 14 días antes del apareamiento y durante ésta y la gestación.
Se ha demostrado que el amlodipino maleato prolonga el periodo de gestación y la duración del trabajo de parto en ratas con esta dosis.
2. En base al peso del paciente de 50 kg.
Lactancia: No se sabe si el amlodipino se excreta en la leche humana. Al no conocerse esta información, se recomienda que se discontinúe la lactancia cuando se administre NORVASC.
Uso pediátrico: No se conoce el efecto de NORVASC sobre la presión arterial en pacientes menores de 6 años.
Uso geriátrico: Los estudios clínicos con NORVASC no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de forma diferente a los sujetos jóvenes. Otra experiencia clínica reportada no ha identificado las diferencias en las respuestas entre los adultos mayores y los más jóvenes. En general, la selección de la dosis para un adulto mayor debe hacerse con precaución, generalmente iniciando con la concentración mínima del rango de dosis, lo que indica la mayor frecuencia de la disminución de la función hepática, renal o cardíaca y de enfermedades concomitantes u otra terapia medicamentosa. Los adultos mayores presentan un aclaramiento disminuido del amlodipino, lo que resulta en un aumento del ABC de aproximadamente 40–60%, por lo que se puede requerir una dosis inicial menor (ver Dosis y administración: Adultos).
VÍA DE ADMINISTRACIÓN: Tabletas de administración oral
SOBREDOSIS: La sobredosis puede ocasionar vasodilatación periférica en exceso con hipotensión marcada y posiblemente una taquicardia refleja. En humanos, la experiencia con sobredosis intencional de NORVASC es limitada.
Las dosis orales únicas de amlodipino maleato, equivalentes a 40 mg de amlodipino/kg y 100 mg de amlodipino/kg en ratones y ratas, respectivamente, ocasionó muertes. Las dosis orales únicas de amlodipino maleato equivalentes a 4 o más mg de amlodipino/kg o mayores en perros (11 o más veces la dosis máxima recomendada en humanos en una base mg/m2) provocó una vasodilatación periférica marcada e hipotensión.
Si se presenta sobredosis, se debe iniciar el control respiratorio y cardíaco activo. Las mediciones frecuentes de presión arterial son esenciales. Si se presenta hipotensión, se debe proporcionar soporte cardiovascular, incluyendo elevación de las extremidades y administración de líquidos según criterio médico. Si la hipotensión no responde a estas medidas conservativas, considérese la administración de vasopresores (tales como fenilefrina) con atención al volumen circulante y producción de orina. Debido a que NORVASC tiene un alto porcentaje de unión a proteínas, es poco probable que la hemodiálisis tenga efecto.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción: El amlodipino es una dihidropiridina antagonista del calcio (antagonista del ion calcio o bloqueador de los canales de calcio lentos) que inhibe la entrada transmembranal de iones de calcio al músculo liso vascular y músculo cardíaco. Los datos experimentales indican que el amlodipino se une a los sitios de unión de la dihidropiridina y no dihidropiridina. Los procesos contráctiles del músculo cardíaco y músculo liso vascular son dependientes del movimiento de los iones del calcio extracelular dentro de las células a través de los canales de iones específicos. El amlodipino inhibe el flujo del ion calcio a través de las membranas celulares de forma selectiva, con un mayor efecto en las células del músculo liso vascular que en las células del músculo cardíaco. Los efectos inotrópicos negativos pueden detectarse in vitro pero dichos efectos no han sido observados en animales intactos a dosis terapéuticas. La concentración sérica de calcio no se ve afectada por el amlodipino. Dentro del rango de pH fisiológico, el amlodipino es un compuesto ionizado (pKa=8,6), y su interacción cinética con el receptor de los canales de calcio está caracterizada por un índice gradual de asociación y disociación con el sitio de unión del receptor, dando como resultado un inicio gradual del efecto.
El amlodipino es un vasodilatador arterial periférico que actúa directamente sobre el músculo liso vascular para provocar una reducción de la resistencia vascular periférica y una reducción de la presión arterial.
Los mecanismos precisos por los que el amlodipino cura la angina no han sido completamente esclarecidos, pero se cree que son los siguientes:
• Angina provocada por el ejercicio: En pacientes con angina provocada por el ejercicio, NORVASC reduce la resistencia periférica total (post carga) contra la cual trabaja el corazón y reduce el producto presión por frecuencia y, así, la demanda de oxígeno en el miocardio, en cualquier nivel del ejercicio.
• Angina vasoespástica: Se ha demostrado que NORVASC bloquea la constricción y restablece el flujo sanguíneo en las arterias coronarias y arteriolas en respuesta al calcio, epinefrina potásica, serotonina y análogo del tromboxano A2 en modelos animales experimentales y en vasos coronarios humanos in vitro. Esta inhibición del espasmo coronario es responsable de la efectividad de NORVASC en la angina vasoespástica (angina variante o de prinzmetal).
Farmacodinamia:
• Hemodinamia: Luego de la administración de dosis terapéuticas a los pacientes con hipertensión, NORVASC produce vasodilatación, lo que da como resultado una reducción de la presión arterial en posición supina y de pie. Esta disminución de la presión arterial no se ve acompañada de un cambio significativo en la frecuencia cardíaca o concentraciones de catecolaminas en plasma con la dosificación crónica. Aunque la administración intravenosa aguda de amlodipino disminuye la presión arterial y aumenta la frecuencia cardíaca en los estudios hemodinámicos de los pacientes con angina estable crónica, la administración oral crónica del amlodipino en estudios clínicos no originó ningún cambio clínicamente significativo en la frecuencia cardíaca o presiones arteriales en pacientes normotensos con angina.
Con la administración oral crónica una vez al día, el efecto antihipertensivo se mantiene durante al menos 24 horas. Las concentraciones plasmáticas se correlacionan con el efecto tanto en los pacientes jóvenes como en los adultos mayores. La magnitud de la reducción de la presión arterial con NORVASC también se correlaciona con la elevación pre tratamiento; así, los individuos con hipertensión moderada (presión diastólica 105-114 mm Hg) tuvieron una respuesta aproximadamente 50% mayor que la de los pacientes con hipertensión leve (presión diastólica 90-104 mm Hg). Los pacientes normotensos no experimentaron ningún cambio clínicamente significativo en las presiones arteriales (+1/–2 mm Hg).
En pacientes hipertensos con función renal normal, las dosis terapéuticas de NORVASC dieron como resultado una resistencia vascular renal disminuida y un incremento del índice de filtración glomerular y flujo plasmático renal efectivo sin cambio en la fracción de filtración o proteinuria.
Al igual que con otros bloqueadores de los canales de calcio, las medidas hemodinámicas de la función cardíaca durante el reposo y ejercicio (o marcha ligera) en pacientes con función ventricular normal tratados con NORVASC en general han demostrado un aumento pequeño del índice cardíaco sin influencia significativa en la dP/dt o en el volumen o presión diastólica final del ventrículo izquierdo. En estudios hemodinámicos, NORVASC no fue asociado con un efecto inotrópico negativo cuando se administró dentro del rango de dosis terapéutica para tratar animales intactos y sujetos, incluso cuando se coadministró con bloqueadores beta en estos últimos. Sin embargo, se han observado hallazgos similares en pacientes bien compensados o normales con insuficiencia cardíaca con agentes que poseen efectos inotrópicos negativos significativos.
• Efectos electrofisiológicos: NORVASC no modifica la función del nodo sinoauricular o la conducción auriculoventricular en animales intactos o en el hombre. En pacientes con angina estable crónica, la administración intravenosa de 10 mg no modificó de forma significativa la conducción A-H y H-V y el tiempo de recuperación del nodo sinusal luego de la marcha ligera. Se obtuvieron resultados similares en pacientes que recibían NORVASC y beta bloqueadores de forma concomitante. En estudios clínicos en los que se administró NORVASC en combinación con los betas bloqueadores a pacientes con hipertensión o angina no se observaron efectos adversos en los parámetros electrocardiográficos. En estudios clínicos con pacientes que solo tenían angina, la terapia con NORVASC no modificó los intervalos electrocardiográficos o produjo grados mayores de bloqueos AV.
Farmacocinética y metabolismo: Luego de la administración oral de dosis terapéuticas de NORVASC, la absorción produce concentraciones plasmáticas máximas entre 6 y 12 horas. Se ha estimado que la biodisponibilidad absoluta se encuentra entre 64 y 90%. La biodisponibilidad de NORVASC no se vio modificada en presencia de alimentos.
El amlodipino es convertido de forma extensa (aproximadamente 90%) a metabolitos inactivos por la vía hepática, siendo excretados en la orina el 10% del compuesto madre y 60% como metabolitos. Estudios ex vivo han mostrado que aproximadamente 93% del medicamento circulante está unido a las proteínas plasmáticas en pacientes hipertensos. La eliminación del plasma es bifásica y la vida medida de eliminación terminal es aproximadamente 30-50 horas.
Las concentraciones plasmáticas del amlodipino en el estado estacionario se alcanzan luego de 7 a 8 días de la administración diaria consecutiva.
La farmacocinética del amlodipino no se ve influenciada de forma significativa por el deterioro renal. Los pacientes con insuficiencia renal pueden, por ello, recibir la dosis inicial común.
Los adultos mayores y pacientes con insuficiencia hepática tienen un aclaramiento disminuido del amlodipino, lo que da como resultado un aumento del ABC de aproximadamente 40-60%, por lo que se puede requerir una dosis inicial menor. Se observó un aumento similar en el ABC en pacientes con insuficiencia cardíaca moderada a severa.
Pacientes pediátricos: Sesenta y dos pacientes hipertensos de 6 a 17 años recibieron dosis de NORVASC entre 1,25 mg y 20 mg. El aclaramiento y volumen de distribución ajustados según el peso fueron similares a los valores en adultos.