
NEBIDO
TESTOSTERONA
Solución inyectable
1 Ampolla , 4 ml Solución inyectable , 1000/4 mg/ml
1 Ampolletas de vidrio color ámbar, Solución inyectable, 4 Mililitros
1 Vial(es), Solución inyectable, 4 Mililitros
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
1 ml de SOLUCIÓN INYECTABLE contiene: 250 mg de undecanoato de testosterona correspondiente a 157,9 mg de testosterona.
1 ampolla/vial con 4 mL de SOLUCIÓN INYECTABLE contiene: 1.000 mg de undecanoato de testosterona (correspondientes a 631,5 mg de testosterona).
Para la lista completa de excipientes, ver Lista de excipientes.
FORMA FARMACÉUTICA:
Solución inyectable.
INDICACIONES TERAPÉUTICAS:
Terapia de reemplazo de testosterona en el hipogonadismo masculino cuando la deficiencia de testosterona ha sido confirmada clínicamente y mediante pruebas de laboratorio (ver Advertencias y precauciones especiales de empleo).
DATOS FARMACÉUTICOS:
Lista de excipientes:
Benzoato de bencilo
Aceite de ricino refinado
Incompatibilidades: En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
Periodo de validez: 5 años
El producto debe ser utilizado inmediatamente después de la apertura.
Precauciones especiales de conservación: No se exponga a temperaturas superiores a 30 °C.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: NEBIDO® es una preparación de depósito de undecanoato de testosterona que se administra por vía intramuscular y, por tanto, se evita el efecto de primer paso. Después de la inyección intramuscular de undecanoato de testosterona como solución oleosa, el compuesto se libera gradualmente del depósito y es casi completamente escindido por las esterasas séricas en testosterona y ácido undecanoico. El aumento de las concentraciones séricas de testosterona por encima de los valores basales ya puede medirse un día después de la administración.
Condiciones de estado estable: Después de la 1ª inyección intramuscular de 1000 mg de undecanoato de testosterona en varones hipogonádicos, se alcanzaron valores medios de Cmax de 38 nmol/L (11 ng/mL) después de 7 días. La segunda dosis fue administrada 6 semanas después de la 1ª inyección, alcanzándose concentraciones máximas de testosterona de aproximadamente 50 nmol/L (15 ng/mL). Durante las tres siguientes administraciones se mantuvo un intervalo constante de dosificación de 10 semanas, alcanzándose el estado de equilibrio entre la 3ª y la 5ª administración. Los valores medios aproximados de la Cmáx y la Cmín de testosterona en estado de equilibrio fueron de 37 (11 ng/mL) y 16 nmol/L (5 ng/mL), respectivamente. La variabilidad intra e interindividual media (coeficiente de variación, %) de los valores de Cmin fue del 22% (rango: 9-28%) y 34% (rango: 25-48%), respectivamente.
Distribución: En el suero del hombre, aproximadamente el 98% de la testosterona circulante se une a la globulina fijadora de hormonas sexuales (SHBG) y a la albúmina. Sólo la fracción libre de la testosterona se considera biológicamente activa. Después de la infusión intravenosa de testosterona a varones de edad avanzada, la vida media de eliminación de la testosterona fue aproximadamente de 1 hora, determinándose un volumen de distribución aparente de 1,0 l/kg aproximadamente.
Biotransformación: La testosterona generada por esterólisis del undecanoato de testosterona se metaboliza y excreta del mismo modo que la testosterona endógena. El ácido undecanoico se metaboliza por ß-oxidación del mismo modo que otros ácidos carboxílicos alifáticos. Los principales metabolitos activos de la testosterona son estradiol y dihidrotestosterona.
Eliminación: La testosterona tiene un amplio metabolismo hepático y extrahepático. Después de la administración de testosterona marcada radioactivamente, aproximadamente el 90% de la radiactividad aparece en la orina como conjugados del ácido glucurónico y ácido sulfúrico y el 6% aparece en las heces después de circulación enterohepática. Los productos medicinales urinarios incluyen la androsterona y la etiocolanolona. Después de la administración intramuscular de esta formulación depot, la tasa de liberación se caracteriza por una vida media de 90 ± 40 días.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Andrógenos, derivados de 3-oxoandrosteno(4), código ATC: G03B A03.
El undecanoato de testosterona es un éster del andrógeno natural testosterona. La forma activa testosterona se forma por escisión de la cadena lateral.
La testosterona es el andrógeno masculino más importante. Se forma principalmente en los testículos y en menor medida también en la corteza suprarrenal.
La testosterona es responsable de la expresión de las características sexuales masculinas durante el desarrollo fetal, infantil y puberal y, después, mantiene el fenotipo masculino y las funciones dependientes de andrógenos (por ejemplo, espermatogénesis, glándulas sexuales accesorias). Asimismo, ejerce otras funciones, por ejemplo, en la piel, los músculos, el esqueleto, los riñones, el hígado, la médula ósea y el sistema nervioso central.
Dependiendo del órgano diana, el espectro de actividades de la testosterona es principalmente androgénico (por ejemplo, próstata, vesículas seminales, epidídimo) o anabólico proteico (músculos, huesos, hematopoyesis, riñones, hígado).
En algunos órganos, los efectos de la testosterona se presentan después de la conversión periférica en estradiol. Éste se une después a los receptores de estrógenos en el núcleo de las células diana, por ejemplo, en las células hipofisarias, grasas, cerebrales y óseas así como en las células de Leydig en los testículos.
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Andrógenos, derivados del 3-oxoandrosteno (4)
Código ATC: G03BA03
El undecanoato de testosterona es un éster del andrógeno natural testosterona. La forma activa, testosterona, se forma por escisión de la cadena lateral.
La testosterona es el andrógeno más importante del varón que se sintetiza principalmente en los testículos y, en menor grado, en la corteza suprarrenal.
La testosterona es responsable de la aparición de las características masculinas durante el desarrollo fetal, la primera infancia y el desaroollo puberal, siendo posteriormente la hormona que mantiene el fenotipo masculino y las funciones que dependen de los andrógenos (por ejemplo: espermatogénesis, glándulas sexuales accesorias).
También realiza funciones, por ejemplo: en la piel, los músculos, los huesos, los riñones, el hígado, la médula ósea y el SNC.
Dependiendo del órgano diana, el espectro de actividades de la testosterona es principalmente androgénico (por ejemplo próstata, vesículas seminales, epidídimo) o anabólico proteico (músculo, hueso, hematopoyesis, riñón, hígado).
Los efectos de la testosterona en algunos órganos se presentan después de la conversión periférica de la testosterona en estradiol, el que se une a los receptores de estrógenos en el núcleo de las células diana, por ejemplo las células hipofisarias, grasas, cerebrales, óseas y testiculares de Leydig.
CONTRAINDICACIONES:
El uso de NEBIDO® está contraindicado en varones con:
– Carcinoma andrógeno -dependiente de próstata o de la glándula mamaria masculina.
– Tumores hepáticos actuales o pasados.
– Hipersensibilidad al principio activo o a cualquiera de los excipientes incluidos en la sección Lista de excipientes.
El uso de NEBIDO® está contraindicado en las mujeres.
FERTILIDAD, EMBARAZO Y LACTANCIA:
Fertilidad: La terapia de sustitución de la testosterona puede reducir reversiblemente la espermatogénesis (ver Reacciones adversas y Datos preclínicos sobre seguridad ).
Embarazo y lactancia: NEBIDO® no está indicado para su uso en mujeres y no debe ser usado en mujeres embarazadas o en periodo de lactancia, ver Contraindicaciones.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y PARA OPERAR MAQUINARIA: NEBIDO® no tiene ningún efecto en la capacidad para conducir ni para operar maquinaria.
EFECTOS ADVERSOS: Respecto a los efectos adversos que pueden aparecer con el uso de andrógenos, véase también la sección Advertencias y precauciones especiales para el uso.
Los efectos adversos reportados con mayor frecuencia durante el tratamiento con NEBIDO® son acné y dolor en el lugar de la inyección.
En raras ocasiones, una microembolia pulmonar relacionado a soluciones oleosas puede producir síntomas como tos, disnea, malestar, hiperhidrosis, dolores torácicos, mareo, parestesia o síncopes. Estas reacciones pueden aparecer durante o inmediatamente después de la inyección y son reversibles. Tanto en estudios clínicos como en reportes post-comercialización los casos de sospecha de microembolismo pulmonar oleoso se han reportado raras veces (ya sea por parte de la compañía u otros notificadores) (frecuencia ≥ 1/10,000 y < 1/1,000 inyecciones) (véase la sección “Advertencias y precauciones especiales para el uso”).
Se han reportado casos de sospecha de reacciones anafilácticas después de una inyección de NEBIDO®.
Los andrógenos pueden acelerar el desarrollo de cáncer de próstata subclínico y de hiperplasia prostática benigna.
En la siguiente Tabla 1 se muestran los efectos adversos (ADRs) según las clasificaciones por órganos y sistemas de MedDRA (COS MedDRA. Las frecuencias tienen fundamento en los datos de estudios clínicos y se definen como Frecuentes (≥ 1/100 a < 1/10) y Poco frecuentes (≥ 1/1,000 a < 1/100). Los efectos adversos se documentaron en 6 estudios clínicos (N = 422) y se clasificaron cuando menos como “posiblemente relacionados a NEBIDO®”.
|
Tabla 1: Frecuencias relativas de los efectos adversos en hombres, categorizadas según COS MedDRA, con base en los datos resumidos de seis estudios clínicos, N = 442 (100.0%), es decir, N = 302 hombres con hipogonadismo se trataron con inyecciones intramusculares de 4 ml de 250 mg/ml de undecanoato de testosterona y N = 120 con 3 ml de 250 mg/ml de undecanoato de testosterona. |
||
|
Clase de órgano o sistema |
Frecuentes (≥ 1/100 a < 1/10) |
Poco frecuentes (≥ 1/1.000 a < 1/100) |
|
Trastornos de la sangre y del sistema linfático |
Policitemia. |
Hematocrito aumentado. Recuento de eritrocitos aumentado. Hemoglobina aumentada. |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad. |
|
|
Trastornos metabólicos y de la nutrición |
Aumento de peso. |
Aumento del apetito. Hemoglobina glucosilada aumentada. Hipercolesterolemia. Aumento de triglicéridos en sangre. Colesterol sanguíneo aumentado. |
|
Trastornos psiquiátricos |
Depresión: Trastorno emocional. Insomnio. Intranquilidad. Agresividad. Irritabilidad. |
|
|
Trastornos del sistema nervioso |
Dolor de cabeza. Migraña. Temblor. |
|
|
Trastornos vasculares |
Sofocos. |
Trastorno cardiovascular. Hipertensión. Mareos. |
|
Trastornos respiratorios, torácicos y mediastínicos |
Bronquitis. Sinusitis. Tos. Disnea. Ronquidos. Disfonía. |
|
|
Trastornos gastrointestinales |
Diarrea. Náusea. |
|
|
Trastornos hepatobiliares |
Alteraciones de las pruebas de la función hepática. Transaminasa glutámica-oxalacética aumentada. |
|
|
Trastornos de la piel y del tejido subcutáneo |
Acné. |
Alopecia. Eritema. Erupción cutánea1. Prurito. Piel seca. |
|
Trastornos musculo-esqueléticos, del tejido conjuntivo y óseos |
Artralgia. Dolor en las extremidades. Trastornos musculares2. Rigidez musculoesquelética. Aumento de creatinin-fosfoquinasa en sangre. |
|
|
Trastornos renales y urinarios |
Flujo de orina disminuido. Retención urinaria. Trastorno del tracto urinario. Nicturia. Disuria. |
|
|
Trastornos del aparato reproductor y de la glándula mamaria |
Antígeno específico prostático aumentado. Examen prostático anormal. Hiperplasia prostática benigna. |
Neoplasia intraepitelial prostática. Induración de la próstata. Prostatitis. Trastornos prostáticos. Cambios en la libido. Dolor testicular. Induración mamaria. Mastodinia. Ginecomastia. Estradiol aumentado. Testosterona aumentada. |
|
Trastornos generales y molestias en el lugar de administración |
Distintos tipos de reacciones en el lugar de inyección3. |
Fatiga. Astenia. Hiperhidrosis4. |
|
Se indica el término MedDRA más apropiado para describir un determinado efecto adverso. No se indican sinónimos ni condiciones relacionadas, aunque también deberían considerarse. 1. Erupción cutánea, incluyendo la erupción papular. 2. Trastornos musculares: Espasmo muscular, tensión muscular y dolor muscular. 3. Distintos tipos de reacción en el lugar de inyección: Dolor en el lugar de inyección, molestias en el lugar de inyección, prurito en el lugar de inyección, enrojecimiento en el lugar de inyección, hematoma en el lugar de inyección, irritación en el lugar de inyección, reacción en el lugar de inyección. 4. Hiperhidrosis: Hiperhidrosis y sudoración nocturna. |
||
En raras ocasiones, un microembolismo pulmonar relacionado a soluciones oleosas puede producir síntomas como tos, disnea, malestar, hiperhidrosis, dolores torácicos, mareo, parestesia o síncopes. Estas reacciones pueden aparecer durante o inmediatamente después de la inyección y son reversibles. Tanto en estudios clínicos como en reportes post-comercialización los casos de sospecha de micorembolismo pulmonar oleoso se han reportado raras veces (ya sea por parte de la compañía u otros notificadores) (frecuencia ≥ 1/10,000 y < 1/1,000 inyecciones) (véase la sección “Advertencias y precauciones especiales para el uso”).
Además de los efectos adversos arriba señalados, durante el tratamiento con productos que contienen testosterona se han reportado nerviosismo, hostilidad, apnea del sueño, distintas reacciones cutáneas incluyendo seborrea, frecuencia aumentada de erecciones y en casos muy raros, ictericia.
El uso con dosis elevada de preparados de testosterona produce en general una interrupción o disminución reversible de la espermatogénesis y, de este modo, una disminución en el tamaño de los testículos. Una terapia de reemplazo de testosterona para hipogonadismo puede causar en raras ocasiones erecciones prolongadas dolorosas (priapismo). La terapia con dosis elevada o de larga duración con testosterona produce con poca frecuencia un aumento en la incidencia de retención de líquidos y edemas.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: Para las reacciones adversas asociadas al uso de andrógenos, ver Advertencias y precauciones especiales de empleo.
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con NEBIDO® son acné y dolor en el lugar de inyección.
El microembolismo pulmonar relacionado con las soluciones oleosas puede dar lugar en casos raros a síntomas como tos, disnea, malestar, hiperhidrosis, dolor torácico, mareo, parestesia o síncope. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. Tanto en ensayos clínicos como en la experiencia post-comercialización los casos en los que existe una sospecha de microembolismo pulmonar oleoso se han descrito (ya sea por parte de la compañía o de otros notificadores) raramente (frecuencia entre > 1/10.000 y < 1/1.000 inyecciones) (ver Advertencias y precauciones especiales de empleo).
Se han notificado sospechas de reacciones anafilácticas tras la inyección de NEBIDO®.
Los andrógenos pueden acelerar la progresión del cáncer de próstata subclínico y de la hiperplasia prostática benigna.
La tabla 1 muestra las reacciones adversas al medicamento (RAMs) según la clasificación por órganos y sistemas MedDRA (COS MedDRA). Las frecuencias se basan en datos obtenidos de los ensayos clínicos y se definen como frecuentes (≥1/100 a < 1/10), poco frecuentes (≥1/1000 a < 1/100) y raras (≥1/10.000 a <1/1.000). Se documentaron reacciones adversas procedentes de 6 ensayos clínicos (N = 422) y fueron consideradas al menos posiblemente relacionadas con NEBIDO®.
Tabla de reacciones adversas:
Tabla 1, Grupos de frecuencias relativas de varones con reacciones adversas, según la clasificación por órganos y sistemas MedDRA a partir de datos agrupados procedentes de seis ensayos clínicos, N =422 (100,0%), de los que, N =302 varones con hipogonadismo tratados con inyecciones intramusculares de 4 ml y N = 120 varones con hipogonadismo tratados con inyecciones de 3 ml de testosterona undecanoato 250 mg/ml.
|
Clasificación órgano -sistema |
Frecuentes (≥ 1/100 a < 1/10) |
Poco frecuentes (≥ 1/1000 a <1/100) |
Raras ≥1/10.000 a < 1/1.000) |
|
Trastornos de la sangre y del sistema linfático |
Policitemia Aumento del hematocrito* Aumento del recuento de eritrocitos* Aumento de la hemoglobina* |
||
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
||
|
Trastornos del metabolismo y de la nutrición |
Aumento de peso |
Aumento del apetito Aumento de la hemoglobina glicosilada Hipercolesterolemia Aumento de los triglicéridos en sangre Aumento del colesterol en sangre |
|
|
Trastornos psiquiátricos |
Depresión Trastorno emocional Insomnio Intranquilidad Agresividad Irritabilidad |
||
|
Trastornos del sistema nervioso |
Dolor de cabeza Migraña Temblores |
||
|
Trastornos vasculares |
Sofocos |
Alteraciones cardiovaculares Hipertensión Mareos |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Bronquitis Sinusitis Tos Disnea Ronquidos Disfonía |
||
|
Trastornos gastrointestinales |
Diarrea Náuseas |
||
|
Trastornos hepatobiliares |
Alteraciones de las pruebas de la función hepática Aumento de la aspartato aminotransferasa |
||
|
Trastornos de la piel y del tejido subcutáneo |
Acné |
Alopecia Eritema Erupción1 Prurito Sequedad de piel |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artralgia Dolor en las extremidades Alteraciones musculares2 Rigidez musculoesquelética Aumento de creatinfosfoquinasa en sangre |
||
|
Trastornos renales y urinarios |
Disminución del flujo urinario Retención urinaria Alteraciones del conducto urinario Nocturia Disuria |
||
|
Trastornos del aparato reproductor y de la mama |
Antígeno específico prostático aumentado. Examen prostático anormal. Hiperplasia benigna de la próstata |
Neoplasia intraepitelial prostática Induración de la próstata Prostatitis Alteración de la prostáta Alteraciones de la libido Dolor testicular Induración mamaria Dolor torácico Ginecomastia Aumento del estradiol Aumento de la testosterona |
|
|
Trastornos generales y condiciones en el sitio de administración |
Varios tipos de reacciones en el lugar de inyección3 |
Fatiga Astenia Hiperhidrosis4 |
|
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Microembolia pulmonar grasa** |
||
|
* Frecuencias observadas con el uso de medicamentos que contienen testosterona. ** Frecuencia determinada en base al número de inyecciones Se incluye el término MedDRA más adecuado para describir una determinada reacción. No se enumeran los sinónimos y trastornos relacionados, pero también deberán tenerse en cuenta. 1 Erupción: incluye erupción papular. 2 Alteraciones musculares: espasmo muscular, distensión muscular y mialgia. 3 Diversos tipos de reacciones en el lugar de la inyección: dolor, malestar, prurito, eritema, hematoma,irritación o reacción en el lugar de inyección. 4 Hiperhidrosis: hiperhidrosis y sudores nocturnos. |
|||
Descripción de reacciones adversas seleccionadas: El microembolismo pulmonar relacionado con las soluciones oleosas puede dar lugar en casos raros a síntomas como tos, disnea, malestar, hiperhidrosis, dolor torácico, mareo, parestesia o síncope. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. Tanto en la experiencia post-comercialización como en las sospechas notificadas por la compañía o los investigadores en ensayos clínicos, la microembolia pulmonar grasa se ha notificado raramente (frecuencia entre > 1/10.000 y < 1/1.000 inyecciones) (ver Advertencias y precauciones especiales de empleo)
Además de las reacciones adversas mencionadas anteriormente, durante el tratamiento con productos que contienen testosterona se han comunicado casos de nerviosismo, hostilidad, apnea del sueño, diversas reacciones cutáneas que incluyen seborrea, aumento del crecimiento del pelo, frecuencia aumentada de erecciones y muy raramente, ictericia.
El tratamiento con dosis altas de productos que contienen testosterona interrumpe o reduce con frecuencia de forma reversible la espermatogénesis, reduciendo así el tamaño de los testículos; la terapia de reemplazo con testosterona en el hipogonadismo puede causar en casos raros erecciones dolorosas y persistentes (priapismo). La administración a largo plazo o en dosis altas de testosterona aumenta ocasionalmente la incidencia de retención de líquidos y edema.
Notificaciones de sospechas de reacciones adversas: Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través de la siguiente dirección electrónica: farmacovigilancia.peru@bayer.com.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR O UTILIZAR MAQUINARIA:
No se ha observado ningún efecto sobre la capacidad para conducir y utilizar máquinas.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Anticoagulantes orales: Se ha comunicado que la testosterona y sus derivados aumentan la actividad de los anticoagulantes orales derivados de cumarina. Aquellos pacientes en tratamiento con anticoagulantes orales requieren un estrecho seguimiento, especialmente durante el comienzo y finalización de la terapia con andrógenos. Se recomienda un aumento del monitoreo del tiempo de la protrombina y de las determinaciones de INR.
Otras interacciones: La administración concomitante de testosterona con ACTH o corticosteroides puede favorecer la formación de edema. Por lo tanto estos principios activos deben ser administrados cuidadosamente, particularmente en pacientes con enfermedades hepáticas o cardiacas, o en pacientes con predisposición al edema.
Interacciones con pruebas de laboratorio: los andrógenos pueden disminuir los niveles de la globulina fijadora de tiroxina, dando lugar a una disminución de los niveles séricos totales de T4 y un aumento de la captación de resina de T3 y T4. No obstante, los niveles de hormona tiroidea libre permanecen inalterados, no existiendo evidencia clínica de disfunción tiroidea.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Anticoagulantes orales: Se ha reportado que la testosterona y sus derivados incrementan el efecto de los anticoagulantes orales. Por ello, en los pacientes que reciben anticoagulantes orales se requiere de una supervisión detallada, en especial al inicio y al final de la terapia con andrógenos. Se recomienda un examen más frecuente del tiempo de protrombina y determinaciones de INR más frecuentes.
Otras formas de interacción: La administración simultánea de testosterona y ACTH o corticoesteroides puede favorecer la formación de edemas. Por ello, estos ingredientes deben utilizarse con precaución en especial en pacientes con enfermedades cardiacas o hepáticas o en pacientes propensos a edemas.
Influencia en los estudios de laboratorio: Los andrógenos pueden reducir el nivel de globulina fijadora de tiroxina y, de este modo, producir un nivel de T4 total en suero reducido y un aumento en la captación de resina de T3 y T4. Sin embargo, los niveles de la hormona tiroidea libre se mantienen sin cambios. No existen indicios clínicos de una afectación de la función tiroidea.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Los estudios toxicológicos no han mostrado otros efectos que aquellos que pueden ser explicados basándose en el perfil hormonal de NEBIDO®.
La testosterona ha mostrado ser no mutagénica in vitro, usando el modelo de mutación invertida (test de Ames) o células ováricas de hámster. En estudios con animales de laboratorio se ha encontrado una relación entre el tratamiento con andrógenos y determinados tipos de cáncer. Los datos experimentales en ratas han mostrado un aumento en las incidencias de cáncer de próstata después del tratamiento con testosterona.
Se sabe que las hormonas sexuales facilitan el desarrollo de determinados tumores, inducidos por agentes carcinogénicos conocidos. Se desconoce la relevancia clínica de esta última observación.
Los estudios de fertilidad realizados en roedores y primates han demostrado que el tratamiento con testosterona puede afectar la fertilidad suprimiendo la espermatogénesis de forma dosis-dependiente.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
No se recomienda el uso de NEBIDO® en niños y adolescentes.
NEBIDO® solo debe usarse si el hipogonadismo (hiper e hipogonadotrófico) ha sido demostrado y si cualquier otra etiología, responsable de los síntomas, ha sido excluida antes del inicio del tratamiento. La insuficiencia de testosterona debe ser claramente demostrada mediante datos clínicos (regresión de las características sexuales secundarias, cambio en la composición corporal, astenia, disminución de la libido, disfunción eréctil, etc.) y confirmada mediante dos determinaciones independientes de testosterona sérica.
Pacientes de edad avanzada: Existe experiencia limitada sobre la seguridad y eficacia de la utilización de NEBIDO® en pacientes de más de 65 años de edad. Actualmente, no existe un consenso sobre los valores de referencia de testosterona específicos para la edad. Sin embargo, debe tenerse en cuenta que los niveles fisiológicos séricos de testosterona son más bajos a medida que aumenta la edad.
Examen médico y pruebas de laboratorio:
Examen médico: Antes del inicio del tratamiento con testosterona, se debe realizar un examen médico detallado a todos los pacientes, con el fin de excluir el riesgo de un cáncer de próstata ya existente. En pacientes que reciban terapia con testosterona debe realizarse un seguimiento prostático y mamario periódico cuidadoso, de acuerdo a los métodos establecidos (tacto rectal y determinación sérica de PSA), al menos una vez al año, y dos veces al año en pacientes de edad avanzada o pacientes de riesgo (aquellos con factores de riesgo clínicos o familiares). Se tendrán en cuenta las directrices locales para el monitoreo de la seguridad en la terapia de sustitución de la testosterona.
Pruebas de laboratorio: Se deben monitorear los niveles séricos de testosterona y a intervalos regulares durante el tratamiento. Los facultativos deben ajustar la dosis de forma individualizada para asegurar el mantenimiento de niveles de testosterona eugonadales.
En pacientes bajo tratamiento a largo plazo con andrógenos, los siguientes parámetros de laboratorio también deben ser monitoreados regularmente: hemoglobina y hematocrito, pruebas de función hepática y perfil lipídico (ver Reacciones adversas)
Debido a la variabilidad en los valores de laboratorio, todas las determinaciones de testosterona deben ser realizadas en el mismo laboratorio.
Tumores: Los andrógenos pueden acelerar la progresión de un cáncer subclínico de próstata y una hiperplasia benigna de próstata.
NEBIDO® debe usarse con precaución en pacientes con cáncer y riesgo de hipercalcemia (e hipercalciuria asociada) debido a metástasis óseas. En estos pacientes se recomienda el control regular de las concentraciones séricas de calcio.
Casos de tumores hepáticos benignos y malignos se han reportado en usuarios de productos hormonales, como los compuestos con andrógenos. Si en los varones que usan NEBIDO® se presentaran molestias abdominales superiores graves, hepatomegalia o signos y síntomas de hemorragia intraabdominal, deberá considerarse un diagnóstico diferencial de tumor hepático.
Insuficiencia cardiaca, hepática o renal: En pacientes con insuficiencia cardiaca, hepática o renal grave o con cardiopatía isquémica, el tratamiento con testosterona puede causar complicaciones graves caracterizadas por edema con o sin insuficiencia cardiaca congestiva. En este caso, se debe interrumpir el tratamiento inmediatamente.
Insuficiencia hepática o renal: No se han realizado estudios para demostrar la eficacia y seguridad del producto en pacientes con insuficiencia hepática o renal. Por tanto, el tratamiento de sustitución de testosterona en estos pacientes se realizará con precaución.
Insuficiencia cardíaca: Se ha de tener precaución en los pacientes con predisposición a desarrollar edema, por ejemplo en los casos severos de insuficiencia cardíaca, hepática o renal, o aquellos de cardiopatía isquémica pues el tratamiento con andrógenos puede ocasionar aumento de la retención de sodio y agua. En el caso de complicaciones graves caracterizadas por edema con o sin insuficiencia cardíaca congestiva debe interrumpirse el tratamiento inmediatamente (ver Reacciones adversas)
La testosterona puede aumentar la presión arterial, por lo que NEBIDO® se debe usar con precaución en varones con hipertensión.
Trastornos de la coagulación: Como regla general se debe tener en cuenta el riesgo de sangrado por el uso de inyecciones intramusculares en pacientes con trastornos hemorrágicos adquiridos o heredados.
Se ha comunicado que la testosterona y sus derivados aumentan la actividad de los anticoagulantes orales derivados de cumarina (ver Interacción con otros medicamentos y otras formas de interacción).
La testosterona debe utilizarse con precaución en pacientes con trombofilia, ya que se han realizado estudios post-comercialización e informes de eventos trombóticos en estos pacientes durante la terapia con testosterona.
Otras patologías: NEBIDO® debe usarse con precaución en pacientes con epilepsia o migraña, ya que estas enfermedades pueden verse agravadas.
En pacientes tratados con andrógenos que alcanzan concentraciones plasmáticas normales de testosterona tras la terapia de sustitución puede ocurrir un aumento de la sensibilidad a la insulina.
Determinados signos clínicos: irritabilidad, nerviosismo, aumento de peso, erecciones prolongadas o frecuentes, pueden indicar una excesiva exposición a los andrógenos, requiriéndose un ajuste de la dosis.
Puede potenciarse la apnea del sueño preexistente.
El tratamiento con NEBIDO® deber ser retirado de forma permanente si los síntomas por una exposición excesiva a los andrógenos persisten o aparecen de nuevo durante el tratamiento a las dosis recomendadas.
Aplicación: Como todas las soluciones oleosas, NEBIDO® tiene que inyectarse exclusivamente por vía intramuscular y muy lentamente (durante dos minutos). La microembolia pulmonar por soluciones oleosas puede causar en casos raros signos y síntomas como tos, disnea, malestar general, hiperhidrosis, dolor torácico, mareos, parestesia o síncope. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. El paciente deberá ser mantenido en observación durante e inmediatamente después de cada inyección con el fin de poder apreciar los posibles signos y síntomas de microembolismo pulmonar relacionado con las soluciones oleosas. El tratamiento es normalmente de apoyo, por ejemplo, administración de oxígeno suplementario.
Se han notificado sospecha de reacciones anafilácticas después de la inyección de NEBIDO®.
El uso de NEBIDO® puede conducir a resultados positivos en los análisis de dopaje.
Los andrógenos, entre los que figura NEBIDO®, no son adecuados para estimular el desarrollo muscular en individuos sanos ni para aumentar la capacidad física.
Los riesgos graves para la salud a consecuencia del uso de NEBIDO® como agente de dopaje no se pueden prescindir (ver Reacciones adversas).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES PARA EL USO: No se recomienda el uso de NEBIDO® en niños ni en adolescentes.
NEBIDO® únicamente puede utilizarse en caso de hipogonadismo (hipergonadotrópico o hipogonadotrópico) demostrado y después de descartar otras causas que podrían originar la sintomatología. La deficiencia de testosterona se debe detectar claramente mediante síntomas clínicos (retroceso de las características sexuales secundarias), cambios en la composición del cuerpo, astenia, disminución de la libido, disfunción eréctil, etc.) y confirmarse mediante dos determinaciones séricas de testosterona distintas.
La experiencia con el uso de NEBIDO® en pacientes de más de 65 años de edad es limitada. Actualmente no se tiene ningún consenso sobre los valores de referencia de testosterona específicos de la edad. Sin embargo, se debe considerar que los niveles fisiológicos de testosterona disminuyen con la edad.
Examen médico: Antes de iniciar la terapia con testosterona, todos los pacientes deben someterse a un examen médico minucioso con el fin de descartar el riesgo de un carcinoma de próstata ya existente. En los pacientes tratados con testosterona se deben realizar cuando menos una vez al año estudios de control cuidadosos y periódicos de la próstata y de la mama de acuerdo con los métodos actualmente establecidos (tacto rectal y niveles séricos de PSA); en el caso de pacientes mayores y de alto riesgo (con determinados factores de riesgo clínicos o familiares), dos veces al año. Se deben tomar en cuenta las directrices nacionales para la monitorización de la seguridad en la terapia de reemplazo de la testosterona.
Además de los controles de laboratorio séricos de testosterona, en los pacientes bajo terapia andrógena de largo plazo también se deben revisar periódicamente los siguientes parámetros de laboratorio: Hemoglobina, hematocrito así como pruebas de función hepática (véase la sección Efectos adversos).
Debido a la variabilidad de los valores de laboratorio, todas las mediciones de testosterona deben efectuarse en el mismo laboratorio.
Tumores: Los andrógenos pueden acelerar la progresión de un cáncer de próstata subclínico o de una hiperplasia prostática benigna.
NEBIDO® debe utilizarse con precaución en pacientes de cáncer en los que, debido a metástasis óseas, exista un riesgo de hipercalcemia (e hipercalciuria asociada). En estos pacientes, se recomienda controlar periódicamente el nivel de calcio en suero.
Se han reportado casos de tumores hepáticos benignos y malignos en personas que usan sustancias hormonales, como por ejemplo los andrógenos. Si en los hombres que utilizan NEBIDO® surgen molestias en el abdomen superior, hepatomegalia, o signos de hemorragia intraabdominal, se debe considerar un tumor hepático en el diagnóstico diferencial.
Otras enfermedades: En los pacientes que padecen de una insuficiencia cardiaca, hepática o renal grave o de una cardiopatía isquémica, la terapia con testosterona puede causar complicaciones serias caracterizadas por edema que pueden venir acompañados de una insuficiencia cardiaca congestiva. En este caso, la terapia debe suspenderse de inmediato. No se han realizado estudios sobre la eficacia y la tolerabilidad del medicamento en pacientes con función renal o hepática limitada. Por ello, en estos pacientes la terapia de reemplazo de testosterona sólo debe realizarse con precauciones.
Se deben tener precauciones en pacientes que tiendan a la formación de edemas, ya que el tratamiento con andrógenos puede intensificar la retención de sodio (véase la sección Efectos adversos).
En principio, siempre se deben observar las restricciones en el uso de inyecciones intramusculares en pacientes con trastornos de la coagulación sanguínea adquiridos o congénitos.
NEBIDO® sólo debe utilizarse con precauciones en pacientes con epilepsia o migraña, ya que estas enfermedades pueden agravarse.
En los pacientes con tratamiento con andrógenos que después de la terapia de reemplazo de testosterona alcancen niveles normales de testosterona en suero, puede ocurrir una sensibilidad a la insulina mejorada.
Determinados síntomas clínicos, tales como irritabilidad, nerviosismo, aumento de peso, erecciones prolongadas o frecuentes, pueden ser señal de una exposición excesiva a los andrógenos y requieren de un ajuste en la dosis.
Una apnea del sueño existente puede intensificarse.
NEBIDO® debe suspenderse definitivamente si persisten los síntomas de una exposición andrógena excesiva o si vuelven a aparecer durante la terapia con el régimen de dosis recomendado.
Aplicación: Al igual que todas las soluciones oleosas, NEBIDO® debe inyectarse únicamente por vía intramuscular y muy lentamente (en el transcurso de dos minutos). En casos poco frecuentes, un microembolismo pulmonar relacionado a soluciones oleosas puede producir síntomas tales como tos, disnea, malestar, hiperhidrosis, dolores torácicos, mareo, parestesia o síncopes. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. Por ello, se debe observar al paciente durante e inmediatamente después de cada inyección para permitir una detección oportuna de signos y síntomas de un microembolismo pulmonar relacionado a soluciones oleosas. El tratamiento se realiza normalmente con medidas de soporte tales como la administración de oxígeno suplementario.
Se han reportado casos de sospecha de reacciones anafilácticas después de una inyección de NEBIDO®.
El uso de NEBIDO® puede arrojar resultados positivos en controles de dopaje.
Los andrógenos como los contenidos en NEBIDO®, no son adecuados para fomentar el desarrollo muscular en personas saludables ni para incrementar la capacidad de rendimiento físico.
Las consecuencias de salud por el uso de NEBIDO® como dopaje no pueden ignorarse y no se pueden descartar riesgos graves para la salud (véase la sección Efectos adversos).
PRECAUCIONES ESPECIALES DE ELIMINACIÓN Y OTRAS MANIPULACIONES:
La solución para inyección intramuscular debe ser inspeccionada de forma visual antes de su uso, debiendo ser usadas solo aquellas soluciones claras y libres de partículas.
El medicamento es para un único uso, debiendo desecharse el resto de solución no utilizada. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Ampolla:
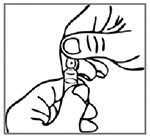
Normas para abrir la ampolla de NEBIDO® con sistema de apertura de “Un punto de corte” (UPC): Hay una marca previamente rayada debajo del punto coloreado en la ampolla, lo que elimina la necesidad de limar el cuello. Antes de abrirla, asegurarse de que cualquier solución en la parte superior de la ampolla fluya hacia la parte inferior. Usar ambas manos para abrir; mientras que se sujeta la parte inferior de la ampolla con una mano, usar la otra mano para romper la parte superior de la ampolla en la dirección opuesta al punto coloreado.
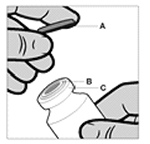
Vial: El vial es solamente para uso único. El contenido del vial se ha de inyectar intramuscularmente, justo después de cargarse a la jeringa. Posteriormente a la remoción de la tapa plástica (A) no retire el anillo de metal (B) o la tapa con reborde (C).
Venta bajo receta médica
SmPC Alemania_CCDS 8_Rev. Noviembre 2016
Fabricado por:
Bayer AG, D-13342 Berlín – Alemania.
Importado y distribuido por:
BAYER S.A. PERÚ
Av. Paseo de la República 3074 Piso 10, San Isidro, Lima 27
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Posología: El contenido de una ampolla de NEBIDO® (que equivale a 1000 mg de undecanoato de testosterona) se administra una ampolla mediante inyección a intervalos de cada 10 a 14 semanas. Las inyecciones con esta frecuencia pueden mantener un nivel suficiente de testosterona sin generar acumulación.
Inicio de la terapia: Antes de iniciar la terapia y al inicio de la misma se debe determinar el nivel de testosterona sérica. En función de ello y de los síntomas clínicos, el primer intervalo de inyección se puede reducir a un mínimo de 6 semanas en comparación con el intervalo de 10 a 14 semanas recomendado para la terapia de mantenimiento. Con esta dosis inicial, se pueden alcanzar más rápidamente niveles de testosterona suficiente para lograr el estado de equilibrio.
Terapia de mantenimiento e individualización de la terapia: El intervalo de las inyecciones debe mantenerse en el rango recomendado de 10 a 14 semanas. Durante la terapia de mantenimiento será necesario un control cuidadoso de los niveles séricos de testosterona. Es recomendable determinar periódicamente los niveles séricos de testosterona. Las determinaciones deben realizarse al final de cada intervalo de inyección considerando los síntomas clínicos. Estos niveles de testosterona sérica deben situarse en el tercio inferior del rango normal. Niveles en el suero por debajo del rango normal serían indicativos de que debe reducirse el intervalo de inyección. En caso de un nivel en suero demasiado elevado, se puede ponderar una ampliación del intervalo de inyección.
Poblaciones especiales:
Niños y adolescentes: NEBIDO® no está indicado para niños ni adolescentes.
El uso de NEBIDO® en adolescentes menores a 18 años no ha sido analizado en estudios clínicos (véase la sección Advertencias y precauciones especiales para su uso).
Pacientes mayores: Los limitados datos disponibles señalan que no es necesario un ajuste de la dosis en pacientes mayores (véase la sección Advertencias y precauciones especiales para su uso).
Pacientes con insuficiencia hepática: No se han realizado estudios en pacientes con una función hepática limitada. El uso de NEBIDO® está contraindicado en hombres que han tenido o tienen tumores hepáticos (véase la sección Contraindicaciones).
Pacientes con insuficiencia renal: No se han realizado estudios en pacientes con una función renal limitada.
Tipo de uso: Para administración intramuscular.
La inyección debe realizarse muy lentamente (en el transcurso de dos minutos). NEBIDO® es únicamente para inyección intramuscular. Se debe considerar que NEBIDO® se inyecta profundamente en el glúteo observando las medidas de precaución habituales para inyecciones intramusculares. En ello se debe cuidar especialmente el evitar inyecciones intravasculares (véase la sección Advertencias y precauciones especiales para su uso, Aplicación). La inyección intramuscular debe realizarse inmediatamente después de abrir la ampolla (indicaciones sobre la ampolla, véase la sección Precauciones especiales para la eliminación y otras indicaciones para la manipulación, Instrucciones para abrir la ampolla de manera segura).
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
Posología: NEBIDO® (1 ampolla/vial corresponde a 1.000 mg de undecanoato de testosterona) se inyecta cada 10 a 14 semanas. La administración de las inyecciones con esta frecuencia permite mantener niveles suficientes de testosterona sin producir acumulación.
Inicio del tratamiento: Antes de comenzar el tratamiento y durante el inicio del mismo, se deben determinar los niveles séricos de testosterona. Dependiendo de los niveles séricos de testosterona y de los síntomas clínicos, el intervalo a partir de la primera inyección puede reducirse hasta un mínimo de 6 semanas, comparado con el intervalo recomendado de mantenimiento de 10 a 14 semanas. Con esta dosis inicial, se pueden alcanzar más rápidamente los niveles de testosterona suficientes para lograr el estado de equilibrio.
Mantenimiento e individualización del tratamiento: El intervalo entre las inyecciones debe mantenerse dentro del límite recomendado de 10 a 14 semanas. Se requiere realizar un seguimiento cuidadoso de los niveles séricos de testosterona durante el mantenimiento del tratamiento. Es recomendable determinar los niveles séricos de testosterona de forma regular. Las determinaciones deben realizarse inmediatamente antes de la siguiente dosis, teniendo en cuenta también los síntomas clínicos. Estos niveles séricos deberían encontrarse dentro del tercio inferior del rango normal. Los niveles séricos que estén por debajo del rango normal indicarían la necesidad de acortar el intervalo entre las inyecciones. En caso de que los niveles séricos estén elevados, puede valorarse un aumento del intervalo entre las inyecciones.
Poblaciones especiales:
Niños y adolescentes: No está indicado el uso de NEBIDO® en niños y adolescentes y no se ha evaluado clínicamente en varones menores de 18 años (ver Advertencias y precauciones especiales de empleo).
Pacientes de edad avanzada: Los datos limitados no sugieren la necesidad de ajustar la dosis en los pacientes de edad avanzada (ver Advertencias y precauciones especiales de empleo).
Pacientes con insuficiencia hepática: No se han realizado estudios formales en pacientes con insuficiencia hepática. El uso de NEBIDO® está contraindicado en los varones con tumores hepáticos actuales o pasados (ver Contraindicaciones).
Pacientes con insuficiencia renal: No se han realizado estudios formales en pacientes con insuficiencia renal.
Forma de administración: Para uso intramuscular.
La inyección debe administrarse muy lentamente (durante dos minutos). NEBIDO® sólo debe administrarse por vía intramuscular. Se debe tener cuidado de inyectar NEBIDO® en el músculo glúteo de forma profunda, siguiendo las precauciones habituales para la administración intramuscular. Se debe tener especial precaución para evitar la inyección intravascular (ver Advertencias y precauciones especiales de empleo, Aplicación). La inyección intramuscular se debe realizar inmediatamente después de la apertura de la ampolla/vial. (Para la ampolla ver en Precauciones especiales de eliminación y otras manipulaciones las instrucciones para abrir la ampolla de forma segura).
SOBREDOSIS:
No se requieren medidas terapéuticas especiales, excepto la terminación del tratamiento con el fármaco o la reducción de la dosis después de una sobredosis.
INFORMACIÓN CLÍNICA:
Indicaciones: Terapia de reemplazo de testosterona en el hipogonadismo masculino, cuando la deficiencia de testosterona ha sido confirmado mediante datos clínicos y pruebas bioquímicas (véase la sección Advertencias y precauciones especiales para su uso).
NATURALEZA Y CONTENIDO DEL ENVASE:
Ampolla de vidrio tipo I de color ámbar conteniendo 4 ml de solución inyectable.
Vial de vidrio tipo I de color ámbar conteniendo 4 ml de solución inyectable.
Tamaño de la caja: 1 x 4 ml