
MITRUL
CICLOBENZAPRINA
Cápsulas de liberación prolongada
Caja, 10,20,30 Cápsulas de liberación prolongada, 15 Miligramos
FÓRMULA
Cada CÁPSULAS DE LIBERACIÓN PROLONGADA 15 mg contiene:
Ciclobenzaprina clorhidrato 15,0 mg
Esfera de azúcar
Opadry clear YS-1-7006
Etilcelulosa
Dietil ftalato
FORMAS FARMACÉUTICAS Y CONCENTRACIONES: Cápsulas de liberación prolongada en las siguientes concentraciones de 15 mg.
PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
Forma de presentación: Cajas x 10, 20 y 30 cápsulas de liberación prolongada.
Almacenamiento y manipulación: Almacenar a temperatura no mayor de 30 °C.
INDICACIONES Y USO: MITRUL® (cápsulas de liberación prolongada de ciclobenzaprina clorhidrato) está indicado como un complemento al descanso y a la terapia física para el alivio del espasmo muscular asociado a patologías músculo-esqueléticas dolorosos agudas. La mejoría se manifiesta mediante el alivio del espasmo muscular y sus signos y síntomas asociados, a saber, dolor, sensibilidad y limitación del movimiento.
Limitaciones de uso:
• MITRUL® debe utilizarse sólo por cortos periodos de tiempo (hasta dos o tres semanas) ya que no hay disponible evidencia adecuada de efectividad para un uso más prolongado y porque el espasmo muscular asociado a patologías músculo-esqueléticas dolorosos agudas generalmente es de corta duración y pocas veces se justifica una terapia específica por periodos mayores.
• MITRUL® no ha resultado efectivo en el tratamiento de la espasticidad asociada a enfermedad cerebral o de la médula espinal o en niños con parálisis cerebral.
INFORMACIÓN PARA EL PACIENTE
• Aconsejar a los pacientes para que dejen de tomar MITRUL® y para que notifiquen al médico de inmediato si experimentan síntomas de una reacción alérgica, tales como dificultad para respirar, urticaria, inflamación de la cara o de la lengua o prurito.
• Aconsejar a los pacientes que no deben tomar MITRUL® con inhibidores MAO o dentro de los 14 días posteriores a su discontinuación.
• Se debe tener precaución sobre el riesgo del síndrome de la serotonina con el uso combinado de MITRUL® y otras drogas, tales como ISRS, IRSN, ATCs, tramadol, bupropión, meperidina, veropamilo o inhibidores de la MAO. Aconsejar a los pacientes sobre los signos y síntomas del síndrome de la serotonina (ver Advertencias y precauciones: Uso en pacientes de edad avanzada) e instruirá los pacientes para que busquen atención médica de inmediato si experimentan estos síntomas.
• Aconsejar a los pacientes para que dejen de tomar MITRUL® y para que notifiquen al médico en el momento si experimentan arritmias o taquicardia.
• Advertir a los pacientes que MITRUL® puede aumentar los efectos de deterioro del alcohol. Estos efectos pueden verse también si MITRUL® se toma con otros depresores del SNC.
• Se debe prevenir a los pacientes acerca del manejo de un auto u otra maquinaria peligrosa hasta no tener la seguridad suficiente de que el tratamiento con MITRUL® no afectará deforma negativa su capacidad para involucrarse en tales actividades.
• Aconsejara los pacientes que deben tomar MITRUL® aproximadamente a la misma hora cada día.
Para mayor información científica sobre el producto, comunicarse con Tecnofarma S.A.,
al telefax 700-3000 o
vía e-mail: info@tecnofarma.com.pe
TECNOFARMA S.A
CONTRAINDICACIONES
• Hipersensibilidad a cualquier componente de este producto. Estas reacciones adversas podrían manifestarse como una reacción anafiláctica, urticaria, hinchazón facial o de la lengua, o prurito.
Discontinuar MITRUL® si se sospecha de una reacción de hipersensibilidad.
• Uso concomitante de inhibidores de la monoaminooxidasa (MAO) o dentro de los 14 días posteriores a su discontinuación. Ha habido convulsiones de crisis hiperpiróticas y muertes en pacientes que reciben ciclobenzaprina (o antidepresivos tricíclicos estructural mente similares) en forma concomitante con fármacos inhibidores de la MAO.
• Durante la fase de recuperación aguda del infarto de miocardio, y en pacientes con arritmias, alteraciones en la conducción o bloqueo cardiaco, o insuficiencia cardiaca congestiva.
• Hipertiroidismo.
REACCIONES ADVERSAS
Reacciones adversas más comunes en los ensayos clínicos con MITRUL®: Como los ensayos clínicos se realizan bajo condiciones ampliamente cambiantes, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas en los estudios clínicos de otro fármaco y pueden no refleja rías tasas observadas en la práctica.
Los datos descriptos a continuación reflejan una exposición a MITRUL® de 253 pacientes en 2 ensayos clínicos. MITRUL® se estudió en dos ensayos doble-ciego, de grupos paralelos, controlados con placebo, controlados con activo de diseño idéntico (ver Estudios clínicos). La población de estudio se compuso de pacientes con espasmos musculares asociados con condiciones músculo-esqueléticas dolorosos agudas. Los pacientes recibieron 15 mg o 30 mg de MITRUL® vía oral una vez por día, 10 mg de ciclobenzaprina de liberación inmediata tres veces por día o placebo durante 14 días.
Las reacciones adversas más comunes (incidencia ≥3% en cualquier grupo de tratamiento y mayor que con el placebo) fueron sequedad de la boca, mareos, fatiga, constipación, náuseas, dispepsia y somnolencia (ver Tabla 1).
Tabla 1: Incidencia de las reacciones adversas más comunes que ocurrieron en ≥3% de los pacientes en cualquier grupo de tratamiento* y mayor que con placebo en los dos ensayos de fase 3, doble-ciego de MITRUL®.
|
Placebo |
MITRUL® |
MITRUL® |
|
|
Sequedad de boca |
2% |
6% |
14% |
|
Mareos |
2% |
3% |
6% |
|
Fatiga |
2% |
3% |
3% |
|
Constipación |
0% |
1% |
3% |
|
Somnolencia |
0% |
1% |
2% |
|
Náuseas |
1% |
3% |
3% |
|
Dispepsia |
1% |
0% |
4% |
|
* 15 mg de MITRUL® una vez por día, 30 mg de MITRUL® una vez por día, o comprimidos de ciclobenzaprina de liberación inmediata 3 veces por día. |
|||
Reacciones adversas adicionales de los estudios clínicos y experiencia poscomercialización: Se han informado las siguientes reacciones adversas en estudios clínicos o experiencia poscomercialización con MITRUL®, ciclobenzaprina de liberación inmediata o drogas tricíclicos. Como algunas de estas reacciones son informadas voluntariamente por una población de tamaño indeterminado, no siempre es posible calcular de forma confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
En un programa de vigilancia poscomercialización de ciclobenzaprina de liberación inmediata, las reacciones adversas más frecuentemente informadas fueron somnolencia, sequedad en la boca y mareos, y las reacciones adversas informadas entre un 1% y 3% de los pacientes fueron: Fatiga/cansancio, astenia, náuseas, constipación, dispepsia, gusto desagradable, visión borrosa, dolor de cabeza, nerviosismo y confusión.
Se informaron las siguientes reacciones adversas en la experiencia poscomercializadón (MITRUL® o ciclobenzaprina de liberación inmediata), en estudios clínicos de ciclobenzaprina de liberación inmediata (incidencia <1%) o en la experiencia poscomercialización con otras drogas tricíclicos.
• Cuerpo en su totalidad: Sincope; malestar; dolor en el pecho; edema.
• Cardiovasculares: Taquicardia; arritmia; vasodilatación; palpitaciones; hipotensión; hipertensión; infarto de miocardio; bloqueo cardiaco; ACV.
• Digestivas: Vómitos; anorexia; diarrea; dolor gastrointestinal; gastritis; sed; flatulencia; edema de lengua; función hepática anormal y raros informes de hepatitis, ictericia, y colestasia; íleo paralítico, decoloración de la lengua; estomatitis; hinchazón parotídea.
• Endocrinas: Síndrome de secreción inadecuada de HAD (Hormona antidiurética).
• Hematológicas y linfáticas: Púrpura; depresión de médula ósea; leucopenia; eosinofilia; trombocitopenia.
• Hipersensibilidad: Anafilaxis; angioedema; prurito; edema facial; urticaria; sarpullido.
• Metabólicas, Nutricionales e Inmunológicas; Elevación y disminución de los niveles de azúcar en sangre; aumento o pérdida de peso.
• Músculo-esqueléticas: Debilidad local; mialgia.
• Sistema nervioso y psiquiátricas: Crisis, ataxia; vértigo; disartria; temblores; hipertonía; convulsiones; espasmos musculares; desorientación; insomnio; ánimo deprimido; sensaciones anormales; ansiedad; agitación; psicosis, pensamientos y sueños anormales; alucinaciones; excitación; parestesia; diplopía; síndrome de la serotonina; síndrome neuroléptico maligno; disminución o aumento de la libido; marcha anormal; delirios; conducta agresiva; paranoia; neuropatía periférica; parálisis de Bell; alteración en los patrones de EEG; síntomas extra piramidales.
• Respiratorias: Disnea.
• Cutáneas: Sudoración; fotosensiblidad; alopecia.
• Sentidos especiales: Ageusia; tinnitus.
• Urogenitales: Frecuencia y/o retención urinaria, micción afectada; dilatación del tracto urinario; impotencia; inflamación testicular; ginecomastía; aumento de senos; galactorrea.
INTERACCIONES MEDICAMENTOSAS: Sobre la base de su similitud estructural con los antidepresivos tricíclicos, MITRUL® puede tener interacciones de riesgo de vida con los inhibidores de la MAO (ver Contraindicaciones), puede aumentar los efectos del alcohol, barbitúricos y otros depresores del SNC, pueden aumentar el riesgo de convulsiones en pacientes que toman tramadol, o puede bloquear la acción antihipertensiva de la guanetidina y de compuestos que actúan de manera similar.
Se han informado casos de poscomercialización de síndrome de la serotonina durante el uso combinado de ciclobenzaprina y otras drogas, tales como ISRS, IRSN, ATCs, tramadol, bupropión, meperidina, verapamilo o inhibidores de la MAO (ver Advertencias y precauciones: Síndrome de serotonina).
ESTUDIOS CLÍNICOS: La eficacia se evaluó en dos estudios doble-ciego, de grupos paralelos, controlados con activo y controlados con placebo de diseño idéntico de 15 y 30 mg de MITRUL® administrado una vez por día, entre las 6 y las 7 de la tarde, de ciclobenzaprina de 10 mg tres veces por día, o placebo durante 14 días en pacientes con espasmos musculares asociados a patologías músculo-esqueléticas dolorosos agudas.
Hubo diferencias significativas en el análisis de eficacia primaria, la calificación del paciente de la utilidad del medicamento, entre el grupo con 15 mg de MITRUL® y el grupo con placebo en los días 4 y 14 en un estudio y entre el grupo con 30 mg de MITRUL® y el grupo con placebo en el día 4 en el segundo estudio.
Tabla 2: Calificación del paciente de la utilidad del medicamento-Estudio 1 *
|
Día 4 |
Día 14 |
|||
|
Placebo (N=64) |
30 mg de MITRUL® (N=64) |
Placebo (N=64) |
30 mg de MITRUL® (N=64) |
|
|
Excelente |
1 (2%) |
3 (5%) |
12 (19%) |
15 (23%) |
|
Muy bueno |
5 (8%) |
13 (20%) |
9(14%) |
19 (30%) |
|
Bueno |
15 (23%) |
22 (34%) |
10(16%) |
15 (23%) |
|
Regular |
24 (38%) |
20 (31%) |
16(25%) |
10 (16%) |
|
Malo |
10 (16%) |
5 (8%) |
9 (14%) |
4 (6%) |
|
Faltante |
9 (14%) |
1 (2%) |
8 (13%) |
1 (2%) |
|
* Los porcentajes se redondean al porcentaje entero más cercano. |
||||
Tabla 3: Calificación del paciente de la utilidad del medicamento-Estudio 2*.
|
Día 4 |
Día 14 |
|||
|
Placebo (N=64) |
MITRUL® 15 mg |
Placebo (N=64) |
MITRUL® 15 mg |
|
|
Excelente |
1 (2%) |
2 (3%) |
10 (16%) |
13 (21%) |
|
Muy bueno |
10 (16%) |
12 (19%) |
12 (19%) |
21 (33%) |
|
Bueno |
14 (22%) |
21 (33%) |
13 (20%) |
9 (14%) |
|
Regular |
16 (25%) |
17 (27%) |
14 (22%) |
10 (16%) |
|
Malo |
19 (30%) |
6 (10%) |
12 (19%) |
5 (8%) |
|
Faltante |
4 (6%) |
5 (8%) |
3 (5%) |
5 (8%) |
|
* Los porcentajes se redondean al porcentaje entero más cercano. |
||||
Además, uno de los dos estudios demostró diferencias significativas entre el grupo con 30 mg/día y el grupo placebo en términos del alivio del dolor local por espasmo muscular calificado por el paciente en el día 4 y día 8, en la restricción de movimiento calificada por el paciente en el día 4 y día 8, y en la impresión global del cambio calificado por el paciente en el día 4, día 8 y día 14.
En ambos estudios, no hubo diferencias de tratamiento significativas entre los grupos de tratamiento con MITRUL® y el grupo placebo en la evaluación global del médico, en la restricción en actividades de la vida cotidiana calificada por el paciente o en la calidad del sueño nocturno.
TOXICOLOGÍA NO CLÍNICA
Carcinogénesis, mutagénesis, deterioro de la fertilidad: Se realizaron estudios a largo plazo en ratones CD1 y ratas Sprague-Dawley con ciclobenzaprina para evaluar su potencial carcinogénico. En un estudio de carcinogenicidad de 81 semanas, se observó un hemangiosarcoma en 3 de 21 ratones macho a 10 mg/kg/día (2 veces la MRHD sobre la base de mg/m2). En un estudio de carcinogenicidad de 105 semanas, se observó un hemangiosarcoma en 3 de 50 ratones macho a 10 mg/kg/día (3 veces la MRHD sobre la base de mg/m2). No hubo hallazgos de tumores en ratas o ratones hembra.
Ciclobenzaprina HCl no fue mutagénico o clastogénico en los siguientes ensayos: un ensayo in vitro Ames de mutación bacteriana, prueba in vitro de aberración cromosómica en célula ováricas de hámster Chino y ensayo in vivo de micronúcleos de ratón.
Ciclobenzaprina HCl no tuvo efectos sobre la fertilidad y el rendimiento reproductivo en las ratas macho o hembra en dosis orales de hasta 20 mg/kg/día (6 veces la MRHD sobre la base mg/m2).
Toxicología y/o farmacología en animales: En un estudio de 67 semanas con ratas que recibieron ciclobenzaprina en dosis orales de 10, 20 o 40 mg/kg/día (3 a 15 veces la MRHD sobre la base de mg/m2), hubo hallazgos en el hígado que consistían en vacuolización midzonal con lipidosis en machos, e hipertrofia hepatocítica midzonal y centrilobular en hembras. Además, no hubo hallazgos de necrosis coagulativa centrilobular. En los grupos de dosis más altas, estos cambios microscópicos se observaron después de 26 semanas e incluso antes en ratas que murieron antes de las 26 semanas; en dosis más bajas, el cambio no se observó hasta después de 26 semanas.
En un estudio de 26 semanas con monos Cynomolgus que recibieron ciclobenzaprina en dosis orales de 2,5; 5; 10 o 20 mg/kg/día, a un mono con dosis de 20 mg/kg/día (15 veces la MRHD sobre la base de mg/m2) se le practicó la eutanasia en la semana 17. La morbilidad de este animal se atribuyó a los hallazgos de pancreatitis crónica, colecistitis, colangitis y necrosis hepática focal.
ADVERTENCIAS Y PRECAUCIONES
Síndrome de serotonina: Se ha informado el desarrollo del síndrome de la serotonina potencial mente con riesgo de vida con ciclobenzaprina cuando se utiliza en combinación con otras drogas, tales como inhibidores selectivos de recaptación de serotonina (ISRS), los inhibidores de la recaptación de serotonina y norepinefrina (IRSN), antidepresivos tricíclicos (ATCs), tramadol, bupropión, meperidina, verapamil o inhibidores de la MAO. Está contraindicado el uso concomitante de MITRUL con los inhibidores de la MAO (ver Contraindicaciones). Los síntomas del síndrome de la serotonina pueden incluir cambios del estado mental (por ej., confusión, agitación, alucinaciones), inestabilidad autónoma (por ej., diaforesis, taquicardia, presión arterial lábil, hipertermia), anormalidades neuromusculares (por ej., temblor, ataxia, hiperreflexia, clonus, rigidez muscular) y/o síntomas gastrointestinales (por ej., náuseas, vómitos, diarrea). El tratamiento con MITRUL® y cualquier agente serotonérgico concomitante debe discontinuarse de inmediato si las reacciones adversas anteriores ocurren y se debe iniciar el tratamiento sintomático. Si el tratamiento concomitante con MITRUL® y otras drogas serotonérgicas está clínicamente garantizado, se recomienda una observación cuidadosa, particularmente durante el inicio del tratamiento o el aumento de las dosis.
Efectos parecidos a los de los antidepresivos tricíclicos: La ciclobenzaprina está estructuralmente relacionada con los antidepresivos tricíclicos por ej., amitriptilina e imipramina. Se ha informado que los antidepresivos tricíclicos producen arritmias, taquicardia sinusal, prolongación del tiempo de conducción que lleva al infarto de miocardio y al ACV (ver Contraindicaciones). MITRUL® puede aumentar los efectos del alcohol, barbitúricos y otros depresores del SNC.
Algunas de las reacciones más serias del sistema nervioso central (SNC) que se observaron con los antidepresivos tricíclicos han ocurrido en estudios a corto plazo de ciclobenzaprina para otras indicaciones, a excepción de espasmo muscular asociado a condiciones músculo-esqueléticas agudas, y en general, en dosis un poco más altas que las recomendadas para los espasmos músculo-esqueléticos. Si se desarrollan síntomas clínicamente significativos del SNC, se debe considerar la suspensión del tratamiento con MITRUL®.
Uso en pacientes de edad avanzada: Como resultado de un aumento del 40% en los niveles plasmáticos de ciclobenzaprina y un aumento del 56% en la vida media plasmática luego de la administración de MITRUL® en individuos ancianos en comparación con adultos jóvenes, no se recomienda el uso de MITRUL® pacientes de edad avanzada (ver Farmacología clínica: Farmacocinética).
Uso en pacientes con insuficiencia hepática: Como resultado de niveles plasmáticos de ciclobenzaprina dos veces más altos en individuos con insuficiencia hepática leve, en comparación con individuos sanos, luego de la administración de ciclobenzaprina de liberación inmediata y debido a que hay flexibilidad de dosis limitada con MITRUL®, no se recomienda el uso de MITRUL® en pacientes con insuficiencia hepática leve, moderada o severa (ver Farmacología clínica: Farmacocinética).
Acción parecida a la de la atropina: Debido a su acción tipo atropina, MITRUL® debe utilizarse con cuidado en pacientes con antecedentes de retención urinaria, glaucoma de ángulo estrecho, presión intraocular aumentada, y en pacientes que toman medicamentos anticolinérgicos.
POSOLOGÍA Y ADMINISTRACIÓN: La dosis adulta recomendada para la mayoría de los pacientes es una (1) cápsula de MITRUL® de 15 mg administrada una vez por día. Algunos pacientes pueden necesitar hasta 30 mg/día, suministrados como dos (2) cápsulas de MITRUL® de 15 mg una vez por día.
Se recomienda que las dosis se tomen aproximadamente a la misma hora cada día.
No se recomienda el uso de MITRUL® por períodos mayores de dos o tres semanas (ver Indicaciones y uso).
USO EN POBLACIONES ESPECÍFICAS
Embarazo:
• Embarazo Categoría B: No hay estudios adecuados y bien controlados de MITRUL® mujeres embarazadas. Como los estudios de reproducción en animales no siempre son predictivos de la respuesta humana, MITRUL® debe usarse durante el embarazo sólo si es claramente necesario.
No se observaron efectos relacionados con el tratamiento en el desarrollo embriofetal de ratones y conejos en aproximadamente 3 a 15 veces de la dosis máxima humana recomendada (MRHD, por sus siglas en inglés), respectivamente (sobre la base de mg/m2 en dosis maternales de 20 mg/kg/día en ratones y conejos).
• Efectos no teratogénicos: La ciclobenzaprina ha demostrado afectar en forma negativa el desarrollo postnatal de las crías de la ratas cuando las hembras fueron tratadas con la droga durante los períodos de embarazo y lactancia. Este estudio descubrió que la ciclobenzaprina redujo el peso corporal de las crías y la supervivencia en aproximadamente ≥3 veces la dosis máxima humana recomendada (sobre la base de mg/m2 en dosis maternales de 10 y 20 mg/kg/día en ratas).
Madres en período de lactancia: Se desconoce si este fármaco se excreta en la leche humana. Como la ciclobenzaprina está estrechamente relacionada a los antidepresivos tricíclicos, algunos de los cuales se excretan en la leche materna, se debe tener cuidado al administrar MITRUL® a mujeres en período de lactancia.
Uso pediátrico: La seguridad y eficacia de MITRUL® no se ha estudiado en pacientes pediátricos.
Uso geriátrico: Los estudios clínicos de MITRUL® no incluyeron un número suficiente de pacientes de 65 años o más para determinar la seguridad y eficacia de MITRUL® en la población de edad avanzada. La concentración plasmática y la vida media de ciclobenzaprina se incrementan considerablemente en los ancianos en comparación con la población general de pacientes. En consecuencia, el uso de MITRUL® no se recomienda en los pacientes de edad avanzada (ver Advertencias y precauciones: Uso en pacientes de edad avanzada y Farmacología clínica: Farmacocinética).
Insuficiencia hepática: No se recomienda el uso de MITRUL® en pacientes con disfunción hepática leve, moderada o severa, (ver Advertencias y precauciones: Uso en pacientes con insuficiancia hepática y Farmacología clínica: Farmacocinética).
SOBREDOSIS: Aunque es poco común, puede haber muertes por sobredosis de MITRUL®. La ingesta de fármacos múltiples (incluyendo alcohol) es común en la sobredosis intencional de ciclobenzaprina.
Como el manejo de la sobredosis es complejo y cambiante, se recomienda que ante la eventualidad de una sobredosificación concurriral hospital más cercano.
Los signos y síntomas de toxicidad pueden manifestarse rápidamente después de la sobredosis de ciclobenzaprina; por lo tanto,se necesita el monitoreoen hospital loantes posible.
Manifestaciones: Los efectos más comunes asociados a la sobredosis de ciclobenzaprina son somnolencia y taquicardia. Las manifestaciones menos frecuentes incluyen temblor, agitación, coma, ataxia, hipertensión, dificultad en el habla, confusión, mareos, náuseas, vómitos y alucinaciones. Las manifestaciones potencialmente críticas pero raras de sobredosis son paro cardiaco, dolor en el tórax, disritmias cardiacas, hipotensión severa, convulsiones y síndrome neuroléptico maligno. Los cambios en el electrocardiograma, particularmente en el eje o ancho de QRS, son indicadores clínicamente significativos de toxicidad de ciclobenzaprina. Otros efectos potenciales de la sobredosis incluyen cualquiera de los síntomas enumerados bajo Reacciones adversas.
Manejo:
• General: Como el manejo de la sobredosis es complejo y cambiante, se recomienda ante la eventualidad de una sobredosificación concurriral hospital más cercano.
Para proteger contra las manifestaciones raras pero potencialmente críticas descriptas anteriormente, obtener un ECG e iniciar inmediatamente el monitoreo cardiaco. Proteger las vías respiratorias del paciente, establecer una línea intravenosa, y comenzar la descontaminación gástrica. Es necesaria la observación con monitoreo cardiaco y la observación de signos de depresión respiratoria o del SNC, hipotensión, disritmias cardiacas y/o bloqueos de conducción, y convulsiones. Si hay signos de toxicidad en cualquier momento durante este período, se necesita un monitoreo prolongado. El monitoreo de los niveles plasmáticos del fármaco no deben guiar el manejo del paciente. La diálisis probablemente no tenga ningún valor debido a las bajas concentraciones plasmáticas del fármaco.
• Descontaminación gástrica: Todos los pacientes con sospecha de sobredosis con MITRUL® deben recibir descontaminación gástrica. Esto debe incluir lavado gástrico de gran volumen seguido de carbón activado. Si la conciencia está afectada, debe asegurarse la vía respiratoria antes del lavado y la emesis está contraindicada.
• Cardiovascular: Una duración máxima de QRS de derivaciones de extremidades de 0,10 segundos puede ser la mejor indicación de la severidad de la sobredosis. Se debe establecer una alcalinización sérica, a un pH de 7,45 a 7,55, usando bicarbonato de sodio intravenoso e hiperventilación (según sea necesario), para los pacientes con disritmias y/o ensanchamiento de QRS. No es deseable un pH >7,60 o un pCO2 <20 mmHg. Las disritmias que no responden a la terapia con bicarbonato de sodio/hiperventilación pueden responder a lidocaína, bretilio o fenitoína. Los antiarrítmicos tipo 1A y 1C generalmente están contraindicados (por ej., quinidina, disopiramida y procainamida).
• SNC: En pacientes con depresión del SNC, se aconseja la intubación temprana debido al potencial de deterioro abrupto. Las convulsiones se deben controlar con benzodiazepinas o, si éstas no son efectivas, con otros anticonvulsivos (por ej., fenobarbital, fenitoína). No se recomienda la fisostigmina salvo para tratar síntomas de riesgo de vida que no han respondido a otras terapias, y sólo en consulta estricta con un centro de toxicología.
• Seguimiento psiquiátrico: Como la sobredosis es a menudo intencional, los pacientes pueden intentar el suicidio por otros medios durante la fase de recuperación. La derivación psiquiátrica puede ser apropiada.
• Manejo pediátrico: Los principios del manejo de la sobredosis en niños y adultos son similares. Se recomienda fervientemente que ante la eventualidad de una sobredosificación concurrir al hospital más cercano.
ABUSO Y DEPENDENCIA DE DROGAS
Dependencia: Las similitudes farmacológicas entre los fármacos tricíclicos exigen que se consideren determinados síntomas de abstinencia al administrar MITRUL®, aún cuando no se haya informado que ocurren con este fármaco. El cese abrupto del tratamiento luego de la administración prolongada rara vez produce náuseas, dolor de cabeza y malestar. Estos no son indicativos de adicción.
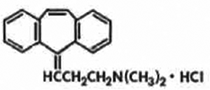
DESCRIPCIÓN: MITRUL® es un relajante muscular que alivia el espasmo muscular de origen local sin interferir con la función muscular. El principio activo en las cápsulas de liberación prolongada MITRUL® es clorhidrato de ciclobenzaprina, USP. El clorhidrato de ciclobenzaprina (HCI) es una sal amina tricíclica cristalina con la fórmula empírica C20H21N• HCl y un peso molecular de 311,9. Tiene un punto de fusión de 217 °C, y pKa de 8,47 a 25 °C. Es libremente soluble en agua y alcohol, escasamente soluble en isopropanol, e insoluble en solventes de hidrocarburos. Si las soluciones acuosas se hacen alcalinas, la base libre se separa. El HCl de ciclobenzaprina está designado químicamente como clorhidrato de 3-(5H-dibenzo[a,d] ciclohepteno-5-ilideno)-N,N-dimetil-1 -propanamina, y tiene la siguiente fórmula estructural:
Las cápsulas de liberación prolongada MITRUL® para administración oral se suministra en concentración de 15 mg.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción: La ciclobenzaprina alivia el espasmo muscular de origen local sin interferir con la función muscular. La ciclobenzaprina no ha demostrado ser efectiva en el espasmo muscular por enfermedad del sistema nervioso central. En modelos animales, la ciclobenzaprina redujo o suprimió la hiperactividad muscular. Los estudios en animales indican que ciclobenzaprina no actúa en la unión neuromuscular o directamente sobre el músculo esquelético. Tales estudios muestran que la ciclobenzaprina actúa fundamentalmente dentro del sistema nervioso central en el tronco cerebral en lugar de a nivel de la médula espinal, aunque una acción superpuesta en esta última puede contribuir a su actividad relajante muscular total. La evidencia indica que el efecto neto de ciclobenzaprina es una reducción de la actividad motora tónica somática, influyendo tanto en el sistema motor gamma (?) como alfa (α). Los estudios farmacológicos en animales demostraron una similitud entre los efectos de ciclobenzaprina y los antidepresivos tricíclicos relacionados de forma estructural, incluyendo antagonismo de la reserpina, potenciación de norepinefrina, efectos anticolinérgicos periféricos y centrales potentes, y sedación. La ciclobenzaprina causó un aumento leve a moderado en la frecuencia cardiaca en animales.
Farmacocinética:
• Absorción: Tras la administración de dosis única de 15 mg y 30 mg de MITRUL® en pacientes adultos sanos (n=15), la Cmax, AUC0-168h y AUC0-8 aumentaron de manera aproximadamente proporcional a la dosis de 15 a 30 mg. El tiempo trascurrido hasta la concentración pico de ciclobenzaprina plasmática (Tmax) fue de 7 a 8 horas en ambas dosis de MITRUL®.
Un estudio sobre los efectos de los alimentos realizado en individuos adultos sanos (n=15) utilizando una dosis única de 30 mg de MITRUL® demostró un aumento estadísticamente significativo en la biodisponibilidad cuando 30mg de MITRUL® se administró con comida en comparación con el estado de ayuno. Hubo un aumento del 35% en la concentración pico de ciclobenzaprina plasmática (Cmax) y un aumento del 20% en la exposición (AUC0-168h y AUC0-8) en presencia de alimentos. Sin embargo, no se observó ningún efecto en la Tmax, o en la forma de la concentración media de ciclobenzaprina plasmática versus el perfil de tiempo. La ciclobenzaprina en plasma fue detectable por primera vez tanto en el estado posprandial como en ayunas a las 1,5 horas.
En un estudio de dosis múltiples utilizando 30 mg de MITRUL® administrado una vez por día por 7 días en un grupo de voluntarios adultos sanos (n=35), se observó una acumulación de 2,5 veces de los niveles plasmáticos de ciclobenzaprina en estado estacionario.
• Metabolismo y excreción: Ciclobenzaprina se metaboliza ampliamente y se excreta fundamentalmente como glucurónidos mediante el riñón. Los citocromos P-450 3A4, 1A2 y, en menor medida, 2D6, mediante la N-demetilación, una de las rutas oxidativas para la ciclobenzaprina. La ciclobenzaprina tiene una vida media de eliminación de 32 horas (rango 8-37 horas; n=18); el clearance plasmático es 0,7 L/min. luego de la administración de dosis única de MITRUL®.
• Poblaciones especiales:
– Pacientes de edad avanzada: Aunque no hubo diferencias notables en la Cmax o la Tmax, la AUC plasmática de ciclobenzaprina aumenta en un 40% y la vida media plasmática de ciclobenzaprina se prolonga en individuos ancianos mayores de 65 años de edad (50 horas) luego de la dosis con MITRUL® en comparación con los individuos más jóvenes (32 horas). No se evaluaron las características farmacocinéticas de ciclobenzaprina luego de la administración de dosis múltiple de MITRUL® en los ancianos.
– Insuficiencia hepática: En un estudio de farmacocinética de ciclobenzaprina de liberación inmediata en 16 individuos con insuficiencia hepática (15 leves, 1 moderado según escala de Child-Pugh), tanto AUC como Cmax fueron aproximadamente el doble de los valores observados en el grupo de control de pacientes sanos. Se desconoce la farmacocinética de ciclobenzaprina en individuos con insuficiencia hepática severa.
TIEMPO DE VIDA ÚTIL: 2 años.
No debe administrarse después de la fecha de vencimiento, según lo indicado en el empaque.