
MICROGYNON
ETINILESTRADIOL, LEVONORGESTREL
Grageas
1 Caja , 1 Blíster , 21 Grageas
COMPOSICIÓN:
Principios activos: Levonorgestrel, etinilestradiol.
Excipientes: Lactosa, Almidón de maíz, Povidona 25000, Talco, Estearato de magnesio, Sacarosa, Povidona 700000, Macrogol 6000, Carbonato de calcio, Glicerol, Dióxido de titanio (E171), Pigmento de óxido de hierro amarillo (E172), cera montanglicol.
Forma galénica y cantidad de principio activo por unidad:
1 gragea de MICROGYNON® contiene:
Levonorgestrel 0.15 mg, etinilestradiol 0.03 mg.
POSOLOGÍA/USO: Los AHC como MICROGYNON® deben ser recetados únicamente por un médico experimentado, que esté en condiciones de dar a la paciente una explicación completa sobre todas las ventajas y desventajas de cada uno de los métodos anticonceptivos disponibles, así como hacerle un examen general y realizarle una exploración ginecológica.
Las grageas siempre deben tomarse aproximadamente a la misma hora del día, preferentemente con un poco de líquido, y siguiendo el orden indicado en el empaque. Durante 21 días consecutivos se toma una gragea diaria. Le sigue siempre un intervalo de descanso de 7 días, antes de volver a empezar con el siguiente blíster. Durante el lapso de descanso, suele presentarse la hemorragia por deprivación, que normalmente empieza 2 o 3 días después de ingerir la última gragea, y que puede persistir al comenzar el siguiente empaque.
Inicio de la toma:
Para aquellas mujeres que en el último mes no utilizaron ningún anticonceptivo hormonal: La gragea debe empezar a tomarse en el 1er día del ciclo (= 1er día de sangrado). También es posible empezar en los días 2 a 5, pero entonces se recomienda el uso adicional de algún método anticonceptivo no hormonal durante los primeros 7 días de la toma de las grageas del primer ciclo (p.ej. preservativos, a excepción el método del calendario de Ogino-Knaus y el método de la temperatura basal).
Cambio de otro anticonceptivo oral combinado (AOC), un anillo vaginal o un parche transdérmico: Se recomienda empezar con la toma de MICROGYNON® preferentemente al día siguiente de la toma de la última gragea activa del AOC anterior, aunque a más tardar el día después del intervalo normal de descanso, o de la fase de placebo.
Si se había estado usando un anillo vaginal o un parche transdérmico, se recomienda empezar con MICROGYNON® el mismo día del retiro del último anillo o del último parche, o a más tardar el día en que se cumpliría el plazo de la siguiente aplicación.
Cambio de un preparado a base de progestágeno solo (minipíldora, inyección, implante, sistema intrauterino de liberación de progestágeno (SIU): El cambio de la minipíldora puede llevarse a cabo cualquier día. Si se trata de un implante o de un SIU de liberación de progestágeno, el cambio debe ser el mismo día de su retiro, como muy temprano. Y en el caso de los preparados inyectables, el día en que se cumpliría el plazo de la siguiente inyección. En todos estos casos, se recomienda el uso adicional de un método anticonceptivo no hormonal durante los primeros 7 días de la toma de grageas.
Después de un aborto en el primer trimestre: Se puede empezar con la toma de MICROGYNON® de inmediato. No se requiere la implementación adicional de acciones anticonceptivas.
Después de un aborto en el segundo trimestre o después de un parto: Para decidir en qué momento se debe retomar el uso de un AHC como MICROGYNON® después de un parto o de un aborto en el 2º trimestre, hay que tomar en consideración que aumenta el riesgo de algún evento tromboembólico venoso postparto (hasta durante 12 semanas; léanse las “Advertencias y Precauciones”).
En todo caso, después de un parto o de un aborto en el 2º trimestre, se recomienda empezar con el uso de MICROGYNON® como muy temprano entre el día 21 y 28. Si se inicia la toma después, se recomienda el uso adicional de un método anticonceptivo no hormonal durante los primeros 7 días de la toma de grageas. Si entretanto hubo relaciones sexuales, hay que descartar antes la presencia de un embarazo o esperar hasta que llegue la primera menstruación.
Indicaciones en caso de olvido de la toma de alguna gragea: Si no han pasado más de 12 horas desde el olvido de la toma de la gragea, hay que tomarla de inmediato, en cuanto se ha detectado el olvido. Las siguientes grageas hay que volver a tomarlas en el horario habitual. La protección anticonceptiva no disminuye.
Si ya han pasado más de 12 horas desde el olvido de la toma de la gragea, la protección anticonceptiva puede verse reducida. En el caso de este tipo de olvido, rigen las siguientes dos normas básicas:
1. La toma nunca debe interrumpirse por más de 7 días.
2. Una toma regular a lo largo de al menos 7 días es indispensable para lograr suprimir adecuadamente el eje hipotálamo-hipófisis-ovario.
En consecuencia, dependiendo de la semana en la que el olvido tuvo lugar, se recomienda lo siguiente:
1ª semana: La gragea olvidada debe ser ingerida de inmediato, en cuanto uno detecte el olvido – inclusive cuando esto implique tomar dos grageas en un día. Las grageas subsiguientes se vuelven a tomar a la hora habitual. Durante los siguientes 7 días es necesario el uso adicional de un método anticonceptivo no hormonal. Si durante los 7 días previos hubo relaciones sexuales, hay que considerar la posibilidad de un embarazo. Mientras más grageas se hayan olvidado y mientras más cercanas al intervalo de descanso se encuentren, mayor es el riesgo de un embarazo.
2ª semana: La gragea olvidada debe ser ingerida de inmediato, en cuanto se detecte el olvido – inclusive cuando esto implique tomar dos grageas en un día. Las siguientes grageas se vuelven a tomar a la hora habitual. Siempre y cuando en los 7 días previos, la toma de la gragea haya sido regular, no es necesario tomar otras medidas anticonceptivas. Si esto no fue el caso o se olvidó más de 1 gragea, es necesario el uso adicional de métodos anticonceptivos no hormonales durante los siguientes 7 días.
3ª semana: Existe un riesgo elevado de embarazo debido a la cercanía con el inminente intervalo sin grageas. Si se sigue una de las siguientes indicaciones de uso, no es necesario el uso adicional de un método anticonceptivo, siempre y cuando la toma de los 7 días previos haya sido regular. En caso contrario, hay que seguir la primera de las indicaciones de uso y durante los siguientes 7 días utilizar adicionalmente un método anticonceptivo no hormonal.
a) La gragea olvidada debe ser ingerida de inmediato, en cuanto se detecte el olvido – inclusive cuando esto implique tomar dos grageas en un día. Las siguientes grageas se vuelven a tomar a la hora habitual. Hay que empezar con la toma de grageas del siguiente empaque inmediatamente después, es decir, sin cumplir con el intervalo de descanso. Es poco probable que antes de terminar el 2º empaque se presente la hemorragia por deprivación, pero pueden presentarse episodios repetidos de ligeros sangrados intermenstruales o metrorragia.
b) La toma de grageas del empaque que se está usando se interrumpe totalmente. Se descansan máximo 7 días (incluyendo aquellos días en que la toma se olvidó) y se retoma desde el principio la ingesta de grageas de un nuevo empaque.
Si en el subsiguiente intervalo de descanso no se presenta la hemorragia por deprivación, hay que considerar la posibilidad de un embarazo.
Indicaciones en caso de trastornos gastrointestinales:
En el caso de trastornos gastrointestinales severos – independientemente de su causa (es decir también en el caso de diarrea provocada por medicamentos, etc.) – es posible que la absorción sea deficiente, por lo que se recomienda el uso adicional de métodos anticonceptivos.
En caso de vómitos en las 3-4 horas posteriores a la toma de la gragea, hay que seguir las reglas básicas del apartado sobre “Indicaciones en caso de olvido de la toma de alguna gragea”. Para que pueda ser mantenido el esquema normal de toma de grageas, es necesario tener disponible un empaque de reserva para poder repetir la toma de la gragea correspondiente.
Manipulación del ciclo menstrual:
Retraso de la menstruación (prolongación del ciclo): Hay que empezar con la toma de la primera gragea del siguiente empaque, sin intervalo de descanso. De este modo puede retrasarse la menstruación deliberadamente (cuando mucho hasta el final del segundo empaque). Durante este tiempo pueden presentarse ligeros sangrados intermenstruales y metrorragia. Posteriormente, la toma regular de MICROGYNON® se continúa después del lapso habitual de 7 días de descanso.
Adelanto de la menstruación: El inicio de la menstruación puede ser desplazado a otro día de la semana, si se acorta el intervalo de descanso deliberadamente. Mientras más corto el intervalo, más poco probable es que se presente la hemorragia por deprivación, y más probable es que se presenten ligeros sangrados intermenstruales y metrorragia a lo largo de la toma del siguiente empaque (de manera similar que cuando se presenta un retraso de la menstruación).
Indicaciones en caso de menstruaciones irregulares: Todos los AHC pueden provocar menstruaciones irregulares (ligeros sangrados intermenstruales o metrorragia), sobre todo durante los primeros meses de uso. Esta es la razón por la que hay que dar tiempo a una fase de adaptación de por lo menos 3 ciclos para poder obtener un diagnóstico acertado del origen de las menstruaciones irregulares.
Si persisten los sangrados irregulares o se presentan por primera vez después de ciclos menstruales regulares, es importante también tomar en consideración causas no hormonales. En este sentido hay que tomar las medidas diagnósticas correspondientes para descartar un embarazo o una enfermedad maligna. Estas aclaraciones pueden incluir un legrado.
La hemorragia por deprivación puede no presentarse durante el intervalo de descanso. Si el AHC se utilizó cabalmente de acuerdo a las indicaciones de posología, es poco probable que se presente un embarazo. No obstante, si el AHC no se tomó exactamente como se indica antes de la falta de la primera hemorragia por deprivación, o si faltan dos hemorragias por deprivación seguidas, es necesario verificar la presencia de un embarazo antes de continuar con la toma.
Recomendaciones posológicas especiales:
Niñas/Adolescentes: El uso de MICROGYNON® está indicado hasta después de la menarca. La eficacia y seguridad de MICROGYNON® fueron probadas en mujeres mayores de 18 años. En el caso de las adolescentes, si está indicado, se recomienda el uso de la misma dosis que en mujeres adultas.
Pacientes mayores: Después de la menopausia no hay indicación.
Insuficiencia renal: MICROGYNON® no fue probado en mujeres con insuficiencia renal.
Insuficiencia hepática: MICROGYNON® no debe ser usado en mujeres con insuficiencia hepática.
INDICACIONES/POSIBILIDADES DE USO:
Anticoncepción hormonal: Antes de tomar la decisión de prescribir MICROGYNON®, hay que considerar los factores de riesgo presentes e individuales de cada mujer, sobre todo en relación a la enfermedad tromboembólica venosa (ETV). También hay que ponderar los riesgos de una ETV con el uso de MICROGYNON® y con los del uso de otros anticonceptivos hormonales combinados (AHC) (véanse las “Contraindicaciones” y las “Advertencias y Precauciones”).
FARMACOCINÉTICA:
Levonorgestrel:
Absorción: Administrado por vía oral, el levonorgestrel se reabsorbe rápida y completamente. La concentración sérica máxima se alcanza aproximadamente 1 hora después de la toma de una dosis única (aprox. 3 ng/ml). El levonorgestrel está casi íntegramente biodisponible después de la toma oral.
Distribución: Alrededor del 64% del levonorgestrel está específicamente unido a la globulina fijadora de hormonas sexuales (SHBG), alrededor del 35% inespecíficamente a albúmina; sólo el 1.3% de la concentración total en suero es un esteroide libre. El aumento de la concentración de la SHBG inducido por etinilestradiol, influye en la fijación relativa de levonorgestrel a proteínas séricas, lo que causa un aumento de la fijación a la SHBG y una disminución de la unión a albúmina y de la fracción libre. El volumen de distribución es de aproximadamente 129 litros.
Metabolismo: La biotransformación de levonorgestrel transcurre por los caminos conocidos del metabolismo de los esteroides, en que la CYP3A4 es la enzima que más participa en el metabolismo. Los principales metabolitos en el plasma son las formas conjugadas y no conjugadas de 3α,5ß-tetrahidro-levonorgestrel. La depuración metabólica del suero es de alrededor 1.3-1.6 mL/min/kg.
Eliminación: Las concentraciones de levonorgestrel en suero disminuyen bifásicamente en un periodo de semidesintegración de alrededor de 20-24 horas. El levonorgestrel se elimina en forma de metabolitos por el riñón y la bilis, en partes casi iguales.
Condiciones para la aproximación a un estado estacionario: Con una toma diaria, las concentraciones de levonorgestrel en suero aumentan al triple a cuádruple aproximadamente, y se aproximan a un estado estacionario en la segunda mitad del ciclo de tratamiento. La farmacocinética de levonorgestrel se ve influenciada por las concentraciones de la SHBG, que con una toma diaria de MICROGYNON® aumenta aproximadamente 1.7 veces. Esto lleva a una disminución de la depuración a 0.7 mL/min/kg aproximadamente en el estado estacionario.
Etinilestradiol:
Absorción: Administrado por vía oral, el etinilestradiol se reabsorbe rápida y completamente. Las concentraciones séricas máximas de alrededor de 95 pg/mL (MICROGYNON®) se alcanzan después de 1-2 horas. La biodisponibilidad total, después de la metabolización presistémica (metabolismo de primer paso), es del orden del 45%, aunque con un gran variabilidad individual del 20-65%.
Distribución: El etinilestradiol es muy fuerte (alrededor de 98%), pero se fija inespecíficamente a la albúmina e induce un aumento de las concentraciones en suero de la SHBG. El volumen de distribución es de alrededor de 2.8-8.6 l/kg.
Metabolismo: El etinilestradiol se metaboliza presistémicamente tanto en la mucosa del intestino delgado como también en el hígado. En la mucosa del intestino delgado se conjuga, en el hígado se degrada por medio de la fase I del metabolismo (los principales metabolitos: 2-hidroxietinilestradiol y 2-metoxietinilestradiol) y la conjugación. El citocromo 3A4 interviene en gran medida en el metabolismo.
Eliminación: Las concentraciones en suero del etinilestradiol disminuyen bifásicamente durante un periodo de 1 hora, respectivamente de 10-20 horas. La depuración es de alrededor de 2.3-7 mL/min/kg. El etinilestradiol se elimina sólo en forma de sus metabolitos con las heces y la orina en una proporción de alrededor de 6:4. El ácido glucurónico y los conjugados de sulfato de etinilestradiol y los metabolitos de la fase I están sujetos a la circulación enterohepática. El periodo de eliminación de los metabolitos es de alrededor de 24 horas.
Condiciones para la aproximación a un estado estacionario: En la toma diaria de MICROGYNON®, las concentraciones en suero de etinilestradiol aumentan ligeramente. En la toma diaria, el estado estacionario se alcanza después de aproximadamente una semana.
Cinética en grupos de pacientes especiales: No existen datos de la farmacocinética de mujeres con insuficiencia hepática o renal.
Los datos preclínicos: Los estudios preclínicos de toxicidad tras ingesta repetida, genotoxicidad y potencial carcinogénico de los anticonceptivos orales combinados, no arrojaron indicios claros de determinados riesgos para el ser humano, aunque los estudios epidemiológicos sí sugieren un riesgo aumentado de carcinoma hepático tras el uso a largo plazo (>6 años), observado en mujeres sin cirrosis hepática y con ausencia de VHB y VHC.
En los animales de experimentación, el etinilestradiol causó efectos letales al embrión, aún con dosis relativamente pequeñas, considerados específicos de la especie; se observaron malformaciones del tracto urogenital y feminización en los fetos varones.
La transferencia de estos resultados de experimentación en animales a humanos, es controversial.
Los estudios de toxicología reproductiva en ratas, ratones y conejos, no arrojaron indicios claros de efectos teratógenos. Para riesgos en personas, véase el apartado “Embarazo/Lactancia”.
CONTRAINDICACIONES:
• Presencia o riesgos de una enfermedad tromboembólica venosa (ETV)
— Tromboembolia venosa – Presencia de ETV (aun en tratamiento con anticoagulantes) o ETV en la anamnesis (p.ej. trombosis venosa profunda o embolia pulmonar)
— Presencia de importantes factores de riesgo tromboembólico venoso como una predisposición congénita o adquirida para eventos tromboembólicos venosos, como p.ej. resistencia a la PCA (incluida la mutación Leiden del factor V), deficiencia congénita de antitrombina III, deficiencia congénita de proteína C o de proteína S
— Presencia simultánea de varios de los factores de riesgo tromboembólico venoso descritos en el apartado de Advertencias y Precauciones.
• Presencia o riesgo de tromboembolismo arterial (TEA)
— Eventos tromboembólicos arteriales y sus pródromos presentes o previos (p.ej. angina de pecho, infarto de miocardio, ataques isquémicos transitorios, accidente cerebrovascular)
— Presencia de importantes factores de riesgo predisponentes de eventos tromboembólicos arteriales, tales como:
— Diabetes mellitus con complicaciones vasculares
— Hipertonía arterial severa
— Dislipoproteinemia severa
— Migraña con síntomas neurológicos focales (también en la anamnesis)
— Predisposición congénita o adquirida de tromboembolia arterial, como p.ej. hiperhomocisteinemia o anticuerpos antifosfolípidos (anticuerpos anticardiolipinas, anticoagulante lúpico)
• Presencia simultánea de varios factores de riesgo predisponentes de eventos tromboembólicos arteriales, como los que se describen en el apartado “Advertencias y Precauciones”.
• Presencia o antecedentes de enfermedad hepática grave, mientras persistan parámetros anormales de funcionamiento hepático;
• Presencia o antecedentes de tumores hepáticos benignos o malignos;
• Presencia o sospecha de enfermedades malignas de los órganos genitales o de las glándulas mamarias, si éstas son dependientes de hormonas sexuales;
• Sangrados vaginales de origen desconocido;
• Sospecha o presencia de embarazo;
• Hipersensibilidad a los componentes o excipientes de MICROGYNON®.
EFECTOS SOBRE LAS FACULTADES PARA CONDUCIR Y UTILIZAR MAQUINARIA: No se realizaron estudios sobre la posible incidencia sobre las facultades para conducir ni para utilizar maquinaria.
Los efectos secundarios adversos: Los principales efectos secundarios adversos en relación al uso de un AHC se describen en el apartado “Advertencias y Precauciones” (véanse ahí). Los efectos secundarios adversos graves son básicamente las tromboembolias arteriales y venosas.
Los efectos secundarios adversos enlistados a continuación pueden presentarse con el uso de un AHC. La frecuencia se define de acuerdo a la siguiente escala (basada principalmente en informes espontáneos de la supervisión del mercado; no existen estimaciones exactas de la frecuencia): Frecuente (≥ 1/100 hasta < 1/10); ocasional (≥ 1/1‘000 hasta < 1/100); raro (≥ 1/10‘000 hasta < 1/1‘000); desconocido.
Infecciones:
Desconocido: Candidiasis vulvovaginal.
Enfermedades del sistema inmunológico:
Raro: Reacciones de hipersensibilidad.
Desconocido: Angioedema.
Trastornos del metabolismo y la alimentación:
Frecuente: Aumento de peso.
Ocasional: Retención de líquidos, variaciones del apetito.
Raro: Pérdida de peso.
Enfermedades psiquiátricas:
Frecuente: Estado de ánimo depresivo, humor variable.
Ocasional: Disminución de la libido.
Raro: Aumento de la libido.
Enfermedades del sistema nervioso:
Frecuente: Cefalea, mareo.
Ocasional: Migraña.
Enfermedades oftálmicas:
Raro: Molestias en el uso de lentes de contacto.
Enfermedades del corazón y cardiovasculares:
Raro: Eventos tromboembólicos venosos (p. ej., trombosis venosa profunda, embolia pulmonar), eventos tromboembólicos arteriales (p. ej., ataques isquémicos transitorios, infarto cerebral, infarto agudo de miocardio), aumento de presión arterial.
Enfermedades del tracto gastrointestinal:
Frecuente: Naúseas.
Ocasional: Vómito, diarrea.
Enfermedades hepáticas y de la vesícula biliar:
Raro: Colelitiasis, ictericia colestásica, tumores de hígado.
Enfermedades de la piel y del tejido subcutáneo:
Ocasional: Eritema, urticaria, prurito generalizado.
Raro: Cloasma, eritema nudoso, eritema multiforme, acné, alopecia.
Enfermedades de los órganos sexuales y de la glándula mamaria:
Frecuente: Dolores en la región pélvica, distensión abdominal o dolores de pecho, sangrados intermenstruales.
Ocasional: Amenorrea, aumento de pechos.
Raro: Galactorrea, secreción vaginal o cambios en el flujo vaginal.
Desconocido: Vaginitis, cervicitis.
Trastornos generales:
Ocasional: Edemas.
PROPIEDADES/EFECTOS:
Código ATC: G03AA07
Mecanismo de acción: Como en todos los anticonceptivos hormonales combinados (AHC), los efectos anticonceptivos de MICROGYNON® se basan en varios factores, debiendo considerarse como los principales la inhibición de la ovulación y la modificación de la secreción del cérvix. Además, debido a los cambios morfológicos y enzimáticos, el endometrio ofrece condiciones poco favorables a la nidación. Finalmente, los cambios hormonales inducidos por los AHC conducen a ciclos más regulares y disminuyen la cantidad del sangrado menstrual.
Los anticonceptivos hormonales combinados tienen una tasa de fallo de menos del 1% anual, siempre y cuando se tomen correctamente.
INTERACCIONES: Para detectar las interacciones potenciales, también debe consultarse la información especializada de los otros medicamentos ingeridos.
La influencia de otros medicamentos en la farmacocinética de los anticonceptivos hormonales:
Los inductores enzimáticos: La interacción entre los anticonceptivos hormonales y ciertos medicamentos, que estimulan enzimas microsomales y por lo tanto suelen provocar un aumento en la depuración de hormonas sexuales, puede causar una disminución de la acción anticonceptiva así como metrorragias. Este es el caso por ejemplo de los barbitúricos, bosentano, carbamazepina, felbamato, modafinilo, oscarbazepina, fenitoina, primidona, rifabutina, rifampicina y topiramato, así como de los medicamentos que contienen hierba de san Juan (Hypericum perforatum).
Una inducción enzimática puede observarse a los pocos días y puede perdurar durante por lo menos 4 semanas o más después de la suspensión de estos medicamentos. A las mujeres que, a corto plazo, siguen tratamientos con estos medicamentos, se les recomienda el uso adicional y pasajero de algún método anticonceptivo no hormonal además del AHC, o elegir otro tipo de contracepción. Se aconseja el uso del método anticonceptivo de barrera durante el tiempo en que se toman simultáneamente ambos medicamentos, así como por los siguientes 28 días después de la suspensión. Si el uso simultáneo de un inductor enzimático se prolonga después de la terminación del empaque del AHC actual, se recomienda empezar de inmediato con el siguiente empaque del AHC, sin respetar el habitual intervalo de descanso. En este caso no hay que esperar la hemorragia por deprivación antes del final del segundo empaque. Si durante el intervalo de descanso, al final del segundo empaque, no sobreviene la hemorragia por deprivación, hay que descartar un embarazo, antes de continuar con el uso de un siguiente empaque.
En tratamientos a largo plazo con estos medicamentos que causan inducción enzimática en el hígado, se sugiere el uso de otros métodos anticonceptivos alternativos.
Además se sabe que diferentes inhibidores de la proteasa del VIH y del VHC, así como de la transcriptasa inversa no nucleosídica (INNTI), pueden causar una disminución o un aumento de las concentraciones de estrógenos o gestágenos en plasma. En algunos casos, estas alteraciones pueden ser clínicamente relevantes.
Los inhibidores de la proteasa como el ritonavir o el nelfinavir (y sus combinaciones) son bien conocidos como fuertes inhibidores de CYO3A4, sin embargo, si se toman al mismo tiempo que hormonas esteroides, pueden presentar características de inductor enzimático y de este modo provocar una reducción en la concentración plasmática de estrógenos y gestágenos.
Los inhibidores enzimáticos: Los inhibidores potentes y moderados de CYP3A4, como los antimicóticos asólicos (p.ej. itraconazol, voriconazol, fluconazol), antibióticos macrólidos (por ejemplo, claritromicina, eritromicina), dilitiazem, verapamilo y el jugo de toronja pueden elevar las concentraciones plasmáticas de estrógenos y/o gestágenos y provocar en consecuencia, más efectos secundarios indeseados.
Las dosis de 60 hasta 120 mg/diarios de etoricoxib causaron un aumento de las concentraciones plasmáticas de etinilestradiol del orden de 1.4 – 1.6 veces, tomando al mismo tiempo un anticonceptivo hormonal combinado de 0.035 mg de etinilestradiol. Se desconoce la relevancia clínica de estas alteraciones.
También la atorvastatina y la rosuvastatina, inhibidores de la HMG-CoA reductasa, pueden elevar las concentraciones plasmáticas de las hormonas sexuales (respectivamente alrededor de 20-30% de aumento del ABC de componentes de estrógeno y gestagéno) y eventualmente provocar en consecuencia, más efectos secundarios indeseados.
La interferencia con la circulación enterohepática: Con el uso simultáneo y a corto plazo (hasta por 10 días) de antibióticos, que no presentan interacción con el sistema enzimático de CYP3A4, no hay interacciones farmacocinéticas. No obstante, al asesorar a la paciente hay que tomar en cuenta que eventualmente la enfermedad subyacente (p.ej. enfermedades de transmisión sexual), para la que se recetó el antibiótico, puede apuntar al uso adicional de un método anticonceptivo de barrera.
No existen suficientes datos sobre posibles interacciones del uso simultáneo y a largo plazo de antibióticos (p.ej. en caso de osteomielitis o borreliosis). Si se quiere evitar un embarazo a toda costa, se recomienda el uso adicional de un método anticonceptivo de barrera durante el tratamiento con antibióticos y hasta por 7 días después de la suspensión.
Si durante el tratamiento con antibióticos aparecen diarreas y/o vómito, se recomienda también tomar en cuenta las indicaciones del capítulo sobre “Indicaciones en caso de trastornos gastrointestinales” del apartado “Posología/Uso”.
La influencia de los anticonceptivos hormonales en la farmacocinética de otros medicamentos: Los anticonceptivos hormonales pueden influir en la farmacocinética de ciertos medicamentos a través de diversos mecanismos de interacción. Pueden inhibir las enzimas hepáticas microsomales o inducir la conjugación hepática, principalmente la glucuronidación. Las concentraciones plasmáticas y las concentraciones en tejidos de otros medicamentos pueden verse respectivamente elevadas (p.ej. con ciclosporina) o disminuidas (p.ej. con lamotrigina, véase más adelante). Además pueden incidir también en la acción farmacológica de ciertas sustancias de las siguientes clases de medicamentos: Analgésicos, antidepresivos, antidiabéticos, medicamentos antimalaria, algunas benzodiazepinas, algunos inhibidores de las betalactamasas, corticoesteroides y anticoagulantes orales. No en todos los casos son clínicamente relevantes las alteraciones en las concentraciones plasmáticas, que resultan de estas interacciones.
In vitro, el etinilestradiol mostró una inhibición de la CYP1A1, la CYP1A2, la CYP2C19, las CYP3A4/5 y la CYP2C8. En estudios clínicos, el uso de un anticonceptivo hormonal con etinilestradiol condujo a un aumento moderado (p.ej. melatonina y tizanidina), respectivamente ligero (p.ej. teofilina), de las concentraciones plasmáticas de sustratos de CYP1A2, así como a un aumento ligero o nulo de las concentraciones plasmáticas de sustratos de CYP3A4 (p.ej. midazolam).
La lamotrigina: Un estudio de posibles interacciones entre el antiepiléptico lamotrigina y un anticonceptivo oral combinado (0.03 mg de etinilestradiol/0.15 mg de levonorgestrel) mostró un aumento clínicamente relevante de la depuración de lamotrigina con un significativo descenso de su concentración plasmática, si estos medicamentos se tomaban simultáneamente. Esto puede provocar un declive en el control de las convulsiones. Se desconoce en qué medida estos resultados son transferibles a otros anticonceptivos combinados con otros componentes gestagénicos y/o con otras dosis de estrógenos. No obstante, se puede suponer que estos preparados exhiben un potencial de interacción comparable.
Si una paciente que toma lamotrigina empieza con el uso de MICROGYNON®, puede ser necesaria una adaptación de la dosis del antiepiléptico, dándosele al principio del tratamiento un seguimiento muy cercano a la concentración de lamotrigina. En este caso es muy importante tomar en cuenta que puede presentarse un aumento muy considerable de la concentración de lamotrigina (inclusive a rangos tóxicos) al suspender el anticonceptivo hormonal (así como también eventualmente durante los intervalos de descanso de 7 días).
Embarazo/Lactancia: La toma de MICROGYNON® está contraindicada durante el embarazo. Antes del inicio del uso de este medicamento es necesario descartar un embarazo. En caso de que durante el tratamiento se presente o se sospeche un embarazo, hay que interrumpir de inmediato la toma del medicamento y consultar al médico.
Hay advertencias de posibles riesgos fetales, basados en investigaciones experimentales en animales (véanse “Los datos preclínicos”). La mayoría de los estudios epidemiológicos realizados hasta hoy no han arrojado indicios claros de ser embriotóxicos o de tener efectos teratogénicos por el uso accidental de combinaciones de estrógenos y progestágenos durante el embarazo.
El medicamento no debe ser usado durante la lactancia, ya que reduce la producción de leche y puede alterar la calidad de la leche. Además es posible encontrar rastros de la sustancia activa en la leche. De ser posible, se recomienda utilizar métodos anticonceptivos no hormonales hasta el completo destete del bebé.
En relación al riesgo de eventos tromboembólicos postparto en la madre, véanse las “Advertencias y Precauciones”.
ADVERTENCIAS Y PRECAUCIONES: El uso de un AHC aumenta el riesgo de enfermedad tromboembólica venosa (ETV) y de tromboembolismo arterial (TEA) en comparación con la no utilización. Las advertencias y precauciones descritas a continuación deben ser verificadas antes de cada prescripción (véanse Riesgos de Enfermedades tromboembólicas venosas [ETV] y Riesgos de tromboembolismo arterial [TEA]. Es importante dar a la paciente informaciones acerca de los eventos tromboembólicos venosos y arteriales, sobre todo sobre los posibles síntomas de ETV y TEA y los factores de riesgo vasculares conocidos, así como sobre lo que se debe hacer en caso de sospecha de trombosis (véanse Síntomas de una ETV [trombosis venosa profunda y embolia pulmonar] y Síntomas de una TEA).
Los beneficios del uso de un AHC como MICROGYNON® debe someterse a una valoración en relación a las enfermedades y riesgos enumerados a continuación – considerando el grado de severidad de cada uno o la suma de varios factores - y discutirse con cada paciente, antes de decidirse por el uso de un anticonceptivo hormonal (véanse también las Contraindicaciones). También hay que recomendar a la paciente la lectura cuidadosa de la información adjunta en el empaque y seguir las recomendaciones que incluye.
Examen clínico: Antes del inicio o reinicio del uso de un AHC como MICROGYNON®, es necesario realizar una anamnesis personal y familiar cuidadosa, así como un examen general y una exploración ginecológica minuciosa, a la luz de las “Contraindicaciones” y de las “Advertencias y Precauciones”, para poder diagnosticar eventuales enfermedades que necesitan tratamiento así como sus factores de riesgo y poder descartar un embarazo. Este examen y exploración incluyen en general la presión sanguínea, glándulas mamarias, abdomen, órganos pélvicos (incluyendo una citología cervical) y estudios de laboratorio relevantes.
Durante toda la duración del uso de un AHC es indispensable repetir estos exámenes a intervalos regulares, aunque la frecuencia y el tipo de análisis dependerán de cada usuaria. Durante estos controles es muy importante verificar cada vez las contraindicaciones (p.ej. un ataque isquémico transitorio) y los factores de riesgo (p.ej. anamnesis familiar de trombosis venosa o arterial, véanse Factores de riesgo de una ETV y Factores de riesgo de una TEA), ya que es factible que éstos aparezcan por primera vez durante el uso de un AHC.
También es importante aclarar que los AHC no ofrecen ningún tipo de protección contra infecciones de VIH (SIDA) ni de otras enfermedades de transmisión sexual.
Motivos para la suspensión inmediata: La usuaria debe saber que, en caso de que se presentaran una o varias de las contraindicaciones arriba mencionadas, así como ante la presencia de alguna de las situaciones descritas a continuación, debe consultar a un médico de urgencia, quien tomará la decisión sobre la eventual continuación con el uso de los AHC:
• Cefalea migrañosa que se presenta por primera vez o exacerbada, o cefalea que se presenta más frecuentemente e inusualmente severa;
• Trastornos repentinos de la vista, la audición, el habla o de algún otro sentido;
• Primeros signos de eventos tromboembólicos (véanse Síntomas de una ETV [trombosis pulmonar profunda y embolia pulmonar] y Síntomas de una TEA);
• Cirugía programada (por lo menos 4 semanas antes) e inmovilización (p.ej. después de un accidente o de una cirugía);
• Aumento significativo de la presión arterial (en mediciones reiteradas);
• Aparición de ictericia, hepatitis, prurito generalizado;
• Intensos dolores del abdomen superior o hepatomegalia;
• Embarazo o sospecha de embarazo.
Riesgos de una enfermedad tromboembólica venosa (ETV): El uso de cualquier AHC aumenta el riesgo de ETV en comparación con el no uso. Los medicamentos que contienen levonorgestrel, norgestimato o noretisterona, conllevan un riesgo mínimo de una ETV.
La decisión de prescribir el medicamento debe tomarse exclusivamente después de una entrevista con la paciente, tras la cual se pueda garantizar que comprende lo siguiente:
• El riesgo de una ETV que conlleva el uso de MICROGYNON®.
• De qué manera influyen en este riesgo sus propios factores de riesgo personales.
• Que el máximo aumento del riesgo de una ETV ocurre en el primer año de uso (sobretodo durante los primeros 3 meses).
• Que los datos existentes indican que este riesgo aumentado prevalece tanto en el caso del primer uso de un AHC, como también en el caso de una reutilización del mismo o de otro AHC (después de un intervalo de mínimo 4 semanas o más tiempo de descanso).
• Que MICROGYNON® es un medicamento. En caso de un accidente o de una intervención quirúrgica, el médico tratante debe ser informado sobre el uso de MICROGYNON®.
En promedio 2 de cada 10’000 mujeres, que no utilizan ningún AHC y que no están embarazadas, sufren una ETV en el transcurso de un año. El riesgo en ciertas mujeres puede aumentar considerablemente, dependiendo de los propios factores de riesgo subyacentes (véase abajo).
En base a los datos epidemiológicos existentes, se estima que en el transcurso de un año, 5-7 de 10’000 mujeres que utilizan un AHC que contiene levonorgestrel, pueden sufrir una ETV.
El número de casos de una ETV al año, con uso de un AHC que contiene levonorgestrel, es menor al esperado durante un embarazo o en fase postparto.
El 1-2% de los casos de una ETV cursan con un desenlace fatal.
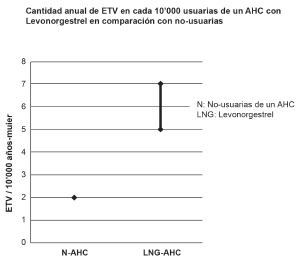
En casos sumamente excepcionales de usuarias de algún AHC, se han reportado trombosis venosas en regiones alejadas de las extremidades, p.ej. trombosis del seno venoso cerebral o trombosis en venas hepáticas, mesentéricas, renales o retinales.
Factores de riesgo de una ETV: El riesgo de complicaciones tromboembólicas venosas puede aumentar sustancialmente en usuarias de algún AHC, si además preexisten factores de riesgo subyacentes en la usuaria, y máxime si se trata de múltiples factores de riesgo simultáneos (véase tabla). Esto debe ser considerado sobre todo al ponderar el riesgo-beneficio del uso de algún AHC, ya que el riesgo de eventos tromboembólicos venosos puede aumentar exponencialmente cuando hay presencia de una combinación de factores de riesgo predisponentes. En este caso, los riesgos totales de una ETV deben ser tomados en cuenta. MICROGYNON® está contraindicada en una mujer, si coexisten simultáneamente múltiples factores que representan un riesgo importante de trombosis venosa.
|
Tabla: Factores de riesgo de una ETV |
|
|
Factores de riesgo |
Observaciones |
|
Obesidad (índice de masa corporal (IMC) superior a 30 kg/m2) |
El riesgo aumenta notoriamente a mayor IMC. Particularmente relevante, si existen además otros factores de riesgo predisponentes. |
|
Inmovilización prolongada, cirugías mayores, toda intervención en las piernas o en la pelvis, neurocirugías o traumatismos severos.
|
En estos casos se recomienda suspender el uso de tabletas/de las grageas/del parche/del anillo (si se trata de una cirugía programada, al menos cuatro semanas antes) y reanudarlo cuando menos dos semanas después del restablecimiento total de la movilidad. Según el caso, se recomienda el uso de otro método anticonceptivo para evitar un embarazo no deseado. Hay que ponderar la utilidad de recetar medicamentos de profilaxis antitrombótica, si MICROGYNON® no se suspendió con anticipación. |
|
Una anamnesis familiar positiva (toda tromboembolia venosa en hermanos o padres, máxime durante la juventud, es decir en menores de 50 años). |
Si hay sospecha de una predisposición genética, la paciente debe ser canalizada a una asesoría con un especialista, antes de tomar la decisión de usar MICROGYNON®. Si los exámenes arrojan como resultado una trombofilia, el uso de MICROGYNON® está contraindicado. |
|
Otras enfermedades asociadas al riesgo aumentado de una ETV |
Lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedades inflamatorias intestinales crónicas (enfermedad de Crohn o colitis ulcerosa), anemia de células falciformes, enfermedades malignas. |
|
Edad |
Sobre todo después de los 35 años. |
Advertencia: Una inmovilización pasajera, como por ejemplo un viaje en avión de una duración mayor a 4 horas, también puede representar un factor de riesgo para una ETV, particularmente en pacientes con presencia de otros factores de riesgo.
No hay consenso sobre el posible rol que juegan las várices y la tromboflebitis superficial en relación al inicio o evolución de una trombosis venosa.
Hay que considerar que el riesgo de eventos tromboembólicos aumenta después de un parto. Hay datos que indican que el riesgo de trombosis puede estar aumentado hasta por 12 semanas después del alumbramiento.
Síntomas de una ETV (trombosis venosa profunda y embolia pulmonar): Hay que recomendar a la paciente que en caso de la aparición de uno o varios de los siguientes síntomas, es necesario buscar ayuda médica de urgencia e informar sobre el uso de MICROGYNON® al personal médico.
• Los síntomas de una trombosis venosa profunda en la pierna pueden ser:
— Hinchazón unilateral en una pierna o a lo largo de una vena de la pierna;
— Sensación de tirantez o de dolor en una pierna, aunque sólo sea perceptible al estar de pie o al caminar;
— Hipertermia, enrojecimiento o cambio de color de la pierna respectiva.
• Los síntomas de una embolia pulmonar pueden ser:
— Disnea repentina e inexplicable, hiperventilación o dificultad respiratoria; intolerancia al esfuerzo;
— Aparición espontánea de tos, eventualmente con esputo sanguinolento;
— Dolor repentino en la cavidad torácica, que puede aumentar al inhalar profundamente;
— Gran estupor, mareo o ansiedad;
— Taquicardia o arritmia.
Algunos de estos síntomas (p.ej. disnea o tos) no son específicos y pueden malinterpretarse como comunes o poco graves (p.ej. infecciones de las vías respiratorias).
Riesgos de una tromboembolia arterial (TEA): Existen algunos estudios epidemiológicos que también han relacionado el uso de anticonceptivos hormonales con un riesgo aumentado de eventos tromboembólicos arteriales (como infarto de miocardio, infarto cerebral o ataques isquémicos transitorios). Antes de prescribir MICROGYNON®, es necesario informar a la paciente sobre este riesgo, así como darle una explicación sobre cómo sus propios factores de riesgo individuales subyacentes, pueden eventualmente aumentar aún más este riesgo.
Rara vez se han reportado trombosis también en otros vasos sanguíneos en usuarias de algún AHC (p.ej. arterias hepáticas, mesentéricas, renales o retinales).
Factores de riesgo de una TEA: Existe un riesgo aumentado de accidente cerebrovascular u otras complicaciones tromboembólicas arteriales en usuarias de un AHC, sobretodo en mujeres con factores de riesgo subyacentes para estas enfermedades (véase tabla). Esto debe ser considerado sobre todo al ponderar el riesgo-beneficio de su uso, ya que el riesgo de eventos tromboembólicos arteriales puede aumentar exponencialmente cuando hay presencia de una combinación de factores de riesgo predisponentes. En este caso, los riesgos totales de una TEA deben ser tomados en cuenta. En pacientes con un alto riesgo de una TEA, por la presencia de factores de riesgo importantes o múltiples, MICROGYNON® está contraindicada.
|
Tabla: Factores de riesgo de una TEA |
|
|
Factores de riesgo |
Observaciones |
|
Edad |
Sobre todo después de los 35 años de edad |
|
Tabaquismo |
A las mujeres que desean utilizar un AHC como MICROGYNON®, hay que recomendarles no fumar. A las mujeres mayores de 35 años, que todavía fuman, es imperativo recomendarles el uso de otro método anticonceptivo. |
|
Hipertensión arterial |
|
|
Diabetes mellitus |
En pacientes diabéticas que ya presentan complicaciones de los vasos sanguíneos, está contraindicado el uso de un AHC. |
|
Dislipoproteinemia |
|
|
Enfermedades de las válvulas del corazón |
|
|
Fibrilación auricular |
|
|
Obesidad (índice de masa corporal superior a 30 kg/m2) |
El riesgo aumenta notoriamente a mayor IMC. Particularmente relevante, si existen además otros factores de riesgo predisponentes. |
|
Una anamnesis familiar positiva (toda tromboembolia arterial en hermanos o padres, máxime durante la juventud, es decir en menores de 50 años). |
Si hay sospecha de una predisposición genética, la paciente debe ser canalizada a una asesoría con un especialista, antes de tomar la decisión de usar MICROGYNON®. Si los exámenes arrojan como resultado una trombofilia, el uso de MICROGYNON® está contraindicado. |
|
Migraña |
Un aumento en la frecuencia o en la severidad de una migraña durante el uso de MICROGYNON® puede ser un síntoma prodrómico de un accidente cerebrovascular y motivo suficiente para su interrupción inmediata. |
|
Otras enfermedades asociadas a un riesgo aumentado de una TEA |
Hiperhomocisteinemia, lupus eritematoso sistémico, anemia de células falciformes, enfermedades malignas. |
Síntomas de una TEA: Hay que recomendar a la paciente que en caso de la aparición de uno o varios de los siguientes síntomas, es necesario buscar ayuda médica de urgencia e informar sobre el uso de MICROGYNON® al personal médico.
• Los síntomas de un accidente cerebrovascular pueden ser:
— Sordera repentina o debilidad de la cara, de un brazo o de una pierna, sobre todo de un lado del cuerpo;
— Confusión repentina;
— Dificultad para hablar o entender;
— Trastornos de la vista repentinos en uno o ambos ojos;
— Repentinos trastornos para caminar;
— Mareo;
— Trastornos del equilibrio o de la coordinación;
— Repentina cefalea severa o prolongada, de origen desconocido;
— Pérdida de la conciencia o desvanecimiento con o sin convulsiones.
• Los síntomas de un infarto de miocardio pueden ser:
— Dolores, malestar, sensación de tensión, sensación de pesadez, sensación de opresión o de tirantez en el pecho, en el brazo o atrás del esternón;
— Molestias que irradian hacia la espalda, mandíbula, cuello, brazo o estómago;
— Sensación de pesadez, molestias estomacales o arcadas;
— Sudoración, náusea, vómito o mareo;
— Debilidad extrema, ansiedad o disnea;
— Taquicardia o arritmia.
• Otros síntomas de una oclusión vascular pueden ser:
— Dolor repentino, hinchazón o ligera cianosis de una extremidad;
— Abdomen agudo.
Sospecha de una predisposición congénita o adquirida a complicaciones tromboembólicas: Ante la sospecha de una predisposición congénita o adquirida a complicaciones tromboembólicas, es necesario que un especialista haga una clarificación fisiológica de los factores de coagulación y que, según el caso, ordene una determinación de ciertos parámetros hemostáticos.
Enfermedades tumorales: En algunos estudios epidemiológicos se determinó un riesgo aumentado de carcinoma de cérvix debido al uso prolongado de un AHC (> 5 años). Sin embargo, se sigue cuestionando qué tanto este resultado es influenciado por otros factores como una infección por diversos virus de papiloma humano (VPH) (principal factor de riesgo), la frecuencia de cribados cervicales o el comportamiento sexual.
Un amplio análisis de 54 estudios epidemiológicos dio como resultado que el riesgo relativo (RR) de un diagnóstico de carcinoma de mama aumenta mínimamente (RR=1.24) en mujeres que han utilizado un AHC. Al dejar de tomar el AHC, el riesgo disminuye persistentemente hasta desaparecer por completo después de 10 años. Debido a que los carcinomas de mama son raros antes de los 40 años, en mujeres que usan un AHC o que lo han estado usando hasta hace poco tiempo, el número adicional de carcinomas mamarios diagnosticados es bajo en comparación con el riesgo total de carcinoma mamario. Estos estudios no ofrecen indicios claros sobre la causalidad. El riesgo aumentado observado puede deberse a un diagnóstico temprano en usuarias de un AHC como también a efectos biológicos de los AHC o a ambos factores juntos. Los carcinomas de mama en mujeres que habían usado un AHC, presentaron la tendencia a estar menos avanzados al momento del diagnóstico, que los de las mujeres que nunca han utilizado un AHC.
En algunos casos excepcionales se han observado en el hígado alteraciones benignas después del uso de principios activos hormonales como los que contiene MICROGYNON®, y aún más excepcionalmente malignas, entre cuyas complicaciones que ponen en peligro la vida se encuentran las hemorragias intraabdominales. En caso de fuertes molestias del abdomen superior, una hepatomegalia o signos de hemorragia intraabdominal, se recomienda incluir la posibilidad de un diagnóstico diferencial de tumor hepático.
Precauciones suplementarias: Las mujeres que usan un anticonceptivo hormonal, no deben ser tratadas al mismo tiempo con preparados a base de hierba de San Juan (hipérico), debido a que la acción anticonceptiva puede verse comprometida. Existen reportes sobre sangrados intermenstruales y casos aislados de embarazos no deseados (véanse también las “Interacciones”).
En mujeres con hipertrigliceridemia presente o familiar, hay que considerar un posible riesgo aumentado de pancreatitis con el uso de un AHC.
A pesar de que con el uso de un AHC frecuentemente se reporta un ligero aumento de la presión sanguínea, son escasos los valores de presión sanguínea aumentados clínicamente relevantes. Si en cambio, durante el uso de un AHC, se presenta un aumento clínicamente relevante de la presión sanguínea (en mediciones reiteradas), se recomienda interrumpir el mismo. En ciertos casos puede valorarse si está indicado retomar el uso del AHC cuando los valores de presión sanguínea (bajo tratamiento) se hayan normalizado.
Con el uso de un AHC se ha reportado una tolerancia a la glucosa disminuida. Las mujeres diabéticas con tolerancia a la glucosa disminuida que usan un AHC deben estar bajo estrecha vigilancia médica, en especial durante el primer mes. Un ajuste del tratamiento antidiabético generalmente no es necesario.
Los trastornos agudos o crónicos de la función hepática pueden requerir la interrupción del uso de un AHC, hasta que los valores de la función hepática se hayan normalizado.
Si hay recurrencia de una ictericia colestásica, que haya aparecido por primera vez durante un embarazo o durante el uso previo de esteroides sexuales, hay que suspender los AHC.
Los estrógenos pueden aumentar la litogénesis biliar. Existen reportes sobre colelitiasis y otras enfermedades biliares (p.ej. colecistitis) relacionadas con el uso de anticonceptivos hormonales.
En mujeres con angioedema congénito y/o adquirido, los estrógenos exógenos pueden inducir o empeorar los síntomas de angioedema.
Las siguientes enfermedades pueden aparecer tanto durante el embarazo como también durante el uso de un AHC, o verse afectadas negativamente, aunque la información disponible no permite sacar conclusiones definitivas sobre la relación causal con el uso de un AHC: Ictericia colestásica y/o prurito; colestiasis; porfiria, lupus eritematoso sistémico; síndrome urémico hemolítico; corea menor; herpes gestacional; hipoacusia por otoesclerosis. El uso de un AHC también se ha asociado a la aparición de la enfermedad de Crohn y de colitis ulcerosa.
Ocasionalmente, el uso de un AHC puede provocar en mujeres con predisposición, la aparición de un cloasma, que aumenta con la radiación solar intensa. Las mujeres con esta tendencia, no deberían exponerse a la radiación UV.
Está comprobado, que el uso regular de ácido fólico antes y durante el embarazo ayuda a evitar defectos del tubo neural (espina bífida, anencefalia). Por lo mismo se recomienda que todas las mujeres que interrumpan la anticoncepción hormonal porque se quieren o pueden embarazar, consuman una alimentación rica en ácido fólico y adicionalmente tomen durante todo este lapso 0.4 mg de ácido fólico al día (p.ej. en forma de un preparado multivitamínico).
Cada gragea de MICROGYNON® contiene 33 mg de lactosa por gragea. Las pacientes con una rara intolerancia congénita a la galactosa, insuficiencia de lactasa propia de los lapones o problemas de absorción de glucosa o galactosa, que siguen una dieta libre de lactosa, deben considerar estas cantidades.
SOBREDOSIS: No existen datos sobre efectos graves causados por una sobredosis. Los síntomas de una sobredosis son: Naúseas, vómito y ligeros sangrados vaginales en adolescentes. El tratamiento eventual debe ser sintomático.
INDICACIONES ADICIONALES:
Incidencia en métodos diagnósticos: Los esteroides anticonceptivos pueden alterar los resultados de ciertos estudios de laboratorio, como parámetros bioquímicos del hígado, de la tiroides, de la función de las glándulas suprarrenales y de los riñones, las concentraciones plasmáticas de proteínas transportadoras y las fracciones lipídicas y lipoproteínicas, parámetros del metabolismo de los glúcidos, así como de coagulación y fibrinólisis. Estas alteraciones generalmente se mueven dentro de los respectivos rangos normales.
Vida útil: 24 meses.
El medicamento debe usarse únicamente hasta la fecha de expiración señalada en el empaque.
Indicaciones para su conservación: No se exponga a temperaturas superiores a 30 °C.
RUC No. 20100096341
VENTA BAJO RECETA MÉDICA.
SmPC Suiza_CCDS 13_Revisión Octubre 2015
Fabricado por:
Schering do Brasil Química e Farmacéutica Ltda
Brasil
Importado por:
BAYER S.A. PERÚ
Av. Paseo de la República 3074 Piso 10,
San Isidro, Lima 27