
MEGEX-I
MEGESTROL
Suspensión oral
Frasco de polietileno de alta densidad , 5,6,8,10 ml
Frasco de polietileno de alta densidad , 12,15,17 ml
Frasco de polietileno de alta densidad , 18,20,30 ml
Frasco de polietileno de alta densidad , 40,50,60 ml
Frasco de polietileno de alta densidad , 70,80,90 ml
Frasco de polietileno de alta densidad , 100,120 ml
Frasco de polietileno de alta densidad , 150,160 ml
Frasco de polietileno de alta densidad , 180,200 ml
Frasco de polietileno de alta densidad , 220,230 ml
Frasco de polietileno de alta densidad , 240,250 ml
Frasco de polietileno de alta densidad , 300,350 ml
Frasco de polietileno de alta densidad , 400,450 ml
Frasco de polietileno de alta densidad , 500 ml
Sachets , 5,10,15 Mililitros
Sachets , 20,25,30 Mililitros
Sachets , 35,50,60 Mililitros
Sachets , 100,120 Mililitros
Caja , Blíster de PVC aluminio , 2,4,6,8 Unidades
Caja , Blíster de PVC aluminio , 10,12,14 Unidades
Caja , Blíster de PVC aluminio , 20,30,40 Unidades
Caja , Blíster de PVC aluminio , 50,60,70 Unidades
Caja , Blíster de PVC aluminio , 80,90,100 Unidades
Suspensión oral , 4000/100 mg/ml
1 Frasco(s), 240 ml, 40 mg/ml
1 Sobres blíster, 20 ml, 40 mg/ml
MANIPULACIÓN ESPECIAL:
Datos sobre el riesgo de la salud: No hay valores umbral-límite establecidos por OSHA, NIOSH, o ACGIH.
La exposición o “sobredosis” a niveles que se aproximan a los niveles de dosis recomendados puede generar efectos secundarios como los descritos anteriormente (ver Advertencias y Reacciones adversas).
Las mujeres con probabilidad de embarazo deben evitar tal exposición.
INDICACIONES Y USO:
MEGEX-I Suspensión oral está indicado para el tratamiento de la anorexia, caquexia o una inexplicable pérdida de peso significativa, en pacientes con un diagnóstico del síndrome de inmunodeficiencia adquirida (SIDA).
Cualquier duda o aclaración sobre el uso de MEGEX-I Suspensión oral, consulte con su médico o farmacéutico.
CONTRAINDICACIONES:
Antecedentes de hipersensibilidad al acetato de megestrol o a cualquier componente de la formulación. Sospecha o conocimiento de embarazo.
CONDUCCIÓN Y USO DE MÁQUINAS:
La influencia de MEGEX-I Suspensión oral sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
REACCIONES ADVERSAS:
Eventos clínicos adversos: Reacciones adversas, las cuales ocurrieron por lo menos en un 5% de los pacientes en cualquier rama en los dos ensayos clínicos sobre eficacia y en el ensayo abierto, son anotados debajo para el tratamiento del grupo. Todos los pacientes anotados tuvieron al menos una visita durante las 12 semanas del estudio.
Estos efectos adversos deberían ser considerados por los médicos, cuando prescriben MEGEX-I Suspensión oral.
|
Reacciones adversas % de Reportes de Pacientes |
|||||||
|
Acetato de Megestrol mg/día Nº de pacientes |
Ensayo 1 (N=236) |
Ensayo 2 (N=87) |
Ensayo abierto |
||||
|
Placebo 0 (N=34) |
100 (N=68) |
400 (N=69) |
800 (N=65) |
Placebo 0 (N=38) |
800 (N=49) |
1200 (N=176) |
|
|
Diarrea Impotencia Prurito Flatulencia Hipertensión Astenia Insomnio Náusea Anemia Fiebre Disminución de la libido Dispepsia Hiperglicemia Cefalea Dolor Vómitos Neumonía Frecuencia urinaria |
15 3 9 9 0 3 0 9 6 3 3 0 3 6 6 9 6 0 |
13 4 9 0 0 2 3 4 3 6 4 0 0 10 0 3 2 0 |
8 6 4 1 0 3 4 0 3 4 0 3 6 1 0 0 0 1 |
15 14 12 9 8 6 6 5 5 5 5 3 3 3 2 2 2 2 |
8 0 3 3 0 8 0 3 0 3 0 5 0 3 5 3 3 5 |
6 4 2 10 0 4 0 4 0 2 2 4 0 0 6 6 0 2 |
10 7 6 6 4 5 1 5 0 1 1 2 3 3 4 4 1 1 |
Los efectos adversos, que ocurrieron en 1% a 3% de todos los pacientes incluidos en los dos ensayos de eficacia clínica con al menos una visita de seguimiento durante las primeras 12 semanas del estudio, fueron enumerados debajo, por sistema corporal. Los efectos adversos que ocurrieron en menos del 1% no fueron incluidos.
No hubo diferencias significativas entre la incidencia de estos efectos en pacientes tratados con acetato de megestrol y pacientes tratados con placebo.
• Cuerpo como un todo: Dolor abdominal, dolor torácico, infección, moniliasis y sarcoma.
• Sistema cardiovascular: Cardiopatía y palpitación.
• Sistema digestivo: Constipación, sequedad de la boca, hepatomegalia, sialorrea y moniliasis oral.
• Sistema hepático linfático: Leucopenia.
• Metabólica y nutricional: Aumento LDH, edema y edema periférico.
• Sistema nervioso: Parestesias, confusión, convulsiones, depresión, neuropatia, hiperestesias, pensamiento anormal.
• Sistema respiratorio: Disnea, tos, faringitis y enfermedad pulmonar.
• Piel y anexos: Alopecia, herpes, prurito, erupción vesiculobullosa, sudor y enfermedades de la piel.
• Sentidos especiales: Ambliopía.
• Sistema urogenital: Albuminuria, incontinencia urinaria, infecciones del tracto urinario, ginecomastia.
Posmercadeo: Los informes de postmercadeo asociados con la Suspensión oral de MEGEX-I incluyen fenómeno tromboembólico, incluyendo tromboflebitis y embolia pulmonar, así como intolerancia a la glucosa (ver Advertencias y precauciones).
ADVERTENCIAS:
El acetato de megestrol puede causar daño fetal cuando se administra a una mujer embarazada. (Para datos en animales sobre el efecto fetal ver Precauciones: Menoscabo de la fertilidad). No hay estudios adecuados y bien controlados en la mujer embarazada.
Si esta droga es usada durante el embarazo, o si la paciente queda embarazada mientras toma o recibe esta droga, la paciente debe ser advertida de los potenciales riesgos al feto. Las mujeres potencialmente fértiles deben ser avisadas para que eviten el embarazo.
El acetato de megestrol no está indicado en el uso profiláctico para evitar pérdidas de peso (ver Precauciones: Carcinogénesis, mutagénesis y menoscabo de la fertilidad).
La actividad glucocorticoide de MEGEX-I Suspensión oral no ha sido completamente evaluada. Se han reportado casos clínicos de diabetes mellitus de nuevo comienzo, exacerbación de diabetes mellitus pre-existente y síndrome de Cushing evidentes asociados con el uso crónico de MEGEX-I. Además, se han observado casos clínicos de insuficiencia adrenal en pacientes que están recibiendo o se les está retirando la terapia crónica con MEGEX-I, en estado de estrés y en ausencia de estrés. Además, la prueba de estimulación con adrenocorticotropina (ACTH) ha revelado la aparición frecuente de supresión pituitaria-adrenal asintomática en pacientes con tratamiento crónico con MEGEX-I. Por lo tanto, la posibilidad de insuficiencia adrenal debe ser considerada en cualquier paciente que esté recibiendo o se le esté retirando la terapia crónica con MEGEX-I que presenten signos y/o síntomas sugestivos de hipoadrenalismo (esto es, hipotensión, náusea, vómitos, mareos o debilidad) bien en estado de estrés o en ausencia de estrés. La evaluación de laboratorio para la insuficiencia adrenal y la consideración del reemplazo o las dosis de ataque de un glucocorticoide de acción muy rápida son fuertemente recomendados en tales pacientes. La falla en reconocer la inhibición del eje hipotálamopituitaria-adrenal puede resultar en muerte. Finalmente, en pacientes que están recibiendo o se les está retirando la terapia crónica con MEGEX-I, debe considerarse el uso de terapia empírica con dosis de ataque de un glucocorticoide de acción muy rápida en condiciones de estrés o de enfermedad intercurrente seria (esto es, cirugía, infección).
No use MEGEX-I Suspensión oral si nota que el empaque ha sido dañado.
Manténgase fuera del alcance de los niños.
PRECAUCIONES:
General: La terapia con MEGEX-I Suspensión oral para pérdida de peso, solamente debería ser sustituida después que las causas tratables de pérdida de peso fueron vistas e indicadas.
Estas causas tratables, incluyen posibles cánceres, infecciones sistémicas, enfermedades gastrointestinales que afectan la absorción, enfermedades endócrinas y renales o enfermedades psiquiátricas.
Efectos sobre la replicación del virus SIDA no han sido determinados.
Usar con cuidado en pacientes con antecedentes de enfermedad tromboembólica.
Uso en diabéticos: Se han informado casos de agravamiento de diabetes preexistente con requerimientos incrementados de insulina asociados al uso de MEGEX-I.
Información para pacientes: Los pacientes que usan acetato de megestrol deberían recibir las siguientes instrucciones:
• Esta medicación debe ser usada bajo prescripción médica.
• Reportar a su médico o farmacéutico cualquier reacción adversa mientras se toma la medicación.
• Usar anticonceptivos mientras se toma esta medicación, si usted es una mujer capaz de quedar embarazada.
• Notificar a su médico si usted queda embarazada mientras toma esta medicación.
Interacciones de fármacos: Los estudios de farmacocinética muestran que no hay alteraciones significativas de zidovudina o rifabutín para garantizar ajuste de dosis cuando el acetato del megestrol es administrado con esas drogas. Los efectos de la zidovudina o del rifabutín en la farmacocinética del acetato de megestrol no fueron estudiados.
Toxicidad animal: El tratamiento por largo plazo con MEGEX-I puede aumentar el riesgo de infecciones respiratorias.
En un estudio de 2 años sobre toxicidad crónica carcinogenético en ratas tratadas con acetato de megestrol, se observó una tendencia hacia: aumento de la frecuencia de infecciones respiratorias; disminución del recuento linfocítico y aumento de neutrófilos.
Carcinogénesis, mutagénesis y menoscabo de la fertilidad:
• Carcinogénesis: Datos sobre carcinogénesis fueron obtenidos de estudios conducidos en perros, monos y ratas tratados con acetato de megestrol a la dosis de 53.2, 26.6 y 1.3 veces menos que la dosis propuesta (13.3 mg/kg/día) para humanos. No se usaron machos en los estudios con perros y monos. En los sabuesos hembras el acetato de megestrol (0.01, 0.1 ó 0.25 mg/kg/día) administrados por más de 7 años, indujo a tumores benignos y malignos de mama. En los monos hembra, no se encontraron tumores luego de 10 años de tratamientos con 0.01, 0.1 o 0.5 mg/kg/día de acetato de megestrol. Tumores pituitarios fueron observados en ratas hembras tratadas con 3.9 o 10 mg/kg/día de acetato de megestrol por dos años.
La relación de estos tumores en ratas y perros, a los humanos es desconocida, pero debería ser considerada en valorar el grado de beneficio/riesgo, cuando se prescribe MEGEX-I Suspensión oral y la vigilancia de pacientes con esta terapia (ver Advertencias).
• Mutagénesis: No hay datos disponibles, actualmente, sobre mutagénesis.
• Menoscabo de la fertilidad: Estudios de toxicidad prenatal/postnatal (segmento III) fueron realizados en ratas a las dosis (0.05-12.5 mg/kg), menores a las indicadas para humanos (13.3 mg/kg); en estos estudios con dosis bajas, la capacidad reproductora de las crías macho de las hembras tratadas con acetato de megestrol fue deteriorada. Resultados similares fueron obtenidos en perros. Ratas preñadas tratadas con acetato de megestrol mostraron una reducción en el peso fetal y en el número de nacidos vivos y feminización de fetos masculinos. No hay datos disponibles actualmente, sobre la reproducción masculina (espermatogénesis).
Embarazo:
• Embarazo categoría X (ver Advertencias y precauciones: Menoscabo de la fertilidad). No hay información adecuada disponible para la teratología animal a una dosis clínica relevante.
Madres lactantes: Dado los potenciales efectos adversos, sobre el recién nacido, la lactancia materna debería descontinuarse, si MEGEX-I Suspensión oral es requerida.
Uso en mujeres: Se observó hemorragia en las 10 pacientes de sexo femenino que participan en los ensayos clínicos. MEGEX-I es un derivado de la progesterona, que puede inducir sangrado vaginal en mujeres.
Uso pediátrico: No ha sido establecida la seguridad y efectividad en pacientes pediátricos.
Uso geriátrico: Los estudios clínicos de MEGEX-I Suspensión oral en el tratamiento de la anorexia, caquexia o pérdida inexplicada de peso en pacientes con SIDA no incluyeron suficiente número de pacientes mayores de 65 años que determinen que éstos pacientes responden diferente a los pacientes más jóvenes. Otros reportes clínicos no han revelado diferencia en la respuesta entre pacientes ancianos y pacientes más jóvenes. Debido a que los pacientes ancianos presentan frecuentemente disminución de la función hepática, renal o cardíaca, enfermedades concomitantes y coprescripción de otros fármacos, se debe tener precaución en la selección de la dosis, comenzando generalmente con el límite inferior del rango de dosis aprobado.
El acetato de megestrol se excreta fundamentalmente por vía renal, por ello, el riesgo de reacciones tóxicas de este principio activo puede incrementarse en pacientes con insuficiencia renal. Debido a que los pacientes ancianos son más proclives a la disminución de la función renal, se debe seleccionar cuidadosamente la dosis y monitorear dicha función.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN:
Deseche el medicamento si se encontrara vencido o si este ya fue utilizado. Se debe desechar de una manera apropiada para asegurarse de que las mascotas, los niños y otras personas no puedan consumirlos. Inutilizar el producto mezclándolo con una sustancia de sabor desagradable, tales como tierra, arena para gatos, o posos de café, colocarlo en una bolsa de plástico y desecharlo. Pregúntele a su farmacéutico cuál es la manera adecuada de desechar sus medicamentos.
POSOLOGÍA Y ADMINISTRACIÓN:
La dosis inicial recomendada para adultos de MEGEX-I Suspensión oral es 800 mg por día (20 mL/día).
Agitar bien el envase, antes de usar.
En los ensayos clínicos evaluando diferentes dosis, las dosis diarias de 400 mg y 800 mg/día resultaron clínicamente efectivas.
Una tapa plástica conteniendo marcas de 10 mL y 20 mL, se suministra para una conveniente administración.
No utilice más de la dosis indicada por su médico. De olvidar una dosis, consulte con su médico o farmacéutico.
SOBREDOSIS:
No hay efectos secundarios graves e inesperados como resultado del estudio con MEGEX-I Suspensión oral, administrado en dosis de hasta 1200 mg/día. En la experiencia postcomercialización, se han recibido informes limitados de sobredosis. Los signos y síntomas reportados en el contexto de sobredosis incluyen diarrea, náusea, dolor abdominal, dificultad para respirar, tos, marcha inestable, apatía y dolor en el pecho. No existe un antídoto específico para la sobredosis con MEGEX-I suspensión oral.
En caso de sobredosis, se deben tomar medidas de apoyo adecuadas. El acetato de megestrol no ha sido probado para dializabilidad, sin embargo, debido a su baja solubilidad, se postula que la diálisis no sería un medio eficaz para el tratamiento de la sobredosis.
DESCRIPCIÓN: MEGEX-I Suspensión oral contiene acetato de megestrol, un derivado sintético de la hormona esteroide de origen natural, progesterona. El acetato de megestrol es un sólido blanco, cristalino, químicamente nombrado como 17α-(acetiloxi)-6-metilpregna-4,6-diene-3,20-diona. Solubilidad en agua a 37 °C es 2 µg por mL, la solubilidad en plasma es de 24 µg por mL. Su peso molecular es 384.51.
La fórmula empírica es C24H32O4 y la fórmula estructural está representada como sigue:
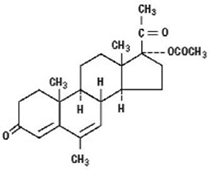
Acetato de megestrol
MEGEX-I Suspensión oral está indicado como una suspensión oral conteniendo 200 mg de acetato de megestrol por cada 5 ml.
MEGEX-I Suspensión oral contiene los siguientes excipientes: Goma de xantana, polietilenglicol 1450, aceite de ricino hidrogenado polioxil 40, acido cítrico, citrato de sodio hidratado, sacarosa, benzoato de sodio, esencia de naranja y agua purificada.
FARMACOLOGÍA CLÍNICA:
Varios investigadores han informado la mejora del apetito, característica del acetato de megestrol y su posible uso en caquexia. El mecanismo preciso por el cual el acetato de megestrol produce efectos en la anorexia y caquexias es desconocido en la actualidad.
Hay varios métodos analíticos utilizados para estimar la concentración del plasma en acetato de megestrol, incluyendo cromatografía de gas – fragmentografía de masa (CG – FM), cromatografía líquida de alta resolución (HPLC) y radioinmunoensayo (RIA). Los métodos de CG – FM y HPLC son específicos para acetato de megestrol y concentraciones de rendimiento equivalentes. El método RIA reacciona con los metabolitos del acetato de megestrol y es, por consiguiente, no específico e indica altas concentraciones que los métodos de CG – FM y HPLC. Las concentraciones del plasma son dependientes, no solo en el método utilizado, también en la inactivación intestinal y hepática del fármaco, el cual puede ser afectado por factores como la motilidad del tracto intestinal, bacterias intestinales, antibióticos administrados, peso corporal, dieta, y función hepática.
La principal vía de mayor eliminación del fármaco en humanos es la urinaria. Cuando el acetato de megestrol marcado radioactivamente fue administrado a humanos en dosis de 4 a 90 mg, la excreción urinaria dentro de los 10 días promedió de 56.5% a 78.4% (promedio 66.4%) y la excreción fecal de 7.7% al 30.3% (promedio 19.8%). La radioactividad total recuperada varió entre 83.1% y 94.7% (promedio 86.2%).
Los metabolitos del acetato de megestrol que fueron identificados en orina constituyeron un 5% a 8% de la dosis administrada. La eliminación respiratoria como dióxido de carbono marcado y grasas almacenadas pueden haber dado razón o respondido en la mínima parte de la radioactividad no encontrada en la orina y heces.
El estado plasmático firme farmacocinético del acetato de megestrol fue evaluado en 10 adultos, pacientes femeninos caquécticos con síndrome de inmunodeficiencia adquirida (SIDA) y una pérdida del peso involuntario mayor del 10% de la línea base. Los pacientes recibieron una sola dosis oral de 800 mg/día de MEGEX. Suspensión oral por 21 días. Los datos de la concentración plasmática obtenidos sobre 21 días fueron evaluados por encima de las 48 horas pasadas de la última dosis.
La concentración promedio plasmática máxima (Cmax) del acetato de megestrol fue 753 (±539) mg/mL. El área promedio debajo de la concentración tiempo–curva (AUC) fue 10476 (±7788) mg x h/mL. El valor del tiempo máximo (Tmax) fue de cinco horas. Siete de diez pacientes ganaron peso en tres semanas.
Adicionalmente, 24 adultos, asintomáticos, seropositivos SIDA, masculinos fueron tratados una vez por día con 750 mg de acetato de megestrol. El tratamiento fue administrado durante 14 días. Los valores promedios de Cmax y AUC fueron 490 (±238) ng/mL y 6779 (±3048) hr x ng/mL, respectivamente. El valor mediano de Tmax fue de 3 horas. El valor de Cmax fue de 202 (±101) ng/mL. El promedio del porcentaje del valor de fluctuación fue de 107 (±40).
El efecto de la comida sobre la biodisponibilidad de MEGEX Suspensión oral no ha sido evaluado.
CARCINOGÉNESIS, MUTAGÉNESIS Y MENOSCABO DE LA FERTILIDAD:
• Carcinogénesis: Datos sobre carcinogénesis fueron obtenidos de estudios conducidos en perros, monos y ratas tratados con acetato de megestrol a la dosis de 53.2, 26.6 y 1.3 veces menos que la dosis propuesta (13.3 mg/kg/día) para humanos. No se usaron machos en los estudios con perros y monos. En los sabuesos hembras el acetato de megestrol (0.01, 0.1 o 0.25 mg/kg/día) administrados por más de 7 años, indujo a tumores benignos y malignos de mama. En los monos hembra, no se encontraron tumores luego de 10 años de tratamientos con 0.01, 0.1 o 0.5 mg/kg/día de acetato de megestrol. Tumores pituitarios fueron observados en ratas hembras tratadas con 3.9 o 10 mg/kg/día de acetato de megestrol por dos años.
La relación de estos tumores en ratas y perros, a los humanos es desconocida, pero debería ser considerada en valorar el grado de beneficio/riesgo, cuando se prescribe MEGEX-I Suspensión oral y la vigilancia de pacientes con esta terapia (ver Advertencias).
• Mutagénesis: No hay datos disponibles, actualmente, sobre mutagénesis.
• Menoscabo de la fertilidad: Estudios de toxicidad prenatal/postnatal (segmento III) fueron realizados en ratas a las dosis (0.05-12.5 mg/kg), menores a las indicadas para humanos (13.3 mg/kg); en estos estudios con dosis bajas, la capacidad reproductora de las crías macho de las hembras tratadas con acetato de megestrol fue deteriorada. Resultados similares fueron obtenidos en perros. Ratas preñadas tratadas con acetato de megestrol mostraron una reducción en el peso fetal y en el número de nacidos vivos y feminización de fetos masculinos. No hay datos disponibles actualmente, sobre la reproducción masculina (espermatogénesis).
Embarazo:
• Embarazo categoría X (ver Advertencias y Precauciones: Menoscabo de la fertilidad). No hay información adecuada disponible para la teratología animal a una dosis clínica relevante.
Madres lactantes: Dado los potenciales efectos adversos, sobre el recién nacido, la lactancia materna debería descontinuarse, si MEGEX-I Suspensión oral es requerida.
Uso en mujeres: Se observó hemorragia en las 10 pacientes de sexo femenino que participan en los ensayos clínicos. MEGEX-I es un derivado de la progesterona, que puede inducir sangrado vaginal en mujeres.
Uso pediátrico: No ha sido establecida la seguridad y efectividad en pacientes pediátricos.
Uso geriátrico: Los estudios clínicos de MEGEX-I Suspensión oral en el tratamiento de la anorexia, caquexia o pérdida inexplicada de peso en pacientes con SIDA no incluyeron suficiente número de pacientes mayores de 65 años que determinen que éstos pacientes responden diferente a los pacientes más jóvenes. Otros reportes clínicos no han revelado diferencia en la respuesta entre pacientes ancianos y pacientes más jóvenes. Debido a que los pacientes ancianos presentan frecuentemente disminución de la función hepática, renal o cardíaca, enfermedades concomitantes y coprescripción de otros fármacos, se debe tener precaución en la selección de la dosis, comenzando generalmente con el límite inferior del rango de dosis aprobado.
El acetato de megestrol se excreta fundamentalmente por vía renal, por ello, el riesgo de reacciones tóxicas de este principio activo puede incrementarse en pacientes con insuficiencia renal. Debido a que los pacientes ancianos son más proclives a la disminución de la función renal, se debe seleccionar cuidadosamente la dosis y monitorear dicha función.
PRESENTACIÓN:
Frasco por 240 mL de suspensión oral.
Sobre por 20 mL de suspensión oral.
ALMACENAMIENTO:
Almacenar a una temperatura menor a 30 °C. Mantener herméticamente cerrado. Proteger del calor. Proteger de la luz.
TIEMPO DE VIDA ÚTIL:
2 años. La fecha de vencimiento es el último día del mes que se indica.
No usar MEGEX-I Suspensión oral pasada la fecha de expiración impresa en el envase.
Elaborado en Corea del Sur por:

Importado y distribuido en Perú por:

Av. Producción Nacional Nº 100
Urb. Industrial La Villa- Chorrillos – Lima
Telfs.: 467-6117 / 467-6122 / 467-6253
EXCIPIENTES:
Goma xantana, polietilenglicol 1450, aceite de ricino hidrogenado polioxil 40, ácido cítrico hidratado, citrato de sodio hidratado, sacarosa, benzoato de sodio, esencia de naranja, agua purificada.