
LEMTRADA
ALEMTUZUMAB
Concentrado para solución de infusión
Caja, 1 Vial(es), 1.2 ml 12/1.2 mg/ml
INSTRUCCIONES NECESARIAS Y HABITUALES PARA UNA BUENA UTILIZACIÓN EN PARTICULAR:
INDICACIONES TERAPÉUTICAS:
LEMTRADA® está indicado en pacientes adultos con esclerosis múltiple remitente recurrente (EMRR) con enfermedad activa definida por manifestaciones clínicas o detectadas por resonancia magnética (ver Acción farmacológica, Propiedades farmacodinámicas y sección Información necesaria previa a la toma de la especialidad farmacéutica Advertencias y precauciones especiales de empleo)
ACCIÓN FARMACOLÓGICA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Inmunosupresor selectivo, código ATC: L04AA34.
Mecanismo de acción: Alemtuzumab es un anticuerpo monoclonal humanizado derivado de ADN recombinante dirigido contra la glicoproteína de superficie celular CD 52 de 21-28 kD. Alemtuzumab es un anticuerpo IgG1 kappa con regiones constantes y marco de variable humana y regiones complementarias-determinantes de un anticuerpo monoclonal murino (rata). El anticuerpo tiene un peso molecular aproximado de 150 kD.
Alemtuzumab se une al CD52, un antígeno de superficie celular presente en grandes cantidades en los linfocitos T (CD3+) y B (CD19+) y, en menores cantidades, en los linfocitos citolíticos naturales (natural killer), monocitos y macrófagos. El antígeno CD52 se expresa poco o nada en los neutrófilos, células plasmáticas o células madre de la médula ósea. Alemtuzumab actúa a través de la citolisis celular dependiente de anticuerpos y la lisis mediada por el complemento tras la unión de la superficie celular con los linfocitos T y B.
No se ha elucidado por completo el mecanismo por el cual LEMTRADA® ejerce sus efectos terapéuticos en la EM. No obstante, las investigaciones sugieren efectos inmunomoduladores a través de la depleción y repoblación de linfocitos, incluyendo:
• Alteraciones en el número, las proporciones y las propiedades de algunos grupos de linfocitos tras el tratamiento.
• Aumento de la representación de grupos de linfocitos T reguladores.
• Aumento de la representación de linfocitos T y B de memoria.
• Efectos transitorios en la inmunidad innata de los componentes (es decir, neutrófilos, macrófagos y linfocitos citolíticos naturales (natural killer).
• La reducción en el nivel de células B y T circulantes por LEMTRADA® y posterior repoblación podría reducir la posibilidad de recaídas que, finalmente, retrasan la evolución de la enfermedad.
Efectos farmacodinámicos: LEMTRADA® reduce los linfocitos T y B circulantes tras cada curso de tratamiento y los valores más bajos se observan 1 mes después del curso de tratamiento (el momento más temprano tras el tratamiento en estudios de fase 3). Los linfocitos se reponen con el tiempo, la recuperación total de las células B se completa en 6 meses. Los recuentos de linfocitos CD3+ y CD4+ aumentan hacia la normalidad más lentamente, pero en general no vuelven a los niveles iniciales 12 meses después del tratamiento. En aproximadamente el 40% de los pacientes, los recuentos de linfocitos totales alcanzan el límite normal más bajo (LNB) 6 meses después de cada curso de tratamiento y aproximadamente el 80% de los pacientes alcanzan el LNB de linfocitos 12 meses después de cada curso de tratamiento.
Los neutrófilos, monocitos, eosinófilos, basófilos y linfocitos citolíticos naturales (natural killer) solo se ven afectados por LEMTRADA® de forma transitoria.
Eficacia clínica y seguridad: La seguridad y eficacia de LEMTRADA® se evaluaron en 3 ensayos clínicos comparativos directos, aleatorizados, ciegos para el evaluador, en pacientes con EMRR.
Para los estudios 1 y 2, el diseño/demografía y los resultados del estudio se muestran en la Tabla 1 y la Tabla 2 respectivamente.
|
Tabla 1: Diseño del estudio y datos iniciales para los estudios 1 y 2 |
||
|
Estudio 1 |
Estudio 2 |
|
|
Nombre del estudio |
CAMMS323 (CARE-MS I) |
CAMMS32400507 (CARE-MS II) |
|
Diseño del estudio |
||
|
Historial de la enfermedad |
Pacientes con EM activa, definida como al menos 2 recaídas en los 2 años anteriores. |
|
|
Seguimiento |
2 años |
|
|
Población del estudio |
Pacientes no tratados Previamente |
Pacientes con respuesta inadecuada al tratamiento anterior* |
|
Datos iniciales |
||
|
Media de edad (años) |
33 |
35 |
|
Duración media/mediana de la enfermedad |
2/1,6 años |
4,5/3,8 años |
|
Duración media del tratamiento de EM anterior (≥1 fármaco utilizado) |
Ninguno |
36 meses |
|
% que han recibido ≥2 tratamientos de EM anteriores |
No procede. |
28% |
|
Valor medio de EDSS al inicio |
20 |
27 |
|
* Definido como pacientes que hayan experimentado al menos 1 recaída durante el tratamiento con interferón beta o acetato de glatirámero tras haber estado en tratamiento con el medicamento durante, al menos, 6 meses. |
||
|
Tabla 2: Criterios clínicos y de RMN de los estudios 1 y 2 |
||||
|
Estudio 1 |
Estudio 2 |
|||
|
Nombre del estudio |
CAMMS323 (CARE-MS I) |
CAMMS32400507 (CARE-MS II) |
||
|
Criterios clínicos |
LEMTRADA® 12 mg (N=376) |
SC IFNB-1a (N=187) |
LEMTRADA® 12 mg (N=426) |
SC IFNB-1a (N=202) |
|
Índice de recaídas1 |
0,18 (0,13, 0,23) |
0,39 (0,29, 0,53) |
0,26 (0,21, 0,33) |
0,52 (0,41, 0,66) |
|
Cociente de tasas (95% CI) Reducción del riesgo |
0,45 (0,32 , 0,63) 54,9 ( p<0, 0 001) |
0,51 (0,3 9, 0,65) 49, 4 ( p<0, 0 001) |
||
|
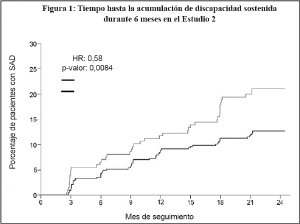
Discapacidad2 (acumulación de discapacidad sostenida [SAD] ≥6 meses1) Pacientes con SAD de 6 meses (95% CI) |
8,0% (5,7, 11,2) |
11,1% (7,3, 16,7) |
12,7% (9,9, 16,3) |
21,1% (15,9, 27,7) |
|
Cociente de riesgo (95% CI) |
0,70 (0,40, 1,23) (p=0,22) |
0,58 (0,38, 0,87) (p=0,0084) |
||
|
Pacientes sin recaídas en el Año 2 (95% CI) |
77,6% (72,9, 81,6) (p<0,0001) |
58,7% (51,1, 65,5) |
65,4% (60,6, 69,7) (p<0,0001) |
46,7% (39,5, 53,5) |
|
Cambio respecto al valor inicial en EDSS en el Año 2 Estimación (95% CI) |
-0,14 (-0,25, -0,02) (p=0,42) |
-0,14 (-0,29, 0,01) |
-0,17 (-0,29, -0,05) (p<0,0001) |
0,24 (0,07, 0,41) |
|
Criterios de RMN (0-2 años) |
||||
|
Cambio medio % en el volumen de la lesión RMN-T2 |
-9,3 (-19,6, -0,2) (p=0,31) |
-6,5 (-20,7, 2,5) |
-1,3 |
-1,2 |
|
Pacientes con lesiones T2 nuevas o más grandes a lo largo del Año 2 |
48,5% (p=0,035) |
57,6% |
46,2% |
67,9% |
|
Pacientes con lesiones realzadas con gadolinio a lo largo del Año 2 |
15,4% (p=0,001) |
27,0% |
18,5% |
34,2% |
|
Pacientes con lesiones T1 hipointensas a lo largo del Año 2 |
24,0% (p=0,055) |
31,4% |
19,9% |
38,0% |
|
Cambio medio % en la fracción parenquimal del cerebro |
-0,867 |
-1,488 |
-0,615 |
-0,810 |
|
1 Variables principales: ARR y SAD. Se declaraba que el estudio había tenido éxito si se cumplía al menos uno de las dos variables principales. 2 El tiempo transcurrido hasta el inicio del SAD (acumulación sostenida de la discapacidad) se definió como un incremento de, al menos, 1 punto en la Escala Expandida del Estado de Discapacidad (EDSS, por sus siglas en inglés) a partir de un valor inicial de EDSS ≥ 1,0 (1,5 puntos de aumento para pacientes con valor inicial de EDSS de 0) que se mantuvo durante 6 meses. |
||||
Gravedad de la recaída: En línea con el efecto en el índice de recaídas, los análisis complementarios del Estudio 1 (CAMMS323) mostraron que LEMTRADA® 12 mg/día produjo un número significativamente menor de pacientes tratados con LEMTRADA® que sufrieran recaídas graves (61% reducción, p=0,0056) y un número significativamente menor de recaídas que requirieran tratamiento con esteroides (58% reducción, p<0,0001) en comparación con IFNB-1a.
Los análisis complementarios del Estudio 2 (CAMMS32400507) mostraron que LEMTRADA® 12 mg/día produjo un número significativamente menor de pacientes tratados con LEMTRADA® que sufrieran recaídas graves (48% reducción, p=0,01216) y un número significativamente menor de recaídas que requirieran tratamiento con esteroides (56% reducción, p<0,0001) u hospitalización (55 % reducción, p=0,0045) en comparación con IFNB-1a.
Reducción mantenida de la discapacidad (RMD): El tiempo transcurrido hasta el inicio de la RMD se definió como un descenso de, al menos, un punto en la escala expandida de estado de discapacidad (EDSS) a partir de un valor inicial de EDSS ≥ 2 que se mantuvo durante 6 meses. RMD es la medida de la mejora mantenida de la discapacidad. El 29% de los pacientes tratados con LEMTRADA® alcanzaron la RMD en el estudio 2, mientras que solo el 13% de los pacientes tratados con IFNB-1a subcutáneo la alcanzaron. La diferencia era estadísticamente significativa (p=0,0002).
El Estudio 3 (fase 2 estudio CAMMS223) evaluó la seguridad y la eficacia de LEMTRADA® en pacientes con EMRR a lo largo de 5 años. Los pacientes tenían una EDSS entre 0-3,0, al menos 2 episodios clínicos de EM en los 2 años anteriores y ≥1 lesión realzada con gadolinio al inicio del estudio. Los pacientes no habían recibido tratamiento anterior para la EM. Los pacientes fueron tratados con LEMTRADA® 12 mg/día (N=108) o 24 mg/día (N=108) administrado una vez al día durante 5 días en el Mes 0 y durante 3 días en el Mes 12 o con IFNB-1a subcutáneo 44 µg (N=107) administrado 3 veces a la semana durante 3 años.
Cuarenta y seis pacientes recibieron un tercer curso de tratamiento con LEMTRADA® 12 mg/día o 24/mg día durante 3 días en el Mes 24.
A los 3 años, LEMTRADA® redujo el riesgo de SAD de 6 meses en un 76% (cociente de riesgo 0,24 [95% CI: 0,110, 0,545], p<0,0006) y redujo el ARR un 67% (cociente de tasas 0,33 [95% CI: 0,196, 0,552], p<0,0001) en comparación con IFNB-1a subcutáneo. Alemtuzumab 12 mg/día produjo unos valores de EDSS significativamente menores (mejora comparada con los datos iniciales) a lo largo de 2 años de seguimiento, en comparación con IFNB-1a (p<0,0001).
A los 5 años, LEMTRADA® redujo el riesgo de SAD 69% (cociente de riesgo 0,31 [95% CI: 0,161, 0,598], p=0,0005) y redujo el ARR un 66% (cociente de tasas 0,34 [95% CI: 0,202, 0,569], p<0,0001) en comparación con IFNB-1a subcutáneo.
En un seguimiento abierto de los ensayos clínicos con LEMTRADA®, algunos pacientes recibieron tratamiento adicional "según necesidades" con LEMTRADA® tras la evidencia documentada de una reanudación de la actividad de la EM. Los cursos adicionales de tratamiento con LEMTRADA® se administraron con 12 mg/día durante 3 días consecutivos (dosis total de 36 mg) al menos 12 meses después del curso de tratamiento anterior. Los beneficios y riesgos de >2 cursos de tratamiento no se han establecido por completo, pero los resultados sugieren que el perfil de seguridad no parece cambiar con los cursos de tratamiento adicionales. Si van a administrarse fases de tratamiento adicionales, deberán administrarse al menos 12 meses después de la fase anterior.
Inmunogenicidad: Al igual que con todas las proteínas terapéuticas, hay posibilidad de inmunogenicidad. Los datos reflejan el porcentaje de pacientes cuyos resultados se consideraron positivos para anticuerpos de alemtuzumab mediante una prueba de inmunoadsorción enzimática (ELISA) y confirmados por un ensayo de unión competitiva. Las muestras positivas se volvieron a evaluar para buscar evidencia de inhibición in vitro mediante un ensayo de citometría de flujo. Se tomaron muestras de suero a los pacientes de los ensayos clínicos controlados de EM 1, 3 y 12 meses después de cada curso de tratamiento para determinar si había anticuerpos anti-alemtuzumab. Aproximadamente el 85% de los pacientes que recibieron LEMTRADA® dieron positivo en las pruebas de anticuerpos anti-alemtuzumab durante el estudio y el 92% de estos pacientes dieron positivo también en las pruebas de anticuerpos que inhiben la fijación de LEMTRADA® in vitro. Los pacientes que desarrollaron anticuerpos anti-alemtuzumab lo hicieron a los 15 meses de la exposición inicial. No hay relación entre la presencia de anticuerpos anti-alemtuzumab o anticuerpos antialemtuzumab inhibidores y una reducción de la eficacia, un cambio en la farmacodinámica, o la aparición de reacciones adversas, incluyendo las reacciones asociadas a la infusión.
La incidencia de anticuerpos depende en gran parte de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positivos para anticuerpos (incluyendo anticuerpos inhibidores) en un ensayo puede verse influida por varios factores como la metodología del ensayo, la manipulación de las muestras, el horario de manipulación de las muestras, fármacos utilizados de forma simultánea y enfermedades subyacentes. Por estos motivos, la comparación de la incidencia de anticuerpos de LEMTRADA® con la incidencia de anticuerpos de otros productos puede ser engañosa.
Población pediátrica: La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con alemtuzumab en niños de 0 a menos de 10 años en tratamiento por esclerosis múltiple (ver Posología y forma de administración para consultar la información sobre el uso en la población pediátrica).
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con LEMTRADA® en uno o más grupos de la población pediátrica con EMRR (ver Posología y forma de administración para consultar la información sobre el uso en la población pediátrica).
Propiedades farmacocinéticas: La farmacocinética de LEMTRADA se evaluó en un total de 216 pacientes con EMRR que recibieron infusiones intravenosas de 12 mg/días o 24 mg/día durante 5 días consecutivos, seguidos de 3 días consecutivos 12 meses después del curso de tratamiento inicial. Las concentraciones en suero aumentaron con cada dosis consecutiva en los cursos de tratamiento. Las mayores concentraciones se observaron tras la última infusión de un curso. La administración de 12 mg/día provocó una Cmáx media de 3014 ng/ml el Día 5 del curso de tratamiento inicial y de 2276 ng/ml el Día 3 del segundo curso de tratamiento. La vida media de las partículas alfa se aproximó a 4-5 días y fue comparable entre cursos de tratamiento produciendo concentraciones bajas o indetectables en suero a los 30 días, aproximadamente, de cada curso de tratamiento.
Alemtuzumab es una proteína cuya ruta metabólica se espera que sea la degradación en pequeños péptidos y aminoácidos individuales por parte de enzimas proteolíticas ampliamente distribuidas. No se han realizado estudios clásicos de biotransformación.
No se pueden sacar conclusiones a partir de los datos disponibles sobre el efecto de la raza y el sexo en la farmacocinética de LEMTRADA®. La farmacocinética de LEMTRADA® no se ha estudiado en pacientes de más de 55 años.
CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 7. Infección por virus de la inmunodeficiencia humana (VIH).
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: En un análisis conjunto de estudios clínicos controlados, la población estuvo constituida por un total de 1.188 pacientes con EM remitente recurrente (EMRR) tratados con LEMTRADA® (12 mg o 24 mg) con un resultado de 2.363 pacientes-años de seguimiento de seguridad y un seguimiento medio de 24 meses.
Las reacciones adversas más importantes son autoinmunidad (PTI, trastornos de tiroides, nefropatías, citopenias), RAI e infecciones. Se describen en Información necesaria previa a la toma de la especialidad farmacéutica, Advertencias y precauciones especiales de empleo.
Las reacciones adversas más frecuentes con LEMTRADA® (en ≥20% de los pacientes) son erupción, cefalea, pirexia e infecciones del tracto respiratorio.
Tabla de las reacciones adversas: La tabla siguiente se basa en los datos de seguridad acumulados hasta 24 meses de pacientes con EMRR tratados con LEMTRADA® 12 mg/día durante 5 días consecutivos al inicio del estudio y durante 3 días consecutivos en el mes 12 del estudio. Las reacciones adversas que se dieron en un ≥0,5% de los pacientes se incluyen por grupo sistémico y según el término preferido del diccionario MedDRA. Las frecuencias se definen según la siguiente convención: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1.000 a <1/100). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad.
|
Tabla 3: Reacciones adversas en el estudio 1, 2 y 3 observadas en el ≥0,5% de los pacientes tratados con LEMTRADA® 12 mg |
|||
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Infecciones e infestaciones |
Infección del tracto respiratorio superior, infección del tracto urinario |
Infecciones del tracto respiratorio inferior, herpes zóster, gastroenteritis, herpes oral, candidiasis oral, candidiasis vulvovaginal, gripe, infección de oído |
Infección dental, herpes genital, onicomicosis |
|
Trastornos de la sangre y del sistema linfático |
Linfopenia, leucopenia |
Linfadenopatía |
Púrpura trombocitopénica inmune, trombocitopenia con disminución de hemoglobina, hematocrito disminuido |
|
Trastornos del sistema inmunológico |
Síndrome de liberación de citoquinas |
||
|
Trastornos endocrinos |
Enfermedad de Basedow, hipertiroidismo, tiroiditis autoinmune, hipotiroidismo, bocio, anticuerpos antitiroideos positivos |
||
|
Trastornos psiquiátricos |
Insomnio*, ansiedad |
Depresión |
|
|
Trastornos del sistema Nervioso |
Cefalea* |
Recaída de EM, mareo*, hipoestesia, parestesia, temblor, disgeusia* |
Alteración sensitiva, hiperestesia |
|
Trastornos oculares |
Visión borrosa |
Conjuntivitis |
|
|
Trastornos del oído y del laberinto |
Vértigo |
||
|
Trastornos cardiacos |
Taquicardia*, bradicardia, palpitaciones |
||
|
Trastornos vasculares |
Rubefacción* |
Hipotensión*, Hipertension |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea*, tos, epistaxis, dolor orofaríngeo |
Opresión en la garganta, hipo, irritación de garganta |
|
|
Trastornos Gastrointestinales |
Náusea* |
Dolor abdominal, vómitos, diarrea, dispepsia*, estomatitis |
Estreñimiento, enfermedad por reflujo gastroesofágico, hemorragia gingival, disfagia |
|
Trastornos hepatobiliares |
Aspartato aminotransferasa elevada |
||
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria*, erupción*, prurito* |
Erupción generalizada*, eritema, equimosis, alopecia, hiperhidrosis, acne |
Ampollas, sudores nocturnos |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgia, debilidad muscular, artralgia, dolor de espalda, dolor en una extremidad, espasmos musculares, cervicalgia |
||
|
Trastornos renales y urinarios |
Proteinuria, hematuria |
||
|
Trastornos del aparato reproductor y de la mama |
Menorragia, menstruación irregular |
Displasia cervical, amenorrea |
|
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia*, fatiga* |
Malestar torácico*, escalofríos*, dolor*, edema periférico, astenia, enfermedad de tipo gripal, malestar general, dolor en el lugar de infusión |
|
|
Exploraciones complementarias |
Disminución de peso |
||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Contusión |
||
Descripción de reacciones adversas seleccionadas: Los términos marcados con un asterisco (*) en la Tabla 3 incluyen reacciones adversas notificadas como Reacciones Asociadas a la Infusión. Las RAI también incluyen fibrilación auricular y anafilaxia que ocurren por debajo del corte del 0,5% para los acontecimientos relacionados (ver Información necesaria previa a la toma de la especialidad farmacéutica, Advertencias precauciones especiales de empleo).
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema Peruano de Farmacovigilancia. Si presenta alguno de los efectos adversos incluso no mencionado en este inserto, informe a su médico o farmacéutico.
EFECTOS EN LA CAPACIDAD PARA CONDUCIR Y MANEJAR MAQUINARIA PESADA:
No se han realizado estudios sobre los efectos de LEMTRADA® sobre la capacidad para conducir y utilizar máquinas.
La mayoría de pacientes experimentan RAI que se producen durante o en las 24 horas siguientes al tratamiento con LEMTRADA®. Algunas RAI (por ejemplo, mareo) podrían afectar de forma temporal a la capacidad del paciente para conducir y utilizar máquinas y se debe tener precaución hasta que se resuelvan.
INTERACCIONES MEDICAMENTOSAS Y OTRAS INTERACCIONES:
No se han realizado estudios formales de interacción medicamentosa con LEMTRADA® utilizando la dosis recomendada en pacientes con EM. En un ensayo clínico controlado con pacientes con EM tratados recientemente con interferón beta y acetato de glatirámero fue necesario interrumpir el tratamiento 28 días antes de iniciar el tratamiento con LEMTRADA®.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Carcinogénesis y mutagénesis: No se han realizado estudios para valorar el potencial carcinogénico o mutagénico de alemtuzumab.
Fertilidad y reproducción: El tratamiento con alemtuzumab intravenoso en dosis de hasta 10 mg/kg/día, administrado durante 5 días consecutivos (AUC de 7,1 veces la exposición humana en la dosis diaria recomendada) no tuvo efecto en la fertilidad ni la función reproductora en ratones transgénicos macho huCD52. El número de espermatozoides normales se vio significativamente reducido (<10%) en relación con los controles y que el porcentaje de espermatozoides anormales (cabezas separadas o sin cabeza) aumentó significativamente (hasta el 3%). No obstante, estos cambios no afectaron a la fertilidad y fueron, por tanto, considerados como no adversos. En ratones hembra con dosis de alemtuzumab intravenoso de hasta 10 mg/kg/día IV (AUC de 4,7 veces la exposición humana en la dosis diaria recomendada) durante 5 días consecutivos antes de su apareamiento con ratones salvajes macho, el promedio de cuerpos lúteos y lugares de implantación por ratón se redujo significativamente en comparación con los animales tratados con vehículo. Se observó una reducción de la ganancia de peso gestacional en relación con los controles con vehículos en ratones hembra embarazadas con dosis de 10 mg/kg/día.
En un estudio de toxicidad para la reproducción en ratones hembra embarazadas expuestas a dosis intravenosas de alemtuzumab de hasta 10 mg/kg/día (AUC 2,4 veces la exposición humana a la dosis recomendada de 12 mg/día) durante 5 días consecutivos durante la gestación, los resultados mostraron un aumento significativo en el número de madres con todos los embriones muertos o reabsorbidos, junto con una reducción simultánea del número de madres con fetos viables. No se observaron variaciones o malformaciones externas, de tejidos blandos o esqueléticos con dosis de hasta 10 mg/kg/día.
Se observaron transferencia placentaria y posible actividad farmacológica de alemtuzumab en ratones durante la gestación y tras el parto. En los estudios con ratones, se observaron alteraciones en los recuentos de linfocitos en crías expuestas a alemtuzumab durante la gestación con dosis de hasta 3 mg/kg/día durante 5 días consecutivos (AUC de 0,6 veces la exposición humana en la dosis recomendada de 12 mg/día). El desarrollo cognitivo, físico y sexual de las crías expuestas a alemtuzumab durante la lactancia no se vio afectado con dosis de hasta 10 mg/kg/día.
ADVERTENCIAS ESPECIALES:
Fertilidad, embarazo y lactancia:
Mujeres en edad fértil: Las concentraciones en suero fueron bajas o indetectables dentro de los 30 días, aproximadamente, después de cada curso de tratamiento. Por tanto, las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces cuando reciban un curso de tratamiento con LEMTRADA® y durante los 4 meses posteriores a ese curso de tratamiento.
Embarazo: Hay datos limitados relativos al uso de LEMTRADA® en mujeres embarazadas. Sólo debe administrarse LEMTRADA® durante el embarazo si los posibles beneficios justifican los riesgos potenciales para el feto.
Se sabe que la IgG humana traspasa la barrera placentaria; alemtuzumab podría traspasar también la barrera placentaria y, por tanto, suponer un riesgo para el feto. Los estudios realizados en animales han mostrado toxicidad en la reproducción (ver Identificacion de la especialidad farmacéutica, Datos preclínicos de seguridad). Se desconoce si alemtuzumab puede causar daños fetales si se administra a mujeres embarazadas o si puede afectar a la capacidad reproductora.
Las enfermedades de tiroides (ver Información necesaria previa a la toma de la especialidad farmacéutica, Advertencias y precauciones especiales de empleo) suponen un riesgo especial para las mujeres embarazadas. Si no se trata el hipotiroidismo durante el embarazo, aumenta el riesgo de aborto espontáneo y de que el feto resulte afectado con problemas como retraso mental y enanismo. En madres con la enfermedad de Graves, los anticuerpos receptores de la hormona estimulante del tiroides se pueden transmitir al feto en desarrollo y causar una enfermedad de Graves neonatal transitoria
Lactancia: Se detectó alemtuzumab en la leche y en las crías de ratones en periodo de lactancia. Se desconoce si alemtuzumab se excreta a la leche humana. No se puede excluir el riesgo para niños lactantes. Por tanto, la lactancia materna debe interrumpirse durante cada curso de tratamiento con LEMTRADA® y durante 4 meses después de la última infusión de cada curso de tratamiento. No obstante, las ventajas de la inmunidad que confiere la leche materna pueden superar los riesgos de una posible exposición del lactante a alemtuzumab.
Fertilidad: No existen datos clínicos adecuados sobre seguridad sobre el efecto de LEMTRADA® en la fertilidad. En un subestudio con 13 pacientes varones tratados con alemtuzumab (en tratamiento con 12 mg o 24 mg), no hubo evidencia de aspermia, azoospermia, recuento de espermatozoides sistemáticamente reducido, trastornos de la movilidad o un aumento de anormalidades morfológicas del esperma.
Se sabe que el CD52 está presente en los tejidos reproductivos humanos y de roedores. Los datos sobre animales han mostrado efectos en la fertilidad de ratones humanizados (ver Identificación de la especialidad farmacéutica, Datos preclínicos sobre seguridad), no obstante se desconoce si existe un posible impacto en la fertilidad humana durante el periodo de exposición, según los datos disponibles.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
No se recomienda el uso de LEMTRADA® en pacientes con formas no activas de la enfermedad o en aquellos que estén estables con su tratamiento actual.
A los pacientes tratados con LEMTRADA® se les debe suministrar el prospecto, la Tarjeta de Paciente y la Guía para el Paciente. Antes del tratamiento deberá informarse al paciente de los riesgos y los beneficios, así como de la necesidad de comprometerse a un seguimiento de 48 meses tras la última administración de LEMTRADA®.
Autoinmunidad: El tratamiento puede dar lugar a la formación de autoanticuerpos y aumentar el riesgo de enfermedades de origen autoinmune incluyendo: púrpura trombocitopénica inmune (PTI), trastornos de tiroides o, raramente, nefropatías (por ejemplo, enfermedad por anticuerpos anti-membrana basal glomerular). Se debe tener cuidado en pacientes con enfermedades autoinmunes previas distintas de la EM, aunque los datos disponibles sugieren que no se produce un empeoramiento de las enfermedades autoinmunes preexistentes tras el tratamiento con alemtuzumab.
Púrpura trombocitopénica inmune (PTI): Se han observado casos graves de PTI en aproximadamente un 1% de los pacientes tratados en ensayos clínicos controlados en EM. En un ensayo clínico controlado en pacientes con EM, un paciente desarrolló PTI que no se detectó antes de la implementación de los requisitos de controles sanguíneos mensuales y falleció de hemorragia intracerebral. La aparición de PTI normalmente se ha dado entre 14 y 36 meses después de la primera administración. Los síntomas de PTI pueden incluir (pero sin limitarse a) tendencia a la formación de hematomas, petequias, sangrado mucocutáneao espontáneo (por ejemplo, epistaxis, hemoptisis), sangrado menstrual irregular o más abundante de lo normal. La hemoptisis puede ser también indicativa de enfermedad anti-MBG (ver a continuación) y debe realizarse un diagnóstico diferencial adecuado. Recuerde al paciente que debe estar alerta ante cualquier síntoma que pueda experimentar y que debe buscar consejo médico en caso de duda.
Antes de iniciar el tratamiento deben realizarse recuentos sanguíneos completos con fórmula leucocitaria completa y a partir de entonces a intervalos mensuales hasta 48 meses después de la última infusión. Después de este periodo, las pruebas deben realizarse en base a los hallazgos clínicos sugestivos de PTI. Si se sospecha de PTI, debe realizarse un recuento sanguíneo completo de forma inmediata.
Si se confirma la aparición de PTI, deberá iniciarse rápidamente una intervención médica adecuada, incluyendo la consulta inmediata a un especialista. Los datos de los ensayos clínicos de EM han mostrado que el cumplimiento de los requisitos de monitorización hematológica y la educación sobre los signos y síntomas de la PTI han llevado a la detección y el tratamiento tempranos de la PTI, consiguiendo que la mayoría de los casos respondan al tratamiento médico de primera línea.
Se desconoce el riesgo potencial asociado a la reinstauración del tratamiento con LEMTRADA® después de la aparición de PTI.
Nefropatías: Se observaron nefropatías, incluyendo la enfermedad por anticuerpos anti-membrana basal glomerular (anti-MBG), en un 0,3% de los pacientes en los ensayos clínicos en EM y, normalmente, ocurrieron en los 39 meses siguientes a la última administración de LEMTRADA®. En los ensayos clínicos, hubo dos casos de enfermedad anti-MBG. Ambos casos fueron graves, se identificaron pronto en los controles clínicos y de laboratorio y respondieron bien al tratamiento.
Las manifestaciones clínicas de nefropatía pueden incluir una elevación de la creatinina en suero, hematuria y/o proteinuria. Aunque no se observó en los ensayos clínicos, puede producirse hemorragia alveolar con la enfermedad anti-MBG. La hemoptisis puede ser también indicativa de PTI (ver anteriormente) y debe realizarse un diagnóstico diferencial adecuado. Se debe recordar al paciente que debe estar alerta ante cualquier síntoma que pueda experimentar y que debe buscar consejo médico en caso de duda. La enfermedad anti-MBG puede provocar fallo renal con necesidad de diálisis y/o transplante si no se trata rápidamente y puede ser una amenaza para la vida si no se trata.
Antes de iniciar el tratamiento deben obtenerse niveles de creatina en suero y, a partir de entonces, a intervalos mensuales hasta 48 meses después de la última infusión. Deben realizarse analíticas de orina con microscopía antes del inicio y a intervalos mensuales a partir de entonces hasta 48 meses después de la última infusión. La observación de cambios clínicamente significativos respecto al nivel basal en la creatinina en suero, hematuria sin explicación y/o proteinuria requieren evaluación adicional para detectar nefropatías, incluyendo la consulta inmediata a un especialista. La detección y el tratamiento tempranos de las nefropatías pueden reducir el riesgo de resultados desfavorables. Después de este periodo, las pruebas deben realizarse en base a los hallazgos clínicos sugestivos de nefropatías.
Se desconoce el riesgo potencial asociado a la reinstauración del tratamiento con LEMTRADA® después de la aparición de nefropatías.
Trastornos de tiroides: Se observaron trastornos autoinmunes de tiroides en un 36% estimado de los pacientes tratados con LEMTRADA® 12 mg en los ensayos clínicos en EM en los 48 meses siguientes a la primera administración de LEMTRADA®. La incidencia de acontecimientos tiroideos fue superior en los pacientes con antecedentes de trastornos de tiroides tanto en los grupos de tratamiento con LEMTRADA® como con interferón beta 1a (IFNB-1a). En pacientes con trastorno de tiroides en curso, LEMTRADA® debe administrarse si los posibles beneficios justifican los posibles riesgos. Los trastornos autoinmunes de tiroides observados incluyeron hipertiroidismo o hipotiroidismo. La mayoría de los acontecimientos fueron de intensidad leve a moderada.
Antes de la autorización, ocurrieron acontecimientos graves en <1% de los pacientes. Sólo la enfermedad de Basedow (también conocida como enfermedad de Graves), el hipertiroidismo y el hipotiroidismo ocurrieron en más de 1 paciente. La mayoría de los acontecimientos tiroideos fueron tratados con tratamiento médico convencional, aunque algunos pacientes requirieron intervención quirúrgica. En los ensayos clínicos, se permitió que los pacientes que habían desarrollado acontecimientos tiroideos volvieran a recibir tratamiento con LEMTRADA®. Aunque la experiencia es limitada, en general los pacientes que volvieron a recibir tratamiento no experimentaron un empeoramiento de la intensidad de los trastornos de tiroides. Debe valorarse de forma individual la repetición del tratamiento con LEMTRADA® teniendo en cuenta la condición clínica de cada paciente.
Deben realizarse pruebas de función tiroidea, como los niveles de hormona estimulante del tiroides, antes de iniciar el tratamiento y cada 3 meses a partir de entonces hasta 48 meses después de la última infusión. Después de este periodo, las pruebas deben realizarse basadas en los hallazgos clínicos que sugieran una disfunción del tiroides.
La enfermedad tiroidea supone un riesgo especial en el caso de mujeres embarazadas (ver Información necesaria previa a la toma de la especialidad farmacéutica, Fertilidad, embarazo y lactancia).
En los ensayos clínicos, el estado de los anticuerpos contra la peroxidasa tiroidea (anti-TPO) del paciente antes del tratamiento no fue indicativo del desarrollo de un acontecimiento adverso relacionado con el tiroides. La mitad de los pacientes que dieron positivo al inicio y un cuarto de los pacientes que dieron negativo al inicio en anticuerpos anti-TPO desarrollaron un acontecimiento relacionado con el tiroides. La amplia mayoría (aproximadamente el 80%) de los pacientes que presentaron un acontecimiento relacionado con el tiroides tras el tratamiento habían dado negativo en anticuerpos anti-TPO al inicio. Así, independientemente del estado de los anticuerpos anti-TPO en el pretratamiento, los pacientes pueden desarrollar un acontecimiento adverso relacionado con el tiroides y deberán realizarse todas las pruebas - analíticas de forma periódica tal y como se ha descrito anteriormente.
Citopenias: De forma poco frecuente, se han notificado citopenias autoinmunes como neutropenia, anemia hemolítica y pancitopenia en ensayos clínicos en EM. Los resultados de los recuentos sanguíneos completos (ver anteriormente en PTI) deben utilizarse para detectar las citopenias. Si se confirma la aparición de una citopenia, debe iniciarse rápidamente una intervención médica adecuada, incluyendo la consulta a un especialista.
Reacciones asociadas a la infusión (RAI): En los ensayos clínicos controlados, las reacciones asociadas a la infusión (RAI) se definieron como cualquier acontecimiento adverso ocurrido durante o en las 24 horas siguientes a la infusión de LEMTRADA®. La mayoría podían deberse a la liberación de citoquinas durante la infusión. La mayoría de los pacientes tratados con LEMTRADA® en ensayos clínicos controlados en EM experimentaron RAI leves a moderadas durante y/o hasta 24 horas después de la administración de LEMTRADA® 12 mg que, a menudo, incluyeron cefalea, erupción, pirexia, náuseas, urticaria, prurito, insomnio, escalofríos, rubefacción, fatiga, disnea, disgeusia, malestar torácico, erupción generalizada, taquicardia, dispepsia, mareo y dolor. En el 3% de los pacientes se produjeron reacciones graves que incluyeron casos de pirexia, urticaria, fibrilación auricular, náuseas, malestar torácico e hipotensión. Pueden aparecer manifestaciones clínicas de anafilaxis similares a las manifestaciones clínicas de las reacciones asociadas a la infusión, pero tendrán tendencia a ser más severas o potencialmente una amenaza para la vida. Las reacciones atribuidas a anafilaxis se han notificado raramente, en contraste con las reacciones asociadas con la infusión.
Se recomienda pretratar a los pacientes para mejorar los efectos de las reacciones a la infusión (ver Instrucciones necesarias y habituales para una buena utilización, en particular, Posología y forma de administración). La mayoría de los pacientes de los ensayos clínicos recibieron antihistamínicos y/o antipiréticos antes de, al menos, una infusión de LEMTRADA®. Los pacientes pueden sufrir RAI a pesar del pretratamiento. Se recomienda observar si hay reacciones durante la infusión de LEMTRADA® y hasta 2 horas después de ésta. Si se produjera una RAI, proporcione el tratamiento sintomático adecuado según sea necesario. Si la infusión no fuera bien tolerada, su duración podría extenderse. En caso de reacciones graves a la infusión, debe considerarse la interrupción inmediata de la infusión intravenosa. En los ensayos clínicos, fueron muy raras las reacciones graves o de anafilaxia que necesitaron la interrupción del tratamiento. Los médicos deben conocer el historial cardiaco del paciente ya que las reacciones asociadas a la infusión pueden incluir síntomas cardiacos como taquicardia. Debe haber recursos disponibles para tratar las reacciones graves o de anafilaxia.
Infecciones: Se produjeron infecciones en el 71% de los pacientes tratados con LEMTRADA®12 mg en comparación con el 53% de los pacientes tratados con interferón beta-1a [IFNB 1a] (44 mcg 3 veces a la semana) en ensayos clínicos controlados en EM de hasta 2 años de duración, y fueron predominantemente de intensidad leve a moderada. Las infecciones que se dieron con más frecuencia en los pacientes tratados con LEMTRADA®que en los pacientes con IFNB 1a incluyeron nasofaringitis, infección del tracto urinario, infección del tracto respiratorio superior, sinusitis, herpes oral, gripe y bronquitis. Se produjeron infecciones graves en el 2,7% de los pacientes tratados con LEMTRADA® en comparación con el 1% de los pacientes tratados con IFNB-1a en ensayos clínicos controlados en EM. Las infecciones graves del grupo de LEMTRADA® incluyeron: apendicitis, gastroenteritis, neumonía, herpes zóster e infección dental. Las infecciones tuvieron, en general, una duración típica y se resolvieron con tratamiento médico convencional.
Se produjeron infecciones graves de varicela zóster, incluyendo varicela primaria y reactivación de varicela zóster, con más frecuencia en pacientes tratados con LEMTRADA® 12 mg (0,3%) en los ensayos clínicos en comparación con los pacientes tratados con IFNB-1a (0%). También se ha notificado infección cervical por virus del papiloma humano (VPH), incluyendo displasia cervical, en pacientes tratadas con LEMTRADA 12 mg (2%). Se recomienda realizar pruebas anuales de detección del VPH a las pacientes.
Se han notificado casos de tuberculosis en pacientes tratados con LEMTRADA® e IFNB-1a en los ensayos clínicos controlados. Se han notificado casos de tuberculosis activa y latente en el 0,3% de los pacientes tratados con LEMTRADA®, con más frecuencia en las regiones endémicas. Antes de iniciar el tratamiento, es necesario evaluar a todos los pacientes para detectar una posible infección activa o inactiva (“latente”) por tuberculosis, según la normativa local.
Se produjeron infecciones superficiales por hongos, especialmente candidiasis oral y vaginal, de forma más frecuente en los pacientes tratados con LEMTRADA® (12%) que en los pacientes tratados con IFNB-1a (3%) en los ensayos clínicos controlados en EM.
Los médicos deben considerar retrasar el inicio de la administración de LEMTRADA® en pacientes con infección activa hasta que ésta esté completamente controlada.
Debe iniciarse la profilaxis con un agente oral contra el herpes desde el primer día de tratamiento con LEMTRADA® y hasta, como mínimo, 1 mes después de cada curso de tratamiento. En los ensayos clínicos se administró a los pacientes aciclovir 200 mg dos veces al día o equivalente.
LEMTRADA® no se ha administrado para el tratamiento de la EM de forma simultánea o después de tratamientos inmunosupresores o antineoplásicos. Al igual que con otros tratamientos inmunomoduladores, deben tenerse en cuenta los posibles efectos combinados sobre el sistema inmunológico del paciente al considerar la administración de LEMTRADA®. El uso simultáneo de LEMTRADA® con alguno de estos tratamientos podría aumentar el riesgo de inmunosupresión.
No hay datos disponibles sobre la relación de LEMTRADA® con la reactivación del virus de la hepatitis B (VHB) o el virus de la hepatitis C (VHC) ya que los pacientes con infecciones crónicas o activas fueron excluidos de los ensayos clínicos. Debe considerarse el cribado de pacientes con riesgo alto de infección por VHB y/o VHC antes de iniciar el tratamiento con LEMTRADA® y se debe tener precaución a la hora de prescribir LEMTRADA® a pacientes identificados como portadores de VHB y/o VHC ya que estos pacientes podrían estar en riesgo de daño hepático irreversible por la posible reactivación del virus como consecuencia de su estado preexistente.
Malignidad: Al igual que con otros tratamientos inmunomoduladores, se debe tener precaución al iniciar el tratamiento con LEMTRADA® en pacientes con enfermedad maligna preexistente y/o en desarrollo. Actualmente se desconoce si alemtuzumab confiere un mayor riesgo de desarrollar tumores malignos de tiroides, ya que la autoinmunidad del tiroides en sí misma puede ser un factor de riesgo para los tumores malignos de tiroides.
Anticoncepción: Se observaron transferencia placentaria y posible actividad farmacológica de LEMTRADA® en ratones durante la gestación y tras el parto. Las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento y hasta 4 meses después de un curso de tratamiento con LEMTRADA® (ver Información necesaria previa a la toma de la especialidad farmacéutica, Fertilidad, embarazo y lactancia).
Vacunas: Se recomienda que los pacientes hayan completado los requisitos locales de inmunización al menos 6 semanas antes del tratamiento con LEMTRADA®. No se ha estudiado la capacidad de las vacunas de generar respuesta inmune tras el tratamiento con LEMTRADA®.
No se ha estudiado formalmente la seguridad de la inmunización con vacunas víricas basadas en virus vivos tras un curso de tratamiento con LEMTRADA® en los ensayos clínicos controlados en EM y no se deben administrar a pacientes con EM que hayan recibido recientemente un curso de tratamiento con LEMTRADA®. Vacunación y pruebas de detección de anticuerpos del virus de la varicela zóster Al igual que con cualquier medicamento modulador del sistema inmune, antes de iniciar un curso de tratamiento con LEMTRADA®, los pacientes sin antecedentes de varicela o que no estén vacunados contra el virus de la varicela zóster (VVZ) deben realizarse pruebas de detección de anticuerpos del VVZ. Debe considerarse la vacunación contra el VVZ en los pacientes con anticuerpos negativos antes de iniciar el tratamiento con LEMTRADA®. Para permitir el efecto total de la vacunación contra VVZ, posponga el tratamiento con LEMTRADA® hasta 6 semanas después de la vacunación.
Pruebas de laboratorio recomendadas para monitorizar a los pacientes Deben realizarse pruebas de laboratorio a intervalos periódicos durante los 48 meses siguientes al último curso de tratamiento con LEMTRADA® para controlar que no haya síntomas tempranos de enfermedad autoinmune:
Recuento sanguíneo completo con fórmula leucocitaria completa (antes de iniciar el tratamiento y a intervalos mensuales a partir de entonces)
Niveles de creatinina en suero (antes de iniciar el tratamiento y a intervalos mensuales a partir de entonces) Analítica de orina con microscopía (antes de iniciar el tratamiento y a intervalos mensuales a partir de entonces)
Una prueba de función tiroidea, como nivel de hormona estimulante del tiroides (antes de iniciar el tratamiento y cada 3 meses a partir de entonces)
Después de este periodo, cualquier hallazgo clínico que sugiera una nefropatía o una disfunción del tiroides requerirá pruebas adicionales.
Información del uso de alemtuzumab antes de la autorización de comercialización de LEMTRADA® fuera de los estudios patrocinados por la compañía: Las siguientes reacciones adversas se identificaron antes del registro de LEMTRADA®, durante el uso de alemtuzumab para el tratamiento de la leucemia linfocítica crónica de células B (LLC-B), así como para el tratamiento de otros trastornos, normalmente a dosis mayores y más frecuentes (por ejemplo, 30 mg) que las recomendadas en el tratamiento de la EM. Dado que estas reacciones fueron notificadas voluntariamente por una población de tamaño desconocido, no siempre es posible calcular de forma fiable su frecuencia o establecer una relación causal con la exposición a alemtuzumab.
Enfermedad autoimmune: Los acontecimientos autoinmunes que se han notificado en pacientes tratados con alemtuzumab incluyeron neutropenia, anemia hemolítica (incluyendo un caso mortal), hemofilia adquirida, enfermedad anti-MBG y enfermedad tiroidea. Se han notificado fenómenos autoinmunes graves y, en ocasiones mortales, incluyendo anemia hemolítica autoinmune, trombocitopenia autoinmune, anemia aplásica, síndrome de Guillain-Barré y polirradiculoneuropatía crónica inflamatoria desmielinizante, en pacientes sin EM tratados con alemtuzumab para otras patologías. Se ha notificado una prueba de Coombs positiva en un paciente oncológico tratado con alemtuzumab. Se ha notificado un acontecimiento mortal de enfermedad de injerto contra huésped asociada a transfusión en un paciente oncológico tratado con alemtuzumab.
Reacciones asociadas a la infusión: Se han observado RAI graves, y en ocasiones mortales, incluyendo broncoespasmo, hipoxia, síncope, infiltrados pulmonares, síndrome de sufrimiento respiratorio agudo, parada respiratoria, infarto de miocardio, arritmias, insuficiencia cardiaca aguda y parada cardiaca en pacientes sin EM tratados con alemtuzumab con dosis mayores y más frecuentes que las utilizadas para EM. También se ha notificado anafilaxia severa y otras reacciones de hipersensibilidad, incluyendo shock anafiláctico y angioedema.
Infecciones e infestaciones: Se han notificado infecciones graves, y en ocasiones mortales, por virus, bacterias, protozoos y hongos, incluyendo las debidas a infecciones latentes o reactivadas, en pacientes sin EM tratados con alemtuzumab para otras patologías con dosis mayores y más frecuentes que las utilizadas para EM. Se han notificado casos de leucoencefalopatía multifocal progresiva (LMP) en pacientes con LLC-B con o sin tratamiento con alemtuzumab. La frecuencia de LMP en pacientes con LLC-B tratados con alemtuzumab no es mayor que la frecuencia habitual.
Trastornos de la sangre y del sistema linfático: Se han notificado reacciones de sangrado intenso en pacientes sin EM.
Trastornos cardiacos: Se han notificado casos de insuficiencia cardiaca congestiva, cardiomiopatía y fracción de eyección reducida en pacientes sin EM tratados con alemtuzumab para otras patologías y tratados previamente con agentes potencialmente cardiotóxicos.
Trastornos linfoproliferativos asociados a virus de Epstein-Barr: Se han observado trastornos linfoproliferativos asociados a virus de Epstein-Barr fuera de los estudios patrocinados por la compañía.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
El tratamiento con LEMTRADA®debe ser iniciado y supervisado por un neurólogo con experiencia en el tratamiento de pacientes con EM. Se debe disponer de los especialistas y los equipos necesarios para el diagnóstico y la gestión puntual de las reacciones adversas más frecuentes, especialmente las infecciones y las enfermedades autoinmunes.
Debe haber recursos disponibles para tratar los casos de hipersensibilidad y/o reacciones anafilácticas. A los pacientes tratados con LEMTRADA®se les debe suministrar la Tarjeta de Paciente y la Guía para el Paciente, así como informarles acerca de los riesgos de LEMTRADA®.
Posología: La dosis recomendada de LEMTRADA es de 12 mg/día, administrados por perfusión intravenosa en 2 cursos de tratamiento.
Curso inicial: 12 mg/día durante 5 días consecutivos (dosis total de 60 mg)
Segundo curso: 12 mg/día durante 3 días consecutivos (dosis total de 36 mg) administrados 12 meses después del curso inicial de tratamiento.
Las dosis que no se administren no deben administrarse el mismo día que una dosis programada.
Seguimiento de los pacientes: Se recomienda una terapia de 2 cursos de tratamiento (ver Posología) con un seguimiento de seguridad de los pacientes desde el inicio del tratamiento hasta 48 meses después de la última perfusión (ver Información necesaria previa a la toma de la especialidad farmacéutica, Advertencias y precauciones especiales de empleo).
Pretratamiento: Los pacientes deben pre-tratarse con corticoesteroides inmediatamente antes de la administración de LEMTRADA® en cada uno de los 3 primeros días de cualquier curso de tratamiento. En los ensayos clínicos, los pacientes fueron pre-tratados con 1.000 mg de metilprednisolona durante los 3 primeros días de cada curso de tratamiento con LEMTRADA®.
De forma adicional, puede considerarse el pretratamiento con antihistamínicos y/o antipiréticos antes de la administración de LEMTRADA®.
Debe administrarse profilaxis oral para la infección por herpes a todos los pacientes desde el primer día de cada curso de tratamiento hasta, como mínimo, 1 mes después del tratamiento con LEMTRADA® (ver también Infecciones en Información necesaria previa a la toma de la especialidad farmacéutica, Advertencias y precauciones especiales de empleo). En los ensayos clínicos, se administró a los pacientes aciclovir 200 mg dos veces al día o equivalente.
Pacientes de edad avanzada: Los ensayos clínicos no incluyeron pacientes con edades superiores a 55 años. No se ha determinado si responden de forma diferente a los pacientes de menor edad.
Pacientes con insuficiencia hepática o renal: No se ha realizado ningún estudio en pacientes que padezcan insuficiencia hepática o renal.
Población pediátrica: No se ha establecido todavía la seguridad y eficacia de LEMTRADA® en niños con EM de 0 a 18 años de edad. No existe una recomendación de uso específica para alemtuzumab en niños de 0 a menos de 10 años para el tratamiento de la esclerosis múltiple. No se dispone de datos.
Forma farmacéutica y vía de administración: Concentrado para solución para Infusión, administrado por vía intravenosa.
Forma de administración: LEMTRADA® debe diluirse antes de la infusión. La solución diluida debe administrarse por infusión intravenosa durante un periodo de unas 4 horas.
Para consultar las instrucciones de dilución del medicamento antes de la administración, ver en esta sección Precauciones de preparación y administración.
SOBREDOSIS:
En los ensayos clínicos controlados, dos pacientes con EM recibieron de forma accidental hasta 60 mg de LEMTRADA® (es decir, la dosis total para el curso inicial de tratamiento) en una sola infusión y experimentaron reacciones graves (cefalea, erupción, además de hipotensión o taquicardia sinusal). Las dosis de LEMTRADA® superiores a las probadas en los estudios clínicos pueden aumentar la intensidad y/o duración de las reacciones adversas asociadas a la perfusión o sus efectos inmunes.
No se conoce un antídoto para la sobredosis de alemtuzumab. El tratamiento consiste en interrumpir la administración del medicamento y proporcionar tratamiento de apoyo.
Si olvidó que le administrasen LEMTRADA®, por favor, póngase en contacto con su médico.
Si tiene alguna duda respecto al uso de este medicamento, consulte a su médico o farmacéutico.
Precauciones de preparación y administración: Para administración intravenosa, extraer 1,2 ml de LEMTRADA® del vial en una jeringa mediante una técnica aséptica. Inyectar en 100 ml de una solución para infusión de 9 mg/ml (0,9%) de cloruro de sodio o una solución para infusión de glucosa (5%). Este medicamento no debe diluirse con otros disolventes. La bolsa debe invertirse suavemente para mezclar la solución.
LEMTRADA® no contiene conservantes antimicrobianos así que se debe tener cuidado para garantizar la esterilidad de la solución preparada. Se recomienda administrar el producto diluido de forma inmediata. Cada vial está destinado a un solo uso.
INFORMACIÓN RELACIONADA:
No administrar el medicamento después de la fecha indicada en el envase.
Periodo de validez
Concentrado: 3 años.
Solución diluida: Se ha demostrado la estabilidad química y física en uso durante 8 horas a 2 °C - 8 °C. Desde el punto de vista microbiológico, se recomienda utilizar el producto inmediatamente. Si no se utiliza inmediatamente, las condiciones y los tiempos de conservación empleados antes de su uso son responsabilidad del usuario y no deben superar las 8 horas a 2 °C - 8 °C, protegido de la luz.
PRESENTACIÓN:
Caja con un vial conteniendo 1.2 mL de LEMTRADA® 12 mg/1.2 mL.
Referencia: Agencia Europea de Medicamentos – EMA SmPC: 12/2013
RS. N° BE-00953
Fabricado por: Boehringer Ingelheim Pharma GmbH & Co. KG - Alemania
Acondicionado por: Genzyme Limited – Reino Unido
Lemtrada® es una marca registrada de Genzyme Corporation
SANOFI GENZYME
IDENTIFICACIÓN DE LA ESPECIALIDAD FARMACÉUTICA:
LEMTRADA® (alemtuzumab) 12 mg/1.2 mL Concentrado para solución para infusión.
Alemtuzumab es un anticuerpo monoclonal que se produce mediante tecnología ADN recombinante en un cultivo en suspensión de células de mamíferos (ovario de hámster chino) en un medio de nutriente.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN:
Concentrado: Consérvese entre 2-8 °C. No congelar ni agitar
Mantener el vial dentro del estuche externo para protegerlo de la luz.
El contenido del vial debe examinarse visualmente antes de cada administración para descartar la existencia de partículas o decoloración. Si el concentrado contiene partículas o presenta decoloración, no debe utilizarse.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Cada VIAL de LEMTRADA® contiene 12 mg/1.2 mL de alemtuzumab.
Los excipientes son: Edetato disódico dihidratado; cloruro de potasio; dihidrogenofosfato de potasio; cloruro de sodio; fosfato de sodio dibásico; polisorbato 80 y agua para inyección.