INFLAMMIDE HFA
BUDESONIDA
Suspensión en aerosol
7.5 ml Aerosol dosificador , 150 Dosis
7.5 ml Aerosol dosificador , 150 Dosis
Aerosol dosificador , 150 Dosis
Aerosol dosificador , 200 mcg
COMPOSICIÓN
Cada dosis de aerosol dosificador contiene:
Budesonida 200 mcg
Excipientes (ácido oleico, etanol absoluto, propelente HFA 134a) c.s.
INDICACIONES: Control crónico de los síntomas del asma.
FARMACOCINÉTICA
Absorción: Tras la inhalación de una dosis única de 1 mg de budesonida mediante el uso de un inhalador de dosis medida presurizado, se alcanza una concentración plasmática máxima promedio de 2,3 nmol/L aproximadamente 30 minutos después de la inhalación. La biodisponibilidad de la budesonida con respecto a una dosis medida obtenida luego de su aplicación con inhaladores pulmonares es de aproximadamente un 20%. Se ha demostrado que la disponibilidad sistémica de la budesonida nebulizada en niños en edad preescolar es la mitad que la observada en adultos sanos.
La absorción de budesonida a partir del aparato gastrointestinal es probablemente completa. Debido al amplio metabolismo de primer paso que experimenta este fármaco en el hígado, la disponibilidad sistémica luego de la administración por vía oral es sólo de alrededor del 11%.
Distribución: La budesonida se distribuye ampliamente en los tejidos. Presenta un grado de unión a las proteínas plasmáticas del 88,3%, y de las proteínas plasmáticas se une principalmente a la albúmina. Tras la administración intravenosa, el volumen de distribución de la budesonida inalterada fue de 2,69 L/kg.
La budesonida atravesó la barrera placentaria en los estudios en animales, pero se desconoce si las concentraciones fisiológicamente activas de la budesonida actualmente utilizadas podrían alcanzar al feto.
Metabolismo y eliminación: El cálculo de la depuración plasmática total de la budesonida inalterada fue de 83,7 L/h, en tanto que aquella de los epímeros 22R y 22S fue de 117 L/h y 68 L/h, respectivamente. Luego de la administración por vía inhalatoria, la semivida plasmática de la budesonida inalterada fue de alrededor de 2 h. En los niños con asma, la depuración sistémica es aproximadamente un 50% mayor que en los adultos sanos.
La budesonida sufre un metabolismo insignificante a nivel pulmonar y gastrointestinal. Estudios in vitro realizados sobre un homogeneizado de hígado humano indican que la budesonida es metabolizada rápida y ampliamente por el sistema del citocromo P450, especialmente por las enzimas CYP3A. Se han identificado dos metabolitos principales, la 6ß-hidroxibudesonida, formado por hidroxilación, y la 16a-hidroxiprednisolona, formado por escisión de la cadena lateral. Estos dos metabolitos poseen muy poca actividad biológica (1/10 - 1/100 de budesonida). Se ha comprobado que la budesonida es un sustrato de la glucoproteína p.
En voluntarios sanos, se recuperó el 31,8% de una dosis inhalada de [3H] budesonida en la orina y el 15,1% en las heces.
Farmacocinética en los grupos de población especiales: En los pacientes con cirrosis hepática moderada (Child-Pugh clase B), la biodisponibilidad sistémica luego de la administración por vía oral de budesonida fue en promedio 3,5 veces más alta en comparación con la observada en los voluntarios sanos, debido al menor metabolismo/efecto de primer paso de los pacientes cirróticos . La biodisponibilidad sistémica en los pacientes con deterioro hepático leve (Child-Pugh clase A) fue similar a la observada en voluntarios sanos. En el caso de la budesonida administrada por vía intravenosa (0,5 mg), no se observó ninguna diferencia importante en términos de depuración, volumen de distribución o semivida entre los pacientes con cirrosis y los voluntarios sanos.
PROPIEDADES FARMACOLÓGICAS
Grupo farmacoterapéutico: Glucocorticoides
Código ATC: R03BA02
Los corticosteroides inhalados como INFLAMMIDE® son la medicación antiinflamatoria más efectiva para el tratamiento del asma. Los estudios han demostrado la eficacia de la budesonida en términos de la mejora de la función pulmonar, la reducción de la hiperreactividad de las vías aéreas, la reducción de los síntomas, la reducción de la frecuencia de las exacerbaciones y la mejora de la calidad de vida.
Aún no se comprenden por completo los mecanismos específicos involucrados en la acción de los corticosteroides en el asma. Los glucocorticosteroides se unen a un receptor citosólico, el cual luego presenta cambios conformacionales del complejo del receptor. Este complejo interactúa con sitios de unión específicos en la región del promotor-potenciador de los genes blanco que modulan la transcripción y también la interacción inhibitoria directa con factores de transcripción proinflamatorios activados, la proteína activadora 1 (AP-1) y el factor nuclear k B (NFkB), los cuales regulan la expresión de genes inflamatorios.
Los mecanismos farmacológicos relevantes son: interferencia con la unión a la IgE, interferencia con el metabolismo del ácido araquidónico y la síntesis de leucotrienos y prostaglandinas; reducción de la fuga microvascular; inhibición de la producción y la secreción de citoquinas; prevención de la activación y migración dirigida de las células inflamatorias; y reactividad aumentada de los receptores ß de la musculatura lisa de las vías aéreas.
En los pacientes asmáticos, la reacción alérgica tardía tras la inoculación con antígenos evidenció una marcada reducción luego de un tratamiento previo de 12 horas con budesonida, pero se logró un efecto adicional luego de un tratamiento previo extendido de una semana o un mes de duración. A diferencia de lo observado con el tratamiento previo de 12 horas y de 1 semana, el tratamiento previo de 1 mes también redujo sustancialmente la reacción inmediata.
Luego de seis semanas de tratamiento, la budesonida inhalada (800 mcg dos veces al día) se redujo la reactividad bronquial a la histamina, al ejercicio y a la hiperventilación voluntaria eucápnica de aire seco de un modo similar. La budesonida inhalada produce mayor efecto sobre la broncoconstricción inducida por 5"-monofosfato de adenosina que sobre la inducida por metabisulfito de sodio.
La budesonida administrada por vía inhalatoria mejoró la función pulmonar y la hiperreactividad bronquial en adultos con diagnóstico reciente de asma tratados durante 3 meses, y fue más efectiva para mejorar las alteraciones del epitelio bronquial y disminuir la inflamación de las vías aéreas que la medicación con un agonistas ß.
CONTRAINDICACIONES
• Bronquiectasia moderada a severa.
• Hipersensibilidad a la budesonida o a cualquiera de los componentes de este producto (ver la composición en el listado de excipientes).
• El uso de este producto está contraindicado en el caso de trastornos hereditarios raros que puedan ser incompatibles con alguno de los excipientes del producto (ver Advertencias y precauciones especiales).
FERTILIDAD, EMBARAZO Y LACTANCIA
Embarazo: No se ha establecido la seguridad del uso de este fármaco durante el embarazo y la lactancia.
Hasta el momento no se ha llevado a cabo ningún estudio controlado para evaluar la seguridad de la budesonida durante el embarazo. No obstante, un estudio de registro sueco (n=2968), un estudio de cohorte danés (n=1231) y una revisión de estudios clínicos y epidemiológicos (n=6600) sugieren que el uso de budesonida en el embarazo no está asociado a un incremento de riesgo de malformaciones congénitas. Sin embargo, según lo indicado por los datos preclínicos, la inhalación de glucocorticoides durante el embarazo puede ser un factor de riesgo para la ocurrencia de alteraciones endócrinas y metabólicas en las crías de los animales expuestos a dichos fármacos. En vista de las limitaciones de los estudios antes mencionados, los médicos deben evaluar la relación riesgo-beneficio para cada caso particular antes del uso de budesonida inhalada durante el embarazo.
Estudios preclínicos han arrojado evidencia de toxicidad reproductiva (ver Toxicología). No queda claro cuál es la relevancia de este hallazgo para los seres humanos; no obstante ello, debe evitarse su administración durante el embarazo a menos que existan razones de fuerza mayor que hagan necesario su uso.
Debe efectuarse un control de los bebés nacidos de madres que hayan recibido dosis sustanciales de corticosteroides, por cuanto existe la posibilidad de un hipoadrenalismo.
Lactancia: La budesonida se excreta en la leche materna; el tratamiento de mantenimiento con budesonida (200 o 400 mcg dos veces al día) por vía inhalatoria administrado mediante turboinhalador en mujeres asmáticas en período de lactancia dio lugar a una exposición sistémica insignificante (se estima que la dosis diaria del bebé fue equivalente al 0,3% de la dosis materna) a la budesonida en los lactantes. El uso de INFLAMMIDE® en las mujeres en período de lactancia debe estar supeditado a una cuidadosa evaluación de la relación riesgo-beneficio.
Fertilidad: No existen datos clínicos en relación con el efecto de la budesonida sobre la fertilidad. Estudios preclínicos realizados con budesonida no revelaron ningún efecto adverso sobre la fertilidad (ver Toxicología).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIA: No se han realizado estudios en torno a los efectos de este fármaco sobre la capacidad para conducir vehículos y operar maquinarias.
No obstante, debe alertarse a los pacientes respecto de la posibilidad de que se produzcan efectos indeseables tales como mareos o cambios en la conducta durante el tratamiento con INFLAMMIDE® HFA. Por lo tanto, se debe recomendar a los pacientes que deben tener precaución al conducir vehículos u operar maquinarias. En el caso de que se presenten mareos o cambios en la conducta, los pacientes deben evitar tareas potencialmente peligrosas, como conducir vehículos u operar maquinarias.
EFECTOS SECUNDARIOS
• Infecciones e infestaciones: Candidiasis de boca y garganta.
• Trastornos del sistema inmunitario: Reacción anafiláctica, hipersensibilidad.
• Trastornos endócrinos: Hipercorticoidismo, insuficiencia suprarrenal.
• Trastornos psiquiátricos: Trastorno psicótico, agresividad, depresión, nerviosismo, inquietud, comportamiento anormal (en los niños), irritabilidad, ansiedad.
• Sistema nervioso: Mareos, cefalea.
• Trastornos oculares: Cataratas, glaucoma, aumento de la presión intraocular.
• Trastornos respiratorios, torácicos y mediastínicos: Irritación de garganta, tos, disfonía, broncoespasmo paradójico1, infiltrado pulmonar con eosinofilia, garganta seca, dolor orofaríngeo.
• Trastornos gastrointestinales: Diarrea, náuseas, vómitos y disgeusia.
• Trastornos de la piel y del tejido subcutáneo: Angioedema, urticaria, exantema, dermatitis, prurito.
• Trastornos musculoesqueléticos, óseos y del tejido conjuntivo: Retardo del crecimiento, disminución de la densidad ósea, mialgia, artralgia.
• Trastornos generales: Letargo, fatiga, sed.
1. Al igual que con otros tratamientos inhalatorios, existe la posibilidad de que se produzca un broncoespasmo paradójico, con un aumento inmediato de las sibilancias tras la administración del fármaco. De ser así, deberá discontinuarse de inmediato el uso de budesonida, evaluar al paciente y, de ser necesario, instituir un tratamiento alternativo.
INCOMPATIBILIDADES: No procede.
INTERACCIONES
Corticosteroides orales o parenterales: La eficacia y los efectos secundarios sistémicos pueden verse potenciados por la administración concomitante de corticosteroides orales o parenterales.
Inhibidores de CYP3A3/4: Pueden incrementar los niveles séricos y/o la toxicidad de la budesonida (p. ej., ketoconazol, itraconazol, clotrimazol, ritonavir, ciclosporina, etinilestradiol, troleandromicina, claritromicina, cimetidina, diltiazem, indinavir).
Inductores de CYP3A3/4: Pueden reducir los niveles séricos y/o la toxicidad de la budesonida (p. ej., carbamazepina, fenitoína, fenobarbital, rifampicina).
Cimetidina: Disminuye la depuración y aumenta la biodisponibilidad de la budesonida.
Simpaticomiméticos beta 2: La combinación con simpaticomiméticos beta 2 puede conducir a una respuesta incrementada a los agonistas de los receptores beta 2.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES
Ataques de asma agudos: Es esencial instruir a los pacientes informándoles que los corticosteroides inhalables controlan la inflamación de las vías aéreas y tienen un inicio de acción lento, y que deben tomarse regularmente aunque no haya presencia de síntomas. Los corticosteroides solamente tienen un efecto broncodilatador agudo mínimo. Por lo tanto, INFLAMMIDE® HFA no están indicados para el tratamiento de los ataques de asma agudos.
Las exacerbaciones de asma aguda, acompañada de aumento de la viscosidad del moco y formación de tapones mucosos, pueden requerir el tratamiento complementario con un corticosteroide de administración por vía oral. Debe continuarse el tratamiento inhalatorio con INFLAMMIDE® HFA. Las exacerbaciones del asma causadas por infecciones bacterianas usualmente se controlan mediante un tratamiento antibiótico adecuado y posiblemente aumentando la dosis de INFLAMMIDE® HFA.
Inmunosupresión: Los corticosteroides pueden enmascarar los signos de un cuadro infeccioso y pueden provocar una supresión del sistema inmunitario, con el consecuente aumento de la susceptibilidad del paciente a las infecciones. Se recomienda precaución en el caso de infecciones virales tales como varicela o sarampión, y en las infecciones micóticas y bacterianas del sistema respiratorio (p. ej., tuberculosis) no tratadas. Se desconoce el efecto de este medicamento sobre la tuberculosis latente.
En dichos casos, debe instaurarse sin demora un tratamiento antiinfeccioso adecuado, y debe evaluarse detenidamente la relación riesgo-beneficio relacionado con la administración de corticosteroides inhalados. También debe tomarse en consideración la posibilidad de infecciones oportunistas.
INFLAMMIDE® HFA deben administrarse antes de las comidas. Se recomienda el uso de un espaciador, que reduce el depósito en la zona orofaríngea, el cepillado de dientes o el enjuague bucal con agua luego de cada inhalación para reducir el riesgo de que se produzca una candidiasis en la cavidad oral o en la garganta.
Enfermedades concomitantes: Se recomienda precaución en los pacientes con diabetes mellitus, osteoporosis y úlcera péptica.
Insuficiencia hepática: La existencia de un deterioro hepático moderado (Child-Pugh clase B) podría afectar el metabolismo de la budesonida, con lo cual se recomienda precaución (ver Farmacocinética).
Efectos sistémicos: Es posible que ocurran efectos sistémicos con los corticosteroides inhalados, especialmente en el caso de prescripción de dosis altas durante períodos prolongados. Los efectos sistémicos incluyen hipercorticoidismo y/o insuficiencia suprarrenal, retraso del crecimiento en los niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma. Es importante, por lo tanto, que la dosis del corticosteroide inhalado se ajuste a la dosis más baja con la cual pueda mantenerse un control efectivo del asma. Se recomienda controlar periódicamente la estatura en los niños que reciban tratamiento prolongado con budesonida por vía inhalatoria. En el caso de observarse un retraso del crecimiento, deberá reevaluarse el tratamiento a fin de reducir la dosis de budesonida inhalada, de ser posible, a la menor dosis con la cual se pueda mantener un control efectivo del asma.
Sobredosificación crónica: La sobredosificación crónica (la administración de dosis superiores a la dosis máxima recomendada) puede conducir a un cuadro de insuficiencia suprarrenal, con la consecuente reducción de la producción de corticosteroides y una deficiencia relativa durante los períodos de estrés físico intenso (infecciones severas, traumatismos, intervenciones quirúrgicas, etc.). Puede ser aconsejable la suplementación con corticosteroides sistémicos.
Pacientes sin uso previo de corticosteroides sistémicos: Los pacientes sin uso previo de corticosteroides sistémicos deberían observar una mejoría de los signos y síntomas de asma aproximadamente a los 10 días del inicio del tratamiento con INFLAMMIDE® HFA. El aumento de la viscosidad del moco y de la inflamación, no obstante, podría repercutir negativamente sobre la eficacia de la budesonida. En estos casos, debe iniciarse un tratamiento con corticosteroides sistémicos (comenzando con una dosis de 40-60 mg de equivalente de prednisona). El tratamiento inhalatorio debe mantenerse y continuarse tras la reducción gradual de la administración sistémica.
Pacientes que inician el tratamiento con budesonida como reemplazo de los corticosteroides orales: Debe aconsejarse a los pacientes que informen a los médicos que los atiendan posteriormente sobre el uso previo de corticosteroides.
Estos pacientes pueden presentar un cuadro de insuficiencia adrenocortical. Puede intentarse un retiro gradual y escalonado de los corticosteroides sistémicos (p. ej., 2,5 mg de equivalente de prednisolona cada 1-2 semanas) luego de aproximadamente 10 días de tratamiento combinado con corticosteroides orales e inhalados. Tras el retiro del tratamiento con corticosteroides sistémicos, la recuperación del eje hipotalámico-hipofisiario-suprarrenal puede tardar varios meses. Un retiro demasiado abrupto puede traer aparejado un deterioro del control del asma.
Durante dicho lapso, los pacientes pueden presentar un cuadro de insuficiencia suprarrenal secundaria a traumatismos, cirugías, infecciones u otras situaciones de estrés físico. En estos casos y tras la presentación de un ataque de asma severo, debe retomarse de inmediato el tratamiento con corticosteroides sistémicos.
Como consecuencia de un menor efecto de los corticosteroides sistémicos, algunos pacientes pueden ver incrementados sus síntomas de otras patologías alérgicas, como ser rinitis y eczema. Puede ser necesario reiniciar temporariamente la administración de corticosteroides sistémicos para tratar estos cuadros.
Excipientes: Los pacientes con enfermedades hereditarias raras de intolerancia a la galactosa, p. ej., galactosemia, no deben tomar este medicamento.
POSOLOGÍA Y ADMINISTRACIÓN
Posología:
• INFLAMMIDE® HFA 200 mcg, aerosol de dosis medidas:
— Adultos y niños de más de 12 años de edad: La dosis inicial es 200 mcg dos veces al día.
La dosis de mantenimiento usualmente es de 200 a 400 mcg dos veces al día, pero pueden ser necesarias dosis más altas (hasta 1600 mcg) durante períodos de diversa duración en algunos pacientes. La dosis debe determinarse para cada caso en particular en función del control del asma, según lo determinado sobre la base de los síntomas presentes, el uso de broncodilatadores y, especialmente en los casos más severos, por el flujo espiratorio máximo.
Con dosis de más de 800 mcg, se recomienda el uso de un espaciador, ya que ello reducirá la absorción sistémica y mejorará el depósito del medicamento en los pulmones
— Niños de 6 a 12 años de edad: Cuando se inicia el tratamiento con INFLAMMIDE® HFA en los niños durante períodos de asma severo, y mientras se reducen o se discontinúan los corticosteroides orales, la posología debe ser 200 mcg dos veces al día.
La dosis de mantenimiento debe ser la dosis más baja que permita mantener al paciente libre de síntomas. Un régimen de dos administraciones al día por lo general es suficiente en los pacientes con asma estable.
• INFLAMMIDE® HFA 200 mcg polvo para inhalación
— Adultos y niños de más de 12 años de edad:
— Fase inicial: 200 mcg dos veces al día.
— Dosis de mantenimiento: La dosis de mantenimiento debe determinarse para cada caso en particular, y debe ser la dosis más baja posible que permita mantener al paciente libre de síntomas.
Para los casos que no responden al tratamiento con budesonida en dosis bajas, o en los cuales ya no es posible controlar el asma mediante las dosis de mantenimiento máximas de los broncodilatadores, se recomienda una posología diaria máxima de hasta 1600 mcg/día. Puede resultar adecuada la administración de dos dosis diarias en los pacientes con asma estable. Si la dosis es más de 4 inhalaciones de polvo por día, puede ser más conveniente dividir la dosis en hasta 3 o 4 aplicaciones individuales.
• INFLAMMIDE® HFA 200 mcg, aerosol de dosis medidas;
— INFLAMMIDE® HFA deben administrarse en forma periódica de acuerdo con el régimen posológico recomendado. INFLAMMIDE® HFA están destinados a ser utilizados como tratamiento prolongado.
— El tratamiento con dosis más altas de INFLAMMIDE® HFA no debe interrumpirse en forma abrupta, la dosis debe reducirse gradualmente, en especial en los pacientes con las formas más severas de esta afección.
— En los pacientes que reciban tratamiento concomitante con broncodilatadores inhalados, el broncodilatador debe administrarse varios minutos antes de la inhalación de INFLAMMIDE® HFA para una mejor penetración en el árbol bronquial y para minimizar los efectos secundarios locales, como la tos.
Administración:
• INFLAMMIDE® HFA 200 mcg, aerosol de dosis medidas:
— Es esencial el correcto uso del aerosol de dosis medidas para el éxito del tratamiento.
— Agite el envase del aerosol y oprima la válvula dos veces antes de usar el dispositivo por primera vez.
Deben seguirse los siguientes pasos antes de cada uso:
• Uso sin espaciador:
1. Retire la tapa protectora.
2. Agite bien el inhalador de dosis medidas (ver Fig. 1).
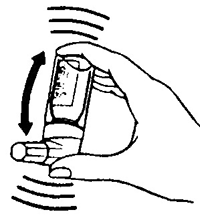
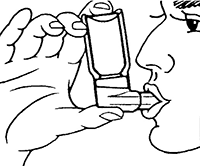
(Fig. 1) (Fig. 2)
3. Exhale profundamente.
4. Sostenga el inhalador de dosis medidas como se muestra en la Fig. 2, y coloque los labios alrededor de la boquilla. La flecha y la base del envase deben estar apuntando hacia arriba.
5. Inhale lo más profundamente posible, oprimiendo firmemente la base del envase en forma simultánea para liberar una dosis medida. Contenga la respiración unos segundos, y luego retire los labios de la boquilla y exhale lentamente.
6. Coloque nuevamente la tapa después de usar el inhalador.
7. Si usa INFLAMMIDE® HFA 200 mcg aerosol de dosis medidas; HFA sin un espaciador, es recomendable realizar un enjuague bucal luego de cada inhalación.
• Uso con espaciador:
1. Retire la tapa protectora de la boquilla y agite bien el aerosol de dosis medidas (Fig. 1).
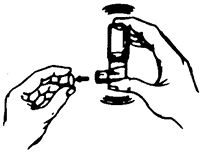
2. Conecte el espaciador a la boquilla por el extremo del espaciador con el orificio de mayor tamaño (Fig. 2).
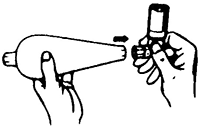
3. Cierre el espaciador con la tapa protectora. La tapa protectora del aerosol de dosis medidas debe colocarse en el espaciador para evitar que se pierda la neblina fina del producto (Fig. 3).
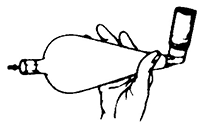
4. Oprima con el dedo índice la base del envase para liberar una aplicación (puff) dentro del espaciador (Fig. 4).
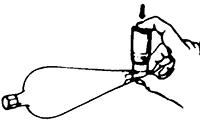
5. Retire la tapa protectora e inhale la neblina aerosolizada del producto que se encuentra en el espaciador (Fig. 5), contenga la respiración unos segundos para asegurar que esta neblina se deposite en los bronquios y evitar que sea expulsada inmediatamente en la exhalación. Retire el espaciador de la boca y exhale lentamente.
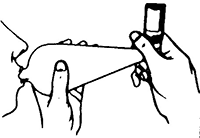
Es fundamental que inhale a través del espaciador tan pronto como se libere la aplicación del producto, ya que de lo contrario las partículas libres en suspensión se depositarán rápidamente en las paredes internas del dispositivo y ya no podrán ser inhaladas. Repita el procedimiento que se describe en los pasos 3, 4 y 5 en el caso de que se le haya prescripto más de 1 puff.
6. Coloque nuevamente la tapa en el inhalador de dosis medidas luego de su uso.
La boquilla y, en caso de utilizarse, el espaciador deben mantenerse siempre limpios, para lo cual se deben lavar con agua tibia y detergente o jabón. Luego, deben enjuagarse bien y secarse cuidadosamente.
Como el envase no es transparente, no es posible ver cuándo se ha agotado su contenido; pero se puede determinar si todavía queda líquido en su interior agitándolo.
• INFLAMMIDE® HFA 200 mcg, aerosol de dosis medidas: El contenido del envase se encuentra bajo presión, y bajo ninguna circunstancia debe abrirse a la fuerza el envase o exponérselo a temperaturas superiores a 50 °C.
SOBREDOSIS
Síntomas: La sobredosificación ocasional no dará lugar a la aparición de ningún síntoma evidente en muchos casos, aunque se traducirá en un descenso de los niveles plasmáticos de cortisol.
Existe un mayor riesgo de infecciones con la administración de dosis elevadas.
La sobredosificación habitual puede ocasionar hipercorticoidismo e insuficiencia suprarrenal.
Tratamiento: La reducción de la dosis o la interrupción del tratamiento neutralizará estos efectos, si bien el reestablecimiento del eje hipotalámico-hipofisiario-suprarrenal puede ser un proceso lento y durante los períodos de estrés intenso (infecciones severas, traumatismos, intervenciones quirúrgicas, etc.) puede ser aconsejable suplementar el tratamiento con esteroides sistémicos.
CONDICIONES DE CONSERVACIÓN Y ALMACENAMIENTO: No almacenar a temperaturas superiores a 30 °C. Conservar en su envase original para protegerlo de la humedad.
PERIODO DE VALIDEZ: 2 años.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: Conservar en el embalaje original para protegerlo de la humedad.
Venta con receta médica.
Importado por:
BOEHRINGER INGELHEIM PERÚ S.A.C
Av. Canaval y Moreyra 480, Piso 20
San Isidro - Telf.: (51-1) 212-4132