
IDELLE
ESTRIOL
Óvulos
1 Caja , 7 Óvulos vaginales
COMPOSICIÓN:
Crema vaginal:
Cada 100 g de CREMA VAGINAL contienen:
Estriol 0,1 g
Excipientes c.s.p. 100 g
Óvulo vaginal:
Cada ÓVULO contiene:
Estriol 0,5 mg
Excipientes c.s.p. 1 óvulo
INDICACIONES:
IDELLE 0,1% Crema vaginal está indicado en:
• El tratamiento a corto plazo para la mejoría de la calidad del epitelio vaginal en la vaginitis atrófica menopáusica. Es importante usar la mínima cantidad efectiva para minimizar los efectos sistémicos.
• Tratamiento de hiperplasia endometrial: La seguridad endometrial del uso prolongado o repetido del estrógeno vaginal tópico es incierta; el tratamiento deberá ser revisado al menos anualmente, con especial consideración dado a algunos síntomas de hiperplasia o carcinoma endometrial.
• Es usado antes de la cirugía vaginal por prolapso en mujeres postmenopáusicas, cuando existe una atrofía epitelial.
ACCIÓN FARMACOLÓGICA: Estriol es una hormona sexual femenina del grupo de los estrógenos naturales. Es responsable del desarrollo sexual normal en las mujeres y de la regulación del ciclo menstrual.
Estriol puede ser empleado en el tratamiento de síntomas y molestias relacionadas con deficiencia estrogénica. Es particularmente efectivo en el tratamiento de los síntomas urogenitales. En caso de atrofia del tracto urogenital inferior, induce a la normalización del epitelio urogenital colaborando así a restaurar la microflora normal y el pH fisiológico en la vagina. Como resultado, se incrementa la resistencia de las células del epitelio urogenital a la infección y la inflamación.
Durante el uso de IDELLE 0,1% Crema vaginal, tiene lugar la absorción sistemática de estriol. Sin embargo, por lo común no dará como resultado proliferación del endometrio, si son respetadas la dosis recomendadas.
Los estrógenos son necesarios para el desarrollo de los caracteres sexuales femeninos, ellos también estimulan la hipertrofia del miometrio mediante hiperplasia endometrial.
En términos de actividad estrogénica natural los estrógenos: estradiol, estrona y estriol tienen un perfil adecuado para terapia hormonal de reemplazo que los estrógenos sintéticos (etinilestradiol y mestranol). La terapia estrogénica es administrada ciclicamente o continuamente para un número de condiciones ginecológicas. Si la terapia a largo plazo es requerida con progestágeno debera ser normalmente añadida para reducir el riesgo de hiplerplasia quística del endometrio (o de un foco endometrial en mujeres quienes tuvieron una histerectomía) y posible transformación a cáncer.
CONTRAINDICACIONES: Embarazo, cáncer estrógeno-dependiente, antecedente de cáncer de mama, tromboflebitis activa, enfermedad tromboembólica arterial activa o reciente (p. ej., angina o infarto de miocardio), tromboembolismo venoso, o antecedente de tromboembolismo venoso recurrente (a menos que tenga tratamiento anticoagulanete), enfermedad hepática (donde las pruebas de función hepática no volvieron a su normalidad), síndrome de Rubin-Johnson y Rotor (o monitorización cercana), hiperplasia endometrial no tratada, sangrado vaginal no diagnósticado, lactancia.
REACCIONES ADVERSAS: Ver Riesgo de uso prolongado (Precauciones); náusea y vómito; calambre abdominal e hinchazón; cambios de peso; aumento y sensibilidad de las mamas; síndrome parecido al menstrual; retención de sodio y líquidos; ictericia colestásica; intolerancia a la glucosa; alteraciones de lípidos en sangre-pueden conducir a pancreatitis; erupción cutánea y cloasma; cambios en el líbido; depresión; cambios de humor; dolor de cabeza; migraña; mareos; calambre de piernas (descartar trombosis venosa); candidiasis vaginal; los lentes de contacto pueden ser irritantes. Los sistemas de entrega transdermal pueden provocar sensibilización (posible reacción de hipersensibilidad severa en la exposición continua), y dolor de cabeza han sido reportadas con el ejercicio vigoroso; el spray puede causar irritación local, rinorrea y epistaxis. Hemorragia por deprivación: La terapia de reemplazo hormonal (TRH) cíclica (donde es administrado un progestágeno por un espacio de 10 a 14 días de cada ciclo de tratamiento con estrógeno de 28 días) usualmente resulta en una hemorragia por deprivación hacia el final del progestágeno. El objetivo de la TRH combinada continua (donde se toma una combinación de estrógeno y progestágeno, usualmente en una tableta simple, durante un ciclo de tratamiento de 28 días) es evitar la hemorragia, sin embargo puede ocurrir una hemorragia irregular durante las etapas de tratamiento temprano (si continúa, la anormalidad endometrial será excluida y en lugar de ello se considerará la TRH cíclica).
INCOMPATIBILIDADES: No se han descrito.
INTERACCIONES CON OTROS MEDICAMENTOS Y/O ALIMENTOS: Estriol no tiene interacciones específicas. Estriol por pertenecer al grupo de los estrógenos tienen las siguientes interacciones. Las interaciones son poco probables con dosis bajas en terapia hormonal de reemplazo.
Inhibidores de la ECA, bloqueadores adrenérgicos neuronales, bloqueadores alfa, antagonistas de los receptores de angiotensina II, beta bloqueadores, bloqueadores de los canales de calcio, clonidina, diazóxido, hidralazina, metildopa, minoxidil, moxonidina, nitratos, nitroprusiato: Los estrógenos antagonizan el efecto hipotensivo de estos medicamentos.
Amprenavir, efavirenz, tacrolimus: El efecto anticonceptivo de los estrógenos problamente es reducido por estos medicamentos.
Antibacterianos: El efecto anticonceptivo de los estrógenos posiblemente es reducido por los antibacterianos que no inducen las enzimas hépaticas.
Antidepresivos tricíclicos: Los estrógenos antagonizan el efecto de los antidepresivos tricíclicos (pero las reacciones adversas de los tricíclicos posiblemente es incrementada debido al aumento de las concentraciones plasmáticas). La hierba de San Juan (St. John’s Wort) reduce el efecto anticonceptivo de los estrógenos (evitar el uso concomitante).
Antidiabéticos: Los estrógenos antagonizan el efecto hipoglicémico de los antidiabéticos.
Antifúngicos Imidazoles, fluconazol, itraconazol, ketoconazol: Se ha reportado fracaso de los anticonceptivos cuando los estrógenos son administrados con estos medicamentos.
Aprepitant, bosentán: Posible fracaso del anticonceptivo hormonal que contiene estrógenos cuando son administrados con estos medicamentos (se recomienda otra alternativa anticonceptiva).
Barbituratos, carbamazepina, griseofulvina, modafinil, nelfinavir, nevirapina, oxcarbazepina, fenitoína, primidona, rifamicinas, ritonavir, topiramato: El metabolismo de los estrógenos es acelerado por estos medicamentos (reduciendo su efecto anticonceptivo).
Ácidos biliares: La eliminación de colesterol en la bilis es incrementada cuando los estrógenos son administrados con sales biliares.
Ciclosporina, ropinirol: Los estrógenos posiblemente incrementan la concentración plásmatica de estos medicamentos.
Fenindiona: Los estrógenos antagonizan su efecto anticoagulante.
Corticosteroides: Los anticonceptivos orales que contienen estrógenos incrementan la concentración plasmática de los corticosteroides.
Cumarinas: Los estrógenos antagonizan el efecto anticoagulante de las cumarinas.
Diuréticos: Los estrógenos antagonizan su efecto diurético.
Lamotrigina: Los estrógenos reducen su concentración plasmática.
Selegelina: Los estrógenos incrementan su concentración plasmática (incrementa el riesgo de toxicidad).
Somatropina: Los estrógenos pueden incrementar el requerimiento de dosis de somatropina (cuando son usados como terapia hormonal de reemplazo).
Terbinafina: Reportes ocasionales de sangrado cuando los estrógenos son administrados con terbinafina.
Teofilina: Los estrógenos reducen su excreción (incrementando su concentración plasmática).
ADVERTENCIAS:
• Antes de iniciar o restituir la terapia de reemplazo hormonal (TRH), deberá tomarse la historia personal médica y familiar, junto con un examen general y ginecológico completo guiado por las contraindicaciones y advertencias para su uso. Durante el tratamiento se recomiendan chequeos periódicos de una frecuencia y naturaleza adaptados a cada mujer en particular, y deberán realizarse exámenes de seguimiento de las mamas y/o mamografías de acuerdo a las prácticas actuales aceptadas para la salud de la mujer, modificadas de acuerdo con las necesidades clínicas de cada mujer.
• Si cualquiera de las condiciones siguientes están presentes, han ocurrido previamente y/o se han agravado durante la gestación o el tratamiento hormonal previo, los beneficios del tratamiento deberán ser evaluados frente a los posibles riesgos. En estos casos la paciente deberá estar estrechamente supervisada. Se debe tomar en cuenta que estas condiciones podrían, en casos raros, repetirse o agravarse durante el tratamiento con IDELLE:
— Antecedentes de desórdenes tromboembólicos o la presencia de factores de riesgo.
— Trastornos hepáticos.
— Antecedentes de hiperplasia endometrial.
— Porfiria.
— Prurito agudo.
— Ictericia colestásica.
— Herpes gestacional.
Otosclerosis.
• El uso de la terapia de reemplazo hormonal en pacientes con una historia de tromboembolismo venoso recurrente o estados trombofílicos conocidos en el tratamiento anticoagulante requieren de una consideración cuidadosa del beneficio-riesgo del uso de la terapia hormonal de reemplazo (ver Contraindicaciones).
• Con la finalidad de evitar la estimulación endometrial, la dosis diaria no deberá exceder de una aplicación (0,5 mg de estriol) ni deberá utilizarse está dosis máxima después de varias semanas.
• Para las infecciones vaginales, se recomienda un tratamiento específico concomitante.
PRECAUCIONES: Una exposición prolongada a los estrógenos no opuestos pueden incrementar el riesgo de desarrollar cáncer endometrial; migraña (o dolores de cabeza similares a la migraña); diabetes (incrementa el riesgo de enfermedad cardíaca); antecedente de nódulos en las mamas o enfermedad fibroquística-monitorización cercana del estado de la mama (riesgo de cáncer de mama); factores de riesgo por tumores estrógenos dependiente (p. ej., cáncer de mama en primer grado relativo); el fibroide uterino puede incrementarse en tamaño, los síntomas de endometriosis pueden exacerbarse; factores con predisposición a tromboembolismo; presencia de anticuerpos antifosfolípidos (riesgo incrementado de eventos trombóticos); riesgo incrementado de enfermedad reportada de vesícula biliar; tumores hipofisiarios; porfiria.
Otras condiciones: La literatura del producto aconseja precaución en otras condiciones, incluyendo hipertensión, enfermedad renal, asma, epilepsia, enfermedad drepanocítica, melanoma, otosclerosis, esclerosis múltiple y lupus eritematoso sistémico (pero requiere cuidado si presenta anticuerpos antifosfolípidos).
DOSIS Y VÍA DE ADMINISTRACIÓN
Crema: IDELLE 0,1% Crema vaginal deberá ser aplicado vía intravaginal mediante un aplicador calibrado en la noche antes de acostarse.
Una aplicación (aplicador lleno hasta la marca) contiene 0,5 g de IDELLE 0,1% Crema vaginal, que corresponde a 0,5 mg de estriol.
IDELLE 0,1% Crema vaginal es administrado intravaginalmente por medio de un aplicador dosificado. Administrar una dosis del aplicador diariamente por 2 a 3 semanas, luego reducir la dosis a dos veces por semana, suspender cada 2 a 3 meses por 4 semanas hasta evaluar la necesidad de continuar el tratamiento.
• Cirugía vaginal: Administrar una dosis del aplicador diariamente por 2 semanas antes de la cirugía y continuar 2 semanas después de la cirugía.
Óvulos: Introducir un óvulo diario, de preferencia por la noche, hasta que se presente una mejoría; continuar con el tratamiento de un óvulo dos veces por semana; los intentos para reducir o discontinuar el tratamiento deberán hacerse en intervalos de 3 a 6 meses con un nuevo examen.
IDELLE 0,5 mg Óvulo vaginal deberá introducirse de manera intravaginal antes de acostarse. Si olvida administrarse una dosis, ésta deberá aplicarse tan pronto como se recuerde, salvo que se dé cuenta de la dosis olvidada el día de la siguiente dosis. En último caso, deberá saltearse la dosis olvidada y continuar con la dosis regular. No deberá administrarse dos dosis el mismo día.
INSTRUCCIONES DE USO:
Aplicarse la crema en la noche, antes de acostarse.
El aplicador debe prepararse en el momento
Instrucciones para el uso del aplicador
Retirar el aplicador de su envase original. Desenroscar la tapa del tubo, inviértala y úsela para abrir el tubo. Enroscar el aplicador en la boca del tubo.
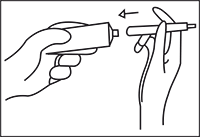
Presionar suavemente en la parte inferior del tubo hasta que la crema llene el aplicador hasta la primera marca (0,5 g). Desenroscar el aplicador del tubo sin presionar el émbolo. Cerrar el tubo.
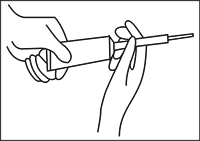
Recostada, introducir suavemente el aplicador a la vagina lo más profundo como sea tolerado y presionar lentamente el émbolo hasta aplicar toda la crema.

Limpieza del aplicador: Retirar el aplicador vacío y lavarlo bien con agua jabonosa tibia. Enjuagar bien. No usar detergentes. Secar con papel adsorbente limpio y guardar protegido el aplicador limpio y seco hasta su próximo uso.
TRATAMIENTO EN CASO DE SOBREDOSIS: Debido a que no existe un antídoto específico, el tratamiento de la sobredosis o de las reacciones tóxicas deberán ser sintomáticas y de soporte.
FORMAS DE PRESENTACIÓN:
Crema: Cajas con 1 tubos x 15 g con aplicador vaginal respectivamente.
Óvulos: Cajas con 7 óvulos vaginales.
MEDIFARMA S.A.
Edificio Plaza República
Av. Rep. de Colombia 791 Piso 10 - San Isidro
Telf.: 207-0000
www.medifarma.com.pe