GYNODIAN DEPOT
ESTRADIOL, PRASTERONA
Solución inyectable
1 Caja, 1 Ampolla, 1 Jeringa prellenada, 1 Mililitros
COMPOSICIÓN:
Principios activos: Enantato de prasterona, valerato de estradiol.
Excipientes: Benzoato de bencilo, aceite de ricino uso inyectable c.s.
Forma galénica y cantidad de principio activo por unidad: Jeringa prellenada y ampolla: 200 mg de enantato de prasterona y 4 mg de valerato de estradiol por 1 ml.
INDICACIONES/POSIBILIDADES DE USO:
Terapia de reemplazo hormonal para el tratamiento sintomático de insuficiencias de estrógeno como consecuencia de menopausia natural o quirúrgica, incluyendo los cambios de humor resultantes en pacientes en las que no se puede realizar la sustitución estrogénica oral o transdérmica habitual.
En el caso del tratamiento de mujeres con el útero intacto se debe prevenir el riesgo de hiperplasia endometrial a través de la administración adicional de un gestágeno.
CONTRAINDICACIONES:
La terapia de reemplazo hormonal (TRH) no debe iniciarse en presencia de alguna de las enfermedades enumeradas a continuación o deberá interrumpirse inmediatamente en caso de que se presente alguna de ellas:
– Carcinoma de mama existente o sospechado,
– Tumores dependientes de hormonas sexuales existentes o sospechados,
– Hiperplasia endometrial no tratada,
– Hemorragia vaginal no aclarada,
– Tumores de hígado existentes o antecedentes de tumores de hígado benignos o malignos,
– Trastornos hepáticos graves,
– Trastornos tromboembólicos venosos o antecedentes de estas afecciones (p. ej. trombosis venosa profunda, embolia pulmonar),
– Trastornos tromboembólicos arteriales agudos o recientemente aparecidos (accidente cerebrovascular, infarto de miocardio),
– Presencia de factores de riesgo para la aparición de trombosis venosa o arterial, en especial trastornos trombofílicos (como p. ej. deficiencia de antitrombina, de proteína C o de proteína S),
– Hipertrigliceridemia grave,
– Embarazo y lactancia,
– Hipersensibilidad a algún componente de GYNODIAN DEPOT.
EMBARAZO Y LACTANCIA:
El empleo de GYNODIAN DEPOT durante el embarazo y la lactancia está contraindicado. Si durante la administración de GYNODIAN DEPOT se gesta un embarazo o existen sospechas de embarazo, se debe interrumpir inmediatamente la administración del medicamento y se debe consultar al médico.
Existe advertencia de riesgos fetales basada en estudios experimentales en animales. Sin embargo, la mayoría de los estudios epidemiológicos efectuados hasta hoy no arrojan ninguna indicación unívoca de efectos embriotóxicos o teratógenos si se administran estrógenos o combinaciones de ellos o combinaciones de hormonas sexuales accidentalmente durante el embarazo.
Pueden secretarse pequeñas cantidades de estradiol y sus metabolitos en la leche materna. No se dispone de información relativa a la excreción de enantato de prasterona en la leche materna.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y DE USO DE MÁQUINAS:
No se ha realizado ningún estudio. Sin embargo, no se espera ningún efecto negativo de GYNODIAN DEPOT a este respecto (no obstante, véase Reacciones adversas).
REACCIONES ADVERSAS:
En la sección de Advertencias y precauciones se describen las reacciones adversas más graves asociadas al uso de terapias de reemplazo hormonal (véase allí).
A continuación se indican las reacciones adversas que fueron informadas asociadas a la toma de preparados de TRH. En ello, las categorías de frecuencia se encuentran definidas del siguiente modo: muy frecuentes ≥ 1/10; frecuentes ≥ 1/100 a < 1/10; poco frecuentes ≥ 1/1000 a < 1/100; raras≥ 1/10‘000 a < 1/1000.
Neoplasias:
• Poco frecuentes: Carcinoma de mama.
Sistema inmunológico:
• Poco frecuentes: Reacción de hipersensibilidad
Metabolismo y nutrición:
• Frecuentes: Aumento de peso
• Poco frecuentes: Apetito reducido o incrementado, pérdida de peso
Trastornos psiquiátricos
• Frecuentes: Labilidad emocional, nerviosismo, depresión
• Poco frecuentes: Modificaciones de la líbido
• Raras: Ansiedad
Sistema nervioso
• Frecuentes: Dolor de cabeza
• Poco frecuentes: Trastornos del sueño, migrañas
• Raras: Mareos
Vasos sanguíneos
• Poco frecuentes: Aumento de presión
• Raras: Trastornos tromboembólicos venosos (infarto de miocardio, derrame cerebrovascular, trombosis venosa profunda, embolia pulmonar)
Trastornos gastrointestinales
• Frecuentes: Dolor estomacal, náuseas
• Poco frecuentes: Gases, vómitos
Hígado/bilis
• Poco frecuentes: Modificación de los valores hepáticos
• Raras: Cholelithiasis
Piel
• Poco frecuentes: Erupciones de la piel, prurito, acné, hirsutismo, alopecia
Sistema musculoesquelético
• Poco frecuentes: Calambres musculares
Aparato reproductor y mama
• Muy frecuentes: Sensación de tensión en las mamas, dolor mamario, anomalías del sangrado
• Frecuentes: Fluor vaginalis, aumento de tamaño de las mamas.
• Poco frecuentes: Molestias vulvovaginales, dolor abdominal, aumento de tamaño de miomas de útero, pólipos cervicales
Trastornos generales
• Frecuentes: Astenia, edemas periféricos
Luego del lanzamiento al mercado, se informaron además los siguientes efectos adversos de GYNODIAN DEPOT: disfonía, eczema, urticaria, eritema nodoso, reacciones en la zona de aplicación.
En mujeres que padecen angioedema hereditario, la administración de estrógenos exógenos puede inducir o exacerbar los síntomas de angioedema.
PROPIEDADES/EFECTOS:
Código ATC: G03EA03
Farmacodinámica:
• Valerato de estradiol: El valerato de estradiol es un precursor a partir del cual se forma el estradiol. La esterificación del estradiol justifica la liberación retardada del depósito inyectado. El estradiol es, de todos los estrógenos fisiológicos, el más potente y tiene la afinidad más fuerte con los receptores de estrógenos. Los órganos diana de estrógenos abarcan sobre todo el útero, el hipotálamo, la hipófisis, la vagina, las mamas y los huesos (osteoclastos).
Bajo GYNODIAN DEPOT aumenta notablemente la eliminación de estrógenos por la orina y los niveles de gonadotropinas se reducen a los valores usualmente esperados durante la etapa de madurez sexual. El efecto antigonadotrópico se mantiene, luego de la inyección, por un promedio de 28 días.
Independientemente de la vía de administración, el estradiol estimula la mitosis y la proliferación del endometrio de forma dosis-dependiente. A fin de evitar una hiperplasia del endometrio y el consecuente aumento del riesgo de cáncer endometrial, en las mujeres posmenopáusicas no histerectomizadas se debe complementar el tratamiento de sustitución con estrógenos con un gestágeno.
• Enantato de prasterona: El enantato de prasterona se libera lentamente a partir del depósito inyectado y se hidroliza completamente en el esteroide fisiológico deshidroepiandrosterona (DHEA) y en el enantato. La DHEA se puede transformar en esteroides andrógenos (androstendiona, androstendiol, testosterona) y en estrógenos (estrona, estradiol).
Mecanismo de acción:
• Resultados clínicos: GYNODIAN DEPOT elimina o mejora las insuficiencias de estrógenos típicas del climaterio, como síntomas vasomotores (oleadas de calor, sudoración), cambios de humor y trastornos del sueño. Alivia también las molestias urogenitales asociadas con modificaciones atróficas. Además, GYNODIAN DEPOT tiene un efecto positivo sobre la psique y la vitalidad. Este efecto psicotrópico y el posible efecto estimulador de la libido se le atribuyen a la prasterona contenida en GYNODIAN DEPOT; no obstante, no existen pruebas de que una combinación de estrógenos y andrógenos sea efectiva en casos de síntomas nerviosos o estados depresivos que no estén asociados a síntomas vasomotores. GYNODIAN DEPOT no está indicado para el tratamiento de dichos estados. GYNODIAN DEPOT hace efecto casi siempre ya a los pocos días de la inyección y su efecto dura, por término medio, durante 4 a 6 semanas.
Hasta ahora no existen datos sobre un posible efecto inhibidor de GYNODIAN DEPOT sobre la aparición y el avance de una osteoporosis posmenopáusica. Farmacocinética
Farmacocinética:
• Valerato de estradiol:
– Absorción: El valerato de estradiol se absorbe completamente, pero de manera retardada a partir del depósito oleoso intramuscular y alcanza su nivel plasmático máximo entre el tercer y el quinto día después de su administración. El valerato de estradiol de GYNODIAN DEPOT es completamente biodisponible.
– Distribución: En el plasma el estradiol se encuentra principalmente unido a proteínas. Aproximadamente el 37% se fija a la SHBG y el 61% a la albúmina. Es poco probable acumulación de estradiol.
El estradiol es de transferencia placentaria y tanto el estradiol mismo como así también sus metabolitos pueden excretarse en pequeñas cantidades a la leche materna.
– Metabolismo: Las estearasas en el plasma y en el hígado descomponen rápida y completamente el valerato de estradiol en estradiol y ácido valérico. La posterior descomposición del ácido valérico por medio de ß-oxidación lleva a la formación de unidades C2 y resulta en la formación de CO2 y agua como productos finales.
El propio estradiol es sometido a diversos pasos de hidroxilación. Sus metabolitos, así como la sustancia inalterada, son finalmente conjugados. Los productos intermedios del metabolismo son estrona y estriol, los cuales muestran una débil actividad estrogénica propia, por lo que su acción no es tan pronunciada como la del estradiol.
La relación entre las cantidades de los tres esteroides se asemeja a las condiciones fisiológicas.
– Eliminación: El estradiol y sus metabolitos se excretan principalmente por los riñones (relación orina: heces = 9:1). La semivida del estradiol en plasma luego de la administración intramuscular de valerato de estradiol es de 4 a 5 días.
• Enantato de prasterona (enantato de deshidroepiandrosterona):
– Absorción: El enantato de prasterona es completamente biodisponible a partir de su depósito oleoso intramuscular y la absorción tiene lugar dentro de los 30 días posteriores a la aplicación. La inyección intramuscular de 200 mg de enantato de prasterona da lugar a niveles plasmáticos máximos de aprox. 9 ng/ml en un periodo de 1 a 4 días. La concentración disminuye de acuerdo con la tasa de liberación a partir del depósito y de la velocidad de hidrólisis del éster, con una semivida de aprox. 9 días. Después de aprox. 18 días se alcanzan nuevamente los niveles fisiológicos de prasterona. El efecto del depósito, en términos de niveles plasmáticos claramente detectables, se mantiene durante 18 días.
– Distribución: Solo alrededor del 4% de la concentración total de prasterona se presenta como esteroide libre, alrededor del 90% de la concentración total se fija a la albúmina, el resto se fija con menor afinidad a la SHBG. El volumen de distribución central de la DHEA alcanza 17 a 34 l.
No se sabe si la prasterona atraviesa la placenta o si pasa a la leche materna.
– Metabolismo: El enantato de prasterona se convierte por hidrólisis completa en prasterona y ácido enántico. La prasterona misma se comporta exactamente como la deshidroepiandrosterona endógena y se metaboliza rápidamente.
– Eliminación: Después de la administración intravenosa, la semivida de eliminación en el plasma es de aprox. 44 minutos. La prasterona inalterada solo se excreta con la orina en una proporción escasa y después de su conjugación. La mayor parte es metabolizada y conjugada. La principal vía de excreción es también a través de los riñones. En una proporción del 99%, los metabolitos urinarios son conjugados hidrosolubles.
Un 91% de la dosis administrada es excretada al cabo de 30 días con la orina (94%) y con las heces (6%). La semivida de eliminación de los metabolitos es de aprox. 3,6 días.
Cinética en situaciones clínicas especiales: Hasta ahora no se han realizado estudios sobre la influencia de las limitaciones funcionales del hígado y los riñones sobre el nivel del principio activo en plasma; no obstante se sabe que la eliminación metabólica de los estrógenos y los andrógenos en pacientes con trastornos de la función hepática se ralentiza (véase Contraindicaciones).
INTERACCIONES:
Se puede reforzar el metabolismo de los estrógenos mediante la administración concomitante de sustancias que inducen enzimas metabolizadoras de fármacos, sobre todo la enzima citocromo P450. Entre estas sustancias se incluye, entre otros, barbitúricos, carbamazepina, felbamato, griseofulvina, hidantoína, oxcarbazepina, primidona, rifampicina, topiramato y hierba de San Juan (hipérico). Clínicamente, un aumento del metabolismo de los estrógenos puede ocasionar una reducción de la eficacia y/o irregularidades del sangrado.
El ritonavir y el nelfinavir, cuando se administran junto con hormonas esteroides, también tienen propiedades de estimulación enzimática, aunque se conocen como fuertes inhibidores enzimáticos.
De forma inversa, la eficacia de GYNODIAN DEPOT puede verse reforzada por la administración simultánea de inhibidores enzimáticos (p. ej. antifúngicos azoles, macrólidos).
Con la aplicación intramuscular de la hormona se evita el efecto de primer paso hepático (first pass). Probablemente por eso, el metabolismo de GYNODIAN DEPOT se ve menos influenciado por inductores enzimáticos que por la administración oral de preparados.
De forma inversa, las hormonas sexuales pueden influir también en la metabolización de otros medicamentos. De la misma forma las concentraciones de plasma pueden aumentar (p. ej. benzodiazepina, ciclosporina, imipramina, metoprolol) o disminuir (p. ej. lamotrigina, véase abajo).
Un estudio sobre la interacción con lamotrigina, un antiepiléptico, y un contraceptivo combinado oral (30 µg etinilestradiol/150 µg levonorgestrel) mostró un aumento clínicamente relevante del clearance de lamotrigina con una reducción respectivamente significativa de los niveles plasmáticos de lamotrigina cuando estos dos medicamentos son administrados simultáneamente. Esta clase de reducción de las concentraciones plasmáticas puede ir acompañada de un control reducido de los ataques.
No se examinaron otros contraceptivos hormonales y terapias de reemplazo hormonal. No obstante, se espera que tales preparados presenten un potencial de interacción comparable. Si se inicia un tratamiento con GYNODIAN DEPOT por primera vez en una paciente que toma lamotrigina, puede requerirse una adecuación de la dosis de lamotrigina y, al comienzo de la terapia, se deberían monitorizar estrechamente las concentraciones de lamotrigina.
A este respecto se debe tener especialmente en cuenta que al finalizar el tratamiento con GYNODIAN DEPOT puede tener lugar un aumento de los niveles de lamotrigina (alcanzando, en ciertas circunstancias, el rango tóxico).
Además puede aumentar el efecto de anticoagulantes orales administrados simultáneamente.
Pueden modificarse las necesidades de antidiabéticos orales o de insulina por la influencia sobre la tolerancia a la glucosa.
ADVERTENCIAS Y PRECAUCIONES:
Toda terapia de reemplazo hormonal debe estar precedida por un examen del estado clínico general y por un examen ginecológico exhaustivo que se debe repetir, como mínimo, una vez al año. Del mismo modo, se debe tener en cuenta el historial clínico personal y familiar. Se debe sopesar cuidadosamente la relación riesgo-beneficio antes de cada tratamiento y para cada paciente en particular. Se debe elegir siempre la dosis mínima eficaz y la duración de tratamiento más breve posible.
Razones para una inmediata interrupción de la terapia: Se debe desistir de administrar más inyecciones de GYNODIAN DEPOT si durante la terapia se presenta alguna de las contraindicaciones mencionadas más arriba o si se presenta alguna de las siguientes situaciones:
– Síntomas de un trastorno tromboembólico venoso o arterial o sospecha de dicha afección;
– Primera aparición o aparición reiterada de fuertes dolores de cabeza no habituales o de tipo migraña;
– Pérdida de agudeza visual repentina parcial o completa;
– Alteraciones auditivas repentinas;
– Aumento significativo de la presión sanguínea;
– Deterioro de la función hepática o aparición de hepatitis, ictericia o prurito por colestasis;
– Crecimiento reconocible de miomas;
– Aumento de ataques de epilepsia;
– Embarazo.
Circunstancias que requieren de un examen especial: Si existen las siguientes molestias, si se han presentado hace poco o si han empeorado durante el embarazo o durante un tratamiento hormonal anterior, la paciente debe ser examinada exhaustivamente. Se debe tomar en consideración que estas molestias pueden volver a aparecer o empeorar durante el tratamiento con GYNODIAN DEPOT:
– Modificaciones benignas en las mamas;
– Hiperplasia endometrial (también en la historia clínica);
– Factores de riesgo para tumores estrógenodependientes (p. Ej. Carcinoma de mama en parientes de 1er grado);
– Miomas o endometriosis;
– Hipertensión;
– Migrañas;
– Diabetes mellitus con compromiso vascular;
– Trastornos hepáticos o de vesícula biliar;
– Porfiria;
– Asma;
– Epilepsia;
– Corea menor;
– Lupus eritematoso sistémico;
– Otosclerosis.
En caso de empeoramiento o ante la primera aparición de las condiciones o los factores de riesgo enunciados a continuación se debe analizar la relación individual riesgo-beneficio y, dado el caso, finalizar la terapia.
• Afecciones tumorales:
– Cáncer de mama: Estudios randomizados controlados y estudios epidemiológicos han revelado un aumento del riesgo de cáncer de mama en mujeres que han realizado una TRH durante varios años. Por ello, todas las mujeres deben someterse a un examen mamario efectuado por el médico antes del inicio de la TRH y anualmente, y realizar un autoexamen de las mamas mensualmente. En función de la edad y los respectivos factores de riesgo, se puede prescribir adicionalmente una mamografía.
Un metaanálisis de 51 estudios epidemiológicos reveló que el riesgo de sufrir cáncer de mama aumenta junto con la duración de la TRH y disminuye al suspenderla. El riesgo relativo de sufrir cáncer de mama fue de 1,35 (95% Cl 1,21-1,49) para mujeres que realizaron una TRH durante 5 años o más.
El estudio WHI mostró que en comparación con placebo, el tratamiento combinado de TRH conjugado con estrógenos y acetato de medroxiprogesterona (AMP) después de un tiempo medio de 5,6 años de tratamiento se daba un aumento de carcinomas de mama invasivos en el grupo estrógeno/gestágeno (riesgo relativo 1,24 [95% Cl 1,02-1,50]). Se desconoce si para otros preparados de TRH combinados existe un riesgo comparable. Por el contrario, en el caso de la monoterapia con estrógenos el riesgo no había aumentado (riesgo relativo 0,77 [95% Cl 0,59-1,01]).
El Million Woman Study, un estudio de cohortes no randomizado, reclutó 1.084.110 mujeres. La edad promedio de las mujeres para entrar a formar parte del estudio era de 55,9 años. La mitad de las mujeres recibió antes o en el momento de inicio del estudio una TRH, el resto de las mujeres nunca fueron tratadas con TRH. Se registraron 9364 casos de carcinoma de mama invasivo y 637 fallecimientos como consecuencia de cáncer de mama luego de un tiempo de observación medio de 2,6 y 4,1 años. Las mujeres que al incorporarse al estudio recibieron TRH mostraron, en comparación con las mujeres que nunca recibieron tal tratamiento, un mayor riesgo respecto de la morbilidad (1,66 [95% Cl 1,58-1,75]) y, posiblemente, en menor medida también respecto de la morbilidad a consecuencia de cáncer de mama (1,22 [95% Cl 1,00-1,48]). El mayor riesgo se observó bajo terapia combinada de estrógenos-gestágenos (2,00 [95% Cl 1,88-2,12]). Para la monoterapia con estrógenos el riesgo relativo fue de 1,30 (95% Cl 1,21-1,40). Los resultados fueron similares para diversos estrógenos y gestágenos, para diferentes dosificaciones y vías de administración y para terapias continuas y secuenciales. En todas las clases de TRH, el riesgo aumenta con la prolongación de la duración de la aplicación. Luego de suspender la terapia, el riesgo disminuye (última aplicación antes > 5 años: riesgo relativo 1,04 [95% Cl 0,95-1,12]).
– Hiperplasia endometrial y carcinoma endometrial: Con la administración de estrógenos a largo plazo aumenta el riesgo de desarrollo de hiperplasia endometrial o carcinoma. El riesgo parece depender de la duración del tratamiento y de la dosis de estrógenos, el riesgo mayor parece ir aparejado de una aplicación de duración más prolongada. Los estudios indican que el aumento de este riesgo se puede reducir en gran medida con la administración adicional de un gestágeno.
Se requiere una monitorización médica de todas las mujeres que realizan una TRH. Todos los casos de hemorragias anormales (sangrados irregulares, fuertes o persistentes, inclusive sangrado de tono amarronado fuera del ciclo menstrual) se deben aclarar mediante medidas de diagnóstico adecuadas (dado el caso incluso con un examen histológico del endometrio) para descartar una causa orgánica o un resultado maligno.
• Cáncer de ovario: Algunos estudios epidemiológicos indican que un tratamiento a largo plazo con un preparado que contenga solamente estrógenos (más de 5 a 10 años) está relacionado con un aumento del riesgo de desarrollo de cáncer de ovario. En algunos estudios, incluso en el estudio WHI, se indica que el riesgo relativo a una administración durante un periodo prolongado de una TRH combinada es el mismo o incluso un poco inferior.
– Tumor hepático: En casos poco frecuentes, luego de la administración de sustancias hormonales, tales como las que contiene GYNODIAN DEPOT, se han observado tumores hepáticos benignos y, con menos frecuencia si cabe, malignos, que en casos aislados han provocado hemorragias en la cavidad abdominal con peligro para la vida de la paciente. Si se presentan molestias epigástricas severas, aumento del tamaño del hígado o signos de hemorragia intraabdominal, se debe considerar la posibilidad de un tumor hepático en el diagnóstico diferencial y, dado el caso, interrumpir la administración del preparado e iniciar un tratamiento adecuado.
• Trastornos tromboembólicos
– Enfermedades coronarias y accidente cerebrovascular: No se debería implementar una TRH como prevención de enfermedades cardiovasculares. Importantes estudios clínicos arrojan que no hay ningún efecto favorable en la profilaxis primaria (estudio WHI) o secundaria (estudio HERS) de enfermedades cardiovasculares. El estudio Women"s Health Initiative (WHI), un estudio a gran escala, prospectivo, controlado con placebos y randomizado, mostró en más de 8000 mujeres mayores posmenopáusicas (edad al inicio del estudio 50 a 79 años, edad promedio 63 años), que recibieron una TRH oral con estrógenos conjugados y acetato de medroxiprogesterona (AMP) por un tiempo medio de 5,2 años, frente al placebo, un aumento del riesgo de trastornos cardiovasculares (riesgo relativo [RR] 1,24 [95% Cl 1,00-1,54], aumento absoluto del riesgo 6 casos por 10.000 personas/años). El riesgo más elevado se registró en el primer año luego del inicio de la TRH (RR 1,81 [95% Cl 1,09-3,01]). A medida que aumenta la distancia respecto de la menopausia, el riesgo se incrementa (menopausia < 10 años: RR 0,89; menopausia 10-19 años: RR 1,22; menopausia ≥ 20 años: RR 1,71). En el brazo de monoterapia con estrógenos no se observó ninguna influencia significativa sobre el riesgo cardiovascular (RR 0,91 [95% Cl 0,75-1,12]).
El riesgo cerebrovascular aumentó tanto en el estudio WHI bajo terapia combinada de estrógenos-gestágenos (RR 1,31 [95% Cl 1,02-1,68]) como así también en la monoterapia con estrógenos (RR 1,39 [95% Cl 1,10-1,77]).
El Heart and Estrogen/Progestin Replacement Study (HERS y HERS II), un estudio prospectivo, controlado con placebos y randomizado, mostró en más de 1300 mujeres posmenstruales con enfermedad coronaria ya existente (edad media al incorporarse al estudio 67 años), que recibieron una TRH oral con estrógenos conjugados y acetato de MPA durante un promedio de 4,1 años (HERS) y 2,7 años (HERS II), que no hubo ninguna reducción del riesgo cardiovascular. El riesgo relativo fue de 0,99 (95% Cl 0,84-1,17). El riesgo más elevado se registró en el primer año luego del inicio de la TRH (RR 1,52 [95% Cl 1,01-2,29]).
A pesar de que no está claro en qué medida se pueden extrapolar los resultados de estos dos estudios a una población más joven o a preparados para TRH con otros principios activos (como GYNODIAN DEPOT), estos deben ser contemplados por el médico al prescribir una TRH. En el caso de mujeres que ya presentan factores de riesgo para la aparición de afecciones cardiovasculares o cerebrovasculares, se deben tomar en consideración terapias alternativas.
– Tromboembolismo venoso (TEV): La terapia de reemplazo hormonal está vinculada a un aumento del riesgo de trastornos tromboembólicos venosos (p. ej. trombosis venosa profunda, embolia pulmonar). Dos estudios controlados randomizados (HERS y WHI) y varios estudios epidemiológicos revelan un riesgo doble a triplemente aumentado en mujeres que realizaron una TRH en comparación con mujeres que nunca recibieron un tratamiento de este tipo. El estudio WHI arrojó un especial aumento de la incidencia de embolia pulmonar. El aumento absoluto del riesgo en mujeres tratadas con TRH alcanzó 8 casos por 10.000 personas/años (15 vs. 7), el riesgo relativo 2,13 (95% Cl 1,39-3,25).
El aumento del riesgo se detectó en mujeres bajo tratamiento de reemplazo hormonal y no se presentó en mujeres a las que se les había administrado con anterioridad. El riesgo parece ser mayor en los primeros años de administración.
También en el brazo de monoterapia con estrógenos del estudio WHI, el riesgo de un tromboembolismo venoso había aumentado tendenciosamente. El riesgo relativo de una trombosis venosa profunda alcanzó 1,47 [95% Cl 0,87-2,47], el de una embolia pulmonar 1,34 [95% Cl 0,70-2,55].
En el caso de mujeres no usuarias de esta terapia, el número de casos de TEV, durante un período de tiempo de 5 años, se estima en 3 de cada 1000 mujeres para el grupo etario de 50 a 59 años y en 8 de cada 1000 mujeres para el grupo etario de 60 a 69 años. En el caso de mujeres sanas que realizan una TRH por más de 5 años, se presentan de 2 a 6 casos adicionales por cada 1000 en el grupo etario de 50 a 59 años y 5 a 15 casos adicionales en el grupo etario de 60 a 69 años. En caso de presentarse los síntomas correspondientes o de sospecha de TEV, se debe interrumpir el tratamiento inmediatamente. Las pacientes con factores de riesgo de afecciones tromboembólicas deben ser controladas cuidadosa y exhaustivamente. En el caso de estas mujeres, la relación riesgo-beneficio se debe sopesar cuidadosamente y, de ser posible, considerar la posibilidad de otras terapias. Los factores de riesgo de tromboembolismo venoso incluyen la correspondiente historia clínica personal y familiar (es decir, ocurrencia de TEV en un paciente cercano en edad relativamente temprana), el tabaquismo, la obesidad, el lupus eritematoso sistémico y las afecciones malignas. Más allá de ellos, el riesgo de TEV aumenta con la edad.
Un historial clínico con abortos espontáneos reiterados debe ser aclarado para descartar una predisposición a la trombofilia. En mujeres con este diagnóstico, la administración de una terapia de reemplazo hormonal se encuentra contraindicada.
En mujeres que presentan una combinación de factores de riesgo o un mayor novel de gravedad de un factor de riesgo en particular, se debería considerar que el riesgo puede aumentar de modo sobreaditivo. En ciertas circunstancias, puede derivarse de ello una contraindicación para una terapia de reemplazo hormonal.
El riesgo de TEV puede verse elevado temporalmente por una inmovilización prolongada, una cirugía mayor o un traumatismo severo. En mujeres con reemplazo hormonal se debe poner mayor atención en las medidas profilácticas para evitar el tromboembolismo venoso luego de intervenciones quirúrgicas. Dependiendo de la naturaleza de la intervención y de la duración de la inmovilización, se debe considerar interrumpir temporalmente la TRH; en caso de una intervención quirúrgica programada, interrumpir, de ser posible, unas semanas antes de la intervención (4 a 6 semanas). El tratamiento solo de deberá reanudar cuando la paciente esté totalmente movilizada.
• Signos de virilización: Pueden aparecer manifestaciones de hirsutismo en cara y piernas, o modificaciones en la voz. Como se ha comprobado, este tipo de manifestaciones de virilización pueden presentarse también espontáneamente durante el climaterio. Sin embargo, se debe advertir sobre los efectos andrógenos de la DHEA como principio activo de GYNODIAN DEPOT. Durante la terapia se debe controlar especialmente a las pacientes que se verían impedidas en el ejercicio de su profesión por una limitación de la voz o del canto. Ante el primer signo de modificación de la voz (cansancio fácil de la voz, aspereza, ronquera), se recomienda interrumpir el tratamiento.
• Demencia: En el Women"s Health Initiative Memory Study (WHIMS), un estudio randomizado, controlado con placebos y subordinado al estudio WHI, fueron tratadas 2229 mujeres de > 65 años (distribución de edades: 65 a 69 años: 47%; 70 a 74 años: 35%; > 75 años: 18%) con estrógenos equinos conjugados y acetato de medroxiprogesterona orales y monitorizadas por un tiempo promedio de 4 años.
Además, 1464 mujeres histerectomizadas de 65 a 79 años fueron tratadas con estrógenos equinos conjugados orales solamente y controladas durante 5,2 años de promedio. Ni el tratamiento con estrógenos conjugados y acetato de medroxiprogesterona ni la monoterapia con estrógenos reveló un efecto favorable sobre la función cognitiva. Se halló un aumento del riesgo de aparición de disfunciones cerebrales para la TRH combinada (riesgo relativo 2,05 [95% Cl 1,21-3,48]). En números absolutos, esto significa 23 casos adicionales cada 10.000 mujeres tratadas por año. También se halló una tendencia similar en el grupo tratado con EEC en monoterapia (riesgo relativo 1,49 [95% Cl: 0,83-2,66]).
A pesar de que no está claro en qué medida se pueden extrapolar estos resultados a una población más joven o a preparados para TRH con otros principios activos, estos deben ser contemplados por el médico al evaluar la relación riesgo-beneficio de una TRH.
• Otras afecciones: Los estrógenos pueden ocasionar retención de líquidos. Las pacientes con afecciones que podrían verse agravadas por este hecho (como insuficiencia cardíaca o renal, asma, epilepsia o migraña), deben ser monitorizadas por esta razón con sumo cuidado.
Las mujeres con disfunción hepática, incluyendo hiperbilirrubinemia como síndrome de Dubin Johnson y de Rotor, se deben supervisar estrechamente. La función hepática debería ser controlada periódicamente. En caso de que los valores hepáticos llegaren a empeorar, se debe cancelar la TRP de inmediato.
En el caso de mujeres con trastornos hepáticos en su historia clínica, se debería implementar una terapia de reemplazo hormonal luego de una cuidadosa ponderación de la relación riesgo-beneficio. Tras la remisión de una hepatitis vírica (es decir: normalización de los parámetros hepáticos) deben transcurrir aproximadamente seis meses antes de utilizar preparados como GYNODIAN DEPOT.
Los estrógenos pueden elevar la litogenicidad de la bilis. Por eso, en algunas mujeres, el riesgo de enfermedades biliares (sobre todo cholelithiasis) se ve aumentado con una terapia con estrógenos.
En el caso de pacientes con prolactinoma previo, se requiere un estrecho control médico (incluso el análisis periódico de los niveles de prolactina), dado que, en casos particulares, se ha informado un aumento del tamaño de prolactinomas bajo una terapia con estrógenos.
Hasta el momento no se ha documentado una relación definitiva entre la aplicación de una TRH y la hipertensión clínica. Se ha observado un ligero aumento de la presión sanguínea en mujeres bajo TRH, pero un aumento clínicamente relevante es infrecuente. Si durante una TRH se observara un aumento duradero de los valores de la presión arterial, se debe considerar la cancelación de la TRH.
Estudios clínicos muestran una influencia de la TRH sobre la resistencia periférica a la insulina y la tolerancia a la glucosa. A pesar de ello, por lo general no se requiere una adecuación de la terapia antidiabética. Sin embargo, en pacientes diabéticas bajo TRH se deberían controlar cuidadosamente los niveles glucémicos.
Las mujeres con hipertrigliceridemia ya existente deben ser monitorizadas estrechamente durante una terapia de reemplazo hormonal, dado que, en casos poco frecuentes, se ha informado de un fuerte aumento de los triglicéridos asociado a una terapia con estrógenos, que trae aparejado un elevado riesgo de pancreatitis.
En algunas pacientes, durante una TRH, pueden presentarse reacciones adversas a consecuencia de la estimulación de los estrógenos, como sangrados no habituales. Las hemorragias frecuentes o continuamente irregulares son signos de una actividad endometrial y deben esclarecerse a través de medidas de diagnóstico adecuadas para descartar afecciones orgánicas.
Los miomas de útero pueden aumentar de tamaño con una terapia con estrógenos. Si se llegare a observar esto, se debe interrumpir el tratamiento de inmediato.
Si, bajo una TRH, se reactivara una endometriosis, se recomienda interrumpir la terapia.
Ocasionalmente se puede presentar cloasma, sobre todo en mujeres con antecedentes de cloasma gravídico. Por eso, en caso de propensión al cloasma se deben evitar la luz solar y otras radiaciones UV durante el tratamiento con GYNODIAN DEPOT.
GYNODIAN DEPOT no tiene efecto anticonceptivo. Durante la TRH se deberían suspender los anticonceptivos hormonales. Dado el caso, para la anticoncepción se deben implementar métodos no hormonales.
Los riesgos de una HRT arriba indicados fueron descriptos principalmente en el tratamiento de mujeres de ≥ 50 años de edad. No existen datos sobre la transferibilidad de estos datos a pacientes con menopausia prematura (es decir: cese de la función ovárica antes de completar los 40 años de edad como consecuencia de enfermedades endócrinas/genéticas, ooforectomía, terapia de neoplasias malignas, etc.) hasta alcanzar la edad de menopausia normal. En este grupo etario debería ponderarse especialmente la relación riesgo-beneficio, tomando en consideración también la etiología de la menopausia prematura (quirúrgica vs. otras causas).
El diagnóstico y la aplicación de la terapia en pacientes con menopausia prematura deberían realizarse, de ser posible, en un centro especializado en el tratamiento de estos cuadros clínicos.
Durante el tratamiento se debe evitar el embarazo (véase Embarazo y lactancia).
A las mujeres deportistas se les debe advertir que este médicamente contiene un principio activo (prasterona) que puede generar una reacción positiva en un control antidopaje.
OTRAS ADVERTENCIAS:
Influencia en métodos diagnósticos: Las hormonas sexuales pueden influir en los resultados de ciertas pruebas de laboratorio, como p. ej. parámetros bioquímicos del hígado, tiroides, función suprarrenal y renal, concentración plasmática de proteínas de unión y fracción lipídica/lipoproteína, parámetros del metabolismo de los hidratos de carbono, de la coagulación y de la fibrinolisis.
Los medicamentos se deben guardar en un lugar seguro y fuera del alcance de los niños.
Vida útil: Ampolla: 48 meses/Jeringa prellenada: 36 meses
El medicamento debe utilizarse solamente hasta la fecha indicada con «EXP/CAD» en el envase.
DOSIFICACIÓN/APLICACIÓN:
Aplicación: Al igual que todas las soluciones oleosas, GYNODIAN DEPOT debe inyectarse estrictamente por vía intramuscular. Las reacciones pasajeras de la paciente (necesidad de toser, accesos de tos, dificultad respiratoria), que se presentan en raras ocasiones durante o inmediatamente después de la inyección de soluciones oleosas, pueden evitarse, como se ha comprobado, inyectando muy lentamente la solución. No obstante, éstos pueden ser también síntomas de una reacción de hipersensibilidad al preparado.
Comienzo de la aplicación: En el caso de mujeres que no pueden ser tratadas con preparados estrogénicos orales o transdérmicos, se puede comenzar con la aplicación de GYNODIAN DEPOT en cualquier momento.
En el caso de mujeres que cambian otro preparado de terapia de reemplazo hormonal (TRH), se debe comenzar con la aplicación de GYNODIAN DEPOT una vez concluido el ciclo de tratamiento de la terapia anterior.
Dosificación: En general, se administra 1 ml de GYNODIAN DEPOT por vía intramuscular cada 4 semanas.
El intervalo entre las inyecciones puede espaciarse más en función de la mejoría lograda.
Aplicación combinada: El gestágeno necesario en mujeres con útero intacto se toma de 12 a 14 días de cada mes respectivamente. Consulte la ficha técnica del preparado de gestágeno correspondiente.
En mujeres histerectomizadas, la aplicación de gestágeno se debe evaluar en el caso de un historial clínico de endometriosis, dado que una única estimulación estrogénica puede provocar una reactivación de una endometriosis.
Duración del tratamiento: Para todas las indicaciones se debe utilizar siempre la dosis mínima eficaz y el tratamiento debe ser lo más corto posible. El reemplazo hormonal solo se debe continuar mientras el beneficio prevalezca sobre el riesgo para la paciente en particular.
Recomendaciones sobre dosificación especiales:
• Población pediátrica: No existe ninguna indicación para niños y adolescentes.
• Pacientes mayores: No existen datos que indiquen que en el caso de las pacientes mayores se requiera una adecuación de la dosis. En el caso de mujeres de 65 años o más, véase el apartado Advertencias y precauciones.
Disfunción hepática: GYNODIAN DEPOT no se ha estudiado en pacientes con trastornos de la función hepática. Por ello, no se pueden realizar recomendaciones de dosificación para pacientes con insuficiencia hepática leve a moderada. Al igual que todas las hormonas sexuales, GYNODIAN DEPOT se encuentra contraindicada en casos de insuficiencia hepática grave.
Disfunción renal: GYNODIAN DEPOT no se ha estudiado en pacientes con trastornos de la función renal. No obstante, los datos disponibles no recomiendan una adecuación de la dosificación.
SOBREDOSIS: En caso de sobredosis se pueden reforzar las manifestaciones enumeradas en Reacciones adversas. El tratamiento es sintomático.
DATOS PRECLÍNICOS:
Para la evaluación toxicológica del riesgo derivado del uso de GYNODIAN DEPOT, además de los estudios con ambos componentes activos valerato de estradiol y enantato de prasterona, también se tuvieron en cuenta los datos obtenidos para el 17 ß-estradiol, el metabolito farmacológicamente activo del valerato de estradiol.
En los estudios de tolerancia sistémica con administración repetida no aparecieron reacciones sistémicas de intolerancia que pudieran constituir objeción al uso del preparado en las dosis terapéuticas.
Tumorigenicidad/Mutagenidad: Los estudios experimentales en animales para la evaluación de un posible potencial tumoral y los ensayos de mutagenicidad solo se han llevado a cabo con el componente estrogénico valerato de estradiol. Dichos estudios no indicaron un potencial tumoral durante el uso de la sustancia activa en seres humanos. No se han realizado estudios adicionales sobre posibles apariciones de tumores con la combinación de los fármacos.
Los componentes de GYNODIAN DEPOT son ésteres de esteroides de ocurrencia endógena, los cuales se vuelven activos después de la hidrólisis de éster. Se espera que el uso de GYNODIAN DEPOT según lo prescrito ocasione un aumento de los niveles plasmáticos de esta hormona endógena, que se encuentre dentro de la variación fisiológica de la mujer sana. Ya que el propósito del tratamiento es el reemplazo de los déficits hormonales endógenos, es altamente improbable que se exceda la concentración plasmática fisiológica. Sin embargo, hay que considerar que los esteroides sexuales pueden estimular el crecimiento de ciertos tejidos y tumores hormonodependientes.
Toxicología reproductiva: Los estudios in vitro con 17ß-estradiol no arrojaron indicios de un potencial mutagénico.
No se han realizado estudios de toxicología reproductiva con GYNODIAN DEPOT ya que el uso según lo prescrito no ocasiona ningún aumento no fisiológico en el nivel hormonal endógeno. Sin embargo, se debe descartar la presencia de un embarazo antes del tratamiento con GYNODIAN DEPOT.
INFORMACIÓN ACERCA DE LA CÁNULA DESECHABLE ESTÉRIL: La esterilidad del producto no se puede asegurar, si el anillo de seguridad ha sido dañado o alterado; en ese caso no utilice la cánula. Para evitar heridas provocadas por la cánula, deseche la cánula en un recipiente adecuado para su eliminación.
PRESENTACIÓN:
Ampolla x 1 ml, Jeringa prellenada de 1 mL
Venta con receta médica
SmPC Suiza_Rev. Nov 2015
Fabricado por: Bayer de México S.A. de C.V. - México
Importado y distribuido por:
BAYER S.A. PERÚ
Av. Paseo de la República 3074, Piso 10 San Isidro
CONDICIONES ESPECÍFICAS DE CONSERVACIÓN:
No se exponga a temperaturas superiores a 30 °C. Protéjase de la luz.
Manténgase fuera del alcance de los niños.
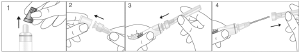
Retirar el tapón de goma de la jeringa (Fig. 1). Mantener la cánula en la funda protectora y retirar la tapa completamente (Fig. 2). Colocar la cánula en la jeringa (Fig. 3) y retirar la funda protectora (Fig. 4).