
CONCERTA
METILFENIDATO
Tabletas
Caja, Frasco de polietileno de alta densidad, 7,10,20,30 Tabletas de liberación prolongada,
Caja, Frasco de polietileno de alta densidad, 56,60,100 Tabletas de liberación prolongada,
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
CONCERTA® 18 mg
Tableta de liberación prolongada
Cada tableta de liberación prolongada contiene:
Metilfenidato clorhidrato 18 mg
Excipientes c.s.p
CONCERTA® 36 mg
Tableta de liberación prolongada
Cada tableta de liberación prolongada contiene:
Metilfenidato clorhidrato 36 mg
Excipientes c.s.p
CONCERTA® 54 mg
Tableta de liberación prolongada
Cada tableta de liberación prolongada contiene:
Metilfenidato clorhidrato 54 mg
Excipientes c.s.p
Este medicamento contiene lactosa monohidrato, como componente de uno de los excipientes. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento.
Consulte la lista completa de los excipientes en la sección Lista de Excipientes.
FORMA FARMACÉUTICA Y CONCENTRACIONES
CONCERTA® (Clorhidrato de metilfenidato) tableta de liberación prolongada está disponible en las siguientes concentraciones: las tabletas de 18 mg son de color amarillo impreso con “alza 18”, las tabletas de 36 mg son de color blanco impreso con “alza 36” y las tabletas de 54 mg son tabletas de color rojo-parduzco impreso con “alza 54”.
INDICACIONES Y USO
CONCERTA® está indicado para el tratamiento de trastorno por déficit de atención e hiperactividad (TDAH) en niños de 6 años de edad y mayores, adolescentes y adultos hasta la edad de 65 años (ver sección Estudios Clínicos).
Un diagnóstico del trastorno por déficit de atención e hiperactividad (TDAH; DSM-IV) implica la presencia de síntomas hiperactivos-impulsivos o de inatención que causaron deterioro y estuvieron presentes antes de los 7 años de edad. Los síntomas deben causar deterioro clínicamente significativo, por ejemplo, en el funcionamiento social, académico u ocupacional, y estar presentes en dos o más ámbitos, por ejemplo, colegio (o trabajo) y en casa. Los síntomas no deben ser mejor explicados por otro trastorno mental. Para el tipo de inatención, al menos seis de los siguientes síntomas deben haber persistido al menos durante 6 meses: falta de atención a detalles/errores por descuido; falta de atención sostenida; mal oyente, incapacidad para el seguimiento de tareas; mala organización; evita tareas que requieren esfuerzo mental sostenido; pierde cosas; se distrae con facilidad; se olvida las cosas con facilidad. Para el tipo hiperactivo-impulsivo, al menos seis de los siguientes síntomas deben haber persistido al menos durante 6 meses: inquietud/intranquilidad; no permanece sentado, corre/trepa de manera inadecuada; dificultad con actividades tranquilas; muy activo; habla excesivamente; respuestas impulsivas; no puede esperar su turno; intruso. El tipo combinado requiere cumplir ambos criterios, de inatención e hiperactivo-impulsivo.
Consideraciones especiales del diagnóstico
La etiología específica de este síndrome es desconocida y no existe una prueba única de diagnóstico. Un diagnóstico adecuado requiere el uso de recursos médicos y sociales, educativos y psicológicos especiales. El aprendizaje puede o no estar dañado. El diagnóstico debe basarse en una evaluación e historia completa del paciente y no solamente en la presencia del número requerido de características del DSM-IV.
Necesidad del programa de tratamiento integral
CONCERTA® está indicado como una parte integral de un programa de tratamiento total para el TDAH que puede incluir otras medidas (psicológicas, educativas, sociales). El tratamiento con el fármaco puede no estar indicado para todos los pacientes con TDAH. Los estimulantes no están destinados para el uso en pacientes que muestran síntomas secundarios a factores ambientales y/u otros trastornos psiquiátricos primarios, incluyendo psicosis. La ubicación educativa apropiada es esencial y la intervención psicosocial a menudo es de ayuda. Cuando las medidas correctivas por sí solas son insuficientes, la decisión de prescribir medicación estimulante dependerá de la evaluación del médico de la cronicidad y severidad de los síntomas del paciente.
DATOS FARMACÉUTICOS
Lista de Excipientes
CONCERTA® 18 mg
Tableta de liberación prolongada
Capa de droga 1:
Oxido de polietileno 200k
Povidona
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Capa de droga 2:
Oxido de polietileno 200k
Povidona (k29-32)
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Óxido Férrico Amarillo
Capa de empuje
Óxido de polietileno 7000K, TG
Cloruro de sodio
Povidona (k29-32)
Hidroxitolueno butilado (BHT)
Ácido esteárico
Óxido Férrico verde (Óxido Férrico Negro 78.9%: Óxido Férrico Amarillo 21.1%)
Membrana
Acetato de celulosa
Poloxámero 188
Recubrimiento de droga
Hipromelosa (Hidroxipropilmetilcelulosa 2910, 3csp)
Ácido Fosfórico
Recubrimiento de color
Opadry II amarillo [Lactosa monohidrato (38%), hipromelosa (28%), dióxido de titanio (C.I 77891) (21.15%), triacetato de glicerol (8%)], Óxido de hierro amarillo (C.I. 77492) (2.85%), ácido esteárico (2.0%)]
Cubierta Incolora
Opadry claro [Hipromelosa (90.9%), macrogol (9.1%)].
Cera carnauba
Impresión de Tinta
Tinta a base de agua opacode negro
Componentes usados en el proceso
Agua purificada
Acetona
CONCERTA® 36 mg
Tableta de liberación prolongada
Capa de droga 1:
Oxido de polietileno 200k
Povidona
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Capa de droga 2:
Oxido de polietileno 200k
Povidona (k29-32)
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Óxido Férrico Amarillo
Capa de empuje
Óxido de polietileno 7000K, TG
Cloruro de sodio
Povidona (k29-32)
Hidroxitolueno butilado (BHT)
Ácido esteárico
Óxido Férrico verde (Óxido Férrico Negro 78.9%: Óxido Férrico Amarillo 21.1%)
Membrana
Acetato de celulosa
Poloxámero 188
Recubrimiento de droga
Hipromelosa (Hidroxipropilmetilcelulosa
2910, 3csp)
Ácido Fosfórico
Recubrimiento de color
Opadry II blanco [Lactosa monohidrato (40%), hipromelosa (28%), dióxido de titanio (C.I 77891) (24%), triacetato de glicerol (8%)].
Cubierta Incolora
Opadry claro [Hipromelosa (90.9%), macrogol (9.1%)].
Cera carnauba
Impresión de Tinta
Tinta a base de agua opacode negro
Componentes usados en el proceso
Agua purificada
Acetona
CONCERTA® 54mg
Tableta de liberación prolongada
Capa de droga 1:
Oxido de polietileno 200k
Povidona
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Óxido férrico rojo
Capa de droga 2:
Oxido de polietileno 200k
Povidona (k29-32)
Ácido succínico
Ácido esteárico (polvo)
Hidroxitolueno butilado (BTH)
Capa de empuje
Óxido de polietileno 7000K, TG
Cloruro de sodio
Povidona (k29-32)
Hidroxitolueno butilado (BHT)
Ácido esteárico
Óxido Férrico verde (Óxido Férrico Negro 78.9%: Óxido Férrico Amarillo 21.1%)
Membrana
Acetato de celulosa
Poloxámero 188
Recubrimiento de droga
Hipromelosa (Hidroxipropilmetilcelulosa 2910, 3csp)
Ácido Fosfórico
Recubrimiento de color
Opadry II rojo [Lactosa monohidrato (40%), hipromelosa (28%), dióxido de titanio (C.I 77891) (19.38%), triacetato de glicerol (8%)], Óxido de hierro amarillo (C.I. 77492)/Óxido de hierro rojo (C.I. 77491) (4.62%)]
Cubierta Incolora
Opadry claro [Hipromelosa (90.9%), macrogol (9.1%)].
Cera carnauba
Impresión de Tinta
Tinta a base de agua opacode negro
Componentes usados en el proceso
Agua purificada
Acetona
Incompatibilidades
No procede.
Período de validez
No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Precauciones especiales de conservación
Mantener fuera del alcance de los niños.
Conservar por debajo de 30°C. Mantener el envase perfectamente cerrado.
Naturaleza y contenido del envase
Caja de cartón con frasco de polietileno de alta densidad x 7, 10, 20, 30, 56, 60 y 100 tabletas de liberación prolongada. Puede que solamente estén comercializados algunos tamaños de envases.
Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
Los medicamentos no se deben tirar por los desagües ni a la basura. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
Version del texto de referencia
USPI enero 2017
Fabricante
Janssen Cilag Manufacturing LLC. – Puerto Rico
Titular del Registro Sanitario
JOHNSON & JOHNSON DEL PERU S.A.
Av. Canaval y Moreyra N° 480, Int. 901 y 1301
San Isidro-Lima
CONTRAINDICACIONES
• Feocromocitoma.
• Hipertiroidismo o tirotoxicosis.
• Diagnóstico o antecedentes de depresión grave, anorexia nerviosa/trastornos de anorexia, tendencias suicidas, síntomas psicóticos, trastornos de ánimo severos, manía, esquizofrenia, trastorno de la personalidad psicopático/borderline.
• Diagnóstico o antecedentes de trastorno bipolar (afectivo) grave y episódico (Tipo I) (que no está bien controlado).
• Trastornos cardiovasculares pre-existentes incluyendo hipertensión grave, insuficiencia cardíaca, enfermedad arterial oclusiva, angina, enfermedad cardíaca congénita hemodinamicamente significativa, cardiomiopatías, infarto de miocardio, arritmias potencialmente mortales y canalopatías (trastornos provocados por la disfunción de los canales iónicos).
• Trastornos cerebrovasculares pre-existentes, aneurisma cerebral, anomalías vasculares incluyendo vasculitis o apoplejía.
Hipersensibilidad a metilfenidato
Se han observado reacciones de hipersensibilidad, como angioedema y reacciones anafilácticas en pacientes tratados con CONCERTA®. Por lo tanto, CONCERTA® está contraindicado en pacientes que se sabe que son hipersensibles a metilfenidato u otros componentes del producto (ver sección Reacciones Adversas).
Agitación
CONCERTA® está contraindicado en pacientes con agitación, tensión y ansiedad marcada, ya que el fármaco puede agravar estos síntomas.
Glaucoma
CONCERTA® está contraindicado en pacientes con glaucoma.
Tics
CONCERTA® está contraindicado en pacientes con tics motores o con un diagnóstico o historia familiar de síndrome de Tourette (ver sección Reacciones Adversas).
Inhibidores de la monoamino oxidasa
CONCERTA® está contraindicado durante el tratamiento con inhibidores de la monoamino oxidasa (MAO) y también dentro de un mínimo de 14 días luego de la discontinuación de un inhibidor de la MAO (puede resultar crisis hipertensiva) (ver sección Interacciones con fármacos).
REACCIONES ADVERSAS
Trastornos psiquiátricos:
- Frecuente: Labilidad emocional, agresividad, agitación, ansiedad, depresión, irritabilidad, comportamiento anormal, cambios de humor, tics, insomnio inicial, comportamiento depresivo, disminución de la libido, bruxismo y ataque de pánico.
- Muy rara: Intento de suicidio (incluyendo suicidio consumado), humor depresivo transitorio6, pensamientos anormales, apatía, comportamientos repetitivos, prestar excesiva atención.
Las siguientes reacciones se discuten con mayor detalle en otras secciones de la ficha técnica:
• Dependencia del fármaco (ver recuadro Advertencias)
• Hipersensibilidad a metilfenidato (ver sección Contraindicaciones)
• Agitación (ver sección Contraindicaciones)
• Glaucoma (ver sección Contraindicaciones)
• Tics (ver sección Contraindicaciones)
• Inhibidores de la Monoamino Oxidasa (ver sección Contraindicaciones e Interacciones de fármacos)
• Eventos cardiovasculares graves (ver sección Advertencias y Precauciones)
• Eventos adversos psiquiátricos (ver sección Advertencias y Precauciones)
• Convulsiones (ver sección Advertencias y Precauciones)
• Priapismo (ver sección Advertencias y Precauciones)
• Supresión del crecimiento a largo plazo (ver sección Advertencias y Precauciones)
• Alteración visual (ver sección Advertencias y Precauciones)
• Potencial para obstrucción gastrointestinal (ver sección Advertencias y Precauciones)
• Monitoreo hematológico (ver sección Advertencias y Precauciones)
La reacción adversa más común en ensayos clínicos doble ciego (>5%) en pacientes pediátricos (niños y adolescentes) fue dolor abdominal superior. Las reacciones adversas más comunes en ensayos clínicos doble ciego (>5%) en pacientes adultos fueron disminución del apetito, dolor de cabeza, boca seca, náuseas, insomnio, ansiedad, mareos, disminución del peso, irritabilidad e hiperhidrosis (ver sección Reacciones Adversas).
Las reacciones adversas más comunes asociadas con la discontinuación (>1%) a partir de los ensayos clínicos en adultos o población pediátrica fueron ansiedad, irritabilidad, insomnio e incremento de la presión sanguínea (ver sección Reacciones Adversas).
El programa de desarrollo para CONCERTA® incluyó exposiciones en un total de 3906 participantes en ensayos clínicos. Se evaluó a niños, adolescentes y adultos con TDAH en 6 estudios clínicos controlados y 11 estudios clínicos abiertos (ver Tabla 3). Se evaluó la seguridad recolectando los eventos adversos, signos vitales, pesos y ECGs y realizando exámenes físicos y análisis de laboratorio.
|
Tabla 3. Exposición a CONCERTA® en estudios clínicos doble ciego y abierto |
||
|
Población de Pacientes |
N |
Rango de la dosis |
|
Niños |
2216 |
18 a 54 mg una vez al día |
|
Adolescentes |
502 |
18 a 72 mg una vez al día |
|
Adultos |
1188 |
18 a 108 mg una vez al día |
Los eventos adversos durante la exposición se obtuvieron principalmente por consulta general y fueron registrados por los investigadores clínicos usando su propia terminología. Por consiguiente, para proporcionar una estimación significativa de la proporción de individuos que experimentaron eventos adversos, se agrupó los eventos en categorías estandarizadas usando terminología MedDRA.
Las frecuencias de los eventos adversos declarados representan la proporción de individuos que experimentaron, al menos una vez, un evento adverso emergente del tratamiento del tipo mencionado. Un evento se consideró emergente del tratamiento si ocurrió por primera vez o empeoró mientras recibía terapia luego de la evaluación en el estado basal.
A lo largo de esta sección se reporta las reacciones adversas. Las reacciones adversas son eventos adversos que se consideraron estar razonablemente asociados con el uso de CONCERTA® en base a la evaluación exhaustiva de la información disponible de los eventos adversos. Una asociación causal para CONCERTA® a menudo no puede establecerse de manera confiable en casos individuales. Además, debido a que los ensayos clínicos se realizan bajo condiciones muy variables, las tasas de la reacción adversa observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
La mayoría de las reacciones adversas fueron de severidad leve a moderada.
Reacciones adversas comúnmente observadas en ensayos clínicos doble ciego, controlados con placebo
Las reacciones adversas en las tablas de reacciones adversas doble ciego en adultos o la población pediátrica pueden ser relevantes para ambas poblaciones de pacientes.
Niños y Adolescentes
La tabla 4 describe las reacciones adversas reportadas en 1% o más de sujetos adolescentes y niños tratados con CONCERTA® en 4 ensayos clínicos doble ciego, controlados con placebo.
|
Tabla 4. Reacciones adversas reportadas por > 1% de sujetos adolescentes y niños tratados con CONCERTA® en 4 ensayos clínicos de CONCERTA® doble ciego, controlados con placebo |
||
|
Sistema de clasificación de órganos Reacción Adversa |
CONCERTA® (n = 321) % |
Placebo (n = 318) % |
|
Trastornos gastrointestinales Dolor abdominal superior Vómitos |
6.2 2.8 |
3.8 1.6 |
|
Trastornos generales y condiciones en el lugar de la administración Pirexia |
2.2 |
0.9 |
|
Infecciones e Infestaciones Nasofaringitis |
2.8 |
2.2 |
|
Trastornos del sistema nervioso Mareos |
1.9 |
0 |
|
Trastornos psiquiátricos Insomnio* |
2.8 |
0.3 |
|
Trastornos respiratorios, torácicos y mediastínicos Tos Dolor orofaríngeo |
1.9 1.2 |
0.9 0.9 |
|
*Los términos de insomnio inicial (CONCERTA® = 0.6%) e insomnio (CONCERTA® = 2.2%) son combinados en Insomnio. |
||
La mayoría de las reacciones adversas fueron de severidad leve a moderada.
Adultos
La tabla 5 enumera las reacciones adversas reportadas en 1% o más de adultos tratados con CONCERTA® en 2 ensayos clínicos doble ciego, controlados con placebo.
|
Tabla 5. Reacciones adversas reportadas por > 1% de sujetos adultos tratados con CONCERTA® en 2 ensayos clínicos doble ciego, controlados con placebo* |
||
|
Sistema de clasificación de órganos Reacción Adversa |
CONCERTA® (n = 415) % |
Placebo (n = 212) % |
|
Trastornos cardíacos Taquicardia Palpitaciones |
4.8 3.1 |
0 0.9 |
|
Trastornos del oído y del laberinto Vértigo |
1.7 |
0 |
|
Trastornos oculares Visión borrosa |
1.7 |
0.5 |
|
Trastornos gastrointestinales Boca seca Náuseas Dispepsia Vómitos Estreñimiento |
14.0 12.8 2.2 1.7 1.4 |
3.8 3.3 0.9 0.5 0.9 |
|
Trastornos generales y condiciones en el lugar de la administración Irritabilidad |
5.8 |
1.4 |
|
Infecciones e Infestaciones Infección del tracto respiratorio superior |
2.2 |
0.9 |
|
Investigaciones Disminución del peso |
6.5 |
3.3 |
|
Trastornos del metabolismo y la nutrición Disminución del apetito Anorexia |
25.3 1.7 |
6.6 1.4 |
|
Trastornos musculoesqueléticos y del tejido conectivo Tensión muscular |
1.9 |
0 |
|
Trastornos del sistema nervioso Dolor de cabeza Mareos Temblor Parestesia Sedación Dolor de cabeza tensional |
22.2 6.7 2.7 1.2 1.2 1.2 |
15.6 5.2 0.5 0 0 0.5 |
|
Trastornos psiquiátricos Insomnio Ansiedad Insomnio inicial Comportamiento depresivo Nerviosismo Inquietud Agitación Agresión Bruxismo Depresión Disminución de la líbido Labilidad emocional Estado de confusión Tensión |
12.3 8.2 4.3 3.9 3.1 3.1 2.2 1.7 1.7 1.7 1.7 1.4 1.2 1.2 |
6.1 2.4 2.8 1.4 0.5 0 0.5 0.5 0.5 0.9 0.5 0.9 0.5 0.5 |
|
Trastornos respiratorios, torácicos y Mediastínicos Dolor orofaríngeo |
1.7 |
1.4 |
|
Trastornos de la piel y del tejido subcutáneo Hiperhidrosis |
5.1 |
0.9 |
|
*Incluyó dosis hasta 108 mg. |
||
La mayoría de las reacciones adversas fueron de severidad leve a moderada.
Otras reacciones adversas observadas en los ensayos clínicos de CONCERTA®
Esta sección incluye reacciones adversas reportadas por sujetos tratados con CONCERTA® en ensayos doble ciego que no cumplen con los criterios especificados en la tabla 4 o tabla 5 y todas las reacciones adversas reportadas por sujetos tratados con CONCERTA® que participaron en ensayos clínicos abiertos y post-comercialización.
Trastornos de la sangre y del sistema linfático: Leucopenia
Trastornos oculares: Trastorno de acomodación, ojo seco
Trastornos vasculares: Sofoco
Trastornos gastrointestinales: Malestar abdominal, dolor abdominal, diarrea
Trastornos generales y condiciones en el lugar de la administración: Astenia, fatiga, sensación de nerviosismo, sed
Infecciones e Infestaciones: Sinusitis
Análisis: Alanina aminotransferasa incrementada, presión arterial incrementada, soplo cardíaco, frecuencia cardíaca incrementada
Trastornos musculoesqueléticos y del tejido conectivo: Espasmos musculares
Trastornos del sistema nervioso: Letargia, hiperactividad psicomotora, somnolencia
Trastornos psiquiátricos: Ira, hipervigilancia, cambios de estados de ánimo, cambios de comportamiento, ataque de pánico, trastorno del sueño, tendencia al llanto, tic
Trastornos del sistema reproductivo y las mamas: Disfunción eréctil
Trastornos respiratorios, torácicos y mediastínicos: Disnea
Trastornos de la piel y del tejido subcutáneo: Rash, rash macular
Trastornos vasculares: Hipertensión
Discontinuación debido a las reacciones adversas
Las reacciones adversas en los 4 estudios controlados con placebo en niños y adolescentes que condujeron a la discontinuación ocurrieron en 2 pacientes con CONCERTA® (0.6%) incluyendo comportamiento depresivo (1, 0.3%) y dolor de cabeza e insomnio (1, 0.3%), y en 6 pacientes con placebo (1.9%) incluyendo dolor de cabeza e insomnio (1, 0.3%), irritabilidad (2, 0.6%), dolor de cabeza (1, 0.3%), hiperactividad psicomotora (1, 0.3%) y tic (1, 0.3%).
En los 2 estudios controlados con placebo en adultos, 25 pacientes con CONCERTA® (6.0%) y 6 pacientes con placebo (2.8%) discontinuaron debido a una reacción adversa. Aquellos eventos con una incidencia de > 0.5% en los pacientes con CONCERTA® incluyeron ansiedad (1.7%), irritabilidad (1.4%), presión arterial incrementada (1.0%) y nerviosismo (0.7%). En los pacientes con placebo, la presión arterial incrementada y el comportamiento depresivo tuvieron una incidencia de > 0.5% (0.9%).
En los 11 estudios abiertos en niños, adolescentes y adultos, 266 pacientes con CONCERTA® (7.0%) discontinuaron debido a una reacción adversa. Aquellos eventos con una incidencia de > 0.5% incluyeron insomnio (1.2%), irritabilidad (0.8%), ansiedad (0.7%), disminución del apetito (0.7%) y tic (0.6%).
Tics
En un estudio a largo plazo no controlado (n = 432 niños), la incidencia acumulada de nueva aparición de tics fue 9% después de 27 meses de tratamiento con CONCERTA®.
En un segundo estudio no controlado (n = 682 niños) la incidencia acumulada de nueva aparición de tics fue 1% (9/682 niños). El período del tratamiento fue hasta 9 meses con una media de la duración del tratamiento de 7.2 meses.
Incrementos de la presión sanguínea y la frecuencia cardíaca
En ensayos clínicos de laboratorio en niños en el salón de clase (Estudios 1 y 2), tanto CONCERTA® una vez al día como metilfenidato tres veces al día incrementaron el pulso en reposo en un promedio de 2 a 6 bpm y produjeron incrementos promedio de la presión sanguínea sistólica y diastólica de aproximadamente 1 a 4 mm Hg durante el día, en relación con el placebo. En el ensayo controlado con placebo en adolescentes (Estudio 4), se observaron incrementos medios desde el estado basal de la frecuencia del pulso en reposo con CONCERTA® y el placebo al final de la fase doble ciego (5 y 3 latidos/minuto, respectivamente). Los incrementos medios desde el estado basal de la presión sanguínea al final de la fase doble ciego para pacientes tratados con CONCERTA® y placebo fueron 0.7 y 0.7 mm Hg (sistólica) y 2.6 y 1.4 mm Hg (diastólica), respectivamente. En un estudio controlado con placebo en adultos (Estudio 6), se observaron incrementos medios dependientes de la dosis de 3.9 a 9.8 lpm desde el estado basal de la frecuencia del pulso en posición de pie con CONCERTA® al final del tratamiento doble ciego frente a un incremento de 2.7 latidos/minuto con el placebo. Los cambios medios desde el estado basal de la presión sanguínea en posición de pie al final del tratamiento doble ciego oscilaron de 0.1 a 2.2 mm Hg (sistólica) y -0.7 a 2.2 mm Hg (diastólica) para CONCERTA® y fue 1.1 mm Hg (sistólica) y -1.8 mm Hg (diastólica) para el placebo. En un segundo estudio controlado con placebo en adultos (Estudio 5), se observaron cambios medios desde el estado basal de la frecuencia del pulso en reposo para CONCERTA® y el placebo al final del tratamiento doble ciego (3.6 y -1.6 latidos/minuto, respectivamente). Los cambios medios desde el estado basal de la presión sanguínea al final del tratamiento doble ciego para pacientes tratados con CONCERTA® y el placebo fueron -1.2 y -0.5 mm Hg (sistólica) y 1.1 y 0.4 mm Hg (diastólica), respectivamente (ver sección Advertencias y Precauciones).
Experiencia Post-Comercialización
Se ha identificado las siguientes reacciones adversas adicionales durante el uso posterior a la aprobación de CONCERTA®. Debido a que estas reacciones se reportan voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia:
Trastornos de la sangre y del sistema linfático: Pancitopenia, trombocitopenia, púrpura trombocitopénica
Trastornos cardíacos: Angina de pecho, bradicardia, extrasístoles, taquicardia supraventricular, extrasístoles ventriculares
Trastornos oculares: Diplopía, midriasis, discapacidad visual
Trastornos generales: Dolor en el pecho, malestar torácico, disminución del efecto del fármaco, hiperpirexia, disminución de la respuesta terapéutica
Trastornos hepatobiliar: Lesión hepatocelular, insuficiencia hepática aguda
Trastornos del sistema inmune: Reacciones de hipersensibilidad tales como angioedema, reacciones anafilácticas, inflamación auricular, condiciones bullosas, condiciones exfoliativas, urticarias, prurito NEC, rashes, erupciones y exantemas NEC
Análisis: Fosfatasa alcalina sanguínea incrementada, bilirrubina sanguínea incrementada, enzima hepática incrementada, disminución del recuento de plaquetas, recuento anormal de células sanguíneas blancas.
Trastornos óseos, musculoesqueléticos y del tejido conectivo: Artralgia, mialgia, espasmos musculares y rabdomiólisis
Trastornos del sistema nervioso: Convulsión, convulsión del Gran Mal, discinesia, síndrome de serotonina en combinación con drogas serotoninérgicas
Trastornos psiquiátricos: Desorientación, alucinación, alucinación auditiva, alucinación visual, manía, logorrea, cambios en la líbido
Trastornos del sistema reproductivo y las mamas: Priapismo
Trastornos de la piel y del tejido subcutáneo: Alopecia, eritema
Trastornos vasculares: Fenómeno de Raynaud.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continua de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Centro Nacional de Farmacovigilancia y Tecnovigilancia.
INTERACCIONES DE FÁRMACOS
Inhibidores de la MAO
No debe usarse CONCERTA® en pacientes que están siendo tratados (actualmente o dentro de las 2 semanas previas) con inhibidores de la MAO (ver sección Contraindicaciones).
Agentes vasopresores
Debido a posibles incrementos de la presión arterial, CONCERTA® debe usarse con precaución con agentes vasopresores (ver sección Advertencias y Precauciones).
Anticoagulantes cumarínicos, antidepresivos e inhibidores selectivos de la recaptación de serotonina
Estudios farmacológicos en humanos han mostrado que metilfenidato puede inhibir el metabolismo de los anticoagulantes cumarínicos, anticonvulsivos (por ejemplo, fenobarbital, fenitoína, primidona) y de algunos antidepresivos (tricíclicos e inhibidores selectivos de la recaptación de serotonina). Se puede requerir disminuir la dosis de estos fármacos cuando se administran de manera concomitante con metilfenidato. Puede ser necesario ajustar la dosis y monitorear las concentraciones plasmáticas del fármaco (o, en el caso de los cumarínicos, los tiempos de coagulación), cuando se inicia o discontinúa el metilfenidato concomitante.
ESTUDIOS CLÍNICOS
Se demostró que CONCERTA® es efectivo en el tratamiento del trastorno por déficit de atención e hiperactividad (TDAH) en 4 estudios aleatorizados, doble ciego, controlados con placebo en niños y adolescentes y en 2 estudios doble ciego, controlados con placebo en adultos que cumplieron los criterios para el TDAH del Manual de Diagnóstico y Estadística 4ta edición (DSM-IV).
Niños
Se realizaron tres estudios doble ciego, controlados con comparador activo y placebo en 416 niños de 6 a 12 años de edad. Los estudios controlados compararon CONCERTA® administrado una vez al día (18, 36 o 54 mg), metilfenidato administrado tres veces al día durante 12 horas (dosis total diaria de 15, 30 o 45 mg) y placebo en dos estudios cruzados, monocéntricos, de 3 semanas (Estudios 1 y 2) y en un estudio de comparación de grupos paralelos, multicéntrico, de 4 semanas (Estudio 3). La comparación principal de interés en los tres ensayos fue CONCERTA® frente al placebo.
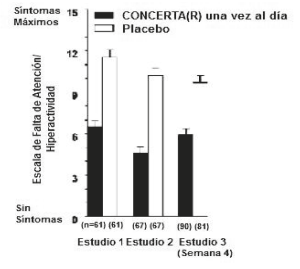
Los síntomas del TDAH fueron evaluados por profesores de escuelas comunitarias usando la Escala de Inatención/Hiperactividad con Agresión (IOWA) de Conners. Se demostró reducción estadísticamente significativa en la subescala de Inatención/Hiperactividad frente al placebo en los tres estudios controlados para CONCERTA®. Los puntajes para CONCERTA® y el placebo para los tres estudios se describen en la Figura 2.
Figura 2. Puntajes medios de los profesores de escuelas comunitarias usando la Escala de Inatención/Hiperactividad de Conners con CONCERTA® una vez al día (18, 36 o 54 mg) y el placebo. Los estudios 1 y 2 incluyeron un cruce de 3 vías de 1 semana por brazo de tratamiento. El estudio 3 incluyó 4 semanas de tratamientos de grupos paralelos con un análisis de la última observación realizada en la semana 4. Las barras de error representan la media más el error estándar de la media.
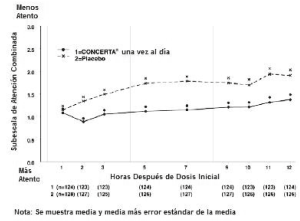
En los estudios 1 y 2, los síntomas del TDAH fueron evaluados por profesores de escuela de laboratorio usando la Escala de calificación de escuela de laboratorio de SKAMP (Swanson, Kotkin, Agler, M-Fynn y Pelham). Los resultados combinados de estos dos estudios demostraron mejorías estadísticamente significativas en la atención y la conducta de pacientes tratados con CONCERTA® frente al placebo que se mantuvieron durante 12 horas después de la dosificación. La Figura 3 presenta las calificaciones SKAMP de los profesores de escuela de laboratorio para CONCERTA® y el placebo.
Figura 3. Calificaciones SKAMP de profesores de escuela de laboratorio: Media (SEM) de atención combinada (Estudio 1 y 2).
Adolescentes
En un ensayo aleatorizado, doble ciego, multicéntrico, controlado con placebo (Estudio 4) que incluyó 177 pacientes, se demostró que CONCERTA® es efectivo en el tratamiento del TDAH en adolescentes de 13 a 18 años de edad a dosis hasta de 72 mg/día (1.4 mg/kg/día). De 220 pacientes que ingresaron a una fase de titulación abierta de 4 semanas, 177 fueron titulados a una dosis individualizada (máximo de 72 mg/día) en base al cumplimiento de los criterios específicos de mejora en la Escala de calificación del TDAH y la Evaluación Global de Efectividad con tolerabilidad aceptable. Los pacientes que cumplen con estos criterios fueron luego aleatorizados para recibir su dosis individualizada de CONCERTA® (18 – 72 mg/día, n = 87) o el placebo (n = 90) durante una fase doble ciego de dos semanas. Al final de esta fase, los puntajes medios para el investigador que calificó en la Escala de calificación del TDAH demostraron que CONCERTA® fue significativa e estadísticamente superior al placebo.
Adultos
Se realizaron dos estudios doble ciego, controlados con placebo en 627 adultos de 18 a 65 años de edad. Los estudios controlados compararon CONCERTA® administrado una vez al día y el placebo en un estudio multicéntrico, de grupos paralelos, de titulación de dosis de 7 semanas (Estudio 5) (36 a 108 mg/día) y en un estudio multicéntrico, de grupos paralelos de dosis fija de 5 semanas (Estudio 6) (18, 36 y 72 mg/día).
El estudio 5 demostró la efectividad de CONCERTA® en el tratamiento del TDAH en adultos de 18 a 65 años de edad a dosis de 36 mg/día a 108 mg/día en base al cambio desde el estado basal hasta la visita final del estudio en la Escala de calificación del investigador del TDAH en adultos (AISRS). De los 226 pacientes que ingresaron al ensayo de 7 semanas, 110 fueron aleatorizados a CONCERTA® y 116 fueron aleatorizados al placebo. El tratamiento se inició con 36 mg/día y los pacientes continuaron con incrementos de 18 mg/día (36 a 108 mg/día) en base al cumplimiento de los criterios específica de mejoría con tolerabilidad aceptable. En la visita final del estudio, los puntajes medios del cambio (Media LS, SEM) para el investigador que calificó en la AISRS demostraron que CONCERTA® fue significativa e estadísticamente superior al placebo.
El Estudio 6 fue un estudio multicéntrico, doble ciego, aleatorizado, controlado con placebo, de grupos paralelos, de respuesta-dosis (duración de 5 semanas) con 3 grupos de dosis fija (18, 36 y 72 mg). Se aleatorizó a los pacientes para recibir CONCERTA® administrado a dosis de 18 mg (n = 101), 36 mg (n = 102), 72 mg/día (n = 102) o placebo (n = 96). Las tres dosis de CONCERTA® fueron significativa e estadísticamente más efectivas que el placebo en la mejoría de los puntajes totales de CAARS (Escala de calificación del TDAHS en adultos de Conners) al final del doble ciego en sujetos adultos con TDAH.
INFORMACIÓN DE RECOMENDACIÓN PARA EL PACIENTE
Ver el inserto para el paciente.
Priapismo
Informar a los pacientes, cuidadores y miembros de la familia de la posibilidad de erecciones dolorosas o prolongadas del pene (priapismo). Instruir al paciente a buscar atención médica inmediata en caso de priapismo (ver sección Advertencias y Precauciones).
Problemas de circulación en los dedos de las manos y de los pies (vasculopatía periférica, incluyendo el Fenómeno de Raynaud)
Indicar a los pacientes que inician el tratamiento con CONCERTA® sobre el riesgo de vasculopatía periférica, incluyendo el fenómeno de Raynaud, y los signos y síntomas asociados: los dedos de las manos o de los pies pueden sentirse entumecidos, fríos, dolorosos y/o pueden cambiar de color de pálido, a azul, a rojo.
Instruir a los pacientes a reportar a su médico cualquier nuevo entumecimiento, dolor, cambio de color de la piel o sensibilidad a la temperatura en los dedos de las manos o de los pies.
Instruir a los pacientes a llamar a su médico inmediatamente con cualquier signo inexplicable de aparición de heridas en los dedos de las manos o de los pies mientras toma CONCERTA®.
Puede ser apropiada una evaluación clínica adicional (por ejemplo, referencia a reumatología) para ciertos pacientes.
Consideraciones Generales
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con metilfenidato y deben aconsejarlos en su uso apropiado. Está disponible el inserto para pacientes para CONCERTA®. El prescriptor o el profesional de la salud deben instruir a los pacientes, sus familias y sus cuidadores a leer el inserto para el paciente y deben ayudarlos a entender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido del inserto para el paciente y obtener respuestas a cualquier pregunta que puedan tener.
Instrucciones de administración
Los pacientes deben ser informados de que CONCERTA® debe ser ingerido entero con la ayuda de líquidos. Las tabletas no deben ser masticadas, divididas o trituradas. El medicamento está contenido dentro de una cubierta no absorbible diseñada para liberar el fármaco a una velocidad controlada. La envoltura de la tableta, junto con los componentes insolubles de núcleo, se elimina del cuerpo; los pacientes no deben preocuparse si ocasionalmente notan en sus heces algo que se parece a una tableta.
Conducción o manejo de máquinas pesada
Los estimulantes pueden afectar la capacidad del paciente para operar máquinas o vehículos potencialmente peligrosos. Por lo tanto, los pacientes deben ser advertidos hasta que estén razonablemente seguros de que CONCERTA® no afecta adversamente su capacidad de participar en tales actividades.
TOXICOLOGÍA NO CLÍNICA
Carcinogénesis, mutagénesis y deterioro de la fertilidad
Carcinogénesis
En un estudio de por vida de carcinogenicidad realizado en ratones B6C3F1, el metilfenidato causó un incremento de adenomas hepatocelulares y, solamente en machos, un incremento de hepatoblastomas a una dosis diaria de aproximadamente 60 mg/kg/día. Esta dosis es aproximadamente 30 veces y 4 veces la dosis máxima recomendada en humanos de CONCERTA® sobre una base de mg/kg y mg/m2, respectivamente. El hepatoblastoma es un tipo de tumor maligno relativamente raro en roedores. No hubo un incremento de los tumores hepáticos malignos totales. La cepa de ratón usada es sensible al desarrollo de tumores hepáticos, y se desconoce el significado de estos resultados en los humanos.
El metilfenidato no causó ningún incremento de los tumores en un estudio de por vida de carcinogenicidad realizado en ratas F344; la dosis más alta usada fue aproximadamente 45 mg/kg/día, la cual es aproximadamente 22 veces y 5 veces la dosis máxima recomendada en humanos de CONCERTA® sobre una base de mg/kg y mg/m2, respectivamente.
En un estudio de carcinogenicidad de 24 semanas en la cepa transgénica de ratón p53+/-, la cual es sensible a carcinógenos genotóxicos, no hubo evidencia de carcinogenicidad. Se alimentaron a ratones macho y hembra con dietas conteniendo la misma concentración de metilfenidato que en el estudio de por vida de carcinogenicidad; los grupos con dosis alta fueron expuestas de 60 a 74 mg/kg/día de metilfenidato.
Mutagénesis
El Metilfenidato no fue mutagénico en el ensayo de mutación inversa de Ames in vitro o en el ensayo de mutación directa en células de linfoma de ratón in vitro. Los intercambios de cromátides hermanas y las aberraciones cromosómicas se incrementaron, indicativo de una respuesta clastogénica débil, en un ensayo in vitro en células cultivadas de ovario de hámster Chino. El metilfenidato fue negativo en el ensayo in vivo en micronúcleos de médula ósea de ratón.
Deterioro de la fertilidad
El Metilfenidato no deterioró la fertilidad en ratones macho o hembra que fueron alimentados con dietas conteniendo el fármaco en un estudio de reproducción continua de 18 semanas. El estudio se realizó a dosis hasta de 160 mg/kg/día, aproximadamente 80 veces y 8 veces la dosis más alta recomendada en humanos de CONCERTA® sobre una base de mg/kg y mg/m2, respectivamente.
ADVERTENCIA: DEPENDENCIA DE FÁRMACOS
CONCERTA® debe administrarse con precaución a pacientes con antecedente de farmacodependencia o alcoholismo. El uso abusivo crónico puede conducir a tolerancia marcada y dependencia psicológica con diversos grados de conducta anormal. Pueden ocurrir episodios claramente psicóticos, especialmente con el abuso parenteral. Se requiere supervisión cuidadosa durante el retiro del uso abusivo ya que puede ocurrir depresión severa. El retiro después del uso terapéutico crónico puede desenmascarar los síntomas del trastorno subyacente que pueden requerir seguimiento.
ADVERTENCIAS Y PRECAUCIONES
Uso en niños menores de 6 años
Metilfenidato no debe utilizarse en niños menores de 6 años. No se han establecido la seguridad y eficacia en este grupo de edad.
Estado cardiovascular
Los pacientes a los que se está considerando administrar un tratamiento con estimulantes deben tener una historia detallada (incluyendo una evaluación de antecedentes familiares de muerte súbita cardíaca o inexplicada o arritmia maligna) y un examen físico para evaluar la presencia de trastornos cardíacos y deben someterse a evaluaciones cardíacas especializadas posteriores si los hallazgos iniciales sugieren estos antecedentes o trastornos. Los pacientes que desarrollen síntomas como palpitaciones, dolor opresivo en el pecho, síncope sin explicación, disnea u otros síntomas que sugieran un trastorno cardíaco durante el tratamiento con metilfenidato deben someterse a una evaluación cardíaca especializada inmediata.
Se recomienda precaución al tratar a pacientes cuyo estado médico subyacente se pueda ver afectado por el aumento de la presión arterial o de la frecuencia cardíaca.
Se debe vigilar cuidadosamente el estado cardiovascular. La presión sanguínea y el pulso se deben registrar en una curva de percentiles en cada ajuste de dosis y, después, al menos cada 6 meses.
Eventos cardiovasculares graves
Muerte súbita y anormalidades cardíacas estructurales preexistentes u otros problemas cardíacos graves
Niños y Adolescentes
Se ha reportado muerte súbita en asociación con el tratamiento de estimulantes del SNC a dosis usuales en niños y adolescentes con anormalidades cardíacas estructurales u otros problemas cardíacos graves. Aunque algunos problemas cardíacos graves por sí solos conllevan a un incremento del riesgo de muerte súbita, los productos estimulantes, generalmente no deben usarse en niños o adolescentes con anormalidades graves del ritmo cardíaco, cardiomiopatía, anormalidades cardíacas estructurales graves conocidas u otros problemas cardíacos graves que pueden colocarlos en mayor vulnerabilidad a los efectos simpaticomiméticos de un fármaco estimulante.
Adultos
Se han reportado muertes súbitas, accidente cerebrovascular e infarto de miocardio en adultos que toman fármacos estimulantes a dosis usuales para el TDAH. Aunque el rol de los estimulantes en estos casos en adultos también es desconocido, los adultos tienen una mayor probabilidad que los niños de tener anormalidades cardíacas estructurales graves, cardiomiopatía, anormalidades del ritmo cardíaco graves, enfermedad de las arterias coronarias u otros problemas cardíacos graves. En general, los adultos con tales anormalidades tampoco deben ser tratados con fármacos estimulantes.
Hipertensión y otras condiciones cardiovasculares
Los medicamentos estimulantes causan un incremento moderado en la presión sanguínea promedio (aproximadamente 2 a 4 mm Hg) y en la frecuencia cardíaca promedio (aproximadamente 3 a 6 lpm) (ver sección Reacciones Adversas) y los individuos pueden tener incrementos mayores. Si bien no se esperaría que los cambios medios por sí solos tengan consecuencias a corto plazo, todos los pacientes deben ser monitoreados por cambios mayores en la frecuencia cardíaca y la presión sanguínea. Se recomienda precaución para tratar a pacientes cuyas condiciones médicas subyacentes podrían estar comprometidas por los incrementos en la presión sanguínea o la frecuencia cardíaca, por ejemplo, aquellos con hipertensión preexistente, insuficiencia cardíaca, infarto de miocardio reciente o arritmia ventricular.
Evaluación del estado cardiovascular en pacientes que están siendo tratados con medicamentos estimulantes
Los niños, adolescentes o adultos que están siendo considerados para el tratamiento con medicamentos estimulantes deben tener un examen físico y una historia cuidadosa (incluyendo evaluación de la historia familiar por muerte súbita o arritmia ventricular) para evaluar la presencia de enfermedad cardíaca, y deben recibir evaluación cardíaca adicional si los hallazgos sugieren tal enfermedad (por ejemplo, electrocardiograma y ecocardiograma). Los pacientes que desarrollan síntomas como dolor opresivo en el pecho, síncope sin explicación u otros síntomas que sugieren enfermedad cardíaca durante el tratamiento con estimulantes deben someterse a una evaluación cardíaca inmediata.
Trastornos psiquiátricos
• Tendencia suicida
Los pacientes en los que aparezca un ideación o comportamiento suicida durante el tratamiento para el TDAH deben ser evaluados inmediatamente por su médico.
Se debe tener en consideración el empeoramiento de un problema psiquiátrico subyacente y una posible relación causal con el tratamiento con metilfenidato.
Puede ser necesario tratar un problema psiquiátrico subyacente y se debe valorar una posible interrupción de metilfenidato.
Eventos adversos psiquiátricos
Psicosis preexistente
La administración de estimulantes puede exacerbar los síntomas de la alteración de la conducta y trastorno del pensamiento en pacientes con un trastorno psicótico preexistente.
Enfermedad bipolar
Se debe tener cuidado particular cuando se usa estimulantes para tratar el TDAH en pacientes con trastorno bipolar comórbido debido a la preocupación por la posible inducción de un episodio mixto/maniaco en tales pacientes. Antes de iniciar el tratamiento con un estimulante, debe examinarse adecuadamente a los pacientes con síntomas depresivos comórbidos para determinar si están en riesgo de trastorno bipolar; tal examen debe incluir una historia psiquiátrica detallada incluyendo historia familiar de suicidio, trastorno bipolar y depresión.
Aparición de nuevos síntomas psicóticos o maniacos
Los síntomas psicóticos o maniacos emergentes del tratamiento, por ejemplo, alucinaciones, pensamiento delirante o manía en pacientes sin historia previa de enfermedad psicótica o manía pueden ser causados por estimulantes a dosis usuales. Si ocurren tales síntomas, debe considerarse un posible rol causal del estimulante y la discontinuación del tratamiento puede ser apropiada. En un análisis combinado de estudios múltiples, controlados con placebo a corto plazo, tales síntomas ocurrieron en aproximadamente 0.1% (4 pacientes con eventos de 3482 expuestos a metilfenidato o anfetamina por varias semanas a dosis usuales) de los pacientes tratados con estimulantes en comparación a 0 en los pacientes tratados con el placebo.
Agresión
Conducta agresiva u hostilidad son a menudo observadas en pacientes con TDAH, y se han sido reportadas en ensayos clínicos y en la experiencia post-comercialización de algunos medicamentos indicados para el tratamiento del TDAH. Aunque no hay evidencia sistemática que los estimulantes causan una conducta agresiva u hostilidad, los pacientes que inician el tratamiento para el TDAH por deben ser monitoreados por la aparición o empeoramiento de la conducta agresiva u hostilidad.
Convulsiones
Existe alguna evidencia clínica que los estimulantes pueden reducir el umbral convulsivo en pacientes con historia previa de convulsiones, en pacientes con anormalidades previas en el EEG en ausencia de convulsiones y, muy raramente, en pacientes sin historia de convulsiones y sin evidencia previa en el EEG de convulsiones. En presencia de convulsiones, el fármaco debe ser discontinuado.
Priapismo
Se han notificado erecciones prolongadas y dolorosas asociadas a uso de medicamentos con metilfenidato, relacionadas de forma principal con un cambio en la pauta de tratamiento con metilfenidato. Los pacientes que presenten erecciones anormalmente prolongadas o frecuentes y dolorosas deben acudir al médico de forma inmediata.
Se han reportado erecciones prolongadas y dolorosas que a veces requirieron intervención quirúrgica, con productos con metilfenidato incluyendo CONCERTA®, en pacientes pediátricos y adultos (ver sección Reacciones Adversas). No se reportó priapismo con la iniciación del fármaco pero se desarrolló después de algún tiempo con el fármaco, a menudo posterior a un incremento de la dosis. También se ha presentado priapismo durante un período de retiro del fármaco (descanso del fármaco o durante la discontinuación). Los pacientes que desarrollan erecciones frecuentes o anormalmente sostenidas y dolorosas deben buscar atención médica inmediata.
Vasculopatía periférica, incluyendo el Fenómeno de Raynaud
Los estimulantes, incluyendo CONCERTA®, usados para tratar el TDAH están asociados con vasculopatía periférica, incluyendo el Fenómeno de Raynaud. Los signos y síntomas son usualmente intermitentes y leves; sin embargo, las secuelas muy raras incluyen ulceración digital y/o degradación del tejido blando. Se observaron efectos de vasculopatía periférica, incluyendo el Fenómeno de Raynaud, en reportes post-comercialización en diferentes momentos y a dosis terapéuticas en todos los grupos de edad durante en el transcurso del tratamiento. Los signos y síntomas generalmente mejoran después de la reducción de la dosis o discontinuación del fármaco. Es necesaria la observación cuidadosa de los cambios digitales durante el tratamiento con estimulantes para el TDAH. Evaluación clínica adicional (por ejemplo, referencia a reumatología) puede ser apropiada para algunos pacientes.
Crecimiento
Se ha descrito una reducción del aumento de peso corporal y un retraso del crecimiento moderados con el uso prolongado de metilfenidato en niños. Actualmente no se conocen y se están estudiando los efectos de metilfenidato sobre la altura y peso finales. Se debe controlar el crecimiento durante el tratamiento con metilfenidato: altura, peso y apetito se deben registrar al menos cada 6 meses en una gráfica de crecimiento. Puede ser necesario interrumpir el tratamiento en aquellos pacientes que no crezcan o aumenten de peso como se espera.
Supresión del crecimiento a largo plazo
El seguimiento cuidadoso del peso y la estatura en niños de 7 a 10 años quienes fueron aleatorizados a grupos de tratamiento con metilfenidato o sin medicación durante 14 meses, así como en subgrupos naturalistas de niños recientemente tratados con metilfenidato y no tratados con medicación durante 36 meses (para las edades de 10 a 13 años), sugiere que los niños medicados de manera consistente (es decir, tratamiento durante 7 días a la semana durante todo el año) tienen una disminución temporal de la velocidad de crecimiento (en promedio, un total de aproximadamente 2 cm menos de la estatura y 2.7 kg menos del peso durante 3 años), sin evidencia de rebote del crecimiento durante este período de desarrollo. Los datos publicados son inadecuados para determinar si el uso crónico de anfetaminas puede causar supresión similar del crecimiento; sin embargo, se prevé que probablemente también tengan este efecto. Por lo tanto, se debe monitorear el crecimiento durante el tratamiento con estimulantes, y los pacientes que no están creciendo o ganando estatura o peso como se esperaba pueden necesitar la interrupción de su tratamiento.
Alteración visual
Se han reportado dificultades con la acomodación y visión borrosa con el tratamiento con estimulantes.
Potencial para obstrucción gastrointestinal
Debido a que la tableta de CONCERTA® es no deformable y no cambia de forma de manera apreciable en el tracto GI, CONCERTA® no debe ser administrado regularmente a pacientes con estrechamiento gastrointestinal preexistente severo (patológico o iatrogénico, por ejemplo: trastornos de la motilidad esofágica, enfermedad inflamatoria del intestino delgado, síndrome de “intestino corto” debido a adherencias o disminución del tiempo de tránsito, historia pasada de peritonitis, fibrosis quística, pseudo-obstrucción intestinal crónica o divertículo de Meckel). Hubo reportes raros de síntomas obstructivos en pacientes con estenosis conocida en asociación con la ingesta de fármacos en formulaciones de liberación controlada no deformables. Debido al diseño de liberación controlada de la tableta, solo debe usarse CONCERTA® en pacientes que puedan ingerir la tableta entera (ver sección Información para el paciente).
Monitoreo hematológico
Se recomienda el recuento diferencial, periódico de las células sanguíneas (CBC) y de las plaquetas durante la terapia prolongada.
ABUSO Y DEPENDENCIA DEL FÁRMACO
Sustancia controlada
Metilfenidato es una sustancia controlada de la Lista II bajo la Ley de Sustancias Controladas.
Abuso
Como se indica en el recuadro de Advertencia, CONCERTA® debe administrarse con precaución a pacientes con antecedente de farmacodependencia o alcoholismo. El uso abusivo crónico puede conducir a tolerancia marcada y dependencia psicológica con diversos grados de conducta anormal. Pueden ocurrir episodios claramente psicóticos, especialmente con el abuso parenteral.
En dos estudios controlados con placebo del potencial abuso en humanos, se compararon dosis orales únicas de CONCERTA® con dosis orales únicas de metilfenidato de liberación inmediata y el placebo en sujetos con antecedente de uso de estimulantes recreativos para evaluar el abuso potencial relativo. Para el propósito de esta evaluación, se definió la respuesta para cada una de las medidas subjetivas como el efecto máximo dentro de las primeras 8 horas después de la administración de la dosis.
En un estudio (n = 40), CONCERTA® (108 mg) y 60 mg de metilfenidato de liberación inmediata comparado con el placebo produjeron mayores respuestas estadísticamente significativas en las cinco medidas subjetivas sugerentes de abuso potencial. Sin embargo, en las comparaciones entre los dos tratamientos activos, CONCERTA® (108 mg) produjo respuestas variables en las medidas subjetivas positivas que fueron estadísticamente indistinguibles de (abuso potencial, gusto por el fármaco, anfetamina y grupo morfina benzedrina [Euforia]) o estadísticamente menores que las respuestas (estimulación-euforia) producidas por 60 mg de metilfenidato de liberación inmediata.
En otro estudio (n = 49), ambas dosis de CONCERTA® (54 mg y 108 mg) y ambas dosis de metilfenidato de liberación inmediata (50 mg y 90 mg) produjeron mayores respuestas estadísticamente significativas en comparación con el placebo en las dos escalas primarias usadas en el estudio (gusto por el fármaco, euforia). Cuando se compararon las dosis de CONCERTA® (54 mg y 108 mg) con metilfenidato de liberación inmediata (50 mg y 90 mg), respectivamente, CONCERTA® produjo menores respuestas subjetivas estadísticamente significativas en estas dos escalas que el metilfenidato de liberación inmediata. CONCERTA® (108 mg) produjo respuestas que fueron estadísticamente indistinguibles de las respuestas en estas dos escalas producidas por metilfenidato de liberación inmediata (50 mg). Se debe considerar las diferencias en las respuestas subjetivas a las dosis respectivas en el contexto que solo el 22% de la cantidad total de metilfenidato en las tabletas de CONCERTA® está disponible para la liberación inmediata desde del recubrimiento del fármaco.
Aunque estos hallazgos revelan una respuesta relativamente menor para CONCERTA® en las medidas subjetivas sugestivas del abuso potencial en comparación con metilfenidato de liberación inmediata a dosis totales aproximadamente equivalentes de metilfenidato, se desconoce la relevancia de estos hallazgos para el abuso potencial de CONCERTA® en la comunidad.
Dependencia
Como se indica en el recuadro de advertencia, se requiera una supervisión cuidadosa durante el retiro del uso abusivo debido a que puede ocurrir depresión severa. El retiro luego de uso terapéutico crónico puede desenmascarar síntomas del trastorno subyacente que pueden requerir seguimiento.
DOSIS Y ADMINISTRACIÓN
Información general de dosificación
CONCERTA® debe ser administrado oralmente una vez al día en la mañana con o sin los alimentos.
CONCERTA® debe ingerirse entero con ayuda de líquidos y no debe masticarse, dividirse o triturarse (ver sección Información para el paciente).
Pacientes nuevos al metilfenidato
La dosis inicial recomendada de CONCERTA® para pacientes que no están tomando actualmente metilfenidato o estimulantes diferentes al metilfenidato es 18 mg una vez al día para niños y adolescentes, y 18 o 36 mg una vez al día para adultos (ver Tabla 1).
|
Tabla 1. Rango de dosis y dosis inicial recomendada de CONCERTA® |
||
|
Edad del paciente |
Dosis inicial recomendada |
Rango de dosis |
|
Niños de 6-12 años de edad |
18 mg/día |
18 mg - 54 mg/día |
|
Adolescentes de 13-17 años de edad |
18 mg/día |
18 mg - 72 mg/día no exceder 2 mg/kg/día |
|
Adultos de 18-65 años de edad |
18 o 36 mg/día |
18 mg - 72 mg/día |
Pacientes usando actualmente metilfenidato
La dosis recomendada de CONCERTA® para pacientes que están toman actualmente metilfenidato dos veces al día o tres veces al día a dosis de 10 a 60 mg/día se proporciona en la Tabla 2. Las recomendaciones de la dosificación se basan en el régimen de dosis actual y en el juicio clínico. La dosis de conversión no debe exceder 72 mg al día.
|
Tabla 2. Conversión de dosis recomendada a partir de regímenes de metilfenidato a CONCERTA® |
|
|
Dosis diaria previa de metilfenidato |
Dosis inicial recomendada de CONCERTA® |
|
5 mg de metilfenidato dos o tres veces al día |
18 mg cada mañana |
|
10 mg de metilfenidato dos o tres veces al día |
36 mg cada mañana |
|
15 mg de metilfenidato dos o tres veces al día |
54 mg cada mañana |
|
20 mg de metilfenidato dos o tres veces al día |
72 mg cada mañana |
Otros regímenes de metilfenidato: Se debe usar el juicio clínico cuando se seleccione la dosis inicial.
Titulación de la dosis
Las dosis pueden incrementarse en 18 mg a intervalos semanales en pacientes que no han logrado una respuesta óptima a una dosis menor. No se ha estudiado y no se recomiendan dosis diarias por encima de 54 mg en niños y 72 mg en adolescentes. No se recomiendan dosis diarias por encima de 72 mg en adultos.
Tratamiento extendido/mantenimiento
No existe evidencia disponible a partir de ensayos controlados para indicar cuánto tiempo el paciente con TDAH debe ser tratado con CONCERTA®. Sin embargo, es de acuerdo general que el tratamiento farmacológico del TDAH puede ser necesario durante períodos prolongados.
La eficacia de CONCERTA® para uso prolongado, es decir por más de 7 semanas no ha sido evaluado sistemáticamente en ensayos controlados. El médico que elige usar CONCERTA® por períodos prolongados en pacientes con TDAH debe reevaluar periódicamente la utilidad del fármaco a largo plazo para el paciente individual con ensayos sin medicación para evaluar el funcionamiento del paciente sin farmacoterapia. La mejoría se puede mantener cuando el fármaco es discontinuado temporal o permanentemente.
Discontinuación y reducción de la dosis
Si ocurre agravamiento paradójico de los síntomas u otros eventos adversos, se debe reducir la dosis, o, si es necesario, se debe discontinuar el fármaco.
Si no se observa mejoría después del ajuste adecuado de la dosis durante un período de un mes, se debe discontinuar el fármaco.
USO EN POBLACIONES ESPECÍFICAS
Embarazo
Categoría C del embarazo
Se ha demostrado que metilfenidato tiene efectos teratogénicos en conejos cuando se administró en dosis de 200 mg/kg/día, lo cual es aproximadamente 100 veces y 40 veces la dosis máxima recomendada en humanos sobre una base de mg/kg y mg/m2, respectivamente.
Un estudio de reproducción en ratas no reveló evidencia de daño para el feto a dosis orales hasta de 30 mg/kg/día, aproximadamente 15 veces y 3 veces la dosis máxima recomendada en humanos de CONCERTA® sobre una base de mg/kg y mg/m2, respectivamente. La exposición plasmática aproximada a metilfenidato más su metabolito principal PPAA en ratas embarazadas fue 1-2 veces la observada en ensayos en voluntarios y pacientes con la dosis máxima recomendada de CONCERTA® en base al AUC.
No se ha establecido la seguridad de metilfenidato para uso durante el embarazo en humanos. No existen estudios adecuados y bien controlados en mujeres embarazadas. CONCERTA® debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Trabajo de parto y parto
Se desconoce el efecto de CONCERTA® en el trabajo de parto y parto en humanos.
Madres en período de lactancia
Se desconoce si el metilfenidato se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, se debe tener precaución si se administra CONCERTA® a una mujer en período de lactancia.
En ratas hembra en período de lactancia tratadas con una dosis oral única de 5 mg/kg de metilfenidato radiomarcado, se observó radioactividad (representando metilfenidato y/o sus metabolitos) en la leche y los niveles fueron generalmente similares a los del plasma.
Uso pediátrico
No debe usarse CONCERTA® en niños menores de seis años de edad, ya que no se ha establecido la seguridad y eficacia en este grupo de edad. No se ha establecido bien los efectos a largo plazo del metilfenidato en los niños.
Uso geriátrico
No se ha estudiado CONCERTA® en pacientes mayores de 65 años de edad.
SOBREDOSIFICACIÓN
Signos y Síntomas
Los signos y síntomas de la sobredosificación de CONCERTA® (metilfenidato), que resultan principalmente de una sobreestimulación del sistema nervioso central y de efectos simpaticomiméticos excesivos, pueden incluir los siguientes: vómitos, agitación, contracciones musculares, convulsiones, convulsiones gran mal, estado de confusión, alucinaciones (auditivas y/o visuales), hiperhidrosis, cefalea, pirexia, taquicardia, palpitaciones, aumento de la frecuencia cardíaca, arritmia sinusal, hipertensión, rabdomiólisis, midriasis y sequedad de boca.
Tratamiento recomendado
El tratamiento consiste en medidas de soporte adecuadas. Se debe proteger al paciente contra autolesiones y contra estímulos externos que agravarían la sobreestimulación ya presente. Puede evacuarse el contenido gástrico mediante lavado gástrico según lo indicado. Antes de realizar el lavado gástrico, controlar la agitación y las convulsiones si están presentes y proteger las vías respiratorias.
Otras medidas para desintoxicar el intestino incluyen la administración de carbón activado y un laxante. Se debe proporcionar cuidado intensivo para mantener un intercambio respiratorio y una circulación adecuada; se puede requerir procedimientos de enfriamiento externo para la pirexia.
No se ha establecido la eficacia de la diálisis peritoneal o hemodiálisis extracorpórea para la sobredosis con CONCERTA®.
Se debe considerar la liberación prolongada de metilfenidato de CONCERTA® cuando se trata a pacientes con sobredosis.
Centro de control de intoxicación
Al igual que el manejo de toda sobredosis, se debe considerar la posibilidad de ingesta de múltiples fármacos. El médico podría considerar contactar a un centro de control de intoxicación por información actualizada sobre el manejo de sobredosis con metilfenidato.
DESCRIPCIÓN
CONCERTA® es un estimulante del sistema nervioso central (SNC). CONCERTA® está disponible en tableta en tres concentraciones. Cada tableta de liberación prolongada para administración oral una vez al día contiene 18, 36 o 54 mg de clorhidrato de metilfenidato USP y está diseñada para tener un efecto de 12 horas de duración. Químicamente, el clorhidrato de metilfenidato es d,l (racémico) clorhidrato de metil α-fenil-2- piperidinacético. Su fórmula empírica es C14H19NO2• HCl. Su fórmula estructural es:
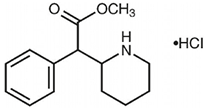
El clorhidrato de metilfenidato USP es un polvo blanco, cristalino, inodoro. Sus soluciones son ácidas al tornasol. Es fácilmente soluble en agua y en metanol, soluble en alcohol y ligeramente soluble en cloroformo y en acetona. Su peso molecular es 269.77.
Componentes y rendimiento del sistema
CONCERTA® usa presión osmótica para suministrar clorhidrato de metilfenidato a una velocidad controlada. El sistema, el cual se parece a una tableta convencional en apariencia, comprende de un núcleo de tres capas osmóticamente activo rodeado por una membrana semipermeable con un recubrimiento de liberación inmediata del fármaco. El núcleo de tres capas está compuesto por dos capas de fármaco que contienen el fármaco y los excipientes, y una capa de empuje que contiene los componentes osmóticamente activos. Hay un orificio perforado con un láser de precisión en el extremo de la capa del fármaco de la tableta. En un entorno acuoso, como el tracto gastrointestinal, el recubrimiento del fármaco se disuelve dentro de una hora, proporcionando una dosis inicial de metilfenidato. El agua penetra a través de la membrana en el núcleo de la tableta. A medida que los excipientes polímeros osmóticamente activos se expanden, se libera el metilfenidato a través del orificio. La membrana controla la velocidad a la cual el agua ingresa en el núcleo de la tableta, que a su vez controla el suministro del fármaco. Además, la velocidad de liberación del fármaco a partir del sistema se incrementa con el tiempo durante un período de 6 a 7 horas debido a la gradiente de concentración-fármaco incorporado en las dos capas de fármacos de CONCERTA®. Los componentes biológicamente inertes de la tableta permanecen intactos durante el tránsito gastrointestinal y se eliminan en las heces como cubierta de la tableta junto con los componentes insolubles del núcleo. Es posible que las tabletas de liberación prolongada de CONCERTA® sean visibles en los Rayos-X abdominales bajo ciertas circunstancias, especialmente cuando se utilizan técnicas de mejoramiento digital.
FARMACOLOGÍA CLÍNICA
Mecanismo de Acción
El clorhidrato de metilfenidato es un estimulante del sistema nervioso central (SNC).
Se desconoce el modo de la acción terapéutica en el trastorno por déficit de atención e hiperactividad (TDAH). Se cree que el metilfenidato bloquea la recaptación de norepinefrina y dopamina en la neurona presináptica e incrementa la liberación de estas monoaminas en el espacio extraneuronal.
Farmacodinámica
El metilfenidato es una mezcla racémica compuesta por los isómeros d y l. El isómero d es más farmacológicamente activo que el isómero l.
Farmacocinética
Absorción
El metilfenidato se absorbe rápidamente. Luego de la administración oral de CONCERTA®, las concentraciones plasmáticas de metilfenidato se incrementan rápidamente, alcanzando un máximo inicial en aproximadamente 1 hora, seguido de concentraciones ascendentes graduales durante las siguientes 5 a 9 horas, tras lo cual se inicia una disminución gradual. Los tiempos medios para alcanzar las concentraciones plasmáticas máximas en todas las dosis de CONCERTA® ocurrieron entre 6 y 10 horas.
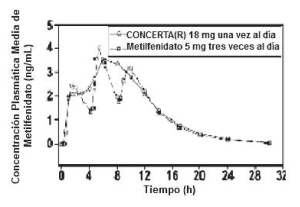
CONCERTA® una vez al día minimiza las fluctuaciones entre las concentraciones máximas y mínimas asociadas con metilfenidato de liberación inmediata tres veces al día (ver Figura 1). Es comparable la biodisponibilidad relativa de CONCERTA® una vez al día y metilfenidato tres veces al día en adultos.
Figura 1. Concentraciones plasmáticas medias de metilfenidato en 36 adultos, luego de una dosis única de CONCERTA® 18 mg una vez al día y metilfenidato 5 mg de liberación inmediata tres veces al día administrado cada 4 horas.
Los parámetros farmacocinéticos medios de la dosis única en 36 adultos sanos luego de la administración de CONCERTA® 18 mg una vez al día y metilfenidato 5 mg tres veces al día se resumen en la Tabla 6.
|
Tabla 6. Parámetros farmacocinéticos (Media ± DE) después de la dosis única en adultos sanos |
||
|
Parámetros |
CONCERTA® |
Metilfenidato |
|
Cmáx (ng/mL) Tmáx (h) AUCinf (ng• h/mL) t½(h) |
3.7 ± 1.0 6.8 ± 1.8 41.8 ± 13.9 3.5 ± 0.4 |
4.2 ± 1.0 6.5 ± 1.8 38.0 ± 11.0 3.0 ± 0.5 |
Se evaluó la farmacocinética de CONCERTA® en adultos sanos luego de la administración de dosis única y múltiples (estado estacionario) de hasta 144 mg/día. La vida media promedio fue alrededor de 3.6 horas. No se observaron diferencias en la farmacocinética de CONCERTA® luego de la ½ dosificación única y repetida una vez al día, lo que indica acumulación no significativa del fármaco. El AUC y el t½ luego de la administración repetida una vez al día son similares a los observados luego de la primera dosis de CONCERTA® en un rango de dosis de 18 a 144 mg.
Proporcionalidad de la dosis
Luego de la administración de CONCERTA® en dosis únicas de 18, 36 y 54 mg/día a adultos sanos, la Cmáx y el AUC (0-inf) de d-metilfenidato fueron proporcionales a la dosis, mientras que la Cmáx y el AUC (0-inf) de l-metilfenidato se incrementaron desproporcionalmente con respecto a la dosis. Luego de administración de CONCERTA®, las concentraciones plasmáticas del isómero l fueron aproximadamente 1/40 de las concentraciones plasmáticas del isómero d.
En adultos sanos, la dosificación única y múltiple de dosis diarias de CONCERTA® de 54 a 144 mg/día produjo incrementos lineales y proporcionales a la dosis en la Cmáx y el AUCinf para el metilfenidato total y su metabolito principal, ácido a-fenil-piperidinacético (PPA). No hubo dependencia del tiempo en la farmacocinética del metilfenidato. La proporción del metabolito (PPA) a fármaco predecesor (metilfenidato) fue constante a través de la dosis de 54 a 144 mg/día, después de la dosis única y de la dosificación múltiple.
En un estudio de dosis múltiple en pacientes adolescentes con TDAH de 13 a 16 años de edad que recibieron su dosis prescrita (18 a 72 mg/día) de CONCERTA®, la Cmáx y el AUCTAU medios de d-metilfenidato y metilfenidato total se incrementaron proporcionalmente con respecto a la dosis.
Distribución
Las concentraciones plasmáticas de metilfenidato en adultos y adolescentes disminuyen de manera biexponencial luego de la administración oral. La vida media de metilfenidato en adultos y adolescentes luego de la administración oral de CONCERTA® fue aproximadamente 3.5 horas.
Metabolismo y Excreción
En humanos, el metilfenidato es metabolizado principalmente por des-esterificación a PPA, el cual tiene escasa o nula actividad farmacológica. En adultos, el metabolismo de CONCERTA® una vez al día, según lo evaluado mediante el metabolismo a PPA, es similar al del metilfenidato tres veces al día. El metabolismo de las dosis única y repetida una vez al día de CONCERTA® es similar.
Después de la dosificación oral de metilfenidato radiomarcado en humanos, aproximadamente el 90% se recuperó en la orina. El principal metabolito urinario fue el PPA, que representa aproximadamente el 80% de la dosis.
Efectos de los alimentos
En los pacientes, no hubo diferencias en la farmacocinética ni en el rendimiento farmacodinámico de CONCERTA® cuando se administró después de un desayuno alto en grasa. No existe evidencia de descarga rápida de la dosis en presencia o ausencia de alimentos.
Efecto del alcohol
Se realizó un estudio in vitro para explorar el efecto del alcohol en las características de liberación de metilfenidato de la forma de dosificación de la tableta de CONCERTA® 18 mg. A una concentración de alcohol hasta de 40% no hubo incremento en la liberación de metilfenidato en la primera hora. Los resultados con la tableta de 18 mg de concentración se consideraron representativos de las otras tabletas de concentraciones disponibles.
Poblaciones Especiales
Género
En adultos sanos, los valores medios del AUC(0-inf) ajustados por la dosis para CONCERTA® fueron 36.7 ng• h/mL en varones y 37.1 ng• h/mL en mujeres, sin diferencias observadas entre los dos grupos.
Raza
En adultos que reciben CONCERTA®, el AUC (0-inf) ajustado por la dosis fue consistente en los grupos étnicos; sin embargo, el tamaño de la muestra puede haber sido insuficiente para detectar variaciones étnicas de la farmacocinética.
Edad
El incremento de la edad produjo un incremento en la depuración oral aparente (CL/F) (incremento del 58% en adolescentes comparado con los niños). Algunas de estas diferencias podrían explicarse por las diferencias en el peso corporal entre estas poblaciones. Esto sugiere que los sujetos con mayor peso corporal pueden tener exposiciones menores de metilfenidato total a dosis similares.
No se ha estudiado la farmacocinética de CONCERTA® en niños menores de 6 años de edad.
Insuficiencia renal
No existe experiencia con el uso de CONCERTA® en pacientes con insuficiencia renal. Después de la administración oral de metilfenidato radiomarcado en humanos, el metilfenidato fue ampliamente metabolizado y aproximadamente el 80% de la radioactividad fue excretada en la orina en la forma de PPA. Debido a que la depuración renal no es una vía importante de la depuración del metilfenidato, se espera que la insuficiencia renal tenga poco efecto en la farmacocinética de CONCERTA®.
Insuficiencia Hepática
No existe experiencia con el uso de CONCERTA® en pacientes con insuficiencia hepática.