
AXELIA 75 MG
PREGABALINA
Cápsulas
Caja , 2,4,6,8 o 10 Cápsulas , 75 Miligramos
Caja , 12,14,15 o 20 Cápsulas , 75 Miligramos
Caja , 25,28,30 o 40 Cápsulas , 75 Miligramos
Caja , 50,60 o 80 Cápsulas , 75 Miligramos
Caja , 100 o 120 Cápsulas , 75 Miligramos
Caja , 200 o 300 Cápsulas , 75 Miligramos
COMPOSICIÓN:
Cada CÁPSULA contiene:
Pregabalina 75 mg
Excipientes c.s.p.
ACCIÓN FARMACOLÓGICA:
Propiedades farmacodinámicas:
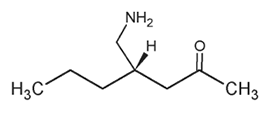
El principio activo, pregabalina, es un análogo del ácido gamma-aminobutírico [ácido (S)-3- ( aminometil)-5-metilhexanoico].
Mecanismo de acción:
La pregabalina se une a una subunidad auxiliar (proteína ?2-?) de los canales de calcio dependientes del voltaje en el Sistema Nervioso Central.
Eficacia clínica y seguridad:
Epilepsia:
Tratamiento complementario:
La pregabalina se ha estudiado en 3 ensayos clínicos controlados con una duración de hasta 12 semanas tanto con dos (DVD) como con tres administraciones al día (TVD). En términos generales, los perfiles de seguridad y eficacia para los regímenes posológicos de dos y tres veces al día fueron similares.
Se observó una reducción en la frecuencia de las crisis a la primera semana de tratamiento.
Población pediátrica:
No se ha establecido la eficacia ni la seguridad de pregabalina como tratamiento complementario para la epilepsia en pacientes pediátricos de menos de 12 años y adolescentes. Los acontecimientos adversos observados en un estudio de farmacocinética y tolerabilidad en el que participaron pacientes de entre 3 meses y 16 años de edad (n = 65) fueron similares a los observados en los adultos. Los resultados de un estudio de seguridad, sin enmascaramiento, de 1 año de duración en 54 pacientes pediátricos de entre 3 meses y 16 años de edad con epilepsia indican que los acontecimientos adversos de pirexia e infecciones respiratorias altas se observaron con mayor frecuencia que en los estudios en adultos (ver secciones "Dosis y Vía de Administración", "Reacciones Adversas" y "Acción Farmacológica - Propiedades Farmacocinéticas").
Monoterapia (pacientes recientemente diagnosticados):
Pregabalina se ha estudiado en 1 ensayo clínico controlado de 56 semanas de duración administrada DVD. Pregabalina no demostró no inferioridad frente a lamotrigina en base a la variable de estar libre de crisis durante 6 meses. Pregabalina y lamotrigina tuvieron perfiles de seguridad similares y buena tolerabilidad.
Trastorno de ansiedad generalizada:
La pregabalina se ha estudiado en 6 ensayos controlados de 4-6 semanas de duración, un estudio en pacientes de edad avanzada de 8 semanas de duración y un estudio a largo plazo de prevención de recaídas con una fase doble ciego de prevención de recaídas de 6 meses de duración.
En la primera semana se observó un alivio de los síntomas del TAG como se reflejó en la Escala de Valoración de la Ansiedad de Hamilton (HAM-A).
En los ensayos clínicos controlados (4-8 semanas de duración) el 52% de los pacientes tratados con pregabalina y el 38% de los que recibieron placebo mejoraron la puntuación total de la HAM-A en al menos un 50% desde la visita basal hasta la finalización del estudio.
En ensayos clínicos controlados, una mayor proporción de pacientes tratados con pregabalina, en comparación con aquellos tratados con placebo, notificó visión borrosa que en la mayoría de los casos se resolvió al continuar con el tratamiento. Se realizaron pruebas oftalmológicas (incluyendo pruebas de agudeza visual, pruebas de campo visual y examen fundoscópico en pupila dilatada) a más de 3600 pacientes como parte de los ensayos clínicos controlados. La agudeza visual se redujo en un 6,5% en los pacientes tratados con pregabalina frente al 4,8% en los pacientes tratados con placebo. Se detectaron alteraciones del campo visual en el 12,4% de los pacientes tratados con pregabalina frente al 11,7% de los pacientes tratados con placebo. Se observaron cambios fundoscópicos en el 1, 7% de los pacientes tratados con pregabalina frente al 2, 1 % de los pacientes tratados con placebo.
Propiedades farmacoclnéticas:
Los parámetros farmacocinéticos de pregabalina en el estado estacionario son similares en voluntarios sanos, pacientes con epilepsia recibiendo fármacos antiepilépticos y pacientes con dolor crónico.
Absorción:
La pregabalina se absorbe rápidamente cuando se administra en ayunas, alcanzando concentraciones plasmáticas máximas una hora tras la administración tanto de dosis única como de dosis múltiples. La biodisponibilidad oral de pregabalina se estima que es > 90% y es independiente de la dosis. Tras la administración repetida, el estado estacionario se alcanza en las 24 a 48 horas posteriores. La velocidad de absorción de pregabalina disminuye cuando se administra con alimentos, produciéndose un descenso en la Cmax de aproximadamente un 25- 30% y un retraso en el tmax de aproximadamente 2,5 horas. Sin embargo, la administración de pregabalina junto con alimentos no tiene ningún efecto clínicamente significativo sobre el grado de absorción de pregabalina.
Distribución:
En estudios preclínicos, se ha visto que la pregabalina atraviesa la barrera hematoencefálica en ratones, ratas y monos. Se ha visto que la pregabalina atraviesa la placenta en ratas y está presente en la leche de ratas lactantes. En humanos, el volumen de distribución aparente de la pregabalina tras la administración oral es de aproximadamente 0,56 Ukg. La pregabalina no se une a las proteínas plasmáticas.
Biotransformación:
La pregabalina sufre un metabolismo insignificante en humanos. Tras una dosis de pregabalina marcada isotópicamente, aproximadamente el 98% de la radioactividad recuperada en orina procedía de pregabalina inalterada. El derivado N-metilado de pregabalina, metabolito principal de ésta encontrado en orina, representó el 0,9% de la dosis. En estudios preclínicos, no hubo indicios de racemización del S-enantiómero de pregabalina al R-enantiómero.
Eliminación:
La pregabalina se elimina del sistema circulatorio principalmente mediante excreción renal como fármaco inalterado. La semivida media de eliminación de pregabalina es de 6,3 horas. El aclaramiento plasmático y el aclaramiento renal de pregabalina son directamente proporcionales al aclaramiento de creatinina (ver sección "Acción Farmacológica - Alteración renal").
Es necesario un ajuste de la dosis en pacientes con la función renal alterada o en hemodiálisis (ver sección "Dosis y Vía de Administración -Tabla 1").
Linealidad/No linealidad:
La farmacocinética de pregabalina es lineal en el rango de dosis diaria recomendada. La variabilidad farmacocinética interindividual de pregabalina es baja(< 20%). La farmacocinética de dosis múltiples es predecible a partir de los datos obtenidos con dosis única. Por tanto, no es necesario llevar una monitorización rutinaria de las concentraciones plasmáticas de pregabalina.
Sexo:
Los ensayos clínicos indican que el sexo no tiene influencia clínicamente significativa sobre las concentraciones plasmáticas de pregabalina.
Alteración renal:
El aclaramiento de pregabalina es directamente proporcional al aclaramiento de creatinina. Además, la pregabalina se elimina del plasma de forma eficaz mediante hemodiálisis (tras una sesión de hemodiálisis de 4 horas, las concentraciones plasmáticas de pregabalina se reducen aproximadamente al 50%). Dado que la eliminación por vía renal es la principal vía de eliminación, en pacientes con insuficiencia renal es necesaria una reducción de la dosis y una dosis complementaria tras la hemodiálisis (ver sección "Dosis y Vía de Administración - Tabla 1 ").
Alteración hepática:
No se han llevado a cabo estudios de farmacocinética específicos en pacientes con la función hepática alterada. Puesto que la pregabalina no sufre un metabolismo significativo y se excreta mayoritariamente como fármaco inalterado en orina, no es previsible que una alteración de la función hepática altere de forma significativa las concentraciones plasmáticas de pregabalina.
Población pediátrica:
En un estudio de farmacocinética y tolerabilidad se evaluó la farmacocinética de pregabalina en pacientes pediátricos con epilepsia (grupos de edad: de 1 a 23 meses, de 2 a 6 años, de 7 a 11 años y de 12 a 16 años) con concentraciones de dosis de 2,5, 5, 10 y 15 mg/kg/día.
En general, el tiempo transcurrido hasta alcanzar la concentración plasmática máxima tras la administración oral de pregabalina a pacientes pediátricos en ayunas fue similar en todo el grupo de edad y se produjo entre 0,5 horas y 2 horas después de la dosis.
Los parámetros de Cmax y AUC de pregabalina aumentaron de forma lineal con el aumento de la dosis en cada grupo de edad. El AUC fue un 30% menor en los pacientes pediátricos con un peso inferior a 30 kg debido a un mayor aclaramiento ajustado al peso corporal del 43% en estos pacientes en comparación con los pacientes con un peso > 30 kg.
La semivida terminal promedio de pregabalina fue, aproximadamente, de entre 3 y 4 horas en los pacientes pediátricos de hasta 6 años de edad, y de entre 4 y 6 horas en los de 7 años o más.
El análisis de farmacocinética poblacional mostró que el aclaramiento de creatinina era una covariable significativa del aclaramiento de pregabalina oral, el peso corporal era una covariable significativa del volumen de distribución aparente de pregabalina oral, y que dichas relaciones eran similares en los pacientes pediátricos y adultos.
No se ha estudiado la farmacocinética de pregabalina en pacientes de menos de 3 meses de edad (ver secciones "Dosis y Vía de Administración", "Reacciones Adversas" y "Acción Farmacológica - Propiedades Farmacodinámicas").
Pacientes de edad avanzada (mayores de 65 años de edad):
El aclaramiento de pregabalina tiende a disminuir al aumentar la edad. Este descenso en el aclaramiento de pregabalina oral está en relación con el descenso del aclaramiento de creatinina asociado con el aumento de la edad. Podría requerirse una reducción de la dosis de pregabalina en pacientes que tengan la función renal alterada debido a la edad (ver sección "Dosis y Vía de Administración- Tabla 1").
Madres lactantes:
Se evaluó la farmacocinética de 150 mg de pregabalina administrados cada 12 horas (dosis diaria de 300 mg), en 10 mujeres lactantes, tras al menos 12 semanas después del parto. La lactancia tuvo un efecto nulo o pequeño sobre la farmacocinética de pregabalina. Pregabalina se excretó por la leche materna a concentraciones promedio, en estado de equilibrio, de aproximadamente el 76% de las presentes en el plasma materno. La dosis estimada para el lactante procedente de la leche materna (suponiendo un consumo medio de leche de 150 ml/kg/día) de las mujeres que reciben 300 mg/día o la dosis máxima de 600 mg/día sería de 0,31 o 0,62 mg/kg/día, respectivamente. Estas dosis estimadas son aproximadamente el 7% de la dosis materna diaria total, en mg/kg.
INDICACIONES:
AXELIA® 75 mg cápsula, está indicado en:
• Epilepsia
Pregabalina está indicado en adultos en el tratamiento combinado de las crisis parciales con o sin generalización secundaria.
• Trastorno de ansiedad generalizada
Pregabalina está indicado en el tratamiento del trastorno de ansiedad generalizada (TAG) en adultos.
CONTRAINDICACIONES:
AXELIA® 75 mg cápsula, está contraindicado en: Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la formulación.
FERTILIDAD, EMBARAZO Y LACTANCIA:
Mujeres en edad fértil/Anticoncepción en hombre y mujeres:
Las mujeres en edad fértil deben utilizar un método anticonceptivo eficaz, al desconocerse el riesgo potencial en la reproducción humana.
Embarazo:
No existen datos suficientes sobre la utilización de pregabalina en mujeres embarazadas.
Los estudios en animales han mostrado toxicidad reproductiva. Se desconoce el riesgo en seres humanos.
Pregabalina no debería utilizarse durante el embarazo excepto si fuese claramente necesario (si el beneficio para la madre es claramente superior al riesgo potencial para el feto).
Lactancia:
Pregabalina se excreta en la leche materna (ver sección "Acción Farmacológica - Propiedades farmacocinéticas"). No se conoce el efecto de pregabalina en recién nacidos/lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad:
No hay datos clínicos sobre el efecto de pregabalina sobre la fertilidad de la mujer. En un ensayo clínico realizado para evaluar el efecto de pregabalina sobre la movilidad de los espermatozoides se expuso a varones sanos a dosis de pregabalina de 600 mg/día. Después de 3 meses de tratamiento, no se observaron efectos sobre la movilidad de los espermatozoides.
Un estudio de fertilidad realizado en ratas hembras ha mostrado efectos adversos sobre la reproducción. Estudios de fertilidad en ratas macho han mostrado efectos adversos sobre la reproducción y sobre el desarrollo. La relevancia clínica de estos hallazgos, se desconoce.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
La influencia de pregabalina sobre la capacidad para conducir y utilizar máquinas puede ser pequeña o moderada. Pregabalina puede causar mareos y somnolencia por lo que puede afectar la capacidad de conducir o para utilizar máquinas. Se aconseja a los pacientes que no conduzcan, manejen maquinaria pesada o realicen otras actividades potencialmente peligrosas hasta que se sepa si este medicamento afecta su capacidad para realizar estas actividades.
Excipientes: Almidón de maíz, lactosa monohidrato, talco.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad:
El programa clínico de pregabalina incluyó a más de 8900 pacientes expuestos a pregabalina, de los que más de 5600 participaron en ensayos doble ciego controlados con placebo. Las reacciones adversas comunicadas con más frecuencia fueron mareos y somnolencia. Generalmente, las reacciones adversas fueron de intensidad de leve a moderada. En todos los estudios controlados, la tasa de abandono a causa de reacciones adversas fue del 12% para pacientes que estaban recibiendo pregabalina y del 5% para pacientes que recibieron placebo. Las reacciones adversas que con más frecuencia dieron lugar a una interrupción del tratamiento en los grupos tratados con pregabalina fueron mareos y somnolencia.
A continuación se relacionan todas las reacciones adversas, que tuvieron lugar con una incidencia superior a la detectada con placebo y en más de un paciente, ordenadas por sistema y frecuencia. Muy frecuentes:> 1/10; Frecuentes:> 1/100 a< 1/10; Poco frecuentes:> 1/1000 a< 1/100; Raras:> 1/10000 a< 1/1000; Muy raras:< 1/10000, frecuencia no conocida: no puede estimarse a partir de los datos disponibles. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Las reacciones adversas enumeradas también pueden estar relacionadas con la enfermedad subyacente y/o con la medicación que se administra al mismo tiempo.
La incidencia de reacciones adversas en general, de reacciones adversas del sistema nervioso central y especialmente de somnolencia se incrementó en el tratamiento del dolor neuropático central debido a lesiones de la médula espinal (ver sección "Advertencias y Precauciones").
Las reacciones adversas adicionales notificadas durante la experiencia postcomercialización se incluyen a continuación en cursiva.
Infecciones e infestaciones:
Frecuentes: Nasofaringitis.
Trastornos de la sangre y del sistema linfático:
Poco frecuentes: Neutropenia.
Trastornos del sistema inmunológico:
Poco frecuentes: Hipersensibilidad.
Raras: Angioedema, reacción alérgica.
Trastornos del metabolismo y de la nutrición:
Frecuentes: Aumento del apetito.
Poco frecuentes: Anorexia, hipoglucemia.
Trastornos psiquiátricos:
Frecuentes: Estado de ánimo eufórico, confusión, irritabilidad, desorientación, insomnio, libido disminuida.
Poco frecuentes: Alucinaciones, crisis de angustia, inquietud, agitación, depresión, estado de ánimo depresivo, estado de ánimo elevado, agresión, cambios del estado de ánimo, despersonalización, dificultad de expresión, sueños anormales, libido aumentada, anorgasmia, apatía.
Raras: Desinhibición.
Trastornos del sistema nervioso:
Muy frecuentes: Mareos, somnolencia, cefalea.
Frecuentes: Ataxia, coordinación anormal, temblor, disartria, amnesia, alteración de la memoria, alteración de la atención, parestesia, hipoestesia, sedación, alteración del equilibrio, letargo. Poco frecuentes: Síncope, estupor, mioclono, pérdida de conciencia, hiperactividad psicomotora, discinesia, mareo postural, temblor de intención, nistagmo, trastorno cognitivo, deterioro mental, trastorno del habla, hiporreflexia, hiperestesia, sensación de ardor, ageusia, malestar general.
Raras: Convulsiones, parosmia, hipocinesia, disgrafía.
Trastornos oculares:
Frecuentes: Visión borrosa, diplopía.
Poco frecuentes: Pérdida de la visión periférica, alteración de la visión, hinchazón ocular, defecto del campo visual, agudeza visual disminuida, dolor ocular, astenopía, fotopsia, ojo seco, aumento del lagrimeo, irritación ocular.
Raras: Perdida de la visión, queratitis, oscilopsia, alteración visual de la percepción de profundidad, midriasis, estrabismo, brillo visual.
Trastornos del oído y del laberinto:
Frecuentes: Vértigo.
Poco frecuentes: Hiperacusia.
Trastornos cardíacos:
Poco frecuentes: Taquicardia, bloqueo auriculoventricular de primer grado, bradicardia sinusal, insuficiencia cardíaca congestiva.
Raras: Prolongación del intervalo QT, taquicardia sinusal, arritmia sinusal.
Trastornos vasculares:
Poco frecuentes: Hipotensión, hipertensión, sofocos, rubefacción, frialdad periférica.
Trastornos respiratorios, torácicos y mediastínicos:
Poco frecuentes: Disnea, epistaxis, tos, congestión nasal, rinitis, ronquidos, sequedad nasal.
Raras: Edema pulmonar, sensación de opresión en la garganta.
Trastornos gastrointestinales:
Frecuentes: Vómitos, náuseas, estreñimiento, diarrea, flatulencia, distensión abdominal, boca seca.
Poco frecuentes: Enfermedad por reflujo gastroesofágico, hipersecreción salival, hipoestesia oral.
Raras: Ascitis, pancreatitis, lengua hinchada, disfagia.
Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes: Erupción papular, urticaria, hiperhidrosis, prurito.
Raras: Síndrome de Stevens Johnson, sudor frío.
Trastornos musculoesqueléticos y del tejido conjuntivo:
Frecuentes: Calambres musculares, artralgia, dolor de espalda, dolor en las extremidades, espasmo cervical.
Poco frecuentes: Hinchazón articular, mialgia, sacudidas musculares, dolor de cuello, rigidez muscular.
Raras: Rabdomiólisis.
Trastornos renales y urinarios:
Poco frecuentes: Incontinencia urinaria, disuria. Raras: Insuficiencia renal, oliguria, retención urinaria.
Trastornos del aparato reproductor y de la mama:
Frecuentes: Disfunción eréctil.
Poco frecuentes: Disfunción sexual, eyaculación retardada, dismenorrea, dolor de mama. Raras: Amenorrea, secreción mamaria, aumento de tamaño de la mama, ginecomastia.
Trastornos generales y alteraciones en el lugar de administración:
Frecuentes: Edema periférico, edema, marcha anormal, caídas, sensación de embriaguez, sensación anormal, fatiga. Poco frecuentes: Edema generalizado, edema facial, opresión en el pecho, dolor, pirexia, sed, escalofríos, astenia.
Exploraciones complementarias:
Frecuentes: Aumento de peso.
Poco frecuentes: Creatinfosfoquinasa elevada en sangre, alanina aminotransferasa elevada, aspartato aminotransferasa elevada, glucosa elevada en sangre, recuento disminuido de plaquetas, creatinina elevada en sangre, potasio disminuido en sangre, peso disminuido. Raras: Recuento disminuido de leucocitos.
En algunos pacientes se han observado síntomas de retirada tras la interrupción del tratamiento con pregabalina, tanto a corto como a largo plazo. Se han mencionado las siguientes reacciones: insomnio, dolor de cabeza, náuseas, ansiedad, diarrea, síndrome gripal, convulsiones, nerviosismo, depresión, dolor, hiperhidrosis y mareos, sugestivos de dependencia física. Se debe informar al paciente sobre esto al inicio del tratamiento.
Con respecto a la interrupción del tratamiento de pregabalina a largo plazo, los datos sugieren que la incidencia y gravedad de los síntomas de retirada pueden estar relacionadas con la dosis.
Población pediátrica:
El perfil de seguridad de pregabalina observado en dos estudios en pacientes pediátricos (estudio de farmacocinética y tolerabilidad, n = 65; estudio de seguimiento de la seguridad, sin enmascaramiento, de 1 año de duración, n= 54) fue similar al observado en los estudios en adultos.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Peruano de Farmacovigilancia de la DIGEMID.
Comunicar a su médico o a su farmacéutico cualquier reacción adversa que no estuviese descrita en el inserto.
INCOMPATIBILIDADES:
No se han reportado.
INTERACCIONES:
Dado que la pregabalina se excreta principalmente inalterada en orina, experimenta un metabolismo insignificante en humanos(< 2% de la dosis recuperada en orina en forma de metabolitos ), no inhibe el metabolismo de fármacos in vitro y no se une a proteínas plasmáticas, no es probable que produzca interacciones farmacocinéticas o sea susceptible a las mismas.
Estudios in vivo y análisis fannacocinético de la población: En consecuencia, en los estudios in vivo, no se observaron interacciones farmacocinéticas relevantes desde el punto de vista clínico entre pregabalina y fenitoína, carbamazepina, ácido valproico, lamotrigina, gabapentina, lorazepam, oxicodona o etanol. El análisis farmacocinético de la población indicó que los antidiabéticos orales, diuréticos, insulina, fenobarbital, tiagabina y topiramato, no presentaban un efecto clínicamente importante sobre el aclaramiento de pregabalina.
Anticonceptivos orales, noretisterona y/o etinilestradiol:
La administración de pregabalina junto con anticonceptivos orales como noretisterona y/o etinilestradiol, no influye en la farmacocinética en el estado de equilibrio de ninguna de estas sustancias.
Medicamentos que influyen en el sistema nervioso central:
La pregabalina puede potenciar los efectos del etanol y del lorazepam. En ensayos clínicos controlados, dosis múltiples orales de pregabalina administrada junto con oxicodona, lorazepam o etanol no produjeron efectos clínicamente relevantes sobre la respiración. Durante la experiencia postcomercialización se han notificado casos de insuficiencia respiratoria y coma en pacientes en tratamiento con pregabalina y otros medicamentos depresores del sistema nervioso central (SNC).
Pregabalina parece tener un efecto aditivo en la alteración de la función cognitiva y motora causada por oxicodona.
Interacciones y pacientes de edad avanzada:
No se realizaron estudios farmacodinámicos específicos de interacción en voluntarios de edad avanzada. Los estudios de interacciones se han realizado sólo en adultos.
ADVERTENCIAS Y PRECAUCIONES:
Pacientes diabéticos:
De acuerdo a la práctica clínica actual, ciertos pacientes diabéticos que ganen peso durante el tratamiento con pregabalina, pueden precisar un ajuste de los medicamentos hipoglucemiantes.
Reacciones de hipersensibilidad:
Durante el período postcomercialización se han notificado casos de reacciones de hipersensibilidad, incluyendo casos de angioedema. Si aparecen síntomas de angioedema, como son tumefacción facial, perioral o de las vías respiratorias superiores, se debe suspender inmediatamente el tratamiento con pregabalina.
Mareos, somnolencia, pérdida de conocimiento, confusión y deterioro mental:
El tratamiento con pregabalina se ha asociado a mareos y somnolencia, lo cual podría incrementar los casos de lesiones accidentales (caídas) en los pacientes de edad avanzada. Asimismo se han notificado, durante el período postcomercialización, casos de pérdida de conocimiento, confusión y deterioro mental. Por tanto, se debe aconsejar a los pacientes que tengan precaución hasta que se familiaricen con los potenciales efectos del medicamento.
Efectos relacionados con la visión:
En ensayos clínicos controlados, una mayor proporción de pacientes tratados con pregabalina, en comparación con aquellos tratados con placebo, notificó visión borrosa que en la mayoría de los casos se resolvió al continuar con el tratamiento. En los ensayos clínicos en los que se llevaron a cabo pruebas oftalmológicas, la incidencia de disminución de la agudeza visual y alteración del campo visual fue mayor en pacientes tratados con pregabalina que en aquellos tratados con placebo; la incidencia de cambios fundoscópicos fue mayor en pacientes tratados con placebo (ver sección "Acción Farmacológica - Propiedades Farmacodinámicas").
Durante el período postcomercialización también se han notificado reacciones adversas visuales incluyendo pérdida de visión, visión borrosa u otros cambios de agudeza visual, muchos de los cuales fueron transitorios. La suspensión del tratamiento con pregabalina puede resolver o mejorar estos síntomas visuales.
Insuficiencia renal:
Se han notificado casos de insuficiencia renal, de los cuales algunos revirtieron con la interrupción del tratamiento con pregabalina.
Retirada de la medicación antiepiléptica concomitante:
No hay datos suficientes que permitan suprimir la medicación antiepiléptica concomitante, tras alcanzar el control de las crisis con pregabalina en el tratamiento combinado, para lograr la monoterapía con pregabalina.
Síntomas de retirada:
En algunos pacientes se han observado síntomas de retirada tras la interrupción del tratamiento con pregabalina, tanto a corto como a largo plazo. Se han mencionado los siguientes acontecimientos: insomnio, dolor de cabeza, náuseas, ansiedad, diarrea, síndrome gripal, nerviosismo, depresión, dolor, convulsiones, hiperhidrosis y mareos, sugestivos de dependencia física. Se debe informar al paciente sobre esto al inicio del tratamiento. Durante el tratamiento con pregabalina, o al poco tiempo de interrumpir el tratamiento con pregabalina, pueden aparecer convulsiones, incluyendo estatus epiléptico y convulsiones de tipo gran mal.
Con respecto a la interrupción del tratamiento de pregabalina a largo plazo, los datos sugieren que la incidencia y gravedad de los síntomas de retirada pueden estar relacionadas con la dosis.
Insuficiencia cardíaca congestiva:
Durante la experiencia postcomercialización se han notificado casos de insuficiencia cardíaca congestiva en algunos pacientes en tratamiento con pregabalina. Estas reacciones se observan sobre todo en pacientes de edad avanzada con función cardiovascular comprometida y tratados con pregabalina en la indicación de tratamiento del dolor neuropático. Pregabalina debe utilizarse con precaución en este tipo de pacientes. Estas reacciones pueden revertir tras la suspensión del tratamiento.
Reacciones adversas en pacientes con lesiones de la médula espinal:
La incidencia de reacciones adversas en general, de reacciones adversas del sistema nervioso central y especialmente de somnolencia se incrementó en el tratamiento del dolor neuropático central debido a lesiones de la médula espinal. Esto se puede atribuir a un efecto adictivo debido al uso simultáneo de medicamentos (por ejemplo, fármacos antiespasmódicos) necesarios para esta afección.
Pensamientos y comportamientos suicidas:
Se han notificado casos de pensamientos y comportamientos suicidas en pacientes tratados con medicamentos antiepilépticos en distintas indicaciones. Un metanálisis de ensayos clínicos controlados con placebo, aleatorizados, con fármacos antiepilépticos, ha mostrado también un pequeño aumento del riesgo de pensamientos y comportamientos suicidas. Se desconoce el mecanismo por el que se produce este riesgo, y los datos disponibles no excluyen la posibilidad de un incremento del riesgo con pregabalina.
Por tanto, los pacientes deben ser monitorizados para detectar signos de pensamientos y comportamientos suicidas, y debe considerarse el tratamiento adecuado. Se debe aconsejar a los pacientes (y a sus cuidadores) que consulten a su médico si aparecen pensamientos y comportamientos suicidas.
Disminución de la funcionalidad del tracto gastrointestinal inferior:
Durante el período postcomercialización se han notificado casos relacionados con la disminución de la funcionalidad del tracto gastrointestinal inferior (por ejemplo, obstrucción intestinal, íleo paralítico, estreñimiento) al administrarse pregabalina conjuntamente con medicamentos con potencial para producir estreñimiento, como los analgésicos opioides. En caso de que se vayan a administrar en combinación pregabalina y opioides, debe considerarse la utilización de medidas para evitar el estreñimiento (especialmente en mujeres y pacientes de edad avanzada).
Uso Incorrecto, potencial de abuso o dependencia:
Se han notificado casos de uso incorrecto, abuso o dependencia. Se debe tener precaución en pacientes con antecedentes de abuso de sustancias, y los pacientes han de ser monitorizados para detectar síntomas de uso incorrecto, abuso o dependencia con pregabalina (se han notificado casos de tolerancia, aumento de la dosis, búsqueda compulsiva de drogas).
Encefalopatía:
Se han notificado casos de encefalopatía, mayoritariamente en pacientes con enfermedades subyacentes que podrían haber provocado la encefalopatía.
Precauciones:
• La revisión de 199 estudios clínicos de 11 drogas antiepilépticas han demostrado que los pacientes que recibían medicamentos antlepiléptlcos tienen casi 2 veces el riesgo del comportamiento o pensamiento suicida (0,43%) comparado a los pacientes que recibían placebo (0,24%). Esta diferencia fue cerca de un caso adicional de pensamiento o comportamiento suicida por cada 500 pacientes tratados con drogas antiepilépticas versus placebo.
Cuatro de los pacientes que fueron seleccionados al azar para recibir una de las drogas antiepllépticas cometieron suicidio, mientras que en el grupo placebo no hubo ningún paciente que lo hiciera.
• Se recuerda a los médicos que deben aconsejar e instruir a sus pacientes, familiares y personal auxiliar que deben estar atentos para identificar tempranamente los signos y/o síntomas de pensamientos y/o comportamiento suicida, así como los cambios de humor.
• Los pacientes y/o familiares deben ponerse en contacto con su médico, si perciben cambios de humor en el paciente o que presenten comportamiento y/o pensamiento suicida.
Advertencias:
• El uso de este medicamento puede producir o incrementar pensamientos y/o comportamiento suicida.
• Los profesionales de la salud prescriptores o quienes están al cuidado de los pacientes así como sus familiares deben estar alertas con la finalidad de Identificar tempranamente la aparición o el empeoramiento de la depresión, pensamiento o comportamiento suicida o cualquier cambio inusual en el humor o comportamiento.
• Estos efectos adversos pueden producirse en los pacientes que reciben tratamiento con estos medicamentos para el tratamiento de la epilepsia, cefalea, migraña, dolor neuropático o cualquier otra indicación durante el tratamiento.
Advertencias sobre excipientes:
Este medicamento contiene lactosa. Los pacientes con problemas hereditarios poco frecuentes como intolerancia a la galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
El rango de dosis es de 150 a 600 mg al día, dividiendo su administración en dos o tres tomas.
Epilepsia:
El tratamiento con pregabalina se puede iniciar con una dosis de 150 mg al día, que se puede administrar dividida en dos o tres tomas. En función de la respuesta y tolerabilidad individual de cada paciente, la dosis se puede incrementar a 300 mg al día después de una semana. La dosis máxima que se puede alcanzar, después de una semana adicional, es de 600 mg al día.
Trastorno de ansiedad generalizada:
El rango de dosis es de 150 a 600 mg al día, dividiendo su administración en dos o tres tomas. Se debe reevaluar de forma periódica la necesidad del tratamiento.
El tratamiento con pregabalina se puede iniciar con una dosis de 150 mg al día. En función de la respuesta y tolerabilídad individual de cada paciente, la dosis se puede incrementar a 300 mg al día después de una semana. Tras una semana adicional, la dosis se puede incrementar a 450 mg al día. La dosis máxima que se puede alcanzar, después de una semana adicional, es de 600 mg al día.
Interrupción del tratamiento con pregabalina:
De acuerdo con la práctica clínica actual, si se tiene que interrumpir el tratamiento con pregabalina se deberá hacer de forma gradual durante un período mínimo de 1 semana, independientemente de la indicación (ver secciones "Advertencias y Precauciones" y "Reacciones Adversas").
Poblaciones especiales:
Pacientes con insuficiencia renal:
La pregabalina se elimina del sistema circulatorio principalmente por excreción renal como fármaco inalterado. Dado que el aclaramiento plasmático de pregabalina es directamente proporcional al aclaramiento de creatinina (ver sección "Acción Farmacológica - Propiedades Farmacocinéticas"), la reducción de la dosis en pacientes con la función renal alterada se deberá realizar de forma individualizada de acuerdo al aclaramiento de creatinina (Acr), tal y como se indica en la Tabla 1, que se ha determinado usando la fórmula siguiente:
Acr (mL/min) = [1,23 x [140 - edad (años)] x peso(Kg) (x 0,85 si se trata de una mujer)
creatinina sdérica (µmol/L)
La pregabalina se elimina del plasma de forma eficaz mediante hemodiálisis (50 % del fármaco en 4 horas). En pacientes sometidos a hemodiálisis, se debe ajustar la dosis diaria de pregabalina según su función renal. Además de la dosis diaria, después de cada sesión de 4 horas de hemodiálisis se debe administrar de forma inmediata una dosis complementaria (véase Tabla 1).
|
Tabla 1: Ajuste de dosis de pregaballna de acuerdo a la función renal |
|||
|
Aclaramiento de creatinina (Acr) (mL/min) |
Dosis diaria total de pregabalina (*) |
Posología |
|
|
> 60 |
150 |
600 |
DVD O TVD |
|
> 15 - <30 |
75 |
300 |
DVD O TVD |
|
< 15 |
25 |
150 |
UVD O DVD |
|
Dosis complementarias tras la hemodiálisis (mG) |
|||
|
25 |
100 |
Dosis (**) |
|
|
TVD = Tres veces al día. DVD = Dos veces al día. UVD = Una vez al día. (*) La dosis diaria total (mg/día) se debe dividir en las tomas indicadas en la posología para obtener los mg/dosis adecuados. (**) La dosis complementaria es una única dosis adicional. |
|||
Pacientes con insuficiencia hepática:
No se requiere ajuste de la dosis en pacientes con la función hepática alterada (ver sección "Acción Farmacológica - Propiedades Farmacocinéticas").
Población pediátrica:
No se ha establecido la seguridad y eficacia de pregabalina en niños menores de 12 años ni en adolescentes (de 12 a 17 años de edad). Los datos actualmente disponibles están descritos en las secciones, "Reacciones Adversas" y "Acción Farmacológica", sin embargo no se puede hacer una recomendación posológica.
Población de pacientes de edad avanzada (mayores de 65 años de edad):
Los pacientes de edad avanzada pueden precisar una reducción de la dosis de pregabalina debido a la disminución de la función renal (ver Pacientes con alteración renal).
Forma de administración:
Pregabalina se puede tomar con o sin alimentos.
Vía de administración: Oral.
No utilice este medicamento, después de la fecha de vencimiento indicada en el envase.
TRATAMIENTO EN CASO DE SOBREDOSIS:
Síntomas:
Durante la experiencia postcomercialización, las reacciones adversas notificadas con mayor frecuencia cuando se produjo una sobredosis por pregabalina, incluyeron somnolencia, estado de confusión, agitación e inquietud.
En raras ocasiones, se han notificado casos de coma.
Tratamiento:
El tratamiento de la sobredosis de pregabalina debe incluir medidas generales de soporte y puede incluir hemodiálisis si fuese necesario (ver sección "Dosis y Vía de Administración- Tabla 1 ").
CONDICIONES DE ALMACENAMIENTO:
Mantener el producto a temperatura no mayor de 30ºC.
IQFARMA
Instituto Quimioterápico S. A.
E-mail: infomedic@iqfarma.com
Av. Santa Rosa 350 - Santa Anita, Lima-Perú 612-0707