
ANTALGINA
METAMIZOL (DIPIRONA)
Tabletas
100 Tabletas , 500 Miligramos
2 Tabletas , 500 Miligramos
Tabletas , 500 Miligramos
COMPOSICIÓN
Cada TABLETA contiene:
Metamizol sódico 500 mg
(como metamizol sódico monohidratado)
Excipientes c.s.p 1 tableta
INDICACIONES:
Este producto está indicado en:
• Dolores intensos agudos post-traumáticos o post-operatorios.
• Cólicos.
• Dolores de origen tumoral.
• Otros dolores intensos y agudos o crónicos, cuando otras medidas terapéuticas no están indicadas.
• Fiebre alta que no cede con otras medidas.
La administración parenteral está indicada sólo cuando no cabe la posibilidad de una administración enteral.
ACCIÓN FARMACOLÓGICA
Propiedades farmacodinámicas: Derivado de la pirazolona.
Grupo farmacoterapéutico: analgésico, antipirético
Código ATC: N02B B02
El metamizol es un derivado de la pirazolona y posee propiedades analgésicas, antipiréticas y espasmolíticas. No se ha determinado completamente cuál es su mecanismo de acción. Algunos resultados de investigaciones muestran que el metamizol y el metabolito principal (4-N-metil- amino-antipirina) tendrían tanto un mecanismo de acción central como uno periférico.
Propiedades farmacocinéticas: Tras la administración oral, el metamizol es hidrolizado completamente al metabolito 4-N-metil- amino-antipirina (MAA), farmacológicamente activo. La biodisponibilidad de MAA es de aprox. 90% y es un poco más elevada luego de la administración oral que luego de la administración parenteral. La ingesta simultánea de alimentos no tiene ninguna influencia relevante sobre la cinética del metamizol.
La efectividad clínica estriba principalmente en el MAA, hasta cierto punto también en el metabolito 4-amino-antipirina (AA). Los valores del AUC para el AA constituyen aprox. el 25% de los valores del AUC para el MAA. Los metabolitos 4-N-acetil-amino-antipirina (AAA) y 4-N-formil-amino- antipirina (FAA) son, aparentemente, farmacológicamente inactivos.
Cabe notar que todos los metabolitos poseen una farmacocinética no lineal. Se desconoce la importancia clínica de este fenómeno. La acumulación de los metabolitos no tiene mayor relevancia para el tratamiento a corto plazo.
El metamizol atraviesa la placenta. Los metabolitos del metamizol se excretan en la leche materna.
El enlace proteico es de 58% para el MAA, de 48% para el AA, de 18% para el FAA y de 14% para el AAA.
Luego de la administración intravenosa, la vida media del metamizol en plasma asciende a aproximadamente 14 minutos. Alrededor de 96% de una dosis radiomarcada se detecta en la orina tras una administración intravenosa, y más o menos un 6% en las heces. Después de una dosis única oral, 85% de los metabolitos excretados en la orina fueron identificados. De ellos, 3±1% eran MAA, 6±3% AA, 26±8% AAA y 23±4% FAA. La depuración renal luego de una dosis oral única de 1 g de metamizol ascendió a 5±2 para el MAA, 38±13 para el AA, 61±8 para el AAA y 49±5 ml/min para el FAA. Las correspondientes vidas medias en plasma fueron de 2.7±0.5 horas para el MAA, 3.7±1.3 horas para el AA, 9.5±1.5 horas para el AAA y 11.2±1.5 para el FAA.
Pacientes adultos mayores: En los pacientes de edad, el AUC aumenta 2 a 3 veces. Posterior a una dosis única oral, la vida media del MAA y del FAA en pacientes con cirrosis hepática se incrementó en cerca de 3 veces, mientras que la vida media del AA y el AAA no se elevó en la misma proporción. En estos pacientes debería evitarse la administración de dosis altas.
Pacientes con función renal limitada: Los datos disponibles de pacientes con función renal limitada indican una reducción de la velocidad de eliminación para algunos metabolitos (AAA y FAA). Por este motivo, en estos pacientes debería evitarse la administración de dosis altas.
Biodisponibilidad: Una prueba de biodisponibilidad de la tableta realizada en 1987 en 12 probandos arrojó como resultado para el 4-MAA, en comparación con el preparado de referencia (administración intravenosa en 2 minutos):
|
Tableta (1 g) |
Administración intravenosa (1 g) |
|
|
Concentración máxima en plasma (Cmáx)[mg/L] |
17.3 ± 7.54 |
56.5 ± 12.2 |
|
Momento de la máxima concentración en plasma (tmáx)[h] |
1.42 ± 0.54 |
Finalización de la administración |
|
Área bajo la curva tiempo-concentración (AUC))[mg h/L] |
80.9 ± 34.1 |
71.2 ± 13.7 |
|
(Valores indicados como valor medio y divergencia estándar) |
||
La biodisponibilidad absoluta de la tableta, medido en relación con el AUC para las concentraciones del 4-MAA en plasma, asciende a 93%.
Cursos medios del nivel plasmático en comparación con un preparado de referencia en un diagrama de concentración-tiempo:
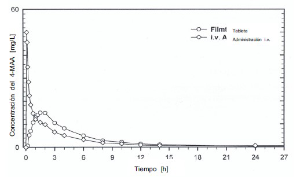
Datos preclínicos sobre seguridad: Existen investigaciones sobre la toxicidad subcrónica y crónica en diversas especies animales. Durante 6 meses, se administró por vía oral 100 hasta 900 mg de metamizol por kilogramo de peso corporal a ratas. Con la dosis máxima (900 mg por kilogramo de peso corporal) se observó, al cabo de 13 semanas, una multiplicación de los reticulocitos y de los cuerpos internos de Heinz. Perros recibieron durante 6 meses metamizol en dosis de 30 a 600 mg por kilogramo de peso corporal. En función de la dosis, a partir de los 300 mg por kilogramo de peso corporal se observó una anemia hemolítica, así como alteraciones funcionales renales y hepáticas.
Con respecto al metamizol, existen resultados contradictorios de estudios in-vitro e in-vivo en los mismos sistemas de prueba.
Estudios a largo plazo en ratas no arrojaron indicios de un potencial tumorigénico. En dos de tres estudios a largo plazo en ratón, se observaron, a altas dosis, adenomas de células hepáticas en mayor número.
Estudios de embriotoxicidad en ratas y conejos no han arrojado indicios de acciones teratogénicas.
No se observó efectos embrioletales en conejos a partir de una dosis diaria aún no maternal tóxica de 100 mg por kilogramo de peso corporal. En ratas, se presentaron acciones embrioletales con dosis en el nivel maternal tóxico. Dosis diarias por encima de 100 mg por kilogramo de peso corporal prolongaron la gestación en ratas y tuvieron un efecto negativo sobre el parto con una elevada mortalidad de madres y crías.
Pruebas de fertilidad mostraron una tasa de preñez ligeramente disminuida en la primera generación con una dosis superior a 250 mg por kilogramo de peso corporal y día. No se afectó la fertilidad de la generación F-1.
Los metabolitos del metamizol pasan a la leche materna. No existen experiencias sobre sus efectos sobre el lactante.
PROPIEDADES FARMACOCINÉTICAS: Tras la administración oral, el metamizol es hidrolizado completamente al metabolito 4-N-metil-amino-antipirina (MAA), farmacológicamente activo. La biodisponibilidad de MAA es de aprox. 90% y es un poco más elevada luego de la administración oral que luego de la administración parenteral. La ingesta simultánea de alimentos no tiene ninguna influencia relevante sobre la cinética del metamizol. La efectividad clínica estriba principalmente en el MAA, hasta cierto punto también en el metabolito 4-amino-antipirina (AA). Los valores del AUC para el AA constituyen aprox. el 25% de los valores del AUC para el MAA. Los metabolitos 4-N-acetil-amino-antipirina (AAA) y 4-N-formil-amino-antipirina (FAA) son, aparentemente, farmacológicamente inactivos. Cabe notar que todos los metabolitos poseen una farmacocinética no lineal. Se desconoce la importancia clínica de este fenómeno. La acumulación de los metabolitos no tiene mayor relevancia para el tratamiento a corto plazo. El metamizol atraviesa la placenta. Los metabolitos del metamizol se excretan en la leche materna. El enlace proteico es de 58% para el MAA, de 48% para el AA, de 18% para el FAA y de 14% para el AAA. Luego de la administración intravenosa, la vida media del metamizol en plasma asciende a aproximadamente 14 minutos. Alrededor de 96% de una dosis radiomarcada se detecta en la orina tras una administración intravenosa, y más o menos un 6% en las heces. Después de una dosis única oral, 85% de los metabolitos excretados en la orina fueron identificados. De ellos, 3±1% eran MAA, 6±3% AA, 26±8% AAA y 23±4% FAA. La depuración renal luego de una dosis oral única de 1 g de metamizol ascendió a 5±2 para el MAA, 38±13 para el AA, 61±8 para el AAA y 49±5 ml/min para el FAA. Las correspondientes vidas medias en plasma fueron de 2,7±0,5 horas para el MAA, 3,7±1,3 horas para el AA, 9,5±1,5 horas para el AAA y 11,2±1,5 para el FAA.
Pacientes adultos mayores: En los pacientes de edad, el AUC aumenta 2 a 3 veces. Posterior a una dosis única oral, la vida media del MAA y del FAA en pacientes con cirrosis hepática se incrementó en cerca de 3 veces, mientras que la vida media del AA y el AAA no se elevó en la misma proporción. En estos pacientes debería evitarse la administración de dosis altas.
Pacientes con función renal limitada: Los datos disponibles de pacientes con función renal limitada indican una reducción de la velocidad de eliminación para algunos metabolitos (AAA y FAA). Por este motivo, en estos pacientes debería evitarse la administración de dosis altas.
Biodisponibilidad: Una prueba de biodisponibilidad de la tableta realizada en 1987 en 12 probandos arrojó como resultado para el 4-MAA, en comparación con el preparado de referencia (administración intravenosa en 2 minutos):
|
Tableta (1 g) |
Administración intravenosa (1 g) |
|
|
Concentración máxima en plasma (Cmáx)[mg/L] |
17,3 ± 7,54 |
56,5 ± 12,2 |
|
Momento de la máxima concentración en plasma (tmáx)[h] |
1,42 ± 0,54 |
Finalización de la administración |
|
Área bajo la curva tiempo-concentración (AUC) )[mg h/L] |
80,9 ± 34,1 |
71,2 ± 13,7 |
|
(Valores indicados como valor medio y divergencia estándar) |
||
La biodisponibilidad absoluta de la tableta, medido en relación con el AUC para las concentraciones del 4-MAA en plasma, asciende a 93%. Cursos medios del nivel plasmático en comparación con un preparado de referencia en un diagrama de concentración-tiempo:
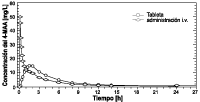
Datos preclínicos sobre seguridad: Existen investigaciones sobre la toxicidad subcrónica y crónica en diversas especies animales. Durante 6 meses, se administró por vía oral 100 hasta 900 mg de metamizol por kilogramo de peso corporal a ratas. Con la dosis máxima (900 mg por kilogramo de peso corporal) se observó, al cabo de 13 semanas, una multiplicación de los reticulocitos y de los cuerpos internos de Heinz. Perros recibieron durante 6 meses metamizol en dosis de 30 a 600 mg por kilogramo de peso corporal. En función de la dosis, a partir de los 300 mg por kilogramo de peso corporal se observó una anemia hemolítica, así como alteraciones funcionales renales y hepáticas. Con respecto al metamizol, existen resultados contradictorios de estudios in vitro e in vivo en los mismos sistemas de prueba. Estudios a largo plazo en ratas no arrojaron indicios de un potencial tumorigénico. En dos de tres estudios a largo plazo en ratón, se observaron, a altas dosis, adenomas de células hepáticas en mayor número. Estudios de embriotoxicidad en ratas y conejos no han arrojado indicios de acciones teratogénicas. No se observó efectos embrioletales en conejos a partir de una dosis diaria aún no maternal tóxica de 100 mg por kilogramo de peso corporal. En ratas, se presentaron acciones embrioletales con dosis en el nivel maternal tóxico. Dosis diarias por encima de 100 mg por kilogramo de peso corporal prolongaron la gestación en ratas y tuvieron un efecto negativo sobre el parto con una elevada mortalidad de madres y crías. Pruebas de fertilidad mostraron una tasa de preñez ligeramente disminuida en la primera generación con una dosis superior a 250 mg por kilogramo de peso corporal y día. No se afectó la fertilidad de la generación F-1. Los metabolitos del metamizol pasan a la leche materna. No existen experiencias sobre sus efectos sobre el lactante.
PROPIEDADES FARMACODINÁMICAS: Derivado de la pirazolona: Grupo farmacoterapéutico: analgésico, antipirético. Código ATC: N02B B02. El metamizol es un derivado de la pirazolona y posee propiedades analgésicas, antipiréticas y espasmolíticas. No se ha determinado completamente cuál es su mecanismo de acción. Algunos resultados de investigaciones muestran que el metamizol y el metabolito principal (4-N-metil-amino-antipirina) tendrían tanto un mecanismo de acción central como uno periférico.
CONTRAINDICACIONES:
• Hipersensibilidad al principio activo o a otras pirazolonas o pirazolidinas (esto incluye también a pacientes que han reaccionado p. ej. con una agranulocitosis luego de la administración de estas sustancias) o a algún otro componente de la lista de excipientes.
• Pacientes con síndrome conocido de asma por analgésicos o intolerancia conocida a los analgésicos, del tipo urticaria-angioedema, es decir, pacientes que reaccionan con broncoespasmo u otras formas de reacción anafilactoide (ej. urticaria, rinitis, angioedema) a los salicilatos, al paracetamol o a otros analgésicos no narcóticos, como p. ej. el diclofenaco, el ibuprofeno, la indometacina o el naproxeno.
• Trastornos de la función de la médula ósea (p. ej. después de tratamiento citostático) o de enfermedades del sistema hematopoyético;
• Deficiencia de glucosa-6-fosfato dehidrogenasa condicionada genéticamente (riesgo de hemólisis);
• Porfiria hepática aguda intermitente (riesgo de desencadenamiento de ataques de porfiria);
• En el último tercio del embarazo (ver Embarazo y lactancia).
- Lactancia (ver Embarazo y lactancia),
- Niños menores de 10 años.
REACCIONES ADVERSAS:
Escala para los datos sobre frecuencias de los efectos adversos:
• Muy frecuente (≥ 1/10)
• Frecuente (≥ 1/100 hasta < 1/10)
• Ocasionalmente (≥ 1/1,000 hasta < 1/100)
• Rara vez (≥ 1/10,000 hasta < 1/1,000)
• Muy rara vez (< 1/10,000)
No se conoce (no se puede estimar la frecuencia en base a los datos de los que se dispone.).
Trastorno de la sangre y del sistema linfático:
• Raras: leucopenia.
• Muy raras: agranulocitosis, incluyendo casos con desenlace fatal, trombocitopenia.
• Frecuencia no conocida: Anemia aplásica, pancitopenia, incluyendo casos con desenlace fatal. Estas reacciones también pueden ocurrir cuando se administró metamizol sódico en ocasiones anteriores sin complicaciones.
Hay indicios ocasionales donde posiblemente el riesgo de agranulocitosis puede aumentar cuando se administra metamizol sódico más de una semana.
Esta reacción no es dependiente de la dosis y puede ocurrir en cualquier momento durante el tratamiento. Se manifiesta con fiebre alta, escalofríos, dolor de garganta, dificultad para deglutir, e inflamación de la boca, la nariz, la garganta, el área genital o anal. En los pacientes que recibieron antibióticos, estas características pueden ser, sin embargo, mínimas. La presencia de ganglios linfáticos o agrandamiento del bazo es baja o ausente. La velocidad de sedimentación globular se acelera en gran medida, los granulocitos se reducen en gran medida o están totalmente ausentes. Generalmente, aunque no siempre, se encuentran valores normales para hemoglobina, eritrocitos y plaquetas.
Para la remisión de los síntomas es crucial la interrupción inmediata. Por lo tanto, se recomienda interrumpir de inmediato el tratamiento con metamizol sódico, en lugar de esperar los resultados de las pruebas de diagnóstico de laboratorio cuando se trata de un deterioro inesperado en el estado general, la fiebre no se resuelve o cuando ocurran cambios repentinos y dolorosos en la mucosa, sobre todo en la boca, la nariz y la garganta.
En caso de producirse pancitopenia, el tratamiento debe interrumpirse inmediatamente y se debe monitorear el hemograma hasta que vuelve a la normalidad.
Trastornos del sistema inmunológico:
• Raros: Reacciones anafilácticas o anafilactoides *.
• Muy raras: síndrome de asma inducidos por el uso de analgésicos.
En los pacientes con síndrome de asma sensibles por el uso de analgésicos, las reacciones de intolerancia se manifiestan normalmente en forma de ataques de asma.
• Frecuencia no conocida: shock anafiláctico *.
* Estas reacciones pueden ocurrir sobre todo después de la administración parenteral, ser grave y potencialmente muy peligrosos en algunos casos incluso mortal. También puede ocurrir cuando metamizol sódico ha sido administrado en ocasiones anteriores sin complicaciones.
Tales reacciones pueden ocurrir durante la inyección o inmediatamente después de la ingestión, también desarrollarse horas más tarde. Sin embargo, se producen predominantemente durante la primera hora después de la administración. Las reacciones que se observan con mayor frecuencia se manifiestan típicamente en la piel y reacciones de membranas mucosas, disnea y (como picazón, ardor, enrojecimiento, ronchas, hinchazón.) Rara vez se observan molestias gastrointestinales. Tales reacciones leves pueden en las formas graves se funden con urticaria generalizada, angioedema severo (también en la laringe), broncoespasmo grave, arritmias cardíacas, hipotensión (a veces precedido por el aumento de la presión arterial), shock circulatorio. Por lo tanto este producto debe interrumpirse inmediatamente en caso de presentarse reacciones cutáneas.
Enfermedad del corazón:
• Frecuencia no conocida: Síndrome Kounis
Trastornos vasculares:
• Poco frecuentes: reacciones de hipotensión durante o después de la aplicación, que pueden estar relacionadas con el tratamiento farmacológico y no por otros signos de anafiláctica o reacción anafiláctica. Tal reacción puede conducir a una severa caída en la presión arterial. Una inyección intravenosa rápida aumenta el riesgo de una reacción hipotensora.
Incluso con hiperpirexia puede conducir a una caída importante de la presión arterial dosis- dependiente, sin más signos de una reacción de hipersensibilidad.
Trastorno de la piel y del tejido subcutáneo:
• Poco frecuentes: erupción medicamentosa.
• Raras: erupción (Ej erupción maculopapular)
• Muy raras: síndrome de Stevens-Johnson o necrólisis epidérmica tóxica.
Trastornos renales y urinarios:
• Muy raros: empeoramiento agudo de la función renal, que es muy rara vez pueden desarrollar proteinuria, oliguria o anuria o insuficiencia renal aguda, nefritis intersticial aguda.
Trastornos generales y alteraciones en el lugar de administración: Acerca de una coloración roja de la orina se ha informado que puede ser debido a un metabolito inofensivo del metamizol sódico, el ácido rubazónico.
Informar sobre las sospechas de reacciones adversas: El informe sospechas de reacciones adversas a la admisión es de gran importancia. Permite el monitoreo continuo de la relación beneficio-riesgo del medicamento. Profesionales de la salud se les anima a cada caso sospechoso de una reacción adversa al correo farmacovigilancia@tevaperu.com.
INCOMPATIBILIDADES:
No se han descrito.
INTERACCIONES MEDICAMENTOSAS:
El metamizol puede causar disminución en los niveles de ciclosporina sérica. Por ello, éstos deben ser vigilados cuando se administra este producto simultáneamente.
Cuando se administra metamizol sódico y cloropromacina simultáneamente, puede ocurrir una hipotermia severa.
La adición de metamizol sódico al metotrexato puede incrementar la toxicidad hematológica del metotrexato, especialmente en los ancianos. Por tanto, esta combinación debe ser evitada.
Metamizol puede reducir el efecto antiplaquetario del ácido acetilsalicílico con el uso concomitante a dosis bajas. Por lo tanto metamizol debe utilizarse con precaución en pacientes que están tomando ácido acetilsalicílico a dosis bajas para la cardioprotección.
Los niveles sanguíneos de bupropion pueden disminuir por el metamizol sódico. Por lo tanto, se debe tener precaución con el uso concomitante de metamizol sódico y bupropión.
En relación a la clase de sustancia de la pirazolona, se sabe que se pueden producir interacciones con los anticoagulantes orales, captopril, litio, metotrexato y triamtereno, así como alteraciones en la efectividad de los antihipertensivos y los diuréticos. Aún se desconoce en qué medida también el metamizol puede conllevar a estas interacciones.
ADVERTENCIAS Y PRECAUCIONES:
Metamizol sódico contiene el derivado de la pirazolona metamizol y presenta los riesgos de shock y de agranulocitosis, que son poco frecuentes pero que pueden poner en peligro la vida.
Los pacientes que muestran reacciones anafilactoides a metamizol sódico también están en especial riesgo de reaccionar de la misma forma a otros analgésicos no narcóticos.
Los pacientes que muestran una reacción anafiláctica u otra mediada inmunológicamente (p. ej. agranulocitosis) a metamizol sódico, igualmente están en especial riesgo de reaccionar de la misma forma a otras pirazolonas y pirazolidinas.
Agranulocitosis: Cuando aparecen signos de agranulocitosis o de trombocitopenia, se debe interrumpir de inmediato la administración de metamizol sódico y se debe controlar el hemograma (incluyendo un hemograma diferencial). No se puede esperar a tener los resultados de los análisis de laboratorio para suspender el tratamiento.
Pancitopenia: Cuando aparecen signos pancitopenia, el tratamiento debe interrumpirse inmediatamente y se debe controlar el hemograma hasta que retorne a la normalidad. Todos los pacientes deben ser advertidos que deben buscar atención médica inmediatamente si se presentan signos y síntomas durante el tratamiento, que sugieran discrasias sanguíneas (por ejemplo, malestar general, infección, fiebre persistente, hematomas, sangrado, palidez).
Reacciones anafilácticas/anafilactoides: Al elegir la forma de administración se debe pensar en que la administración parenteral de metamizol sódico está asociada con un elevado riesgo de reacciones anafilácticas o bien anafilactoides.
El riesgo de posibles reacciones anafilactoides severas a metamizol sódico es significativamente elevado en los pacientes con:
• Síndrome de asma por analgésicos o intolerancia a los analgésicos, del tipo urticaria- angioedema
• Asma bronquial, particularmente con rinosinusitis existente y pólipos nasales simultáneamente;
• Urticaria crónica;
• Intolerancia a los colorantes (p. ej. tartrazina) o bien a los conservantes (p. ej. benzoatos);
• Intolerancia al alcohol. Estos pacientes reaccionan con síntomas como estornudo, lagrimeo y enrojecimiento facial pronunciado incluso a pequeñas cantidades de bebidas alcohólicas. Una intolerancia al alcohol de este tipo puede ser un indicio de un síndrome de asma por analgésicos no diagnosticado hasta el momento.
Un choque anafiláctico puede presentarse especialmente en pacientes susceptibles. Por lo tanto, se debe tener especial cuidado en pacientes con asma o atopia.
Reacciones cutáneas graves: Las reacciones cutáneas potencialmente mortales, como el síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET) han sido reportadas con el uso de metamizol sódico. Si se desarrollan síntomas o signos de SSJ o NET (como erupciones progresivas en la piel, a menudo con ampollas o lesiones de la mucosa), el tratamiento con metamizol sódico debe ser detenido de inmediato y puede ser reintroducido en otro momento.
Los pacientes deben ser advertidos de monitorizar signos y síntomas de reacciones en la piel, sobre todo durante las primeras semanas de tratamiento.
Reacciones aisladas de hipotensión: Este producto puede desencadenar reacciones hipotensivas. Probablemente estas reacciones dependan de la dosis. Hay que contar con ello en la administración parenteral más que en la enteral. El riesgo de tales reacciones es asimismo elevado en:
• El caso de administrarse la inyección intravenosa muy rápidamente.
• Pacientes con p. ej. hipotonía preexistente, con depleción de volumen o deshidratación, inestabilidad circulatoria o deficiencia circulatoria incipiente (como p. ej. en pacientes con infarto de miocardio o politraumatismo);
• Pacientes con fiebre alta.
Por ello, en estos pacientes se requiere una verificación cuidadosa de la indicación y una vigilancia médica estrecha. Pueden ser necesarias medidas preventivas (p. ej. estabilización de la circulación) para reducir el riesgo de reacciones hipotensivas.
Metamizol sódico sólo debe emplearse bajo vigilancia atenta de los parámetros hemodinámicos en los pacientes en los que debe evitarse absolutamente la baja de la presión arterial, como p. ej. en caso de cardiopatía coronaria grave o estenosis relevante de los vasos sanguíneos que irrigan el cerebro.
Metamizol sódico debería emplearse únicamente luego de una rigurosa valoración riesgo-beneficio y con las correspondientes medidas de precaución en pacientes con trastornos funcionales renales o hepáticos.
Antes de administrar metamizol sódico se debe interrogar específicamente al paciente. En pacientes con riesgo elevado de reacciones anafilactoides, metamizol sódico puede emplearse sólo tras una valoración cuidadosa de los posibles riesgos frente a los beneficios esperados. De administrarse metamizol sódico en estos casos, el médico deberá vigilar estrechamente al paciente y asegurar la disponibilidad de medidas de emergencia.
En la envoltura exterior: Advertencia: Contiene metamizol.
Una tableta de metamizol sódico contiene aproximadamente 1.42 mmol (32.7 mg) de sodio. Hay que tener presente esto en personas que están bajo una dieta controlada de sodio (pobre en sodio/pobre en sal).
Embarazo y lactancia:
Embarazo: No existen datos suficientes sobre el empleo de metamizol sódico en embarazadas. El metamizol atraviesa la placenta. En estudios experimentales en animales, metamizol no mostró efectos teratogénicos. Dado que no existe experiencia suficiente en el ser humano, no debería administrarse/ingerirse metamizol sódico en el primer trimestre y en el segundo debería hacérselo únicamente después de que el médico haya realizado una valoración riesgo-beneficio estricta.
Pese a que el metamizol inhibe sólo débilmente la síntesis de las prostaglandinas, no se puede descartar un cierre prematuro del Ductus arteriosus (Botalli), como tampoco complicaciones perinatales debidas a una reducción de la agregación trombocitaria del neonato y de la madre. Considerando esto, metamizol sódico está contraindicada durante el último trimestre del embarazo.
Lactancia: Los metabolitos del metamizol se excretan en la leche materna. En consecuencia, debe evitarse la lactancia durante la/el ingesta/empleo y hasta por lo menos 48 horas después de la/del última(o) ingesta/empleo de este producto.
Efectos sobre la capacidad para conducir y utilizar maquinaria: Dentro de la gama de dosis recomendada, no se conoce menoscabo de la capacidad de concentración y reacción. Sin embargo, por una cuestión de seguridad, al menos en el caso de dosis elevadas, se debería considerar la posibilidad de un menoscabo y no utilizar máquinas, conducir vehículos o realizar otras actividades peligrosas. Esto es especialmente aplicable cuando se ha consumido alcohol.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía oral.
La dosificación depende de la intensidad de los dolores o de la fiebre y de la sensibilidad individual para reaccionar a metamizol sódico monohidrato.
En principio, debería optarse por la dosis más baja que sea capaz de controlar el dolor y la fiebre. En lo que se refiere a la fiebre, en niños una dosis de 10 mg de metamizol por kilogramo de peso corporal es, en general, suficiente.
Un efecto notorio se puede esperar 30 a 60 minutos después de la administración oral y aproximadamente 30 minutos después de la administración parenteral.
En el caso de los niños y los adolescentes hasta los 14 años de edad, la dosis única a administrarse es de 8 a 16 mg de metamizol sódico monohidrato por kilogramo de peso corporal. Los adultos y los adolescentes a partir de los 15 años (> 53 kg) pueden ingerir hasta 1000 mg por dosis única. Si el efecto no fuera eficaz, es posible administrar la dosis única hasta 4 veces al día, ello dependiendo de la dosis máxima diaria.
Las siguientes tablas de dosificación contienen las dosis únicas recomendadas y las dosis diarias máximas.
Tabla de dosificación para metamizol sódico 500 mg tabletas
|
Edad |
Dosis única |
Dosis máxima diaria |
|
10-14 años (32-53 kg) |
1 tableta (equivalente a 500 mg de metamizol sódico monohidrato) |
Hasta cuatro tabletas/(equivalentes a 2000 mg de metamizol sódico monohidrato) |
|
Adultos y adolescentes a partir de los 15 años (> 53 kg) |
1-2 tabletas (equivalentes a 500- 1000 mg de metamizol sódico 1 monohidrato) |
Hasta 8 tabletas (equivalentes a 4000 mg de metamizol sódico 1 monohidrato) |
Pacientes adultos mayores: En pacientes de adultos mayores, se debería bajar la dosis ya que la excreción de los productos del metabolismo de este metamizol sódico puede ocurrir con retardo. En el caso de un estado general disminuido y de una depuración limitada de la creatinina
En pacientes con un estado general disminuido y una depuración limitada de la creatinina, se debería bajar la dosis ya que la eliminación de los productos del metabolismo de metamizol sódico puede ocurrir con retardo.
Función renal o hepática restringida: Dado que cuando la función renal o hepática está restringida la velocidad de eliminación disminuye, debería evitarse las dosis elevadas y reiteradas. Si se va a administrar el fármaco sólo por un corto tiempo, no será necesario reducir la dosis. No hay experiencias en lo relativo a una administración de larga duración.
Tipo de administración: El tipo de administración está supeditada al efecto terapéutico deseado y al estado del paciente. En muchos casos basta con la administración oral para conseguir un efecto satisfactorio. De requerirse que el fármaco actúe rápidamente o si la administración oral o rectal no está indicada, se recomienda la inyección intravenosa o intramuscular de este metamizol sódico. Al elegir la forma de administración hay que tener en cuenta que la administración parenteral está asociada con un elevado riesgo de reacciones anafilácticas o bien anafilactoides.
Las tabletas se degluten sin masticar y con suficiente cantidad de líquido (p. ej. un (1) vaso de agua).
Duración de la administración: La duración de la administración está supeditada al tipo y gravedad de la enfermedad. En el caso de terapias con metamizol sódico por plazos largos serán necesarios controles con hemograma periódicos, incluyendo el hemograma diferencial.
DOSIS Y VIA DE ADMINISTRACIÓN: Vía oral.
La dosificación depende de la intensidad de los dolores o de la fiebre y de la sensibilidad individual para reaccionar a metamizol sódico monohidrato. En principio, debería optarse por la dosis más baja que sea capaz de controlar el dolor y la fiebre. En lo que se refiere a la fiebre, en niños una dosis de 10 mg de metamizol por kilogramo de peso corporal es, en general, suficiente. Un efecto notorio se puede esperar 30 a 60 minutos después de la administración oral y aproximadamente 30 minutos después de la administración parenteral. En el caso de los niños y los adolescentes hasta los 14 años de edad, la dosis única a administrarse es de 8 a 16 mg de metamizol sódico monohidrato por kilogramo de peso corporal. Los adultos y los adolescentes a partir de los 15 años (>53 kg) pueden ingerir hasta 1000 mg por dosis única. Si el efecto no fuera eficaz, es posible administrar la dosis única hasta 4 veces al día, ello dependiendo de la dosis máxima diaria. Las siguientes tablas de dosificación contienen las dosis únicas recomendadas y las dosis diarias máximas. Tabla de dosificación para metamizol sódico 500 mg tabletas.
|
Edad (peso corporal) |
Dosis única |
Dosis máxima diaria |
|
10-14 años (32-53 kg) |
1 tableta (equivalente a 500 mg de metamizol sódico monohidrato) |
Hasta cuatro tabletas/(equivalentes a 2000 mg de metamizol sódico monohidrato) |
|
Adultos y adolescentes a partir de los 15 años (>53 kg) |
1-2 tabletas (equivalentes a 500-1000 mg de metamizol sódico 1 monohidrato) |
Hasta 8 tabletas (equivalentes a 4000 mg de metamizol sódico 1 monohidrato) |
Pacientes adultos mayores: En pacientes de adultos mayores, se debería bajar la dosis ya que la excreción de los productos del metabolismo de este metamizol sódico puede ocurrir con retardo. En el caso de un estado general disminuido y de una depuración limitada de la creatinina. En pacientes con un estado general disminuido y una depuración limitada de la creatinina, se debería bajar la dosis ya que la eliminación de los productos del metabolismo de metamizol sódico puede ocurrir con retardo.
Función renal o hepática restringida: Dado que cuando la función renal o hepática está restringida la velocidad de eliminación disminuye, debería evitarse las dosis elevadas y reiteradas. Si se va a administrar el fármaco sólo por un corto tiempo, no será necesario reducir la dosis. No hay experiencias en lo relativo a una administración de larga duración.
Tipo de administración: El tipo de administración está supeditada al efecto terapéutico deseado y al estado del paciente. En muchos casos basta con la administración oral para conseguir un efecto satisfactorio. De requerirse que el fármaco actúe rápidamente o si la administración oral o rectal no está indicada, se recomienda la inyección intravenosa o intramuscular de este metamizol sódico. Al elegir la forma de administración hay que tener en cuenta que la administración parenteral está asociada con un elevado riesgo de reacciones anafilácticas o bien anafilactoides. Las tabletas se degluten sin masticar y con suficiente cantidad de líquido (p. ej. un (1) vaso de agua).
Duración de la administración: La duración de la administración está supeditada al tipo y gravedad de la enfermedad. En el caso de terapias con metamizol sódico por plazos largos serán necesarios controles con hemograma periódicos, incluyendo el hemograma diferencial.
TRATAMIENTO EN CASO DE SOBREDOSIS:
Síntomas: Después de una sobredosificación aguda se han observado náuseas, vómitos, dolor en la región abdominal, deterioro de la función renal/insuficiencia renal aguda (p. ej. debido a una nefritis intersticial) y -más raramente- síntomas nerviosos centrales (vértigo, somnolencia, coma, convulsiones) y descenso de la presión arterial hasta llegar incluso al shock y la taquicardia.
Después de administrar dosis muy altas, la excreción de ácido rubazónico puede causar enrojecimiento de la orina.
Medidas terapéuticas: No se conoce un antídoto específico para el metamizol. Si la ingesta de metamizol es muy reciente, se puede intentar limitar la absorción sistémica a través de medidas destinadas a reducir la absorción (p. ej. con carbón activado). El metabolito principal (4-N-metil-amino-antipirina) puede ser eliminado mediante hemodiálisis, hemofiltración, hemoperfusión o filtración del plasma.
El tratamiento de la intoxicación, al igual que la prevención de complicaciones severas, puede hacer necesario vigilancia y tratamiento intensivos generales y especiales.
Medidas de emergencia para casos de reacciones de hipersensibilidad (shock): Al primer signo (p. ej. reacciones cutáneas, tales como urticaria y enrojecimiento, intranquilidad, cefalea, transpiración, náuseas) interrumpir la inyección. Dejar la cánula en la vena o habilitar un acceso venoso. Aparte de las medidas de emergencia habituales, tales como colocar al paciente en la posición de decúbito dorsal, mantener libres las vías respiratorias y aplicar oxígeno, puede requerirse la administración de simpaticomiméticos, volumen o glucocorticoides.
PERÍODO DE VALIDEZ:
No usar y/o administrar después de la fecha de expira indicada en los envases.
TEVA PERÚ S.A.
Telf.: 415-0500
LISTADO DE EXCIPIENTES:
Ácido esteárico, croscarmelosa sódica, estearato de magnesio, almidón de maíz.
PRESENTACIÓN: Caja x 100 tabletas.
TEVA PERÚ S.A.
Av. Venezuela 5415 - San Miguel
Telf.: 415-0500
Lima - Perú
ALMACENAMIENTO:
Almacenar a temperatura no mayor de 30 ºC.
PERIODO DE VALIDEZ: No usar y/o administrar después de la fecha de expira indicada en los envases.