
AERONID
FLUTICASONA, SALMETEROL
Suspensión en aerosol
1 Caja, Inhalador, 7.25(120 dosis) Suspensión en aerosol, 50 25/50 mcg
1 Caja, Inhalador, 7.5(120 dosis) Suspensión en aerosol, 50 125 25/125 mcg
1 Caja, Inhalador, 7.5(120 dosis) Suspensión en aerosol, 50 250 25/250 mcg
FÓRMULAS:
AERONID 50:
Cada dosis (inhalación) contiene: Salmeterol (como xinafoato) 25 µg; fluticasona propionato 50 µg; excipientes c.s.p
AERONID 125:
Cada dosis (inhalación) contiene: Salmeterol (como xinafoato) 25 µg; fluticasona propionato 125 µg; excipientes c.s.p.
AERONID 250:
Cada dosis (inhalación) contiene: Salmeterol (como xinafoato) 25 µg; fluticasona propionato 250 µg; excipientes c.s.p.
LISTA DE EXCIPIENTES:
Ácido oleico, alcohol deshidratado, tetrafluoro etano (HFA – 134a)
Para reportar reacciones adversas probables, por favor contacte a Laboratorios Roemmers S.A. Tlf: 462-1616 Anexo 252 o escríbanos a farmacovigilancia@pe.roemmers.com
Elaborado por Laboratorios Haymann S.A.
Montevideo, Uruguay
Importado y/o distribuido por:
LABORATORIOS ROEMMERS S.A.
Jr. Faustino Sánchez Carrión 425
Magdalena del Mar, Telf.: 462-1616
Lima 17-Perú
CONDICIONES DE CONSERVACIÓN Y USO:
• Mantener fuera del alcance de los niños.
• Almacenar a temperatura no mayor de 30 ºC.
• Mantener en su envase original hasta su utilización.
• No exponer a la luz del sol o al calor excesivo .Proteger del congelamiento.
• Envasado bajo presión, no debe perforarse ni arrogarse al fuego, aun cuando esté vacío.
• No utilice si observa signos de deterioro del envase o del contenido del mismo.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
INDICACIONES:
AERONID está indicado para el tratamiento regular del asma cuando la administración de una combinación (un agonista ß2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada:
• Pacientes insuficientemente controlados con corticosteroides inhalados y agonistas ß2 de acción corta administrados "a demanda"
o
• Pacientes adecuadamente controlados con un agonista ß2 de acción prolongada y con un corticosteroide por vía inhalatoria.
ACCIÓN FARMACOLÓGICA:
Propiedades farmacodinámicas: AERONID contiene salmeterol y fluticasona propionato que tienen diferentes mecanismos de acción. A continuación se exponen los respectivos mecanismos de acción de ambos fármacos:
Salmeterol: Salmeterol es un agonista selectivo de acción prolongada (12 horas) de los receptores ß2 adrenérgicos, con una cadena lateral larga que se une a la zona externa del receptor.
Salmeterol da lugar a una broncodilatación más prolongada, que dura por lo menos 12 horas, en comparación con las dosis recomendadas para los agonistas de los receptores ß2 adrenérgicos convencionales de duración de acción corta.
Fluticasona propionato: El fluticasona propionato administrado por vía inhalatoria a las dosis recomendadas tiene una acción antiinflamatoria glucocorticoidea a nivel pulmonar que se traduce en una reducción de los síntomas y de las exacerbaciones del asma, con menos reacciones adversas que cuando los corticosteroides se administran por vía sistémica.
Eficacia clínica y seguridad: Ensayos clínicos con salmeterol/fluticasona propionato en asma: Se ha realizado un estudio de 12 meses de duración (GOAL – “Gaining Optimal Asthma ControL”), en 3.416 pacientes adultos y adolescentes con asma persistente, en el que se ha comparado la eficacia y seguridad de salmeterol/fluticasona propionato frente a corticosteroides inhalados en monoterapia (fluticasona propionato) para determinar si los niveles predefinidos de control del asma eran alcanzables. Se fue aumentando el tratamiento cada 12 semanas hasta alcanzar un “control total”** o la dosis máxima de fármaco. El estudio GOAL mostró que había más pacientes tratados con salmeterol/fluticasona propionato que alcanzaban un control del asma que pacientes tratados con corticoides inhalados (CI) en monoterapia y este control se alcanzó a dosis más bajas de corticoides.
* Se alcanzó un “buen control” del asma y de manera más rápida con salmeterol/fluticasona propionato que con los corticosteroides inhalados en monoterapia. El tiempo de tratamiento en el que el 50% de los pacientes alcanzaron su primera semana de “buen control” fue de 16 días para el grupo tratado con salmeterol/fluticasona propionato comparado con 37 días para el grupo en tratamiento con corticosteroides inhalados en monoterapia. En el subconjunto de pacientes con asma que no habían sido tratados con esteroides previamente, el tiempo en el que se alcanzó su semana de “buen control” fue de 16 días en el grupo tratado con salmeterol/fluticasona propionato comparado con 23 días en el grupo tratado con corticosteroides inhalados en monoterapia.
Los resultados generales del estudio mostraron:
Porcentaje de pacientes que alcanzan Buen Control* (BC) o Control Total** (CT) del asma durante los 12 meses de duración del estudio
|
Tratamiento previo al estudio |
Salmeterol/fluticasona |
Fluticasona propionato |
||
|
BC |
CT |
BC |
CT |
|
|
No CI (solo agonistas ß adrenérgicos de corta duración) |
78% |
50% |
70% |
40% |
|
Dosis bajas de CI (≤ 500 microgramos de dipropionato de beclometasona/día o equivalente) |
75% |
44% |
60% |
28% |
|
Dosis medias de CI (>500 a 1.000 microgramos de dipropionato de beclometasona/día o equivalente) |
62% |
29% |
47% |
16% |
|
Resultados conjuntos en los 3 niveles de tratamiento |
71% |
41% |
59% |
28% |
|
* “Buen control” del asma: 2 días o menos con puntuación de síntomas mayores a 1 (la puntuación de síntomas = 1 se define como “síntoma de corta duración durante el día”), uso de agonistas ß2 de corta duración de acción durante 2 días o menos y 4 o menos veces por semana, mayor o igual al 80% del pico de flujo espiratorio previsto por la mañana, sin despertares nocturnos, ni exacerbaciones ni efectos adversos que obliguen a modificar el tratamiento. ** “Control total” del asma: ausencia de síntomas, sin necesidad de utilizar agonistas ß2 de corta duración de acción, mayor o igual al 80% del pico de flujo espiratorio previsto por la mañana, sin despertares nocturnos, ni exacerbaciones ni efectos adversos que obliguen a modificar el tratamiento. |
||||
Los resultados de este estudio sugieren que 50/100 microgramos de salmeterol/fluticasona propionato dos veces al día puede ser utilizado como terapia inicial de mantenimiento en pacientes con asma persistente moderado en los que se considere esencial alcanzar el control del asma rápidamente (ver Posología y Forma de administración).
Se ha realizado un estudio doble ciego, aleatorizado, de grupos paralelos, de 318 pacientes con asma persistente, de edad igual o superior a 18 años, para evaluar la seguridad y tolerabilidad de la administración de dos inhalaciones dos veces al día (dosis dobles) de salmeterol/fluticasona propionato durante dos semanas. Este estudio mostró que al doblar las dosis de cada concentración de salmeterol/fluticasona propionato durante un máximo de 14 días se observa un pequeño aumento de acontecimientos adversos relacionados con el agonista [temblor: 1 paciente (1%) vs 0 pacientes; palpitaciones: 6(3%) vs 1(<1%); calambres musculares: 6(3%) vs 1(<1%)] y una incidencia similar de acontecimientos adversos relacionados con el corticosteroide inhalado [p.e. candidiasis oral: 6(6%) vs 16(8%), ronquera: 2(2%) vs 4(2%)] cuando se compara con la pauta posológica habitual de una inhalación dos veces al día. Este pequeño aumento de acontecimientos adversos relacionados con el agonista debe tenerse en cuenta si se considera doblar la dosis de salmeterol/fluticasona propionato en pacientes adultos que requieran terapia adicional con corticoides inhalados a corto plazo (hasta 14 días).
“Salmeterol Multi-Center Asthma Research Trial” (SMART): El estudio SMART es un estudio multi-céntrico, aleatorizado, doble ciego, controlado con placebo en grupos paralelos, de 28 semanas de duración, realizado en EEUU, en el que se trataron aleatoriamente 13.176 pacientes con salmeterol (50 microgramos dos veces al día) y 13.179 pacientes con placebo, además de recibir su tratamiento habitual para el asma. Los pacientes fueron incluidos en el ensayo si tenían al menos 12 años, asma, y si actualmente estaban usando medicación para el asma (pero no LABAs). Se recogieron los datos del uso basal de corticosteroides inhalados en el momento de comenzar el estudio, aunque no era necesario para el mismo. El criterio de eficacia primario en el estudio SMART fue la determinación, de forma combinada, del número de muertes relacionadas con problemas respiratorios y de acontecimientos respiratorios con riesgo para la vida.
Hallazgos fundamentales del estudio SMART: Criterio de eficacia primario
|
Grupo de pacientes |
Número de criterios de eficacia primarios/Número de pacientes |
Riesgo relativo (intervalo de confianza 95%) |
|
|
Salmeterol |
Placebo |
||
|
Todos los pacientes |
50/13.176 |
36/13.179 |
1,40 (0,91; 2,14) |
|
Pacientes que utilizan corticosteroides inhalados |
23/6.127 |
19/6.138 |
1,21 (0,66; 2,23) |
|
Pacientes que no utilizan corticosteroides inhalados |
27/7.049 |
17/7.041 |
1,60 (0,87; 2,93) |
|
Pacientes Afro- americanos |
20/2.366 |
5/2.319 |
4,10 (1,54; 10,90) |
|
(El riesgo en negrita es estadísticamente significativo con un IC del 95%). |
|||
Hallazgos fundamentales del estudio SMART en función del uso de corticosteroides inhalados en el periodo basal: Criterios de eficacia secundarios
|
Número de criterios de eficacia secundarios/Número de pacientes |
Riesgo relativo (intervalo de confianza 95%) |
||
|
Salmeterol |
Placebo |
||
|
Muertes relacionadas con problemas respiratorios |
|||
|
Pacientes que utilizan corticosteroides inhalados |
10/6.127 |
5/6.138 |
2,01 (0,69; 5,86) |
|
Pacientes que no utilizan corticosteroides inhalados |
14/7.049 |
6/7.041 |
2,28 (0,88; 5,94) |
|
Combinación de muertes relacionadas con asma y acontecimientos respiratorios con riesgo para la vida |
|||
|
Pacientes que utilizan corticosteroides inhalados |
16/6.127 |
13/6.138 |
1,24 (0,60; 2,58) |
|
Pacientes que no utilizan corticosteroides inhalados |
21/7.049 |
9/7.041 |
2,39 (1,10; 5,22) |
|
Muertes relacionadas con el asma |
|||
|
Pacientes que utilizan corticosteroides inhalados |
4/6.127 |
3/6.138 |
1,35 (0,30; 6,04) |
|
Pacientes que no utilizan corticosteroides inhalados |
9/7.049 |
0/7.041 |
* |
|
*No se puede calcular porque no hay acontecimientos en el grupo tratado con placebo. El riesgo en negrita es estadísticamente significativo con un IC del 95% .Los criterios de eficacia secundarios recogidos en la tabla son estadísticamente significativos en toda la población). Los criterios de eficacia secundarios combinados de todas las causas de muerte o acontecimientos con riesgo para la vida, todas las causas de muerte, o todas las causas de hospitalización, no alcanzaron significación estadística en toda la población. |
|||
Población pediátrica: En el ensayo SAM101667, realizado en 158 niños de edades comprendidas entre los 6 y los 16 años de edad, con asma sintomática, la combinación de salmeterol/fluticasona propionato es igualmente eficaz que aumentar la dosis de fluticasona propionato al doble respecto al control de los síntomas y la función pulmonar. Este estudio no fue diseñado para investigar el efecto sobre las exacerbaciones.
En un ensayo aleatorizado de 12 semanas de duración realizado con niños con edades comprendidas entre los 4 y 11 años de edad [n=428] se comparó salmeterol/fluticasona propionato polvo para inhalación (50/100 microgramos, una inhalación dos veces al día) con salmeterol/fluticasona propionato inhalador (25/50 microgramos, dos inhalaciones dos veces al día). El cambio medio ajustado respecto al valor basal del pico de flujo espiratorio medio matutino en las semanas 1 -12 fue de 37,7 L/min en el grupo polvo para inhalación y de 38,6 L/min en el grupo del inhalador. También se observaron mejorías en ambos grupos de tratamiento en relación a la medicación de rescate y los días y noches libres de síntomas.
Propiedades farmacocinéticas: Cuando salmeterol y fluticasona propionato se administraron en combinación por vía inhalatoria, la farmacocinética de cada componente fue similar a la observada cuando los fármacos se administraron por separado. Por consiguiente, en lo que respecta a farmacocinética, cada componente puede considerarse separadamente.
Salmeterol: Salmeterol actúa localmente en el pulmón, por lo que los niveles plasmáticos no son predictivos del efecto terapéutico. Además, se dispone solo de datos limitados sobre la farmacocinética de salmeterol, a causa de la dificultad técnica de la determinación del fármaco en plasma, debido a las bajas concentraciones plasmáticas a dosis terapéuticas (aproximadamente 200 picogramos/mL o menos) alcanzadas tras la inhalación.
Fluticasona propionato: La biodisponibilidad absoluta de una dosis única del fluticasona propionato inhalado en sujetos sanos varía aproximadamente entre un 5 y un11% de la dosis nominal, dependiendo del dispositivo para inhalación utilizado. Se ha observado un menor grado de exposición sistémica al fluticasona propionato inhalado, en pacientes con asma.
La absorción sistémica tiene lugar principalmente a través de los pulmones, siendo inicialmente rápida y posteriormente prolongada. El resto de la dosis inhalada puede ingerirse, contribuyendo mínimamente sin embargo a la exposición sistémica, debido a la baja solubilidad acuosa y a un metabolismo pre-sistémico, dando como resultado una disponibilidad por vía oral de menos del 1%. Hay un aumento lineal en la exposición sistémica con el aumento de la dosis inhalada. La disposición del fluticasona propionato se caracteriza por un aclaramiento plasmático elevado (1.150 mL/min), un gran volumen de distribución en el estado de equilibrio (aproximadamente 300 l) y una semivida terminal de aproximadamente 8 horas.
La unión a proteínas plasmáticas es del 91%.
El fluticasona propionato se elimina muy rápidamente de la circulación sistémica. La vía principal es la metabolización, por la enzima CYP3A4 del citocromo P450, a un metabolito carboxílico inactivo. Se han hallado también en las heces otros metabolitos no identificados.
El aclaramiento renal del fluticasona propionato es insignificante. Menos del 5% de la dosis se excreta en orina, principalmente en forma de metabolitos. La parte principal de la dosis se excreta en heces como metabolitos y fármaco inalterado.
Población pediátrica: El efecto de 21 días de tratamiento con salmeterol/fluticasona propionato inhalador 25/50 microgramos (2 inhalaciones dos veces al día con o sin cámara de inhalación) o salmeterol/fluticasona propionato polvo para inhalación 50/100 microgramos (1 inhalación dos veces al día) fue evaluada en 31 niños de edades comprendidas entre 4 y 11 años con asma leve. La exposición sistémica al fluticasona propionato fue similar para salmeterol/fluticasona propionato inhalador con cámara de inhalación (107 pg hr/ml [95% IC: 45,7; 252,2]) y salmeterol/fluticasona propionato polvo para inhalación (138 pg hr/ml [95% IC: 69,3; 273,2]), pero menor para salmeterol/fluticasona propionato inhalador (24 pg hr/ml [95% IC: 9,6; 60,2]). La exposición sistémica a salmeterol fue similar para salmeterol/fluticasona propionato inhalador, salmeterol/fluticasona propionato inhalador con cámara de inhalación, y salmeterol/fluticasona propionato polvo para inhalación (126 pg hr/ml [95% IC: 70; 225], 103 pg hr/ml [95% IC: 54; 200], y 110 pg hr/ml [95% IC: 55; 219], respectivamente).
CONTRAINDICACIONES:
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la Lista de Excipientes.
REACCIONES ADVERSAS:
Como AERONID contiene salmeterol y fluticasona propionato, es de esperar que aparezcan reacciones adversas de naturaleza y gravedad similares a las atribuidas a cada uno de los compuestos. No aparecen reacciones adversas adicionales tras la administración conjunta de los dos compuestos.
A continuación se indican las reacciones adversas asociadas con salmeterol/fluticasona propionato, clasificadas por órganos y frecuencia. Las frecuencias se han definido de la siguiente forma:
• Muy frecuentes (≥1/10),
• Frecuentes (≥1/100 a <1/10),
• Poco frecuentes (≥1/1.000 a <1/100),
• Raras (≥1/10.000 a <1/1.000) y
• Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las frecuencias se han identificado a partir de los datos de ensayos clínicos. No se tuvo en cuenta la incidencia en el grupo placebo.
|
Clasificación de órganos |
Reacciones adversas |
Frecuencia |
|
Infecciones e infestaciones |
Candidiasis en la boca y garganta |
Frecuentes |
|
Neumonía |
Frecuentes1,3,5 |
|
|
Bronquitis |
Frecuentes1,3 |
|
|
Candidiasis esofágica |
Raras |
|
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad con las siguientes manifestaciones: |
|
|
Reacciones de hipersensibilidad cutánea |
Poco frecuentes |
|
|
Angioedema (principalmente edema facial y orofaríngeo) |
Raras |
|
|
Síntomas respiratorios (disnea) |
Poco frecuentes |
|
|
Síntomas respiratorios (broncoespasmo) |
Raras |
|
|
Reacciones anafilácticas incluyendo shock anafiláctico |
Raras |
|
|
Trastornos endocrinos |
Síndrome de Cushing, aspecto cushingoide, supresión suprarrenal, retraso en el crecimiento de niños y adolescentes, disminución de la densidad mineral del hueso |
Raras4 |
|
Trastornos del metabolismo y de la nutrición |
Hipocaliemia |
Frecuentes3 |
|
Hiperglucemia |
Poco frecuentes4 |
|
|
Trastornos psiquiátricos |
Ansiedad |
Poco frecuentes |
|
Trastornos del sueño |
Poco frecuentes |
|
|
Cambios en el comportamiento, incluidos hiperactividad psicomotora e irritabilidad (predominantemente en niños) |
Raras |
|
|
Depresión, agresividad (predominantemente en niños) |
Frecuencia no conocida |
|
|
Trastornos del sistema nervioso |
Cefalea |
Muy frecuentes1 |
|
Temblor |
Poco frecuentes |
|
|
Trastornos oculares |
Cataratas |
Poco frecuentes |
|
Glaucoma |
Raras4 |
|
|
Trastornos cardiacos |
Palpitaciones |
Poco frecuentes |
|
Taquicardia |
Poco frecuentes |
|
|
Arritmias cardíacas (incluyendo, taquicardia supraventricular y extrasístoles) |
Raras |
|
|
Fibrilación auricular |
Poco frecuentes |
|
|
Angina de pecho |
Poco frecuentes |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Nasofaringitis |
Muy frecuentes2,3 |
|
Irritación de garganta |
Frecuentes |
|
|
Ronquera/disfonía |
Frecuentes |
|
|
Sinusitis |
Frecuentes1,3 |
|
|
Broncoespasmo paradójico |
Raras4 |
|
|
Trastornos de la piel y del tejido subcutáneo |
Contusiones |
Frecuentes1,3 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Calambres musculares |
Frecuentes |
|
Fracturas traumáticas |
Frecuentes1,3 |
|
|
Artralgia |
Frecuentes |
|
|
Mialgia |
Frecuentes |
|
|
1. Notificado frecuentemente con placebo 2. Notificado muy frecuentemente con placebo 3. Notificado durante un estudio de EPOC de 3 años 4. Ver Advertencias 5. Ver Acción Farmacológica - Propiedades Farmacodinámicas |
||
Descripción de algunas de las reacciones adversas: Se han comunicado las reacciones adversas farmacológicas de un tratamiento con un agonista ß2, tales como temblor, palpitaciones y cefalea, pero tienden a ser transitorias y a disminuir con el tratamiento regular.
Al igual que con otros tratamientos de administración por vía inhalatoria, puede aparecer broncoespasmo paradójico, con un aumento inmediato de las sibilancias y la dificultad para respirar tras la administración. El broncoespasmo paradójico responde a un broncodilatador de acción rápida y debe tratarse inmediatamente. Debe interrumpirse inmediatamente la administración de AERONID suspensión para inhalación en envase a presión, examinar al paciente e instituir una terapia alternativa si fuera necesario.
Debido al componente fluticasona propionato, algunos pacientes pueden padecer ronquera y candidiasis (aftas) en boca y garganta, y rara vez, en el esófago. Tanto la ronquera como la incidencia de candidiasis en la boca y la garganta pueden aliviarse enjuagándose la boca con agua y/o cepillándose los dientes tras utilizar este producto. La candidiasis sintomática en la boca y en la garganta puede tratarse mediante una terapia antifúngica tópica mientras se continúa el tratamiento con AERONID.
Población pediátrica: Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoide, supresión suprarrenal y retraso en el crecimiento de niños y adolescentes (ver Advertencias.). Los niños también pueden experimentar ansiedad, trastornos del sueño y cambios en el comportamiento, incluidos hiperactividad e irritabilidad.
Comunicar a su médico o farmacéutico cualquier reacción adversa que no estuviese descrita en el inserto.
INTERACCIONES MEDICAMENTOSAS:
Los ß-bloqueantes adrenérgicos pueden disminuir o antagonizar el efecto del salmeterol. Debe evitarse la utilización de fármacos ß bloqueantes tanto selectivos como no selectivos en pacientes con asma, a menos que haya razones que obliguen a ello.
Como resultado de la terapia ß2 agonista, puede aparecer hipocaliemia potencialmente grave. Se debe tener especial precaución en asma agudo y grave ya que este efecto puede ser potenciado por un tratamiento concomitante con derivados de la xantina, esteroides y diuréticos.
El uso concomitante de otros fármacos que contengan agonistas adrenérgicos puede tener un efecto potencialmente aditivo.
Fluticasona propionato: En circunstancias normales, se obtienen bajas concentraciones plasmáticas de fluticasona propionato después de la inhalación, debido a un intenso metabolismo de primer paso hepático y a un alto aclaramiento sistémico producido por el citocromo P450 3A4 en el intestino e hígado. Por lo tanto, es improbable que se produzcan interacciones medicamentosas clínicamente significativas en las que intervenga el fluticasona propionato.
En un estudio sobre interacción llevado a cabo con fluticasona propionato intranasal en sujetos sanos, se ha demostrado que 100 mg dos veces al día de ritonavir (potente inhibidor del citocromo P450 3A4) puede aumentar varios cientos de veces las concentraciones de fluticasona propionato en plasma, originando unas concentraciones de cortisol sérico marcadamente reducidas. Se carece de información relativa a esta interacción para el fluticasona propionato inhalado, pero se espera un importante aumento en los niveles plasmáticos de fluticasona propionato.
Se han notificado casos de síndrome de Cushing y de supresión suprarrenal. Debería evitarse el uso de la combinación, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo glucocorticoide.
En un pequeño estudio realizado en voluntarios sanos, ketoconazol, inhibidor ligeramente menos potente del CYP3A, produjo un aumento de la exposición de fluticasona propionato tras una única inhalación del 150%. Esto produjo una mayor reducción de los niveles de cortisol plasmático en comparación con el fluticasona propionato solo. También se espera que el tratamiento concomitante con otros inhibidores potentes del CYP3A, como itraconazol o con inhibidores moderados del CYP3A, como eritromicina aumente la exposición sistémica de fluticasona propionato y el riesgo de efectos adversos sistémicos. Se recomienda tener precaución y evitar, en la medida de lo posible, el tratamiento a largo plazo con estos fármacos.
Salmeterol: Inhibidores potentes del CYP3A4: La administración conjunta de ketoconazol (400 mg una vez al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 7 días produjo un aumento significativo de la exposición de salmeterol en plasma (1,4 veces la Cmax y 15 veces el AUC). Esto puede conducir a un aumento de la incidencia de otros efectos sistémicos del tratamiento con salmeterol (p.e. prolongación del intervalo QTc y palpitaciones) en comparación con el tratamiento con salmeterol o ketoconazol solo (ver Advertencias).
No se han observado efectos clínicamente significativos sobre la presión sanguínea, la frecuencia cardiaca y los niveles de potasio y glucosa en sangre. La administración concomitante con ketoconazol no aumentó la semivida de eliminación de salmeterol ni aumentó la acumulación de salmeterol con dosis repetidas.
Se debe evitar la administración concomitante de ketoconazol, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos adversos sistémicos del tratamiento con salmeterol. Es probable que exista un riesgo similar de interacción con otros inhibidores potentes del CYP3A4 (p.e. itraconazol, telitromicina, ritonavir).
Inhibidores moderados del CYP3A4: La administración conjunta de eritromicina (500 mg tres veces al día por vía oral) y salmeterol (50 microgramos dos veces al día por vía inhalatoria) en 15 sujetos sanos durante 6 días produjo un aumento pequeño, pero no estadísticamente significativo, de la exposición de salmeterol (1,4 veces la Cmax y 1,2 veces el AUC). La administración concomitante con eritromicina no se asoció con ningún efecto adverso grave.
ADVERTENCIAS:
AERONID no debe utilizarse para el tratamiento de los síntomas agudos del asma para los que se requiere el uso de un broncodilatador de inicio rápido y corta duración de acción. Se debe advertir a los pacientes de que lleven en todo momento su inhalador para el alivio de los síntomas de un ataque agudo de asma.
Los pacientes no deben iniciar el tratamiento con AERONID durante una exacerbación aguda grave, o si están sufriendo un empeoramiento significativo o un deterioro agudo del asma.
Durante el tratamiento con AERONID pueden producirse acontecimientos adversos graves relacionados con el asma y exacerbaciones. Se debe pedir a los pacientes que continúen el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran tras comenzar el tratamiento con AERONID.
El aumento en la necesidad de utilizar la medicación de rescate (broncodilatadores de acción corta) o una disminución de la respuesta a esta medicación de rescate indican un empeoramiento en el control del asma y los pacientes deben ser examinados por un médico.
Un empeoramiento repentino y progresivo en el control del asma puede poner en peligro la vida del paciente, por lo que se le debe hacer una evaluación inmediata. Debe considerarse el hecho de aumentar la terapia corticosteroidea.
Una vez que se hayan controlado los síntomas del asma, se puede tener en cuenta la posibilidad de reducir gradualmente la dosis de AERONID. Es importante controlar de forma regular a los pacientes a los que se les está disminuyendo el tratamiento. Debe utilizarse la dosis mínima eficaz de AERONID (ver Posología y forma de administración).
El tratamiento con AERONID no debe suspenderse bruscamente debido al riesgo de exacerbaciones. La medicación debe suspenderse bajo supervisión médica.
Como en el caso de todos los medicamentos administrados por vía inhalatoria que contienen corticosteroides, se administrará con precaución a pacientes con tuberculosis pulmonar activa o latente y con infecciones fúngicas, vírales o de otro tipo en las vías respiratorias. Si está indicado, se debe establecer rápidamente el tratamiento apropiado.
Raramente AERONID puede causar arritmias cardiacas, tales como taquicardia supraventricular, extrasístoles y fibrilación auricular, y un leve descenso transitorio de los niveles de potasio en sangre a dosis terapéuticas elevadas. AERONID debe emplearse con precaución en pacientes con alteraciones cardiovasculares graves o alteraciones del ritmo cardiaco y en pacientes con diabetes mellitus, tirotoxicosis, hipocaliemia no corregida o en pacientes con predisposición a tener niveles bajos de potasio en sangre.
Se han notificado casos muy raros de aumento de los niveles de glucosa en sangre (ver Reacciones adversas), lo cual debe tenerse en cuenta cuando se prescriba a pacientes con antecedentes de diabetes mellitus.
Al igual que con otros tratamientos de administración por vía inhalatoria, puede aparecer broncoespasmo paradójico, aumentando de forma inmediata la sibilancia y dificultad para respirar tras la administración. El broncoespasmo paradójico responde a un broncodilatador de acción rápida y debe tratarse inmediatamente. Debe interrumpirse inmediatamente la administración de AERONID, examinar al paciente e instituirse una terapia alternativa si fuera necesario. Se han notificado efectos adversos farmacológicos del tratamiento con agonistas ß2, tales como temblor, palpitaciones y cefalea, aunque tienden a ser transitorios y disminuyen con el uso del tratamiento.
Pueden aparecer efectos sistémicos con cualquier corticosteroide administrado por vía inhalatoria, especialmente a dosis elevadas prescritas durante largos periodos. La probabilidad de que estos efectos aparezcan es mucho menor que con corticosteroides administrados por vía oral. Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, disminución de la densidad mineral del hueso, cataratas y glaucoma y más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños) (para mayor información sobre los efectos sistémicos de los corticosteroides inhalados en niños y adolescentes ver la sección “Población Pediátrica” más adelante). Por lo tanto, es importante someter a los pacientes a controles periódicos y reducir la dosis de corticosteroide inhalado a la dosis mínima con la que se mantenga un control eficaz del asma.
El tratamiento prolongado con altas dosis de corticosteroides inhalados puede causar supresión suprarrenal y crisis suprarrenal aguda. Se han descrito casos muy raros de supresión suprarrenal y crisis suprarrenal aguda con dosis de fluticasona propionato superiores a 500 microgramos e inferiores a 1.000 microgramos. Las situaciones que podrían potencialmente desencadenar una crisis suprarrenal aguda, incluyen trauma, cirugía, infección o cualquier reducción rápida de la dosis. Los síntomas que aparecen son habitualmente vagos y pueden incluir anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, hipotensión, disminución del nivel de conciencia, hipoglucemia y convulsiones. Se debe considerar la administración adicional de corticosteroides por vía sistémica durante periodos de estrés o cirugía electiva.
La absorción sistémica de salmeterol y fluticasona propionato se realiza mayoritariamente a través de los pulmones. Como el uso de una cámara de inhalación con un inhalador presurizado puede aumentar la cantidad de fármaco que llega a los pulmones, se debe tener en cuenta que esto podría producir potencialmente un aumento en el riesgo de efectos adversos sistémicos. Los datos farmacocinéticos tras dosis única han demostrado que la exposición sistémica al salmeterol y fluticasona propionato puede aumentar hasta duplicarse cuando se utiliza la cámara AeroChamber Plus como cámara de inhalación de r en comparación a cuando se utiliza la cámara Volumatic.
Los beneficios del tratamiento con fluticasona propionato por vía inhalatoria deben reducir la necesidad de administrar esteroides por vía oral, pero los pacientes transferidos que recibían terapia con esteroides por vía oral pueden seguir estando en situación de riesgo de alteración de la reserva suprarrenal durante un tiempo considerable. Por lo tanto, se debe tratar con especial precaución a estos pacientes y se debe monitorizar su función suprarrenal de forma regular. Los pacientes que han requerido una terapia corticosteroidea de emergencia con dosis altas en el pasado, pueden también estar en situación de riesgo.
Esta posibilidad de alteración residual deberá siempre tenerse en cuenta en situaciones de emergencia y electivas que puedan producir estrés, debiéndose considerar la instauración de un tratamiento corticosteroideo apropiado. El grado de insuficiencia suprarrenal puede requerir el consejo de un especialista antes de los procedimientos electivos.
Ritonavir puede aumentar de manera considerable las concentraciones de fluticasona propionato en plasma. Por lo tanto, debería evitarse el uso concomitante de fluticasona propionato y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo corticosteroide. También hay un aumento del riesgo de que aparezcan efectos adversos sistémicos cuando se combina el fluticasona propionato con otros inhibidores potentes del CYP3A (ver Interacciones medicamentosas).
En un estudio de 3 años de duración, realizado en pacientes con Enfermedad Pulmonar Obstructiva Crónica (EPOC) que recibieron salmeterol y fluticasona propionato en combinación a dosis fija administrado en forma de polvo para inhalación, se produjo un aumento en las notificaciones de infecciones de las vías respiratorias bajas (especialmente neumonía y bronquitis) en comparación con placebo (ver Reacciones adversas).
En un estudio EPOC a 3 años los pacientes de edad avanzada, pacientes con un índice de masa corporal bajo (<25 kg/m2) y los pacientes clasificados como muy graves (VEMS <30% del normal) tuvieron el mayor riesgo de desarrollar neumonía con independencia del tratamiento. Los médicos deben permanecer alerta ante el posible desarrollo de neumonía y otras infecciones de las vías respiratorias bajas en pacientes con EPOC, ya que las características clínicas de tales infecciones se superponen con frecuencia con las de las exacerbaciones. Si un paciente con EPOC grave ha experimentado neumonía, se debe reevaluar el tratamiento con AERONID. No se ha establecido la seguridad y eficacia de AERONID suspensión para inhalación en envase a presión en pacientes con EPOC, por lo que AERONID suspensión para inhalación en envase a presión no está indicado para el tratamiento de pacientes con EPOC.
Los datos de un amplio ensayo clínico (“Salmeterol Multi-Center Asthma Research Trial”, SMART) sugirieron que los pacientes afro-americanos presentaban un mayor riesgo de padecer acontecimientos graves relacionados con el sistema respiratorio o de muertes durante la utilización de salmeterol en comparación con placebo (ver Acción farmacológica - Propiedades farmacodinámicas). No se conoce si era debido a factores farmacogenéticos u otros factores. Por lo tanto, se debe pedir a los pacientes con ascendencia africana o afro-caribeña que continúen con el tratamiento pero que acudan a su médico si los síntomas del asma siguen sin estar controlados o empeoran durante el tratamiento con AERONID.
El uso concomitante de ketoconazol por vía sistémica aumenta significativamente la exposición sistémica a salmeterol. Esto puede conducir a un aumento de la incidencia de los efectos sistémicos (p.e. prolongación del intervalo QTc y palpitaciones).
Por tanto, se debe evitar el uso concomitante de ketoconazol u otros inhibidores potentes del CYP3A4, a menos que los beneficios superen el riesgo potencialmente aumentado de padecer efectos sistémicos del tratamiento con salmeterol (ver Interacciones medicamentosas).
Población pediátrica: Los niños y adolescentes menores de 16 años que reciben dosis altas de fluticasona propionato (habitualmente > 1.000 microgramos/día) pueden estar, en particular, en situación de riesgo. Pueden aparecer efectos sistémicos, especialmente a dosis elevadas prescritas durante largos periodos. Los posibles efectos sistémicos incluyen Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, crisis suprarrenal aguda y retraso en el crecimiento de niños y adolescentes y más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad. Se debe considerar remitir a los niños o adolescentes a un especialista en neumología pediátrica.
Se recomienda controlar de forma regular la altura de los niños que reciben tratamiento prolongado con corticosteroides inhalados. Se debe reducir la dosis de corticosteroide inhalado a la dosis mínima con la que se mantenga un control eficaz del asma.
PRECAUCIONES:
Embarazo: Existen algunos datos en mujeres embarazadas (de 300 a 1.000 embarazos) que indican que salmeterol y fluticasona propionato no producen malformaciones ni toxicidad fetal/neonatal. Los estudios realizados en animales han mostrado toxicidad para la reproducción tras la administración de agonistas de receptores ß2 adrenérgicos y glucocorticosteroides (ver Acción Farmacológica - Datos preclínicos de seguridad).
Solo se debe considerar la administración de AERONID a mujeres embarazadas si el beneficio esperado para la madre supera cualquier posible riesgo para el feto.
En mujeres embarazadas se debe utilizar la dosis mínima eficaz de fluticasona propionato requerida para mantener un control adecuado del asma.
Lactancia: Se desconoce si salmeterol y fluticasona propionato/metabolitos se excretan en la leche materna.
Los estudios han demostrado que salmeterol y fluticasona propionato, y sus metabolitos, se excretan en la leche de ratas lactantes.
No se puede excluir el riesgo en recién nacidos lactantes/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con AERONID tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad: No hay datos en humanos. Sin embargo, los estudios realizados en animales no mostraron efectos del salmeterol o fluticasona propionato en la fertilidad.
Efectos sobre la capacidad para conducir y utilizar máquinas: La influencia de AERONID suspensión para inhalación en envase a presión sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
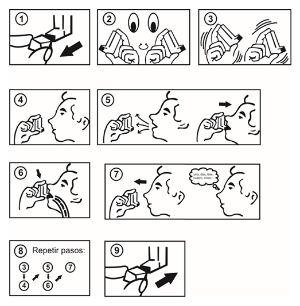
INSTRUCCIONES DE USO:
Se debe enseñar a los pacientes el manejo adecuado de su inhalador.
Durante la inhalación, es preferible que el paciente esté de pie o sentado. El inhalador se ha diseñado para ser utilizado en posición vertical.
Comprobación del inhalador: Antes de usar por primera vez el inhalador quitar el protector del aplicador bucal o boquilla apretando suavemente por los lados, agitar bien el inhalador, sujetar el inhalador en posición vertical colocando el dedo pulgar en la base del inhalador, debajo de la boquilla, para asegurar, de esta manera, el funcionamiento del inhalador. Se debe agitar el inhalador inmediatamente antes de cada inhalación. Si ha transcurrido una semana o más sin utilizar el inhalador, se debe quitar el protector del aplicador, agitar bien el inhalador y liberar al aire dos aplicaciones.
Utilización del inhalador:
1. Los pacientes deben quitar el protector de la boquilla, apretando suavemente por los lados.
2. Los pacientes deben comprobar que no hay partículas extrañas por dentro y por fuera del inhalador, incluyendo la boquilla.
3. Los pacientes deben agitar bien el inhalador para asegurar la eliminación de cualquier partícula extraña y que el contenido del inhalador se mezcla adecuadamente.
4. Los pacientes deben sujetar el inhalador en posición vertical entre los dedos y el pulgar, colocando el pulgar en la base del inhalador, por debajo de la boquilla.
5. Los pacientes deben expulsar tanto aire como les sea posible y colocar la boquilla del inhalador entre los dientes y cerrar los labios alrededor de la boquilla. Los pacientes no deben morder la boquilla.
6. Inmediatamente después de comenzar a tomar aire por la boca, los pacientes deben pulsar firmemente la parte superior del inhalador para liberar AERONID, y continuar tomando aire profunda y constantemente.
7. Mientras contienen la respiración, los pacientes deben retirar el inhalador de la boca y quitar el dedo de la parte superior del inhalador. Los pacientes deben continuar aguantando la respiración el tiempo que les sea posible.
8. Para administrar una segunda inhalación, los pacientes deben mantener el inhalador en posición vertical y esperar medio minuto antes de repetir los pasos 3 a 7.
9. Los pacientes deben volver a colocar el protector de la boquilla inmediatamente en su posición correcta, empujando firmemente y ajustándolo hasta oír un chasquido. No se requiere una fuerza excesiva y se debe oír un “clic” al encajarlo en su posición.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Posología:
Forma de administración: Vía inhalatoria.
Se hará saber a los pacientes que deben usar diariamente AERONID, a fin de obtener un beneficio óptimo, aun cuando no tengan síntomas.
Los pacientes deben ser reevaluados regularmente por un médico, de manera que la concentración de AERONID que reciban siga siendo la óptima y solo se modifique por consejo médico. Debe ajustarse la dosis a fin de que se administre la más baja con la que se mantenga un control eficaz de los síntomas. Cuando el control de los síntomas se mantenga con la concentración más baja de la combinación administrada dos veces al día, entonces el siguiente paso podría consistir en probar el tratamiento exclusivamente con un corticosteroide por vía inhalatoria. Como alternativa, aquellos pacientes que precisen de un agonista ß2 de acción prolongada podrán recibir AERONID una vez al día si, a criterio de su médico, este fuera el tratamiento adecuado para mantener el control de la enfermedad. En caso que la pauta posológica de una vez al día se administre a un paciente con antecedentes de síntomas nocturnos, la dosis debe ser administrada por la noche, mientras que si el paciente presenta un historial de síntomas principalmente diurnos, la dosis debe administrarse por la mañana.
Los pacientes deben recibir la concentración de AERONID que contenga la cantidad apropiada de fluticasona propionato adecuada a la gravedad de su enfermedad.
Nota: Si un paciente individual necesitara una posología no incluida en el régimen recomendado, se deberán prescribir las dosis apropiadas de ß2 agonista y/o corticosteroide.
Dosis recomendadas:
Adultos y adolescentes de 12 años en adelante:
• Dos inhalaciones de 25 microgramos de salmeterol y 125 microgramos de fluticasona propionato dos veces al día
Se puede probar, durante un periodo de tiempo limitado, la utilización de AERONID como terapia inicial de mantenimiento en adultos y adolescentes con asma persistente moderada (definidos como pacientes con síntomas diarios, utilización de medicación de rescate diaria y obstrucción de las vías respiratorias de moderada a grave) para los que es esencial un control rápido del asma. En estos casos, la dosis inicial recomendada es de dos inhalaciones de 25 microgramos de salmeterol y 50 microgramos de fluticasona propionato dos veces al día. Una vez que se ha alcanzado el control del asma, se debe revisar el tratamiento y considerar si los pacientes deben ser tratados con corticosteroides inhalados únicamente. Es importante controlar de forma regular a los pacientes a los que se les esté disminuyendo el tratamiento.
No se ha observado un beneficio claro al compararlo con fluticasona propionato inhalado solo, usado como terapia inicial de mantenimiento, cuando no se cumplen uno o dos de los criterios de gravedad. En general los corticosteroides inhalados continúan como primera línea de tratamiento para la mayoría de los pacientes. AERONID no está destinado al tratamiento inicial del asma leve. AERONID en dosis de 25 microgramos/50 microgramos, no es apropiado en adultos y niños con asma grave; se recomienda establecer la dosis apropiada de corticosteroides inhalados antes de utilizar cualquier combinación fija en pacientes con asma grave.
Población pediátrica:
• Niños de 4 años en adelante: La dosis máxima permitida en niños es 100 microgramos de fluticasona propionato dos veces al día.
No se dispone de datos acerca del uso de AERONID, suspensión para inhalación en envase a presión en niños menores de 4 años, por lo tanto no usar en esta población.
Los niños menores de 12 años podrían tener dificultades para sincronizar la utilización del inhalador con la inspiración. Se recomienda que los pacientes que tengan, o puedan tener, dificultades para coordinar la utilización del inhalador con la inspiración, utilicen una cámara de inhalación con AERONID inhalador. Un estudio clínico reciente ha demostrado que los pacientes pediátricos que utilizan una cámara de inhalación, alcanzan una exposición similar a los adultos que no utilizan cámara de inhalación y a los pacientes pediátricos que utilizan el salmeterol/fluticasona propionato en polvo para inhalación, confirmando que las cámaras de inhalación compensan en aquellos casos en los que la técnica de inhalación no es correcta (ver Acción farmacológica - Propiedades farmacocinéticas).
Se pueden utilizar cámaras como Volumatic o AeroChamber Plus (dependiendo de las recomendaciones nacionales). Existen datos limitados que demuestran un aumento en la exposición sistémica cuando se utiliza la cámara AeroChamber Plus como cámara de inhalación en comparación con la utilización de la cámara Volumatic (ver Advertencias).
Los pacientes deben ser instruidos en el uso y el cuidado apropiado del inhalador y la cámara; igualmente se debe contrastar la forma de empleo para asegurar que la cantidad óptima del fármaco inhalado llega a los pulmones. Los pacientes deben continuar utilizando la misma marca de cámara de inhalación, ya que cambiar de cámara puede tener como resultado que llegue distinta dosis de fármaco a los pulmones (ver Advertencias).
En caso de introducción o cambio de cámara de inhalación, la dosis deberá reajustarse a la dosis efectiva más baja.
Poblaciones especiales: No es necesario ajustar la dosis en pacientes de edad avanzada o en aquellos con insuficiencia renal. No se dispone de datos sobre el uso de AERONID en pacientes con insuficiencia hepática.
Comunicar al médico o farmacéutico, según proceda, para cualquier aclaración sobre la utilización del producto.
SOBREDOSIS:
No se dispone de datos procedentes de ensayos clínicos relativos a la sobredosis con AERONID; no obstante, a continuación se facilitan datos acerca de la sobredosis con ambos fármacos:
Los signos y síntomas de una sobredosis con salmeterol son mareos, aumento de la presión arterial sistólica, temblor, cefalea, y taquicardia. Si el tratamiento con AERONID ha de interrumpirse debido a una sobredosis del componente agonista ß2, debe considerarse la administración de un tratamiento esteroideo de sustitución adecuado. También puede aparecer hipocaliemia y, por ello, se deben monitorizar los niveles de potasio sérico. Se debe considerar la reposición de potasio.
Aguda: La inhalación de forma aguda de dosis de fluticasona propionato, superiores a las recomendadas, puede conducir a una supresión temporal de la función suprarrenal. Esto no hace necesario tomar ninguna acción de emergencia ya que la función suprarrenal se recupera en algunos días, como se comprueba en las determinaciones de cortisol en plasma.
Sobredosificación crónica de fluticasona propionato inhalado: Se debe monitorizar la reserva suprarrenal y puede ser necesario un tratamiento con corticosteroides sistémicos. Cuando se estabilice, el tratamiento debe continuarse con un corticosteroide inhalado a la dosis recomendada. Consulte la Advertencias: riesgo de supresión suprarrenal.
En casos de sobredosificación aguda y crónica de fluticasona propionato, se debe continuar la terapia con AERONID con una posología adecuada para el control de los síntomas.
MONITOREO DEL PACIENTE: No aplica.
IMPORTANTE:
Los pacientes no deben efectuar las etapas 5, 6 y 7 rápidamente. Es importante iniciar la respiración tan lentamente como se pueda, justamente antes de pulsar el inhalador. Es aconsejable que los pacientes practiquen en el espejo las primeras veces. Si observan una “especie de niebla” saliendo por la parte superior del inhalador o por los lados de la boca deben comenzar desde el paso 3.
Los pacientes deben enjuagarse la boca con agua y escupirla, y/o cepillarse los dientes después de cada dosis administrada, con el fin de minimizar el riesgo de candidiasis orofaríngea y ronquera.
Limpieza del inhalador: Su inhalador debe limpiarse al menos una vez a la semana.
1. Quitar el protector de la boquilla.
2. No sacar el cartucho de la carcasa de plástico.
3. Limpiar la boquilla por dentro y por fuera así como la carcasa de plástico con un paño seco.
4. Volver a colocar el protector de la boquilla en su posición correcta. No se requiere una fuerza excesiva y se debe oír un “clic” al encajarlo en su posición.
No sumergir en agua el cartucho metálico.
EXPIRACIÓN DEL PRODUCTO:
No utilizar después de la fecha de vencimiento que aparece en el envase.
La fecha de vencimiento es el último día del mes que se indica.