
ADENEX
TERAZOSINA
Comprimidos recubiertos
Comprimidos , 2 Miligramos
Comprimidos , 5 Miligramos
FÓRMULA
Cada COMPRIMIDO de ADENEX® 2 mg contiene:
Terazosina (como terazosina clorhidrato dihidrato 2,38 mg) 2 mg
Excipientes c.s.p.
Cada COMPRIMIDO de ADENEX® 5 mg contiene:
Terazosina (como terazosina clorhidrato dihidrato 5,95 mg) 5 mg
Excipientes c.s.p.
INDICACIONES: Terazosina está indicada para el tratamiento sintomático de la hiperplasia prostética benigna (HBP). Existe una respuesta rápida con aproximadamente el 70% de pacientes que experimentan un aumento del flujo urinario y mejora los síntomas de la HBP cuando son tratados con Terazosina. Los efectos a largo plazo de Terazosina sobre la incidencia de la cirugía, obstrucción urinaria aguda u otras complicaciones de la HPB están aún por determinarse.
Los comprimidos de Terazosina también están indicados para el tratamiento de la hipertensión. Las tabletas de Terazosina pueden ser utilizadas solas o en combinación con otros agentes hipertensivos, como diuréticos o agentes bloqueadores beta adrenérgicos.
ACCIÓN FARMACOLÓGICA
Hiperpiasia prostática benigna: Los síntomas asociados con Hiperplasia prostática benigna (HPB) están relacionados con la obstrucción de la salida vesical, conformado por dos componentes subyacentes: Un componente estático y un componente dinámico. El componente estático es una consecuencia de un aumento del tamaño de la próstata. Con el transcurrir del tiempo la próstata continuará agrandándose. Sin embargo, estudios clínicos han demostrado que el tamaño de la próstata no se correlaciona con la severidad de los síntomas HPB o el grado de obstrucción urinaria. El componente dinámico es una función de un aumento del tono del músculo liso prostético y del cuello vesical, conducentes a constricción de la salida vesical. El tono del músculo liso es mediado por estímulo del nervio simpático de receptores α1 adrenérgicos, que abundan en la próstata, cápsula prostética y cuello vesical. La reducción de los síntomas y mejora de las velocidades de flujo urinario después de la administración de terazosina está relacionada con relajación del músculo liso producida por bloqueo de los receptores adrenérgicos α1 en el cuello vesical y la próstata. Debido a que hay relativamente pocos receptores a] adrenérgicos en el cuerpo vesical, la terazosina es capaz de reducir la obstrucción de la salida vesical sin afectar la contractilidad de la vejiga.
Terazosina se ha estudiado ampliamente en 1222 hombres con HBP sintomática. En tres estudios controlados con placebo, la evaluación de síntomas y mediciones uroflujométricas se realizaron aproximadamente 24 horas después de la dosificación. Los síntomas se cuantificaron sistemáticamente utilizando el índice de Boyarsky. El cuestionario evaluó los síntomas de goteo obstructivo (vacilación, intermitencia, goteo terminal, el deterioro de tamaño y fuerza del chorro, sensación de vaciado incompleto de la vejiga) e irritativos (nocturia, frecuencia diurna, urgencia, disuria) calificando cada uno de los 9 síntomas de 0-3, para una puntuación total de 27 puntos. Los resultados de estos estudios indican que la terazosina mejoró de manera estadísticamente significativa los síntomas y el pico de las tasas de flujo de la orina sobre el placebo de la siguiente manera:
|
Puntaje de síntomas (Rango 0-27) |
Velocidad de flujo pico (mL/sec) |
||||||
|
(%) N |
Basal media |
Cambio medio |
(%) N |
Basal media |
Cambio medio |
(%) |
|
|
Estudio 1 |
(10 mg)a |
||||||
|
– Placebo |
55 |
9,7 |
-2,3 |
(24) 54 |
10,1 |
+1,0 |
(10) |
|
– Terazosina |
54 |
10,1 |
-4,5 |
(45)* 52 |
8,8 |
+3,0 |
(34)* |
|
Estudio 2 |
(2, 5, 10, 20 mg)b |
||||||
|
– Placebo |
89 |
12,5 |
-3,8 |
(30) 88 |
8,8 |
+1,4 |
(16) |
|
– Terazosina |
85 |
12,2 |
-5,3 |
(43)* 84 |
8,4 |
+2,9 |
(35)* |
|
Estudio 3 |
(1, 2, 5, 10 mg)c |
||||||
|
– Placebo |
74 |
10,4 |
-1,1 |
(11) 74 |
8,8 |
+1,2 |
(14) |
|
– Terazosina |
73 |
10,9 |
-4,6 |
(42)* 73 |
8,6 |
+2,6 |
(30)* |
|
a. Dosis más alta de 10 mg mostrada. b. 23% de los pacientes con 10 mg, 41% de los pacientes con 20 mg. c. 67% de los pacientes con 10 mg. * Mejora significativamente mayor (p≤0,05) que el placebo. |
|||||||
En los tres estudios, los puntajes de los síntomas y las tasas de flujo pico de orina mostraron una mejora estadísticamente significativa respecto al valor basal en pacientes tratados con Terazosina desde la semana 2 (o la primera visita clínica) y a lo largo del estudio.
El análisis de los efectos de Terazosina en los síntomas urinarios individuales demostró que, en comparación con el placebo, Terazosina mejoró significativamente los síntomas de vacilación, intermitencia, alteración en el tamaño y la fuerza del chorro de orina, sensación de vaciamiento incompleto, goteo terminal y la frecuencia diurna y nocturna. Las evaluaciones globales de la función urinaria y los síntomas generales se llevaron también a cabo por los investigadores que desconocían la asignación al tratamiento del paciente. En los estudios 1 y 3, los pacientes tratados con terazosina tuvieron una mejoría general significativa mayor (p≤0,001) en comparación con pacientes tratados con placebo.
En un estudio a corto plazo (Estudio 1), los pacientes fueron randomizados a 2, 5 o 10 mg de Terazosina o placebo. Los pacientes asignados al azar al grupo de 10 mg alcanzaron una respuesta estadísticamente significativa tanto en los síntomas como en la tasa de flujo pico en comparación con el placebo (Figura 1).
Figura 1: Estudio 1
|
Cambio medio en puntaje de síntomas totales con respecto a la basal†
|
Incremento medio en tasa de flujo pico (ml/seg) con respecto a la basal†
|
|
† Para valores básales observados en la tabla anterior. * p≤0,05,en comparación con el grupo de placebo. |
|
En una prueba de largo plazo, abierta, no controlada con placebo, 181 hombres fueron seguidos durante 2 años y 58 de estos hombres fueron seguidos durante 30 meses. El efecto de Terazosina en las puntuaciones de los síntomas urinarios y las tasas de flujo pico se mantuvo a lo largo de la duración del estudio (Figuras 2 y 3):
Figura 2: Cambio medio en el puntaje total de síntomas respecto del estudio basal, a largo plazo, de etiqueta abierta, no controlado con placebo (N=494)
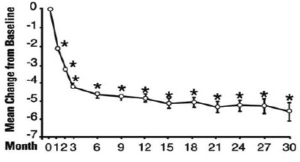
* p≤0,05 frente a la basal
Basal media=10,7
Figura 3: Cambio medio en la tasa de flujo pico con respecto al estudio basal, de largo plazo, de etiqueta abierta, no controlado con placebo (N = 494)
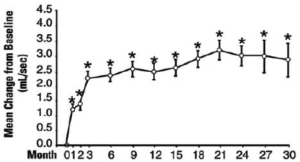
* P ≤0,05 frente a la basal
Basal media= 9,9
En este ensayo de largo plazo, tanto las puntuaciones de los síntomas y las tasas de flujo urinario demostraron una mejoría estadísticamente significativa que sugiere una relajación de las células del músculo liso.
Aunque el bloqueo de los receptores adrenérgicos α1 también disminuye la presión arterial en pacientes hipertensos con aumento de la resistencia vascular periférica, el tratamiento con terazosina de los hombres normotensos con HBP no dio lugar a un efecto reductor en la presión arterial clínicamente significativo:
Cambios medios en la presión arterial desde la basal a la visita final en todos los estudios controlados con placebo, en doble ciego
|
Estudios controlados con placebo |
|||||
|
Pacientes normotensos DBP |
Pacientes hipertensos DBP |
||||
|
Grupo |
N |
Cambio medio |
N |
Cambio medio |
|
|
SBP |
Placebo |
293 |
-0,1 |
45 |
-5,8 |
|
Terazosina |
519 |
-3,3* |
65 |
-14,4* |
|
|
DBP |
Placebo |
293 |
+0,4 |
45 |
-7,1 |
|
Terazosina |
519 |
-2,2* |
65 |
-15,1* |
|
|
* p≤0,05 frente a placebo |
|||||
Hipertensión: En los animales, terazosina produce una disminución en la presión sanguínea disminuyendo la resistencia vascular periférica total. La acción vasodilatadora hipotensora de la terazosina parece producirse principalmente por el bloqueo de receptores adrenérgicos α1. Terazosina disminuye gradualmente la presión arterial dentro de los 15 minutos tras la administración oral.
Los pacientes en ensayos clínicos de terazosina recibieron regímenes una vez al día (la gran mayoría) y dos veces al día con dosis totales por lo general en el rango de 5-20 mg/día, y presentaron hipertensión leve (alrededor del 77%, presión diastólica de 95 a 105 mm Hg) o moderada (23%, presión diastólica 105-115 mmHg). Debido a la terazosina, como todos los antagonistas alfa, puede causar inusualmente grandes caídas en la presión arterial después de la primera o pocas primeras dosis, la dosis inicial fue de 1 mg en prácticamente todos los ensayos, con ajuste posterior a una dosis fija o titulación especificada para algunos puntos finales de presión arterial especificados (por lo general una presión diastólica en decúbito supino de 90 mmHg).
Las respuestas de la presión arterial se midieron al final del intervalo de dosificación (generalmente 24 horas) y los efectos demostraron persistir en todo el intervalo de tiempo, con las respuestas habituales en posición supina, sistólica 5-10 mmHg y diastólica 3,5-8 mmHg mayor que el placebo. Las respuestas de pie tendieron a ser algo más grandes, por 1-3 mmHg, aunque esto no fue cierto en todos los estudios. La magnitud de las respuestas de la presión arterial fue similar a prazosin y menor a hidroclorotiazida (en un solo estudio de los pacientes hipertensos). En las mediciones de 24 horas después de la dosis, la frecuencia cardíaca se mantuvo sin cambios.
Mediciones limitadas de respuesta pico (2-3 horas tras la dosificación) durante la administración de terazosina crónica indican que es mayor que el cerca del doble de la respuesta mínima (24 horas), lo que sugiere cierta atenuación de la respuesta a las 24 horas, presumiblemente debido a una caída en las concentraciones de terazosina en sangre al final del intervalo de dosis. Esta explicación no se ha establecido con certeza, sin embargo, y no es coherente con la similitud de la respuesta de la presión arterial a la dosificación de una vez al día y dos veces al día y con la ausencia de una relación dosis-respuesta observada en un rango de 5-20 mg, es decir, si las concentraciones en la sangre habían caído hasta el punto de proporcionar menos que un efecto pleno a las 24 horas, un intervalo de dosificación más corto o dosis mayores deberían haber conducido a una respuesta incrementada.
Se están llevando a cabo estudios adicionales de respuesta a la dosis y de duración de la dosis. La presión arterial debe medirse al final del intervalo de dosis, si la respuesta no es satisfactoria, los pacientes pueden ser tratados en una dosis más grande o con un régimen de dosificación de dos veces al día. Este último también debe ser considerado si los efectos secundarios posiblemente relacionados con la presión arterial, tales como mareos, palpitaciones, o quejas ortostáticas, se observan dentro de algunas horas después de la administración.
El efecto de la presión arterial mayor asociado con concentraciones plasmáticas pico (primeras horas después de la dosis) parece un tanto más dependiente de la posición (mayor en la posición erecta) que el efecto de terazosina a las 24 horas y en la posición erecta también hay un aumento de 6-10 latidos por minuto en la frecuencia cardíaca en las primeras horas tras la administración. Durante las primeras 3 horas después de la administración el 12,5% de los pacientes tuvo una caída de la presión sistólica de 30 mmHg o más de decúbito supino a posición de pie, o presión sistólica de pie por debajo de 90 mmHg con una caída de al menos 20 mmHg, en comparación con el 4% de un grupo placebo.
Hubo una tendencia a que los pacientes aumenten de peso durante el tratamiento con terazosina. En los ensayos de monoterapia controlados con placebo, los pacientes hombres y mujeres que recibieron terazosina ganaron un promedio de 1,7 y 2,2 libras, respectivamente, en comparación con las pérdidas de 0,2 y 1,2 libras, respectivamente, en el grupo placebo. Ambas diferencias fueron estadísticamente significativas. Durante los ensayos clínicos controlados, los pacientes que recibieron monoterapia con terazosina tuvieron una disminución pequeña pero estadísticamente significativa (una caída del 3%) en comparación con el placebo en colesterol total y fracciones de lipoproteínas de muy baja densidad y de baja densidad combinadas. No se observaron cambios significativos en la fracción de lipoproteínas de alta densidad y triglicéridos en comparación con el placebo.
El análisis de los datos clínicos de laboratorio tras la administración de terazosina sugirió la posibilidad de hemodilución en base a la disminución de hematocrito, hemoglobina, leucocitos, proteínas totales y albúmina. La disminución en hematocrito y proteínas totales se ha observado con el bloqueo alfa y se atribuye a la hemodilución.
ACCIÓN TERAPÉUTICA: Antagonista de los receptores alfa-adrenórgicos.
Código ATC:G04CA03
FARMACOCINÉTICA: En relación a la solución, el clorhidrato de terazosina administrado como Terazosina tabletas es esencialmente absorbido completamente en el hombre. Los alimentos tuvieron poco o ningún efecto sobre el grado de absorción, pero los alimentos retrasaron el tiempo para alcanzar la concentración máxima en aproximadamente 1 hora. Terazosina ha demostrado que sufre metabolismo hepático mínimo de primer paso y casi toda la dosis circulante está en forma de fármaco original. Los niveles plasmáticos alcanzaron el máximo aproximadamente una hora después de la administración, y luego disminuyeron con una vida media de aproximadamente 12 horas. En un estudio que evaluó el efecto de la edad sobre la farmacocinótica de la terazosina, la vida media promedio plasmática fue de 14,0 y 11,4 horas para el grupo de edad ≥70 años y el grupo de edad de 20-39 años, respectivamente. Tras la administración oral la depuración plasmática se redujo en 31,7% en pacientes de 70 años de edad o más en comparación a los pacientes de 20-39 años de edad.
El fármaco está altamente unido a las proteínas plasmáticas y la unión es constante en el rango de concentraciones clínicamente observado. Aproximadamente el 10% de la dosis administrada oralmente se excreta como fármaco original en la orina y aproximadamente el 20% se excreta en las heces. El resto se elimina en forma de metabolitos. El deterioro de la función renal no tuvo efecto significativo sobre la eliminación de terazosina, y ajustar la dosis de terazosina para compensarla eliminación del fármaco durante la hemodiálisis (aproximadamente un 10%) no parece ser necesario. En general, aproximadamente el 40% de la dosis administrada se excreta en la orina y aproximadamente 60% en las heces. La eliminación del compuesto en los animales es cualitativamente similar a la del hombre.
CONTRAINDICACIONES
• Hipersensibilidad a la droga.
• Antecedentes de síncope.
REACCIONES ADVERSAS: La incidencia de eventos adversos emergentes del tratamiento ha sido comprobada en los ensayos clínicos realizados en todo el mundo. Todos los eventos adversos reportados durante estos ensayos se registraron como reacciones adversas. Las tasas de incidencia presentadas a continuación están basadas en datos combinados de seis ensayos controlados con placebo que involucran la administración una vez al día de terazosina a dosis que fluctúa de 1 a 20mg.
La tabla 1 resume aquellos hechos adversos informados por pacientes en ensayos, cuando la proporción de incidencia del grupo terazosina fue por lo menos del 1% y fue mayor que el del grupo placebo, o donde la reacción es de interés clínico. Astenia, hipotensión postural, vértigo, somnolencia, congestión nasal/rinitis e impotencia fueron los únicos hechos significativos (p≤0,05) más comunes en pacientes medicados con terazosina que en pacientes con placebo. La incidencia de infección del tracto urinario fue significativamente más baja en pacientes tratados con terazosina que en pacientes tratados con placebo. Un análisis de la proporción de incidencia de hechos adversos hipotensivos ajustado a la longitud de duración del tratamiento ha demostrado que el riesgo de los hechos es máximo durante los primeros siete días de tratamiento, pero continúa en todos los intervalos temporales.
Tabla 1: Reacciones adversas durante ensayos de hiperplasia prostética benigna controlados con placebo
|
Sistema corporal |
Terazosina |
Placebo |
|
Organismo en su totalidad |
||
|
Astenia+ |
7,4%* |
3,3% |
|
Sindrome gripal |
2,4% |
1,7% |
|
Cefalea |
4,9% |
5,8% |
|
Aparato cardiovascular |
||
|
Hipotensión |
0,6% |
0,6% |
|
Palpitaciones |
0,9% |
1,1% |
|
Hipotensión postural |
3,9%* |
0,8% |
|
Sincope |
0,6% |
0,0% |
|
Aparato digestivo |
||
|
Náuseas |
1,7% |
1,1% |
|
Trastornos metabólicos y nutricionales |
||
|
Edema periférico |
0,9% |
0,3% |
|
Aumento ponderal |
0,5% |
0,0% |
|
Sistema nervioso |
||
|
Mareos |
9,1%* |
4,0% |
|
Somnolencia |
3,6%* |
1,9% |
|
Vértigo |
1,4% |
0,3% |
|
Aparato respiratorio |
||
|
Disnea |
1,7% |
0,8% |
|
Congestión nasal/Rinitis |
1,9%* |
0,0% |
|
Sentidos especiales |
||
|
Visión bonosa/Ambliopía |
1,3% |
0,0% |
|
Sistema urogenital |
||
|
Impotencia |
1,6%* |
0,6% |
|
Infección del tracto urinario |
1,3% |
3,9%* |
|
+ Incluye debilidad, cansancio, lasitud y fatiga. * p<0,05 comparación entre grupos. |
||
Se ha informado sobre hechos adversos adicionales, pero éstos no son, por lo general distinguibles de los síntomas que podrían haber ocurrido tanto en ausencia como con la exposición a terazosina. El perfil de seguridad de los pacientes tratados en un estudio abierto a largo plazo, fue similar al observado en estudios controlados.
Los hechos adversos fueron por lo común transitorios y leves o de intensidad moderada, pero a veces fueron suficientemente serios como para interrumpir el tratamiento. En los ensayos clínicos controlados con placebo, las tasas de terminación prematura debido a eventos adversos no fueron estadísticamente diferentes entre los grupos placebo y terazosina. Los eventos adversos que se consideraron, a juzgar por su reporte, como razones para la interrupción de la terapia en al menos un 0,5% de los pacientes del grupo de terazosina y que se notificaron con más frecuencia que en el grupo placebo, se muestran en la Tabla 2.
Tabla 2: Interrupción del tratamiento durante los ensayos de Hiperplasia Prostática Benigna controlados con placebo
|
Sistema corporal |
Terazosina |
Placebo |
|
Organismo en su totalidad |
||
|
Fiebre |
0,5% |
0,0% |
|
Cefalea |
1,1% |
0,8% |
|
Aparato cardiovascular |
||
|
Hipotensión postural |
0,5% |
0,0% |
|
Sincope |
0,5% |
0,0% |
|
Aparato digestivo |
||
|
Náuseas |
0,5% |
0,3% |
|
Sistema nervioso |
||
|
Mareos |
2,0% |
1,1% |
|
Vértigo |
0,5% |
0,0% |
|
Aparato respiratorio |
||
|
Disnea |
0,5% |
0,3% |
|
Sentidos especiales |
||
|
Visión borrosa/Ambliopía |
0,6% |
0,0% |
|
Sistema urogenital |
||
|
Infección del tracto urinario |
0,6% |
0,3% |
Hipertensión: La prevalencia de las reacciones adversas ha sido comprobada en los ensayos clínicos llevados a cabo principalmente en los Estados Unidos. Todas las experiencias adversas (eventos) informadas en estos ensayos se registraron como reacciones adversas. Las tasas de prevalencia que se presentan a continuación están basadas en datos combinados de catorce ensayos controlados con placebo, que incluyen la administración una vez al día de terazosina, como monoterapia o en combinación con otros agentes antihipertensivos, en dosis que van de 1 a 40 mg. La Tabla 3 resume aquellas experiencias adversas comunicadas por los pacientes en estos ensayos en los que la tasa de prevalencia en el grupo de terazosina fue al menos 5%, la tasa de prevalencia para el grupo de terazosina fue al menos 2% y fue mayor que la tasa de prevalencia para el grupo placebo, o donde la reacción es de particular interés. Astenia, visión borrosa, mareos, congestión nasal, náuseas, edema periférico, palpitaciones y somnolencia fueron los únicos síntomas que fueron significativamente (p<0,05) más comunes en los pacientes que recibieron terazosina que en los pacientes que recibieron placebo. Similares tasas de reacciones adversas se observaron en las pruebas de monoterapia controladas con placebo.
Tabla 3: Reacciones adversas durante los ensayos de hipertensión controlados con placebo
|
Sistema corporal |
Terazosina |
Placebo |
|
Cuerpo como un todo |
||
|
Astenia† |
11,3%* |
4,3% |
|
Dolor de espalda |
2,4% |
1,2% |
|
Cefalea |
16,2% |
15,8% |
|
Sistema cardiovascular |
||
|
Palpitaciones |
4,3%* |
1,2% |
|
Hipotensión postural |
1,3% |
0,4% |
|
Taquicardia |
1,9% |
1,2% |
|
Sistema digestivo |
||
|
Náusea |
4,4%* |
1,4% |
|
Trastornos metabólicos y de la nutrición |
||
|
Edema |
0,9% |
0,6% |
|
Edema periférico |
5,5%* |
2,4% |
|
Ganancia de peso |
0,5% |
0,2% |
|
Sistema musculoesquelético |
||
|
Dolor en las extremidades |
3,5% |
3,0% |
|
Sistema nervioso |
||
|
Depresión |
0,3% |
0,2% |
|
Mareos |
19,3%* |
7,5% |
|
Disminución de la libido |
0,6% |
0,2% |
|
Nerviosismo |
2,3% |
1,8% |
|
Parestesia |
2,9% |
1,4% |
|
Somnolencia |
5,4%* |
2,6% |
|
Sistema respiratorio |
||
|
Disnea |
3,1% |
2,4% |
|
Congestión nasal |
5,9%* |
3,4% |
|
Sinusitis |
2,6% |
1,4% |
|
Sentidos especiales |
||
|
Visión borrosa |
1,6%* |
0,0% |
|
Sistema urogenital |
||
|
Impotencia |
1,2% |
1,4% |
|
† Incluye debilidad, cansancio, lasitud y fatiga. * Estadísticamente significativo al nivel p=0,05. |
||
Se han reportado tras reacciones adversas, pero estas, en general, no se distinguen de los síntomas que podrían haber ocurrido en ausencia de exposición a la terazosina. Las siguientes reacciones adversas adicionales fueron reportadas por lo menos 1% de 1987 pacientes que recibieron terazosina en ensayos clínicos controlados o abiertos de corto o largo plazo o han sido notificadas durante la experiencia de comercialización:
• Cuerpo como un todo: Dolor en el pecho, edema facial, fiebre, dolor abdominal, dolor de cuello, dolor en el hombro.
• Sistema cardiovascular: Arritmia, vasodilatación.
• Sistema digestivo: Estreñimiento, diarrea, sequedad de boca, dispepsia, flatulencia, vómitos.
• Trastornos metabólicos/nutricionales: Gota.
• Sistema musculoesquelético: Artralgias, artritis, alteraciones de las articulaciones, mialgia.
• Sistema nervioso: Ansiedad, insomnio.
• Sistema respiratorio: Bronquitis, síntomas de resfrío, epistaxis, síntomas de la gripe, aumento de la tos, faringitis, rinitis.
• Piel y anexos: Prurito, rash, sudoración.
• Sentidos especiales: Visión anormal, conjuntivitis, tinnitus.
• Sistema urogenital: Frecuencia urinaria, incontinencia urinaria principalmente informada en mujeres posmenopáusicas, infección del tracto urinario.
Las reacciones adversas fueron generalmente leves o moderadas pero a veces fueron lo suficientemente graves como para interrumpir el tratamiento. Las reacciones adversas que fueron más molestas, a juzgar por su informe como razones para la interrupción de la terapia en al menos 0,5% del grupo de terazosina y por ser informadas con mayor frecuencia que en el grupo placebo, se muestran en la Tabla 4.
Tabla 4: Descontinuaciones durante las pruebas de hipertensión controladas con placebo
|
Sistema corporal |
Terazosina |
Placebo |
|
Cuerpo como un todo |
||
|
Astenia |
1,6% |
0,0% |
|
Cefalea |
1,3% |
1,0% |
|
Sistema cardiovascular |
||
|
Palpitaciones |
1,4% |
0,2% |
|
Hipotensión postural |
0,5% |
0,0% |
|
Sincope |
0,5% |
0,2% |
|
Taquicardia |
0,6% |
0,0% |
|
Sistema digestivo |
||
|
Náusea |
0,8% |
0,0% |
|
Trastornos metabólicos y de la nutrición |
||
|
Edema periférico |
0,6% |
0,0% |
|
Sistema nervioso |
||
|
Mareos |
3,1% |
0,4% |
|
Parestesia |
0,8% |
0,2% |
|
Somnolencia |
0,6% |
0,2% |
|
Sistema respiratorio |
||
|
Disnea |
0,9% |
0,6% |
|
Congestión nasal |
0,6% |
0,0% |
|
Sentidos especiales |
||
|
Visión borrosa |
0,6% |
0,0% |
Experiencia post-comercialización: La experiencia post-comercialización indica que en raras ocasiones los pacientes pueden desarrollar reacciones alérgicas, incluyendo anafilaxis, después de la administración de clorhidrato de terazosina. Se han notificado casos de priapismo y trombocitopenia durante la vigilancia post-comercialización. También se ha informado fibrilación auricular Durante la cirugía de catarata, una variante del síndrome de pupila pequeña conocida como Síndrome del iris flácido intraoperatorio (IFIS), ha sido reportado en asociación con bloqueantes α1.
INTERACCIONES: La administración concomitante de terazosina con inhibidores de la 5-fosfodiesterasa (PDE-5) puede resultar en la potenciación de los efectos sobre la presión arterial y en los síntomas de hipotensión.
En estudios clínicos controlados, terazosina se administró en forma concomitante con diuréticos, y varios bloqueantes beta-adrenérgicos, no observándose interacciones inesperadas.
Terazosina también se han utilizado en pacientes con una variedad de terapias concomitantes, y aunque no se trataba de estudios formales de interacción, las mismas no se observaron.
Terazosina se ha utilizado de forma concomitante, en al menos 50 pacientes, con los siguientes medicamentos o clases de drogas: 1) analgésicos o antiinflamatorios (paracetamol, ácido acetilsalicílico, codeína, ibuprofeno, indometacina); 2) antibióticos (eritromicina, trimetoprima/sulfametoxazol); 3) anticolinégicos y simpáticomiméticos (fenilefrina, fenilpropanolamina, pseudoefedrina); 4) antigotosos (allopurinol); 5) antihistamínicos (clorfeniramina); 6) agentes cardiovasculares (atenolol, hidroclorotiazida, meticlotiazida, propranolol); 7) corticosteroides; 8) agentes gastrointestinales (antiácidos; 9) hipoglucemiantes; 10) sedantes y tranquilizantes (diazepam).
En un estudio (n=24) donde terazosina y verapamilo se administran de forma concomitante, el AUC0-24 de terazosina aumentó un 11% después de la dosis de verapamilo primero y después de 3 semanas de tratamiento con verapamilo se incrementó en un 24% con un aumento medio asociado de la Cmax (25%) y Cmin (32%). La Tmax media de terazosina se redujo de 1,3 horas a 0,8 horas después de 3 semanas de tratamiento con verapamilo. Diferencias estadísticamente significativas no fueron encontradas a nivel de verapamilo con y sin terazosina.
En un estudio (n=6) donde terazosina y captopril fueron administradas concomitantemente, la disposición plasmática de captopril no se vio influenciada por la administración concomitante de terazosina y la terazosina plasmática máxima aumentó linealmente con la dosis en el estado estacionario tras la administración de terazosina más captopril.
ADVERTENCIAS
Síncope y efecto de “primera dosis”: Terazosina comprimidos recubiertos, al igual que otros agentes bloqueadores alfa-adrenérgicos puede producir una marcada reducción de la presión sanguínea, en especial hipotensión postural, y síncope en asociación con la primera dosis o los primeros pocos días de terapia. Un efecto similar puede ser esperado si la terapia es interrumpida durante varios días y después reiniciada. También se ha informado síncope con otros agentes bloqueantes alfa-adrenérgicos en asociación con aumentos rápidos de dosis o la introducción de otra droga antihipertensiva. Se cree que el síncope es debido a un excesivo efecto hipotensivo postural, si bien en ocasiones el episodio sincopal ha estado precedido por un episodio de severa taquicardia supraventricular con frecuencias cardíacas de 120-160 latidos por minuto. Además se debe considerar la posibilidad de la contribución de la hemodilución a los síntomas de hipotensión postural.
A fin de reducir la probabilidad de síncope o excesiva hipotensión, el tratamiento debe ser iniciado siempre con una dosis de 1 mg de terazosina, y debe administrarse al acostarse. Los comprimidos de 2 mg y 5 mg no deben ser indicados como terapia inicial. Después la dosis debe ser aumentada lentamente. El paciente debe ser advertido de evitar situaciones tales como conducir o tareas peligrosas, ya que podría resultar en lesión si ocurriera síncope al inicio del tratamiento.
En los estudios de investigación temprana, en los cuales se administraron dosis únicas en aumento hasta 7,5 mg a intervalos de 3 días, la tolerancia al fenómeno de la primera dosis no necesariamente se desarrolló y el efecto de "la primera dosis" se observó en todas las dosis. Se produjeron episodios sincópales en 3 de los 14 sujetos que recibieron tabletas de Terazosina en dosis de 2,5, 5 y 7,5 mg, que son superiores a la dosis inicial recomendada, además, se observó hipotensión ortostática grave (presión arterial que cayó hasta 50/0 mm Hg) en otros dos y se produjeron mareo, taquicardia y sensación de desorientación en la mayoría de los sujetos. Estos efectos adversos ocurrieron dentro de 90 minutos de la dosificación.
En tres estudios de HBP controlados con placebo 1, 2 y 3, la incidencia de hipotensión postural en los pacientes tratados con terazosina fue de 5,1%, 5,2% y 3,7% respectivamente.
En los ensayos clínicos de dosis múltiples en los cuales participaron casi 2000 pacientes hipertensos tratados con tabletas de terazosina, el síncope fue reportado en alrededor del 1% de los pacientes. El síncope no se asocia necesariamente sólo con la primera dosis.
Si ocurriera un episodio de síncope, el paciente debe ser colocado en posición recostada y tratado con apoyo, como sea necesario. Existe evidencia que el efecto ortostático de terazosina es mayor, aún con uso crónico, al poco tiempo luego de la dosis. El riesgo de aparición de estos eventos es máximo durante los 7 días iniciales de tratamiento, pero continúa en todos los intervalos temporales.
Priapismo: Rara vez (probablemente menos de una vez en varios miles de pacientes), la terazosina y otros antagonistas α1, han sido asociados con priapismo (erección doloroso del pene, sostenida durante horas y que no se alivia con el coito o la masturbación). Dos o tres docenas de casos han sido reportados. Debido a que esta condición puede llevar a impotencia permanente si no es rápidamente tratada, los pacientes deben ser informados sobre la seriedad de la condición.
PRECAUCIONES
Cáncer de próstata: El carcinoma de próstata y la HPB generan síntomas similares. Estas dos enfermedades frecuentemente coexisten. Por ello los pacientes que se cree tienen HPB deben ser examinados previo al inicio de la terapia con terazosina para descartar la presencia de carcinoma de próstata.
Síndrome de Iris Flácido Intraoperatorio (IFIS): El "Síndrome de Iris Flácido Intraoperatorio" (IFIS) se ha observado durante la cirugía de cataratas en algunos pacientes en tratamiento o previamente tratados con bloqueantes α1. Esta variante del síndrome de pupila pequeña se caracteriza por la combinación de iris flácido que aparece en respuesta a la irrigación intraoperatoria, miosis intraoperatoria progresiva a pesar de la dilatación preoperatoria con fármacos midriáticos estándar, y el potencial prolapso del iris hacia las incisiones de facoemunificación. El médico oftalmólogo debe estar preparado para posibles modificaciones a su técnica quirúrgica, como la utilización de los ganchos de iris, anillos dilatadores del iris, o sustancias viscoelásticas. Aparentemente no sería un beneficio detener el tratamiento con bloqueantes α1 previamente a la cirugía de cataratas.
Hipotensión ortostática: Si bien el síncope es el efecto ortostático más severo de la terazosina, otros síntomas de presión sanguínea baja tal como mareos, vértigo y palpitaciones fueron más comunes y se presentaron en alrededor del 28% de los pacientes que participaron en estudios clínicos de hipertensión. En estudios clínicos de HPB el 21% de los pacientes experimentaron uno o más de los siguientes efectos: Mareos, vértigo, hipotensión, hipotensión postural, síncope. Los pacientes con ocupaciones en los que estos hechos representan problemas potenciales, deben ser tratados con particular cautela.
Alteraciones en valores de laboratorio: En estudios clínicos controlados se han observado descensos pequeños pero estadísticamente significativos en los valores de hematocrito, hemoglobina, glóbulos blancos, proteínas totales y albúmina. Estos hallazgos de laboratorio sugieren la posibilidad de hemodilución. El tratamiento con terazosina durante más de 24 horas no ha tenido un efecto significativo sobre los niveles del Antígeno Prostático Específico (SPA)
CARCINOGÉNESIS, MUTAGÉNESIS Y ALTERACIONES DE LA FERTILIDAD: Terazosina demostró carecer de potencial mutagénico cuando se evaluó in vivo e in vitro (prueba de Ames y citogenética in vivo, la prueba letal dominante en ratones, en el ensayo in vivo de aberración cromosómica de hámster chino y el ensayo de mutación V79).
Terazosina administrada en el alimento de ratas en dosis de 8, 40 y 250 mg/kg/día (70, 350, y 2100 mg/m2/día), durante dos años, se asoció con un aumento estadísticamente significativo de tumores suprarrenales medulares benignos de ratas macho expuestas a las dosis de 250 mg/kg. Esta dosis es equivalente a 175 veces la dosis humana máxima recomendada de 20 mg (12 mg/m2). Las ratas hembras no se vieron afectadas. Terazosina no fue oncogénica en ratones cuando se administro con los alimentos durante 2 años a una dosis máxima tolerada de 32 mg/kg/día (110 mg/m2, 9 veces la dosis máxima recomendada en humanos). La ausencia de mutagenicidad las baterías de pruebas, la inexistencia de tumorigenicidad con cualquier tipo de célula en el ensayo de carcinogenicidad en ratones, el no aumento de la incidencia total de tumores en cada especie, y la no aparición de lesiones proliterativas suprarrenales en ratas hembra, sugiere un evento específico de ratas macho.
Muchos otros compuestos de diversos productos farmacéuticos y químicos también se han asociado con tumores benignos de la médula suprarrenal en ratas macho sin pruebas en su apoyo en cuanto a carcinogenicidad en el hombre.
El efecto de terazosina sobre la fertilidad se evaluó en un estudio estándar fertilidad o de desempeño reproductivo en el que se administraron dosis orales de 8, 30 y 120 mg/kg/día a ratas macho y hembra. Cuatro de 20 ratas macho recibieron 30 mg/kg (240 mg/m2, 20 veces la dosis máxima recomendada en humanos), y cinco de 19 ratas macho la dosis de 120 mg/kg (960 mg/m2, 80 veces la dosis máxima recomendada en humanos), El peso y la morfología testicular no se vieron afectados por el tratamiento. El frotis vaginal con dosis de 30 y 120 mg/kg/día, parece contener menos espermatozoides que los frotis de apareamientos de control y una buena correlación se informó entre el conteo de espermatozoides y embarazo posterior. La administración oral de Terazosina durante uno o dos años provocó un aumento estadísticamente significativo en la incidencia de atrofia testicular en ratas expuestas a 40 y 250 mg/kg/día (29 y 175 veces la dosis máxima recomendada en humanos), pero no en ratas expuestas a 8 mg/kg/día (más de 6 veces la dosis máxima recomendada en humanos). También se observó atrofia testicular en perros tratados con 300 mg/kg/día (>500 veces la dosis máxima recomendada en humanos) durante tres meses, pero no después de un año cuando se administraron dosis de 20 mg/kg/día (38 veces la dosis máxima recomendada en humanos). Esta lesión también se ha visto con otro bloqueante a] selectivo.
Embarazo y lactancia:
• Embarazo: Categoría C.
Terazosina no fue teratogénico en ratas o conejos cuando recibieron dosis orales de hasta 280 y 60 veces, respectivamente, la dosis humana recomendada. Se produjeron resorciones fetales en ratas que recibieron 480 mg/kg/día, aproximadamente 280 veces la dosis humana recomendada máxima. Se observó aumento de las resorciones fetales, disminución del peso fetal y aumento del número de costillas supernumerarias en la descendencia de los conejos que recibieron 60 veces la dosis humana máxima recomendada. Estos hallazgos (en ambas especies) fueron más probablemente causados por toxicidad materna. No existen estudios adecuados y bien controlados en mujeres embarazadas y la seguridad de terazosina durante el embarazo no ha sido establecida. Terazosina no se recomienda durante el embarazo a menos que el beneficio potencial justifique el riesgo potencial a la madre y el feto.
• Efectos no teratogónicos: En un estudio peri y posnatal en ratas, una cantidad significativamente mayor de crías murieron en el grupo que recibió 120 mg/kg/día (>75 veces la dosis humana máxima recomendada) que en el grupo de control durante el período posparto de tres semanas.
Madres lactantes: No se sabe si terazosina se excreta en la leche materna. Debido a que muchos fármacos se excretan en la leche materna, se debe tener precaución cuando las tabletas de terazosina se administran a una mujer que da lactar.
Pacientes pediátricos: La seguridad y eficacia en niños no ha sido determinada.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: La dosis de terazosina debe ajustarse según la respuesta individual de cada paciente.
Si se interrumpe la administración de terazosina durante varios días, el tratamiento debe reanudarse con el régimen de dosis inicial.
Hiperplasia benigna de próstata:
• Dosis inicial: Para todos los pacientes es de 1 mg a la hora de acostarse. Debe cumplirse estrictamente este régimen de tratamiento inicial para evitar la posibilidad de una hipotensión aguda.
• Dosis siguientes: Según la respuesta de cada paciente y después de 3 o 4 días, la dosis puede aumentarse a 2 mg hasta terminar el envase. Posteriormente, la dosis puede aumentarse paulatinamente hasta alcanzar la respuesta clínica deseada.
Uso con otras drogas: Se debe tener precaución cuando terazosina es administrada de forma concomitante con otros agentes antihipertensivos, especialmente con bloqueantes de los canales de caldo como verapamilo, para evitar la posibilidad de aparición de hipotensión significativa. Cuando se utiliza terazosina y otros agentes antihipertensivos concomitantemente, pueden ser necesarias la reducción de la dosis y retitulación de cualquier agente. La administración concomitante de terazosina con un inhibidor de la PDE-5 puede resultar en una suma de efectos sobre la presión arterial y sobre los síntomas de hipotensión, por lo que la terapia con el inhibidor de la PDE-5 debe iniciarse con la dosis más baja en pacientes que toman terazosina.
Hipertensión: La dosis y el intervalo de dosis de terazosina (12 o 24 horas) deben ser ajustados de acuerdo a la respuesta de la presión arterial del paciente. La siguiente es una guía para su administración:
• Dosis inicial: 1 mg al acostarse es la dosis inicial para todos los pacientes, y esta dosis no debe superarse. Este régimen de dosificación debe observarse estrictamente con el fin de minimizar el potencial de efectos hipotensores severos.
• Dosis siguientes: La dosis puede incrementarse lentamente para alcanzar la respuesta de presión arterial deseada. El rango de dosis recomendada usual es 1 mg a 5 mg administrados una vez al día, sin embargo, algunos pacientes pueden beneficiare de dosis tan altas como 20 mg al día. Las dosis mayores de 20 mg no parecen proporcionar un efecto adicional en la presión arterial y dosis mayores de 40 mg no han sido estudiadas. La presión arterial debe monitorearse ol final del intervalo de dosificación para asegurar que se mantenga el control durante todo el intervalo. También puede ser útil medir la presión arterial 2-3 horas después de la administración para ver si las respuestas máximas y mínimas son similares y para evaluar los síntomas como mareos o palpitaciones que pueden resultar de la respuesta hipotensora excesiva. Si la respuesta disminuye sustancialmente a las 24 horas, se puede considerar un incremento de la dosis o el uso de un régimen dos veces al día. Si se descontinúa la administración de terazosina por varios días o más tiempo, la terapia debe reiniciarse utilizando el régimen de administración inicial. En pruebas clínicas, excepto para la dosis inicial, la dosis se administró en las mañanas.
Uso con otras drogas: Ver información anterior.
Uso pediátrico: La seguridad y efectividad de este medicamento en niños no han sido determinadas.
SOBREDOSIFICACIÓN: Si la sobredosis de terazosina produce hipotensión, el apoyo del sistema cardiovascular es prioritario. La restauración de la presión sanguínea y la normalización de la velocidad cardiaca pueden ser logradas manteniendo al paciente en posición supina. Si esta medida fuese inadecuada, el shock debiera ser tratado primero con expansores de volumen. Si fuera necesario, entonces deben usarse vasopresores y controlar la función renal y apoyarla como fuera necesario. Los datos de laboratorio indican que terazosina está combinada con proteínas; por ello la diálisis puede no ser de utilidad.
Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano.
CONSERVACIÓN: Almacenara temperatura no mayor de 30 °C.
Este medicamento solo debe utilizarse bajo estricto control y vigilancia médica y no puede repetirse sin nueva receta.
Mantener fuera del alcance de los niños.
Para mayor información científica sobre el producto, comunicarse con Tecnofarma S.A.,
al telefax 700-3000 o
vía e-mail: info@tecnofarma.com.pe
TECNOFARMA S.A
TIEMPO DE VIDA ÚTIL: 3 años.