
ZELBORAF
VEMURAFENIB
Comprimidos recubiertos
Comprimidos recubiertos , 240 Miligramos
Composición cualitativa y cuantitativa
Principio activo: vemurafenib.
Cada comprimido recubierto contiene 240 mg de vemurafenib (como coprecipitado de vemurafenib y succinato acetato de hipromelosa).
Excipientes: sílice coloidal anhidra (dióxido de silicio coloidal), croscarmelosa sódica, hidroxipropilcelulosa y estearato de magnesio.
Masa del núcleo: alcohol polivinílico, dióxido de titanio, macrogol 3350 (polietilenglicol 3350), talco y óxido de hierro rojo.
Forma farmacéutica: Comprimido recubierto
Indicaciones terapéuticas: Zelboraf® está indicado para el tratamiento del melanoma metastásico o irresecable con la mutación V600 del gen BRAF (BRAF V600).
Zelboraf® está indicado para el tratamiento de pacientes con enfermedad de Erdheim-Chester (EEC) que presentan la mutación V600 de BRAF.
DATOS FARMACÉUTICOS
Conservación: conforme al registro local.
Instrucciones especiales de uso, manipulación y eliminación: este medicamento no debe usarse después de la fecha de caducidad, indicada con «EXP» en el envase.
Eliminación de los medicamentos no utilizados o caducados: la emisión de productos farmacéuticos al medio ambiente debe reducirse al mínimo. Evítese tirar los medicamentos por los desagües o a la basura doméstica, y utilícense los sistemas de recogida disponibles localmente.
Propiedades farmacocinéticas
Los parámetros farmacocinéticos del vemurafenib se determinaron mediante un análisis no compartimental en un estudio de fase I y otro de fase III. Las medias de la Cmáx, la Cmín y el ABC0-12 h fueron aproximadamente de 62 µg/ml, 53 µg/ml y 600 µg·h/ml, respectivamente. En un análisis de farmacocinética poblacional de los datos conjuntos de 458 pacientes, la estimación de la mediana de la Cmáx, la Cmín y el ABC en estado de equilibrio fue de 62 µg/ml, 59 µg/ml y 734 µg·h/ml, respectivamente. La estimación de la mediana del cociente de acumulación con una pauta de 2 tomas diarias es de 7,36. Se ha demostrado que la farmacocinética del vemurafenib es proporcional a la dosis con dosis de 240-960 mg 2 v/d; y el análisis de farmacocinética poblacional también confirmó que la farmacocinética del vemurafenib es lineal.
Absorción: tras administrar una dosis única de 960 mg (4 comprimidos de 240 mg), la mediana del Tmáx del vemurafenib es de aproximadamente 4 horas. Cuando el vemurafenib se administra en dosis múltiples de 960 mg 2 v/d, se observa una notable acumulación, con gran variabilidad de unos pacientes a otros. En el estudio de fase II, la media de la concentración plasmática del vemurafenib 4 horas después de la administración aumentó de 3,6 µg/ml el día 1 a 49,0 µg/ml el día 15 (intervalo: 5,4-118 µg/ml).
Los alimentos (comidas con gran contenido de grasa) aumentan la biodisponibilidad relativa de una dosis única de 960 mg de vemurafenib. Los cocientes de las medias geométricas entre el estado posprandial y en ayunas correspondientes a la Cmáx y el ABC fueron de 2,5 y 4,6-5,1, respectivamente. La mediana del Tmáx pasó de 4 a 7,5 horas cuando se tomó con alimentos una dosis única de vemurafenib. Los datos relativos a la seguridad y la eficacia de los estudios fundamentales procedían de pacientes que tomaron el vemurafenib con y sin alimentos.
En el estado de equilibrio (alcanzado el día 15 en el 80 % de los pacientes), la media de la exposición plasmática al vemurafenib se mantiene estable (concentración antes de la dosis matinal y 2-4 horas después de la misma), tal como indica el índice medio de 1,13. Se observó una variabilidad entre pacientes igualmente notable en la exposición plasmática en el estado de equilibrio independientemente de la reducción de la dosis.
Se calcula que, tras la administración oral, la constante de la velocidad de absorción en los pacientes con melanoma metastásico es de 0,19 h-1 (con una variabilidad interindividual del 101 %).
Distribución: se calcula que el volumen de distribución aparente poblacional del vemurafenib en pacientes con melanoma metastásico es de 91 l (con una variabilidad interindividual del 64,8 %). In vitro, la unión a las proteínas del vemurafenib es elevada (>99 %).
Metabolismo: las proporciones relativas de vemurafenib y sus metabolitos se caracterizaron en un estudio de ba-lance de masas en el ser humano, en estado de equilibrio, con una dosis única de vemurafenib marcado con C14 administrado por vía oral. Por término medio, el 95 % de la dosis se recuperó en un plazo de 18 días: la mayor parte (94 %) en las heces, y <1 % en la orina. La principal enzima responsable del metabolismo del vemurafenib in vitro es el CYP3A4, pero también se han identificado metabolitos resultantes de la conjugación (glucuronización y glicosilación) en el ser humano. No obstante, el principal componente en el plasma era el fármaco original (95 %). Aunque el metabolismo no parece dar lugar a una cantidad importante de metabolitos en el plasma, no cabe excluir la importancia del metabolismo en la excreción. La coadministración de rifampicina, un inductor potente del CYP3A4, redujo significativamente la exposición plasmática al vemurafenib (ABC), aproximadamente un 40 %, tras administrar una dosis única de 960 mg de vemurafenib, lo que indica que la vía del CYP3A4 puede ser una importante vía de eliminación del vemurafenib.
Eliminación: se calcula que el aclaramiento aparente poblacional del vemurafenib en pacientes con melanoma metastásico es de 29,3 l/d (con una variabilidad interindividual del 31,9 %). La estimación de la mediana de la semivida de eliminación individual del vemurafenib es de 56,9 horas (intervalo de los percentiles 5 y 95: 29,8-119,5 horas).
Farmacocinética en poblaciones especiales
Población geriátrica: de acuerdo con el análisis de farmacocinética poblacional, la edad no tiene ningún efecto estadísticamente significativo en la farmacocinética del vemurafenib.
Sexo: el análisis de farmacocinética poblacional puso de manifiesto que el sexo tiene una importancia estadísticamente significativa en la variabilidad interindividual; en los varones, el aclaramiento aparente (CL/F) fue un 17 % mayor y el volumen de distribución (V/F) fue un 48 % mayor que en las mujeres. Sin embargo, los resultados del análisis poblacional han mostrado que las diferencias en la exposición son relativamente pequeñas (estimación de la mediana en estado de equilibrio del ABC12 h y de la Cmáx de 792 µg·h/ml y 67 µg/ml en las mujeres y de 696 µg·h/ml y 63 µg/ml en los hombres, respectivamente), lo cual indica que no es preciso ajustar la dosis en función del sexo.
Población pediátrica: los limitados datos farmacocinéticos obtenidos de 6 pacientes adolescentes de 15-17 años con melanoma en estadio IIIC o IV con la mutación V600 de BRAF indican que las características farmacocinéticas del vemurafenib en los adolescentes son, en general, similares a las de los adultos. Sin embargo, no se puede llegar a ninguna conclusión, dado que el volumen de datos es limitado (ver Pautas posológicas especiales).
Insuficiencia renal: según el análisis de farmacocinética poblacional en el que se usaron datos de ensayos clínicos en pacientes con melanoma metastásico, la insuficiencia renal leve y moderada (aclaramiento de creatinina: >30 ml/min) no influía en el aclaramiento aparente del vemurafenib. No hay datos clínicos y farmacocinéticos suficientes para determinar la posible necesidad de ajustar la dosis en pacientes con insuficiencia renal grave (aclaramiento de creatinina: <29 ml/min) (ver Pautas posológicas especiales y 2.5.7 Insuficiencia renal).
Insuficiencia hepática: de acuerdo con los datos preclínicos y los de un estudio de balance de masas en el ser humano, la mayor parte del vemurafenib se elimina por vía hepática. Según el análisis de farmacocinética poblacional en el que se usaron datos de ensayos clínicos en pacientes con melanoma metastásico, los aumentos de la concentración de AST, ALT y bilirrubina total hasta 3 veces por encima del límite superior de la normalidad no influyeron en el aclaramiento aparente del vemurafenib. No se puede determinar la posible necesidad de ajustar la dosis en pacientes con insuficiencia hepática grave, ya que no hay datos clínicos y farmacocinéticos suficientes para determinar el efecto de un deterioro hepático metabólico o excretor en la farmacocinética del vemurafenib (ver Pautas posológicas especiales e Insuficiencia hepática).
Datos no clínicos sobre seguridad
Carcinogenicidad: no se han realizado estudios de carcinogenicidad.
Genotoxicidad: todos los estudios habituales de genotoxicidad con el vemurafenib fueron negativos.
Trastornos de la fecundidad: no se han realizado estudios de fecundidad preclínicos. No se han observado efectos en los órganos sexuales en los estudios toxicológicos con dosis repetidas.
Toxicidad para la función reproductora: no se evidenció en embriones o fetos de rata ningún signo de teratogenicidad del vemurafenib en dosis ≤250 mg/kg/d (aproximadamente 1,7 veces superiores a la exposición clínica humana según el ABC), ni tampoco en embriones o fetos de conejo en dosis ≤450 mg/kg/d (aproximadamente 0,7 veces superiores a la exposición clínica humana según el ABC).
Las concentraciones fetales fueron un 3-5 % de las concentraciones maternas, lo que indica el posible paso del vemurafenib de la madre al feto en desarrollo.
No se han realizado estudios específicos del vemurafenib en animales para evaluar su efecto en la fecundidad. Ahora bien, en los estudios toxicológicos con dosis repetidas no se detectaron alteraciones histopatológicas en los órganos sexuales de machos y hembras con dosis ≤450 mg/kg/d en la rata (unas 0,6 y 1,6 veces, respectivamente, la exposición humana según el ABC) y el perro (aproximadamente 0,4 veces la exposición humana según el ABC tanto en los machos como en las hembras).
Otros efectos: en estudios toxicológicos con dosis repetidas, se identificó al hígado y la médula ósea como órganos diana en el perro. En un estudio de 13 semanas realizado en el perro, con una pauta de administración 2 veces al día, se observaron efectos tóxicos reversibles en el hígado (necrosis y degeneración hepatocelular) con exposiciones inferiores a la exposición clínica (según las comparaciones del ABC). En un estudio de 39 semanas en perros que concluyó prematuramente, se detectó necrosis focal de la médula ósea en un perro con la pauta de administración 2 v/d y una exposición dentro del intervalo de exposición clínica.
Se evidenció in vitro que el vemurafenib era fototóxico en fibroblastos murinos cultivados tras la irradiación UVA, pero no lo fue in vivo en un estudio en la rata.
In vitro se observó que el vemurafenib inhibía al CYP2C9 (CI50 de 5,9 µM).
Propiedades farmacodinámicas
Mecanismo de acción: el vemurafenib es un inhibidor de la serina-treonina cinasa BRAF. Las mutaciones en el gen BRAF dan lugar a una activación constitutiva de las proteínas BRAF, que puede provocar la proliferación celular sin factores de crecimiento asociados.
Los datos preclínicos generados mediante ensayos bioquímicos han demostrado que el vemurafenib puede inhibir las cinasas BRAF con activación de mutaciones en el codón 600 (véase la siguiente tabla).
|
Tabla 8 . Actividad inhibidora de cinasas del vemurafenib frente a diferentes cinasas BRAF |
||
|
Cinasa |
Frecuencia prevista en el melanoma con mutación V600a |
Concentración inhibidora 50 (nM) |
|
BRAFV600E |
87,3 % |
10 |
|
BRAFV600K |
7,9 % |
7 |
|
BRAFV600R |
1 % |
9 |
|
BRAFV600D |
<0,2 % |
7 |
|
BRAFV600G |
<0,1 % |
8 |
|
BRAFV600M |
0,1 % |
7 |
|
BRAFV600A |
<0,1 % |
14 |
|
BRAFWT |
No procede |
39 |
|
a Estimación realizada a partir de 16 403 melanomas con mutaciones confirmadas en el codón 600 de BRAF, en la base de datos pública COSMIC, versión 71 (noviembre de 2014). |
||
Este efecto inhibidor se confirmó en los ensayos de fosforilación de ERK y de antiproliferación celular en líneas de células de melanoma disponibles con expresión de BRAF con la mutación V600. En los ensayos de antiproliferación celular, la concentración inhibidora 50 (CI50) frente a líneas celulares con la mutación V600 (V600E, V600R, V600D y V600K) fue de 0,016-1,131 μM, mientras que la CI50 frente a líneas celulares del tipo BRAF natural fue de 12,06-14,32 μM.
Ensayos clínicos / Eficacia: la eficacia del vemurafenib se ha evaluado en 675 pacientes de un ensayo clínico de fase III y 278 pacientes de dos ensayos clínicos de fase II. Antes de entrar en el estudio, se realizó a todos los pacientes una prueba diagnóstica en muestras del tumor para detectar la presencia de una mutación V600 de BRAF (prueba diagnóstica cobas® 4800 BRAF V600 Mutation Test).
Melanoma metastásico o irresecable
Pacientes sin tratamiento previo: los resultados de un estudio de fase III aleatorizado, sin enmascara-miento, multicéntrico e internacional respaldan el uso del vemurafenib en pacientes con melanoma metastásico o irresecable con la mutación V600 de BRAF que no habían sido tratados previamente. Los pacientes fueron asignados aleatoriamente al tratamiento con vemurafenib (960 mg 2 v/d) o dacarbazina (1000 mg/m2 cada 3 semanas).
Un total de 675 pacientes fueron asignados aleatoriamente al vemurafenib (n = 337) o a la dacarbazina (n = 338). La aleatorización se estratificó según el estadio de la enfermedad, la concentración de LDH, el estado general según la escala de ECOG y la región geográfica. Las características iniciales de los grupos estaban adecuadamente equilibradas. De los pacientes asignados aleatoriamente al grupo del vemurafenib, la mayoría eran varones (59 %) y de raza blanca (99 %); la mediana de la edad fue de 56 años (28 % tenían ≥65 años); todos los pacientes presentaban un estado general de 0 o 1 según la escala de ECOG, y la mayoría se hallaban en el estadio M1c de la enfermedad (66 %). Las variables principales de valoración de la eficacia de este estudio fueron la supervivencia global (SG) y la supervivencia sin progresión (SSP). Las variables secundarias clave de valoración de la eficacia fueron la tasa de mejor respuesta global confirmada y la duración de la respuesta.
En el análisis intermedio preespecificado (fecha límite de obtención de datos: 30 de diciembre de 2010), se observaron mejorías estadísticamente significativas y clínicamente importantes de las variables de valoración principales: la SG (p <0,0001) y la SSP (p < 0,0001) (prueba de rangos logarítmicos no estratificada). En el momento de la actualización realizada a los 3 meses (fecha límite de obtención de datos: 31 de marzo de 2011), habían fallecido 200 pacientes en total (78 en el grupo del vemurafenib y 122 en el grupo de la dacarbazina). La mediana del periodo de seguimiento de la SG fue de 6,2 meses (intervalo: 0,4-13,9 meses) en el grupo del vemurafenib y de 4,5 meses (intervalo de <0,1 a 11,7 meses) en el grupo de la dacarbazina.
La supervivencia global fue mayor con el vemurafenib que con la dacarbazina, con una hazard ratio (razón de riesgos instantáneos) de 0,44 (IC 95 %: 0,33-0,59), lo cual representa una reducción del 56 % del riesgo de fallecimiento con el vemurafenib en comparación con la dacarbazina. La estimación de la tasa de supervivencia a los 6 meses por el método de Kaplan-Meier fue del 83 % (IC 95 %: 79-87 %) con el vemurafenib y del 63 % (IC 95 %: 57-69 %) con la dacarbazina. En el momento del análisis, la estimación por el método de Kaplan-Meier de la mediana de la SG con el vemurafenib no se había alcanzado (IC 95 %: 9,6, no alcanzada) y con la dacarbazina fue de 7,9 meses (IC 95 %: 7,3-9,6).
Se llevó a cabo un análisis post-hoc actualizado de la SG 24 meses después de la aleatorización del último paciente (fecha límite de obtención de datos: 20 de diciembre de 2012). En el momento de este análisis, habían fallecido 478 pacientes: 242 en el grupo del vemurafenib y 236 en el grupo de la dacarbazina. La mediana del periodo de seguimiento en el grupo del vemurafenib fue de 13,4 meses (intervalo: 0,4-33,3 meses). La estimación de Kaplan-Meier de la mediana de la SG con el vemurafenib fue de 13,6 meses (IC 95 %: 12,0, 15,3).
La SSP según la evaluación del investigador fue más prolongada con el vemurafenib que con la dacarbazina, con una hazard ratio de progresión o fallecimiento (SSP) de 0,26 (IC 95 %: 0,20-0,33), lo cual representa una reducción del 74 % del riesgo de progresión o fallecimiento con el vemurafenib en comparación con la dacarbazina. La estimación por el método de Kaplan-Meier de la tasa de SSP a los 6 meses fue del 47 % (IC 95 %: 38-55 %) con el vemurafenib y del 12 % (IC 95 %: 7-18 %) con la dacarbazina. La mediana de la SSP fue de 5,32 meses (IC 95 %: 4,86-6,57 meses) con el vemurafenib y de 1,61 meses (IC 95 %: 1,58-1,74) con la dacarbazina. La tasa de mejor respuesta global confirmada (respuesta completa más respuesta parcial; variable de valoración secundaria), según la evaluación del investigador, mejoró significativamente (p <0,0001) en el grupo del vemurafenib (48,4 %; IC 95 %: 41,6-55,2 %) en comparación con el grupo de la dacarbazina (5,5 %; IC 95 %: 2,8-9,3 %). En el 37 % de los pacientes que recibieron vemurafenib y el 24 % de los tratados con dacarbazina se estabilizó la enfermedad según los criterios RECIST (versión 1.1).
En todos los subgrupos (edad, sexo, LDH inicial, estado general según la escala de ECOG, estadio de la enfermedad metastásica) y regiones geográficas se observaron mejorías a favor del vemurafenib de la SG, la SSP y la mejor respuesta global confirmada.
Los resultados relativos a la eficacia se resumen en la siguiente tabla y en las figuras 1 (SG actualizada) y 2 (SSP).
Figura 1. Curvas de Kaplan-Meier de la supervivencia global actualizadas - Pacientes sin tratamiento previo
(20 de diciembre de 2012)
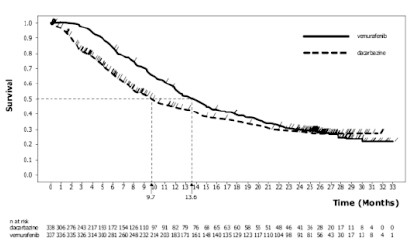
Survival: supervivencia; Time (months): tiempo (meses); n at risk: N.º de pacientes en riesgo; dacarbazine: dacarbazina: vemurafenib: vemurafenib.
|
Tabla 9. Eficacia del vemurafenib en pacientes con melanoma con la mutación V600 de BRAF que no habían recibido previamente tratamiento |
|||
|
Vemurafenib (n = 337) |
Dacarbazina (n = 338) |
pd |
|
|
Supervivencia global Hazard ratio (IC 95 %)a |
0,44 (0,33, 0,59) |
<0,0001 |
|
|
Mediana de la SG (meses) (IC 95 %)b |
No se alcanzó (9,6, no se alcanzó) |
7,9 (7,3, 9,6) |
- |
|
Tasa de supervivencia a los 6 meses (IC 95 %)b |
83 % (79 %, 87 %) |
63 % (57 %, 69 %) |
- |
|
SG actualizada Mediana de la SG (meses) (IC 95 %)b, c |
13,6 |
9,7 (7,9, 12,8) |
- |
|
Supervivencia sin progresión Hazard ratio (IC 95 %)a |
0,26 (0,20, 0,33) |
<0,0001 |
|
|
Mediana de la SSP (meses) (IC 95 %)b |
5,32 (4,86, 6,57) |
1,61 (1,58, 1,74) |
- |
|
a Estimación de la hazard ratio mediante el modelo de Cox; una hazard ratio <1 es favorable al vemurafenib. b Estimaciones de Kaplan-Meier. c Resultados actualizados (24 meses después de la aleatorización del último paciente) d Prueba de rangos logarítmicos no estratificada |
|||
Figura 2. Curvas de Kaplan-Meier de la supervivencia sin
progresión: pacientes sin tratamiento previo
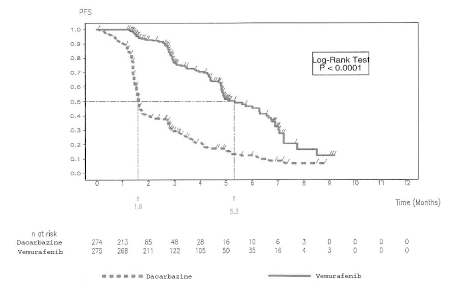
PFS: SSP; Time (months): tiempo (meses); Log-Rank Test: prueba de rangos logarítmicos; n at risk: N.º de pacientes en riesgo; dacarbazine: dacarbazina: vemurafenib: vemurafenib.
La proporción de pacientes que mejoraron según la evaluación del estado general realizada por el médico fue mayor en el grupo del vemurafenib (63,4 %) (IC 95 %: 57-69 %) que en el grupo de la dacarbazina (20,2 %) (IC 95 %: 15-26 %).
Pacientes que no respondieron al menos a un tratamiento sistémico anterior: se llevó a cabo un estudio de fase II con un solo grupo, multicéntrico y multinacional, en 132 pacientes con melanoma metastásico que habían recibido previamente al menos un tratamien-to. La mediana de la edad fue de 52 años; el 19 % de los pacientes eran mayores de 65 años. La mayoría de los pacientes eran varones (61 %), de raza blanca (99 %), y se hallaban en el estadio M1c de la enfermedad (61 %). El 49 % de los pacientes no había respondido a >2 terapias anteriores. La mediana de la duración del seguimiento fue de 6,87 meses (intervalo: 0,6-11,3).
La tasa de mejor respuesta global confirmada (respuesta completa más respuesta parcial; variable de valoración principal) según la evaluación de un comité de revisión independiente (CRI) fue del 52 % (IC 95 %: 43-61 %). La mediana del tiempo transcurrido hasta la respuesta fue de 1,4 meses; el 75 % de las respuestas tuvieron lugar al cabo de 1,6 meses de tratamiento. La mediana de la duración de la respuesta según la evaluación del CRI fue de 6,5 meses (IC 95 %: 5,6, no se alcanzó). En el 30 % de los pacientes se observó una enfermedad estable según los criterios RECIST (versión 1.1). La mediana de la SG fue de 15,9 meses (IC 95 %: 11,2-19,3), la tasa de supervivencia a los 6 meses fue de 0,77 (IC 95 %: 0,69-0,84) y al cabo de 1 año fue de 0,58 (IC 95 % 0,48-0,66). La mediana de la SSP fue de 6,1 meses (IC 95 %: 5,5-6,9), y la tasa de SSP a los 6 meses fue del 52 % (IC 95 %: 43-61 %).
Pacientes con metástasis encefálicas: se llevó a cabo un estudio de fase II multicéntrico, sin enmascaramiento, con un solo grupo (N =146) del vemurafenib en pacientes adultos con melanoma metastásico confirmado histológicamente, portador de la mutación V600 de BRAF, y con metástasis encefálicas. El estudio constaba de dos cohortes que fueron incluidas simultáneamente:
- Pacientes sin tratamiento previo (cohorte 1: n = 90): pacientes que no habían recibido previamente tratamiento para las metástasis encefálicas; se permitió el tratamiento sistémico previo del melanoma metastásico.
- Pacientes tratados previamente (cohorte 2: n = 56): pacientes que habían recibido tratamiento previo para las metástasis encefálicas y que presentaron una progresión de la enfermedad después de este tratamiento. En el caso de los pacientes tratados con radioterapia estereotáctica o cirugía, tenían que haber desarrollado después de este tratamiento previo una nueva lesión encefálica evaluable según los criterios RECIST.
La mediana de la edad de los pacientes fue de 54 años (intervalo: 26-83 años), siendo similar en las dos cohortes. La mayoría de los pacientes eran varones (61,6 %), con una distribución similar entre las dos cohortes. Se notificó que 135 pacientes (92,5 %) eran de raza blanca; la raza de 11 pacientes (7,5 %) no se notificó en virtud de la normativa local. La mediana del número de lesiones diana encefálicas al inicio del estudio fue de 2 (intervalo: 1-5) en ambas cohortes.
El objetivo principal del estudio era evaluar la eficacia del vemurafenib usando la tasa de mejor respuesta global (TMRG) en el encéfalo de pacientes con melanoma metastásico con metástasis encefálicas no tratadas pre-viamente, según la evaluación de un comité de revisión independiente (CRI) usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST), versión 1.1.
Los objetivos secundarios fueron una evaluación de la eficacia del vemurafenib usando la tasa de mejor respuesta global (TMRG) en el encéfalo de pacientes tratados previamente, la duración de la respuesta (DR), la supervivencia sin progresión (SSP) y la supervivencia global (SG) en pacientes con melanoma con metástasis encefálicas.
|
Tabla 10. Eficacia del vemurafenib en pacientes con metástasis encefálicas |
|||
|
Cohorte 1 Sin tratamiento previo |
Cohorte 2 Con tratamiento previo |
Total |
|
|
TMRGa en el encéfalo (n) Pacientes con respuesta (n [%]) (IC 95 %)b |
90 16 (17,8 %) (10,5, 27,3) |
56 10 (17,9 %) (8,9, 30,4) |
146 26 (17,8 %) (12,0, 25,0) |
|
DRc en el encéfalo (n) Mediana (meses) (IC 95 %)d |
16 4,6 (2,9, 6,2) |
10 6,6 (2,8, 10,7) |
26 5,0 (3,7, 6,6) |
|
SSP - Global (n) Mediana (meses)e (IC 95 %)d |
90 3,7 (3,6, 3,7) |
56 3,7 (3,6, 5,5) |
146 3,7 (3,6, 3,7) |
|
SSP - Sólo encéfalo (n) Mediana (meses)e (IC 95 %)d |
90 3,7 (3,6, 4,0) |
56 4,0 (3,6, 5,5) |
146 3,7 (3,6, 4,2) |
|
SG Mediana (meses)(IC 95 %)d |
90 8,9 (6,1, 11,5) |
56 9,6 (6,4, 13,9) |
146 9,6 (6,9, 11,5) |
|
a Tasa de mejor respuesta global según la evaluación de un comité de revisión independiente, número de pacientes con respuesta - n (%) b Intervalo de confianza (IC) de Clopper-Pearson del 95 % bilateral. c Duración de la respuesta según la evaluación de un comité de revisión independiente. d Estimación de Kaplan-Meier. e Según la evaluación del investigador. |
|||
Enfermedad de Erdheim-Chester (EEC): se llevó a cabo un estudio de fase II sin enmascaramiento, multicéntrico, con múltiples cohortes, en pacientes de ≥16 años de edad con cánceres distintos del melanoma con la mutación V600 de BRAF (MO28072).
Este estudio incluyó a 22 pacientes con EEC. La mayoría de los pacientes (68,2 %) habían recibido previamente terapias sistémicas, y los datos demográficos mostraban que la mediana de la edad en los pacientes con EEC era de 58,5 años (intervalo: 34-77 años). El 55 % de los pacientes eran varones y el 45 % mujeres.
La variable de valoración principal del análisis final fue la tasa de mejor respuesta global (TMRG) confirmada, según la evaluación del investigador conforme a los criterios RECIST (versión 1.1) y se presenta en la tabla 11 siguiente. Una de las variables de valoración secundarias fue la tasa de beneficio clínico (TBC) según la evaluación del investigador conforme a los criterios RECIST. La mediana de la duración del seguimiento fue de 26,6 meses en los pacientes con EEC (intervalo: 3,0-44,3 meses).
|
Tabla 11. Eficacia del vemurafenib en pacientes con EEC (según la evaluación del investigador) |
|
|
N = 22 |
|
|
Mejor respuesta global confirmada Pacientes con respuesta (n [%]) (IC 95 %)a Respuesta completa (RC) Respuesta parcial (RP) |
12 (54,5 %) (32,2, 75,6) 1 (4,5 %) 11 (50 %) |
|
Tasa de beneficio clínicob (n [%]) (IC 95 %)a |
16 (72 ,7 %) (49,8, 89,3 ) |
|
a IC 95 % determinado usando el método de Clopper-Pearson. b Tasa de beneficio clínico confirmada, definida como los pacientes con RC, RP o EE durante ≥6 meses. |
|
La mediana del tiempo transcurrido hasta la respuesta fue de 11,0 meses (IC 95 %: 3,7-14,6 meses).
La mediana de la DR, el tiempo transcurrido hasta la progresión tumoral (TPT), la SSP y la SG no fueron estimables tras una mediana de duración del seguimiento de 26,6 meses.
La estimación de la tasa de SSP al cabo de 24 meses fue del 83,3 % (IC 95 %: 66,1-100 %), y la estimación de la tasa de SG al cabo de 24 meses fue del 94,7 % (IC 95 %: 84,7-100 %).
Inmunogenicidad: no procede.
Contraindicaciones: Zelboraf está contraindicado en pacientes con hipersensibilidad conocida al vemurafenib o a cualquiera de los excipientes (ver Advertencias y precauciones generales).
Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios de los efectos del vemurafenib sobre la capacidad para conducir y utilizar máquinas.
Reacciones adversas
Ensayos clínicos
Resumen del perfil de seguridad: en el programa de desarrollo clínico del vemurafenib en conjunto, se calcula que han recibido el vemurafenib un total de 6300 pacientes.
Pacientes con melanoma metastásico o irresecable: las reacciones adversas (RA) se observaron en 2 ensayos clínicos: uno de fase III (NO25026) en pacientes no tratados previamente (n = 675) con melanoma metastásico o irresecable con la mutación V600 de BRAF, y otro de fase II (NP22657) en pacientes con melanoma metastásico con la mutación V600 de BRAF que no habían respondido previamente al menos a un tratamiento sistémico (n = 132).
En el estudio NO25026, un ensayo de fase III sin enmascaramiento, los pacientes asignados aleatoriamente al grupo del vemurafenib recibieron una dosis inicial oral de 960 mg 2 v/d; los asignados al grupo de referencia (control) con tratamiento activo recibieron dacarbazina i.v. en dosis de 1000 mg/m2 cada 3 semanas. La mediana de la duración del tratamiento con vemurafenib fue de 6,6 meses, frente a 0,8 meses en el grupo de la dacarbazina. El estudio de fase II (NP22657) fue un ensayo sin enmascaramiento, no comparativo, con un solo grupo, en el que los pacientes recibieron 960 mg de vemurafenib 2 v/d. La mediana de la duración del tratamiento en este estudio fue de 5,7 meses.
Las reacciones adversas de cualquier grado más frecuentes (≥30 % en cualquiera de los estudios) fueron las siguientes: artralgia, fatiga, exantema, reacción de fotosensibilidad, alopecia, náuseas, diarrea, cefalea, prurito, vómitos, papiloma cutáneo e hiperqueratosis. Las reacciones adversas de grado 3 más frecuentes (≥5 %) fueron las siguientes: CCEC, queratoacantoma, exantema, artralgia y ?-glutamil-transferasa (GGT) aumentada. La incidencia de reacciones adversas de grado 4 fue ≤4 % en ambos estudios.
La incidencia de eventos adversos que implicaron la retirada permanente de la medicación del estudio en el ensayo NO25026 fue del 7 %. En el ensayo NP22657, la incidencia de eventos adversos que implicaron la retirada permanente de la medicación del estudio fue del 3 %.
En la tabla 3 siguiente se resumen las reacciones adversas que se registraron en pacientes con melanoma metastásico o irresecable. Las reacciones adversas se enumeran según la clase de órgano, aparato o sistema del MedDRA. La correspondiente categoría de frecuencia de cada reacción adversa se basa en la siguiente clasificación: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1000 a <1/100), rara (≥1/10 000 a <1/1000), muy rara (<1/10 000).
Pacientes con EEC con la mutación V600 de BRAF: en un estudio de fase II sin enmascaramiento y con múltiples cohortes (MO28072), los pacientes recibieron vemurafenib en dosis de 960 mg 2 v/d (N = 22). La mediana de la duración del tratamiento en los pacientes con EEC de este estudio fue de 14,2 meses. Las RA (de cualquier grado) y las RA de grado ≥3 más frecuentes que se observaron en la población con melanoma también se han notificado en la población de pacientes con EEC. Sin embargo, la hipertensión y el exantema de grado ≥3 se observaron más frecuentemente en los pacientes con EEC.
La incidencia de eventos adversos que implicaron la retirada permanente de la medicación fue del 32 %.
En la tabla 4 siguiente se resumen las RA que se registraron en pacientes con EEC. Las reacciones adversas se enumeran según la clase de órgano, aparato o sistema del MedDRA. La correspondiente categoría de frecuencia de cada reacción adversa se basa en la siguiente clasificación: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1000 a <1/100), rara (≥1/10 000 a <1/1000), muy rara (<1/10 000).
|
Tabla 2. Resumen de las RA* ocurridas en ≥10% de los pacientes tratados con vemurafenib |
|||||||||
|
Estudio de fase III: pacientes no tratados previamente |
Estudio de fase II: pacientes que respondieron al menos a una terapia sistémica previa |
||||||||
|
Vemurafenib n = 336 |
Dacarbazina n = 282 |
Vemurafenib n = 132 |
|||||||
|
RA |
Todos los grados (%) |
Grado 3 (%) |
Grado 4 (%) |
Todos los grados (%) |
Grado 3 (%) |
Grado 4 (%) |
Todos los grados (%) |
Grado 3 (%) |
Grado 4 (%) |
|
Trastornos de la piel y del tejido subcutáneo Erupción Reacción de fotosensibilidad Alopecia Prurito Hiperqueratosis Erupción maculopapular Queratosis actínica Piel seca Erupción papular Eritema |
36 30 35 22 20 9 6 16 4 11 |
8 3 <1 1 1 2 - - <1 - |
- - - - - - - - - - |
1 4 2 1 - <1 3 1 - 1 |
- - - - - - - - - - |
- - - - - - - - - - |
52 49 36 30 28 21 17 16 13 8 |
7 3 - 2 - 6 - - - - |
- - - - - - - - - - |
|
Trastornos musculosqueléticos y del tejido conjuntivo Artralgia Mialgia Dolor en una extremidad Dolor musculosquelético Dolor de espalda |
49 12 13 6 6 |
3 - <1 <1 - |
- - - - - |
3 1 6 3 5 |
<1 - 2 - - |
- - - - - |
67 24 9 11 11 |
8 <1 - - <1 |
- - - - - |
|
Trastornos generales y alteraciones en el sitio de administración Fatiga Edema periférico Pirexia |
33 15 18 |
2 <1 <1 |
- - - |
31 5 9 |
2 - <1 |
- - - |
543 23 17 |
4 - 2 |
- - - |
|
Trastornos gastrointestinales Náuseas Diarrea Vómitos Estreñimiento |
30 25 15 10 |
1 <1 1 - |
- - - - |
41 12 24 23 |
2 <1 1 - |
- - - - |
37 29 26 16 |
2 <1 2 - |
- - - - |
|
Trastornos del sistema nervioso Cefalea Disgeusia |
21 13 |
<1 - |
- - |
9 3 |
- - |
- - |
27 11 |
- - |
- - |
|
Neoplasias benignas, malignas y no especifi cadas (incluidos quistes y pólipos) Papiloma cutáneo CCCE# Queratosis seborreica |
18 12 7 |
<1 11 <1 |
- - - |
- <1 1 |
- <1 - |
- - - |
30 21 14 |
- 21 - |
- - - |
|
Exploraciones complementarias Gamma-glutamiltransferasa elevada |
4 |
2 |
<1 |
1 |
- |
- |
15 |
6 |
4 |
|
Trastornos del metabolismo y la nutrición Apetito disminuido |
16 |
- |
- |
7 |
- |
- |
21 |
- |
- |
|
Trastornos respiratorios, torácicos y mediastínicos Tos |
7 |
- |
- |
6 |
- |
- |
12 |
- |
- |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos Quemadura solar |
9 |
- |
- |
- |
- |
- |
14 |
- |
- |
|
* Reacciones adversas notificadas de acuerdo con el MedDRA y clasificadas según la versión 4.0 de los criterios terminológicos comunes del National Cancer Institute referentes a los acontecimientos adversos (NCI-CTCAE) para la evaluación de la toxicidad. # Todos los casos de carcinoma de células escamosas cutáneo tenían que notificarse como de grado 3, según las instrucciones dadas a los investigadores de los estudios, y no fue necesario modificar la dosis o interrumpir el tratamiento en ningún paciente. §§ La elevación de la GGT de grado 4 se registró en pacientes con melanoma metastásico o irresecable (<1 % en los pacientes sin tratamiento previo y 4 % en los pacientes que no habían respondido al menos a una terapia sistémica previa). |
|||||||||
|
Tabla 4. Resumen de las RA* en pacientes con EEC |
|||
|
RA |
15 pacientes recibieron al menos una terapia sistémica previa |
Categoría de frecuencia |
|
|
n = 22 |
|||
|
Todos los grados (%) |
Grado 3 (%) |
||
|
Trastornos de la piel y del tejido subcutáneo |
|||
|
Reacción de fotosensibilidad |
41 |
- |
Muy frecuente |
|
Alopecia |
55 |
- |
Muy frecuente |
|
Prurito |
36 |
- |
Muy frecuente |
|
Hiperqueratosis |
50 |
5 |
Muy frecuente |
|
Exantema maculopapuloso |
59 |
18 |
Muy frecuente |
|
Queratosis actínica |
32 |
5 |
Muy frecuente |
|
Sequedad cutánea |
45 |
- |
Muy frecuente |
|
Síndrome de eritrodisestesia palmoplantar |
41 |
- |
Muy frecuente |
|
Queratosis pilar |
32 |
- |
Muy frecuente |
|
Exantema papuloso |
23 |
- |
Muy frecuente |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||
|
Artralgia |
82 |
14 |
Muy frecuente |
|
Enfermedad de Dupuytren |
4,5 |
- |
Frecuente |
|
Trastornos generales y alteraciones en el lugar de la administración |
|||
|
Fatiga |
55 |
5 |
Muy frecuente |
|
Trastornos gastrointestinales |
|||
|
Náuseas |
32 |
- |
Muy frecuente |
|
Diarrea |
50 |
- |
Muy frecuente |
|
Vómitos |
23 |
- |
Muy frecuente |
|
Trastornos del sistema nervioso |
|||
|
Neuropatía periférica sensitiva |
36 |
- |
Muy frecuente |
|
Neoplasias benignas, malignas y sin especificar (incl. quistes y pólipos) |
|||
|
Papiloma cutáneo |
55 |
- |
Muy frecuente |
|
Carcinoma de células escamosas de la piel# |
36 |
36 |
Muy frecuente |
|
Queratoacantoma |
13,6 |
13,6 |
Muy frecuente |
|
Queratosis seborreica |
41 |
- |
Muy frecuente |
|
Nevus melanocítico |
23 |
- |
Muy frecuente |
|
Trastornos cardiacos |
|||
|
Intervalo QT del electrocardiograma prolongado |
55 |
5 |
Muy frecuente |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||
|
Tos |
36 |
- |
Muy frecuente |
|
Trastornos vasculares |
|||
|
Hipertensión |
36 |
23 |
Muy frecuente |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
|||
|
Quemadura solar |
23 |
- |
Muy frecuente |
|
* Reacciones adversas notificadas de acuerdo con la versión 19.1 del MedDRA y clasificadas según la versión 4.0 de los NCI-CTCAE. # Según el protocolo, los casos de carcinoma de células escamosas cutáneo tenían que notificarse como de grado 3. |
|||
Descripción de determinadas reacciones adversas registradas en ensayos clínicos
Carcinoma de células escamosas cutáneo (CCEC) (ver Advertencias y precauciones generales): en pacientes con melanoma metastásico o irresecable, la incidencia de CCEC en los pacientes tratados con vemurafenib en los estudios fue aproximadamente del 20 %. La mayoría de las lesiones extirpadas que fueron evaluadas por un laboratorio central de dermatopatología independiente se clasificaron como del subtipo de CCE-queratoacantoma o con características de queratoacantoma mixto (52 %), que son un tipo más benigno, menos invasivo, de CCEC. La mayoría de las lesiones clasificadas como «otras lesiones» (43 %) fueron lesiones cutáneas benignas (por ejemplo, verruga vulgar, queratosis actínica, queratosis benigna, quiste/quiste benigno). El CCEC suele producirse en etapas tempranas del tratamiento. En los pacientes que desarrollaron un CCEC, la mediana del tiempo transcurrido hasta la aparición del CCEC fue de 7,1-8,1 semanas. Aproximadamente el 33 % de los pacientes que desarrollaron un CCEC presentaron más de un evento; la mediana del tiempo transcurrido entre eventos fue de 6 semanas. Los casos de CCEC se trataron habitualmente con una simple excisión; en general, los pacientes siguieron bajo tratamiento sin modificar la dosis.
En los pacientes con EEC, la incidencia de CCEC, queratoacantoma o ambos fue del 40,9 %. La mediana del tiempo transcurrido hasta la primera aparición de CCEC en los pacientes en los que apareció al menos una vez fue de 12,1 semanas.
Reacciones de hipersensibilidad (ver Advertencias y precauciones generales): en un ensayo clínico se notificó un caso de reacción de hipersensibilidad con exantema, fiebre, escalofríos e hipotensión que tuvo lugar 8 días después de comenzar la administración de vemurafenib en dosis de 960 mg 2 v/d. Se observaron síntomas similares tras reanudar el tratamiento con una dosis única de 240 mg de vemurafenib. El paciente suspendió definitivamente el tratamiento con vemurafenib y se recuperó sin secuelas.
Prolongación del intervalo QT (ver Advertencias y precauciones generales): el análisis de los datos electrocardiográficos centralizados de un subestudio del QT de fase II sin enmascaramiento (abierto) y no comparativo realizado en 132 pacientes tratados con vemurafenib en dosis de 960 mg 2 v/d mostró un aumento medio del QTc entre el día 1 (3,3 ms; límite superior del IC 95 %: 5 ms) y el día 15 (12,8 ms; límite superior del IC 95 %: 14,9 ms). En este estudio se observó una prolongación del QTc dependiente de la exposición; la media del efecto en el QTc se mantuvo estable en 12-15 ms después del primer mes de tratamiento. El mayor valor de la media de la prolongación del QTc (15,1 ms; límite superior del IC 95 %: 17,7 ms) se observó en los 6 primeros meses de tratamiento (n = 90 pacientes). En 2 pacientes (1,5 %) se registraron valores absolutos del QTc durante el tratamiento >500 ms (grado 3 según los criterios CTC-AE), y sólo un paciente (0,8 %) presentó una prolongación del QTc >60 ms en comparación con el valor inicial.
El modelado de datos y la simulación de la prolongación del QT se tradujeron en las siguientes estimaciones: para la dosis de 960 mg 2 v/d, el porcentaje previsto de pacientes con una prolongación del QTcP >60 ms en comparación con el valor inicial fue del 0,05 %. Se previó que este porcentaje aumentaría hasta el 0,2 % en los pacientes obesos con un IMC de 45 kg/m2. La proporción prevista de pacientes con una prolongación >60 ms respecto al QTcP inicial fue del 0,043 % en los varones y del 0,046 % en las mujeres. La proporción prevista de pacientes con una prolongación del QTcP con valores >500 ms fue del 0,05 % en los varones y del 1,1 % en las mujeres.
Alteraciones analíticas: las alteraciones de las pruebas hepáticas en pacientes con melanoma metastásico o irresecable (estudio clínico de fase III NO25026) y en los pacientes con EEC (MO28072) se resumen en la tabla siguiente como la proporción de pacientes que presentaron un cambio desde el valor inicial hasta un evento de grado 3 o 4.
|
Tabla 5. Alteración de las pruebas hepáticas: cambio desde el valor basal hasta un evento de grado 3 o 4* |
||
|
Cambio desde el valor inicial hasta un evento de grado 3 o 4 |
||
|
Pacientes con melanoma metastásico o irresecable (estudio NO25026) |
Pacientes con EEC (estudio MO28072) |
|
|
Parámetro |
% |
% |
|
GGT** |
11,5 |
- |
|
AST |
0,9 |
0 |
|
ALT* |
2,8 |
9,1 |
|
Fosfatasa alcalina* |
2,9 |
4,5 |
|
Bilirrubina* |
1,9 |
0 |
|
* En lo que respecta a la ALT, la fosfatasa alcalina y la bilirrubina, no hubo ningún paciente con un cambio hasta un evento de grado 4. ** No se obtuvieron datos sobre la GGT en los pacientes con EEC. |
||
|
Tabla 6. Cambio de la concentración de creatinina respecto al valor inicial |
||
|
Los cambios de la concentración de creatinina respecto al valor inicial en estudios se resumen en la siguiente tabla. |
||
|
Pacientes con melanoma metastásico o irresecable (estudio NO25026) |
Pacientes con EEC (estudio MO28072) |
|
|
% |
% |
|
|
Cambio de ≥1 grado respecto al inicio del estudio (todos los grados) |
27,9 |
95,5 |
|
Cambio de ≥1 grado respecto al inicio del estudio hasta un grado ≥3 |
1,2 |
9,1 |
|
Hasta un grado 3 |
0,3 |
9,1 |
|
Hasta un grado 4 |
0,9 |
0,0 |
Experiencia poscomercialización: se han identificado las siguientes reacciones adversas en la experiencia poscomercialización del vemurafenib (tabla 7), basándose en notificaciones espontáneas de casos y en casos publi-cados. Las reacciones adversas se presentan conforme a las clases de órgano, aparato o sistema del MedDRA, y la estimación de la categoría de frecuencia correspondiente a cada reacción adversa se basa en la siguiente clasificación: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1000 a <1/100), rara (≥1/10 000 a <1/1000), muy rara (<1/10 000).
|
Tabla 7. Reacciones adversas registradas en la experiencia poscomercialización |
|||
|
Clase de órgano, aparato o sistema |
Zelboraf (%) |
Categoría de frecuencia |
Referencias bibliográficas de la ficha técnica |
|
Trastornos hepatobiliares Daño hepático1 |
<1 |
Poco frecuente |
39 |
|
Trastornos de la sangre y del sistema linfático Neutropenia |
<1 |
Poco frecuente |
41 |
|
Neoplasias benignas, malignas y sin especificar (incl. quistes y pólipos) Leucemia mielomonocítica crónica (LMMC)1, 2 Adenocarcinoma pancreático1, 3 |
No procede No procede |
De frecuencia desconocida De frecuencia desconocida |
33 45 |
|
Trastornos de la piel y del tejido subcutáneo Reacción adversa con eosinofilia y síntomas sistémicos (DRESS)1 |
No procede |
De frecuencia desconocida |
34 |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos Lesión por radiación1, 4 |
No procede |
De frecuencia desconocida |
43 |
|
Trastornos gastrointestinales Pancreatitis |
<1 |
Poco frecuente |
42 |
|
Trastornos renales y urinarios Daño renal agudo |
No procede |
De frecuencia desconocida |
48 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo Enfermedad de Dupuytren Fibromatosis de la fascia plantar |
No procede No procede |
De frecuencia desconocida De frecuencia desconocida |
52, 54 52, 54 |
|
1 V. 2.4 Advertencias y precauciones. 2 Progresión de una leucemia mielomonocítica crónica preexistente con mutación de NRAS. 3 Progresión de un adenocarcinoma pancreático preexistente con mutación de KRAS. 4 Incluye el fenómeno de activación de los efectos de la radioterapia (recall), lesión cutánea por radiación, neumonía por radiación, esofagitis por radiación, proctitis por radiación, hepatitis por radiación, cistitis por radiación y necrosis por radiación. |
|||
Descripción de determinadas reacciones adversas registradas en la experiencia poscomercialización
Daño renal agudo: se han notificado una amplia gama de casos de reacciones adversas renales con Zelboraf, que fueron desde elevaciones de leves a moderadas de la concentración de creatinina a la nefritis intersticial aguda y la necrosis tubular aguda; algunos de ellos se observaron en el marco de eventos de deshidratación. En la mayoría de los casos, las elevaciones de la concentración de creatinina parecieron ser reversibles (ver Advertencias y precauciones generales).
Alteraciones analíticas: desde la comercialización, se han notificado casos de alteraciones en las pruebas hepáticas, incluido un aumento de la ALT ≥5 veces por encima del límite superior de la normalidad (LSN), un aumento de la fosfatasa alcalina ≥2 veces por encima del LSN y un aumento de la ALT ≥3 veces por encima del LSN, así como una elevación simultánea de la concentración de bilirrubina (>2 veces por encima del LSN) (ver Advertencias y precauciones generales).
Las alteraciones de la concentración de creatinina se notificaron en el marco de la experiencia desde la comercialización (ver Advertencias y precauciones generales).
Interacciones con otros medicamentos y otras formas de interacción
Efectos del vemurafenib en las enzimas metabolizadoras de fármacos: los resultados de un estudio de interacciones farmacológicas in vivo en pacientes con melanoma metastásico demostraron que el vemurafenib es un inhibidor moderado del CYP1A2 y un inductor del CYP3A4.
No se recomienda el uso concomitante de vemurafenib y fármacos metabolizados por el CYP1A2 y el CYP3A4 con un margen terapéutico estrecho. Si no se puede evitar la coadministración, se actuará con cautela, dado que el vemurafenib puede aumentar la exposición plasmática a fármacos que son sustratos del CYP1A2 y reducir la exposición plasmática a fármacos que son sustratos del CYP3A4. Si está indicado desde el punto de vista clínico, puede plantearse una reducción de la dosis del fármaco sustrato del CYP1A2 administrado concomitantemente. En un ensayo clínico, la coadministración de vemurafenib elevó 2,6 veces el área bajo la curva de las concentraciones plasmáticas (ABC) de la cafeína (substrato del CYP1A2) y redujo en un 39 % el ABC del midazolam (substrato de CYP3A4). En otro ensayo clínico, el vemurafenib aumentó el ABCúlt y el ABCinf de una dosis única de 2 mg de tizanidina (sustrato del CYP1A2) aproximadamente 4,2 y 4,7 veces, respectivamente.
El ABC del dextrometorfano (substrato del CYP2D6) y del dextrorfano, su metabolito, aumentó aproximadamente un 47 %, lo cual es indicativo de un efecto en la farmacocinética del dextrometorfano que podría no estar mediado por la inhibición del CYP2D6.
La coadministración de vemurafenib se tradujo en un aumento del 18 % del ABC de la S-warfarina (sustrato del CYP2C9) (ver Propiedades farmacocinéticas). Cuando se utilicen concomitantemente el vemurafenib y la warfarina, se debe proceder con precaución y determinar si es preciso vigilar también el INR.
El vemurafenib inhibió moderadamente al CYP2C8 in vitro. No se sabe qué importancia puede tener esto in vivo, pero no cabe descartar que exista el riesgo de un efecto clínicamente importante al administrar concomitantemente sustratos del CYP2C8. La administración concomitante de sustratos de CYP2C8 con un margen terapéutico estrecho debe hacerse con precaución, dado que el vemurafenib puede aumentar su concentración.
Fármacos que inhiben o inducen al CYP3A4: el vemurafenib es un substrato del CYP3A4; por consi-guiente, la administración concomitante de inhibidores o inductores potentes del CYP3A4 puede alterar las concentraciones del vemurafenib. La coadministración de rifampicina, un inductor potente del CYP3A4, redujo significativamente la exposición plasmática al vemurafenib (ABC), aproximadamente un 40 %, tras administrar una dosis única de 960 mg de vemurafenib (ver Metabolismo). Se tendrá especial cautela al administrar inhibidores potentes del CYP3A4 (por ejemplo: ketoconazol, itraconazol, claritromicina, atazanavir, nefazodona, saquinavir, telitromicina, ritonavir, indinavir, nelfinavir, voriconazol) o inductores potentes del CYP3A4 (por ejemplo: fenitoína, carbamazepina, rifampicina, rifabutina, rifapentina, fenobarbital) junto con el vemurafenib.
Radioterapia: se han notificado casos de potenciación de la toxicidad de la radioterapia en pacientes tratados con vemurafenib (ver Advertencias y precauciones y Experiencia poscomercialización, Reacciones adversas). En la mayoría de los casos, los pacientes se sometieron a pautas de radioterapia en dosis ≥2 Gy/d (pautas hipofraccionadas).
Interacción del vemurafenib con sistemas de transporte de fármacos: en estudios in vitro se ha demostrado que el vemurafenib es tanto un sustrato como un inhibidor de la GPP y de la proteína de resistencia del cáncer de mama (BCRP), que actúan como bombas de expulsión. En el estudio clínico de interacciones farmacológicas GO28394, en el que se usó un sustrato de la GPP (digoxina), se demostró que la administración de múltiples dosis orales de vemurafenib (960 mg 2 v/d) elevó la exposición a la digoxina administrada en una dosis oral única, con un aumento aproximado de 1,8 veces y 1,5 veces en lo que se refiere al ABCúlt y la Cmáx, respectivamente. Se debe actuar con cautela cuando se administre el vemurafenib junto con sustratos de la GPP. Si está indicado desde el punto de vista clínico, puede plantearse una reducción de la dosis del fármaco sustrato de la GPP coadministrado.
No se conocen los efectos del vemurafenib en fármacos que son sustratos de la BCRP ni los efectos de los inductores o inhibidores de la BCRP en la exposición al vemurafenib.
En estudios in vitro se ha demostrado también que el vemurafenib es un inhibidor de la bomba de expulsión de sales biliares. No se sabe qué importancia puede tener esto in vivo.
Advertencias y precauciones
Advertencias y precauciones generales: antes de tratar a los pacientes con vemurafenib se debe confirmar mediante una prueba validada que tienen un tumor con la mutación V600 de BRAF.
Neoplasias malignas
Carcinoma de células escamosas cutáneo (CCEC)
En pacientes tratados con vemurafenib se han notificado casos de carcinoma de células escamosas cutáneo (CCEC) (incluidos los clasificados como del subtipo del queratoacantoma o del subtipo del queratoacantoma mixto) (ver Ensayos clínicos, Reacciones adversas). El CCEC se presentó habitualmente en etapas tempranas del tratamien-to. En los ensayos clínicos del vemurafenib, los posibles factores de riesgo asociados al CCEC fueron la edad (≥65 años), el cáncer cutáneo previo y la exposición crónica al sol. El tratamiento habitual consistió en una simple excisión quirúrgica del CCEC, y los pacientes pudieron continuar con el tratamiento sin ajustar la dosis.
Se recomienda hacer a todos los pacientes una evaluación dermatológica antes de iniciar el tratamiento y controles regulares durante el mismo. Toda lesión cutánea sospechosa debe extirparse, remitirse para hacer un examen anatomopatológico y tratarse conforme a las pautas de tratamiento locales habituales. La vigilancia se mantendrá durante 6 meses después de suspender el tratamiento con vemurafenib o hasta instaurar otra terapia antineoplásica.
Se indicará a los pacientes que informen a su médico si observan algún cambio en la piel.
Carcinoma de células escamosas no cutáneo (CCENC): se han descrito casos de carcinoma de células escamosas no cutáneo (CCENC) en pacientes que recibían vemurafenib. Antes de iniciar el tratamiento, y cada 3 meses durante el mismo, se hará una exploración de la cabeza y el cuello del paciente, consistente al menos en la inspección visual de la mucosa bucal y la palpación de los ganglios linfáticos. También se debe realizar una tomografía computarizada torácica antes de comenzar el tratamiento y cada 6 meses durante el mismo. Se recomienda hacer una exploración ginecológica (en las mujeres) y una exploración anal (en pacientes de ambos sexos) antes de iniciar el tratamiento y al concluirlo, o cuando se considere necesario desde el punto de vista clínico. Tras suspender el tratamiento con vemurafenib, se mantendrá la vigilancia del CCENC durante un perio-do de 6 meses o hasta instaurar otra terapia antineo-plásica. Los signos anómalos se evaluarán como proceda desde el punto de vista clínico.
Nuevo melanoma primario: en los ensayos clínicos se han descrito casos de nuevo melanoma primario. Estos casos se controlaron mediante extirpación, y los pacientes continuaron el tratamiento sin necesidad de ajustar la dosis. Las lesiones cutáneas deben vigilarse como se ha indicado en el apartado del CCEC.
Otras neoplasias malignas: dado su mecanismo de acción, el vemurafenib puede causar la progresión de cánceres asociados a mutaciones de RAS (ver Experien-cia poscomercialización, Reacciones adversas). El vemurafenib debe usarse con precaución en pacientes que hayan tenido o que presenten concomitantemente un cáncer asociado a una mutación de RAS.
Reacciones de hipersensibilidad: se han notificado casos de reacciones de hipersensibilidad graves, incluida la anafilaxia, en asociación con el vemurafenib (ver Contraindicaciones y Ensayos clínicos, Reacciones adversas). Las reacciones de hipersensibilidad graves consistieron en erupción y eritema generalizados o hipotensión arterial. En caso de reacción de hipersensibilidad grave, se suspenderá definitivamente el tratamiento con vemurafenib.
Reacciones cutáneas: en pacientes tratados con vemurafenib en el ensayo clínico fundamental, se registraron reacciones cutáneas graves, incluidos casos raros de síndrome de Stevens-Johnson y necrólisis epidérmica tóxica. Se han notificado reacciones adversas con eosinofilia y síntomas generales asociadas al vemurafenib (ver Experiencia poscomercialización, Reacciones adversas). Si el paciente sufre una reacción cutánea grave, se suspenderá definitivamente el tratamiento con vemurafenib.
Potenciación de la toxicidad de la radioterapia: se han notificado casos de activación de los efectos de la radioterapia (radiation recall) y de sensibilización a la radioterapia en pacientes que recibieron radioterapia antes, durante o después del tratamiento con vemurafenib (ver Interacciones con otros medicamentos y otras formas de interacción y Experiencia poscomercialización, Reacciones adversas). La mayoría de los casos fueron cutáneos, aunque algunos casos con afectación visceral tuvieron desenlaces mortales.
El vemurafenib debe usarse con cautela cuando se administre radioterapia concomitante o secuencialmente.
Prolongación del intervalo QT: se ha observado una prolongación del intervalo QT dependiente de la exposición en un subestudio del QT de fase II sin enmascaramiento (abierto) y no comparativo realizado en pacientes con melanoma metastásico previamente tratados (ver Ensayos clínicos, Reacciones adversas). La prolongación del intervalo QT puede dar lugar a un riesgo elevado de arritmias ventriculares, como la torsade de pointes (taquicardia ventricular polimorfa en entorchado). No se recomienda el tratamiento con vemurafenib en pacientes con trastornos electrolíticos que no puedan corregirse, con síndrome del QT prolongado o que estén tomando medicamentos que prolonguen el intervalo QT.
Antes de iniciar el tratamiento con vemurafenib y después de cada ajuste posológico debe realizarse un control electrocardiográfico y electrolítico. Después, este control se hará mensualmente durante los 3 primeros meses de tratamiento y posteriormente se realizará cada 3 meses, o con mayor frecuencia si se considera indicado desde el punto de vista clínico. No se recomienda empezar el tratamiento con vemurafenib en pacientes con un QTc >500 ms. Si el QTc sobrepasa los 500 ms (grado ≥3 según los CTC-AE) durante el tratamiento, se debe suspender temporalmente la administración de vemurafenib, corregir los trastornos electrolíticos y controlar los factores de riesgo cardiaco de prolongación del intervalo QT (por ejemplo, insuficiencia cardiaca congestiva, bradiarritmias). El tratamiento se reanudará únicamente, y en una dosis más baja, si el QTc desciende hasta <500 ms, tal como se describe en las tablas 1 y 2. Se recomienda suspender permanentemente la administración de vemurafenib si, después de la corrección de los factores de riesgo asociados, el QTc es >500 ms y además ha aumentado >60 ms en comparación con el valor previo al tratamiento.
Daño hepático: se han notificado casos de daño hepático, algunos graves, durante el tratamiento con vemurafenib (ver Experiencia poscomercialización y Alteraciones analíticas, Reacciones adversas).
Durante el tratamiento con vemurafenib pueden producirse alteraciones de los resultados de las pruebas hepáticas (ver Alteraciones analíticas, Reacciones adversas). Se debe medir la concentración de las enzimas hepáticas (aminotransferasas y fosfatasa alcalina) y la bilirrubina antes de comenzar el tratamiento; durante el tratamiento se realizarán controles mensuales o según se considere adecuado desde el punto de vista clínico. Las alteraciones analíticas se controlarán reduciendo la dosis, interrumpiendo la administración o suspendiendo definitivamente el tratamiento (ver Posología y forma de administración, Modificación de la dosis).
Fotosensibilidad: se han referido casos de fotosensibilidad de leves a graves en pacientes tratados con vemurafenib en ensayos clínicos (ver Ensayos clínicos, Reacciones adversas). Se debe indicar a todos los pacientes que eviten la exposición solar mientras tomen vemurafenib. Para prevenir las quemaduras solares, se aconsejará a los pacientes que, mientras tomen este medicamento, utilicen fuera de casa prendas de vestir que protejan del sol, así como una crema solar y un protector labial de amplio espectro frente a UVA y UVB (factor de protección solar [FPS] ≥30).
En caso de fotosensibilidad de grado 2 (intolerable) o eventos adversos mayores, se recomienda ajustar la dosis (ver Posología y forma de administración, Modificación de la dosis).
Enfermedad de Dupuytren y fibromatosis de la fascia plantar: se han notificado casos de enfermedad de Dupuytren y fibromatosis de la fascia plantar con el vemurafenib. La mayoría de los casos eran de leves a mode-rados, aunque también se han notificado casos graves y discapacitantes de la enfermedad de Dupuytren (ver Experiencia poscomercialización, Reacciones adversas).
Ante estos eventos, se debe reducir la dosis, interrumpir temporalmente el tratamiento o retirarlo definitivamente (ver Posología y forma de administración, Modificaciones de la dosis).
Reacciones oftálmicas: se han notificado casos de reacciones oftálmicas graves, incluida la uveítis. Se debe controlar sistemáticamente a los pacientes para detectar reacciones oftálmicas (ver Reacciones adversas, Ensayos clínicos).
Administración concomitante con ipilimumab: en un ensayo de fase I se registraron elevaciones asintomáticas de grado 3 de la concentración de aminotransferasas y bilirrubina al administrar concomitantemente ipilimu-mab (3 mg/kg) y vemurafenib (960 mg 2 v/d o 720 mg 2 v/d). Considerando estos datos, no se recomienda admi-nistrar concomitantemente ipilimumab y vemurafenib.
Efectos del vemurafenib en otros fármacos: el vemurafenib es un inhibidor moderado del CYP1A2 e inductor del CYP3A4. El vemurafenib puede aumentar la exposición plasmática a fármacos metabolizados principalmente por el CYP1A2 y reduce la exposición plasmática a fármacos metabolizados predominantemente por el CYP3A4. No se recomienda el uso concomitante de vemurafenib con fármacos metabolizados por el CYP1A2 y el CYP3A4 que tengan un margen terapéutico estrecho. Se puede considerar una reducción de la dosis del fármaco sustrato del CYP1A2 coadministrado, si está indicado desde el punto de vista clínico (ver Interacciones con otros medicamentos y otras formas de interacción).
Se debe actuar con cautela y considerar el control adicional del cociente internacional normalizado (INR) cuando se usen concomitantemente el vemurafenib y la warfarina (ver Interacciones con otros medicamentos y otras formas de interacción).
El vemurafenib es un inhibidor de la glicoproteína P (GPP), que actúa como bomba de expulsión. El vemurafenib puede aumentar la exposición plasmática a fármacos que son sustratos de la GPP. Se debe proceder con cautela cuando se administre el vemurafenib junto con sustratos de la GPP. Se puede considerar una reducción de la dosis del fármaco sustrato de la GPP coadministrado, si está indicado desde el punto de vista clínico (ver Interacciones con otros medicamentos y otras formas de interacción).
Efectos de otros medicamentos en el vemurafenib
Dado que el vemurafenib es un sustrato del CYP3A4, la administración concomitante de inhibidores o inductores potentes del CYP3A4 puede alterar la concentración del vemurafenib. Los inhibidores e inductores potentes del CYP3A4 deben usarse con precaución si se administran junto con el vemurafenib (ver Interacciones con otros medicamentos y otras formas de interacción).
Alteraciones analíticas
Creatinina: se han notificado elevaciones de la concentración de creatinina, en su mayoría casos de leves (de >1 a 1,5 veces por encima del LSN) a moderados (de >1,5 a 3 veces por encima del LSN) y reversibles (ver y Alteraciones analíticas, Reacciones adversas).
Se debe medir la concentración de creatinina sérica antes de iniciar el tratamiento, y se controlará periódicamente durante el tratamiento según se considere adecuado desde el punto de vista clínico. En cuanto a las modificaciones de la dosis recomendada, véase Posología y forma de administración, tabla 1.
Abuso y dependencia del fármaco: no procede.
Pautas posológicas especiales
Uso en geriatría: no es necesario ningún ajuste especial de la dosis en los pacientes de 65 o más años.
Uso en pediatría: no se han establecido la seguridad ni la eficacia del vemurafenib en pacientes menores de 18 años. No se ha aprobado el uso del vemurafenib en pacientes menores de 18 años (ver Farmacocinética en poblaciones especiales).
Insuficiencia renal: no es necesario ajustar la dosis inicial en los pacientes con insuficiencia renal leve o moderada (ver Insuficiencia renal y Farmacocinética en poblaciones especiales). No hay datos suficientes para determinar la posible necesidad de ajustar la dosis en pacientes con insuficiencia renal grave.
Insuficiencia hepática: no es necesario ajustar la dosis inicial en los pacientes con insuficiencia hepática leve o moderada (ver Insuficiencia hepática y ver Farmacocinética en poblaciones especiales). No hay datos suficientes para determinar la posible necesidad de ajustar la dosis en pacientes con insuficiencia hepática grave.
Posología y forma de administración
Posología habitual: la dosis recomendada de vemurafenib es de 960 mg (4 comprimidos de 240 mg) 2 veces al día (2 v/d). La primera dosis debe tomarse por la mañana y la segunda por la noche, aproximadamente 12 horas más tarde. Cada dosis puede tomarse con o sin alimentos (ver Absorción).
Los comprimidos de vemurafenib deben tomarse enteros, con un vaso de agua; no deben masticarse ni triturarse.
Duración del tratamiento: se recomienda mantener el tratamiento con vemurafenib hasta la progresión de la enfermedad o la aparición de reacciones adversas inaceptables (ver tablas 1 y 2).
Dosis omitidas: si se omite una dosis, puede tomarse hasta 4 horas antes de la siguiente para mantener el régimen de administración 2 v/d. No deben tomarse al mismo tiempo ambas dosis.
Vómitos: si el paciente sufre vómitos después de la administración de vemurafenib, no debe tomar una dosis adicional del medicamento, sino que el tratamiento debe proseguir del modo habitual.
Modificaciones de la dosis (ver Advertencias y precauciones generales y Ensayos clínicos, Reacciones adversas)
Para tratar los eventos adversos sintomáticos o la prolongación del QTc puede ser preciso reducir la dosis de vemurafenib, interrumpir temporalmente la adminis-tración o suspender definitivamente el tratamiento. No se recomienda modificar la dosis o interrumpir el tratamiento en caso de carcinoma de células escamosas cutáneo. No se recomienda reducir la dosis a menos de 480 mg 2 v/d.
|
Tabla 1. Modificaciones de la dosis |
||
|
Modificación de la dosis de vemurafenib recomendada |
||
|
Grado de toxicidad (CTC-AE)* |
Cambios de la dosis de vemurafenib durante el periodo de tratamiento actual |
Modificaciones de la dosis al reanudar el tratamiento |
|
Grado 1 o de grado 2 que sea tolerable |
Sin cambios |
No procede |
|
De grado 2 que sea intolerable o de grado 3 1.ª ocasión^ |
Interrumpir el tratamiento hasta la resolución: grado 0-1 |
Reducir la dosis en 240 mg 2 v/d |
|
2.ª ocasión^ |
Interrumpir el tratamiento hasta la resolución: grado 0-1 |
Reducir la dosis en 240 mg 2 v/d |
|
3.ª ocasión^ |
Suspender permanentemente el tratamiento |
No procede |
|
Grado 4 |
||
|
1.ª ocasión^ |
Suspender permanentemente el tratamiento o interrumpirlo hasta la resolución: grado 0-1 |
Reducir la dosis a 480 mg 2 v/d |
|
2.ª ocasión^ |
Suspender permanentemente el tratamiento |
No procede |
|
* La intensidad de los eventos adversos clínicos se clasifica conforme a la versión 4.0 de los criterios terminológicos comunes de los eventos adversos (CTC-AE) ^ Cualquier reacción adversa en la que la interrupción del tratamiento y la reducción de la dosis están indicadas desde el punto de vista clínico y se llevan a cabo. |
||
|
Tabla 2. Pauta de modificación de la dosis dependiendo de la prolongación del intervalo QT |
|
|
Valor de QTc |
Ajuste posológico |
|
QTc inicial >500 ms |
No se recomienda el tratamiento. |
|
El QTc aumenta hasta alcanzar valores >500 ms además de un cambio >60 ms respecto al valor previo al tratamiento |
Suspender definitivamente el tratamiento. |
|
1.ª aparición de un QTc >500 ms durante el tratamiento y el cambio respecto al valor previo al tratamiento sigue siendo ≤60 ms |
Suspender temporalmente el tratamiento hasta que el QTc disminuya hasta valores <500 ms Véanse las medidas de vigilancia en Advertencias y precauciones generales. Reducir la dosis en 240 mg 2 v/d |
|
2.ª aparición de un QTc >500 ms durante el tratamiento y el cambio respecto al valor previo al tratamiento sigue siendo ≤60 ms |
Suspender temporalmente el tratamiento hasta que el QTc disminuya hasta valores <500 ms Véanse las medidas de vigilancia en Advertencias y precauciones generales. Reducir la dosis en 240 mg 2 v/d |
|
3.ª aparición de un QTc >500 ms durante el tratamiento y el cambio respecto al valor previo al tratamiento sigue siendo ≤60 ms |
Suspender definitivamente el tratamiento. |
Uso en poblaciones especiales
Mujeres y hombres en edad de procrear
Fecundidad: no se han realizado estudios preclínicos sobre la fecundidad (ver Trastornos de la fecundidad). En los estudios toxicológicos con dosis repetidas no se detectaron alteraciones histopatológicas en los órganos sexuales de machos y hembras (ver Toxicidad para la función reproductora).
Anticoncepción: se recomienda que las mujeres y los hombres en edad de procrear utilicen medidas anticonceptivas adecuadas durante el tratamiento con vemurafenib y hasta al menos 6 meses después de concluir su administración.
Embarazo: no debe administrarse el vemurafenib a mujeres embarazadas, salvo que los posibles beneficios para la madre sean superiores al riesgo para el feto.
No se han realizado estudios en embarazadas, aunque se ha notificado un caso en el que el vemurafenib pasó al feto a través de la placenta. Teniendo en cuenta su mecanismo de acción, el vemurafenib puede causar daños fetales cuando se administra a embarazadas. No se revelaron signos de teratogenicidad del vemurafenib en embriones o fetos de ratas en estudios en animales (ver Toxicidad para la función reproductora).
Parto: no se ha estudiado la seguridad del vemurafenib durante el parto.
Lactancia: no se sabe si el vemurafenib se excreta en la leche materna humana. No se puede descartar que exista un riesgo para los recién nacidos y los lactantes. A la hora de decidir si se debe suspender la lactancia materna o el tratamiento con vemurafenib, se tendrá en cuenta la importancia de la lactancia materna para el niño y el beneficio del tratamiento para la madre.
Uso en pediatría: no se han determinado la seguridad ni la eficacia del vemurafenib en menores de 18 años.
Uso en geriatría: noventa y cuatro de los 336 (28 %) pacientes con melanoma metastásico o irresecable tratados con vemurafenib en el estudio de fase III tenían 65 o más años de edad. Los pacientes ancianos (≥65 años) pueden ser más propensos a sufrir eventos adversos, incluidos el CCEC, la disminución del apetito y trastornos cardiacos. Los efectos del vemurafenib en la supervivencia global, la supervivencia sin progresión y la tasa de mejor respuesta global fueron similares en los pacientes ancianos y en pacientes más jóvenes (ver Farmacocinética en poblaciones especiales).
Sexo: los eventos adversos de grado 3 notificados con más frecuencia en las mujeres que en los hombres fueron el exantema, las artralgias y la fotosensibilidad (ver Farmacocinética en poblaciones especiales).
Insuficiencia renal: los datos sobre pacientes con insuficiencia renal son limitados. No se puede excluir el riesgo de una exposición elevada en pacientes con insuficiencia renal grave (ver Pautas posológicas especiales y Farmacocinética en poblaciones especiales).
Insuficiencia hepática: los datos sobre pacientes con insuficiencia hepática son limitados. Dado el aclaramien-to hepático del vemurafenib, no se puede descartar el riesgo de una exposición elevada en pacientes con insuficiencia hepática grave (ver Pautas posológicas especiales y Farmacocinética en poblaciones especiales).
Vía de administración: Oral.
Declaración de esterilidad/radiactividad: no procede.
Sobredosis: No existe ningún antídoto específico en caso de sobredosis de vemurafenib. Los pacientes que presenten reacciones adversas deben recibir el tratamiento sintomático adecuado. Entre las reacciones adversas limitantes de la dosis de vemurafenib se encuentran el exantema con prurito y la fatiga. Si se sospecha una sobredosis, se suspenderá la administración de vemurafenib y se instaurará el tratamiento sintomático adecuado.
DESCRIPCIÓN
Clase terapéutica o farmacológica del fármaco: el vemurafenib es una molécula de baja masa molecular que inhibe selectivamente las serina-treonina cinasas BRAF oncogénicas.
Código ATC: L01XE15.
Presentación Comercial: Caja de cartón x 7 blísteres x 8 comprimidos recubiertos c/u + inserto.
Información de abril de 2017.
Fabricado para F. Hoffmann- La Roche S.A Basilea, Suiza por Roche S.P.A. Segrate, Italia.
Medicamento: manténgase fuera del alcance de los niños.
ROCHE ECUADOR S.A.
Casilla 1711- 06185 CCI
Quito - Ecuador