
RIVAZIC
RIVASTIGMINA
Parches de liberación transdérmica
1 Envase(s), 30 Parche transdérmico, 4,6 mg
1 Envase(s), 30 Parches de liberación transdérmica, 9,5 mg
1 Envase(s), 30 Parches de liberación transdérmica, 13.3 mg
COMPOSICIÓN:
Fórmula
Cada PARCHE TRANSDÉRMICO DE LIBERACIÓn de 4,6 mg/24 hs contiene
Rivastigmina 6,84 mg
Excipientes: Ácido clorhídrico, Trietilcitrato, Polímero acrílico, Etilcelulosa 7 cPs, lámina de poliéster – polietileno, lámina de poliéster siliconada.
Cada PARCHE TRANSDÉRMICO DE LIBERACIÓN de 9,5 mg/24 hs contiene
Rivastigmina 13,68 mg
Excipientes: Ácido clorhídrico, Trietilcitrato, Polímero acrílico, Etilcelulosa 7 cPs, lámina de poliéster – polietileno, lámina de poliéster siliconada.
Cada PARCHE TRANSDÉRMICO DE LIBERACIÓN de 13,3 mg/24 hs contiene
Rivastigmina 20,52 mg
Excipientes: Ácido clorhídrico, Trietilcitrato, Polímero acrílico, Etilcelulosa 7 cPs, lámina de poliéster – polietileno, lámina de poliéster siliconada.
INDICACIONES TERAPÉUTICAS:
Indicaciones
Demencia leve a moderada de tipo Alzheimer.
Demencia leve a moderada asociada a la enfermedad de Parkinson.
MECANISMO DE ACCIÓN:
Acción terapéutica
Psicoanaléptico antidemencial.
Anticolinesterásico.
Clasificación ATC: N06DA03.
Características farmacológicas
Mecanismo de acción: Aunque se desconoce el mecanismo de acción preciso de rivastigmina, se cree que ejerce su efecto terapéutico al mejorar la función colinérgica. Esto se logra aumentando la concentración de acetilcolina a través de la inhibición reversible de su hidrólisis por la enzima colinesterasa. El efecto de rivastigmina puede disminuir a medida que avanza el proceso de la enfermedad y menos neuronas colinérgicas permanecen funcionalmente intactas. No hay evidencia de que rivastigmina altere el curso del proceso de demencia subyacente.
Farmacodinamia: Después de una dosis oral de rivastigmina de 6 mg en humanos, la actividad anticolinesterasa está presente en el líquido cefalorraquídeo durante aproximadamente 10 horas, con una inhibición máxima de aproximadamente, el 60% 5 horas después de la administración.
Los estudios in vitro e in vivo demuestran que la inhibición de la colinesterasa por rivastigmina no se ve afectada por la administración concomitante de memantina, un antagonista del receptor de N-metil-D-aspartato. Farmacocinética
Absorción: Después de la aplicación inicial del parche de rivastigmina, existe un tiempo de retraso de 0,5 a 1 hora en su absorción. Las concentraciones luego aumentan lentamente, generalmente alcanzando un máximo después de 8 horas, aunque los valores máximos (Cmáx) también pueden ocurrir más tarde (de 10 a 16 horas). Después del pico, las concentraciones plasmáticas disminuyen lentamente durante el resto del período de aplicación de 24 horas. En estado estacionario, los niveles mínimos son aproximadamente del 60% al 80% de los niveles máximos.
Un parche de 9.5 mg/24 horas da una exposición aproximadamente igual a la proporcionada por una dosis oral de 6 mg dos veces al día (es decir, 12 mg/día). La variabilidad interindividual en la exposición es menor (43% a 49%) para la formulación transdérmica en comparación con las formulaciones orales (73% a 103%). La fluctuación (entre la Cmáx y la Cmín) es menor para los parches que para la formulación oral de rivastigmina.
Durante una aplicación dérmica de 24 horas, aproximadamente, el 50% del contenido de fármaco del parche se libera del sistema.
El área de exposición bajo la curva de concentración plasmática desde el tiempo cero hasta el infinito (AUC0-∞) de rivastigmina (y el metabolito NAP266-90) es mayor cuando el parche se aplica en la parte superior de la espalda, el pecho o la parte superior del brazo. Se podrían usar otros dos sitios (abdomen y muslo) si ninguno de los otros 3 sitios está disponible, pero el profesional debe saber que la exposición a rivastigmina en plasma asociada con estos sitios es aproximadamente de un 20% a un 30% menor.
No hubo acumulación relevante de rivastigmina o del metabolito NAP226-90 en plasma en pacientes con enfermedad de Alzheimer con dosis diarias.
El perfil farmacocinético de los parches transdérmicos de rivastigmina es comparable en pacientes con enfermedad de Alzheimer y en pacientes con demencia asociada a la enfermedad de Parkinson.
Distribución: Rivastigmina se une débilmente a las proteínas plasmáticas (aproximadamente, el 40%) en el rango terapéutico. Atraviesa fácilmente barrera hematoencefálica, alcanzando concentraciones máximas en el LCR en 1,4 a 2,6 horas. El rango del volumen aparente de distribución es de 1,8 a 2,7 l/kg.
Metabolismo: Rivastigmina se metaboliza en gran medida principalmente, a través de la hidrólisis mediada por colinesterasas en el metabolito descarbamilado NAP226-90. In vitro, este metabolito muestra una inhibición mínima de la acetilcolinesterasa (menos del 10%).
Basado en la evidencia de estudios in vitro y en animales, las principales isoenzimas del citocromo P450 están mínimamente involucradas en el metabolismo de rivastigmina
La proporción de AUC0-∞ entre el metabolito y el fármaco sin metabolizar es aproximadamente 0,7 después de la aplicación del parche versus 3,5 después de la administración oral, lo que indica que se produce mucho menos metabolismo después del tratamiento dérmico. Se forma menos NAP226-90 después de la aplicación del parche, probablemente debido a la falta de metabolismo presistémico (primer paso hepático). Sobre la base de estudios in vitro, no se detectaron rutas metabólicas únicas en la piel humana.
Eliminación: La excreción renal de los metabolitos es la principal vía de eliminación. La rivastigmina sin cambios se encuentra en cantidades mínimas en la orina. Después de la administración de 14C-rivastigmina, la eliminación renal es rápida y esencialmente completa (más del 90%) en 24 horas. Menos del 1% de la dosis administrada se excreta en las heces. La vida media de eliminación aparente en el plasma es de aproximadamente 3 horas después de la eliminación del parche. El aclaramiento renal es de aproximadamente 2,1 a 2,8 l/h.
Peso corporal: La exposición a la rivastigmina es mayor en sujetos con bajo peso corporal. En comparación con un paciente con un peso corporal de 65 kg, las concentraciones de rivastigmina en estado estacionario en un paciente con un peso corporal de 35 kg se duplicarían aproximadamente, mientras que para un paciente con un peso corporal de 100 kg, las concentraciones se reducirían aproximadamente a la mitad.
Insuficiencia hepática: Después de una dosis única de 3 mg, el aclaramiento oral promedio de rivastigmina es 60% menor en pacientes con insuficiencia hepática que en sujetos sanos. Después de una dosis oral de 6 mg dos veces al día, el aclaramiento promedio de rivastigmina es 65% más bajo en pacientes con insuficiencia hepática leve (Child-Pugh 5 a 6) y moderada (Child-Pugh 7 a 9) que en sujetos sanos.
Tabaquismo: Después de la administración oral de rivastigmina (hasta 12 mg/día) junto con nicotina, el análisis farmacocinético poblacional mostró un aumento del aclaramiento oral de rivastigmina en un 23%.
CONTRAINDICACIONES:
El uso de este producto está contraindicado en pacientes con conocida hipersensibilidad a la rivastigmina, a otros derivados del carbamato o a cualquier excipiente de la fórmula.
Historia previa de reacciones en el sitio de aplicación, como dermatitis alérgica de contacto con rivastigmina a través del parche transdérmico.
Se han descrito casos aislados de reacciones cutáneas generalizadas en la experiencia posterior a la comercialización.
REACCIONES ADVERSAS:
En base a la información disponible y de dominio público, a continuación en la Tabla 2 se enumeran las reacciones adversas que se produjeron con una frecuencia ≥ 2%, en estudios clínicos con rivastigmina parches en pacientes con demencia asociada a la enfermedad de Alzheimer y a la enfermedad de Parkinson.
|
Tabla 2: Reacciones adversas asociadas al uso de rivastigmina. |
|
|
Trastornos psiquiátricos |
Depresión* |
|
Insomnio* |
|
|
Ansiedad* |
|
|
Agitación* |
|
|
Hiperactividad psicomotora |
|
|
Agresión |
|
|
Alucinaciones* |
|
|
Alucinaciones visuales |
|
|
Trastornos del sistema nervioso |
Cefalea |
|
Mareo |
|
|
Temblor |
|
|
Somnolencia |
|
|
Hipocinesia |
|
|
Bradicinesia |
|
|
Rigidez de la rueda dentada |
|
|
Discinesia |
|
|
Vértigo |
|
|
Trastornos gastrointestinales |
Náuseas* |
|
Vómitos* |
|
|
Diarrea* |
|
|
Dolor abdominal |
|
|
Dolor abdominal superior |
|
|
Trastornos vasculares |
Hipertensión |
|
Trastornos generales y del sitio de aplicación |
Caídas* |
|
Eritema sitio de aplicación* |
|
|
Prurito en el sitio de aplicación |
|
|
Astenia |
|
|
Fatiga |
|
|
Trastornos renales y urinarios |
Infección del tracto urinario* |
|
Incontinencia urinaria |
|
|
Trastornos del metabolismo |
Anorexia / Disminución del apetito* |
|
Disminución de peso*# |
|
|
* Reacciones adversas con una frecuencia >5% # No está claro qué parte de la pérdida de peso se asocia con la anorexia, las náuseas, los vómitos y la diarrea asociada con el medicamento. |
|
En pacientes con demencia asociada con la enfermedad de Parkinson, las siguientes reacciones adversas solo se han observado en ensayos clínicos con rivastigmina por vía oral:
Frecuentes (se producen en al menos 1/100 pacientes): Náuseas, vómitos, disminución del apetito, inquietud, empeoramiento de la enfermedad de Parkinson, bradicardia, diarrea, dispepsia, hipersecreción salival, aumento de la sudoración.
Poco frecuentes (se producen entre 1/100 y 1/1000 pacientes): Distonía, fibrilación auricular, bloqueo auriculoventricular.
Experiencia postcomercialización: Las siguientes reacciones adversas se identificaron durante el uso posterior a la aprobación de rivastigmina en todas sus formas farmacéuticas (oral y transdérmica), aunque no es posible estimar de forma confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- Trastornos cardíacos: Taquicardia.
- Trastornos hepatobiliares: Pruebas de función hepática anormales, hepatitis.
- Trastornos del sistema nervioso: Enfermedad de Parkinson (empeoramiento), convulsiones, temblor.
- Trastornos psiquiátricos: Pesadillas.
- Trastornos de la piel y del tejido subcutáneo: Dermatitis alérgica, hipersensibilidad en el lugar de aplicación, ampollas, dermatitis alérgica diseminada, síndrome de Stevens-Johnson, urticaria
- Trastornos vasculares: Hipertensión.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones
Efecto de rivastigmina en el metabolismo de otras drogas: Rivastigmina se metaboliza principalmente a través de la hidrólisis por las esterasas. A través de las principales isoenzimas del citocromo P450 se produce un metabolismo mínimo.
Sobre la base de estudios in vitro, no se esperan interacciones farmacocinéticas de rivastigmina con fármacos metabolizados por las isoenzimas: CYP1A2, CYP2D6, CYP3A4/5, CYP2E1, CYP2C9, CYP2C8, CYP2C19 o CYP2B6.
No se observaron interacciones farmacocinéticas entre rivastigmina vía oral y digoxina, warfarina, diazepam o fluoxetina en voluntarios sanos. El aumento del tiempo de protrombina inducido por warfarina no se ve afectado por la administración de rivastigmina.
Efecto de otras drogas en el metabolismo de rivastigmina: No se espera que los fármacos que inducen o inhiben el metabolismo de CYP450 alteren el metabolismo de la rivastigmina.
Un análisis farmacocinético de la población mostró que la farmacocinética de rivastigmina tomada por vía oral no estaba influenciada por los medicamentos comúnmente recetados, como: antiácidos, antihipertensivos, beta bloqueantes, bloqueantes de los canales de calcio, antidiabéticos, antiinflamatorios no esteroideos, estrógenos, analgésicos salicilatos, antianginosos y antihistamínicos.
Metoclopramida: Debido al riesgo de potenciación de las reacciones adversas extrapiramidales, no se recomienda el uso concomitante de metoclopramida y rivastigmina.
Medicamentos colinomiméticos y anticolinérgicos: Rivastigmina puede aumentar los efectos colinérgicos de otros medicamentos colinomiméticos y también puede interferir con la actividad de los medicamentos anticolinérgicos (por ejemplo, oxibutinina, tolterodina). No se recomienda el uso concomitante de rivastigmina con medicamentos que tengan estos efectos farmacológicos a menos que se considere clínicamente necesario.
Beta bloqueantes: Puede ocurrir potenciación de efectos como bradicardia y síncope cuando rivastigmina se usa concomitantemente con beta bloqueantes, especialmente los beta bloqueantes cardioselectivos (incluido atenolol). No se recomienda el uso concomitante cuando hay signos de bradicardia, incluyendo síncope.
RECOMENDACIONES:
Advertencias
Errores en la dosificación que producen sobredosis: El mal uso del medicamento y errores en la dosificación han llevado a reacciones adversas graves, algunos casos han requerido hospitalización, y raramente pueden tener consecuencias fatales. La mayoría de los casos de mal uso del medicamento y errores en la dosificación estaban relacionados con no retirar el parche viejo cuando se aplicaba el nuevo y el uso de múltiples parches al mismo tiempo. Se debe instruir a los pacientes y a sus cuidadores de las importantes instrucciones de administración de los parches transdérmicos.
Trastornos gastrointestinales: Rivastigmina puede causar reacciones adversas gastrointestinales, como náuseas significativas, vómitos, diarrea, anorexia/disminución del apetito y pérdida de peso. La deshidratación puede resultar de vómitos prolongados o diarrea y puede asociarse con resultados graves. La incidencia y gravedad de estas reacciones están relacionadas con la dosis. Por este motivo, se debe iniciar el tratamiento con rivastigmina a una dosis de 4,6 mg/24 horas y ajustar a una dosis de 9,5 mg/24 horas y luego a una dosis de 13,3 mg/24 horas, si corresponde.
Si se interrumpe el tratamiento durante más de 3 días debido a intolerancia, se debe reiniciar con la dosis de 4,6 mg/24 horas para reducir la posibilidad de vómitos intensos y sus posibles secuelas.
Un informe posterior a la comercialización describió un caso de vómitos graves con rotura esofágica después de un reinicio inadecuado del tratamiento de una formulación oral de rivastigmina sin retitulación después de 8 semanas de interrupción del tratamiento.
Los cuidadores deben estar atentos y controlar si aparecen reacciones adversas gastrointestinales e informar al médico si ocurren.
Es fundamental informar a los cuidadores que si la terapia se ha interrumpido durante más de 3 días debido a la intolerancia, no se debe administrar la siguiente dosis sin contactar al médico para realizar una correcta valoración.
Reacciones cutáneas: Con el uso de los parches de rivastigmina pueden ocurrir reacciones cutáneas en el sitio de aplicación. Estas reacciones no son en sí mismas una indicación de sensibilización. Sin embargo, el uso del parche de rivastigmina puede provocar dermatitis alérgica de contacto.
Se debe sospechar dermatitis alérgica por contacto si las reacciones en el lugar de aplicación se extienden más allá del tamaño del parche, si hay evidencia de una reacción local más intensa (por ejemplo, aumento del eritema, edema, pápulas, vesículas) y si los síntomas no mejoran significativamente dentro de las 48 horas posteriores a la remoción del parche. En estos casos, el tratamiento debe interrumpirse.
En pacientes que desarrollen reacciones en el lugar de la aplicación, sugestivas de dermatitis alérgica de contacto y que aún requieren rivastigmina, el tratamiento debe cambiarse a rivastigmina oral solo después de que los resultados de las pruebas de alergia den negativas y bajo supervisión médica cercana. Es posible que algunos pacientes sensibilizados a la rivastigmina por la exposición al parche no puedan tomar rivastigmina de ninguna forma.Ha habido informes aislados posteriores a la comercialización de pacientes que experimentaron dermatitis alérgica diseminada cuando recibieron rivastigmina independientemente de la vía de administración (oral o transdérmica). En estos casos, el tratamiento debe interrumpirse. Los pacientes y cuidadores deben ser instruidos en consecuencia. Otras reacciones adversas del aumento de la actividad colinérgica:
Efectos neurológicos
Síntomas extrapiramidales: Los colinomiméticos, incluyendo rivastigmina, pueden exacerbar o inducir síntomas extrapiramidales. Se ha observado un empeoramiento de los síntomas parkinsonianos, particularmente temblor, en pacientes con demencia asociada con la enfermedad de Parkinson que fueron tratados con cápsulas rivastigmina.
Convulsiones: Se cree que los fármacos que aumentan la actividad colinérgica tienen algún potencial para causar convulsiones. Sin embargo, la actividad convulsiva también puede ser una manifestación de la enfermedad de Alzheimer.
Úlcera péptica/hemorragia gastrointestinal: Los inhibidores de la enzima colinesterasa, incluyendo rivastigmina, pueden aumentar la secreción de ácido gástrico debido al aumento de la actividad colinérgica. Se debe supervisar a los pacientes que usan rivastigmina para detectar síntomas de sangrado gastrointestinal activo u oculto, especialmente aquellos con mayor riesgo de desarrollar úlceras, por ejemplo, aquellos con antecedentes de enfermedad ulcerativa o aquellos que reciben fármacos Antiinflamatorios No Esteroideos (AINEs) concurrentes. Los estudios clínicos con rivastigmina no han mostrado ningún aumento significativo, con respecto al placebo, en la incidencia de úlcera péptica o sangrado gastrointestinal.
Uso con anestesia: Es probable que rivastigmina, como inhibidor de la colinesterasa, potencie la relajación muscular de la succinilcolina durante la anestesia. Efectos de conducción cardíaca: Debido a que rivastigmina aumenta la actividad colinérgica, su uso puede tener efectos vagotónicos sobre la frecuencia cardíaca (por ejemplo, bradicardia). El potencial de esta acción puede ser particularmente importante en pacientes con síndrome del seno enfermo u otras condiciones supraventriculares de conducción cardíaca. En los ensayos clínicos, rivastigmina no se asoció con ningún aumento en la incidencia de eventos adversos cardiovasculares, cambios en la frecuencia cardíaca o la presión arterial o anomalías en el electrocardiograma (ECG).
Efectos genitourinarios: Aunque no se observaron en ensayos clínicos con rivastigmina, los fármacos que aumentan la actividad colinérgica pueden causar obstrucción urinaria.
Efectos pulmonares: Los medicamentos que aumentan la actividad colinérgica, incluyendo rivastigmina, deben usarse con cuidado en pacientes con antecedentes de asma o enfermedad pulmonar obstructiva.
Alteraciones en la conducción o uso de maquinaria: La demencia puede causar un deterioro gradual del rendimiento de la conducción o comprometer la capacidad para utilizar maquinaria. La administración de rivastigmina también puede provocar reacciones adversas que son perjudiciales para estas funciones. Durante el tratamiento con rivastigmina, evalúe de forma rutinaria la capacidad del paciente para continuar conduciendo u operando maquinaria.
Precauciones
Uso pediátrico: No se ha establecido la seguridad y la eficacia en pacientes pediátricos. No se recomienda el uso de rivastigmina en pacientes pediátricos (menores de 18 años).
Uso geriátrico: No se observaron diferencias generales en la seguridad o la eficacia entre pacientes mayores de 65 años y pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
Insuficiencia hepática: Con el uso de rivastigmina oral se observó un aumento de la exposición a rivastigmina en pacientes con insuficiencia hepática leve o moderada. Los pacientes con insuficiencia hepática leve o moderada pueden tolerar solo dosis más bajas. En estos pacientes se debe considerar el uso de los parches transdérmicos de 4,6 mg/24 h tanto como dosis inicial como dosis máxima.
Los pacientes con disfunción hepática clínicamente significativa pueden presentar más reacciones adversas. Se debe tener especial cuidado con los mismos.
No hay datos disponibles sobre el uso de rivastigmina en pacientes con insuficiencia hepática grave.
Peso corporal bajo o alto: Los pacientes con peso corporal inferior a 50 kg pueden experimentar más reacciones adversas y pueden ser más propensos a interrumpir el tratamiento debido a estos eventos. Se debe titular y monitorizar cuidadosamente a estos pacientes de reacciones adversas (p. ej. náuseas o vómitos excesivos) y si aparecen estos efectos adversos considerar la reducción de la dosis de mantenimiento al parche transdérmico de 4,6 mg/24 h.
Debido a que los niveles en sangre de rivastigmina varían con el peso, se debe realizar una titulación y monitoreo cuidadosos en pacientes con peso corporal alto. Embarazo: No hay datos adecuados sobre los riesgos de desarrollo asociados con el uso de rivastigmina en mujeres embarazadas.
En animales, no se observaron efectos adversos sobre el desarrollo embrio-fetal en dosis orales de 2 a 4 veces la Dosis Máxima Recomendada en Humanos (MRHD).
Rivastigmina debe ser utilizada en mujeres embarazadas sólo si el beneficio potencial supera el posible riesgo para el feto.
Lactancia: No hay datos sobre la presencia de rivastigmina en la leche materna, los efectos en el lactante amamantado o los efectos de rivastigmina en la producción de leche.
Rivastigmina y sus metabolitos se excretan en la leche de rata después de la administración oral de rivastigmina; los niveles de rivastigmina más metabolitos en la leche de rata son aproximadamente 2 veces más altos que en el plasma materno.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de recibir rivastigmina y cualquier posible efecto adverso sobre el lactante amamantado, ya sea por rivastigmina o por la afección materna subyacente.
Carcinogénesis, mutagénesis, y alteraciones de la fertilidad
Carcinogénesis: En estudios de carcinogenicidad oral realizados a dosis de hasta 1,1 mg/kg/día en ratas y 1,6 mg/kg/día en ratones, rivastigmina no fue carcinogénica.
En un estudio de carcinogenicidad dérmica realizado con dosis de hasta 0,75 mg/kg/día en ratones, rivastigmina no fue carcinógena. La exposición media a rivastigmina en plasma (AUC) a esta dosis fue menor que en los humanos a la dosis máxima recomendada en humanos (13,3 mg/24 horas).
Mutagénesis: Rivastigmina fue clastogénica en ensayos de aberración cromosómica in vitro en células de mamíferos en presencia, pero no en ausencia, de activación metabólica. Rivastigmina fue negativa en el ensayo de mutación inversa bacteriana in vitro (Ames), el ensayo de HGPRT in vitro y en la prueba de micronúcleo de ratón in vivo.
Trastornos de la fertilidad: No se han realizado estudios de fertilidad o reproducción con rivastigmina en parches en animales. Rivastigmina no tuvo efecto sobre la fertilidad o el rendimiento reproductivo en ratas con dosis orales de hasta 1,1 mg/kg/día.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología, dosificación y modo de administración
|
Tamaño del parche |
Contenido de Rivastigmina |
Liberación de Rivastigmina en 24 horas |
|
3,8 cm2 |
6,84 mg |
4,6 mg |
|
7,6 cm2 |
13,68 mg |
9,5 mg |
|
11,4 cm2 |
20,52 mg |
13,3 mg |
Dosis inicial: Iniciar el tratamiento con un parche de RIVAZIC® de 4,6 mg/24 horas aplicado a la piel una vez al día.
Titulación de la dosis: Aumente la dosis solo después de un mínimo de 4 semanas con la dosis anterior, y solo si la dosis anterior ha sido tolerada. Para pacientes con demencia asociada a Alzheimer y enfermedad de Parkinson leves a moderados, continúe con la dosis efectiva de 9,5 mg/24 horas mientras persista el beneficio terapéutico. Luego, los pacientes pueden aumentar hasta la dosis máxima efectiva de 13,3 mg/24 horas.
Para pacientes con demencia asociada a Alzheimer grave, la dosis efectiva es 13,3 mg/24 horas. Las dosis superiores a 13,3 mg/24 horas no confieren un beneficio adicional apreciable y se asocian con un aumento en la incidencia de reacciones adversas.
Demencia asociada a Alzheimer y enfermedad Parkinson leve a moderada: La dosis efectiva de RIVAZIC® es de 9,5 mg/24 horas o 13,3 mg/24 horas administrada una vez al día.
Reemplace con un parche nuevo cada 24 horas.
Demencia asociada a Alzheimer grave: La dosis efectiva de RIVAZIC® es de 13,3 mg/24 horas administrada una vez al día.
Reemplace con un parche nuevo cada 24 horas.
Interrupción del tratamiento
- Si se interrumpe la dosificación durante 3 días o menos, reinicie el tratamiento con RIVAZIC® de igual o menor concentración a la utilizada.
- Si se interrumpe la dosificación durante más de 3 días, reinicie el tratamiento con RIVAZIC® de 4,6 mg/ 4 horas y la titulación como se describe anteriormente.
Dosificación en poblaciones específicas
Pacientes con insuficiencia hepática: Considere usar RIVAZIC® de 4,6 mg/24 horas como la dosis inicial y de mantenimiento en pacientes con insuficiencia hepática leve (puntuación de Child-Pugh 5 a 6) a moderada (puntuación de Child-Pugh de 7 a 9).
Pacientes con bajo peso corporal: Titule y monitoree cuidadosamente a los pacientes con bajo peso corporal (menos de 50 kg) para detectar toxicidades (p. ej., náuseas excesivas, vómitos) y considere la posibilidad de reducir la dosis de mantenimiento a 4,6 mg/24 horas si se desarrollan tales toxicidades.
Cambio de rivastigmina oral a RIVAZIC® parches: Los pacientes tratados con rivastigmina por vía oral pueden rotar el tratamiento a RIVAZIC® parches de la siguiente manera:
- Si el paciente recibe una dosis diaria total de menos de 6 mg de rivastigmina oral puede cambiarse al parche de RIVAZIC® de 4,6 mg/24 horas.
- Si el paciente recibe una dosis diaria total de 6 mg a 12 mg de rivastigmina oral puede cambiarse al parche de RIVAZIC® de 9,5 mg / 24 horas.
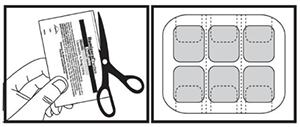
Indique a los pacientes o cuidadores que se apliquen el primer parche el día siguiente a la última dosis oral. Forma de aplicación: Los parches de RIVAZIC® son de plástico fino y opaco y se pegan a la piel. Los parches se encuentran en un sobre protector, en planchas de a seis. Solo se debe abrir el sobre cuando vaya a ponerse un parche. No despegue el parche hasta el momento de ponérselo. Para abrirlo, cortar el sobre a lo largo de la línea de puntos con unas tijeras.
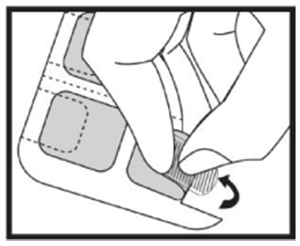
Antes de aplicar un parche, asegurar que la piel esté limpia, seca y sin pelo, sin polvos, aceite, hidratante o loción que impidan que el parche se pegue bien a la piel, sin cortes, enrojecimientos o irritaciones.
Quitar uno de los parches de la plancha, sin tocar con los dedos el lado adhesivo del parche, tomándolo del lado del parche que queda con la lámina plástica adherida. Y vuelva a guardar la plancha con los parches restantes en el sobre, hasta su nuevo uso.
Colocar el lado adhesivo del parche sobre la parte superior o inferior de la espalda o en la parte superior del brazo o en el pecho (evitando los senos en mujeres).Ver a continuación dónde colocar su RIVAZIC® PARCHES.
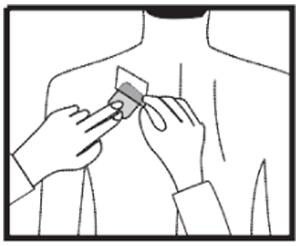
Despegar la lámina plástica que quedó adherida al parche y presione firmemente el parche contra la piel con la palma de la mano durante un mínimo de 30 segundos y asegúrese de que los bordes se han pegado bien. Si esto le ayuda, puede escribir sobre el parche, por ejemplo, el día de la semana, con un bolígrafo de punta fina redondeada.
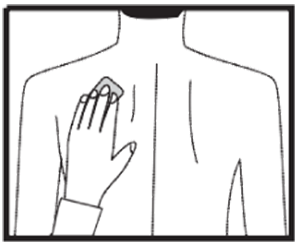
Debe llevar puesto el parche continuamente hasta el momento de cambiarlo por otro nuevo. Vuelva a guardar la plancha sobrante en el sobre, hasta su nuevo uso. Cuando se ponga un nuevo parche, puede probar con diferentes zonas para encontrar las que le resulten más cómodas y donde la ropa no roce con el parche.
Se debe instruir a los pacientes y cuidadores de las importantes instrucciones de administración:
- Quitar cuidadosamente cualquier parche que lleve antes de ponerse uno nuevo. El llevar múltiples parches en su cuerpo podría exponerlo a una cantidad excesiva de este medicamento y esto podría ser potencialmente peligroso.
- Poner solo UN parche al día en UNA SOLA de las posibles zonas como se muestra en los siguientes diagramas:
- Parte superior izquierda o parte superior derecha del brazo.
- Parte superior izquierda o parte superior derecha del pecho (evitando los senos en mujeres).
- Parte superior izquierda o parte superior derecha de la espalda.
- Parte inferior izquierda o parte inferior derecha de la espalda
- Cada vez que se cambie el parche, debe quitarse el parche del día anterior antes de ponerse el nuevo parche en un lugar diferente de la piel (por ejemplo un día en el lado derecho del cuerpo y al día siguiente en el lado izquierdo; o un día en la parte superior del cuerpo y al día siguiente en la parte inferior). Esperar al menos 14 días para volver a ponerse un parche nuevo exactamente en la misma área de piel.
- Si el parche se desprende, se debe aplicar uno nuevo durante el resto del día, y debe ser reemplazado a la hora habitual el siguiente día.
- El parche puede utilizarse en todas las situaciones cotidianas, incluso durante el baño o épocas calurosas.
- El parche no se debe exponer a ninguna fuente externa de calor (p.ej. excesiva luz solar, saunas, solario) durante un período de tiempo largo.
- El parche no debe cortarse en trozos.
- Cada 24 horas quitar el parche previo antes de ponerse UN parche nuevo en SOLO UNA de las siguientes zonas posibles.
Cómo quitar RIVAZIC® parches: Tirar suavemente de uno de los bordes del parche para despegarlo lentamente de la piel. Si quedan residuos adhesivos sobre la piel, empape el área con agua tibia y jabón suave o utilice aceite de bebé para eliminarlo. No se debe utilizar alcohol u otros líquidos disolventes (quitaesmaltes de uñas u otros disolventes).
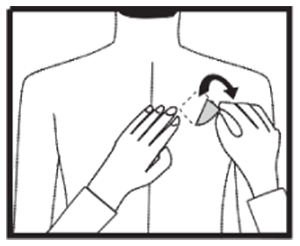
Después de retirar el parche las manos se deben lavar con jabón o agua. En caso de contacto con los ojos o si los ojos se enrojecen después de manipular el parche, se debe lavar inmediatamente con abundante agua y pedir consejo médico si los síntomas no se resuelven.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosificación: Se han informado casos de sobredosis con los parches de rivastigmina, que se han producido por la aplicación de más de un parche a la vez y por no eliminar el parche del día anterior antes de aplicar un parche nuevo. Los síntomas informados en estos casos de sobredosis son similares a los observados en casos de sobredosis asociados con formulaciones orales de rivastigmina.
Como rivastigmina tiene una vida media plasmática de aproximadamente 3,4 horas después de la administración del parche y una inhibición de la acetilcolinesterasa de aproximadamente 9 horas, se recomienda que, en casos de sobredosis asintomática, el parche se retire inmediatamente y no se aplique ningún otro parche para próximas 24 horas.
Como en cualquier caso de sobredosis, deben utilizarse medidas de apoyo generales.
La sobredosis con inhibidores de la colinesterasa puede provocar una crisis colinérgica caracterizada por: náuseas, vómitos, salivación, sudoración, bradicardia, hipotensión, depresión respiratoria y convulsiones.
El aumento de la debilidad muscular es una posibilidad y puede causar la muerte si los músculos respiratorios están involucrados. Se han notificado respuestas atípicas en la presión arterial y la frecuencia cardíaca con otros fármacos que aumentan la actividad colinérgica cuando se administran conjuntamente con anticolinérgicos cuaternarios como el glicopirrolato.
Los síntomas adicionales asociados con la sobredosis de rivastigmina son: diarrea, dolor abdominal, mareos, temblor, dolor de cabeza, somnolencia, confusión, hiperhidrosis, hipertensión, alucinaciones y malestar general.
Debido a la corta vida media de eliminación de rivastigmina en plasma después de la administración del parche, la diálisis (hemodiálisis, diálisis peritoneal o hemofiltración) no estaría clínicamente indicada en caso de sobredosis.
En una sobredosis acompañada de náuseas y vómitos graves, se debe considerar el uso de antieméticos. Rara vez se ha informado un desenlace fatal con una sobredosis de rivastigmina.
Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano.
PRESENTACIÓN:
Envases conteniendo 30 parches transdérmicos + Inserto.
MEDICAMENTA
Casilla 17-21-027
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Conservación: Almacenar a temperatura no mayor de 30º C.
LEYENDAS DE PROTECCIÓN:
Todo medicamento debe mantenerse fuera del alcance de los niños.