NASONEX
FUROATO DE MOMETASONA
Spray nasal acuoso
1 Caja, 1 Frasco con Normal Spray, 18 g, 0,5 mg/g
COMPOSICIÓN:
Forma farmacéutica y formulación: Spray nasal acuoso
Cada SPRAY contiene:
Furoato de mometasona monohidrato 0.5 mg/g de furoato de mometasona
Excipiente: Celulosa dispersable BP 65 cps (celulosa microcristalina y carmelosa d e
sodio), glicerol, citrato sódico dihidratado, ácido cítrico monohidratado,polisorbato 80, cloruro de benzalconio, agua purificada.
INDICACIONES TERAPÉUTICAS:
NASONEX está indicado para uso en adultos y niños de 2 años de edad y mayores para tratar los síntomas de la alérgica estacional o rinitis perenne.
En pacientes que tienen un antecedente de síntomas moderados a severos de rinitis alérgica estacional, el tratamiento profiláctico con NASONEX puede ser iniciado hasta cuatro semanas antes del inicio previsto de la estación de polen.
NASONEX está indicado para uso en adultos y adolescentes de 12 años de edad y mayores como tratamiento adyuvante a los antibióticos en ep isodios agudos de sinusitis.
NASONEX está indicado para el tratamiento de los síntomas asociados con la rinosinusitis aguda en pacientes de 12 años de edad y mayores sin signos o síntomas de infección bacteriana severa.
NASONEX también está indicado para el tratamiento de los pólipos nasales y los síntomas asociados, incluyendo congestión y pérdida del olfato en pacientes adultos de 18 años de edad y mayores.
PRINCIPIO ACTIVO (S) / GRUPO FARMACOLÓGICO:
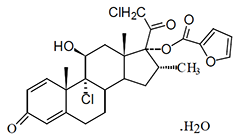
NASONEX Spray Nasal contiene furoato de mometasona monohidrato (Figura 1.1), un corticosteroide sintético 17-heterocíclico con actividad anti-inflamatoria, que actualmente se utiliza terapéuticamente para el tratamiento del asma, pólipos nasales, rinitis y sinusitis.
Principio Activo
Furoato de mometasona monohidratado (ver figura 1.1), 9,21-dicloro-11β,17- dihidroxi- 16α-metilpregna-1,4-dieno-3,20-diona, 17-(2)-furoato, es un sintético, corticosteroide anti-inflamatorio cuyo núcleo esteroide es análogo a 16α-metilo de la beclometasona, pero con un grupo 21-cloro y una nueva función (2)- furoato 17-éster. La fórmula empírica es C27H30Cl2O6.H2O y Peso Molecular (PM) es 539.45 FIGURA 1.1: FUROATO DE MOMETASONA MONOHIDRATO
NASONEX es un aerosol nasal no presurizado de dosis medida, diseñado p ara administración nasal local. El producto se presenta en frascos blancos de polietileno de alta densidad, suministrados con activadores de bombas de atomización de dosis medida, manual, de polipropileno y tapa de plástico. Cada activación de la bomba de atomización manual de dosis medida para administración intranasal, libera una cantidad de furoato de mometasona monohidrato equivalente a 50 µg de furoato de mometasona.
CONTRAINDICACIONES:
Hipersensibilidad a cualquiera de los componentes de NASONEX.
REACCIONES ADVERSAS:
a Nota: Los eventos adversos citados a continuación son para estudios en
adultos con rinitis. Los resultados similares se observaron para el tratamiento
pediátrico y coadyuvante para estudios de sinusitis.
Los eventos adversos locales relacionados con el tratamiento que se reportaron en los estudios clínicos con NASONEX incluyen: cefalea (8%), epistaxis (es decir, sangrado franco, moco sanguinolento y manchas de sangre) (8%), faringitis (4%), ardor nasal (2%), irritación nasal (2%) y ulceración nasal (1%), que normalmente se observan con el uso de un corticosteroide nasal en spray.
La epistaxis fue generalmente auto-limitada y de severidad leve y se produjo con incidencia mayor en comparación con el placebo (5%), pero con una incidencia comparable o menor comparada al control activo de corticosteroides nasales estudiado (hasta el 15%).
En pacientes tratados para la rinosinusitis aguda, la incidencia g lobal d e los eventos adversos fue comparable al placebo y similar a la observada en pacientes con rinitis alérgica.
Poliposis Nasal: En los pacientes tratados por poliposis nasal, la incidencia global de eventos adversos fue comparable con el placebo y similar a la observada en pacientes con rinitis alérgica.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
El furoato de mometasona a través de NASONEX ha sido administrado concomitantemente con loratadina sin ningún efecto sobre las concentraciones plasmáticas de loratadina o su metabolito principal. En estos estudios, las concentraciones plasmáticas del furoato de mometasona no fueron detectables utilizando un ensayo con un LLOQ de 50 pg/mL. La terapia de combinación fue bien tolerada.
El furoato de mometasona es metabolizado por CYP3A4.
La coadministración con inhibidores potentes de CYP3A4 (p.ej., ketoconazol, itraconazol, claritromicina, ritonavir, productos que contienen cobicistat) puede conducir a concentraciones plasmáticas aumentadas de corticosteroides y potencialmente aumentar el riesgo de efectos secundarios de corticosteroides sistémicos. Considere el beneficio de la coadministración versus el riesgo potencial de efectos sistémicos de los corticosteroides, en cuyo caso los pacientes deben ser monitorizados para detectar efectos secundarios de corticosteroides sistémicos.
INFORMACIÓN COMPLEMENTARIA:
Embarazo y lactancia
No existen estudios adecuados o bien controlados en mujeres embarazad as. Como con otras preparaciones nasales con corticosteroides NASONEX no debe utilizarse en mujeres embarazadas o madres en periodo de lactancia a menos que el beneficio potencial justifique el riesgo potencial para la madre, el feto o el bebé. Los bebés nacidos de madres que recibieron corticosteroides durante el embarazo deben observarse cuidadosamente para detectar hipoadrenalismo.
RECOMENDACIONES:
NASONEX debe utilizarse con precaución, en todo caso, en los pacientes con infecciones tuberculosas activas o latentes del tracto respiratorio, o en infecciones virales sistémicas, bacterianas, micóticas no tratadas o con herpes simple ocular.
Después de 12 meses de tratamiento con NASONEX, no hubo evidencia de atrofia de la mucosa nasal; también, el furoato de mometasona tiende a revertir la mucosa nasal cercana a un fenotipo histológico normal. Como con cualquier tratamiento a largo plazo, los pacientes que utilizan NASONEX durante varios meses o más deben ser examinados periódicamente por posibles cambios en la mucosa nasal, incluyendo el desarrollo de ulceraciones nasales. Si se desarrolla infección micótica localizada de la nariz o faringe, puede ser requerido la descontinuación de la terapia con NASONEX o la instauración del tratamiento adecuado.
No existe evidencia de supresión del eje hipotálamo-pituitario-adrenal (HPA) después del tratamiento prolongado con NASONEX. Sin embargo, igual que con otros corticosteroides, los pacientes que son cambiados de administración a largo plazo de corticosteroides activos sistémicamente a NASONEX requieren atención cuidadosa. La suspensión de los corticosteroides sistémicos en estos pacientes puede resultar en insuficiencia suprarrenal. Si estos pacientes presentan signos y síntomas de insuficiencia suprarrenal o síntomas de supresión (p.ej., dolor muscular y/o articular, lasitud y depresión inicialmente), deben instituirse medidas apropiadas.
Los pacientes que reciben corticosteroides que están potencialmente inmunosuprimidos deben ser advertidos del riesgo de exposición a ciertas infecciones (p.ej., varicela, sarampión) y de la importancia de obtener atención médica si se produce dicha exposición.
Después del uso de corticosteroides intranasales, muy raramente se han reportado casos de perforación del tabique o aumento de la presión intraocular.
La alteración visual puede ser reportada con el uso sistémico y tópico de corticosteroides (incluyendo, intranasal, inhalado e intraocular). Si un paciente se presenta con síntomas como visión borrosa u otras alteraciones visuales, se debe considerar al paciente para remisión a un oftalmólogo para evaluar posibles causas de las alteraciones visuales que pueden incluir cataratas, glaucoma o enfermedades raras como la coriorretinopatía serosa central (CSR) que han sido reportados después del uso de corticosteroides sistémicos y tópicos.
Debido al efecto inhibitorio de los corticosteroides en la cicatrización de las heridas, los pacientes que han experimentado cirugía nasal reciente o trauma no deben utilizar corticosteroides nasales hasta que se haya producido la curación.
Raramente, pueden ocurrir reacciones de hipersensibilidad inmediata después de la administración intranasal de furoato de mometasona monohidrato. Muy raramente, se ha reportado anafilaxia y angioedema por NASONEX. Muy raramente se han reportado alteraciones del gusto y del olfato.
Rinosinusitis Aguda Si se observan signos o síntomas de infección bacteriana severa (como fiebre, dolor facial unilateral severo persistente/dolor dental, edema facial orbital o periorbital o empeoramiento de los síntomas después de una mejoría inicial), debe advertirse al paciente que consulte a su médico inmediatamente.
La seguridad y eficacia del NASONEX para el tratamiento de los síntomas de rinosinusitis en menores de 12 años de edad no han sido estudiadas.
La seguridad y eficacia del NASONEX para el tratamiento de poliposis nasal en niños y menores de 18 años de edad no han sido estudiadas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Rinitis Alérgica: Adultos (incluyendo pacientes geriátricos) y niños de 12 años de edad o mayores: La dosis usual recomendada es dos aplicaciones (50 µg/aplicación) en cada fosa nasal una vez al día (dosis total 200 µg). Una vez controlados los síntomas, la reducción de la dosis a una aplicación en cada fosa nasal (dosis total 100 µg) puede ser efectiva para mantenimiento.
Si los síntomas no se controlan adecuadamente, la dosis puede aumentarse a un máximo de cuatro aplicaciones en cada fosa nasal una vez al d ía (d osis diaria total 400 µg). Se recomienda reducir la dosis después de controlar los síntomas.
Sinusitis Asociada: Adultos (incluyendo pacientes geriátricos) y adolescentes de 12 años de edad y mayores: La dosis usual recomendada es dos aplicaciones (50 microgramos/aplicación) en cada fosa nasal dos veces al día (dosis total 400 microgramos). Si los síntomas no se controlan adecuadamente, la dosis puede aumentarse a cuatro aplicaciones (50 microgramos/aplicación) en cada fosa nasal dos veces al día (d osis total 800 microgramos).
Rinosinusitis Aguda: Adultos (incluyendo pacientes geriátricos) y adolescentes de 12 años de edad o mayores: La dosis usual recomendada para rinosinusitis aguda es dos aplicaciones (50 microgramos/aplicación) en cada fosa nasal dos veces al día (dosis diaria total de 400 microgramos). Si los síntomas empeoran durante el tratamiento, el paciente debe ser advertido de consultar a su médico.
Poliposis Nasal: Adultos (incluyendo pacientes geriátricos) y adolescentes de 18 años de edad o mayores: La dosis usual recomendada para poliposis es de dos aplicaciones (50 microgramos/aplicación) en cada fosa nasal dos veces al día (dosis total de 400 mcg). Una vez que los síntomas estén controlados adecuadamente, se recomienda reducir la dosis a dos aplicaciones en cada fosa nasal una vez al día (dosis total diaria 200 mcg).
Niños entre 2 y 11 años de edad: la dosis usual recomendada es de una aplicación (50 µg/aplicación) en cada fosa nasal una vez al día (dosis total 100 µg).
Cada activación libera aproximadamente 100 mg de suspensión, que contiene furoato de mometasona monohidrato equivalente a 50 µg de furoato de mometasona.
Antes de administrar la primera dosis, agitar bien el envase y activar la b omba 10 veces (hasta obtener un aerosol uniforme). Si la bomba no se usa durante 7 días (US)/14 días (no-US) o más, volver a cebar la bomba con 2 activaciones, hasta que se observe un aerosol uniforme. Agitar bien el envase antes de cada uso.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Debido a que la biodisponibilidad sistémica es <1% (utilizando un ensayo sensible con un límite de cuantificación de 0.25 pg/mL) después de la administración de furoato de mometasona a través de NASONEX, la sobredosis es poco probable que requiera cualquier terapia diferente a la observación.
PRESENTACIONES:
Caja frasco x 18 g – 140 aplicaciones de 50 mcg c/u + instructivo de uso.
Caja frasco x 18 g – 140 aplicaciones de 50 mcg c/u + instructivo de uso (uso pediátrico)
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Conservar a una temperatura no mayor a 30 ºC; excursiones p ermitidas a 15-30º C. No congelar.
LEYENDAS DE PROTECCIÓN:
Todo medicamento debe conservarse fuera del alcance de los niños
Hecho en México por:
LABORATORIOS SENOSIAIN, S.A. de C.V.
Camino a San Luis Rey No. 221
38137 Celaya, Gto.