
MOMATE AZ
AZELASTINA, MOMETASONA
Suspensión nasal
1 Caja, 1 Frasco de polietileno de alta densidad,
1 Caja, 1 Frasco(s), 150 Dosis, 50/140 µg/µg
COMPOSICIÓN:
Cada aplicación contiene
Mometasona Furoato 50 mcg
Clorhidrato de Azelastina 140 mcg
Excipientes: cloruro de benzalconio, celulosa microcristalina y carboximetilcelulosa de sodio, carmelosa sódica, glucosa anhidra, ácido cítrico monohidrato, citrato de sodio, polisorbato 80, edetato disódico, neotamo, agua para inyección.
INDICACIONES TERAPÉUTICAS:
Indicaciones: Cloruro de Azelastina y Mometasona Furoato Nasal Spray está indicado para el alivio de los síntomas de la rinitis alérgica estacional en pacientes de 12 años de edad y mayores.
MECANISMO DE ACCIÓN:
Propiedades farmacológicas
Mecanismo de acción: Clorhidrato de Azelastina, es un derivado de ftalazinona, que exhibe actividad antagonista del receptor de histamina H1 en tejidos aislados, modelos animales y seres humanos. El spray nasal de Azelastina se administra como una mezcla racémica sin diferencia en la actividad farmacológica observada entre los enantiomeros en los estudios in vitro. El principal metabolito, desmetilazelastina, también posee actividad antagonista sobre receptores H1.
Mometasona Furoato es un corticosteroide que demuestra propiedades antiinflamatorias potentes. El mecanismo preciso de acción de corticosteroides sobre la rinitis alérgica no se conoce. Los corticosteroides han demostrado tener una amplia gama de efectos sobre múltiples tipos de células (por ejemplo: mastocitos, eosinófilos, neutrófilos, macrófagos y linfocitos) y mediadores (por ejemplo, histamina, eicosanoides, leucotrienos y citoquinas) implicados en la inflamación.
El spray nasal de Mometasona Furoato 50 mcg disminuyó algunos marcadores de la fase temprana y tardía de la respuesta alérgica. Estas observaciones incluyen disminuciones en la histamina (frente a placebo) y en los niveles de proteínas catiónicas de eosinofilos, y las reducciones de eosinofilos, neutrófilos y proteínas de adhesión de células epiteliales (frente a la línea de base). La importancia clínica de esos hallazgos no se conoce.
Información toxicológica
Combinación Mometasona Furoato + Clorhidrato de Azelastina: Una combinación de Mometasona Furoato + Clorhidrato de Azelastina (hasta 171 + 148 μg/día) cuando se administra dos veces al día durante 28 días consecutivos, por vía intranasal a ratas Wistar, no ha mostrado ninguna toxicidad adicional en comparación con el perfil de toxicidad de solo Mometasona Furoato (171 μg/día) y Cloruro de Azelastina sola (480 μg/día) de prueba en el mismo estudio. Dosis máxima intranasal humana recomendada (en función del peso corporal) de Mometasona Furoato + Azelastina en combinación (200 + 560 mg/día).
CONTRAINDICACIONES:
- Hipersensibilidad a Clorhidrato de Azelastina, Mometasona Furoato o a cualquiera de los excipientes.
- El Spray nasal no debe ser utilizado en presencia de infección localizada en mucosa nasal sin tratar.
- Debido al efecto inhibitorio de los esteroides sobre la cicatrización de las heridas, los pacientes que han sufrido cirugía nasal reciente o trauma no deben usar spray nasal hasta la curación.
REACCIONES ADVERSAS:
El siguiente listado de reacciones adversas se basa en los datos de un ensayo clínico (560 pacientes) y del estudio de vigilancia posterior a la comercialización de los componentes individuales de la FDC con tasas clasificados por frecuencias como reacciones adversas, usando la siguiente clasificación:
• Muy común (≥1/10).
• Común (≥1/100, a <1/10).
• No común (≥1/1000, a <1/100).
• Raro (≥1/10000, a <1/1000).
• Muy raro (≥1/10000) incluyendo casos aislados.
Clorhidrato de Azelastina y Mometasona Furoato spray nasal: En un estudio clínico realizado en 560 pacientes con rinitis alérgica estacional, 282 pacientes fueron expuestos a Clorhidrato de Azelastina y Mometasona Furoato spray nasal para una duración media de 14,94 días.Se informaron eventos adversos relacionados con Clorhidrato de Azelastina y Mometasona Furoato nasal spray en 11/282 sujetos. Se reportaron un total de 18 eventos adversos relacionados con la combinación de Azelastina + Mometasona. La mayoría de las reacciones adversas comunes reportadas en el estudio fueron dolor de cabeza (5 casos) y disgeusia (5 casos). La otra reacción adversa fueron somnolencia (3 casos), letargo (2 casos), náuseas (1 casos), dispepsia (1 casos) y estomudos (1 casos). La mayoría de los eventos adversos fueron leves en gravedad y no hubo eventos adversos graves reportados durante el estudio. A continuación, se muestra las reacciones adversas a medicamentos notificadas con los componentes individuales de la combinación a dosis fija.Azelastina spray nasal: Se informaron las siguientes frecuencias de efectos indeseables para la Azelastina spray nasal: Comúnmente (1*10%), un sabor amargo específico de la sustancia puede ser experimentado después de la administración (a menudo debido al método incorrecto de la aplicación, es decir, la inclinación de la cabeza demasiado hacia atrás durante la administración) que, en raros casos, puede provocar náuseas.
Poco frecuentes (0,1*1%), una irritación leve y transitoria de la mucosa nasal inflamada puede ocurrir con síntomas como ardor, picazón, estornudos y epistaxis.
En casos muy raros, se reportaron (<0,01%) reacciones de hipersensibilidad (tales como sarpullido, prurito, urticaria).Mometasona Furoato spray nasal
|
Tabla: Tratamiento de Rinitis alérgica relacionado a las reacciones adversas de Mometasona Furoato spray nasal. |
|
|
Muy común (≥1/10); Común (≥1/100, a <1/10); No común (≥1/1000, a <1/100); Raro (≥1/10000, a <1/1000); Muy raro (≥1/10000) |
|
|
Trastomos Respiratorios, Torácicos y mediastínicos. Común: |
Epistaxis, faringitis, ardor nasal, irritación nasal, ulceración nasal. |
|
Trastomos Generales y alteraciones en el lugar de administración. Común: |
Dolor de cabeza. |
La epistaxis fue generalmente autolimitante y ligeramente grave, y se produjo a una incidencia más alta en comparación con el placebo (5%), pero con una incidencia comparable o menor cuando se compara con el control activo corticosteroides nasales estudiados (hasta 15%). La incidencia de todos los otros efectos era comparable con la de placebo.
En la población pediátrica, la incidencia de eventos adversos, por ejemplo, epistaxis (6%), dolor de cabeza (3%), irritación nasal (2%) y estornudos (2%) fue comparable a placebo.
Pueden aparecer efectos sistémicos de los corticosteroides nasales, especialmente cuando se prescriben a dosis elevadas durante periodos prolongados.
Experiencia post-comercialización: Las siguientes reacciones adversas han sido identificadas durante el periodo post-comercialización para Azelastina spray nasal: dolor abdominal, ardor nasal, náuseas, sabor dulce, irritación de la garganta, reacción anafiláctica, irritación en el lugar de aplicación, la fibrilación auricular, visión borrosa, dolor de pecho, confusión, mareos, disnea, edema facial, hipertensión, contracciones musculares involuntarias, nerviosismo, palpitaciones, parestesia, parosmia, estornudos paroxísticos, prurito, erupción, alteración o pérdida del sentido del olfato y / o sabor, la taquicardia, la tolerancia, la retención urinaria, y la xeroftalmía. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Las siguientes reacciones adversas han sido identificadas durante el periodo post-comercialización de Mometasona Furoato spray nasal 50 mcg: ardor e irritación nasal, la anafilaxia y angioedema, alteraciones en el gusto y el olfato y perforación del tabique nasal.
Comunicar a su médico o farmacéutico cualquier reacción adversa que no estuviese descrita en el inserto.
Para reportar cualquier evento adverso o una queja de producto, envíanos un correo
PV.WestLATAM@glenmarkpharma.com.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones: No hay estudios específicos de interacción fármaco-fármaco que se hayan realizado con la combinación de dosis fija de Clorhidrato de Azelastina y Mometasona Furoato spray nasal. Los datos cumplen con la información disponible para los componentes individuales de la combinación a dosis fija. También ambos, Mometasona y Azelastina, se metabolizan con diferentes receptores por lo que no hay interacción fármaco-fármaco anticipado al uso de esta combinación a dosis fija.
Clorhidrato de Azelastina
Depresores del sistema nervioso central
El uso concurrente de Azelastina Nasal Spray con alcohol u otros depresores del sistema nervioso central deben ser evitados porque pueden producir reducción de la lucidez mental y deterioro del funcionamiento del sistema nervioso central.
Eritromicina y Ketoconazol
Se llevaron a cabo estudios de interacción que investigan los efectos cardiacos, medida por el intervalo QT corregido (QTc), Clorhidrato de Azelastina administrado por vía oral de forma concomitante y Eritromicina o Ketoconazol. Eritromicina oral (500 mg tres veces al día por 7 días) no tuvo ningún efecto sobre la farmacocinética de la Azelastina o QTc en base a los análisis de electrocardiogramas seriados. El ketoconazol (200 mg dos veces al día durante 7 días) interfirió con la medición de las concentraciones plasmáticas de Azelastina en el sistema HPLC analítico; sin embargo, no se observaron efectos sobe QTc.
Cimetidina
Cimetidina (400 mg dos veces al día) aumentó la Cmáx media y el AUC del Clorhidrato de Azelastina administrado por vía oral (4 mg dos veces al día) en aproximadamente 65%.
Mometasona Furoato
Inhibidores del citocromo P450 3A4 Ketoconazol Los estudios han demostrado que Mometasona Furoato es principalmente y extensamente metabolizada en el hígado de todas las especies investigadas y sufre metabolismo extensivo con múltiples metabolitos. Estudios in vitro han confirmado el papel principal del citocromo CYP 3A4 en el metabolismo de este compuesto. La administración concomitante con ketoconazol, un potente inhibidor de la CYP 3A4, puede incrementar las concentraciones de Mometasona Furoato en el plasma.
Ritonavir
Se debe tener precaución cuando se considera la coadministración de Mometasona Furoato con inhibidores de la proteasa, como Ritonavir, debido a los efectos adversos relacionados con el aumento de la exposición sistémica a Mometasona Furoato, puede ocurrir debido a la administración concomitante de inhibidores de CYP 3A4 inhibiendo el metabolismo de Mometasona Furoato. Loratadina
Un estudio de interacción clínica se llevó a cabo con loratadina. No se observaron interacciones.
Incompatibilidad: No aplicable.
RECOMENDACIONES:
Precauciones
Clorhidrato de Azelastina
Actividades que requieren atención mental
En los ensayos clínicos, la incidencia de somnolencia se ha reportado en algunos pacientes que toman Azelastina spray nasal. Los pacientes deben ser advertidos frente a la participación en ocupaciones peligrosas que requieran alerta mental y motor de coordinación completa, como operar maquinas o conducir un vehículo de motor después de la administración de Azelastina spray nasal. El uso concurrente de Azelastina spray nasal con alcohol u otros depresores del sistema nervioso central deben ser evitados porque pueden producirse adicionalmente reducción en el estado de alerta y deterioro adicional del funcionamiento del sistema nervioso central.
Mometasona Furoato
Efecto local nasal
Epistaxis
En estudios clínicos, la epistaxis fue observada más frecuentemente en pacientes con rinitis alérgica con Mometasona Furoato spray nasal que quienes recibieron placebo.
Infección por Cándida
Un estudio clínico con Mometasona: Furoato 50 mcg spray nasal, se produjo el desarrollo de infecciones localizadas en la nariz y la faringe por Candida albicans. Cuando dicha infección se desarrolla, el uso de Mometasona Furoato 50 mcg spray nasal debe interrumpirse y debe instituirse terapia local o sistémica apropiada, si es necesario. Perforación del Septum nasal
Los casos de perforación del tabique nasal se han reportado después de la aplicación intranasal de corticoides. Como con cualquier tratamiento tópico a largo plazo de la cavidad nasal, los pacientes que usan Mometasona Furoato 50 mcg spray nasal, durante varios meses o más deben ser examinados periódicamente, por posibles cambios en la mucosa nasal.
Curación de heridas
Debido al efecto inhibitorio de los corticosteroides en la cicatrización de heridas, los pacientes que han experimentado úlceras nasales recientes en tabique nasal, cirugía o trauma nasal, no deben usar un corticosteroide nasal hasta que se produzca la cicatrización.
Glaucoma y Cataratas
Corticosteroides inhalados pueden producir el desarrollo de glaucoma y/o cataratas. Por lo tanto, una estrecha vigilancia se justifica en pacientes con un cambio en la visión o con un historial de aumento de la presión intraocular, glaucoma y/o cataratas.
Reacciones de hipersensibilidad
Las reacciones de hipersensibilidad, incluyendo casos de sibilancias pueden ocurrir después de la administración intranasal de Mometasona Furoato. Suspender Mometasona spray nasal si se producen tales reacciones.
Inmunosupresión
Las personas que consumen medicamentos que suprimen el sistema inmunológico son más susceptibles a las infecciones que los individuos sanos. La varicela y sarampión, por ejemplo, pueden tener un curso más grave o incluso mortal en los niños no inmunes o adultos sobre los corticosteroides. En estos niños o adultos que no han tenido estas enfermedades, en particular se debe tener cuidado para evitar la exposición. La dosis, la vía y duración de la administración de corticosteroides afecta el riesgo de desarrollar una infección diseminada. La contribución de la enfermedad subyacente y/o el tratamiento con corticosteroides antes del riesgo también se desconoce. Si ha estado expuesto a la varicela, la profilaxis con globina inmune contra la varicela zóster (VZIG) puede estar indicada. Si ha estado expuesto al sarampión, la profilaxis con inmunoglobulina intramuscular agrupada (IG) puede estar indicada. Si se desarrolla la varicela, el tratamiento con agentes antivirales puede ser considerado.
Los corticosteroides deben ser usados con precaución, en pacientes con infección tuberculosa activa o inactiva del tracto respiratorio, o en hongos no tratada, infecciones virales, bacterianas sistémicas o herpes simple ocular debido a la potencial de empeoramiento de estas infecciones.
Efecto en el eje Hipotalámico-hipofisario-adrenal Hipercorticismo y supresión adrenal
Cuando se utilizan los esteroides intranasales en dosis superiores a los recomendados, o en individuos susceptibles en las dosis recomendadas, pueden aparecer efectos sistémicos de los corticoesteroides, como hipercorticismo y supresión adrenal. Si se producen tales cambios, la dosis de mometasona furoato spray nasal se debe suspender lentamente, de acuerdo con los procedimientos aceptados para descontinuar la terapia con corticosteroides orales.
Efecto sobre el crecimiento
Los corticosteroides pueden causar una reducción en la velocidad de crecimiento cuando se administra a pacientes pediátricos. Monitorear el crecimiento de forma rutinaria de los pacientes pediátricos que recibieron Mometasona Furoato nasal spray. Para minimizar los efectos sistémicos de los corticosteroides intranasales, incluyendo Mometasona Furoato nasal spray, ajustar la dosis de cada paciente a la dosis más baja que controla efectivamente sus síntomas.
Clorhidrato de Azelastina y Mometasona Furoato (140 mcg / 50 mcg) Spray Nasal contiene cloruro de benzalconio. Puede causar irritación de la mucosa nasal y broncoespasmo.
Uso durante el embarazo
Azelastina: no existen ensayos clínicos adecuados y bien controlados en mujeres embarazadas. Se ha demostrado que Clorhidrato de Azelastina causa toxicidad en el desarrollo de ratones, ratas y conejos. La Azelastina spray nasal debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el potencial riesgo del feto.
Mometasona: No existen estudios adecuados, ni bien controlados en mujeres embarazadas. Mometasona Furoato spray nasal 50 mcg, al igual que otros corticosteroides, se debe utilizar durante el embarazo, solo si el potencial beneficio justifica el potencial riesgo del feto. La experiencia con corticosteroides orales desde su introducción en dosis terapéutica, contrario a la fisiológica, sugiere que los roedores son más propensos a los efectos teratogénicos de los corticosteroides que los humanos. Además, porque hay un aumento natural en la producción de corticosteroides durante el embarazo, la mayoría de mujeres requieren una dosis de corticosteroides exógenos inferior y muchas no tendrán el tratamiento con corticosteroides durante el embarazo.
Madres lactantes
Azelastina: No se sabe si el Clorhidrato de Azelastina se excreta en la leche humana, porque muchos fármacos son excretados en la leche humana, se debe tener precaución cuando Azelastina spray nasal se administra a una mujer lactante.
Mometasona: No se sabe si Mometasona Furoato es excretado en la leche humana, porque otros corticosteroides son excretados en la leche humana, se debe tener precaución cuando Mometasona Furoato 50 mcg spray nasal es administrado en mujeres lactantes.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Pacientes adultos y adolescentes de 12 años a más: La dosis recomendada es de una pulverización en cada fosa nasal dos veces al día.
Pediatría: Como la seguridad y eficacia no se ha establecido en este grupo de edad, Clorhidrato de Azelastina y Mometasona Furoato spray nasal no se recomienda para uso en niños menores de 12 años de edad.
Pacientes con insuficiencia renal: No es necesario ajustar la dosis en pacientes con insuficiencia renal leve (aclaramiento de creatinina> 79 ml/min). Para los pacientes con insuficiencia renal moderada a grave (aclaramiento de creatinina <79 ml / min * > 10 ml/min), este producto es para ser usado con precaución y bajo estricta supervisión médica.
Pacientes con insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficiencia hepática.
Forma de administración: Clorhidrato de Azelastina y Mometasona Furoato spray nasal es sólo para uso nasal. Vía de administración: Nasal.
Instrucciones para su uso
Preparación de la pulverización: La botella debe agitarse suavemente antes de usar durante unos 5 segundos. Uso del spray
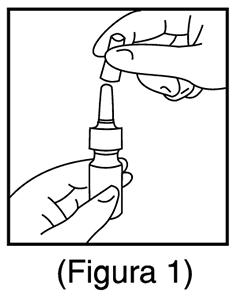
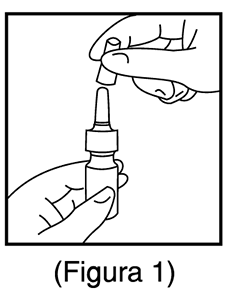
1. Retirar la tapa de plástico antipolvo (Figura 1).
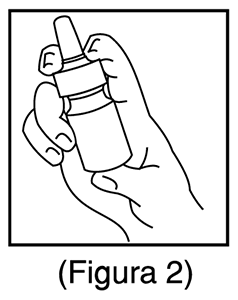
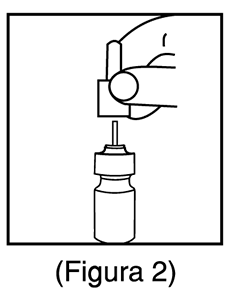
2. Antes de usar Mometasona Furoato y Clorhidrato de Azelastina spray nasal por primera vez, accionar la bomba presionando los hombros del aplicador nasal de color blanco con los dedos índice y medio al mismo tiempo que se presiona la base del frasco con el pulgar (Figura 2). No agujerear el aplicador nasal. Presionar la bomba 6 veces o hasta que aparezca un rociado fino. No accionar en los ojos. La bomba está lista para usar, una vez que se haya usado este producto, se puede almacenar hasta por 1 semana. Si no se usa el spray nasal por más de 1 semana, entonces accionarlo 2 veces o hasta que aparezca un rociado fino.
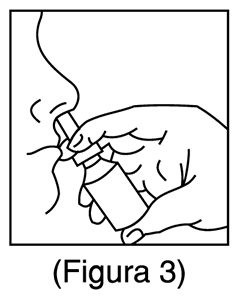
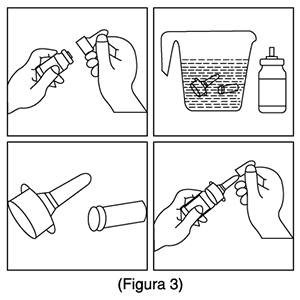
3. Suene suavemente la nariz para despejar las fosas nasales. Cierre 1 fosa nasal. Incline la cabeza ligeramente hacia adelante, mantenga la botella en posición vertical, inserte cuidadosamente el aplicador en la otra fosa nasal (Figura 3). No rocíe directamente sobre el tabique nasal (pared que separa las dos fosas nasales).
4. Luego respirar por la boca.
5. Repetir en el otro orificio nasal.
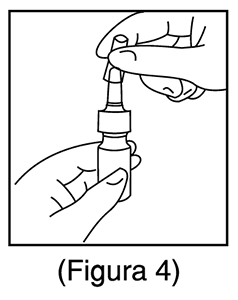
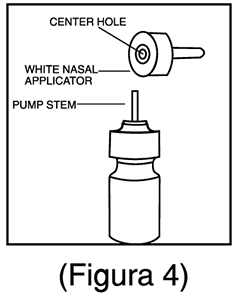
6. Limpie el aplicador nasal con un pañuelo de papel limpio y vuelva a colocar la tapa de plástico antipolvo. (Figura 4).
Instrucciones para el paciente sobre la limpieza del aplicador.
1. Para limpiar el aplicador nasal, vuelva a colocar la tapa de plástico anipolvo. (Figura 1).
2. Deslice suavemente hacia arriba el aplicador nasal blanco para retirar. (Figura 2).
3. Remoje el aplicador nasal y la tapa antipolvo en agua tibia durante unos minutos, active la bomba pulverizando para que se limpien los conductos internos, finalmente enjuague el aplicador nasal y la tapa antipolvo con agua corriente limpia (Figura 3). Repetir el procedimiento si la niebla no sale. (Figura 3)
Nota: En caso de que, durante el uso por primera vez, se observe que el actuador está bloqueado debido a presión accidental durante el tránsito o durante la manipulación, lo que provoca la liberación de contenido minúsculo, nunca use un alfiler o ningún objeto afilado para perforar o desbloquear la boquilla, en su lugar, someta el aplicador nasal a limpieza.
4. Vuelva a colocar el aplicador nasal asegurándose de que el vástago de la bomba se vuelva a insertar en el orificio central del aplicador. (Figura 4).
5. Vuelva a accionar la bomba presionando hacia abajo sobre los hombros del aplicador nasal blanco con los dedos índice y medio mientras sostiene la base del frasco con el pulgar, presione y suelte la bomba 2 veces o hasta que aparezca una fina pulverización. No rocle en los ojos. La bomba ya está lista para usarse. La bomba puede almacenarse sin usar hasta por 1 semana sin volver a cebar si no se usa por más de 1 semana, vuelva a cebar rociando 2 veces o hasta que aparezca un rocío fino. (Figura 5).
6. Vuelva a colocar la tapa de plástico antipolvo. (Figura 6).
Consultar a su médico o farmacéutico para cualquier aclaración sobre la utilización del medicamento.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Tratamiento en caso de sobredosis: No hay información específica disponible sobre el tratamiento de la sobredosis con Clorhidrato de Azelastina y Mometasona Furoato spray nasal. No ha habido una sobredosis reportada con Azelastina spray nasal. La sobredosis aguda en adultos con esta forma de dosificación es poco probable que resulte en efectos adversos clínicamente significativos, distintos del aumento de la somnolencia. Los ensayos clínicos en adultos con dosis únicas de la formulación oral de Clorhidrato de Azelastina (hasta 16 mg) no se han traducido en una mayor incidencia de eventos adversos graves, las medidas generales de apoyo deben ser empleados si se produce una sobredosis. No hay antídoto conocido para Azelastina spray nasal.
No hay datos disponibles sobre los efectos de la aguda o crónica más de la dosis con Mometasona Furoato spray nasal 50 mcg. Dosis intranasales únicas de hasta 4000 mcg y las dosis de inhalación orales de hasta 8000 mcg se han estudiado en voluntarios humanos sin efectos adversos informados. Crónica sobredosis con cualquier corticosteroide puede resultar en signos o síntomas de hipercorticismo.
PRESENTACIÓN:
Caja con 1 frasco conteniendo 150 aplicaciones más inserto.
Importado y Distribuido por:
Glenmark Pharmaceuticals Ecuador S.A.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Período de validez: No usar después de la fecha de vencimiento indicada en el envase.
Condiciones de almacenamiento: Consérvese a temperatura no mayor de 30°C. Agitar bien antes de cada uso. Venta bajo receta médica.
LEYENDAS DE PROTECCIÓN:
Todo medicamento debe conservarse fuera del alcance de los niños.