GIOTRIF
AFATINIB
Comprimidos recubiertos
Frasco, Comprimidos recubiertos, 20, 30, 40 Y 50 Miligramos
1 Caja, 14, 21, 28 Comprimidos recubiertos, 20, 30, 40, 50 mg
COMPOSICIÓN:
Concentración 20 MG
Cada COMPRIMIDO RECUBIERTO contiene:
Afatinib 20 mg,
Excipientes: lactosa monohidrato, celulosa microcristalina, sílice coloidal anhidro, crospovidona, estearato de magnesio, hipromelosa 2910, macrogol 400, dióxido de titanio, talco, polisorbato 80.
Concentración 30 MG
Cada COMPRIMIDO RECUBIERTO contiene:
Afatinib 30 mg,
Excipientes: lactosa monohidrato, celulosa microcristalina, sílice coloidal anhidro, crospovidona, estearato de magnesio, hipromelosa 2910, macrogol 400, dióxido de titanio, talco, polisorbato 80, laca de aluminio color índigo carmín.
Concentración 40 MG
Cada COMPRIMIDO RECUBIERTO contiene:
Afatinib 40 mg,
Excipientes: lactosa monohidrato, celulosa microcristalina, sílice coloidal anhidro, crospovidona, estearato de magnesio, hipromelosa 2910, macrogol 400, dióxido de titanio, talco, polisorbato 80, laca de aluminio color índigo carmín.
Concentración 50 MG
Cada COMPRIMIDO RECUBIERTO contiene:
Afatinib 50 mg,
Excipientes: lactosa monohidrato, celulosa microcristalina, sílice coloidal anhidro, crospovidona, estearato de magnesio, hipromelosa 2910, macrogol 400, dióxido de titanio, talco, polisorbato 80, laca de aluminio color índigo carmín.
INDICACIONES TERAPÉUTICAS:
Indicaciones/uso: GIOTRIF® está indicado para el tratamiento de pacientes con:
• Cáncer de pulmón de células no pequeñas (non-small cell lung cancer, NSCLC) localmente avanzado o metastásico con mutación(es) del receptor del factor de crecimiento epidérmico (Epidermal Growth Factor Receptor, EGFR).
• NSCLC localmente avanzado o metastásico de histología escamosa, con progresión durante quimioterapia basada en platino o posteriormente.
MECANISMO DE ACCIÓN:
Acción terapéutica: Agentes antineoplásicos – inhibidores de la proteína cinasa, código ATC: L01XE13.
Acción farmacológica
Mecanismo de acción: Afatinib es un bloqueador irreversible potente y selectivo de la familia ErbB. Afatinib se une mediante enlace covalente y bloquea en forma irreversible la señalización de todos los homo y heterodímeros formados por los siguientes integrantes de la familia ErbB: EGFR (ErbB1), HER 2 (ErbB2), ErbB3 y ErbB4.
Efectos farmacodinámicos: La señalización aberrante de ErbB desencadenada, por ejemplo, por las mutaciones y/o la amplificación del EGFR, por la amplificación o la mutación del HER2 y/o por la sobreexpresión del ligando o receptor ErbB contribuye al fenotipo maligno en subconjuntos de pacientes en diversos tipos de cáncer. En modelos preclínicos de esta patología con desregulación de la vía ErbB, afatinib administrado como agente único bloqueó efectivamente la señalización del receptor ErbB, lo cual condujo a la inhibición del crecimiento tumoral o bien a la regresión del tumor. Los modelos de NSCLC con mutaciones L858R o Del 19 del EGFR son particularmente sensibles al tratamiento con afatinib. La adquisición de una mutación T790M secundaria es el principal mecanismo de resistencia adquirida a afatinib y la proporción génica del alelo que contiene la mutación T790M se correlaciona con el grado de resistencia in vitro. La mutación T790M se encuentra aproximadamente, en el 50% de los tumores de los pacientes tras la progresión de la enfermedad con afatinib, para los cuales los TKI del EGFR dirigidos a la mutación T790M se pueden considerar como una opción de línea de tratamiento posterior.
Farmacocinética
Absorción y distribución
Tras la administración oral de GIOTRIF®, las concentraciones máximas (Cmáx) de afatinib se observan aproximadamente, de 2 a 5 horas después de la administración de la dosis. La media de los valores de Cmáx y AUC0-∞ aumentó en forma ligeramente más que proporcional en el rango de dosis de 20 mg a 50 mg de GIOTRIF®. La exposición sistémica a afatinib disminuyó en un 50 % (Cmáx) y un 39 % (AUC0-∞) cuando se administró con una comida de alto contenido graso en comparación con la administración en ayunas. En base a los datos de farmacocinética poblacionales obtenidos de estudios clínicos en diversos tipos de tumores, se observó una disminución promedio del 26 % en el AUCτ,ss cuando se consumieron alimentos dentro del lapso de 3 horas antes o 1 hora después de la toma de GIOTRIF®. Por lo tanto, no se deben consumir alimentos 3 horas antes y 1 hora después, como mínimo, de la toma de GIOTRIF® (ver las secciones “Posología y administración” e “Interacciones”). Después de la administración de GIOTRIF®, la biodisponibilidad relativa media fue del 92 % (cociente de la media geométrica ajustada del AUC0-∞) cuando se la comparó con una solución oral.
La unión in vitro de afatinib a las proteínas plasmáticas humanas es de aproximadamente, un 95 %.
Metabolismo y excreción
Las reacciones metabólicas catalizadas por enzimas juegan un papel insignificante para afatinib in vivo. Los aductos covalentes a proteínas son los principales metabolitos circulantes de afatinib.
Tras la administración de una solución oral de 15 mg de afatinib, el 85,4 % de la dosis se recuperó en las heces y el 4,3 % en la orina. El compuesto original afatinib representó el 88 % de la dosis recuperada. La vida media terminal aparente es de 37 horas. Las concentraciones plasmáticas de afatinib en estado de equilibrio dinámico se alcanzan dentro de los 8 días de la administración de dosis múltiples de afatinib, lo cual conduce a una acumulación de 2,77 veces (AUC) y 2,11 veces (Cmáx).
Insuficiencia renal
Menos del 5 % de una dosis única de afatinib se excreta a través de los riñones. Se comparó la exposición a afatinib de sujetos con insuficiencia renal y la de voluntarios sanos tras la administración de una dosis única de 40 mg de GIOTRIF®. La exposición de los sujetos con insuficiencia renal moderada (índice de filtración glomerular estimado [eGFR] de 30 a 59 ml/min según la fórmula MDRD) fue 101% (Cmáx) y 122% (AUC0-tz) en comparación con los voluntarios sanos. La exposición de los sujetos con insuficiencia renal grave (eGFR de 15 a 29 ml/min de acuerdo con la fórmula MDRD) fue 122% (Cmáx) y 150% (AUC0-tz) en comparación con los voluntarios sanos. Según este estudio y el análisis farmacocinético poblacional de los datos obtenidos de ensayos clínicos efectuados en diversos tipos de tumor se concluye que no es necesario ajustar la dosis inicial de los pacientes con insuficiencia renal leve (eGFR 60-89 ml/min), moderada (eGFR 30-59 ml/min) o grave (eGFR 15-29 ml/min), pero que se debe realizar un monitoreo de los pacientes que sufren insuficiencia grave (ver las secciones“Análisis farmacocinético poblacional en poblaciones especiales” a continuación y “Posología y administración”). No se ha estudiado GIOTRIF® en pacientes con un eGFR < 15 ml/min o sometidos a diálisis.
Insuficiencia hepática
Afatinib es eliminado principalmente por vía de excreción biliar/fecal. Los sujetos con deterioro hepático leve (Child Pugh A) y moderado (Child Pugh B) tuvieron una exposición similar en comparación con los voluntarios sanos después de una dosis única de 50 mg de GIOTRIF®. Esto coincide con los datos de farmacocinética poblacional obtenidos de estudios clínicos en diversos tipos de tumor (ver la sección “Análisis de farmacocinética poblacional en poblaciones especiales”). No se considera necesario ningún ajuste de dosis inicial en los pacientes con deterioro hepático leve o moderado “ver la sección “Posología y administración”. No se ha estudiado la farmacocinética de afatinib en sujetos con disfunción hepática severa (Child Pugh C) (ver la sección “Advertencias y precauciones especiales”).
Análisis farmacocinético en poblaciones objetivo
Se realizó un análisis de farmacocinética poblacional en 927 pacientes con cáncer que recibieron monoterapia de GIOTRIF®. No se considera necesario ningún ajuste de dosis inicial para ninguna de las siguientes covariables estudiadas.
Edad
No se pudo observar ninguna repercusión significativa de la edad (rango: 28 a 87 años) sobre la base de la farmacocinética de afatinib.
Peso corporal
La exposición plasmática (AUCτ,ss) se incrementó un 26% para un paciente de 42 kg (percentil 2,5) y se redujo un 22% para un paciente de 95 kg (percentil 97,5) en relación con un paciente con un peso corporal de 62 kg (mediana del peso corporal de los pacientes de la población general del estudio).
Sexo
Las mujeres tuvieron una exposición plasmática (AUCτ,ss, con corrección para peso corporal) un 15 % más alta que los hombres.
Raza
No existe ninguna diferencia estadísticamente significativa en la farmacocinética de afatinib entre los pacientes asiáticos y los caucásicos. Tampoco se detectaron diferencias evidentes en la farmacocinética para los pacientes indoamericanos/nativos de Alaska o negros, en base a los limitados datos disponibles de estas poblaciones (6 y 9 de 927 pacientes incluidos en el análisis, respectivamente).
Insuficiencia renal
La exposición a GIOTRIF® se incrementó moderadamente conforme menor fue el nivel de depuración de creatinina (creatinine clearance, CrCL), es decir, para un paciente con un CrCL de 60 ó 30 ml/min, la exposición (AUCτ,ss) a afatinib aumentó un 13 % y un 42 %, respectivamente, y disminuyó un 6 % y un 20 % para un paciente con un CrCL de 90 ó 120 ml/min, respectivamente, en comparación con un paciente con un CrCL de 77 ml/min (mediana de CrCL de la población de pacientes total analizada). Insuficiencia hepática
La insuficiencia hepática leve y moderado, identificado mediante resultados anómalos en las pruebas de función hepática, no se correlacionó con ningún cambio significativo en la exposición de afatinib.
Otras características/factores intrínsecos de los pacientes
Otras características/factores intrínsecos de los pacientes que tuvieron una repercusión significativa sobre la exposición a afatinib fueron: estado funcional ECOG, niveles de lactato deshidrogenasa, niveles de fosfatasa alcalina y proteínas totales. Las magnitudes del efecto individual de cada una estas covariables no se consideraron clínicamente relevantes.
Los antecedentes de tabaquismo, el consumo de alcohol o la presencia de metástasis hepáticas no tuvieron ninguna repercusión significativa en la farmacocinética de afatinib.
CONTRAINDICACIONES:
GIOTRIF® está contraindicado en pacientes con hipersensibilidad conocida a afatinib o a cualquiera de los excipientes.
REACCIONES ADVERSAS:
La evaluación de seguridad de GIOTRIF® se basa en datos obtenidos de estudios clínicos y de la experiencia posterior a la comercialización.
NSCLC
Estudios controlados
En el estudio pivotal LUX-Lung 3 (1200.32), un total de 229 pacientes no tratados previamente con un EGFR TKI fueron tratados con GIOTRIF® con una dosis inicial de 40 mg administrada una vez al día. Un total de 111 pacientes fueron tratados con pemetrexed/cisplatino. La incidencia general de Reacciones Adversas del Medicamento (RAM) en los pacientes tratados con GIOTRIF® una vez al día fue similar a la observada con pemetrexed/cisplatino (100 % vs. 96 %). La incidencia de RAM de diarrea (95 % vs. 15 %) y de erupción cutánea/acné (89 % vs. 6 %) fue más alta en los pacientes tratados con GIOTRIF® que en aquellos tratados con pemetrexed/cisplatino, respectivamente. En el 57 % de los pacientes tratados con GIOTRIF® se efectuaron reducciones de dosis a raíz de los eventos adversos. Las reducciones de la dosis observadas en el conjunto de pacientes condujo a una menor frecuencia de eventos adversos (p. ej., después de la primera reducción de la dosis, la frecuencia de la diarrea, independientemente de la causalidad, se redujo del 96 % al 52 %).
La discontinuación del tratamiento a raíz de RAM fue menor en los pacientes que recibieron 40 mg de GIOTRIF® una vez al día en comparación con aquellos que recibieron pemetrexed/cisplatino (8 % vs. 12 %). En los pacientes tratados con GIOTRIF®, las tasas de discontinuaciones debido a RAM de diarrea y erupción cutánea/acné fueron del 1,3 % y del 0 %, respectivamente.
En el estudio LUX-Lung 6 (1200.34), un total de 239 pacientes no tratados previamente con un EGFR TKI fueron tratados con GIOTRIF® con una dosis inicial de 40 mg, administrada una vez al día. Un total de 113 pacientes fueron tratados con gemcitabina/cisplatino. La incidencia general de RAM en pacientes tratados con GIOTRIF® fue similar a la observada con gemcitabina/ cisplatino (98,7% vs. 99,1%). La incidencia de las RAM diarrea (88,7% vs. 10,6%) y exantema/ acné (81,2% vs. 8,8%) fue más alta en los pacientes tratados con GIOTRIF® que en aquellos tratados con gemcitabina/cisplatino. Hubo reducciones de dosis debido a los eventos adversos en el 33,1% de los pacientes tratados con GIOTRIF® y en el 26,5% de los pacientes tratados con gemcitabina/cisplatino. Las interrupciones de la medicación del estudio debido a las RAM fueron menos frecuentes en los pacientes que recibieron GIOTRIF® en comparación con gemcitabina/cisplatino (6,3% vs. 39,8%). En los pacientes tratados con GIOTRIF®, las tasas de interrupción debido a las RAM diarrea y exantema/acné fueron 0% y 2,5%, respectivamente.
En el estudio de aval controlado con placebo, LUX-Lung 1 (1200.23), un total de 390 pacientes tratados previamente con un EGFR TKI fueron aleatorizados a GIOTRIF® y recibieron una dosis inicial de 50 mg una vez al día. Un total de 195 pacientes recibieron placebo. La incidencia general de RAM en los pacientes tratados con GIOTRIF® fue superior que en aquellos que recibieron placebo (95 % vs. 38 %). La incidencia de RAM de diarrea (85 % vs. 6 %) y de erupción cutánea/acné (77 % vs. 13 %) fue más alta en los pacientes tratados con GIOTRIF®. En el 38 % de los pacientes tratados con GIOTRIF® hubo reducciones de dosis a raíz de los eventos adversos. Las reducciones de la dosis observadas en el conjunto de pacientes condujo a una menor frecuencia de eventos adversos (p. ej., después de la primera reducción de la dosis, la frecuencia de la diarrea, independientemente de la causalidad, se redujo del 87 % al 49 %). La tasa de interrupción del tratamiento a raíz de RAM fue más alta en los pacientes que recibieron 50 mg de GIOTRIF® una vez al día en comparación con aquellos que recibieron placebo (8% vs. < 1%). En los pacientes tratados con GIOTRIF®, las tasas de interrupción como consecuencia de eventos de diarrea y exantema/acné fueron del 3,6% y del 1,8%, respectivamente.En el estudio pivote LUX-Lung 8 (1200.125), un total de 392 pacientes con NSCLC escamoso fueron tratados con GIOTRIF® con una dosis inicial de 40 mg administrada una vez al día y un total de 395 pacientes fueron tratados con 150 mg de erlotinib una vez al día. Después del primer ciclo de tratamiento (28 días) se ajustó la dosis de GIOTRIF® a 50 mg en 39 (10%) pacientes. La incidencia general de ADR en los pacientes tratados con GIOTRIF® o erlotinib fue del 93% vs. 81%, respectivamente. La incidencia de ADR de diarrea fue más alta en los pacientes tratados con GIOTRIF® en comparación con aquellos que recibieron erlotinib (70% vs. 33%), mientras que la incidencia de exantema/acné fue similar en ambos grupos (67% vs. 67%). En el 27 % de los pacientes tratados con GIOTRIF® hubo reducciones de dosis, debido a los eventos adversos. El tratamiento se discontinuó a raíz de ADR en el 11% de los pacientes tratados con GIOTRIF®, y en el 5% de los pacientes tratados con erlotinib.
Todos los estudios de NSCLC con dosis diarias de 40 mg o 50 mg de GIOTRIF®
La seguridad de la monoterapia de GIOTRIF® se evaluó con dosis iniciales de 40 mg o 50 mg administradas una vez al día en análisis combinados de estudios de NSCLC en pacientes con mutaciones del EGFR o población enriquecida por las mismas. El tipo de histología predominante en esta población de pacientes fue el adenocarcinoma de pulmón. En general, los tipos de RAM estuvieron generalmente asociados con el modo de acción inhibitorio del EGFR que posee afatinib y el perfil de las RAM son concordantes entre los estudios LUX-Lung 3 y LUX-Lung 1, respectivamente. Las RAM de Grado 1 ó 2 de los CTCAE se produjeron en el 58,8 % y en el 53,1 % de los pacientes tratados con 40 mg y 50 mg de GIOTRIF®, respectivamente. Las RAM de Grado 3 o 4 de los CTCAE se produjeron en el 38% y en el 41% de los pacientes tratados con 40 mg y 50 mg de GIOTRIF®, respectivamente. Para ambas dosis, en estas 2 poblaciones de pacientes diferentes, la mayoría de las RAM fueron Grado 1 ó 2 de los CTCAE y fueron manejables, según se describe en las secciones “Posología y administración” y “Advertencias y precauciones especiales”. Esto se vio reflejado en las bajas tasas de discontinuación del tratamiento debido a RAM observadas para ambas dosis iniciales (7 % y 11,7 %).
En la Tabla 8 se proporciona un resumen de las RAM frecuentes de diarrea y erupción cutánea/acné en una población con NSCLC positivo para mutación del EGFR o enriquecida por la misma, tratada con GIOTRIF® Efectos sobre la capacidad para conducir vehículos y operar maquinaria
No se ha realizado ningún estudio de los efectos sobre la capacidad de conducir vehículos u operar maquinarias.
|
Tabla 8. Análisis combinados de eventos de diarrea y erupción cutánea/acné relacionados con el fármaco tomados de una población con NSCLC positivo para mutación del EGFR o enriquecida por la misma que recibió monoterapia de GIOTRIF® en estudios clínicos |
||
|
Pacientes no tratados previamente con un EGFR TKI (dosis inicial 40 mg/día) N = 497 |
Pacientes tratados previamente con un EGFR TKI (dosis inicial 50 mg/día) N = 1638 |
|
|
Erupción cutánea/acné de Grado 3 según CTCAE |
14,3 % |
11,8 % |
|
Diarrea de Grado 3 según CTCAE |
9,9 % |
17,6 % |
|
Discontinuación debido a erupción cutánea/acné (todos los grados) |
1,2 % |
1,9 % |
|
Discontinuación debido a diarrea (todos los grados) |
0,6 % |
4,5 % |
De los pacientes que recibieron una dosis inicial de 40 mg, 1 (0,2 %) tuvo en evento de erupción cutánea/acné de Grado 4. Entre los pacientes que recibieron una dosis inicial de 50 mg, 1 (0,1 %) tuvo en evento de erupción cutánea/acné de Grado 4, y 3 (0,2 %) tuvieron diarrea de Grado 4.
La seguridad de la monoterapia de GIOTRIF® se evaluó en el estudio LUX-Lung 8 en pacientes con carcinoma de pulmón de células escamosas que recibieron una dosis inicial de 40 mg. Las ADR más frecuentes estuvieron asociadas con el modo de acción inhibitorio del EGFR que posee GIOTRIF® y fueron concordantes con las observadas en los estudios LUX-Lung 3 y LUX-Lung 1 en pacientes con adenocarcinoma de pulmón. La mayoría de los pacientes con ADR (65%) tuvo eventos de Grado 1 o 2. La ADR de Grado 3 / 4 de los CTCAE de diarrea se produjo en el 9,9% / 0,5% de los pacientes. La tasa de exantema de grado 3 de los CTCAE relacionada con el fármaco fue del 5,9%. Las ADR condujeron a la discontinuación del tratamiento en el 11% de los pacientes. La discontinuación del tratamiento debido a las ADR de diarrea y exantema/acné independientemente del grado de severidad, se produjo en el 3,8% y el 2,0% de los pacientes.
En la Tabla 8 se presentan las RAM clasificadas por SOC y términos preferentes del MedDRA reportados a partir de cualquiera de los grupos de dosis de GIOTRIF®, ordenados por población, obtenidos a partir del total de estudios de NSCLC, con dosis iniciales diarias de 40 mg y 50 mg de GIOTRIF®.
|
Tabla 9. Efectos secundarios identificados a partir del total de estudios de NSCLC con dosis diarias iniciales de 40 mg y 50 mg de GIOTRIF® como monoterapia y de la experiencia posterior a la comercialización |
|
Infecciones |
|
Paroniquia Cistitis |
|
Trastornos del metabolismo y de la nutrición |
|
Disminución del apetito Deshidratación Hipopotasemia |
|
Trastornos del sistema nervioso |
|
Disgeusia |
|
Trastornos oculares |
|
Conjuntivitis Sequedad ocular Queratitis |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
Epistaxis Rinorrea Enfermedad pulmonar intersticial |
|
Trastornos gastrointestinales |
|
Diarrea Estomatitis Queilitis Dispepsia Náuseas Vómitos Pancreatitis Perforación gastrointestinal |
|
Trastornos hepatobiliares |
|
Elevación de la alanina aminotransferasa Elevación de la aspartato aminotransferasa |
|
Trastornos de la piel y del tejido subcutáneo |
|
Erupción cutánea Dermatitis acneiforme Prurito Piel seca Síndrome de eritrodisestesia palmoplantar Síndorme de Stevens-Johnson* Necrólisis epidérmica tóxica* Alteraciones en las uñas *derivados de la experiencia posterior a la comercialización |
|
Trastornos musculoesqueléticos y del tejido conectivo |
|
Espasmos musculares |
|
Trastornos renales y urinarios |
|
Deterioro renal / Insuficiencia renal |
|
Trastornos generales y afecciones del sitio de administración |
|
Pirexia |
|
Investigaciones |
|
Descenso de peso |
|
En Argentina: “Ante cualquier inconveniente con el producto, el paciente puede llenar la ficha que está en la página web de la ANMAT: http://www.anmat.gov.ar/farmacovigilancia/Notificar.asp O llamar a ANMAT responde 0800-333-1234” |
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones medicamentosas farmacocinéticas Transportadores del fármaco:
Glucoproteína P (P-gp)
Efecto de los inhibidores e inductores de la P-gp sobre afatinib
Se realizaron dos estudios para evaluar el efecto de ritonavir, un potente inhibidor de la P-gp, sobre la farmacocinética de afatinib. En un estudio, se investigó la biodisponibilidad relativa de afatinib cuando se administró ritonavir (200 mg b.i.d. durante tres días), ya sea en forma simultánea o 6 horas después de una dosis única 40 mg de GIOTRIF®. La biodisponibilidad relativa de afatinib fue del 119 % (AUC0-∞) y el 104 % (Cmáx) cuando se administró de manera simultánea con ritonavir y de 111 % (AUC0-∞) y el 105 % (Cmáx) cuando ritonavir se administró 6 horas después de GIOTRIF®. En un segundo estudio, cuando ritonavir (200 mg b.i.d. durante tres días) se administró 1 hora antes de una dosis única de 20 mg de GIOTRIF®, la exposición a afatinib aumentó un 48 % (AUC0-∞) y un 39 % (Cmáx) (ver “Posología y administración", “Advertencias y precauciones especiales” e “Interacciones”).El pretratamiento con rifampicina (600 mg q.d. durante 7 días), un potente inductor de la P-gp, disminuyó la exposición plasmática a afatinib un 34% (AUC0-∞) y un 22% (Cmáx) después de la administración de una dosis única de 40 mg de GIOTRIF® (ver “Advertencias y precauciones especiales” e “Interacciones”).
Efecto de afatinib sobre los sustratos de la P-gp Sobre la base de los datos in vitro, se ha determinado que afatinib es un inhibidor moderado de la P-gp. Se considera improbable que el tratamiento con GIOTRIF® se traduzca en cambios en las concentraciones plasmáticas de otros sustratos de la P gp.
Proteína de Resistencia del Cáncer de Mama (BCRP)
Los estudios in vitro indicaron que afatinib es un sustrato y un inhibidor del transportador BCRP (breast cancer resistance protein).
Sistemas de transporte de captación del fármaco Los datos in vitro indicaron que se considera improbable que se produzcan interacciones medicamentosas con afatinib como consecuencia de la inhibición de los transportadores OATB1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT1, OCT2, y OCT3.
Enzimas metabolizadoras del fármaco
Enzimas del citocromo P450 (CYP)
Efectos de las enzimas del CYP inductoras e inhibidoras de afatinib
Los datos in vitro indicaron que es improbable que se produzcan interacciones medicamentosas con afatinib como consecuencia de una inhibición o inducción de las enzimas del CYP por la medicación concomitante. En los seres humanos, se ha determinado que las reacciones metabólicas catalizadas por enzimas desempeñan un papel insignificante en el metabolismo de afatinib. Aproximadamente, el 2 % de la dosis de afatinib fue metabolizada por FMO3 y la N-desmetilación dependiente del CYP3A4 fue demasiado baja para ser detectada en forma cuantitativa.
Efecto de afatinib sobre las enzimas del CYP
Afatinib no es un inhibidor ni un inductor de las enzimas del CYP. Por lo tanto, es improbable que GIOTRIF® afecte el metabolismo de otros fármacos que dependan de las enzimas del CYP.
UDP-glucuronosiltransferasa 1A1 (UGT1A1)
Sobre la base de datos in vitro, se considera improbable que se produzcan interacciones medicamentosas con afatinib como consecuencia de la inhibición de UGT1A1.
Farmacodinamia
Electrofisiología cardíaca
GIOTRIF® en dosis diarias de 50 mg no provocó ninguna prolongación significativa del intervalo QTcF tras la administración de dosis únicas y múltiples en pacientes con tumores sólidos recidivantes o refractarios. No hubo ningún hallazgo cardíaco de seguridad que fuera un motivo de inquietud desde el punto de vista clínico. Esto sugiere que GIOTRIF® no tiene un efecto relevante sobre el intervalo QTcF.
Interacciones
Interacciones con la glucoproteína P (P-gp)
Sobre la base de los datos in vitro, se ha determinado que afatinib es un sustrato de la P-gp. Los datos clínicos indican que la administración concomitante de inhibidores o inductores potentes de la P-gp pueden alterar la exposición a afatinib. Los resultados de un estudio de interacción farmacológica demostraron que GIOTRIF® puede combinarse de manera segura con inhibidores de la P-gp (como ritonavir) siempre que el inhibidor se administre de forma simultánea al GIOTRIF® o después de éste. Si se administran antes de GIOTRIF®, los inhibidores potentes de la P-gp (incluyendo, entre otros, ritonavir, ciclosporina A, ketoconazol, itraconazol, eritromicina, verapamilo, quinidina, tacrolimus, nelfinavir, saquinavir y amiodarona) pueden aumentar la exposición a afatinib y deben utilizarse con precaución (ver las secciones “Posología y administración”, “Advertencias y precauciones especiales” y “Farmacocinética”).
Los inductores potentes de P-gp (incluyendo, entre otros, rifampicina, carbamazepina, fenitoína, fenobarbital o hierba de San Juan) pueden reducir la exposición a afatinib (ver las secciones “Advertencias y precauciones especiales” y “Farmacocinética”).
Efecto de los alimentos sobre afatinib
La coadministración de una comida de alto contenido graso con GIOTRIF® dio como resultado una disminución significativa de la exposición a afatinib de aproximadamente, un 50 % en lo que respecta a la Cmáx y de un 39 % en lo que respecta al AUC0-∞. GIOTRIF® se debe administrar lejos de las comidas (ver “Posología y administración” y “Farmacocinética”).
INFORMACIÓN COMPLEMENTARIA:
Fabricado por Boehringer Ingelheim Pharma GmbH & Co. KG, Ingelheim am Rheim, Alemania. Industria Alemana. Bajo licencia de Boehringer Ingelheim International GmbH, Ingelheim am Rhein, Alemania.
En Argentina: Importado por: Boehringer Ingelheim S.A. Juana Azurduy 1534 C.A.B.A. Tel. (011)-4704-8333
Director Técnico: Marcelo Ostrower, Farmacéutico y Bioquímico.
Especialidad medicinal autorizada por el Ministerio de Salud. Certificado N° 57.296.
En Paraguay: Importado por: Lab. Bagó del Paraguay S.A. - Av. España 1525 - Reg. Q.F. Carolina Delgado. R.P. N° 4599. Distribuido por: Intercom Farmacéutica S.A. - Tte. Rómulo Ríos - Depósito Nº 6. Tel.: 021-614.661. Venta aut. por la D.N.V.S. del M.S.P. y B.S. Reg.Sanitario N° 20286-01-EF (20 mg), 20289-01-EF (30 mg), 20226-02-EF (40 mg) y 20285-01-EF (50mg).
En Ecuador: Importado y distribuido por Boehringer Ingelheim del Ecuador Cía. Ltda., Quito, Ecuador.
RECOMENDACIONES:
Advertencias y precauciones especiales
Evaluación del estado de mutación del EGFR [solamente para NSCLC positivo para mutación del EGFR] Cuando se evalúe el estado de mutación del EGFR de un paciente, es importante elegir una metodología bien validada y robusta para evitar resultados falsos negativos o falsos positivos.
Diarrea
Se ha informado diarrea, incluso diarrea severa, durante el tratamiento con GIOTRIF® (ver sección “Reacciones adversas”). La diarrea puede causar deshidratación con o sin deterioro renal, cuadro éste que, en casos raros, ha tenido un desenlace fatal. La diarrea usualmente se presenta dentro de las 2 primeras semanas de tratamiento. La diarrea de Grado 3 se presenta con mayor frecuencia dentro de las primeras 6 semanas de tratamiento. El tratamiento proactivo de la diarrea, incluyendo la hidratación adecuada combinada con agentes antidiarreicos, en especial dentro de las primeras 6 semanas de tratamiento, es importante y debe iniciarse cuando aparecen los primeros signos de diarrea. Deben utilizarse antidiarreicos (p. ej., loperamida) y, de ser necesario, debe aumentarse gradualmente la dosis de los mismos hasta llegar a la dosis aprobada recomendada máxima. Los antidiarreicos deben estar fácilmente accesibles para los pacientes, de manera que el tratamiento pueda iniciarse ante los primeros signos de diarrea y continuarse hasta que las deposiciones blandas hayan cesado durante 12 horas. Puede ser necesario que los pacientes con diarrea severa tengan que interrumpir o reducir la dosis o discontinuar el tratamiento con GIOTRIF® (ver la sección “Posología y administración”). En caso de deshidratación, puede ser necesario que los pacientes reciban electrolitos y líquidos por vía intravenosa. Eventos adversos cutáneos relacionados
En pacientes tratados con GIOTRIF® se ha informado erupción cutánea/acné (ver la sección “Reacciones adversas”). En general, la erupción cutánea se manifiesta como una erupción eritematosa y acneiforme leve o moderada, que puede producirse o empeorar en las zonas expuestas al sol. Se aconseja el uso de ropa de protección y/o el uso de pantalla solar en los pacientes que se expongan al sol. La intervención temprana (p. ej., emolientes, antibióticos) de las reacciones dermatológicas puede facilitar la continuación del tratamiento con GIOTRIF®.
Los pacientes con reacciones cutáneas severas o prolongadas también pueden requerir la interrupción temporaria del tratamiento, una reducción de la dosis (ver “Posología y administración”), intervenciones terapéuticas adicionales o derivación a un especialista con experiencia en el manejo de estos efectos dermatológicos. Se han notificado cuadros cutáneos con lesiones bullosas, vesiculares y exfoliativas, incluyendo casos raros indicativos de síndrome de Stevens-Johnson y necrólisis epidérmica tóxica. Se debe interrumpir o discontinuar el tratamiento con GIOTRIF® si el paciente presenta cuadros con lesiones bullosas, vesiculares o exfoliativas severas. Sexo femenino, bajo peso corporal y deterioro renal subyacente
Se ha observado una mayor exposición a afatinib en pacientes de sexo femenino, en pacientes con bajo peso corporal y en pacientes con deterioro renal subyacente (ver “Farmacocinética”). Esto podría dar como resultado un mayor riesgo de padecer eventos adversos mediados por el EGFR, como diarrea, erupción cutánea/acné y estomatitis. Se recomienda un monitoreo más estrecho en los pacientes con dichos factores de riesgo.
Enfermedad Pulmonar Intersticial (ILD)
Se han informado casos de ILD o eventos similares a la ILD (como infiltración pulmonar, neumonitis, síndrome de distrés respiratorio agudo, alveolitis alérgica), incluyendo casos con desenlace fatal, en pacientes que recibieron GIOTRIF® para el tratamiento del NSCLC. Los eventos similares a la ILD relacionados con el fármaco de todos los grados se informaron en el 0,7 % de pacientes tratados con GIOTRIF® en todos los estudios clínicos ( 0,5% de pacientes con NSCLC con reacciones adversas similares a la ILD de Grado ≥3 según los CTCAE (ver la sección “Reacciones adversas”). No se han estudiado pacientes con antecedentes de ILD. Se debe realizar una evaluación cuidadosa de todos los pacientes con un comienzo agudo y/o un empeoramiento inexplicable de síntomas pulmonares (disnea, tos, fiebre) para excluir la posibilidad de un cuadro de ILD. Se debe interrumpir la administración de GIOTRIF® mientras se investigan dichos síntomas. Si se diagnostica ILD, GIOTRIF® se discontinuará de forma permanente y se instaurará el tratamiento adecuado según sea necesario (ver la sección “Posología y administración”).
Insuficiencia hepática severa
Se ha notificado insuficiencia hepática, incluyendo casos con desenlace fatal, durante el tratamiento con GIOTRIF® en menos del 1 % de los pacientes. En dichos pacientes, existían factores de confusión tales como hepatopatía preexistente y/o comorbilidades asociadas con la progresión de la enfermedad maligna subyacente. Se recomienda la realización de pruebas de función hepática periódicas en los pacientes con afecciones hepáticas preexistentes. La interrupción de la dosis de GIOTRIF® puede llegar a resultar necesaria en pacientes que presenten empeoramiento de la función hepática (ver la sección “Posología y administración”). Se debe discontinuar el tratamiento con GIOTRIF® en los pacientes que desarrollen un insuficienciaGIOTRIF®hepática severa mientras reciban dicho fármaco.
Perforaciones gastrointestinales
Se han informado perforaciones gastrointestinales, inclusive casos fatales, durante el tratamiento con GIOTRIF® en el 0,2% de los pacientes en todos los estudios clínicos controlados aleatorizados. En la mayoría de los casos, se asoció la perforación gastrointestinal con otros factores de riesgo conocidos, inclusive las medicaciones concomitantes como los corticoides, AINE o agentes antiangiogénicos, antecedente subyacente de úlcera gastrointestinal, enfermedad diverticular subyacente, edad o metástasis en intestinos, en los sitios de perforación. En los pacientes que presentan perforación gastrointestinal mientras están recibiendo GIOTRIF®, se debe interrumpir el tratamiento de manera definitiva.
Queratitis
Los pacientes que presenten síntomas como inflamación ocular aguda o empeoramiento de la misma, lagrimación, sensibilidad a la luz, visión borrosa, dolor ocular y/u ojos rojos deben ser derivados sin demora a un especialista en oftalmología. Si se confirma un diagnóstico de queratitis ulcerativa, se debe interrumpir o discontinuar el tratamiento con GIOTRIF®. Si se diagnostica queratitis, los beneficios y riesgos de continuar el tratamiento deben ser cuidadosamente sopesados. GIOTRIF® debe utilizarse con precaución en pacientes con antecedentes de queratitis, queratitis ulcerativa y sequedad ocular severa. El uso de lentes de contacto constituye también un factor de riesgo para la queratitis y la ulceración (ver la sección “Reacciones adversas”).
Función ventricular izquierda
La disfunción ventricular izquierda se ha asociado con la inhibición del HER2. Sobre la base de los datos de estudios clínicos disponibles, no existen indicios de que GIOTRIF® provoque efectos adversos sobre la contractilidad cardíaca. Sin embargo, GIOTRIF® no ha sido estudiado en pacientes con anomalías de la Fracción de Eyección Ventricular Izquierda (LVEF) o antecedentes de afecciones cardíacas importantes. En los pacientes que tengan factores de riesgo cardíacos y en los pacientes con trastornos que puedan afectar la LVEF, debe considerarse un control cardíaco, incluyendo una evaluación de la LVEF al inicio del tratamiento con GIOTRIF® y durante el mismo. En los pacientes que desarrollan signos/síntomas cardíacos relevantes durante el tratamiento, debe considerarse un control cardíaco, que incluya la evaluación de la LVEF.
En los pacientes cuya fracción de eyección sea menor que el límite inferior del rango normal de la institución, debe considerarse la realización de una consulta cardiológica y la interrupción o discontinuación del tratamiento con GIOTRIF®.
Interacciones con la glucoproteína P (P-gp)
Los inhibidores potentes de la P-gp pueden conducir a una mayor exposición a afatinib si se administran antes de la toma de GIOTRIF®, y es por ello que se deben utilizar con precaución. Si fuera necesario administrar inhibidores de la P-gp, deben administrarse en forma simultánea con la toma de GIOTRIF® o posteriormente. El tratamiento concomitante con inductores potentes de la P-gp puede reducir la exposición a afatinib (ver “Posología y administración”, “Interacciones” y “Farmacocinética”). Lactosa
GIOTRIF® contiene lactosa. Los pacientes con trastornos hereditarios raros de intolerancia a la galactosa, deficiencia de lactasa Lapp o mala absorción de glucosa-galactosa no deben tomar este medicamento.
Embarazo, lactancia y fertilidad:
Embarazo
Categoría D
Resumen de riesgo:
Basado en su mecanismo de acción, Afatinib puede causar daño fetal si se administra a mujeres embarazadas. Afatinib fue embriotóxico, en animales con toxicidad materna, condujo a abortos en estadios tardíos gestacionales en conejos, a dosis de 5 mg/kg (aproximadamente, 0.2 veces la exposición por AUC (Área bajo la curva) de la dosis recomendada en humanos de 40 mg/día) o mayor. Si esta droga es utilizada durante el embarazo, o si la paciente resulta embarazada mientras la está recibiendo, la paciente debe ser advertida de los riesgos potenciales para el feto.
Datos en animales
La administración de afatinib a conejos embarazados en dosis de 5 mg/kg (aproximadamente, 0.2 veces la exposición por AUC (área bajo la curva) de la dosis recomendada en humanos de 40 mg/día) o mayores durante el período de organogénesis causó incremento de pérdidas post implantación y, en animales mostrando toxicidad materna, aborto en estadios gestacionales tardíos. En el mismo estudio, con la dosis alta de 10 mg/kg (aproximadamente, 0.7 veces la exposición por AUC (área bajo la curva) de la dosis recomendada en humanos de 40 mg/día) hubo reducción del peso fetal, e incremento en la incidencia de enanismo, así como variaciones dérmicas y de las vísceras. En un estudio de desarrollo embriofetal en ratas, hubo alteraciones esqueléticas que consistieron en osificaciones retardadas o incompletas y peso fetal reducido a la dosis de 16 mg/kg (aproximadamente, dos veces la exposición a la dosis recomendada en humanos de 40 mg/día).
Lactancia
En base a los datos no clínicos, es probable que afatinib sea excretado en la leche humana. No se puede excluir un riesgo para el lactante. Se debe informar a las madres que no deben amamantar mientras reciban GIOTRIF®.
Fertilidad
No se han realizado estudios de fertilidad en seres humanos con GIOTRIF®. Los datos de toxicología no clínicos disponibles han indicado efectos sobre los órganos reproductores con dosis elevadas (ver “Carcinogenésis, Mutagenesis y trastornos de la Fertilidad”). Por lo tanto, no se puede descartar la posibilidad de que el tratamiento con GIOTRIF® tenga efectos adversos sobre la fertilidad en los seres humanos.
Carcinogenésis, mutagénesis y trastornos de la fertilidad
No se han conducido estudios de carcinogénesis con Afatinib.
Se observó una respuesta marginal a Afatinib en un ensayo de testeo de mutagenicidad en un cultivo bacteriano (Ames). No se identificó potencial mutagénico o genotóxico en un test in vitro de aberraciones cromosómicas a concentraciones no tóxicas, así como en ensayos in vivo de micronúcleos de médula ósea, ensayo in vivo Comet, y en un estudio oral mutacional de 4 semanas in vivo en ratones Muta Mouse. En un estudio dedicado a fertilidad, ratas machos y hembras recibieron afatinib vía oral a dosis de 4, 6 u 8 mg/kg. En machos, a la dosis de 6 mg/kg (aproximadamente, la misma exposición por AUC (área bajo la curva) de la dosis recomendada en humanos de 40 mg/día) o mayor, hubo un incremento en la incidencia de ausencia o recuento bajo de esperma, aunque la fertilidad no fue globalmente afectada; las disminuciones en el esperma se superpusieron con hallazgos de incremento de apoptosis en los testículos y atrofia en las vesículas seminales y en la próstata, en los estudios de toxicidad generales. En hembras, a las altas dosis de 8 mg/kg (aproximadamente, 0.63 veces la exposición por AUC (área bajo la curva) de la dosis recomendada en humanos de 40 mg/día), hubo una disminución leve del número de cuerpos lúteos junto con un leve incremento de pérdida post-implantación debido a reabsorciones tempranas. En un estudio de toxicología general de 4 semanas, las ratas hembras tuvieron disminución del peso ovárico a todos los niveles de dosis; el peso del órgano no fue recuperado para el final del período de 2 semanas de recuperación.
DOSIS Y VÍA DE ADMINISTRACIÓN:
La dosis recomendada de GIOTRIF®
• para los pacientes con NSCLC positivo para mutación del EGFR, no tratados previamente con un inhibidor de la tirosina cinasa del EGFR (pacientes vírgenes de tratamiento con un EGFR TKI) es 40 mg por vía oral una vez al día.
• para los pacientes con NSCLC positivo para mutación del EGFR tratados previamente con un EGFR TKI es 50 mg por vía oral una vez al día.
• para los pacientes con NSCLC escamoso que han recibido previamente régimen de primera línea con platino es 40 mg por vía oral una vez al día.
GIOTRIF® se debe administrar sin alimentos. No se deben consumir alimentos al menos 3 horas antes y 1 hora después, como mínimo, de haber tomado GIOTRIF® (ver “Interacciones” y “Farmacocinética”). Los comprimidos deben tragarse enteros, con agua.
El tratamiento con GIOTRIF® se debe continuar hasta la progresión de la enfermedad o hasta que el paciente ya no lo tolere (ver Tabla 1 a continuación).
Aumento escalonado de dosis
Se puede considerar un aumento de dosis hasta una dosis máxima de 50 mg/día en los pacientes que toleren una dosis inicial de 40 mg/día (es decir, ausencia de diarrea, erupción cutánea, estomatitis y otros eventos relacionados con el fármaco de Grado > 1 según los CTCAE) el primer ciclo de tratamiento (para la definición de ciclo de tratamiento ver Propiedades farmacológicas). La dosis no se debe escalar en los pacientes con una reducción de dosis anterior. No está recomendado el escalamiento de dosis en pacientes tratados previamente con un EGFR TKI.La dosis diaria máxima en todos los casos es 50 mg. Ajuste de dosis por reacciones adversas
Las reacciones adversas al medicamento sintomáticas (p. ej., diarrea severa/persistente o reacciones adversas cutáneas) pueden manejarse exitosamente mediante la interrupción del tratamiento y la implementación de reducciones de la dosis de GIOTRIF® según se detalla en la Tabla 1 (ver sección “Reacciones Adversas”; para más detalles sobre el manejo de los eventos adversos (AEs) específicos relacionados con el medicamento, ver “Advertencias y Precauciones especiales”).
|
Tabla 7. Información sobre el ajuste de dosis por reacciones adversas |
||
|
Evento adverso relacionado con el medicamento según los CTCAEa |
Posología recomendada de GIOTRIF® |
|
|
Grado 1 o Grado 2 |
No interrumpir b |
Ningún ajuste de dosis |
|
Grado 2 (prolongado c o intolerable) o Grado > 3 |
Interrumpir hasta recuperación a Grado 0/1 b |
Reanudar con reducción de dosis en disminuciones de 10 mg d |
|
a Criterios Terminológicos Comunes del NCI para Eventos Adversos v3.0 b En el caso de diarrea, se deben administrar medicamentos antidiarreicos (p. ej., loperamida) de inmediato y continuarlos en caso de diarrea persistente hasta que cesen las deposiciones líquidas. c >48 horas de diarrea y/o >7 días de erupción cutánea d Si un paciente no puede tolerar 20 mg/día, se debe considerar la discontinuación permanente de GIOTRIF® |
||
Si un paciente presenta un cuadro de síntomas respiratorios agudo o un empeoramiento de tales síntomas, se debe considerar la posibilidad de enfermedad pulmonar intersticial (interstitial lung disease, ILD), en cuyo caso GIOTRIF® debe interrumpirse hasta tanto esté disponible el resultado de la evaluación. Si se diagnostica ILD, GIOTRIF® se debe discontinuar y se debe instaurar el tratamiento adecuado, según sea necesario [ver “Advertencias y precauciones especiales”].
Se debe discontinuar permanentemente afatinib por:
Lesiones cutáneas bullosas, ampollares o exfoliativas que pongan en peligro la vida (ver Advertencias y precauciones especiales)
Enfermedad pulmonar intersticial confirmada (ver Advertencias y precauciones especiales)
Deterioro hepático severo inducido por drogas (ver Advertencias y precauciones especiales)
Queratitis ulcerativa persistente (ver Advertencias y precauciones especiales)
Disfunción ventricular izquierda sintomática (ver Advertencias y precauciones especiales) Reacciones adversas severas o intolerables ocurriendo a la dosis de 20 mg por día.
Dosis omitidas
Si se omite una dosis de GIOTRIF®, se debe tomar durante el mismo día tan pronto como el paciente lo recuerde. No obstante, si la próxima dosis programada se debiera tomar dentro de las siguientes 8 horas, entonces la dosis omitida se debe saltear.
Poblaciones especiales
Pacientes con insuficiencia renal
Se observó un aumento de la exposición a afatinib en los pacientes con insuficiencia renal moderada o grave (ver la sección “Farmacocinética”). No es necesario realizar ajustes en la dosis inicial de los pacientes con insuficiencia renal leve, moderada o grave (eGFR 15-29 ml/min). Debe realizarse un monitoreo de los pacientes con insuficiencia renal grave y ajustar la dosis de GIOTRIF® en caso de intolerancia. No se recomienda el tratamiento con GIOTRIF® en pacientes con eGFR < 15 ml/min o sometidos a diálisis.
Pacientes con insuficiencia hepática
La exposición a afatinib no cambia significativamente en pacientes con deterioro hepático leve (Child Pugh A) o moderado (Child Pugh B) (ver la sección “Farmacocinética”). No es necesario realizar ajustes en la dosis inicial en los pacientes con insuficiencia hepática leve o moderado. GIOTRIF® no ha sido estudiado en pacientes con insuficiencia hepática severa (Child Pugh C), por lo tanto no se recomienda su utilización en este grupo de pacientes.
Edad, raza, sexo
No es necesario ningún ajuste de dosis en función de la edad, la raza o el sexo del paciente (ver la sección “Farmacocinética”).
Población pediátrica
La seguridad y la eficacia de GIOTRIF® no han sido estudiadas en pacientes pediátricos. Por lo tanto, no se recomienda el tratamiento con GIOTRIF® en niños o adolescentes.
Uso de inhibidores de la glucoproteína P (P-gp) En el caso de que sea necesario el tratamiento con inhibidores de la P-gp, los mismos deben administrarse en forma simultánea con GIOTRIF® o después de la toma de este fármaco.
Para pacientes que requieran una terapia con un inhibidor de la PGP se reducirá 10 mg la dosis diaria de GIOTRIF®, si no es tolerada, y se volverá a la dosis habitual después de la discontinuación del inhibidor la PGP (ver las secciones “Advertencias y Precauciones especiales”, “Interacciones” y “Farmacocinética”).
Uso de inductores de la glucoproteína P (P-gp) Para pacientes que requieran una terapia crónica con un inductor de la PGP se aumentará 10 mg la dosis diaria de GIOTRIF®, si es tolerada, y se volverá a la dosis habitual dos a tres días después de la discontinuación del inductor de la PGP (ver “Advertencias y precauciones especiales”, “Interacciones” y “Farmacocinética”).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas
La dosis más alta de GIOTRIF® estudiada en un número limitado de pacientes en estudios clínicos de Fase I es de 160 mg una vez al día durante 3 días y de 100 mg una vez al día durante 2 semanas. Las reacciones adversas observadas con esta dosis fueron principalmente de tipo dermatológico (erupción cutánea/acné) y gastrointestinal (especialmente diarrea). Los casos de sobredosis en 2 adolescentes sanos, que involucraron la ingesta de 360 mg de GIOTRIF® cada uno (como parte de una ingesta farmacológica mixta), estuvieron asociados con reacciones adversas al fármaco que consistieron en náuseas, vómitos, astenia, mareos, cefalea, dolor abdominal y elevación de la amilasa (<1,5 veces el límite superior del rango normal [upper limit of normal, ULN]). Ambos sujetos se recuperaron de dichos eventos adversos.
Tratamiento
No existe un antídoto específico para la sobredosis de GIOTRIF®. Cuando se sospeche de una sobredosis, se debe suspender GIOTRIF® e instituir cuidado de soporte. Si está indicado, se puede lograr la eliminación del afatinib no absorbido mediante vómitos o lavado gástrico.
En Argentina: "Ante esta eventualidad concurrir al hospital o comunicarse con los centros de toxicología: Htal. de Niños R. Gutiérrez tel. 011-4962-6666/2247, Htal. P. de Elizalde tel. 011-4300-2115, Htal. Fernández tel. 011-4801-5555 y Htal. A. Posadas tel. 011-4658-7777/4654-6648."
En Paraguay concurrir al hospital más cercano o comunicarse con el Hospital de Emergencias Médicas – Centro Nacional de Toxicología – Tel 220-418- Gral. Santos y Teodoro Mongelos.
En Ecuador: Notificación de Reacciones Adversas a Medicamentos: “Es importante notificar las sospechas de reacciones adversas después de la autorización del medicamento. Se invita a los usuarios así como a los profesionales de la salud a notificar las sospechas de reacciones adversas al siguiente e-mail: pv_local_ecuador@boehringer-ingelheim.com; cel. +593 994870886.
Mediante la notificación Ud. puede contribuir a proporcionar mayor información sobre la seguridad del medicamento.”
PRESENTACIÓN:
Presentaciones
Blísters: Envases con 14, 21 y 28 comprimidos recubiertos.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Condiciones de conservación y almacenamiento Consérvese a temperatura no mayor a 30°C. Almacenar en su envase original para proteger de la humedad y la luz.
BIBLIOGRAFÍA:
Estudios clínicos
GIOTRIF® en cáncer de pulmón de células no pequeñas (NSCLC)
La eficacia y seguridad de la monoterapia de GIOTRIF® en el tratamiento de pacientes con NSCLC con mutaciones del EGFR se demostró en 4 estudios aleatorizados y controlados (LUX-Lung 3, 1200.32; LUX-Lung 6; 1200.34; LUX-Lung 1, 1200.23 y LUX-Lung 7, 1200.123, en un estudio a gran escala de Fase III (LUX-Lung 5, 1200.42) y en un estudio a gran escala de rama única de Fase II (LUX-Lung 2, 1200.22). En los estudios LUX-Lung 3, LUX-Lung 6, LUX-Lung 7 y LUX-Lung 2 se enrolaron pacientes con mutación positiva del EGFR no tratados previamente con un EGFR TKI. En los estudios LUX-Lung 1 y LUX-Lung 5 se reclutaron pacientes clínicamente enriquecidos en términos de mutaciones del EGFR que habían recibido tratamiento previo con un EGFR TKI (gefitinib o erlotinib) y tuvieron progresión de la enfermedad con dicho tratamiento. Se esperaba que las poblaciones de los estudios LUX-Lung 1 y 5 contuvieran una gran proporción de pacientes con mutación de resistencia T790M, la cual es detectable en aproximadamente, el 50 % de los pacientes con NSCLC previamente responsivos que presentan resistencia a erlotinib y/o gefitinib.
La eficacia y la seguridad de GIOTRIF® como tratamiento de segunda línea para pacientes con NSCLC de histología escamosa se investigó en un estudio de diseño no ciego controlado con tratamiento activo LUX-Lung 8.
GIOTRIF® en pacientes con mutación positiva del EGFR no tratados previamente con un EGFR TKI
LUX-Lung 3 (1200.32)
En el contexto del tratamiento de primera línea, se evaluó la eficacia y seguridad de GIOTRIF® en pacientes con NSCLC localmente avanzado o metastásico (estadio IIIB o IV) positivo para mutación del EGFR en un estudio internacional, aleatorizado, multicéntrico, de diseño abierto (LUX-Lung 3). Los pacientes, que no habían recibieron tratamiento sistémico previo para su enfermedad avanzada o metastásica, fueron sometidos a pruebas destinadas a detectar la presencia de 29 mutaciones del EGFR diferentes, usando un método basado en una Reacción de Polimerasa en Cadena (PCR) (TheraScreen®: EGFR29 Mutation Kit, Qiagen Manchester Ltd.). Los pacientes (N = 345) fueron aleatorizados (en una proporción de 2:1) a recibir 40 mg de GIOTRIF® por vía oral una vez al día (N = 230) o bien un total de hasta 6 ciclos de pemetrexed/cisplatino (N = 115). La aleatorización se estratificó en función del estado de mutación del EGFR (L858R; Del 19; otra) y de la raza (asiática, no asiática). Se permitió el ajuste creciente de la dosis de GIOTRIF® hasta 50 mg después de 21 días de tratamiento en el caso de que el paciente no presentara ningún evento adverso relacionado con el medicamento o de que, en el caso de presentarse, el evento adverso fuera limitado (es decir, ausencia de diarrea, erupción cutánea, estomatitis y/u otros eventos relacionados con el fármaco > Grado 1 de los CTCAE), y de que cumpliera con el régimen posológico de GIOTRIF® y no hubiera tenido ninguna reducción de la dosis en el pasado.
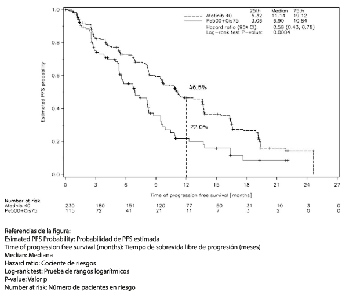
El criterio de valoración primario de progresión libre de enfermedad (progression free survival, PFS) (revisión independiente, 221 eventos) indicó una mejoría estadísticamente significativa en la mediana de PFS entre los pacientes tratados con GIOTRIF® y aquellos tratados con quimioterapia (11,1 vs. 6,9 meses). Cuando se compararon los subgrupos preespecificados de mutaciones frecuentes del EGFR (L858R o Del 19), las diferencias en términos de PFS fueron más pronunciadas (13,6 vs. 6,9 meses). El porcentaje de pacientes vivos y sin progresión (tasa de PFS) a los 12 meses fue 46,5 % en los pacientes tratados con GIOTRIF® y del 22 % en los pacientes tratados con quimioterapia para la población total del estudio, y del 51,1 % frente a un 21,4 % en el caso del subgrupo de mutaciones frecuentes.
La curva de Kaplan-Meier del análisis primario de PFS se presenta en la Figura 1 y los resultados de eficacia se resumen en la Tabla 5. Al momento de la realización del análisis primario de PFS, un total de 45 (20%) pacientes tratados con GIOTRIF® y 3 (3%) pacientes tratados con quimioterapia estaban vivos y libres de progresión; de esta manera, sus datos están censurados en la Figura 1.
Figura 1. Curva de Kaplan-Meier para la PFS, por revisión independiente, por grupo de tratamiento, en el Estudio LUX-Lung 3 (población total)
|
Tabla 1 . Resultados de eficacia GIOTRIF® vs. pemetrexed/cisplatino |
|||
|
GIOTRIF® (N = 230) |
Pemetrexed/ Cisplatino (N = 115) |
Cociente de riesgo (hazard ratio, HR) / Cociente de probabilidades (odds ratio, OR) (IC del 95 %) Valor p4 |
|
|
PFS, Población general del estudio Meses (mediana) Tasa de PFS a 1 año Tasa de PFS a 18 meses |
11,1 46,5 % 26,4 % |
6,9 22 % 8,6 % |
HR 0,58 (0,43-0,78) 0,0004 |
|
PFS, Pacientes con mutaciones L858R o Del 19 1 Meses (mediana) Tasa de PFS a 1 año Tasa de PFS a 18 meses |
13,6 51,1 % 28,6 % |
6,9 21,4 % 7,4 % |
HR 0,47 (0,34-0,65) < 0,0001 |
|
Tasa de respuesta objetiva (CR+PR) 2 |
56,1 % |
22,6 % |
OR 4,66 (2,77-7,83) < 0,0001 |
|
Tasa de control de la enfermedad (CR+PR+SD) 2 |
90,0 % |
80,9 % |
OR 2,14 (1,13-4,04) 0,0189 |
|
Duración de la respuesta Meses (mediana) |
11,1 |
5,5 |
- |
|
Sobrevida general (OS), Población del estudio total Meses (mediana) 3 |
28,2 |
28,2 |
HR 0,88 (0,66, 1,17) 0,39 |
|
1 N = 308 (GIOTRIF®: 204, pemetrexed/cisplatino: 104) 2 CR = respuesta completa (complete response); PR = respuesta parcial (partial response); SD = enfermedad estable (stable disease) 3 Análisis de OS actualizado a diciembre de 2013 4 Valor de -p para la PFS/OS basado en la prueba de rangos logarítmicos estratificada; Valor de -p para la Tasa de Respuesta Objetiva y Tasa de Control de la Enfermedad basado en regresión logística. |
|||
El análisis de la PFS basado en la revisión del investigador arrojó resultados similares (mediana de PFS 11,1 vs. 6,7 meses, HR = 0,49, p < 0,0001) a los de la revisión independiente. El efecto sobre la PFS fue concordante dentro de los principales subgrupos, lo que incluyó el sexo, la edad, la raza, el estado ECOG y el tipo de mutación (L858R, Del 19) tanto en la revisión independiente como en la revisión del investigador. Sobre la base de la revisión del investigador, la ORR fue 69,1 % vs. 44,3 % y la DCR fue 90,0 % vs. 82,6 % en los pacientes tratados con GIOTRIF® en comparación con aquellos tratados con quimioterapia. En el subgrupo predefinido de mutaciones comunes (Del 19, L858R) para GIOTRIF (N = 203) y quimioterapia (N = 104), la mediana de OS fue 31,6 meses frente a 28,2 meses (HR = 0,78, IC del 95 % (0,58, 1,06), p = 0,1090). En los subgrupos predefinidos de mutaciones, la mediana de OS con GIOTRIF como tratamiento de primera línea vs. quimioterapia fue 33,3 meses vs. 21,1 meses (HR = 0,54 (IC del 95 % 0,36-0,79), p = 0,0015) en pacientes con Del19 (n=169) y 27,6 meses vs. 40,3 meses (HR=1,30(IC del 95 % 0,80-2,11), p = 0,2919) en pacientes con L858R (n=138).
El beneficio en términos de PFS estuvo acompañado por una mejoría en los síntomas relacionados con la enfermedad, según lo determinado mediante los Cuestionarios de Calidad de Vida (Quality of Life Questionnaires) (QLQ-C30 y QLQ-LC13) de la Organización Europea para la Investigación y el Tratamiento del Cáncer (European Organization for Research and Treatment of Cancer, EORTC). GIOTRIF® prolongó significativamente el tiempo hasta el deterioro de síntomas preespecificados de tos (HR 0,6; p = 0,0072) y disnea (HR 0,68; p = 0,0145) a razón de más de 7 meses en comparación con la quimioterapia. El tiempo hasta el deterioro del dolor también se prolongó, con GIOTRIF®, pero no alcanzó significancia estadística (HR 0,83; p = 0,1913). De manera estadísticamente significativa, un mayor número de pacientes tratados con GIOTRIF® tuvo mejoría de la disnea en comparación con aquellos tratados con quimioterapia (64 % vs. 50 %; p = 0,0103). Se observó una tendencia a favor de GIOTRIF® en lo que respecta al dolor (59 % vs. 48 %; p = 0,0513); con características individuales del dolor que alcanzaron mejoría con significancia estadística (“Con dolor”: 56,0 % vs. 40,0 %; p = 0,0095; “Dolor en el pecho”: 51,0 % vs. 37,0 %; p = 0,0184; “Dolor en el brazo o en el hombro”: 41,0 % vs. 26,0 %; p = 0,0103). En lo que a la tos se refiere, un número mayor de pacientes mejoró con GIOTRIF® (67 % vs. 60 %; p = 0,2444).
Los puntajes promedios a través del tiempo para la calidad de vida relacionada con la salud (health-related quality of life, HRQoL) se midieron con el cuestionario QLQ-C30 de la EORTC. Los puntajes medios a lo largo del tiempo para la calidad de vida general y el estado de general de salud fueron significativamente mejores con GIOTRIF® que con la quimioterapia. Los puntajes medios fueron significativamente mejores en 3 de los 5 dominios funcionales (físico, de rol y cognitivo) y no indicaron ninguna diferencia en los dominios de desempeño social y emocional.
LUX-Lung 6 (1200.34)
[33, 34, 66]
La eficacia y la seguridad de GIOTRIF® en pacientes asiáticos con adenocarcinoma de pulmón localmente avanzado o metastásico (estadio IIIB/IV) positivo para mutación del EGFR se evaluaron en un estudio aleatorizado, multicéntrico, de diseño abierto (LUX-Lung 6). Al igual que en el LUX-Lung 3, los pacientes que no habían recibido tratamiento sistémico previo para su enfermedad avanzada o metastásica fueron sometidos a pruebas destinadas a detectar la presencia de 29 mutaciones del EGFR diferentes, usando un método basado en una reacción de la cadena polimerasa (PCR) (TheraScreen®: EGFR29 Mutation Kit, Qiagen Manchester Ltd.).
Los pacientes (N = 364) fueron aleatorizados (en una proporción de 2:1) a recibir 40 mg de GIOTRIF® por vía oral una vez al día (N = 242) o bien un total de hasta 6 ciclos de gemcitabina/cisplatino (N = 122). La aleatorización se estratificó en función del estado de mutación del EGFR (L858R; Del 19; otra). Se permitió el ajuste creciente de la dosis de GIOTRIF® hasta 50 mg después del primer ciclo (21 días) de tratamiento en el caso de que los pacientes no presentaran ningún evento adverso relacionado con el medicamento o de que, en el caso de presentarse, el evento adverso fuera limitado (es decir, ausencia de diarrea, exantema cutáneo, estomatitis y/u otros eventos relacionados con el fármaco > Grado 1 de los CTCAE), de que cumplieran y no hubieran tenido ninguna reducción de la dosis en el pasado. Entre los pacientes aleatorizados, el 65% era de sexo femenino, la mediana de edad fue de 58 años y todos los pacientes fueron asiáticos. Los pacientes con mutación del EGFR frecuente (L858R o Del 19) representaron el 89% de la población del estudio.
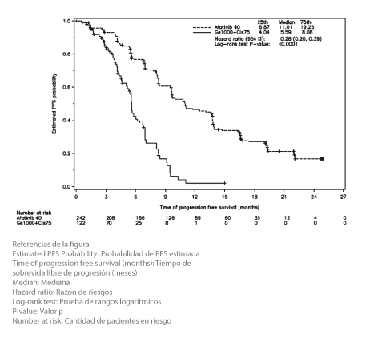
El criterio de valoración primario de sobrevida libre de progresión (PFS) (revisión independiente central, 221 eventos) indicó una mejoría estadísticamente significativa en la PFS para los pacientes tratados con GIOTRIF® comparados con aquellos tratados con quimioterapia (mediana de PFS 11,0 vs. 5,6 meses). Cuando se compararon los subgrupos pre especificados de mutaciones frecuentes del EGFR (L858R o Del 19), las diferencias en términos de la mediana de PFS fueron constantes (11,0 vs. 5,6 meses). Los porcentajes de pacientes vivos y libres de progresión (tasa de PFS) a los 12 meses fueron del 46,7% en los pacientes tratados con GIOTRIF® y del 2,1% en los pacientes tratados con quimioterapia para la población total del estudio, y del 56,4% versus 4,4% en el caso del subgrupo de mutaciones frecuentes.
Las curvas de Kaplan-Meier del análisis primario de PFS se presentan en la Figura 2 y los resultados de eficacia se resumen en la Tabla 6. Al momento de la realización del análisis primario de PFS, un total de 57 (15,7%) pacientes tratados con GIOTRIF® estaba vivo y libre de progresión; de esta manera, sus datos están censurados en la Figura 2.
Figura 2. Curvas de Kaplan-Meier para la PFS, por revisión independiente, por grupo de tratamiento, en el Estudio LUX-Lung 6
(análisis primario, población total)
|
Tabla 2. Resultados de eficacia de GIOTRIF® vs. gefitinib (Estudio LUX-Lung 6) obtenidos sobre la base del análisis primario de la PFS |
|||
|
GIOTRIF® (N = 242 |
Gefitinib/Cisplatino (N = 122) |
Razón riesgos (HR) / Cociente de probabilidades (OR) (IC del 95%) Valor p4 |
|
|
PFS, Población general del estudio Meses (mediana) Tasa de PFS a 1 año Tasa de PFS a 18 meses |
11,0 46,7% 26,8% |
5,6 2,1% 0,0% |
HR 0,28 (0,20-0,39) <0,0001 |
|
PFS, Pacientes con mutaciones L858R o Del 19 1 Meses (mediana) Tasa de PFS a 1 año Tasa de PFS a 18 meses |
11,0 56,4% 26,8% |
5,6 4,4% 0,0% |
HR 0,25 (0,18-0,35) < 0,0001 |
|
Tasa de respuesta objetiva (CR+PR) 2 |
66,9% |
23,0% |
OR 7,28 (4,36-12,18) < 0,0001 |
|
Tasa de control de la enfermedad (CR+PR+SD) 2 |
92,6% |
76,2% |
OR 3,84 (2,04-7,24) <0,0001 |
|
Duración de la respuesta Meses (mediana) |
9,7 |
4,3 |
- |
|
Sobrevida general (OS), Población del estudio total Meses (mediana) 3 |
23,1 |
23,5 |
HR 0,93 (0,72, 1,22) 0,6137 |
|
1 N = 324 (GIOTRIF®: 216, gemcitabina/cisplatino: 108) 2 CR = Respuesta Completa; PR = Respuesta Parcial; SD = Enfermedad Estable. 3 Análisis de OS actualizado al 27 de diciembre de 2013 (cuando fallecieron 246 pacientes) 4 Valor p para la PFS/OS basado en la prueba de rangos logarítmicos estratificada; Valor p para la Tasa de Respuesta Objetiva y Tasa de Control de la Enfermedad basado en regresión logística. |
|||
El análisis de la PFS basado en la revisión del investigador arrojó resultados similares (HR = 0,26, IC=95%, 0,19-0,36; p <0,0001; mediana de PFS 13,7 vs. 5,6 meses) según el análisis basado en la revisión independiente. El efecto sobre la PFS fue concordante en todos los principales subgrupos, lo que incluyó el sexo, la edad, la raza, el estado ECOG y el tipo de mutación (L858R, Del 19) tanto en la revisión independiente como en la revisión del investigador. Sobre la base de la revisión del investigador, la ORR fue 74,4% vs. 31,1% y la DCR fue 93,0% vs. 75,4% en los pacientes tratados con GIOTRIF® en comparación con aquellos tratados con quimioterapia. En el subgrupo predefinido de mutaciones frecuentes de EGFR (Del 19, L858R) para GIOTRIF (N = 216) y quimioterapia (N = 108), la mediana de OS fue 23,6 meses versus 23,5 meses (HR = 0,83, IC del 95% (0,62, 1,09), p = 0,1756). En los subgrupos predefinidos de mutaciones de EGFR, la mediana de OS con GIOTRIF como tratamiento de primera línea vs. quimioterapia fue 31,4 meses vs. 18,4 meses (HR = 0,64 (IC del 95% 0,44-0,94), p = 0,0229) en pacientes con Del 19 (n = 186) y 19,6 meses vs. 24,3 meses (HR=1,22 (IC del 95% 0,81-1,83), p = 0,3432) en pacientes con L858R (n = 138). El beneficio en términos de PFS de GIOTRIF® estuvo acompañado por una mejoría en los síntomas relacionados con la enfermedad, según lo determinado mediante los Cuestionarios de Calidad de Vida (QLQ-C30 y QLQ-LC13) de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC). GIOTRIF® prolongó significativamente el tiempo hasta el deterioro de los síntomas pre especificados de tos (HR 0,453; IC del 95% 0,299, 0,685: p = 0,0001), disnea (HR 0,536; IC del 95% 0,395, 0,727: p = < 0,0001) y dolor (HR 0,703; IC del 95% 0,514, 0,961: p = 0,0265) al comparar con la quimioterapia. Se observó un porcentaje significativamente mayor de mejoría entre los pacientes tratados con GIOTRIF® en comparación con la quimioterapia en lo que respecta a tos (75,9% de los pacientes vs. 55,4%; p=0,0003), disnea (70,9% vs. 47,5%; p < 0,0001) y dolor (64,3% vs. 46,5%; p=0,0029).
Los puntajes medios a través del tiempo para la calidad de vida relacionada con la salud (HRQoL) se midieron utilizando la herramienta QLQ-C30 de la EORTC. Los puntajes medios a lo largo del tiempo para la calidad de vida general, el estado de salud general y los dominios funcionales (físico, rol, cognitivo, social y emocional) fueron significativamente mejores con GIOTRIF® que con la quimioterapia.
LUX-Lung 2 (1200.22)
El estudio LUX-Lung 2 fue un ensayo de diseño no ciego, de rama única, de Fase II, en el cual se investigó la eficacia y seguridad de GIOTRIF® en 129 pacientes con adenocarcinoma pulmonar localmente avanzado o metastásico (estadio IIIB o IV) con mutaciones del EGFR no tratados previamente con un EGFR TKI. Los pacientes fueron enrolados en un régimen de primera línea (N = 61) o de segunda línea (es decir, después de haber fracasado a 1 régimen de quimioterapia previo) (N = 68). Los pacientes fueron seleccionados centralmente en función de las mutaciones del EGFR. Los pacientes recibieron 40 mg (N = 30) o 50 mg (N = 99) de GIOTRIF® una vez al día. El criterio de valoración primario fue la ORR. Los criterios de valoración secundarios fueron PFS, DCR y OS. En 61 pacientes tratados con el régimen de primera línea, la ORR confirmada fue 65,6 % y la DCR fue 86,9 % de acuerdo con la revisión independiente. La mediana de PFS fue de 12,0 meses según la revisión independiente y de 15,6 meses de acuerdo a la evaluación del investigador. La mediana de OS no se ha alcanzado en la población que recibió el régimen de primera línea. La eficacia fue similarmente alta en el grupo de pacientes que había recibido quimioterapia previa (N = 68; ORR 57,4 %; PFS de 8 meses según la revisión independiente y de 10,5 meses según la evaluación del investigador; DCR 77,9 %). La mediana de la OS en los pacientes que recibieron el régimen de segunda línea fue 23,3 meses (IC del 95 % 18,5-38).
LUX-Lung 7 (1200.123)
El estudio LUX-Lung 7 es un ensayo internacional, aleatorizado, de diseño abierto, de Fase IIb, en el cual se investigó la eficacia y seguridad de GIOTRIF® en pacientes con adenocarcinoma pulmonar localmente avanzado o metastásico (estadio IIIB o IV) con mutaciones del EGFR en un régimen de primera línea. Los pacientes fueron seleccionados en función de la presencia de mutaciones activadoras del EGFR (Del 19 y/o L858R) usando el método TheraScreen® EGFR RGQ PCR Kit, Qiagen Manchester Ltd. Los pacientes (N = 319) fueron aleatorizados (1:1) a recibir 40 mg de GIOTRIF® por vía oral una vez al día (N = 160) o 250 mg de gefitinib por vía oral una vez al día (N = 159). La aleatorización se estratificó en función del estado de mutación del EGFR (Del 19; L858R) y de la presencia de metástasis cerebral (sí; no).
Entre los pacientes aleatorizados, el 62% era de sexo femenino, la edad media fue de 63 años, el 16% de los pacientes tenía metástasis cerebral, el estado funcional ECOG inicial fue 0 (31%) o 1 (69%), el 57% eran asiáticos y el 43% eran no-asiáticos. Los pacientes tenían una muestra tumoral con una mutación del EGFR categorizada como deleción del exón 19 (58%) o sustitución del exón 21 L858R (42%).
Los criterios de valoración co-primarios son PFS determinada por la revisión independiente, tiempo hasta el fracaso del tratamiento (TTS) y OS. Los criterios de valoración secundarios incluyen ORR y DCR. El riesgo de progresión se redujo significativamente en el caso de Afatinib versus gefitinib (ver Tabla 2) y la ORR fue 70% para Afatinib y 56% para gefitinib. El análisis primario de la OS se llevará a cabo luego de que hayan ocurrido la cantidad de eventos requeridos según protocolo.
|
Tabla 3. Resultados de eficacia de GIOTRIF® vs. gefitinib |
|||
|
GIOTRIF® (N=160) |
Gefitinib (n=159) |
Razón de riesgos instantáneos / Cociente de probabilidades (IC del 95%) Valor p2 |
|
|
Mediana de PFS (meses), Población general del estudio Tasa de PFS a 18 meses Tasa de PFS a 24 meses |
11,0 27% 18% |
10,9 15% 8% |
HR 0,73 (0,57-0,95) 0,0165 |
|
Tiempo hasta fracaso del tratamiento (meses) Tasa de TTF a 18 meses Tasa de TTF a 24 meses |
13,7 35% 25% |
11,5 27% 13% |
HR 0,73 (0,58-0,92) 0,0073 |
|
Mediana de OS (meses)1, Población general del estudio |
27,9% |
25% |
HR 0,87 (0,65, 1,15) 0,33 |
|
1 Análisis de OS en desarrollo a agosto de 2015 2 Valor p para la PFS/TTF/OS basado en la prueba de rangos logarítmicos estratificada |
|||
La razón de riesgos de la PFS para pacientes con mutaciones DEL 19 y mutaciones L858R fue 0,76 (IC del 95% [0,55, 1.06]; p = 0,1071), y 0,71 (IC del 95% [0,47, 1,06]; p = 0,0856) respectivamente, para afatinib vs. gefitinib.Análisis de la eficacia de GIOTRIF en pacientes sin tratamiento previo con EGFR TKI que presentan tumores que albergan mutaciones poco comunes del EGFR (LUX-Lung 2, 3 y 6).
En tres estudios clínicos de GIOTRIF® con genotipificación tumoral prospectiva (estudios de Fase 3 LUX-Lung 3 y - 6, y estudio de rama única de Fase 2 LUX-Lung 2), se llevó a cabo un estudio de datos de un total de 75 pacientes sin tratamiento previo con TKI que padecían adenocarcinomas pulmonares avanzados (estadio IIIb–IV) que albergaban mutaciones poco comunes del EGFR, definidas como todas las mutaciones excepto las mutaciones Del 19 y L858R. Los pacientes fueron tratados con GIOTRIF® 40 mg (en los tres estudios) o 50 mg (LUX-Lung 2) por vía oral, una vez al día.En los pacientes con tumores que albergaban mutaciones de tipo sustitución ya sea G719X (N=18), L861Q (N=16) o S768I (N=8), la ORR confirmada fue del 72,2%, 56,3%, 75,0%, respectivamente, y la mediana de duración de la respuesta fue de 13,2 meses, 12,9 meses y 26,3 meses, respectivamente.
En pacientes con tumores que albergan inserciones en el exón 20 (N=23) la ORR confirmada fue del 8,7% y la mediana de duración de la respuesta fue de 7,1 meses. En pacientes con tumores que albergan mutaciones T790M de-novo (N=14) la ORR confirmada fue del 14,3% y la mediana de duración de la respuesta fue de 8,3 meses.
GIOTRIF® en pacientes con tratamiento previo con un EGFR TKI
LUX-Lung 1 (1200.23)
En un estudio internacional, doble ciego, comparativo con placebo, de Fase IIb/III (LUX-Lung 1), se evaluó la eficacia y seguridad de GIOTRIF® en pacientes con NSCLC localmente avanzado o metastásico (estadio IIIB o IV) que habían recibido previamente 1 o 2 líneas de quimioterapia y que tuvieron progresión después del tratamiento con un EGFR TKI (gefitinib o erlotinib). En este estudio se enrolaron 585 pacientes que fueron aleatorizados (2:1) a recibir 50 mg de GIOTRIF® una vez al día más el mejor cuidado de soporte (best supportive care, BSC) (N = 390) o placebo más BSC (N = 195). La población del estudio estuvo clínicamente enriquecida por mutaciones del EGFR, al requerir que los pacientes hubieran tenido tratamiento previo con un EGFR TKI durante al menos 12 semanas.
El criterio de valoración primario del estudio fue la OS. Los criterios de valoración secundarios incluyeron PFS, ORR, DCR y calidad de vida relacionada con la salud (HRQoL), evaluada mediante los cuestionarios QLQ-C30, QLQ-LC13 y EQ-5D de la EORTC. La PFS fue evaluada por el investigador y por un comité de revisión independiente.Entre los 585 pacientes aleatorizados, el 60 % había recibido 1 línea y el 39 % había recibido 2 líneas de quimioterapia previa para la enfermedad metastásica. El 55 % de los pacientes habían recibido tratamiento previo con erlotinib como EGFR TKI, el 40 % había recibido gefitinib y el 5 % había recibido ambos. Un total de 214 (36,5 %) pacientes cumplieron los criterios de resistencia adquirida a erlotinib/gefitinib (es decir, CR/PR a erlotinib/gefitinib o SD ≥ 6 meses con el régimen previo de erlotinib/gefitinib, progresión dentro de las últimas 4 semanas con erlotinib/gefitinib y ningún tratamiento sistémico de intervención previo al tratamiento con GIOTRIF®). Se realizaron pruebas opcionales de mutaciones del EGFR en 141 pacientes, de los cuales 96 (68 %) tuvieron un resultado positivo, lo que indica una elevada tasa de positividad para mutaciones en la población total del estudio. Una duración prolongada del tratamiento previo con un EGFR TKI (≥48 semanas) y/o una respuesta del tumor (CR/PR) al EGFR TKI previo estuvieron asociadas con una mayor probabilidad de positividad para mutaciones del EGFR (subpoblación altamente enriquecida en términos de mutaciones del EGFR; ver Tabla 8).
|
Tabla 4. Enriquecimiento clínico en términos de mutaciones del EGFR dentro de la población total del estudio LUX-Lung 1 (N = 585) |
||||
|
Subpoblación altamente enriquecida en mutaciones del EGFR (CR/PR a EGFR TKI previo y/o ≥48 semanas de EGFR TKI)1 |
Número de pacientes de la subpoblación |
Número de pacientes con resultados interpretables en la prueba de mutaciones del EGFR2 |
Número de pacientes con resultados positivos en la prueba de mutaciones del EGFR |
Proporción estimada de pacientes con mutaciones del EGFR |
|
Sí |
391 |
103 |
86 |
83 % |
|
No |
94 |
38 1 |
10 |
26 % |
|
1 CR = Respuesta Completa (complete response); PR = Respuesta Parcial (partial response) 2 En base a las pruebas del tejido archivado (analizado en forma central o local) |
||||
Los resultados de eficacia se resumen en la Tabla 4. El criterio de valoración primario de OS no indicó ninguna diferencia estadística entre los pacientes tratados con GIOTRIF® y aquellos que recibieron placebo (10,8 meses vs. 12,0 meses). Lo más probable es que este resultado sea atribuible al tiempo inesperadamente prolongado de sobrevida observado tras la progresión en ambos grupos de tratamiento y a la mayor duración y la elevada frecuencia de tratamientos oncológicos posteriores, que evidenciaron un desequilibrio a favor del grupo de placebo. El criterio de valoración secundario de PFS evidenció una mejoría estadísticamente significativa en la mediana de la PFS entre los pacientes tratados con GIOTRIF® comparada con aquellos que recibieron placebo (3,3 meses vs. 1,1 meses). El porcentaje de pacientes vivos y sin progresión a los 6 meses fue del 26,1 % en el caso de GIOTRIF® y del 6,0 % en el caso del placebo. Esta diferencia fue más pronunciada cuando se compararon las subpoblaciones con un elevado grado de enriquecimiento clínico por mutaciones del EGFR (N = 391) (PFS 4,4 meses vs. 1,0 mes; tasa de PFS a 6 meses 29,9 % vs. 3,7 %). En la subpoblación complementaria que no cumplió con los criterios de alto enriquecimiento clínico (N = 194), las diferencias entre GIOTRIF® y el placebo fueron menores (PFS 2,76 vs. 1,84 meses, tasa de PFS a 6 meses 18,7 % vs. 11,5 %).
|
Tabla 5. Resultados de eficacia de GIOTRIF® más BSC vs. placebo más BSC en el estudio |
||||||
|
Población total del estudio |
Subpoblación altamente enriquecida (N = 391; est. 83% positivo para mutaciones del EGFR) |
|||||
|
GIOTRIF® + BSC |
Placebo + BSC |
Razón de riesgo Cociente de probabilidades (IC del 95 %) Valor p |
GIOTRIF® + BSC |
Placebo + BSC |
Cociente de riesgo (hazard ratio, HR) / Cociente de probabilidades (odds ratio, OR) (IC del 95 %) Valor p4 |
|
|
Nro. de pacientes |
390 |
195 |
- |
257 |
134 |
- |
|
OS Meses (mediana) 358 eventos |
10,8 |
12,0 |
HR 1,08 (0,86-1,35) 0,7428 |
11,8 |
11,2 |
HR 0,90 (0,69-1,18) 0,433 |
|
OS actualizada1 Meses (mediana) 501 eventos |
10,9 |
11,7 |
HR 1,01 (0,84-1,22) 0,5445 |
12,0 |
11,2 |
HR 0,91 (0,73-1,14) 0,419 |
|
PFS |
3,3 |
1,1 |
HR 0,38 |
4,4 |
1,0 |
HR 0,28 |
|
Meses (mediana)2 Tasa de PFS a 6 meses |
26,1 % |
6,0 % |
(0,31-0,48) < 0,0001 |
29,9 % |
3,7 % |
(0,21-0,36) < 0,0001 |
|
Tasa de respuesta objetiva (CR + PR)2,3 |
7,4 % |
0,5 % |
OR 15,61 (2,1-115) 0,0071 |
8,9 % |
0,7 % |
OR 13,07 (1,7-97,9) 0,0123 |
|
Tasa de control de la enfermeda d (CR + PR + SD) 2,3 |
58,2 % |
18,5 % |
OR 6,28 (4,1-9,5) < 0,0001 |
63,8 % |
15,7 % |
OR 9,49 (5,6-16,1) < 0,0001 |
|
1 Análisis de sobrevida actualizado al 9 de febrero de 2012 2 Sobre la base de la revisión independiente 3 CR = Respuesta Completa (complete response); PR = Respuesta Parcial (partial response); SD = Enfermedad Estable (stable disease) 4 Valor de-p para la PFS/OS basado en la prueba de rangos logarítmicos estratificada; Valor de -p para la Tasa de Respuesta Objetiva y Tasa de Control de la Enfermedad basado en regresión logística |
||||||
En un análisis de los pacientes que cumplieron con los criterios de resistencia adquirida (133 [34%] pacientes tratados con GIOTRIF®, 81 [42%] de los pacientes que recibieron placebo), la mediana de PFS determinada por la revisión independiente fue de 4,5 meses (IC del 95% 2,73-4,73) para los pacientes tratados con GIOTRIF® en comparación con 1,0 mes (IC 95% 0,95-1,71) para los pacientes que recibieron placebo.
La actividad de GIOTRIF® en este subgrupo (en el cual el intervalo entre el final del tratamiento previo con un EGFR TKI y el inicio del tratamiento del estudio fue ≤ 4 semanas) sugiere que el efecto de GIOTRIF® no es un mero resultado de la re exposición a un tratamiento orientado al EGFR.
El beneficio en términos de la PFS estuvo acompañado de una mejoría en los síntomas relacionados con la enfermedad, según lo determinado por las herramientas QLQ-C30 y QLQ-LC13 de la EORTC. GIOTRIF® prolongó significativamente el tiempo hasta el deterioro de los síntomas pre especificados de tos a razón de más de 3 meses (HR 0,60; p < 0,001) en comparación con el placebo. El tiempo hasta el deterioro de la disnea (HR 0,84; p = 0,1701) y el dolor (HR 0,88; p = 0,2876) también fue más prolongado con GIOTRIF®, pero no alcanzó significación estadística. Un número significativamente mayor de pacientes tratados con GIOTRIF® en comparación con aquellos tratados con placebo tuvo mejorías clínicamente significativas en la tos (46 % vs. 25 %, p < 0,0001), la disnea (51 % vs. 36 %, p = 0,0006) y el dolor (50 % vs. 32 %, p < 0,0001).
Los puntajes medios a través del tiempo para la HRQoL se midieron utilizando la herramienta QLQ-C30 de la EORTC. Los puntajes medios a lo largo del tiempo para la calidad de vida general y el estado de general fueron significativamente mejores para GIOTRIF® que para el placebo. Los puntajes medios fueron significativamente mejores en 1 de los 5 dominios funcionales (físico) y favorecieron a GIOTRIF® en el dominio del rol, y no indicaron ninguna diferencia en 3 de los 5 dominios (desempeño social, cognitivo y emocional).
LUX-Lung 5 (1200.42)
LUX-Lung 5 es un estudio internacional, de diseño abierto, aleatorizado, de Fase III, en una población de pacientes enriquecida con mutaciones del EGFR similar a la del estudio LUX-Lung 1. En la Parte A, los pacientes con NSCLC metastásico, de estadio IIIB/IV, confirmado patológicamente, luego de ≥ 1 línea de quimioterapia y progresión tras el tratamiento con gefitinib o erlotinib durante generalmente 12 semanas o más, recibieron 50 mg de GIOTRIF® una vez al día hasta la progresión de la enfermedad. Después de la progresión, en la Parte B, los pacientes con beneficio clínico (≥ 12 semanas) fueron elegibles para continuar con 40 mg de GIOTRIF® más paclitaxel o para recibir la quimioterapia elegida por el investigador.
El criterio de valoración primario para la Parte A fue la evaluación de la PFS efectuada por el investigador. Los criterios de valoración secundarios fueron ORR, DCR y OS.
Se llevó a cabo un análisis intermedio de la Parte A, el cual confirmó los resultados del estudio LUX-Lung 1. La mediana de PFS en la población total del estudio (N = 1154) fue 3,3 meses, la tasas de PFS a 6 meses fue 24,5 %, y la ORR y la DCR fueron del 7,6 % y del 63,6 %, respectivamente. En forma similar a lo observado en el estudio LUX-Lung 1, la eficacia en el subgrupo altamente enriquecido clínicamente (N=598) fue más pronunciada, con una mediana de PFS de 4,2 meses y una ORR y una DCR de 9,5 % y 72,2 %, respectivamente.
El número de pacientes con un evento de OS fue 301 (26,1%). La mediana de la OS fue 13,70 meses.
GIOTRIF® en pacientes con NSCLC de histología escamosa.
LUX-Lung 8 (1200.125)
La eficacia y seguridad de GIOTRIF® como tratamiento de segunda línea para pacientes con NSCLC avanzado de histología escamosa se investigó en un estudio internacional de diseño no ciego aleatorizado de Fase III LUX-Lung 8. Pacientes progresados a un tratamiento de primera línea en base a platino de como mínimo 4 ciclos fueron aleatorizados 1:1 a una dosis diaria de 40 mg de GIOTRIF® o 150 mg de erlotinib hasta la progresión. Se permitió el aumento de dosis de GIOTRIF® 50 mg después del primer ciclo (28 días) de tratamiento en el caso de ausencia de evento adverso relacionado con el medicamento o limitado (por ejemplo, ausencia de diarrea, exantema, estomatitis y/u otros eventos relacionados con el fármaco > Grado 1 según el CTCAE), cumplimiento del régimen posológico y ninguna reducción de la dosis previa. La aleatorización se estratificó en función de la raza (asiática oriental vs. no asiática oriental). El criterio de valoración primario fue la PFS (analizado cuando fueron informados al menos 372 eventos por el revisor independiente); la OS fue el criterio de valoración secundario (analizado al producirse las primeras 632 muertes). Otros criterios de valoración secundarios incluyeron ORR, DCR, cambio en el tamaño del tumor y HRQOL.
Entre los 795 pacientes aleatorizados, la mayoría fue de sexo masculino (83,8%), de raza blanca (72,8%), fumadores o ex-fumadores (91,6%) con estado funcional ECOG 1 inicial (66,8%).
GIOTRIF® como tratamiento de segunda línea mejoró significativamente la PFS y la OS de pacientes con NSCLC escamoso en comparación con erlotinib. En el análisis primario de PFS la mediana de PFS fue de 2,43 meses en el grupo de GIOTRIF® y de 1,94 meses en el de erlotinib (HR=0,82, IC 95% (0,676, 0,998), p=0,0427). El análisis final de PFS que incluyó a todos los pacientes aleatorizados confirmó los resultados anteriores (Tabla 5). El análisis primario de OS demostró una reducción significativa del riesgo de muerte para pacientes tratados con GIOTRIF® en comparación con erlotinib (HR=0,81 IC 95% (0,69, 0,95), p=0,0077) con proporciones significativamente más altas de pacientes tratados con GIOTRIF® vivos a lo largo del período de observación, en puntos de referencia tales como 12 y 18 meses posteriores a la aleatorización.
Las tasas de respuesta tumoral objetiva y estabilización de la enfermedad fueron mayores con GIOTRIF®. La mediana de duración de la respuesta fue de 7,29 meses en el caso de GIOTRIF® y de 3,71 en el caso de erlotinib.
|
Tabla 6. Resultados de eficacia de GIOTRIF® vs. erlotinib en el estudio LUX-Lung 8, obtenidos a partir del análisis primario de OS, incluidos todos los pacientes aleatorizados |
|||
|
GIOTRIF® (N=398) |
Erlotinib (n=397) |
Cociente de riesgo/ Cociente de probabilidades (IC 95%) p-value1 |
|
|
PFS Meses (mediana) |
2,63 |
1,94 |
HR 0,81 (0,69, 0,96) 0,0103 |
|
OS Meses (mediana) Vivo a los 12 meses Vivo a los 18 meses |
7,92 36,4% 22,0% |
6,77 28,2% 14,4% |
HR 0,81 (0,69, 0,95) 0,0077 |
|
Tasa de respuesta objetiva (CR+PR)* |
5,5% |
2,8% |
OR 2,06 (0,98, 4,32) 0,0551 |
|
Tasa de control de la enfermedad (CR+PR+SD)* |
50,5% |
39,5% |
OR 1,56 (1,18, 2,06) 0,0020 |
|
*CR = respuesta completa; PR = respuesta parcial; SD = enfermedad estable 1 Valor-p para la PFS/OS basado en la prueba de rangos logarítmicos estratificada; Valor dep para la Tasa de Respuesta Objetiva y Tasa de Control de la Enfermedad basado en regresión logística. |
|||
Figura 3. Curva de Kaplan-Meier para la OS por grupo de tratamiento, en el Estudio LUX-Lung 8
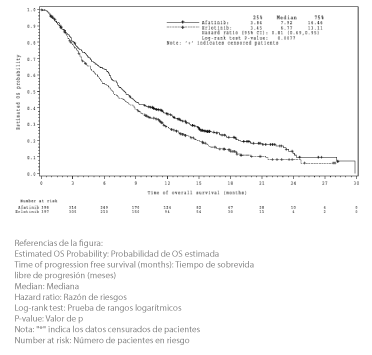
El análisis de los resultados informados por los pacientes, según los cuestionarios QLQ-C30 y QLQ-LC13 favoreció a GIOTRIF®. Un número significativamente mayor de pacientes en el grupo con GIOTRIF® informó una mejoría del estado de salud general/calidad de vida en comparación con erlotinib (35,7% vs. 28,3%, p=0,0406). Una mayor proporción de pacientes tratados con GIOTRIF® presentó una mejoría de la tos (43,4% vs. 35,2%, p=0,0294) y la disnea (51,3% vs. 44,1%, p=0,0605), mientras que no se observó diferencias en relación al dolor (40,2% vs. 39,2%, p=0,7752). GIOTRIF® retrasó significativamente el tiempo hasta el deterioro de la disnea (HR 0,79, p=0,0078). Los puntajes promedio a lo largo del tiempo para la tos, la disnea, y el dolor, así como para los dominios funcionales físico, de rol, cognitivo, y de desempeño emocional fueron significativamente mejores con GIOTRIF® que con erlotinib.
LEYENDAS DE PROTECCIÓN:
Producto de uso delicado. Adminístrese por prescripción y bajo vigilancia médica.
Venta bajo receta médica.
Manténgase fuera del alcance de los niños.
Mayor información disponible a solicitud del cuerpo médico.
Boehringer-Ingelheim
del Ecuador Cía. Ltda.
Quito
Av. Shyris N-344 y Av. Eloy Alfaro.
Edificio Parque Central, Piso 15
Teléfono: 593 2 3979900