
FIRMAGON 120MG Y 80MG
DEGARELIX
Polvo y disolvente para solución inyectable
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FIRMAGON 120 mg: cada vial contiene 120.0 mg de degarelix (como acetato). Excipiente: Manitol 160.0 mg.
Cada jeringa prellenada con disolvente contiene 3.0 ml de agua inyectable.
FIRMAGON 80 mg: cada vial contiene 80.0 mg de degarelix (como acetato). Excipiente: Manitol 220.5 mg.
Cada jeringa prellenada con disolvente contiene 4.2 ml de agua inyectable.
FORMA FARMACÉUTICA: Polvo y disolvente para solución inyectable.
Indicaciones terapéuticas: FIRMAGON es un antagonista de la hormona liberadora de gonadotropinas (GnRH) indicado para el tratamiento de pacientes varones adultos con cáncer de próstata avanzado hormono-dependiente.
PROPIEDADES FARMACOLÓGICAS
Propiedades farmacodinámias
Grupo farmacoterapéutico: otros antagonistas hormonales y agentes relacionados, código ATC: L02BX02.
Mecanismo de acción: Degarelix es un antagonista selectivo de la hormona liberadora de gonadotropinas (GnRH) que se une de modo competitivo y reversible a los receptores hipofisarios de GnRH produciendo una rápida disminución de la liberación de gonadotropinas, de la hormona luteinizante (LH) y de la hormona folículoestimulante (FSH) y, con ello, la reducción de la secreción de la testosterona (T) por los testículos. Se sabe que el carcinoma prostático es andrógeno-dependiente y que responde al tratamiento que anula el origen de los andrógenos. A diferencia de los agonistas de GnRH, los antagonistas no inducen la aparición de picos de LH que son responsables de la aparición de picos de testosterona/estimulación del crecimiento tumoral y que podrían producir un posible cuadro de síntomas al inicio del tratamiento.
Una dosis única de 240 mg de degarelix, seguida por una dosis de mantenimiento mensual de 80 mg, produce una rápida disminución en las concentraciones de LH, FSH y, consecuentemente, de la testosterona. La concentración plasmática de dihidrotestosterona (DHT) disminuye de un modo similar a la testosterona.
Degarelix es eficaz en la supresión y en el mantenimiento de la supresión de la testosterona en niveles inferiores a los 0,5 ng/ml de la castración química. La dosis mensual de mantenimiento de 80 mg controla de manera continua la supresión de la testosterona en el 97 % de los pacientes durante al menos un año. La mediana de los niveles de testosterona tras un año de tratamiento fue de 0,087 ng/ml (rango intercuartílico 0,06-0,15) N=167.
Resultados del ensayo confirmatorio de Fase III: se evaluó la eficacia y la seguridad de degarelix en un ensayo abierto, multicéntrico, aleatorizado, de grupos paralelos y controlado con un comparador activo. El ensayo evaluó la eficacia y seguridad de dos regímenes posológicos mensuales de degarelix, con una dosis de inicio de 240 mg (40 mg/ml) seguido de dosis mensuales por vía subcutánea de 160 mg (40 mg/ml) u 80 mg (20 mg/ml), comparando con una administración mensual intramuscular de 7,5 mg de leuprorelina en pacientes con cáncer prostático que requerirían tratamiento de deprivación androgénica. Un total de 620 pacientes fueron aleatorizados a uno de los tres grupos de tratamiento, de los cuales, 504 pacientes (81%) concluyeron el ensayo. En el grupo tratado con 240/80 mg de degarelix, 41 pacientes (20%) se retiraron del estudio, comparado con los 32 pacientes (16%) del grupo de leuprorelina.
De los 610 pacientes tratados
• El 31% presentaba cáncer de próstata localizado.
• Un 29% tenía cáncer de próstata localmente avanzado.
• El 20% con cáncer de próstata metastásico.
• En un 7% se desconocía la extensión del cáncer.
• A un 13% se les había practicado cirugía con intención curativa o radiación y presentaban aumento del PSA.
Las características demográficas al comienzo fueron similares en ambos brazos del ensayo. La mediana de edad fue de 74 años (dentro de un rango de 47 a 98 años). El objetivo principal fue demostrar que degarelix es eficaz en la inducción y el mantenimiento de la supresión de la testosterona a valores inferiores a 0,5 ng/ml, durante 12 meses de tratamiento. La dosis de mantenimiento eficaz más baja elegida fue de 80 mg de degarelix.
Supresión de la testosterona sérica (T) ≤0,5 ng/ml: FIRMAGON es eficaz en la inducción de un descenso rápido y pronunciado en los niveles plasmáticos de testosterona, ver Tabla 2.
|
Tabla 2: Porcentaje de pacientes con supresión inducida T≤0,5 ng/ml tras el inicio del tratamiento. |
||
|
Tiempo |
Degarelix 240/80 mg |
Leuprorelina 7,5 mg |
|
Día 1 |
52% |
0% |
|
Día 3 |
96% |
0% |
|
Día 7 |
99% |
1% |
|
Día 14 |
100% |
18% |
|
Día 28 |
100% |
100% |
Prevención en la aparición de picos de testosterona: se considera que hay un pico de testosterona cuando se observa un aumento ≥15% en su valor con respecto al nivel basal en las dos primeras semanas. Ninguno de los pacientes tratados con degarelix experimentó un pico en el nivel de testosterona; con una disminución media del nivel de testosterona del 94% en el día 3. La mayor parte de los pacientes tratados con leuprorelina tuvieron un pico de testosterona; con un incremento medio del 65% en el nivel de testosterona en el día 3. Estas diferencias fueron estadísticamente significativas (p<0,001).
Gráfica 1: Cambios en los niveles de testosterona con respecto al nivel basal, en porcentaje, por grupo de tratamiento, durante 28 días (expresados en medianas y rangos intercuartílicos).
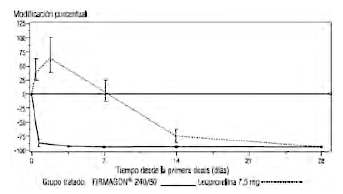
La variable principal de eficacia del ensayo fue la tasa de supresión de testosterona tras un año de tratamiento con degarelix o leuprorelina. No se ha demostrado el beneficio clínico de administrar degarelix en comparación con la administración de leuprorelina asociada con un antiandrógeno al comienzo del tratamiento.
Reversibilidad de la testosterona: en un estudio que involucró pacientes con aumento de PSA después de la terapia localizada (principalmente prostectomía radical y radiación) se les administró FIRMAGON por siete meses seguidos de un periodo de monitoreo de siete meses. El tiempo de recuperación de la testosterona promedio (>0,5 ng/ml, por encima del nivel de castración) después de la descontinuación del tratamiento fue de 112 días (contados desde el inicio del periodo de monitoreo, es decir, 28 días después de la última inyección). El tiempo promedio hacia una testosterona >1.5 ng/ml (por encima del límite inferior del rango normal) fue de 168 días.
Efectos a largo plazo: en el ensayo se definió la respuesta satisfactoria como la inducción de la castración química obtenida al día 28 y mantenida hasta el día 364 sin que la concentración de testosterona superara los 0,5 ng/ml.
|
Tabla 3: Probabilidad acumulada de valores de testosterona ≤0.5 ng/ml entre el día 28 y el 364. |
||
|
Degarelix 240/80 mg N=207 |
Leuprorelina 7,5 mg N=201 |
|
|
No. de pacientes respondedores |
202 |
194 |
|
Tasa de respuesta (intervalos de confianza)* |
97,2% (93,5; 98,8%) |
96,4% (92,5; 98,2%) |
|
*Estimaciones de Kaplan-Meier en cada grupo. Inducción de la supresión del antígeno prostático específico (PSA) |
||
Durante la realización del ensayo clínico, no se midió la dimensión del tumor, pero se produjo una mejora indirecta en la respuesta del tumor, observada por una reducción del 95% en la mediana de los valores de PSA tras 12 meses de tratamiento con degarelix. La mediana de los valores de PSA a nivel basal fue:
• En el grupo tratado con 240/80 mg de degarelix: 19,8 ng/ml (rango intercuartílico: P25 9,4 ng/ml, P75 46,4 ng/ml).
• En el grupo tratado con 7,5 mg de leuprorelina: 17,4 ng/ml (rango intercuartílico: P25 8,4 ng/ml, P75 56,5 ng/ml).
Gráfica 2: Cambios en porcentaje de los niveles de PSA desde el nivel basal hasta el día 56, diferenciados por grupo de tratamiento (medianas expresadas con los rangos intercuartílicos
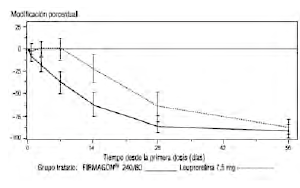
Esta diferencia fue estadísticamente significativa (p<0,001) para los análisis programados en los días 14 y 28.
Los niveles de antígeno prostático específico (PSA) disminuyeron en un 64% dos semanas después de la administración de degarelix, en un 85% transcurrido un mes, en un 95% a los tres meses, y se mantuvieron en niveles de supresión (aproximadamente un 97%) a lo largo del año que duró el tratamiento.
Desde el día 56 al 364 no hubo diferencias significativas entre degarelix y el comparador en el porcentaje de cambio con respecto al nivel basal.
Efecto en el volumen de la próstata: tres meses después de terapia con degarelix (régimen de dosificación de 240/80 m) resultó en una reducción del 37% en el volumen de la próstata de acuerdo a lo medido por la ecografía transrectal (TRUS) en pacientes que requieren terapia hormonal previo a la radioterapia y en pacientes que son candidatos a la castración médica. La reducción del volumen de la próstata fue similar a la conseguida con la goserelina más protección con anti-andrógenos.
Efecto en los intervalos QT/QTc: en el ensayo confirmatorio que comparó FIRMAGON con leuprorelina, se realizaron frecuentes electrocardiogramas. Ambas terapias mostraron que los intervalos QT/QTc excedían de 450 ms en aproximadamente el 20% de los pacientes. Desde el inicio hasta el final del estudio, la mediana de los cambios para FIRMAGON fue de 12,0 ms y para leuprorelina fue de 16,7 ms.
Anticuerpos anti-degarelix: se ha observado la formación de anticuerpos anti-degarelix en el 10% de los pacientes tratados durante un año con FIRMAGON. No hay indicios de que este hecho comprometa la eficacia o la seguridad del tratamiento con FIRMAGON tras un año de tratamiento. No se dispone de datos de eficacia y seguridad en lo relacionado con la formación de anticuerpos para un periodo mayor de un año de tratamiento.
Población pediátrica: la agencia europea de medicamentos ha retirado la obligación de someter los resultados de los estudio con FIRMAGON en todos los subgrupos de la población pediátrica (ver sección 5.2 para la información del Uso pediátrico).
Propiedades farmacocinéticas
Absorción: tras la administración subcutánea de 240 mg de degarelix a una concentración de 40 mg/ml en pacientes con cáncer de próstata reclutados para el ensayo pivotal CS21, el AUC0-28días fue de 635 (602-668) ng*día/ml, la Cmáx fue de 66,0 (61,0-71,0) ng/ml y ocurrió para un Tmáx de 40 (37-42) horas.
La media de estos valores fue de aproximadamente 11-12 ng/ml tras la administración de la dosis de inicio y de 11-16 ng/ml tras la administración de la dosis de mantenimiento de 80 mg a una concentración de 20 mg/ml. Degarelix se elimina siguiendo un modelo bicompartimental, con una semivida terminal media (t½) de aproximadamente 43 días en el caso de la dosis de inicio ó 28 días para la dosis de mantenimiento, estimaciones basadas en modelado farmacocinética poblacional. La prolongada semivida que se observa tras la administración subcutánea es consecuencia de la liberación muy lenta de degarelix desde el reservorio que se forma en el/los lugar/es de la inyección. El comportamiento farmacocinético del medicamento se ve influenciado por la concentración en la solución inyectable. Por ello, la Cmáx y la biodisponibilidad tienden a disminuir al aumentar la concentración de la dosis, a la vez que la vida media se incrementa. Consecuentemente no se deben utilizar otras concentraciones de dosis que las expresamente recomendadas.
Distribución: el volumen de distribución en hombres adultos sanos es de aproximadamente 1 l/kg. La unión a proteínas plasmáticas es de alrededor del 90%.
Metabolismo: Degarelix sufre una degradación por el sistema hepatobiliar que es común a los péptidos, siendo principalmente eliminado en las heces en forma de fragmentos peptídicos. Tras la administración subcutánea no se detectaron metabolitos relevantes en muestras obtenidas de plasma. Estudios in vitro muestran que degarelix no es sustrato del complejo CYP450.
Eliminación: en varones sanos, aproximadamente el 20-30% de una dosis única administrada por vía intravenosa se elimina por la orina, lo que sugiere que un 70-80% se elimina por vía hepatobiliar. El aclaramiento de degarelix tras la administración de dosis únicas intravenosas (0,864-49,4 µg/kg) a pacientes de edad avanzada sanos fue de 35-50 ml/h/kg.
Poblaciones especiales
Pacientes con insuficiencia renal: no se han realizado estudios farmacocinéticos en pacientes con insuficiencia renal. Únicamente cerca de un 20-30% de la dosis administrada de degarelix se excreta inalterada por vía renal. Un análisis farmacocinético poblacional de los datos procedente del ensayo confirmatorio de Fase III mostró que el aclaramiento de degarelix en aquellos pacientes que presentan insuficiencia renal leve o moderada disminuye en aproximadamente un 23%, por lo que no se recomienda realizar un ajuste de la dosis en estos pacientes. Existen pocos datos en pacientes con insuficiencia renal grave, por lo que debe utilizarse con precaución en estos pacientes.
Pacientes con insuficiencia hepática: se ha realizado un estudio farmacocinético con degarelix en pacientes que presentaban insuficiencia hepática leve o moderada. En estos pacientes, no se detectaron signos de aumento de la exposición, comparando con individuos sanos. No se recomienda realizar un ajuste de la dosis en estos pacientes.
En pacientes con insuficiencia hepática grave no se ha estudiado el uso, por lo que debe utilizarse con precaución en este grupo de población.
Datos preclínicos sobre seguridad: estudios de reproducción en animales muestran que degarelix causa esterilidad en los animales macho. Esto se debe al efecto farmacológico y es reversible.
Estudios de toxicidad reproductiva con degarelix en animales hembra revelaron datos esperados de sus propiedades farmacológicas. Se produjo una prolongación dosis-dependiente del tiempo de apareamiento y de la gestación, una reducción en el número de cuerpos lúteos y un aumento de las pérdidas producidas tanto en la fase previa como posterior a la implantación, abortos, muerte embrionaria/ fetal prematura, partos prematuros y en la duración del parto.
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y potencial carcinogénico. Los estudios in vivo e in vitro realizados no mostraron signos de prolongación del intervalo QT.
No se ha observado toxicidad específica en órganos en los estudios de toxicidad aguda, subaguda y crónica realizados en ratas y monos tras la administración subcutánea de degarelix. Se observó irritación local debida al medicamento cuando se administran altas dosis de degarelix por vía subcutánea en animales.
DATOS FARMACÉUTICOS
Incompatibilidades: en ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
Precauciones especiales de conservación: conservar a temperatura no mayor a 30 °C en su envase original.
Naturaleza y contenido de envase
FIRMAGON 120 mg: 2 viales de vidrio tipo I con tapón de goma de bromobutilo y sello de aluminio con cápsula tipo flip-off que contienen 120 mg de polvo para solución inyectable. 2 jeringas prellenadas de vidrio tipo I con émbolo de goma de elastómero, tapón de la jeringa y línea marcando 3 ml conteniendo
3 ml de disolvente.
2 vástagos de émbolo.
2 adaptadores del vial.
2 agujas para inyección (25G 0.5 x 25 mm).
FIRMAGON 80 mg: 1 vial de vidrio tipo I con tapón de goma de bromobutilo y sello de aluminio con cápsula tipo flip-off que contienen 80 mg de polvo para solución inyectable. 1 jeringa prellenada de vidrio tipo I con émbolo de goma de elastómero, tapón de la jeringa y línea marcando 4 ml conteniendo
4.2 ml de disolvente.
1 vástago de émbolo.
1 adaptador del vial.
1 aguja para inyección (25G 0.5 x 25 mm).
Leyendas de protección: venta bajo receta o prescripción médica. Manténgase fuera del alcance de los niños. Leer el prospecto anexo antes de su uso.
Fabricante del polvo: Rentschler Biotechnologie GmbH, Erwin-Rentschler-Strasse 21, 88471, Laupheim, Alemania.
Fabricante del solvente: Ferring GmbH, Wittland 11, 24109, Kiel, Alemania.
Acondicionador: Ferring International Center S.A., Chemin de la Vergognausaz 50, 1162 St-Prex, Suiza.
Titular: Ferring GmbH, Wittland 11, 24109, Kiel, Alemania.
Este prospecto fue revisado en: 09/2013.
LABORATORIOS BIOPAS S. A.
Contraindicaciones: Hipersensibilidad al principio activo o a alguno de los excipientes.
Embarazo y lactancia
Embarazo y lactancia: FIRMAGON no tiene indicaciones adecuadas para su uso en mujeres.
Fertilidad: siempre y cuando la testosterona está suprimida, FIRMAGON puede inhibir la fertilidad masculina.
Efectos sobre la capacidad para conducir y utilizar máquinas: FIRMAGON tiene efecto nulo o insignificante sobre la capacidad de conducir y utilizar máquinas. Sin embargo, la fatiga y el mareo son reacciones adversas frecuentes que podrían influir la capacidad para conducir y utilizar máquinas.
Reacciones adversas: Las reacciones adversas que aparecieron más frecuentemente durante el tratamiento con degarelix durante el ensayo confirmatorio de fase III (N=409) se debieron a los efectos fisiológicos derivados de la supresión de la testosterona, incluyendo sofocos y aumento de peso (registrado, respectivamente, en un 25% y un 7%, de los pacientes que recibieron tratamiento durante un año), o efectos locales en el lugar de inyección. Se han notificado escalofríos transitorios, fiebre o síndrome pseudogripal que aparecieron horas después de la administración (en un 3%, 2% y 1% de los pacientes, respectivamente).
Las reacciones adversas en el lugar de inyección fueron fundamentalmente dolor y eritema, notificadas en un 28% y un 17% de los pacientes, respectivamente; de forma menos frecuente se notificaron edema (6%), induración (4%) y nódulos (3%). Estas reacciones ocurrieron principalmente tras la administración de la dosis de inicio, mientras que para el tratamiento de mantenimiento con la dosis de 80 mg, la incidencia de estas reacciones por cada 100 inyecciones fue de 3 para dolor y <1 para eritema, edema, nódulo e induración. Dichas reacciones adversas fueron en su mayoría transitorias, de intensidad leve a moderada y que produjeron muy pocos abandonos (<1%).
Lista tabulada de reacciones adversas: la frecuencia de las reacciones adversas listadas abajo se define utilizando la siguiente convención: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1.000 a < 1/100), raras (≥ 1/10.000 a < 1/1.000) y muy raras (< 1/10.000). Con cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad.
|
Tabla 1: Frecuencia de aparición de las reacciones adversas comunicadas en 1.259 pacientes tratados de un total de 1.781 pacientes al año (ensayos fase II y III). |
||||
|
Clasificación de órganos del sistema MedDRA (SOC) |
Muy frecuentes |
Frecuente |
Poco frecuente |
Rara |
|
Trastornos de la sangre y del sistema linfático |
Anemia* |
Fiebre neutropénica |
||
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Reacciones anafilácticas |
||
|
Trastornos del metabolismo y de la nutrición |
Aumento de peso* |
Hiperglucemia/Diabetes mellitus, aumento del colesterol, pérdida de peso, disminución del apetito cambios en la calcemia |
||
|
Trastornos psiquiátricos |
Insomnio |
Depresión, disminución del deseo sexual* |
||
|
Trastornos del sistema nervioso |
Mareos, cefaleas |
Deterioro mental, hipoestesia |
||
|
Trastornos oculares |
Visión borrosa |
|||
|
Trastornos cardiacos |
Arritmia cardiaca (incluyendo fibrilación auricular), palpitaciones, prolongación del intervalo QT* |
Infarto al miocardio, insuficiencia cardiaca. |
||
|
Trastornos vasculares |
Sofocos* |
Hipertensión, reacción vasovagal (incluyendo hipotensión) |
||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea |
|||
|
Trastornos gastrointestinales |
Diarrea, náuseas |
Estreñimiento, vómitos, dolor abdominal, molestia abdominal, sequedad de boca |
||
|
Trastornos hepatobiliares |
Aumento de las ransaminasas hepáticas |
Aumento de la bilirrubina, aumento de la fosfatasa alcalina |
||
|
Trastornos de la piel del tejido subcutáneo |
Hiperhidrosis, sudoración nocturna, erupción cutánea |
Urticaria, nódulo cutáneo alopecia, prurito, eritema |
||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor y molestias musculoesqueléticas |
Osteoporosis/osteopenia, artralgia, debilidad muscular, espasmos musculares, hinchazón/entumecimiento de articulaciones |
||
|
Trastornos renales y urinarios |
Polaquiuria, urgencia miccional, disuria, nocturia, insuficiencia renal, incontinencia |
|||
|
Trastornos del aparato reproductor y de la mama |
Ginecomastia*, atrofia testicular*, disfunción eréctil* |
Dolor testicular, dolor en el pecho, dolor pélvico, irritación genital, interrupción de la eyaculación |
||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones adversas en el lugar de inyección |
Escalofríos, fiebre, fatiga*, síndrome pseudogripal |
Malestar, edema periférico |
|
|
*Consecuencia fisiológica de la supresión de la testosterona. |
||||
Descripción de reacciones adversas selectas
Cambios en los parámetros de laboratorio: los cambios observados en los parámetros de laboratorio después de un año de tratamiento en el ensayo confirmatorio de fase III (N=409) fueron similares para degarelix y el agonista de GnRH que se utilizó como comparador (leuprorelina). Para ambos medicamentos, se observaron valores de transaminasas hepáticas (ALT, AST y GGT) notablemente atípicos (>3*ULN) en el 2-6% de los pacientes que presentaban valores normales antes del inicio del tratamiento. Se observó un marcado descenso en los valores hematológicos, hematocrito (≤0,37) y hemoglobina (≤115 g/l) en el 40% y 13-15%, respectivamente, de los pacientes que presentaban valores normales antes de comenzar el tratamiento. Se desconoce hasta qué punto este descenso en los valores hematológicos es consecuencia del cáncer prostático subyacente o se debe al tratamiento de deprivación androgénica. Se observaron valores notablemente atípicos de potasio (≥5,8 mmol/l), de creatinina (≥177 μmol/l) y de BUN (≥10,7 mmol/l) en el 6%, 2% y 15% de los pacientes tratados con degarelix y en el 3%, 2% y 14% de los tratados con leuprorelina, respectivamente. Estos pacientes presentaban valores normales antes de comenzar el tratamiento.
Cambios en los datos electrocardiográficos: los cambios electrocardiográficos observados después de un año de tratamiento en el ensayo confirmatorio de fase III (N=409) fueron similares para degarelix y el agonista de GnRH que se utilizó como comparador (leuprorelina). Tres (<1%) de los 409 pacientes pertenecientes al grupo tratado con degarelix y cuatro (2%) de los 201 pacientes del grupo tratado con 7,5 mg de leuprorelina, presentaron un QTcF ≥ 500 ms. Desde el inicio hasta el final del ensayo la mediana del cambio en el valor del QTcF para degarelix fue de 12,0 ms y en el caso de leuprorelina, de 16,7 ms.
La falta de un efecto intrínseco de degarelix en la repolarización cardiaca (QTcF), ritmo cardiaco, conducción AV, depolarización cardiaca, o de la morfología de la onda T o U fue confirmado mediante un estudio QT en sujetos sanos (N=80) que recibieron durante 60 min una infusión intravenosa de degarelix, alcanzando un promedio de Cmáx de 222 ng/ml, aproximadamente 3-4 veces la Cmáx obtenida durante el tratamiento de cáncer de próstata.
Interacción con otros medicamentos y otras formas de interacción: No se han realizado estudios formales para investigar la interacción fármaco-fármaco. Debido a que el tratamiento de deprivación androgénica puede inducir una prolongación del intervalo QTc, el uso concomitante de degarelix con medicamentos que producen una prolongación del intervalo QTc o de medicamentos capaces de inducir torsades de pointes, tales como antiarrítmicos de clase IA (ej. quinidina, disopiramida) o de clase III (ej. amiodarona, sotalol, dofetilida, ibutilida) medicamentos antiarrítmicos, metadona, moxifloxacino, antipsicóticos, etc., deben ser cuidadosamente evaluados (ver sección Advertencias).
Degarelix no es un sustrato del complejo CYP450 y se ha observado que no activa ni inhibe in vitro de forma importante las isoformas CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, o CYP3A4/5. Por ello, es improbable que aparezcan interacciones farmacocinéticas metabólicas relacionadas con estas isoenzimas que sean clínicamente relevantes.
Advertencias y precauciones especiales de empleo: Los datos disponibles sobre eficacia y seguridad con el uso de degarelix se circunscriben a un año de tratamiento.
Efectos sobre el intervalo QT/QTc: el tratamiento prologando de deprivación androgénica puede producir una prolongación del intervalo QT. En el ensayo confirmatorio en el que se comparó FIRMAGON con leuprorelina, se realizaron electrocardiogramas (ECGS) periódicos (mensualmente); ambos tratamientos mostraron que los intervalos QT/QTc superaban los 450 ms en aproximadamente el 20% de los pacientes, y 500 ms en el 1% y 2% de los pacientes tratados con de degarelix y leuprorelina, respectivamente (ver sección 5.1).
No se ha estudiado el uso de FIRMAGON en pacientes con un historial de intervalo QT corregido mayor de 450 ms; con historial o factores de riesgo de torsades de pointes o medicación concomitante que pueda producir una prolongación del intervalo QT. Por lo que, en estos pacientes, la relación beneficio/riesgo de FIRMAGON debe ser cuidadosamente evaluada (ver secciones 4.5 y 4.8).
Insuficiencia hepática: los pacientes con sospecha de enfermedad hepática o enfermedad hepática diagnosticada no han sido incluidos en los ensayos clínicos a largo plazo con degarelix. Se han observado incrementos moderados pero transitorios en la ALT y AST sin aumento de la bilirrubina o manifestaciones clínicas.
En estos pacientes se recomienda la monitorización de la función hepática durante el tratamiento. Se ha investigado la farmacocinética de degarelix tras la administración de una dosis intravenosa única en pacientes que presentan insuficiencia hepática de leve a moderada (ver sección 5.2).
Insuficiencia renal: no se ha estudiado el uso de degarelix en pacientes con insuficiencia renal grave, por lo que se debe utilizar con precaución en estos pacientes.
Hipersensibilidad: no se ha estudiado el uso de degarelix en pacientes con historial de asma grave no controlada, reacciones anafilácticas o urticaria/angiedema grave.
Cambios en la densidad ósea: se ha descrito en la literatura médica una disminución de la densidad ósea en varones orquiectomizados o en pacientes tratados con agonistas de la GnRH. Esto permite anticipar que el tratamiento prolongado de supresión androgénica produce cambios en la densidad ósea. No se ha determinado la densidad ósea durante el tratamiento con degarelix.
Tolerancia a la glucosa: se ha observado una disminución en la tolerancia a la glucosa en varones orquiectomizados o tratados con agonistas de la GnRH. Puede ocurrir un desarrollo o empeoramiento de la diabetes, por lo que los pacientes diabéticos que sigan un tratamiento de deprivación androgénica requerirán una monitorización más frecuente de la glucosa sanguínea. No se ha estudiado el efecto de degarelix sobre los niveles de insulina o glucosa.
Enfermedad cardiovascular: ha sido reportado en la literatura médica, enfermada cardiovascular tal como infarto e infarto al miocardio en pacientes con terapia de privación androgénica. Por lo tanto, se deben tomar en cuenta todos los factores de riesgo cardiovasculares.
Posología y forma de administración
Posología
Dosis de inicio: 240 mg administración en dos inyecciones subcutáneas de 120 mg.
Dosis de mantenimiento – administración mensual: 80 mg administrados en una inyección subcutánea.
La primera dosis de mantenimiento se administrará un mes después de la dosis de inicio.
El efecto terapéutico de degarelix deberá ser monitorizado mediante parámetros clínicos y los niveles plasmáticos de antígeno prostático específico (PSA). En ensayos clínicos se ha demostrado que la supresión de testosterona (T) sucede inmediatamente después de la administración de la dosis de inicio, de tal manera que un 96% de los pacientes presentan niveles de testosterona séricos similares a los obtenidos mediante castración médica (T≤0,5 ng/ml) a los tres días y un 100% un mes después de la administración. El tratamiento a largo plazo con la dosis de mantenimiento hasta un año, muestra que el 97 % de los pacientes mantienen la supresión de los niveles de testosterona (T≤0,5 ng/ml).
En el caso de que aparezca una respuesta subóptima en los pacientes, se confirmará que los niveles plasmáticos de testosterona continúan estando en niveles de supresión. Debido que degarelix no produce picos de testosterona, no es necesaria la administración conjunta de antiandrógenos al inicio del tratamiento.
Método de administración: FIRMAGON debe reconstituirse antes de su administración.
Vía de administración: ÚNICAMENTE para uso subcutáneo, no administrar por vía intravenosa. No se ha estudiado la administración por vía intramuscular, por lo que no se recomienda el uso de esta vía.
FIRMAGON se administra por inyección subcutánea en la pared abdominal. Al igual que otros medicamentos que se utilizan por vía subcutánea, debe variarse periódicamente el lugar de la inyección. Las inyecciones se deben realizar en zonas que no estén sometidas a presión local, por ejemplo ni muy cerca de la cintura ni muy cerca del área costal. Las instrucciones para la reconstitución deben respetarse escrupulosamente. No se recomienda la administración de distintas concentraciones debido a que la formación del sistema de gelificación depósito está determinada por la concentración. La solución reconstituida debe ser límpida, libre de sustancias no disueltas.
LOS VIALES NO DEBEN SER AGITADOS
FIRMAGON 120 mg: el empaque contiene dos viales de polvo y dos jeringas prellenadas con solvente que deben ser preparadas para inyección subcutánea. Por lo tanto, el procedimiento descrito a continuación necesita ser repetido una segunda ocasión.
1. Remover la cubierta de empaque del adaptador del vial. Conectar el adaptador al vial del polvo presionando el adaptador hacia abajo hasta que la punta salga a través del tapón de goma y el adaptador se ajuste en su lugar.
2. Preparar la jeringa prellenada mediante la inserción del vástago del émbolo.
3. Remover el tapón de la jeringa prellenada. Insertar la jeringa en el vial del polvo enroscándola en el extremo superior del adaptador. Transferir todo el disolvente al vial del polvo.
4. Con la jeringa aún insertada en el adaptador, mover sutilmente el vial hasta que el líquido se vea claro y sin partículas de polvo no disueltas. Si el polvo se adhiere a las paredes del vial arriba de la superficie del líquido, inclinar ligeramente el vial. Evite la agitación del vial para prevenir la formación de espuma.
La formación de un anillo de burbujas en la superficie del líquido es aceptable. El procedimiento de reconstitución generalmente toma pocos minutos, pero en algunos casos puede tardar hasta 15 minutos.
5. Colocar el vial boca abajo y extraer hasta la línea marcada en la jeringa para inyección. Siempre asegúrese de retirar el volumen exacto y ajustar por alguna burbuja de aire.
6. Desconectar la jeringa del adaptador del vial y colocar la aguja en la jeringa para inyección subcutánea.
7. Realizar una inyección subcutánea profunda. Para eso: agarrar la piel del abdomen, elevar el tejido subcutáneo e insertar la aguja profundamente en un ángulo no menor de 45 grados.
Inyectar 3 ml de FIRMAGON 120 mg lentamente, inmediatamente después de la reconstitución.
8. No se debe inyectar en áreas en dónde el paciente vaya a estar expuesto a presión, por ejemplo alrededor del cinturón o de la cintura o cerca de las costillas.
No inyectar directamente en una vena. Jale el émbolo cuidadosamente para verificar si se aspira sangre. Si aparece sangre en la jeringa, el producto no puede ser usado. Suspenda el procedimiento y deseche la jeringa y la aguja (reconstituir una nueva dosis para el paciente).
9. Repetir el procedimiento de reconstitución para la segunda dosis. Elegir un sitio diferente de inyección e inyectar 3 ml.
FIRMAGON 80 mg: el empaque contiene un vial de polvo y una jeringa prellenada con solvente que debe ser preparada para inyección.
1. Remover la cubierta de empaque del adaptador del vial. Conectar el adaptador al vial del polvo presionando el adaptador hacia abajo hasta que la punta salga a través del tapón de goma y el adaptador se ajuste en su lugar.
2. Preparar la jeringa prellenada mediante la inserción del vástago del émbolo.
3. Remover el tapón de la jeringa prellenada. Insertar la jeringa en el vial del polvo enroscándola en el extremo superior del adaptador. Transferir todo el solvente al vial del polvo.
4. Con la jeringa aún insertada en el adaptador, mover sutilmente el vial hasta que el líquido se vea claro y sin partículas de polvo no disueltas. Si el polvo se adhiere a las paredes del vial arriba de la superficie del líquido, inclinar ligeramente el vial. Evite la agitación del vial para prevenir la formación de espuma. La formación de un anillo de burbujas en la superficie del líquido es aceptable. El procedimiento de reconstitución generalmente toma pocos minutos, pero en algunos casos puede tardar hasta 15 minutos.
5. Colocar el vial boca abajo y extraer hasta la línea marcada en la jeringa para inyección. Siempre asegúrese de retirar el volumen exacto y ajustar por alguna burbuja de aire.
6. Desconectar la jeringa del adaptador del vial y colocar la aguja en la jeringa para inyección subcutánea.
7. Realizar una inyección subcutánea profunda. Para eso: agarrar la piel del abdomen, elevar el tejido subcutáneo e insertar la aguja profundamente en un ángulo no menor de 45 grados.
Inyectar 4 ml de FIRMAGON 80 mg lentamente, inmediatamente después de la reconstitución.
8. No se debe inyectar en áreas en dónde el paciente vaya a estar expuesto a presión, por ejemplo alrededor del cinturón o de la cintura o cerca de las costillas.
Poblaciones especiales
Pacientes de edad avanzada y pacientes con insuficiencia hepática o renal: no es necesario realizar ajuste de dosis en pacientes de edad avanzada o en aquellos pacientes que presenten un cuadro de insuficiencia hepática o renal de leve a moderado (ver sección 6.2). No se ha estudiado en pacientes con insuficiencia hepática o renal grave, por lo que se debe utilizar con precaución en estos pacientes (ver sección Advertencias y precauciones especiales de empleo).
Población pediátrica: FIRMAGON no tiene indicaciones adecuadas para su uso en mujeres, niños y adolescentes en el tratamiento de pacientes varones adultos con cáncer de próstata avanzado hormono-dependiente.
Sobredosis: No hay experiencia clínica de los efectos causados por una sobredosis aguda de degarelix. En caso de sobredosis, se debe monitorizar al paciente y administrar tratamiento de soporte, si fuese necesario.