
EYLIA
AFLIBERCEPT
Solución para inyección intravítrea
Estuche , 1 Vial(es) , Solución para inyección
COMPOSICIÓN:
Composición cualitativa y cuantitativa
Un mililitro de SOLUCIÓN PARA INYECCIÓN contiene 40 mg de Aflibercept.
Cada JERINGA PRECARGADA de dosis única proporciona una cantidad utilizable para dar una dosis única de 50 microlitros que contienen 2 mg de Aflibercept.
Cada VIAL proporciona una cantidad utilizable para dar una dosis única de 50 microlitros que contienen 2 mg de Aflibercept. Para la lista completa de excipientes, ver la sección “Lista de excipientes”.
Lista de excipientes: Polisorbato 20, Fosfato dihidrogenado de sodio, monohidrato, Fosfato disódico hidrogenado, heptahidrato, Cloruro de sodio, Sacarosa, Agua para inyectables.
Forma farmacéutica: Solución para inyección. Solución transparente, incolora a amarillo pálido, isoosmótica de pH 6.2.
INDICACIONES TERAPÉUTICAS:
Indicaciones: EYLIA está indicado para el tratamiento de:
- Degeneración macular asociada a la edad neovascular (DMAE húmeda).
- Edema macular secundario a la oclusión de la vena central de la retina (OVCR).
- Edema macular secundario a la oclusión de rama de la vena de la retina (ORVR).
- Edema macular diabético (EMD).
- Neovascularización coroidea miópica (NVC miópica).
CONTRAINDICACIONES:
- Infección ocular o periocular.
- Inflamación intraocular activa severa.
- Hipersensibilidad conocida a Aflibercept o a alguno de sus excipientes.
REACCIONES ADVERSAS:
Eventos adversos
Resumen del perfil de seguridad: Se han presentado eventos adversos serios relacionados con el procedimiento de inyección en menos de 1 en 2,400 inyecciones intravítreas con EYLIA e incluyeron endoftalmitis, desprendimiento de retina, catarata traumática, cataratas, desprendimiento vítreo y aumento de la presión intraocular (ver sección “Advertencias y precauciones especiales de empleo”).
Los eventos adversos observados más frecuentemente (en al menos el 5% de los pacientes tratados con EYLIA) fueron hemorragia conjuntival , dolor ocular , cataratas (7.6%), aumento de la presión intraocular , desprendimiento vítreo y moscas volantes.
Lista tabulada de reacciones adversas: Los datos de seguridad descritos a continuación incluyen todas las reacciones adversas de los ocho estudios de fase III con una posibilidad razonable de causalidad con el procedimiento de inyección o con el medicamento. Las reacciones adversas se listan con un sistema de clasificación de órganos y frecuencia usando el siguiente criterio:
Muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); poco frecuentes (≥1/1,000 a <1/100), muy poco frecuentes (>1/10,000 a < 1/1,000). En cada grupo de frecuencia, las reacciones adversas al fármaco se presentan en orden decreciente de seriedad.
|
Tabla 1: Todas las reacciones adversas emergentes del tratamiento informadas en pacientes de estudios de fase III |
||||
|
Clase de órgano o sistema |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Muy poco frecuentes |
|
Trastornos del sistema inmunológico. |
Hipersensibilidad. |
|||
|
Trastornos oculares. |
Hemorragia conjuntival, dolor ocular. |
Desgarro del epitelio pigmentario retiniano*, desprendimiento del epitelio pigmentario de la retina, catarata, catarata cortical, catarata nuclear, catarata subcapsular, erosión corneal, abrasión corneal, aumento de la presión intraocular, visión borrosa, moscas volantes, desprendimiento vítreo, dolor en el lugar de la inyección, sensación de cuerpo extraño en los ojos, aumento del lagrimeo, edema palpebral, hemorragia en el lugar de la inyección, queratitis punteada. Hiperemia conjuntival, hiperemia ocular. |
Endoftalmitis**, desprendimiento retiniano, desgarro retiniano, uveítis, iritis, iridociclitis, opacidades lenticulares, defecto del epitelio corneal, turbidez del humor acuoso de la cámara anterior, edema corneal. |
Catarata traumática, vitritis, hipópion. |
|
*Condiciones conocidas por estar asociadas con la DMAE húmeda. Observadas sólo en los estudios de DMAE húmeda. ** Endoftalmitis con cultivo positivo y cultivo negativo. |
||||
Descripción de las reacciones adversas seleccionadas
Eventos tromboembólicos arteriales: Eventos tromboembólicos arteriales (ETA) son eventos adversos potencialmente relacionados con la inhibición sistémica del VEGF. Hay un riesgo teórico de ETA después del uso intravítreo de inhibidores del VEGF.
Inmunogenicidad: Como con todas las proteínas terapéuticas, hay un potencial de inmunogenicidad con EYLIA.
Efectos sobre la capacidad de conducir o utilizar máquinas: Los pacientes pueden experimentar trastornos visuales temporales después de una inyección intravítrea con EYLIA y los exámenes oculares asociados. No deben conducir ni utilizar máquinas hasta que se haya recuperado suficientemente la función visual.
Incompatibilidades: EYLIA no debe mezclarse con otros medicamentos.
RECOMENDACIONES:
Advertencias y precauciones especiales de empleo
Endoftalmitis: Las inyecciones intravítreas, incluyendo las de EYLIA, se han asociado a endoftalmitis (ver sección “Eventos adversos”). Siempre que se administre EYLIA se debe emplear una técnica de inyección aséptica adecuada.Se debe instruir a los pacientes para que informen inmediatamente cualquier síntoma sugestivo de endoftalmitis y deben tratarse adecuadamente.
Aumento de la presión intraocular: Se han observado aumentos de la presión intraocular en los 60 minutos siguientes a una inyección intravítrea, incluida EYLIA (ver sección “Eventos adversos”). Se ha de tener precaución especial en los pacientes con glaucoma mal controlado. Por lo tanto, en todos los casos se deberá realizar un seguimiento y tratar adecuadamente tanto la presión intraocular como la perfusión de la cabeza del nervio óptico.
Embarazo y lactancia
Embarazo: No se dispone de datos sobre el uso de Aflibercept en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva después de la administración sistémica.
EYLIA no debe usarse durante el embarazo, a menos que el beneficio potencial supere el posible riesgo para el feto.Mujeres en edad fértil: Las mujeres en edad fértil deben utilizar un método anticonceptivo eficaz durante el tratamiento y durante al menos 3 meses después de la última inyección intravítrea de EYLIA.
Lactancia: Se desconoce si Aflibercept es excretado en la leche materna. No puede excluirse un riesgo para el lactante. EYLIA no se recomienda durante la lactancia. Debe tomarse la decisión sobre si interrumpir la lactancia o abstenerse del tratamiento con EYLIA.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y forma de administración: EYLIA es para inyección intravítrea. Sólo debe ser administrado por un médico calificado con experiencia en la administración de inyecciones intravítreas.
Pauta posológica
Degeneración macular asociada a la edad neovascular (DMAE húmeda): La dosis recomendada de EYLIA es de 2 mg (equivalente a 50 microlitros).
El tratamiento con EYLIA se inicia con una inyección mensual para tres dosis consecutivas, seguida por una inyección cada 2 meses. A largo plazo (luego de los primeros 12 meses de tratamiento), se recomienda que los pacientes continúen con el tratamiento con EYLIA cada 2 meses.
Edema macular secundario a la oclusión de la vena central de la retina (OVCR): La dosis recomendada de EYLIA es de 2 mg (equivalente a 50 microlitros). Después de la inyección inicial, el tratamiento se administra una vez al mes hasta la estabilización de los resultados visuales y/o anatómicos. Pueden requerirse tres o más inyecciones consecutivas mensuales.
El tratamiento se debe continuar y el intervalo se puede extender en función de los resultados visuales y/o anatómicos.
Edema macular secundario a la oclusión de rama de la vena de la retina (ORVR): La dosis recomendada de EYLIA es de 2mg (equivalente a 50 microlitros).
Posterior a la inyección inicial, el tratamiento se debe administrar mensualmente hasta la estabilización de los resultados visuales y/o anatómicos. Pueden requerirse tres o más inyecciones consecutivas mensuales.
El tratamiento se debe continuar y el intervalo se puede extender en función de los resultados visuales y/o anatómicos.
Edema macular diabético (EMD): La dosis recomendada de EYLIA es de 2 mg (equivalente a 50 microlitros) administrado por inyección intravítrea mensualmente durante las primeras 5 dosis consecutivas, seguidas por una inyección cada 2 meses.
Neovascularización coroidea miópica (NVC miópica): La dosis recomendada de EYLIA es una única inyección intravítrea de 2 mg (equivalent e a 50 microlitros). Solo deben administrarse dosis adicionales si los resultados visuales y anatómicos indican que la enfermedad persiste. Información adicional sobre poblaciones especiales
Información adicional en poblaciones especiales Pacientes con insuficiencia hepática y/o renal: No se han realizado estudios específicos en pacientes con insuficiencia hepática y/o renal con EYLIA.
Los datos disponibles no indican la necesidad de ajustar la dosis con EYLIA en estos pacientes.
Pacientes de edad avanzada: No es necesaria ninguna consideración especial.
Forma de administración: Las inyecciones intravítreas deben realizarse conforme a los estándares médicos y las directrices aplicables, por un médico cualificado con experiencia en la administración de inyecciones intravítreas. En general, tienen que garantizarse anestesia y asepsia adecuadas, incluyendo microbicidas tópicos de amplio espectro (p. ej., Povidona Iodada). Se recomie nda desinfección quirúrgica de las manos, guantes estériles, campos estériles y un blefaróstato estéril (o equivalente).Inmediatamente después de la inyección intravítrea, en los pacientes se debe monitorizar una posible elevación de la presión intraocular. La monitorización adecuada puede consistir en un control de la perfusión de la cabeza del nervio óptico o una tonometría. En caso necesario, debe haber disponible un equipo estéril para paracentesis.Después de la inyección intravítrea se debe instruir a los pacientes para que informen, inmediatamente, sobre cualquier síntoma sugestivo de endoftalmitis (p. ej., dolor ocular, enrojecimiento ocular, fotofobia, visión borrosa).Cada jeringa precargada o vial debe utilizarse únicamente para el tratamiento de un solo ojo.
Después de la inyección, cualquier producto no utilizado debe desecharse.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: En general, fueron bien toleradas dosis de hasta 4 mg a intervalos mensuales en los ensayos clínicos y de 8 mg en casos aislados de sobredosis. La sobredosis con aumento del volumen de inyección puede incrementar la presión intraocular. Por tanto, en caso de sobredosis se debe monitorizar la presión intraocular y, si se considera necesario por el médico responsable, debe iniciarse el tratamiento adecuado.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de almacenamiento: Conservar en refrigeración (de 2°C a 8°C / 36°F a 46 °F). No congelar. Mantenga la jeringa precargada en su envase blíster y dentro del empaque de cartón externo para protegerla de la luz. Conservar el vial en el empaque de cartón para protegerlo de la luz.
Instrucciones de uso / manipulación: La jeringa precargada y el vial son de un solo uso. Antes de la administración, inspeccione visualmente la solución inyectable. No use la jeringa precargada o el vial si son visibles partículas, turbidez o descoloración. Antes de utilizar, el vial o el envase blíster no abiertos de EYLIA pueden conservarse a temperatura ambiente (25°C / 77°F) hasta por 24 horas. Después de abrir el vial o el envase blíster, continuar bajo condiciones asépticas.
Para la inyección intravítrea se debe usar una aguja hipodérmica de 30 G x 0.5 pulgadas.
Jeringa precargada:
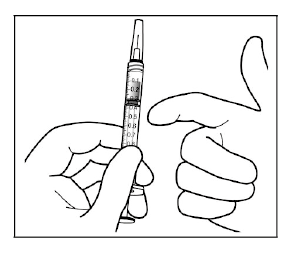
1. Cuando esté listo para administrar EYLIA, abra el estuche y saque el envase blíster esterilizado. Despegue con cuidado el envase blíster, asegurando la esterilidad de su contenido. Mantenga la jeringa en la bandeja estéril hasta que usted esté listo para el ensamblaje.
2. Usando técnica aséptica, saque la jeringa del envase blíster esterilizado.
3. Para quitar el capuchón de la jeringa, sujete la jeringa con una mano mientras que usa la otra mano para asir el capuchón de la jeringa con los dedos pulgar e índice. Observación: quite (no gire o doble) el capuchón de la jeringa.
4. Para evitar comprometer la esterilidad del producto, no tire del émbolo.
5. Usando técnica aséptica, enrosque firmemente la aguja hipodérmica en la punta de la jeringa Luer-Lock.
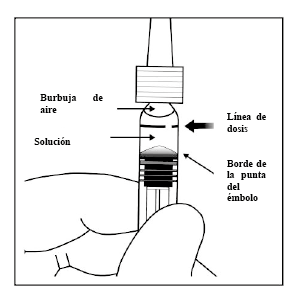
6. Sujete la jeringa con la aguja hacia arriba, compruebe que no hay burbujas en la jeringa. Si hay burbujas, golpee suavemente la jeringa con los dedos hasta que las burbujas se desplacen a la parte superior.
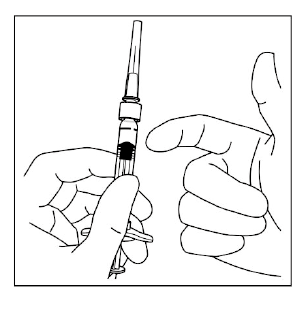
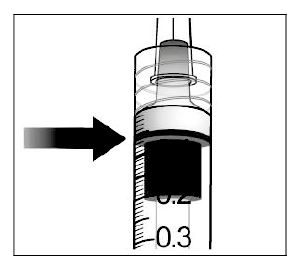
7. Para eliminar todas las burbujas y para expulsar el exceso de fármaco, empuje despacio el émbolo hasta alinear la base cilíndrica del émbolo en forma de cúpula con la línea negra de dosificación en la jeringa (equivalente a 50 microlitros).
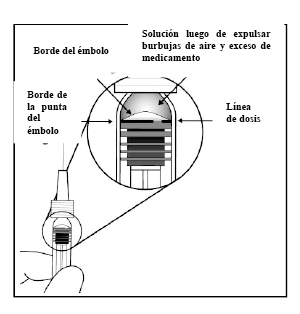
Viales:
1. Quite la tapa de plástico y desinfecte la parte exterior del tapón de goma del vial.
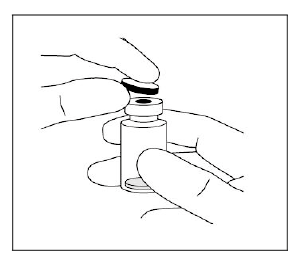
2. Acople la aguja con filtro de 18 G y 5 micras suministrada en el estuche a una jeringa Luerlock estéril de 1 mL.
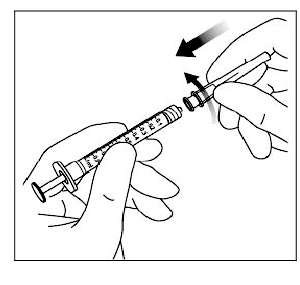
3. Introduzca la aguja con filtro en el centro del tapón del vial hasta que la aguja esté totalmente introducida en el vial y la punta contacte el fondo o el extremo inferior del vial.
4. Usando técnica aséptica, extraiga todo el contenido del vial de EYLIA en la jeringa, manteniendo el vial en una posición vertical, ligeramente inclinado para facilitar la extracción completa. Para que no entre aire, asegúrese de que el bisel de la aguja con filtro esté sumergido en el líquido. Continúe inclinando el vial mientras lo retira, manteniendo el bisel de la aguja con filtro sumergido en el líquido.
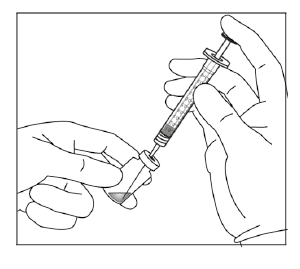
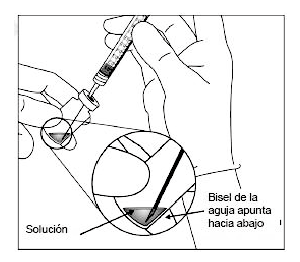
5. Asegurése de que el vástago del émbolo se haya retirado lo suficiente cuando vacíe el vial para vaciar completamente la aguja con filtro.
6. Quite la aguja con filtro y deséchela adecuadamente.
Nota: la aguja con filtro no debe utilizarse para la inyección intravítrea.
7. Usando técnica aséptica, enrosque firmemente una aguja hipodérmica de 30 G x 0.5 pulgadas a la punta de la jeringa Luerlock.
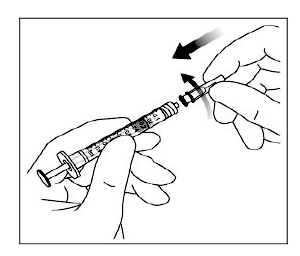
8. Sujete la jeringa con la aguja hacia arriba, compruebe que no hay burbujas en la jeringa. Si hay burbujas, golpee suavemente la jeringa con los dedos hasta que las burbujas se desplacen a la parte superior.
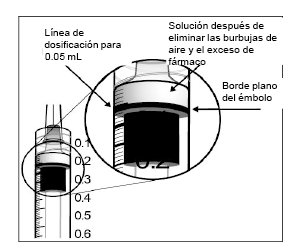
9. Elimine todas las burbujas y expulse el exceso de fármaco empujando despacio el émbolo, de modo que el extremo del émbolo se alinee con la línea que marca 0.05 mL en la jeringa.
Bayer S. A.
Para mayor información, comuníquese con la
Dirección Médica de Bayer S. A.
Luxemburgo N34-359 y Av. Portugal esquina.
Edif. Cosmopolitan Parc, pisos 6 y 7
Quito-Ecuador.
Telf: (593) 2 3975200
informacionmedicaandina@bayer.com
farmacovigilancia.ecuador@bayer.com
www.andina.bayer.com