
EPACOR
ÁCIDO EICOSAPENTAENÓICO (EPA), DOCOSAHEXAENÓICO, ÁCIDO (DHA)
Cápsula blanda
Caja, 30 Cápsulas,
COMPOSICIÓN:
Cada CÁPSULA BLANDA DE GELATINA CON CUBIERTA ENTÉRICA contiene 1000 mg de ácidos omega 3 al 84% de concentración de EPA+DHA equivalentes a 840 mg de EPACOR®.
EPACOR®, es un agente regulador de los lípidos, en forma de cápsula blanda de gelatina con cubierta entérica para administración oral.
Cada CÁPSULA de 1 gramo de EPACOR® contiene al menos 840 mg de etilésteres de ácidos grasos omega-3 de aceite de pescado. Son en su mayoría una combinación de ésteres de ácido eicosapentaenóico (EPA – aproximadamente 465 mg) y ácido docosahexaenóico (DHA - aproximadamente 375 mg).
PRINCIPIO ACTIVO (S) / GRUPO FARMACOLÓGICO:
Descripción del fármaco: Ácidos grasos poliinsaturados omega 3 de alta concentración.
La fórmula empírica del etil -ester de EPA es C22H34O2, y su peso molecular es 330.51. La fórmula estructural del etil-ester del EPA es:
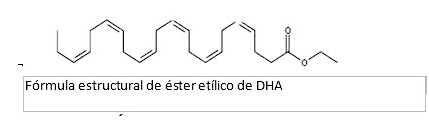
La fórmula empírica del etil- ester del DHA es C24H36O2, y su peso molecular es 356,55. La fórmula estructural de éster etílico de DHA es:
INDICACIONES TERAPÉUTICAS:
Indicaciones: EPACOR® (etil-ésteres de ácidos grasos omega-3) está indicado a tratamiento adjunto a dieta y a otros tratamientos estándar (IECAs, bloqueadores beta, antiagregantes, estatinas) en la prevención secundaria del infarto de miocardio, y b) en el tratamiento de la hipertrigliceridemia (> 500 mg/dl) endógena en pacientes adultos cuando las medidas dietéticas resultan insuficientes.
MECANISMO DE ACCIÓN:
Farmacología clínica
Mecanismo de acción: El mecanismo de acción de EPACOR® no ha sido aclarado totalmente.
Los posibles mecanismos de acción hipolipemiante incluyen: -diacilglicerol acil-transferasa (DGAT).
Actividad de la lipoproteín lipasa plasmática.
EPACOR® puede reducir la síntesis de triglicéridos en el hígado dado que EPA y el DHA son sustratos pobres de las enzimas responsables de la síntesis de TG, e inhiben la esterificación de otros ácidos grasos. Farmacocinética
En voluntarios sanos y en pacientes con hipertrigliceridemia, EPA y DHA son bien absorbidos cuando se administran por vía oral como etil-ésteres. Los ácidos grasos Omega-3 administrados como etil-ésteres (EPACOR®) inducen un aumento significativo, dosis dependiente, en el contenido de EPA en los fosfolípidos del suero, el aumento en el contenido de DHA es menos marcado y nodependiente de la dosis.
Poblaciones específicas
Edad: La incorporación de EPA y DHA en los fosfolípidos séricos es independiente de la edad (<49 años frente a> 49 años).
Género: Las mujeres tienden a incorporar más EPA en los fosfolípidos del suero que los hombres. El significado clínico de esto es desconocido.
Pediátrica: La farmacocinética de EPACOR® (EPA + DHA) en pacientes pediátricos no se ha establecido.
Insuficiencia renal o hepática: EPACOR® no ha sido estudiado en pacientes con insuficiencia renal o hepática.
CONTRAINDICACIONES:
EPACOR® está contraindicado en pacientes con hipersensibilidad conocida (por ej. la reacción anafiláctica) al EPACOR® o cualquiera de sus componentes.
REACCIONES ADVERSAS:
Experiencia de los ensayos clínicos: Dado que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los clínicos de un fármaco pueden no reflejar las tasas observadas en la práctica. Las reacciones adversas notificadas en al menos 3% y con una frecuencia mayor que el placebo para los pacientes tratados con EPA + DHA, basada en datos reunidos a través de 23 estudios clínicos, se enumeran en la Tabla 3.
|
Tabla 3. Reacciones adversas que ocurren con |
||||
|
Reacciones Adversas* |
EPA + DHA (N= 656) |
Placebo (N= 370) |
||
|
n |
% |
n |
% |
|
|
Eructos |
29 |
4 |
5 |
1 |
|
Dispepsia |
22 |
3 |
6 |
2 |
|
Alteraciones del gusto |
27 |
4 |
1 |
<1 |
|
*Los estudios incluyeron pacientes con HCT y HTG severa. |
||||
Otras reacciones adversas de los ensayos clínicos se enumeran a continuación:
- Sistema digestivo: estreñimiento, trastornos gastrointestinales y vómitos.
- Trastornos metabólicos y nutricionales: aumento de ALT y AST.
- Piel: prurito y sarpullido.
Interacciones medicamentosas: Los anticoagulantes u otras drogas que afectan la coagulación algunos estudios con EPA + DHA han demostrado la prolongación del tiempo de sangría, el cual sin embargo no ha excedido los límites normales y no producen episodios de hemorragias clínicamente significativas. Nose han realizado estudios clínicos para examinar a fondo el efecto de la administración concomitante de anticoagulantes y EPA + DHA. En algunos estudios se encontró un aumento significativo del fibrinógeno, al igual que una disminución del tiempo de coagulación en la prueba combinada de protrombina cuando se administró EPA + DHA en pacientes tratados con concomitantemente con anticoagulantes orales. Estos resultados apuntan a una interacción con anticoagulantes que puede ser de relevancia clínica. Los pacientes que reciban tratamiento con EPACOR® y un fármaco anticoagulante o de otro tipo que afecte la coagulación, (por ej. Aspirina, AINES, Warfarina, Cumarina), deben ser controlados periódicamente.
Abuso de drogas y dependencia: No se conocen efectos de abuso o dependencia ocasionados por los componentes de EPACOR®.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones medicamentosas
Estatinas: En los diversos estudios que evaluaron la coadministración diaria de una estatina (Simvastatina 80 mg, Atorvastatina 80 mg o Rosuvastaina 40 mg) con EPA + DHA, 4 gramos/día no afectó el área bajo la curva (AUC) o la tasa (Cmáx) de la exposición a las Estatinas o sus metabolitos activos en estado estacionario.
Estudios in vitro utilizando microsomas hepáticos humanos indican que no existe inhibición del citocromo P450 clínicamente significativa mediada por la combinación de EPA/DHA en humanos.
Estudios clínicos
Hipertrigliceridemia severa: Los efectos de han sido evaluados en diversos estudios clínicos. EPA + DHA en dosis de 4 gramos por día fue evaluado en dos estudios aleatorizados, doble ciego, controlados con placebo, de grupos paralelos de 84 pacientes adultos (42 con EPA + DHA, 42 con placebo), con niveles de triglicéridos muy altos. Los pacientes cuyos niveles basales de triglicéridos estuvieron entre 500 y 2.000 mg/dl se reclutaron en 2 estudios de una duración de 6 a 16 semanas. La mediana de triglicéridos y los niveles de LDL-C en estos pacientes fueron 792 mg/dL y 100 mg/dLrespectivamente. Nivel medio de HDL-C fue de 23,0 mg/dl. Los resultados de este estudio se muestran en la tabla 1.
|
Tabla 1. Medianas de referencia y porcentaje de cambio desde la basal en los parámetros lipídicos en pacientes con niveles de muy altos de |
|||||
|
Parámetros |
EPA*DHAN=42 |
Placebo N=42 |
Dif. |
||
|
BI |
% Cambio |
BI |
% Cambio |
||
|
TG |
816 |
-44.9 |
788 |
+6.7 |
-51.6 |
|
No HDL-C |
271 |
-13.8 |
292 |
-3.6 |
-10.2 |
|
CT |
296 |
-9.7 |
314 |
-1.7 |
-8.0 |
|
VLDL-C |
175 |
-41.7 |
175 |
-0.9 |
-40.8 |
|
HDL-C |
22 |
+9.1 |
24 |
0.0 |
+9.1 |
|
LDL-C |
89 |
+44.5 |
108 |
-4.8 |
+49.3 |
|
BL= Basal (mg/dL): 5 Cambio = Cambio medio por ciento desde l abasal: DIF = Cambio medio en % con EPA + DHA - Cambio medio en % con placebo. |
|||||
placebo), con triglicéridos persistentemente altos (200 a 499 mg/dl) a pesar de tratamiento con imvastatina. Los pacientes fueron tratados con Simvastatina 40 mg al día durante 8 semanas antes de la aleatorización, para controlar su colesterol LDL a no más del 10% por encima de las metas del NCEP ATP y se mantuvo en esta dosis durante el estudio.
Tras 8 semanas de tratamiento abierto con Simvastatina, los pacientes fueron aleatorizados a EPA + DHA 4 g/día o placebo durante otras 8 semanas con coterapia con Simvastatina. El promedio basal de triglicéridos y los niveles de LDL-C en estos pacientes fueron 268 mg/dL y 89 mg/dL, respectivamente. Las medianas de referencia de no-HDL-C y los niveles de HDL-C fueron 138 mg/dL y 45 mg/dL, respectivamente. Los cambios en los parámetros lipídicos de los grupos que recibieron Simvastatina más EPA + DHA o más placebo se muestran en la Tabla 2.
|
Tabla 2. Respuesta a la adición de EPA/DHA 4 g/día a pacientes con hipertrigliceridemia (200 a 499 mg/dL) con terapia en curso con |
||||||||
|
Parámetros |
EPA/DHA + Simvastatina N= 122 |
Placebo + Simvastatina N= 122 |
Dif. |
Valor P |
||||
|
BI |
FDT |
Cmed% |
BI |
FDT |
Cmed% |
|||
|
No HDL-C |
137 |
123 |
-9.0 |
141 |
134 |
-2.2 |
-6.8 |
< 0.0001 |
|
TG |
268 |
482 |
-29.5 |
271 |
260 |
-6.3 |
-23.2 |
< 0.0001 |
|
TC |
184 |
172 |
-4.8 |
184 |
178 |
-1.7 |
-3.1 |
<0.05 |
|
VLDL-C |
52 |
37 |
-27.5 |
52 |
49 |
-7.2 |
-20.3 |
<0.05 |
|
Apo-B |
86 |
80 |
-4.2 |
87 |
85 |
-1.9 |
-2.3 |
<0.05 |
|
HDL-C |
46 |
48 |
+3.4 |
43 |
44 |
-1.2 |
+4.6 |
<0.05 |
|
LDL-C |
91 |
88 |
+0.7 |
88 |
85 |
-2.8 |
+3.5 |
=0.05 |
|
BL= Basal (mg/dL):; FOT= Fin de tratamiento (mg/dL); Cmed %= Cambio medio en porcentaje desde la basal; Dif= Cambio medio en % con EPA/DHA - Cambio medio en % con Placebo. |
||||||||
EPA+DHA 4 g/día redujo significativamente los niveles de no-HDL-C, TG, TC, VLDL-C, y Apo-B e incremento el HDL-C y LDL-C desde la basal con respecto al placebo.
RECOMENDACIONES:
Advertencias y precauciones
Precauciones
Monitoreo: Pruebas de laboratorio en pacientes con insuficiencia hepática, la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST) deben ser controlados periódicamente durante el tratamiento con EPACOR®. En algunos pacientes, tratados con EPA + DHA, se observó aumento de los niveles de ALT, sin un aumento concomitante en los niveles de AST.
En algunos pacientes, EPACOR® puede aumentar los niveles de LDL-C, el cual debe ser controlado periódicamente durante el tratamiento.
Los estudios de laboratorio deben realizarse periódicamente para medir los niveles de TG del paciente durante el tratamiento.
Alergia al pescado: EPACOR® contiene ésteres de ácidos grasos omega-3 (EPA y DHA) obtenidos a partir de aceite de pescado. No se sabe si los pacientes con alergia al pescado y / o los crustáceos, tienen un mayor riesgo de una reacción alérgica a EPACOR®.
Advertencias
- EPACOR® utilizarse con precaución en pacientes con sensibilidad conocida o alergia al pescado y / o los crustáceos.
- Los pacientes deben ser advertidos que el uso de agentes reguladores de lípidos no reduce la importancia de adherirse a la dieta.
Carcinogénesis, mutagénesis, alteración de la fertilidad: Se han realizado estudios de carcinogenicidad en ratas con dosis orales por sonda de hasta 2g/kg/día, (hasta 5 veces la exposición sistémica humana después de una dosis oral de 4 g/día basado en una comparación de superficie corporal), sin aumento en la incidencia de tumores.
Los etil-esteres de AG Omega-3 no resultaron mutagénicos o clastogénicos en ensayos de aberraciones cromosómicas en las células pulmonares de hámster chino V79 o en linfocitos humanos.
En un estudio de fertilidad en ratas con dosis orales por sonda de hasta 2 g/kg/día, tratadas durante 2 semanas antes y durante el apareamiento, gestación y lactancia, no se observó ningún efecto adverso sobre la fertilidad. Uso en poblaciones específicas
Embarazo. Categoría C: No hay estudios adecuados y bien controlados en mujeres embarazadas. Se desconoce si EPACOR® puede causar daño fetal cuando es administrado a una mujer embarazada o puede afectar la capacidad reproductiva.
EPACOR® debe utilizarse durante el embarazo sólo si el beneficio potencial para el paciente justifica el riesgo potencial para el feto.
Datos en estudios animales: En ratas hembras que recibieron dosis orales por sonda de hasta 2 g/kg/día de EPA+DHA, (5 veces la exposición sistémica humana con una dosis de 4 g/día basado en la comparación de la superficie corporal), comenzando dos semanas antes del apareamiento y continuando durante la gestación y la lactancia, no se observaron efectos adversos. Tampoco se observó efectos adversos en ratas preñadas que recibieron dosis orales de 2 g/kg/día por sonda desde el primer día de gestación, ni en las que lo recibieron a partir del día 14 de gestación hasta el día 21 de lactancia.
Madres lactantes: No se sabe si los etil-ésteres de ácidos grasos omega-3 se excretan en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, se debe tener precaución cuando se administra EPACOR® a una mujer lactante.
Uso pediátrico: La seguridad y eficacia en pacientes pediátricos no han sido establecidas.
Uso geriátrico: Un número limitado de pacientes mayores de 65 años han sido reclutados en los estudios clínicos de EPA + DHA. La seguridad y eficacia en los sujetos mayores de 60 años no parecen diferir de los de los sujetos menores de 60 años de acuerdo a los resultados.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Consideraciones de uso: Los pacientes deben recibir una dieta hipolipemiante adecuada antes de recibir EPACOR® y deben seguirla durante el tratamiento.
Se deben realizar estudios de laboratorio para asegurarse de que los niveles de lípidos son consistentemente anormales antes de instituir la terapia con EPACOR®. Deben realizarse los esfuerzos necesarios para controlar los lípidos séricos con dieta apropiada, ejercicio, pérdida de peso en pacientes obesos, y el control de cualquier problema médico como la diabetes mellitus y el hipotiroidismo, que puedan estar contribuyendo a las anormalidades de los lípidos.
Los medicamentos conocidos por exacerbar la hipertrigliceridemia (como ß-bloqueadores, tiazidas, estrógenos) se debe suspender o cambiar si es posible antes de la consideración de la terapia con medicamentos para reducir los triglicéridos.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis y administración: La dosis diaria de EPACOR® es de hasta 4 gramos por día y puede tomarse como una sola dosis de 4 gramos (4 cápsulas) o como dosis fraccionada dos veces al día. Las cápsulas de EPACOR® no deben romperse, triturarse o, masticarse.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: En el caso de una sobredosis, el paciente debe ser tratado sintomáticamente, con las medidas generales de tratamiento de soporte, según sea necesario.
PRESENTACIÓN:
Caja x 30 cápsulas de gelatina blanda con cubierta entérica.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Condiciones de almacenamiento: Por debajo de 30 grados centígrados.
RODDOME PHARMACEUTICAL S. A.
P. O. Box 17-17-148
Quito, Ecuador
Fabricado por: Procaps S. A.
Colombia