
ELOMET
FUROATO DE MOMETASONA
Crema
1 Caja, 1 Tubo, 15 g, 0,1 g %
COMPOSICIÓN:
Forma farmacéutica y formulación: Crema
Cada gramo 0.1% contiene:
Furoato de mometasona 1 mg
En una base de crema de hexilenglicol, fosfatidilcolina hidrogenada, dióxido de titanio, octenilsuccinato de almidón alumínico, cera blanca, petrolato blanco, agua purificada y ácido fosfórico para ajustar el pH.
INDICACIONES TERAPÉUTICAS:
La crema de furoato de mometasona está indicada para el alivio de las manifestaciones inflamatorias y pruríticas de la dermatosis que responde a corticosteroides. Las indicaciones tales como psoriasis, dermatitis atópica e irritación y/o dermatitis alérgica por contacto pueden ser incluidas.
PRINCIPIO ACTIVO (S) / GRUPO FARMACOLÓGICO:
La formulación de Elomet Crema contiene furoato de mometasona (SCH 32088; Figura 1.1), un corticosteroide sintético 17-heterocíclico con propiedades antiinflamatorias, antipruríticas y vasoconstrictoras, que actualmente está siendo utilizado terapéuticamente para el tratamiento de dermatosis corticosusceptibles, tales como psoriasis y dermatitis atópica.
Principio Activo
Furoato de mometasona (ver figura 1.1), 9,21-dicloro-11β,17-dihidroxi-16α-metilpregna-1,4-dieno-3,20-diona 17-(2)-furoato, es un corticosteroide antiinflamatorio, sintético; cuyo núcleo esteroide es el 16α-metil análogo de beclometasona, pero con un grupo 21-cloro y una nueva función (2)-furoato 17-éster. La fórmula empírica es C27H30Cl2O6 y Peso Molecular (PM) es 521.44.
FIGURA 1.1: FUROATO DE MOMETASONA (SCH 32088)
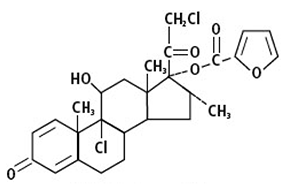
MECANISMO DE ACCIÓN:
Propiedades farmacológicas
La actividad farmacodinámica de la crema de furoato de mometasona está directamente relacionada con su componente activo, furoato de mometasona, y los vehículos.
Al igual que otros corticosteroides tópicos, furoato de mometasona tiene propiedades antiinflamatorias, antipruriginosas y vasoconstrictoras. El mecanismo de la actividad antiinflamatoria de los esteroides tópicos, en general, no está claro. Los corticosteroides, sin embargo, se cree que actúan por la inducción de proteínas inhibidoras de la fosfolipasa A2, llamadas colectivamente lipocortinas. Se ha postulado que estas proteínas controlan la biosíntesis de mediadores potentes de la inflamación, tal como prostaglandinas y leucotrienos, mediante la inhibición de la liberación de ácido araquidónico su precursor común. El ácido araquidónico es liberado de la membrana de los fosfolípidos por la fosfolipasa A2.
Furoato de mometasona es un potente inhibidor de la producción in vitro de tres citoquinas inflamatorias que están implicados en la iniciación y el mantenimiento del estado inflamatorio: interleuquina 1 (IL - 1), interleucina 6 (IL-6), y factor de necrosis tumoral (TNF- α ).
El grado de absorción percutánea de los corticosteroides tópicos está determinado por muchos factores, incluyendo el vehículo y la integridad de la barrera epidérmica y el uso de vendajes oclusivos. Los corticosteroides tópicos pueden ser absorbidos por la piel intacta normal. La inflamación y/u otros procesos de enfermedades en la piel aumentan la absorción percutánea. Los vendajes oclusivos aumentan sustancialmente la absorción percutánea de los corticosteroides tópicos
Farmacocinética y metabolismo preclínico
Se realizaron varios estudios para investigar la absorción, distribución, metabolismo y excreción después de varias rutas de administración y en diferentes especies del furoato de mometasona. El furoato de mometasona y/o sus metabolitos son rápidamente y extensamente distribuidos en las ratas. El Furoato de mometasona experimenta un extenso metabolismo de primer paso y se excreta en forma de metabolitos principalmente por vía biliar, y de forma limitada en la orina.
Datos de seguridad preclínico
No hay efectos toxicológicos únicos a la exposición de furoato de mometasona demostrados durante el curso de las pruebas preclínicas. Todos los efectos observados son típicos de esta clase de compuestos y están relacionados con los efectos farmacológicos exagerados de los glucocorticoides.
Los estudios preclínicos demuestran que el furoato de mometasona carece de actividad androgénica, anti-androgénica, estrogénica o anti-estrogénica, pero, al igual que otros glucocorticoides, exhibe alguna actividad anti-uterotrófica y retrasa la apertura vaginal en modelos animales a altas dosis orales de 56 mg/kg/día y 280 mg/kg/día.
Absorción
La absorción percutánea de furoato de 3H-mometasona fue estudiado en el hombre después de la aplicación tópica de la crema al (0.1%). Los resultados mostraron que solo aproximadamente 0.4% y 0.7% del esteroide, respectivamente, fueron absorbidos sistémicamente después de 8 horas de contacto, sin oclusión, a través de la piel intacta de voluntarios normales.
En los estudios sobre los efectos de la crema de furoato de mometasona en el eje hipotalámico-pituitario-adrenal (HPA), 15 gramos fueron aplicados dos veces al día durante 7 días a 6 pacientes con psoriasis o dermatitis atópica. La crema se aplicó sin oclusión a por lo menos 30 % de la superficie del cuerpo. Los resultados sugieren que el medicamento provocó un ligero descenso de la secreción de corticoides adrenales, aunque en ningún caso los niveles de cortisol en plasma van por debajo del límite inferior del rango normal.
En un estudio con 24 niños (de 6 meses a 13 años de edad) con eczema atópico moderado a severo, la crema de furoato de mometasona fue aplicada una vez al día durante tres a seis semanas. No se utilizaron apósitos oclusivos. Los niveles de cortisol en plasma para todos los pacientes permanecieron dentro o por encima del rango normal durante el curso del tratamiento. Los valores de laboratorio clínico de los niños en general, se mantuvieron dentro del rango normal. Hubo algunos valores de laboratorio que estaban fuera del rango normal durante el curso del tratamiento; sin embargo, el investigador no consideró que estos valores sean de importancia clínica o indicativo de toxicidad del sistema de órganos específicos.
Distribución
Debido a la absorción insignificante de furoato de mometasona después de la administración tópica, se evaluó la farmacocinética del fármaco después de la administración intravenosa de furoato de mometasona. El volumen aparente de distribución fue de 917 litros, lo que indica que cualquier furoato de mometasona absorbido se distribuye ampliamente. En el plasma humano, el furoato de mometasona está unido en un 99%.
Metabolismo
El furoato de mometasona absorbido se metaboliza de manera rápida y extensa en múltiples metabolitos. Los múltiples metabolitos son más polares que el furoato de mometasona, y debido a su polaridad, no se considera que tengan actividad farmacológica. No se forma ningún metabolito principal. Después de la administración intravenosa, el aclaramiento total de furoato de mometasona fue 976 ml/min, lo que confirma un extenso metabolismo.
Excreción
Después de la administración intravenosa y basado en el modelo compartimental, la vida media efectiva de eliminación plasmática es de 5.8 horas. Cualquier absorción del fármaco se excreta en forma de metabolitos principalmente por vía biliar, y de forma limitada, en la orina.
CONTRAINDICACIONES:
La crema de furoato de mometasona está contraindicada en pacientes que son hipersensibles al furoato de mometasona o a cualquier otro componente en estas preparaciones.
REACCIONES ADVERSAS:
Las siguientes reacciones adversas locales han sido reportadas con las formulaciones tópicas de furoato de mometasona: prurito, reacciones en el sitio de aplicación, infecciones bacterianas, foliculitis, furunculosis, erupciones acneiformes y signos de atrofia de la piel.
Las reacciones adversas locales adicionales que han sido reportadas con poca frecuencia cuando los corticosteroides dermatológicos tópicos se han utilizado como se recomienda incluyen: ardor, irritación, sequedad, hipertricosis, hipopigmentación, dermatitis perioral, dermatitis alérgica por contacto, maceración de la piel, infección secundaria, estrías, miliaria.
También se han reportado reacciones adversas sistémicas, como la visión borrosa, con el uso de corticosteroides tópicos.
RECOMENDACIONES:
Si se desarrolla irritación, se debe descontinuar los corticosteroides tópicos e instaurar una terapia adecuada.
En presencia de una infección dermatológica, se debe instituir el uso de un agente antimicótico o antibacteriano apropiado. Si no ocurre rápidamente una respuesta favorable, se debe descontinuar el corticosteroide hasta que la infección esté controlada adecuadamente.
La absorción sistémica de corticosteroides tópicos puede producir la supresión reversible del eje hipotalámico-pituitario-adrenal (HPA) con el potencial de insuficiencia glucocorticosteroide después de la suspensión del tratamiento. En algunos pacientes también puede producirse manifestaciones del síndrome de Cushing, hiperglucemia y glucosuria por absorción sistémica de corticosteroides tópicos durante el tratamiento. Los pacientes que se aplican un esteroide tópico en una gran área de superficie o en áreas bajo oclusión deben ser evaluados periódicamente para evidenciar de la supresión del eje HPA.
Cualquiera de los efectos secundarios que se reportan después del uso sistémico de corticosteroides, incluyendo supresión adrenal, pueden también ocurrir con corticosteroides tópicos, especialmente en lactantes y niños.
La alteración visual puede ser reportada con uso sistémico y tópico (incluyendo, intranasal, inhalado e intraocular) de corticosteroides. Si un paciente se presenta con síntomas como visión borrosa u otras alteraciones visuales, se debe considerar al paciente para que lo remita a un oftalmólogo para evaluar posibles causas de alteraciones visuales que pueden incluir cataratas, glaucoma o enfermedades raras como la coriorretinopatía serosa central (CSCR, por sus siglas en inglés) las cuales han sido reportadas después del uso de corticosteroides sistémicos y tópicos.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica a partir de dosis equivalentes debido a su mayor superficie de la piel a masa corporal.
No hay estudios adecuados y bien controlados en mujeres embarazadas. Al igual que otros glucocorticoides, las formulaciones de furoato de mometasona deben usarse en mujeres embarazadas o en periodo de lactancia solo si el beneficio potencial justifica el riesgo potencial para la madre, feto o bebé.
Los productos de furoato de mometasona no son para uso oftálmico.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Aplicar una capa delgada de furoato de mometasona crema a las áreas de piel afectadas una vez al día.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
El uso excesivo y prolongado de corticosteroides tópicos puede suprimir la función hipotalámica-pituitaria-adrenal, dando lugar a insuficiencia suprarrenal secundaria.
Si se observa supresión del eje HPA, se debe tratar de retirar el medicamento, para reducir la frecuencia de aplicación o para sustituir por un esteroide menos potente.
PRESENTACIONES:
Caja x 1 tubo crema x 15 g.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Conservar a una temperatura no mayor a 30°C.
LEYENDAS DE PROTECCIÓN:
Todo producto debe conservarse fuera del alcance de los niños..
Hecho en México por:
SCHERING-PLOUGH LABO N.V.,
Heist-op-den-Berg – Bélgica.