
DIPROCEL
BETAMETASONA
Ungüento
1 Caja, 1 Tiras de aluminio, 30 g, 0,05 g %
COMPOSICIÓN:
Forma farmacéutica y formulación: Ungüento
Cada gramo de UNGÜENTO 0.05% contiene:
dipropionato de betametasona (equivalente a 0.5 mg de betametasona) 0.64 mg
En un vehículo aumentado, optimizado que contiene cera blanca, estearato de propilenglicol, propilenglicol y vaselina.
INDICACIONES TERAPÉUTICAS:
Indicaciones y uso
DIPROCEL Ungüento es indicado para el alivio de manifestaciones inflamatorias y pruríticas de la dermatosis sensible a los corticosteroides.
PRINCIPIO ACTIVO (S) / GRUPO FARMACOLÓGICO:
DIPROCEL ungüento, contiene dipropionato de betametasona, un corticosteroide sintético con actividad anti-inflamatoria a administrarse tópicamente.
El dipropionato de betametasona es un polvo blanco a blanco crema, inodoro, cristalino, insoluble en agua; totalmente soluble en acetona y en cloroformo; escasamente soluble en alcohol.
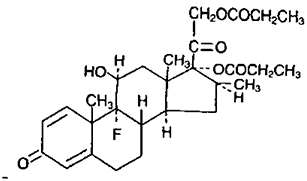
Tiene un peso molecular de 504.16 y la fórmula empírica es C28H37FO7; un nombre químico de 9-fluoro-11ß,17,21-trihidroxi-16ß-metilpregna-1,4-dieno-3,20-diona,17,21-dipropionato y tiene la siguiente fórmula:
MECANISMO DE ACCIÓN:
Farmacología clínica
Los corticosteroides tópicos, como el dipropionato de betametasona, son efectivos en el tratamiento de dermatosis sensibles a corticosteroides, principalmente debido a sus acciones anti-inflamatorias, anti-pruríticas y vasoconstrictoras. Mientras los efectos fisiológicos, farmacológicos y clínicos de los corticosteroides son bien conocidos, son inciertos los mecanismos exactos de sus acciones en cada enfermedad. Sin embargo, se cree que los corticosteroides actúan por la inducción de proteínas inhibidoras de la fosfolipasa A2, llamadas colectivamente lipocortinas. Se ha postulado que estas proteínas controlan la biosíntesis de mediadores potentes de inflamación, como prostaglandinas y leucotrienos, mediante la inhibición de la liberación de su precursor común, el ácido araquidónico. El ácido araquidónico es liberado desde la membrana de fosfolípidos por la fosfolipasa A.
La magnitud de la absorción percutánea de los corticosteroides tópicos es determinada por muchos factores incluyendo el vehículo, la integridad de la barrera epidérmica y el uso de vendas oclusivas.
Mientras que los corticosteroides tópicos pueden ser absorbidos desde la piel normal intacta, la inflamación dérmica y/u otros procesos de enfermedad dermatológica pueden incrementar la absorción percutánea. Los apósitos oclusivos incrementan sustancialmente la absorción percutánea de los corticosteroides tópicos.
A 14 gramos por día durante nueve días, DIPROCEL Ungüento demostró disminuir los niveles plasmáticos de cortisol tras aplicaciones repetidas en la piel enferma en pacientes con psoriasis. Estos efectos fueron reversibles al suspender el tratamiento. A 7 gramos por día (aplicados como 3.5 gramos dos veces al día), DIPROCEL Ungüento demostró causar mínima inhibición del eje HPA cuando se lo aplicó durante dos a tres semanas en pacientes normales y en pacientes con psoriasis y trastornos eczematosos. Con 6 a 7 gramos de DIPROCEL Ungüento aplicado una vez por día por tres semanas, no se observó ninguna inhibición significativa del eje HPA en pacientes con psoriasis y dermatitis atópica, cuando se midió los niveles de cortisol plasmático y de 17-hidroxi-corticosteroide urinario en 24 horas.
Después de la absorción dérmica, los corticosteroides tópicos ingresan en las vías farmacocinéticas de manera similar a los corticosteroides administrados por vía sistémica. En grados variables, los corticosteroides son fijados a las proteínas plasmáticas. Estos son metabolizados primariamente en el hígado y excretados por los riñones. Algunos corticosteroides tópicos y sus metabolitos son excretados por vía biliar.
CONTRAINDICACIONES:
DIPROCEL Ungüento está contraindicado en aquellos pacientes con antecedentes de sensibilidad al dipropionato de betametasona, otros corticosteroides o a cualquiera de los componentes de estas preparaciones.
REACCIONES ADVERSAS:
Se han reportado las siguientes reacciones adversas locales con DIPROCEL:
Ungüento: Eritema, foliculitis, prurito/picazón y vesiculación.
Otras reacciones adversas locales que se han comunicado con el uso de corticosteroides tópicos incluyen: hipertricosis, hipopigmentación, dermatitis perioral, dermatitis alérgica por contacto, maceración de la piel, infección secundaria, trastornos de la piel (ejemplos de los cuales incluyen la atrofia de la piel y sequedad), estrías y miliaria.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Información preclínica
Carcinogénesis, Mutagénesis y Disminución
de la Fertilidad:
No se han realizado estudios de larga duración en animales para evaluar el potencial carcinogénico del dipropionato de betametasona o el efecto sobre la fertilidad de los corticosteroides aplicados tópicamente.
El dipropionato de betametasona fue negativo en un ensayo de mutagenicidad bacteriana (Salmonella typhimurium y Escherichia coli), y en un ensayo de mutagenicidad en células de mamíferos (CHO/HGPRT). Fue positivo en el ensayo in vitro sobre aberración de cromosomas de linfocitos humanos, y equívoco en el ensayo in vivo en micronúcleos de médula ósea del ratón. Este patrón de respuesta es similar al de la dexametasona e hidrocortisona.
Estudios en conejos, ratones y ratas, usando dosis intramusculares de hasta 1, 33 y 2 mg/kg respectivamente, produjeron incrementos relacionados con la dosis en reabsorciones fetales en conejos y ratones.
Los corticosteroides han demostrado ser teratogénicos en animales de laboratorio cuando se los administra sistémicamente en niveles de dosis relativamente bajos. Algunos corticosteroides han mostrado ser teratogénicos después de la aplicación dérmica en animales de laboratorio. Se ha demostrado que el dipropionato de betametasona es fetotóxico (incidencia mayor de reabsorciones) y teratogénico en conejos cuando se administra por vía intramuscular en dosis de 0.015 y 0.05 mg/kg. Esta dosis es aproximadamente 26 veces la dosis tópica humana de DIPROCEL asumiendo una absorción percutánea humana de aproximadamente 3% y el uso de 7 g por día en una persona de 70 kg. Las anomalías observadas incluyeron hernias umbilicales (0.015 y 0.05 mg/kg), cefalocele y paladar hendido (0.05 mg/kg); también se observó una incidencia mayor de reabsorciones en ambos niveles de dosis. Otros corticosteroides han mostrado ser teratogénicos en animales de laboratorio cuando se los administró sistémicamente a niveles de dosis relativamente bajas y algunos corticosteroides han sido teratogénicos después de la aplicación dérmica.
INFORMACIÓN COMPLEMENTARIA:
Embarazo: No existen estudios adecuados y bien controlados del potencial teratogénico de los corticosteroides aplicados de manera tópica en mujeres embarazadas. Por lo tanto, los esteroides tópicos deben usarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres en periodo de lactancia: No se sabe si la administración tópica de corticosteroides resultaría en suficiente absorción sistémica para producir cantidades detectables en la leche materna. Los corticosteroides administrados de manera sistémica son secretados en la leche materna en cantidades que probablemente no tengan ningún efecto dañino en el infante. Sin embargo, se debe tomar una decisión sobre suspender el medicamento, tomando en cuenta la importancia del medicamento para la madre.
RECOMENDACIONES:
Generalidades: La absorción sistémica de corticosteroides tópicos puede producir supresión reversible del eje HPA con el potencial de insuficiencia de glucocorticosteroides después de retirar el tratamiento. También se pueden producir manifestaciones del síndrome Cushing en algunos pacientes por absorción sistémica de corticosteroides tópicos mientras están en tratamiento.
Por lo tanto, los pacientes que se aplican una gran dosis de esteroide tópico potente en un área grande de superficie deben ser evaluados periódicamente en busca de evidencia de supresión del eje HPA. Si se nota supresión del eje HPA, se debe hacer el intento de retirar el medicamento, reducir la frecuencia de aplicación, o sustituir con un corticosteroide menos potente. La recuperación de la función del eje HPA es generalmente pronta y completa cuando se suspende el medicamento. De manera infrecuente, pueden ocurrir signos y síntomas de retiro de esteroide, que requieren corticosteroides sistémicos suplementarios.
Cualquiera de los efectos secundarios que se reportan después del uso sistémico de corticosteroides, incluyendo supresión adrenal, pueden también ocurrir con corticosteroides tópicos, especialmente en lactantes y niños.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica de las dosis equivalentes debido a su mayor superficie de piel en relación a la masa corporal.
Si se desarrolla irritación, se debe suspender el tratamiento e instituir una terapia apropiada.
En presencia de infecciones dermatológicas, se debe instituir el uso de un agente antifúngico o antibacterial apropiado. Si no ocurre prontamente una respuesta favorable, se debe suspender el corticosteroide hasta que la infección haya sido controlada adecuadamente.
DIPROCEL no es para uso oftálmico.
La alteración visual puede ser reportada con uso sistémico y tópico de corticosteroides (incluyendo inhalado intranasal e intraocular). Si un paciente se presenta con síntomas como visión borrosa u otras alteraciones visuales, se debe considerar al paciente para remisión a un oftalmólogo para la evaluación de posibles causas de trastornos visuales que pueden incluir cataratas, glaucoma o enfermedades raras como la coriorretinopatía serosa central (CSR) que han sido reportados después del uso de corticoides sistémicos y tópicos.
DOSIS Y VÍA DE ADMINISTRACIÓN: Solo Para Uso Dermatológico.
Aplique una fina capa de DIPROCEL Ungüento en las áreas afectadas una o dos veces por día. El tratamiento con DIPROCEL Ungüento debe limitarse a 50 gramos por semana
USO PEDIÁTRICO:
No se ha establecido la seguridad y efectividad de los productos DIPROCEL en pacientes pediátricos. Por lo tanto, no se recomienda el uso de productos DIPROCEL en pacientes menores de 12 años de edad. Los pacientes pediátricos pueden demostrar mayor sensibilidad a la supresión del eje HPA inducido por corticosteroides tópicos y a los agentes corticosteroides exógenos en comparación con pacientes adultos mayores por su mayor absorción debido a una relación mayor de área de superficie de piel con respecto al peso corporal. Se ha reportado la supresión del eje HPA, síndrome de Cushing e hipertensión intracraneal en pacientes pediátricos que reciben corticosteroides tópicos. Las manifestaciones de la supresión adrenal en pacientes pediátricos niños incluyen el retardo del crecimiento lineal, retardo del aumento de peso, bajos niveles de cortisol en el plasma y ausencia de respuesta a la estimulación de ACTH. Las manifestaciones de hipertensión intracraneal incluyen una fontanela abultada, cefalea y papiledema bilateral.
También se han notificado reacciones adversas sistémicas, como la visión borrosa, con el uso de corticosteroides tópicos.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
El uso prolongado, excesivo de esteroides tópicos puede suprimir la función hipotalámica–pituitaria–adrenal, resultando en insuficiencia adrenal. Si se nota la supresión del eje HPA, se debe intentar retirar el medicamento, reducir la frecuencia de aplicación, o sustituir con un esteroide menos potente.
PRESENTACIONES:
Caja con 7 tabletas de 500 mg cada una.
Caja con 7 tabletas de 750 mg cada una.
Caja con frasco ámpula con 500 mg en 100 ml.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Conservar a una temperatura no mayor a 30°C.
LEYENDAS DE PROTECCIÓN:
Todo medicamento debe conservarse fuera del alcance de los niños.
Hecho por:
SCHERING-PLOUGH LABO N.V.,
Heist-op-den-Berg – Bélgica.