
DIPHERELINE 3.75 MG
TRIPTORELINA
Polvo para suspensión inyectable
1 Caja, 1 Vial de polvo, 3,75 mg
COMPOSICIÓN:
Principio activo
Cada vial de 175 mg contiene
Triptorelina acetato
equivalente a triptorelina 3.75 mg
Excipientes: Polimero láctico coglicolico, manitol, carmelosa sódica, polisorbato 80
Cada ampolla de 2 ml de disolvente contiene:
manitol, agua para inyección.
PRINCIPIO ACTIVO (S) / GRUPO FARMACOLÓGICO:
Grupo farmacoterapéutico: Este medicamento es un análogo sintético de la hormona liberadora de gonadotrofina.
Antineoplásico e inmunomodulador, análogo de la hormona liberadora de gonadotrofina.
INDICACIONES TERAPÉUTICAS:
Cáncer de próstata.
Tratamiento de cáncer de próstata localmente avanzado solo en combinación y como adyuvante de radioterapia.
Tratamiento del cáncer de próstata metastásico. El efecto favorable del tratamiento es más pronunciado y más frecuente si el paciente no ha recibido previamente ningún otro tratamiento hormonal.
- Pubertad precoz (antes de los 8 años en niñas y de los 10 en niños).
- Endometriosis genital y extragenital (estadio I a IV).
El tratamiento no debe ser administrado por más de 6 meses (ver efectos no deseados). No se recomienda tomar un segundo curso de tratamiento con triptorelina u otro análogo de GnRH.
- Infertilidad femenina.
Tratamiento complementario asociado a gonadotropinas (HMG, FSH, HCG) durante la inducción de la ovulación para la fecundación in vitro y transferencia de embrión (F.I.V.T.E.).
Tratamiento de fibromiomas uterinos previo a la cirugía:
- Asociado con anemia (hemoglobina ≤ 8 g/dl),
- Cuando la reducción del tamaño del fibromioma es necesario para facilitar o modificar la técnica quirúrgica: cirugía endoscópica, cirugía transvaginal. La duración del tratamiento es restringida a 3 meses.
CONTRAINDICACIONES:
Nunca utilice DIPHERELINE 3,75 mg:
• Si usted es alérgico (hipersensible) a la triptorelina, a la hormona encargada de liberar gonadotropinas (GnRH), a los demás análogos de GnRH o a uno de los demás componentes de DIPHERELINE 3,75 mg.
• Si está embarazada o amamantando.
REACCIONES ADVERSAS:
¿Cuáles son los posibles efectos no deseados? AI igual que todos los medicamentos, DIPHERELINE 3,75 mg puede provocar efectos no deseados, aunque no todas las personas los experimenten. En raras ocasiones se puede producir una reacción alérgica grave. Consulte inmediatamente al médico si experimenta síntomas tales como dificultad para tragar o respirar, hinchazón de los labios, la cara, la garganta o la lengua, erupción cutánea.
El uso prolongado de este medicamento en el adulto podría provocar una disminución de la masa ósea.
Si usted presenta una hipertrofia (tumor benigno) de la glándula pituitaria sin diagnosticar, ésta se puede descubrir durante el tratamiento con DIPHERELINE 3,75 mg. Los síntomas incluyen dolores de cabeza repentinos, vómitos, trastornos a la vista y parálisis ocular. AI igual que con otros análogos de GnRH, con el uso de DIPHERELINE 3,75 mg se puede observar un aumento de la cantidad de glóbulos blancos.
En el hombre
La mayoría de los efectos no deseados son esperables debido al cambio de la tasa de testosterona en el cuerpo. Dichos efectos incluyen bochornos, impotencia y disminución de la libido.
Muy frecuentes (que afectan a más de 1 paciente de 10)
• Disminución de la libido
• Hormigueo en las piernas
• Bochornos
• Transpiración excesiva
• Dolor dorsal
• Impotencia
• Debilidad
Frecuentes (que afectan entre 1 a 10 pacientes de 100)
• Hipersensibilidad
• Depresión, cambios de humor, pérdida de la libido
• Mareo, dolor de cabeza
• Presión alta
• Boca seca, náuseas
• Dolor muscular y óseo, dolor en las piernas y brazos
• Dolor abdominal inferior
• Reacción en el sitio de inyección (enrojecimiento, inflamación y/o dolor), edema (acumulación de líquido en los tejidos)
• Aumento de peso
• Disminución de glóbulos rojos (anemia)
Poco frecuentes (que afectan entre 1 a 10 pacientes de 1000)
• Aumento de plaquetas sanguíneas
• Pérdida de apetito, diabetes, gota (dolor intenso e hinchazón de las articulaciones, generalmente del dedo gordo del pie), exceso de lípidos en sangre, aumento de apetito.
• Insomnio, irritabilidad
• Entumecimiento u hormigueo
• Problemas de visión
• Zumbido en los oídos, vértigo
• Palpitaciones
• Dificultad para respirar, sangrado nasal
• Acné, caída del cabello, enrojecimiento de la piel, comezón, erupción cutánea
• Dolor abdominal, estreñimiento, diarrea, vómito
• Dolor articular, dolor óseo, calambres musculares, debilidad muscular, dolor muscular
• Despertar para orinar, Problemas para orinar
• Dolor de mamas, inflamación de mamas, reducción del tamaño testicular, dolor de testículos
• Somnolencia, hinchazón de tobillos, pies, dedos, letargia.
• Modificación de algunos exámenes sanguíneos (incluyendo un aumento en los marcadores hepáticos (ALT, AST, creatinina sanguínea, urea sanguínea, GGT), aumento de presión sanguínea, pérdida de peso.
Raras (que afectan entre 1 a 10 pacientes de 10000)
• Inflamación de la nariz y la garganta
• Reacciones anafilácticas
• Estado de confusión, disminución de la actividad, euforia
• Pérdida de memoria
• Sensación anormal en los ojos, trastornos de la vista
• Presión arterial baja
• Respiración entrecortada en posición horizontal
• Sensación de llenura en el abdomen, flatulencia, trastornos del gusto
• Ampollas, coloración roja o violeta de la piel
• Rigidez articular, hinchazón de las articulaciones, rigidez músculo-esquelético, osteoartritis
• Dolor torácico, dificultad para mantenerse en pie, síntomas pseudogripales, fiebre
• Aumento de la fosfatasa alcalina en la sangre
Frecuencia indeterminada (la frecuencia no se puede determinar sobre Ia base de los datos disponibles)
• Reacción alérgica seria la cual causa inflamación de la cara, lengua y cuello, mareo o dificultas para respirar (shock anafiláctico)
• Ansiedad
• Incontinencia urinaria
• Malestar general
• Cambios en el electrocardiograma (prolongación del intervalo QT)
• Edema angioneurótico
AI igual que con los demás análogos de GnRH, se puede observar un aumento en la cantidad de glóbulos blancos con DIPHERELINE 3,75 mg.
Los pacientes tratados en el largo plaza con análogos de GnRH en combinación con radioterapia pueden presentar una mayor cantidad de efectos secundarios, especialmente gastrointestinales asociadas a la radioterapia.
En la mujer
La mayoría de los efectos secundarios son causados por el cambio en el nivel de estrógenos del organismo Efectos más frecuentes (que afectan a más de 1 paciente de 10) incluyen: dificultades para dormir, cambios de humor, decrecimiento de la libido, dolor de cabeza, bochorno, acné, sudoración excesiva, piel grasosa, trastornos mamarios, dolor durante o después de las relaciones sexuales, sangrado vaginal, síndrome de hiperestimulación ovárica (con aumento en el tamaño de los ovarios y retención de líquidos), aumento en el tamaño de los ovarios, dolor pélvico, sequedad de la vagina, debilidad.
Efectos secundarios frecuentes (que afectan entre 1 a 10 pacientes de 100) incluyen: reacciones alérgicas, depresión (tratamiento a largo plazo), nerviosismo, mareos, aumento de peso, náuseas, dolor abdominal o malestar, dolor mamario, dolor de articulaciones, calambres musculares, dolor de piernas y brazos, reacción en el sitio de inyección (incluyendo dolor, hinchazón, enrojecimiento, inflamación), hinchazón de tobillos, pies y dedos.
Efectos secundarios poco frecuentes (que afectan entre 1 a 10 pacientes de 1000) incluyen: disminución del apetito, retención de líquidos, cambios de humor, ansiedad, depresión (períodos cortos de tratamiento), desorientación, cambio del sentido del gusto, pérdida de sensación, pérdida temporal de conciencia, pérdida de memoria, falta de concentración, entumecimiento u hormigueo, movimiento muscular involuntario, ojos secos, visión borrosa, vértigo, palpitaciones, dificultad para respirar, sangrado nasal, sensación de llenura en el abdomen, diarrea, flatulencia, boca seca, úlceras en la boca, vómito, pérdida del cabello, piel seca, excesivo cabello corporal, uñas quebradizas, comezón, rash, dolor de espalda, dolor muscular, sangrado después de las relaciones sexuales, prolapso, menstruación dolorosa, períodos irregulares, períodos largos, quistes pequeños (hinchazón) en los ovarios lo cual causa dolor, secreción de la vagina, pérdida de peso.
Efectos adversos reportados durante la vigilancia post-comercialización (la frecuencia no puede ser estimada de los datos disponibles): Reacciones alérgicas serias las cuales causan hinchazón de la cara, lengua y cuello, mareos o dificultad para respirar (shock anafiláctico), confusión, disturbios visuales, aumento de la presión sanguínea, edema angioneurótico, urticaria, debilidad muscular, ausencia de períodos menstruales, fiebre, malestar general, modificación de algunos exámenes sanguíneos (incluyendo aumento de las pruebas de función hepática (fosfatasa alcalina)), aumento de la presión sanguínea.
En el tratamiento de la infertilidad, la combinación con las gonadotropinas puede causar un aumento en el tamaño de los ovarios o un hiperestímulo ovárico que se puede manifestar a través de dolores pélvicos y/o abdominales y dificultad para respirar. Si ello ocurre, se debe consultar al médico tan pronto como sea posible.
En el tratamiento de la endometriosis, el desorden para el cual el tratamiento ha sido justificado (dolores pélvicos, dismenorrea) puede ser exacerbado al inicio del tratamiento, pero debe desaparecer en uno o dos semanas. Esto puede ocurrir incluso si el tratamiento está produciendo efectos beneficiosos. Sin embargo, se debe notificar inmediatamente al médico de este fenómeno.
En el niño
Efectos secundarios muy frecuentes (que afectan entre 1 a 10 pacientes de 10): sangrados vaginales pueden ocurrir en las niñas en el primer mes de tratamiento.
Efectos secundarios frecuentes (que afectan entre 1 a 10 pacientes de 100): dolor abdominal, enrojecimiento e hinchazón en el sitio de inyección, dolor de cabeza, bochorno, aumento de peso, acné, reacciones de hipersensibilidad.
Efectos adversos poco frecuentes (que afectan entre 1 a 10 pacientes de 1000): visión borrosa, vómitos, estreñimiento, náusea, malestar general, sobrepeso, dolor de cuello, cambios de ánimo, dolor de mamas, sangrado nasal, comezón, rash o urticaria en la piel.
Durante la vigilancia post-comercialización, los siguientes efectos adversos han sido también reportados (su frecuencia no puede ser estimada desde los datos disponibles): aumento de presión sanguínea, visión anormal, reacciones alérgicas serias que causan dificultad para respirar o mareo e hinchazón de la cara, cuello o garganta (shock anafiláctico visto en adultos), edema angioneurótico, dolor muscular, algunas pruebas sanguíneas afectadas incluyen niveles de hormona (prolactina), dolor muscular, desordenes de humor, depresión y nerviosismo.
Efectos sobre la habilidad para conducir vehículos y uso de maquinaria: Usted puede experimentar mareos, cansancio o trastornos en la visión tales como visión borrosa, que constituyen los posibles efectos no deseados del tratamiento o de la enfermedad tratada. Si experimenta alguno de dichos efectos no deseados, no debe conducir o utilizar maquinaria.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones con otros medicamentos: Si usted toma o ha tomado recientemente otro medicamento, incluyendo un medicamento obtenido sin receta, coménteselo a su médico o a su farmacéutico.
Cuando la triptorelina se usa en combinación con fármacos que modifican la secreción de gonadotropinas pituitarias, se deben tomar precauciones especiales y se recomienda terminar el monitoreo con ensayos hormonales. Dado que el tratamiento con deprivación androgénica puede prolongar el intervalo QT, el usoconcomitante de DIPHERELINE con medicamentos conocidos por prolongar el intervalo QT o medicamentoscapaces de inducir torcida de puntas como la clase IA (por ejemplo, quinidina, disopiramida) o clase III (por ejemplo, amiodarona, Sotalol, dofetilida, ibutilida), medicamentos antiarrítmicos, metadona, moxifloxacino, antipsicóticos, etc. deben ser cuidadosamente evaluados.
INFORMACIÓN COMPLEMENTARIA:
Favor leer cuidadosamente este folleto completo antes de utilizar este medicamento.
• Guarde este folleto, podría tener necesidad de releerlo.
• Si tiene alguna otra pregunta, duda, solicite mayor información a su médico o farmacéutico.
• Este medicamento le ha sido recetado en forma personal. No lo comparta con nadie más, aun cuando los síntomas sean idénticos ya que podría ser nocivo para esa persona.
• Si alguno de los efectos no deseados se vuelve grave o si usted observa un efecto no deseado que no se haya mencionado en este folleto, notifíquelo a su médico o farmacéutico.
RECOMENDACIONES:
Precauciones de uso: alertas especiales.
Tome precauciones especiales con DIPHERELINE 3,75 mg: El uso de agonistas de GnRH puede causar reducción en la densidad mineral ósea. En el hombre, datos preliminares sugieren que el uso de un bifosfonato en combinación con un agonista GnRH puede reducir la pérdida de minerales óseos. Precauciones especiales son necesarias si el paciente tiene factores de riesgo adicionales para osteoporosis (i.e abuso crónico del alcohol, fumadores, terapia a largo plazo con medicamentos que reducen la densidad mineral ósea, i.e. anticonvulsivantes o corticosteroides, historia familiar de osteoporosis, malnutrición).
Debe confirmarse que la paciente no está embarazada antes de prescribir DIPHERELINE 3,75 mg.
Raramente, el tratamiento con agonistas de la GnRH puede revelar la presencia de un adenoma gonadotrópico de células pituitarias desconocido previamente. Estos pacientes pueden presentar una apoplexia pituitaria caracterizada por dolor de cabeza repentino, vómito, discapacidad visual y parálisis de los ojos.
Puede haber un aumento en el riesgo de depresión (que puede ser severa) en pacientes que están siendo tratados con agonistas GnRH, tal como triptorelina. Los pacientes deben ser informados y tratados apropiadamente si los síntomas ocurren. Los pacientes con depresión conocida deben ser cuidadosamente monitoreados durante la terapia.
DIPHERELINE 3,75 mg puede producir cambios en el estado de ánimo.
DIPHERELINE 3,75 mg contiene menos de 1 mmol sodio (23 mg) por dosis, siendo esencialmente “libre de sodio”.Se debe tener precaución en pacientes tratados con anticoagulantes, ya que pueden aparecer hematomas en el sitio de inyección.
Cáncer de próstata: Inicialmente, triptorelina, similar a otros agonistas GnRH, causa un aumento transitorio de los niveles séricos de testosterona. Como consecuencia, pueden ocurrir casos aislados de un empeoramiento transitorio de los signos y síntomas del cáncer de próstata durante las primeras semanas de tratamiento. Durante la fase de tratamiento inicial, se debe considerar la administración adicional de un anti-andrógeno apropiado para controlar el aumento inicial de los niveles de testosterona sérica y el empeoramiento de los síntomas clínicos.
Un pequeño número de pacientes puede experimentar un empeoramiento temporal de los signos y síntomas de su cáncer de próstata y un aumento temporal del dolor asociado al cáncer (dolor metastásico) el cual puede ser manejado sintomáticamente.
Similar a otros agonistas GnRH, se ha observado casos aislados de compresión del cordón espinal u obstrucción uretral. Si se desarrolla compresión del cordón espinal o disfunción renal, se debe instituir el tratamiento estándar, y en casos extremos se debe considerar una orquiectomía inmediata (castración quirúrgica). Se debe monitorizar cuidadosamente al paciente durante las primeras semanas de tratamiento, particularmente los pacientes que sufren de metástasis vertebral, por el riesgo de compresión del cordón espinal y los pacientes con obstrucción del tracto urinario. Por esta misma razón, se debe tomar cuidados adicionales cuando se inicia el tratamiento en pacientes con signos premonitorios de compresión del cordón espinal.
Después de la castración quirúrgica, triptorelina no induce ningún decrecimiento adicional de los niveles de testosterona séricos.
La deprivación androgénica a largo plazo, ya sea por orquiectomía bilateral o administración de análogos de GnRH se asocia con un aumento en el riesgo de pérdida ósea y puede conducir a osteoporosis y aumentar el riesgo de fracturas óseas.
La terapia de deprivación androgénica puede prolongar el intervalo QT. En pacientes con historia o factores de riesgo para prolongación de intervalo QT y en pacientes que reciben tratamiento concomitante que pueden prolongar el intervalo QT, los médicos deben evaluar la relación riesgo beneficio incluyendo Torcida de puntas previo a iniciar el tratamiento con DIPHERELINE. Adicionalmente, de datos epidemiológicos, se ha observado que los pacientes pueden experimentar cambios metabólicos (i.e. intolerancia a la glucosa) o un aumento en el riesgo de enfermedades cardiovasculares durante la terapia de deprivación androgénica. Sin embargo, datos prospectivos no han confirmado la relación entre el tratamiento con análogos de GnRH y un aumento en la mortalidad cardiovascular. Los pacientes con alto riesgo para enfermedades metabólicas o cardiovasculares deber ser cuidadosamente evaluados antes de iniciar el tratamiento y ser adecuadamente monitorizados durante la terapia de deprivación androgénica. El riesgo de problemas del ritmo cardíaco puede aumentar cuando se usa DIPHERELINE si usted tiene alguna condición en el corazón o los vasos sanguíneos, incluyendo problemas rítmicos del corazón (arritmia), o está siendo tratado con medicamentos para estas condiciones. Si usted padece de diabetes o sufre de problemas del corazón informe a su médico.
La administración de triptorelina en dosis terapéuticas resulta en supresión del sistema pituitario gonadal.
La función normal es usualmente restaurada después de la discontinuación del tratamiento. Las pruebas diagnósticas de la función gonadal durante el tratamiento y después de la descontinuación de la terapia con análogos de GnRH pueden generar resultados erróneos.
Dada la deprivación androgénica, el tratamiento con análogos GnRH puede incrementar el riesgo de anemia. Este riesgo debe ser evaluado en los pacientes tratados y ser monitorizado apropiadamente.
Un aumento transitorio de las fosfatasas ácidas puede ser observado al inicio del tratamiento. Puede ser beneficioso verificar los niveles de testosterona en sangre periódicamente con un método exacto el cual no debe exceder 1 ng/ml.
En mujeres: Debe confirmarse que la paciente no está embarazada previo a prescribir DIPHERELINE 3,75 mg. El uso de agonistas GnRH puede causar reducción de la densidad mineral ósea en promedio un 1% por mes durante un período de tratamiento de 6 meses. Cada 10% de reducción de la densidad mineral ósea se asocia con un aumento de 2 a 3 veces el riesgo de fractura.
En la mayoría de las mujeres, los datos disponibles sugieren que la recuperación de la pérdida ósea ocurre después de la descontinuación de la terapia.
No hay datos disponibles para pacientes con osteoporosis establecida o con factores de riesgo para osteoporosis (i.e abuso crónico del alcohol, fumadores, terapia a largo plazo con medicamentos que reducen la densidad mineral ósea, i.e. anticonvulsivantes o corticosteroides, historia familiar de osteoporosis, malnutrición i.e. anorexia nerviosa). Dado que la reducción de la densidad mineral ósea es probablemente más perjudicial en estos pacientes, el tratamiento con triptorelina debe considerarse individualmente y sólo debe iniciarse si los beneficios del tratamiento superan el riesgo después de una evaluación muy cuidadosa.
Se deben considerar medidas adicionales para contrarrestar la pérdida de densidad mineral ósea.
Infertilidad femenina: La recuperación folicular inducida por la inyección de triptorelina combinada con gonadotrofinas puede aumentar notablemente en algunos pacientes predispuestos y particularmente en casos de enfermedad ovárica poliquística. Al igual que con otros análogos de la GnRH, ha habido informes de síndrome de hiperestimulación ovárica asociado con el uso de triptorelina en combinación con gonadotropinas, lo cual puede causar dolor pélvico y/o abdominal y dificultad para respirar. Si esto ocurre consulte con su médico inmediatamente.
La respuesta ovárica a la asociación triptorelina-gonadotropina puede diferir con las mismas dosis de un paciente a otro y, en algunos casos, de un ciclo a otro en el mismo paciente. La ovulación inducida debe ser monitoreada bajo supervisión médica rigurosa con controles biológicos y clínicos estrictos y regulares: análisis rápido de estrógenos plasmáticos y ecografía. Si la respuesta ovárica es excesiva, se recomienda interrumpir la estimulación del ciclo interrumpiendo las inyecciones de gonadotropina.
En pacientes con insuficiencia renal o hepática, la triptorelina tiene una vida media de eliminación de 7-8 horas en comparación con 3-5 horas en sujetos sanos. A pesar de esta exposición prolongada, no se espera que la triptorelina esté presente en circulación en el momento de la transferencia del embrión.
Endometriosis y tratamiento pre-quirúrgico de fibromas uterinos: La administración regular, cada cuatro semanas, de un vial de DIPHERELINE 3,75 mg da como resultado una amenorrea hipogonadotrófica constante. Si la hemorragia genital ocurre después del primer mes, se debe medir los niveles de estradiol plasmático y si los niveles están por debajo de 50 pg/ml, se deben investigar posibles lesiones orgánicas.
Dado que la menstruación debe detenerse durante el tratamiento con triptorelina, se debe instruir al paciente para que notifique a su médico si la menstruación regular persiste.
Se debe utilizar un método de anticoncepción no hormonal durante todo el tratamiento, incluso durante un mes después de la última inyección.
Después de retirar el tratamiento, la función ovárica se reanuda y la ovulación se produce aproximadamente 2 meses después de la última inyección.
Se recomienda que, durante el tratamiento de los fibromas uterinos, se determine con regularidad el tamaño del fibroma. Ha habido algunos informes de hemorragia en pacientes con fibromas submucosos después de la terapia con análogos de GnRH. Típicamente, el sangrado ha ocurrido 6 - 10 semanas después del inicio del tratamiento.
Pubertad precoz: El tratamiento de los niños con tumores cerebrales progresivos debe seguir una cuidadosa evaluación individual de los riesgos y beneficios.
En las niñas, la estimulación gonadal inicial puede conducir, en el primer mes, a sangrado vaginal de intensidad leve o moderada.
Después de la interrupción del tratamiento se producirá el desarrollo de las características de la pubertad.
La información con respecto a la fertilidad en pacientes tratados con análogos de GnRH durante la infancia es limitada. En la mayoría de las niñas, la menstruación regular comenzará en promedio un año después de finalizar la terapia.
Se debe excluir la pubertad pseudo-precoz (tumor o hiperplasia gonadal o adrenal) y la pubertad precoz independiente de gonadotropina (toxicosis testicular, hiperplasia familiar de Leydig).
La densidad mineral ósea (DMO) puede disminuir durante la terapia con GnRH para la pubertad precoz central. Sin embargo, después del cese del tratamiento, la acumulación de masa ósea subsecuente se preserva y el pico de masa ósea en la adolescencia tardía no parece afectado por el tratamiento.
Se puede observar un deslizamiento de la epífisis femoral después de retirar el tratamiento con GnRH.
La teoría sugerida es que las bajas concentraciones de estrógeno durante el tratamiento con agonistas de GnRH debilitan la placa epifisaria. El aumento de la velocidad de crecimiento después de descontinuar el tratamiento da como resultado una reducción de la fuerza de cizallamiento necesaria para el desplazamiento de la epífisis.
Uso durante el embarazo y lactancia: La triptorelina no debe usarse durante el embarazo ya que el uso concurrente de agonistas de la GnRH se asocia con un riesgo teórico de aborto o anormalidad fetal. Antes del tratamiento, las mujeres potencialmente fértiles deben ser examinadas cuidadosamente para descartar embarazo. Los métodos no hormonales de anticoncepción deben emplearse durante la terapia hasta que reaparezca la menstruación.Se debe descartar que la paciente esté embarazada antes de prescribir DIPHERELINE para el tratamiento de infertilidad.
Cuando se utiliza triptorelina en este contexto, no hay evidencia clínica que sugiera una relación causal entre la triptorelina y cualquier anomalía subsiguiente del desarrollo de ovocitos o embarazo o del desenlace. Solicite la opinión de su médico o farmacéutico antes de tomar cualquier medicamento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología, método y ruta de administración, frecuencia de administración y duración del tratamiento.|
Método de administración: Vía intramuscular.
Posología
Cáncer de próstata: Una inyección intramuscular de DIPHERELINE 3,75 mg cada 4 semanas.
Pubertad precoz: El tratamiento de los niños con triptorelina debe realizarse bajo la supervisión de un endocrinólogo pediátrico o de un pediatra o endocrinólogo con experiencia en el tratamiento de pubertad precoz central.
Niños con menos de 20 kg de peso: Administrar la mitad de la dosis (la mitad del volumen de la suspensión reconstituida) mediante inyección intramuscular cada 4 semanas (28 días).
Niños con 20 a 30 kg de peso: Administrar 2/3 de la dosis (dos tercios del volumen de la suspensión reconstituida) mediante inyección intramuscular cada 4 semanas (28 días).
Niños con más de 30 kg de peso: Una inyección intramuscular cada 4 semanas (28 días).
Endometriosis: Una inyección intramuscular de DIPHERELINE 3,75 mg cada 4 semanas.
El tratamiento debe iniciarse en los primeros 5 días del ciclo menstrual.
Duración del tratamiento: Depende de la severidad inicial de la endometriosis y los cambios observados en las características clínicas (funcionales y anatómicas) durante el tratamiento. Inicialmente, la endometriosis debe ser tratada por al menos 4 meses y por máximo 6 meses. No se recomienda tomar un segundo curso de tratamiento con triptorelina u otro análogo de GnRH.
Infertilidad femenina: El régimen usual corresponde a un vial de DIPHERELINE 3,75 mg administrado por vía intramuscular en el segundo día del ciclo. La combinación con gonadotropinas se lleva cabo después de la desensibilización pituitaria (estrógenos plasmáticos menores a 50 pg/ml), por lo general alrededor de 15 días después de la inyección de DIPHERELINE. Tratamiento de fibromiomas uterinos previo a cirugía: Una inyección de DIPHERELINE 3,75 mg repetida cada 4 semanas. El tratamiento debe iniciarse en los primeros 5 días del ciclo menstrual. La duración del tratamiento no debe exceder los 3 meses.
Nota: Es importante que la preparación de la inyección se haga rigurosamente de acuerdo a las instrucciones que se acompañan. Debe informarse, cualquier inyección incompleta, que cause la perdida de una cantidad superior a la que normalmente queda en el dispositivo utilizado para la inyección.
Instrucciones de uso
1. Preparación del paciente antes de la reconstitución del medicamento: Prepare al paciente desinfectando el lugar de la inyección. Esta operación debe realizarse primero, ya que una vez reconstituido, el producto debe inyectarse inmediatamente.
2. Preparación de la inyección: En la caja se incluyen dos agujas:
Aguja 1: una aguja larga (38 mm) sin dispositivo de seguridad para utilizar en la reconstitución.
Aguja 2: una aguja larga (38 mm) con dispositivo de seguridad para utilizar en la inyección.

La presencia de burbujas en la parte superior del liofilizado forma parte del aspecto normal del producto.
2a
• Extraer la ampolla que contiene el solvente. Dar unos golpecitos en el extremo de la ampolla para que toda la solución penetre en el cuerpo de la ampolla.
• Enroscar la aguja 1 (sin dispositivo de seguridad) en la jeringa. No quitar aún el protector de la aguja.
• Romper el cuello de la ampolla, manteniéndola en posición vertical.
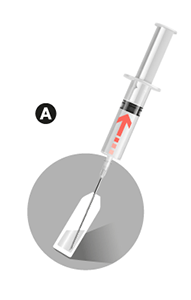
• Quitar el protector de la aguja 1. Insertar la aguja en la ampolla y aspirar todo el disolvente con la jeringa.
• Dejar a un lado la jeringa que contiene el disolvente.
2b
• Extraer el vial que contiene el polvo. Dar unos golpecitos en la parte superior del vial para que el polvo que se haya acumulado baje al fondo del vial.
• Quitar la tapa de plástico del vial.
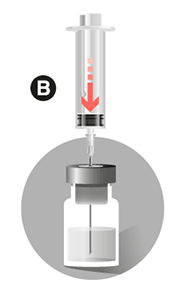
• Volver a coger la jeringa que contiene el solvente e introducir la aguja verticalmente a través del tapón de goma del vial e inyectar lentamente el disolvente para que, si es posible, lave toda la parte superior del vial.
2c
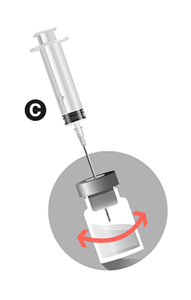
• Desplazar ligeramente la aguja 1 hacia arriba hasta que quede por encima del nivel de líquido. No quitar la aguja del vial. Reconstituir la suspensión, moviendo suavemente de lado a lado. No invertir el vial.
• Asegurarse de que la agitación es suficiente para obtener una suspensión homogénea y lechosa.
• Importante: Verificar que no queda polvo sin suspender en el vial (si se observan grumos, seguir moviendo hasta que desaparezcan).
2d
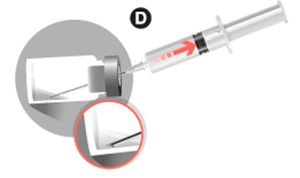
• Cuando la suspensión sea homogénea, deslizar la aguja hacia abajo sin invertir el vial, y aspirar la totalidad de la suspensión. Una pequeña cantidad se quedará en el vial y debe desecharse. Se incluye una cantidad adicional a fin de cubrir esta pérdida.
• Para desacoplar la aguja, manipular sólo la parte coloreada. Retirar de la jeringa la aguja 1 empleada para la reconstitución. Acoplar la aguja 2 a la jeringa.
• Desplazar la cubierta de seguridad de la aguja hacia el cilindro de la jeringa. La cubierta de seguridad se mantiene fija en la posición en que se coloque.
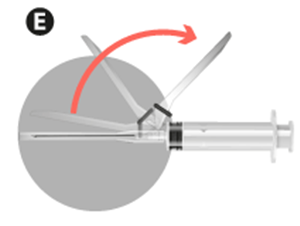
• Quitar el protector de la aguja.
• Purgar la aguja para eliminar el aire de la jeringa e inyectar inmediatamente en el músculo del glúteo previamentedesinfectado.
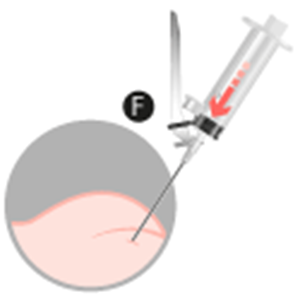
3. Inyección intramuscular
• A fin de evitar la precipitación, inyectar inmediatamente enel músculo del glúteo previamente desinfectado.
4. Después del uso
• Activación del sistema de seguridad utilizando la técnica de una sola mano,
• Nota: Mantener el dedo detrás de la pestaña del dispositivo en todo momento.
Hay dos métodos alternativos para activar el sistema de seguridad.
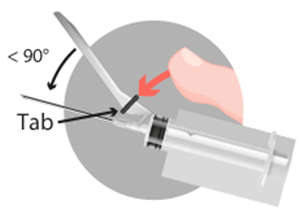
Método A: Empujar la pestaña del dispositivo hacia delante con el dedo.
Método A
o,
Método B: Empujar la cubierta con una superficie plana.Método B
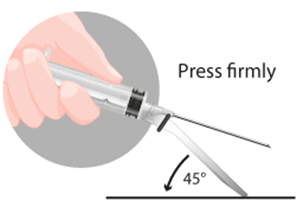
En ambos casos presionar con un movimiento firme y rápido hasta que se escuche un click distintivo.
Confirmar visualmente que la aguja está totalmente bloqueada con el cierre.
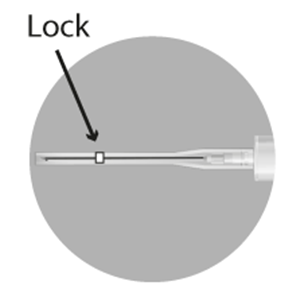
Las agujas usadas, cualquier resto de suspensión no utilizada u otro material residual deben desecharse en conformidad con las directrices locales.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas e instrucción en caso de sobredosis Si toma más DIPHERELINE 3,75 mg del que debería: Consulte inmediatamente con su médico o farmacéutico.Instrucciones en caso de omisión de una o más dosis
Si olvida tomar DIPHERELINE 3,75 mg: Consulte con su médico. No tome una dosis doble por el olvido de la dosis individual.
Riego de síndrome de retirada
Efectos cuando se detiene el tratamiento con DIPHERELINE 3,75 mg
En mujeres, recuperación de actividad ovárica (posibilidad de ovulación, menstruación).
Si usted tiene una consulta adicional durante el uso de este tratamiento, consulte a su médico o farmacéutico.
PRESENTACIÓN:
Caja x 1 vial de polvo, 1 ampolla de disolvente 2 ml + 1 blíster x 1 jeringa con 2 agujas+ Inserto.
Para mayor información diríjase a:
Abbott Laboratorios Cía Ltda.
Av. República de El Salvador N34-493
y Av. Portugal
telefóno: (02) 399-2500
Ó para reporte de eventos adversos:
Email: pv.ecuador@abbott.com
RECOMENDACIONES SOBRE ALMACENAMIENTO:
¿Cómo almacenar dipherelne 3,75 mg?
No usar después de la fecha de vencimiento que aparece en el empaque.
Conservar a temperatura no mayor a 30°C, en su envase y empaque original.
Todo medicamento debe conservarse fuera del alcance de los niños.
Una vez reconstituido, use inmediatamente.
No utilice DIPHERELINE 3,75 mg si constata signos visibles de deterioro a nivel del embalaje o blíster. Informe a su farmacéutico. Los medicamentos no deben ser desechados en el alcantarillado o en la basura doméstica.
Consulte a su farmacéutico que se debe hacer con los medicamentos inutilizados. Estas medidas permiten proteger el medio ambiente.