COMBIVENT
IPRATROPIO, SALBUTAMOL (ALBUTEROL)
Solución para inhalación
Caja , 20 Vial(es) , Solución para inhalación , 2.5 Mililitros
COMPOSICIÓN:
COMBIVENT solución para nebulización en viales monodosis
1 vial monodosis (2,5 mL) de la SOLUCIÓN PARA NEBULIZACIÓN contiene:
522 mcg (8r)-3α-hidroxi-8-isopropil-1αH,5αH-bromuro de tropanio (±)-tropato monohidrato.
(= bromuro de ipratropio) que corresponde a 500 mcg de bromuro de ipratropio anhidro.
3013 mcg di[(RS)-2-tert-butilamino-1-(4-hidroxi-3- hidroximetil-fenil)etanol] sulfato.
(= sulfato de salbutamol) que corresponde a 2500 mcg salbutamol base.
Excipientes: cloruro de sodio, ácido clorhídrico, agua purificada.
INDICACIONES TERAPÉUTICAS:
Indicaciones: COMBIVENT solución para nebulización en viales monodosis está indicado en el tratamiento del broncoespasmo reversible, asociado con enfermedades obstructivas de las vías respiratorias en pacientes que requieren más de un broncodilatador.
MECANISMO DE ACCIÓN:
Propiedades farmacológicas
Grupo farmacoterapéutico: Adrenérgicos en combinación con anticolinérgicos para las enfermedades de las vías aéreas obstructivas. Código ATC: R03AL02.
Mecanismo de acción y farmacodinamia: El bromuro de ipratropio es un compuesto de amonio cuaternario con propiedades anticolinérgicas (parasimpaticolíticas). En estudios preclínicos, inhibe los reflejos vagales porque antagoniza la acción de la acetilcolina, el neurotransmisor liberado por el nervio vago. Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocada por la interacción de la acetilcolina con los receptores muscarínicos del músculo liso bronquial. La liberación de Ca++ es mediada por el sistema de segundo mensajero que consiste en IP3 (inositol trifosfato) y DAG (diacilglicerol). La broncodilatación que sigue a la inhalación del bromuro de ipratropio es principalmente local y específica del pulmón; no es de naturaleza sistémica. El sulfato de salbutamol es un fármaco beta2-adrenérgico que actúa sobre el músculo liso de las vías respiratorias y causa relajación. El salbutamol relaja todos los músculos lisos desde la tráquea hasta los bronquiolos terminales y los protege contra todos los estímulos broncoconstrictores.
COMBIVENT proporciona la liberación simultánea de bromuro de ipratropio y sulfato de salbutamol, lo cual da lugar a un efecto aditivo sobre los receptores pulmonares, tanto muscarínicos como beta2-adrenérgicos, y produce una broncodilatación superior a la que se consigue con cada uno de los fármacos por separado.
Población pediátrica: COMBIVENT no ha sido estudiado en la población pediátrica.
Farmacocinética: En general, tras la inhalación, 10 a 39% de la dosis se deposita en los pulmones, lo cual depende de la formulación, la técnica y el dispositivo de inhalación, mientras que el resto de la dosis administrada se deposita en la boquilla y en la parte superior de las vías respiratorias (orofaringe). La proporción de la dosis depositada en los pulmones alcanza la circulación rápidamente (en minutos). La cantidad de principio activo depositada en la orofaringe es deglutida lentamente y pasa al tubo digestivo. Por consiguiente la exposición sistémica depende de la biodisponibilidad, tanto oral como pulmonar. La coadministración de bromuro de ipratropio y sulfato de salbutamol no potencia la absorción sistémica de ninguno de los componentes por lo cual la acción aditiva de COMBIVENT se debe al efecto local combinado sobre el pulmón, tras la inhalación.
Ipratropio
Absorción: La excreción renal acumulada (0-24 horas) de ipratropio (compuesto de origen) se aproxima al 46% tras la administración de una dosis intravenosa, es inferior al 1% tras la administración oral y es aproximadamente del 3 al 4% de una dosis inhalada. Sobre la base de estos datos se estima que la biodisponibilidad sistémica total de las dosis orales e inhaladas de bromuro de ipratropio es del 2% y del 7% al 9% respectivamente. Teniendo esto en cuenta, las porciones ingeridas de la dosis de bromuro de ipratropio no contribuyen de manera relevante a la exposición sistémica.
Distribución: Se calcularon los parámetros cinéticos que describen la disposición de ipratropio a partir de las concentraciones plasmáticas tras la administración intravenosa. Se observa una rápida declinación bifásica de las concentraciones plasmáticas. El volumen de distribución aparente en equilibrio (Vdss) es aproximadamente de 176 litros (≈ 2,4 L/kg). La unión del fármaco a las proteínas plasmáticas es mínima (menos del 20%). Los datos preclínicos indican que el ipratropio, una amina cuaternaria, no atraviesa la barrera hematoencefálica ni la placenta.
Biotransformación: La semivida de la fase de eliminación terminal es de alrededor de 1,6 horas. El ipratropio presenta una depuración total de 2,3 L/min y una depuración renal de 0,9 L/min. Tras la administración intravenosa alrededor del 60% de la dosis se metaboliza en el hígado, la mayor parte probablemente por oxidación.Eliminación: En un estudio de balance de excreción, la excreción renal acumulada (6 días) de la radioactividad relacionada con el fármaco (como compuesto de origen y todos los metabolitos) representó el 72,1% tras la administración intravenosa, el 9,3% tras la administración oral y el 3,2% tras la inhalación. La radioactividad total excretada en las heces fue del 6,3% tras la aplicación intravenosa, del 88,5% luego de la administración oral y del 69,4% después de la inhalación. Con respecto a la excreción de la radioactividad relacionada con el fármaco tras la administración intravenosa, la principal vía de excreción fue la renal. La semivida de eliminación de la radioactividad relacionada con el fármaco (compuesto de origen y metabolitos) es de 3,6 horas. Los principales metabolitos urinarios se unen poco al receptor muscarínico y deben ser considerados inactivos.
Salbutamol
Absorción y distribución: El salbutamol se absorbe rápida y completamente tras la administración oral, ya sea por vía inhalatoria o gástrica, y su biodisponibilidad oral es de alrededor del 50%. La concentración plasmática media máxima de salbutamol de 492 pg/mL se alcanza después de 3 horas de la inhalación de COMBIVENT. Se calcularon los parámetros cinéticos a partir de las concentraciones plasmáticas tras la administración intravenosa. El volumen de distribución aparente (Vz) es de aproximadamente 156 litros (≈ 2,5 L/kg). Sólo el 8% del fármaco se une a las proteínas plasmáticas. En estudios preclínicos, aproximadamente 5% de las concentraciones plasmáticas del salbutamol se encuentran en el cerebro. Sin embargo, esta cantidad probablemente representa la distribución de la sustancia en el agua extracelular del cerebro.
Biotransformación y eliminación: Después de esta inhalación única, se estima que alrededor del 27% de la dosis suministrada por la boquilla se excreta sin modificación en la orina de 24 horas. La semivida terminal media es de alrededor de 4 horas, la depuración total media es de 480 mL/min y la depuración renal media, de 291 mL/min.
El salbutamol es metabolizado por conjugación a 4"-O-sulfato. El R(-)-enantiómero del salbutamol (levosalbutamol) es metabolizado preferentemente y en consecuencia es eliminado del organismo en forma más rápida que el S(+)-enantiómero. Tras la administración intravenosa la excreción urinaria fue completa después de aproximadamente 24 horas. La mayor parte de la dosis se excretó como compuesto de origen (64,2%) y el 12,0% se excretó como sulfato conjugado. Después de la administración oral, la excreción urinaria del fármaco inalterado y del sulfato conjugado fue del 31,8% y el 48,2% de la dosis, respectivamente.
CONTRAINDICACIONES:
COMBIVENT está contraindicado en:
- Pacientes con miocardiopatía hipertrófica obstructiva o taquiarritmia.
- Pacientes con hipersensibilidad conocida a la atropina o a sus derivados, o a cualquier otro componente del producto.
REACCIONES ADVERSAS:
Muchas de las reacciones adversas listadas se pueden atribuir a las propiedades anticolinérgicas y simpaticomiméticas beta2-adrenérgicas de COMBIVENT. Como sucede con todos los tratamientos inhalatorios, COMBIVENT puede producir síntomas de irritación local. Las reacciones adversas al medicamento se identificaron a partir de datos obtenidos en ensayos clínicos y de farmacovigilancia durante el uso posterior a la aprobación del fármaco. Los efectos secundarios observados con mayor frecuencia en los ensayos clínicos fueron dolor de cabeza, irritación de garganta, tos, sequedad bucal, trastornos de la motilidad gastrointestinal (incluye estreñimiento, diarrea y vómitos), náuseas y mareos.
|
Trastornos del sistema inmune: |
|
Reacción anafiláctica |
|
Hipersensibilidad |
|
Trastornos del metabolismo y la nutrición: |
|
Hipopotasemia |
|
Trastornos psiquiátricos: |
|
Nerviosismo |
|
Trastorno mental |
|
Trastornos del sistema nervioso: |
|
Dolor de cabeza |
|
Temblor |
|
Mareos |
|
Trastornos oculares: |
|
Trastornos de la acomodación |
|
Edema corneal |
|
Glaucoma |
|
Aumento de la presión intraocular |
|
Midriasis |
|
Visión borrosa |
|
Dolor ocular |
|
Hiperemia conjuntival |
|
Visión de halos |
|
Trastornos cardíacos: |
|
Palpitaciones |
|
Taquicardia |
|
Arritmia |
|
Fibrilación auricular |
|
Taquicardia supraventricular |
|
Isquemia miocárdica |
|
Trastornos respiratorios, torácicos y mediastínicos: |
|
Tos |
|
Disfonía |
|
Sequedad de garganta |
|
Broncoespasmo |
|
Broncoespasmo paradójico |
|
Laringoespasmo |
|
Edema faríngeo |
|
Trastornos gastrointestinales: |
|
Sequedad bucal |
|
Náuseas |
|
Irritación de la garganta |
|
Diarrea |
|
Vómitos |
|
Estreñimiento |
|
Trastornos de la motilidad gastrointestinal |
|
Edema bucal |
|
Estomatitis |
|
Trastornos de la piel y del tejido subcutáneo: |
|
Reacciones cutáneas como |
|
- Erupción |
|
- Prurito |
|
- Urticaria |
|
Angioedema |
|
Hiperhidrosis |
|
Trastornos musculoesqueléticos y del tejido conjuntivo: |
|
Espasmos musculares |
|
Debilidad muscular |
|
Mialgia |
|
Trastornos renales y urinarios: |
|
Retención urinaria |
|
Trastornos generales y en el sitio de la administración: |
|
Astenia |
|
Exploraciones complementarias: |
|
Disminución de la presión arterial diastólica |
|
Aumento de la presión arterial sistólica |
Efectos sobre la capacidad de conducir vehículos u operar maquinarias: No se han estudiado los efectos sobre la capacidad de conducir vehículos u operar maquinarias. Sin embargo, se debe informar a los pacientes que pueden experimentar efectos adversos como mareos, alteraciones de la acomodación, midriasis y visión borrosa durante el tratamiento con COMBIVENT. Por lo tanto, se debe recomendar precaución al conducir vehículos u operar maquinarias. Si los pacientes experimentan los efectos adversos mencionados antes, deben evitar la realización de tareas potencialmente riesgosas como conducir vehículos u operar maquinarias.Toxicología: Se examinó la toxicidad aguda de COMBIVENT después de administrar una única inhalación a ratas y perros. Hasta la dosis más elevada técnicamente posible (rata: 887/5397 mcg/kg de bromuro de ipratropio/salbutamol, perro: 164/861 mcg/kg de bromuro de ipratropio/salbutamol) no hubo indicios de toxicidad sistémica; la combinación fue bien tolerada localmente. Tras la administración intravenosa se calculó una DL50 aproximada para cada fármaco individual de 12 a 20 mg/kg para el bromuro de ipratropio y de 60 a 73 mg/kg para el sulfato de salbutamol que dependió de las especies examinadas (ratón, rata, perro).
Se realizaron dos estudios de toxicidad de 13 semanas por vía inhalatoria en ratas y perros con la combinación de bromuro de ipratropio y sulfato de salbutamol. En estos estudios, el corazón resultó ser el órgano blanco. En la rata se observó aumento del peso cardíaco, independiente de la dosis, cuando se utilizaron 34/197 a 354,5/2604 mcg/kg/día de bromuro de ipratropio/sulfato de salbutamol, si bien esto no tuvo un correlato histopatológico. En el perro, con dosis de 32/198 a 129/790 mcg/kg/día de bromuro de ipratropio/sulfato de salbutamol se observó un ligero aumento de la frecuencia cardíaca y, con dosis más altas, escaras o fibrosis detectables mediante el examen histopatológico del músculo papilar del ventrículo izquierdo, a veces acompañadas de mineralización. Los hallazgos cardiovasculares obtenidos en los estudios mencionados antes deben considerarse como efectos bien conocidos de los beta-adrenérgicos como el salbutamol. El perfil toxicológico del bromuro de ipratropio también se conoce desde hace muchos años y está caracterizado por los típicos efectos anticolinérgicos como la sequedad de las membranas mucosas de la cabeza, midriasis, queratoconjuntivitis seca (sequedad ocular) sólo en perros, la reducción del tono y la inhibición de la motilidad del tubo digestivo (rata). Se dispone de estudios de toxicidad reproductiva para los dos componentes individuales de COMBIVENT. El sulfato de salbutamol causa fisura palatina en el ratón cuando se administran altas dosis por vía subcutánea, esto comienza a observarse con dosis dentro del rango de la Dosis Máxima Diaria Recomendada en Humanos (DMDRH) por vía inhalatoria (sobre la base de la relación mg/m2). Sin embargo este fenómeno es bien conocido y se produce también después de la administración de otros compuestos beta-adrenérgicos. Actualmente se considera que este efecto se debe al aumento del nivel materno de corticosterona y puede considerarse como el resultado del estrés generalizado, sin relevancia para otras especies. Además de estos hallazgos, los estudios realizados con sulfato de salbutamol y bromuro de ipratropio solo mostraron efectos marginales, en caso de haberlos, sobre los embriones, los fetos y las crías, y esto únicamente dentro del rango de la toxicidad materna. El bromuro de ipratropio no afectó la fertilidad de las ratas macho ni hembra en dosis orales de hasta 50 mg/kg (aproximadamente 3400 veces la DMDRH sobre la base de la relación mg/m2). Los estudios de reproducción en ratas con salbutamol no revelaron indicios de deterioro de la fertilidad.
Ambos fármacos fueron examinados individualmente en numerosas pruebas de genotoxicidad in vivo e in vitro. Ni el sulfato de salbutamol ni el bromuro de ipratropio mostraron indicio alguno de mutagenia. Además COMBIVENT no presentó actividad genotóxica en las pruebas in vitro.
Se investigaron las propiedades cancerígenas del sulfato de salbutamol y el bromuro de ipratropio por separado en varios estudios sobre carcinogenia. Después de la administración oral de sulfato de salbutamol se observó en la rata, aunque no en ratones, hámsters y perros, una mayor incidencia de leiomiomas mesováricos con dosis alrededor de ≥20 veces mayores que la DMDRH por vía inhalatoria. Se observó que la aparición de leiomiomas es evitable mediante la administración simultánea de betabloqueantes. Se observó que estos hallazgos son específicos de la especie y por consiguiente carecen de relevancia clínica, por lo que no conducen a restricción alguna para el uso clínico del sulfato de salbutamol. El bromuro de ipratropio no mostró potencial carcinogénico cuando se lo examinó por vía oral en ratones y ratas. No se halló evidencia de efecto inmunotoxicológico alguno causado por COMBIVENT o por alguno de sus principios activos individuales.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interferencia con resultados de laboratorio u otras pruebas diagnósticas: El uso de COMBIVENT puede dar lugar a resultados positivos debido al salbutamol en las pruebas para detector abuso de sustancias de uso no clínico, por ejemplo, en el contexto de la mejora del rendimiento deportivo (dopaje).
Interacciones: La administración concomitante crónica de COMBIVENT con otros fármacos anticolinérgicos no ha sido estudiada; por lo tanto, no se recomienda la administración concomitante crónica de COMBIVENT con otros anticolinérgicos.
La administración concomitante de derivados de las xantinas, además de otros beta-adrenérgicos y anticolinérgicos puede aumentar los efectos secundarios.La hipopotasemia inducida por los agonistas beta2 puede aumentar por la administración concomitante de derivados de las xantinas, glucocorticoides y diuréticos. Esto debe ser tomado en cuenta particularmente en pacientes con obstrucción grave de las vías aéreas. La hipopotasemia puede dar lugar a un aumento de la sensibilidad a las arritmias en pacientes tratados con digoxina. En tales situaciones, se recomienda monitorear las concentraciones séricas de potasio. La administración concomitante de betabloqueantes puede producir una reducción potencialmente seria de la broncodilatación.Los agonistas beta2 deben ser administrados con precaución a pacientes tratados con inhibidores de la monoaminoxidasa o con antidepresivos tricíclicos, dado que la acción de estos puede potenciar la acción de los agonistas beta2. La inhalación de hidrocarburos halogenados anestésicos como halotano, tricloroetileno y enflurano, puede aumentar la sensibilidad a los efectos cardiovasculares de los agonistas beta.
INFORMACIÓN COMPLEMENTARIA:
Fabricado por: Laboratorie Unither, Amiens, Francia.
Bajo licencia de: Boehringer Ingelheim International GmbH, Ingelheim am Rhein, Alemania.
Importado y distribuido por: Ecuador: Boehringer Ingelheim del Ecuador Cía. Ltda., Quito, Ecuador. Colombia: Boehringer Ingelheim S.A., Bogotá D.C., Colombia.
Versión 05.
Mayor información disponible a
solicitud del cuerpo médico.
Boehringer-Ingelheim
del Ecuador Cía. Ltda.
Quito
Av. Shyris N-344 y Av. Eloy Alfaro.
Edificio Parque Central, Piso 15
Teléfono: 593 2 3979900
RECOMENDACIONES:
Advertencias y precauciones especiales
Hipersensibilidad: Pueden producirse reacciones de hipersensibilidad inmediata después de la administración de COMBIVENT, como lo demuestran raros casos de urticaria, angioedema, erupción, broncoespasmo y edema orofaríngeo.
Broncoespasmo paradójico: Al igual que con otros medicamentos inhalables, existe la posibilidad de que COMBIVENT provoque un espasmo paradójico, cuadro potencialmente fatal. En caso de producirse un espasmo paradójico, debe suspenderse de inmediato el uso de COMBIVENT y debe utilizarse otra terapia en su reemplazo.Complicaciones oculares: Se han comunicado casos aislados sobre complicaciones oculares (es decir, midriasis, aumento de la presión intraocular, glaucoma de ángulo estrecho, dolor ocular) cuando el bromuro de ipratropio aerosolizado, ya sea solo o en combinación con un agonista beta2-adrenérgico, entra en contacto accidentalmente con los ojos. El dolor o malestar ocular, visión borrosa, visión de halos o halos coloreados alrededor de las luces asociados con enrojecimiento ocular por congestión conjuntival y edema corneal, pueden ser signos de glaucoma agudo de ángulo estrecho. En caso de que aparezcan estos síntomas en cualquier combinación, debe iniciarse el tratamiento con gotas mióticas y consultar al especialista de inmediato.
Los pacientes deben recibir información sobre la correcta administración de COMBIVENT. Se debe evitar que la solución o el medicamento aerosolizado entre en los ojos. Los pacientes que puedan tener predisposición al glaucoma deben ser advertidos específicamente para que protejan sus ojos.
Se recomienda administrar COMBIVENT solución para nebulización en viales monodosis a través de una boquilla. Si no se dispone de una boquilla y se usa una máscara para nebulizar, ésta debe ajustarse en forma adecuada. Efectos sistémicos: En las siguientes afecciones COMBIVENT debe usarse solo después de haber ponderado cuidadosamente la relación entre riesgos y beneficios, en especial cuando se usan dosis más altas que las recomendadas: diabetes mellitus insuficientemente controlada, infarto de miocardio reciente, trastornos orgánicos vasculares o cardíacos graves, hipertiroidismo, feocromocitoma, riesgo de glaucoma de ángulo estrecho, hipertrofia prostática u obstrucción del cuello vesical.Efectos cardiovasculares: Se pueden observar efectos cardiovasculares con los fármacos simpaticomiméticos, incluido COMBIVENT.
Existen evidencias a partir de datos obtenidos post-comercialización y de publicaciones bibliográficas sobre raros casos de isquemia miocárdica asociada al salbutamol. A los pacientes con cardiopatía subyacente grave (por ejemplo, cardiopatía isquémica, arritmia o insuficiencia cardíaca grave) tratados con salbutamol debido a su enfermedad respiratoria, se les debe advertir que consulten al médico si experimentan dolor en el pecho u otros síntomas de empeoramiento de la cardiopatía. Se debe prestar atención a los síntomas como disnea y dolor en el pecho, dado que su origen puede ser tanto respiratorio como cardíaco.
Hipopotasemia: El tratamiento con agonistas beta2 puede dar lugar a una hipopotasemia potencialmente seria. Además, la hipoxia puede agravar los efectos de la hipopotasemia sobre el ritmo cardíaco. En tales situaciones, se recomienda monitorear las concentraciones séricas de potasio.
Alteraciones de la motilidad gastrointestinal: Los pacientes con fibrosis quística pueden ser más propensos a sufrir trastornos de la motilidad gastrointestinal. Disnea: En caso de disnea aguda, que empeora rápidamente, se debe indicar a los pacientes que consulten a un médico en forma inmediata.
Fertilidad, embarazo y lactancia
Embarazo: No se ha establecido la seguridad de COMBIVENT durante el embarazo humano. Debe tomarse en cuenta el efecto inhibitorio de COMBIVENT sobre las contracciones uterinas. Los beneficios de la administración de COMBIVENT durante el embarazo confirmado o presunto, deben valorarse con respecto a los posibles riesgos para el feto. Deben tomarse las precauciones habituales con respecto al uso de fármacos durante el embarazo, especialmente durante el primer trimestre.Con relación al bromuro de ipratropio, los estudios preclínicos no han mostrado efectos embriotóxicos, ni teratogénicos después de la inhalación o de la aplicación intranasal de dosis considerablemente superiores a las recomendadas para el hombre. Con respecto al sulfato de salbutamol, los estudios preclínicos no inhalatorios mostraron ausencia de efectos perjudiciales directos o indirectos, salvo en los casos en que se excedió la Dosis Máxima Diaria Recomendada en Humanos (DMDRH) (véase la sección Toxicología).
Lactancia: Se desconoce si el bromuro de ipratropio y el sulfato de salbutamol se excretan en la leche materna. Se considera improbable que el bromuro de ipratropio llegue al lactante en cantidades importantes, especialmente cuando se administra por inhalación. Sin embargo, se debe tener precaución cuando se administre COMBIVENT a madres lactantes.
Fertilidad: No se han estudiado los efectos de COMBIVENT sobre la fertilidad humana. No se dispone de datos clínicos sobre la fertilidad para la combinación de bromuro de ipratropio y sulfato de salbutamol ni para ninguno de los componentes individuales de la combinación.Los estudios preclínicos realizados con bromuro de ipratropio y salbutamol no mostraron efectos adversos sobre la fertilidad (véase la sección Toxicología).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis y administración: Debido a que no existe suficiente información sobre el tratamiento con COMBIVENT en los niños, su uso no está indicado en pacientes pediátricos.COMBIVENT no ha sido estudiado en pacientes con insuficiencia hepática o renal. Debe utilizarse con precaución en esas poblaciones de pacientes. Se debe advertir a los pacientes que en caso de presentar disnea aguda o que empeora rápidamente si las inhalaciones adicionales de COMBIVENT no son suficientes para producir una mejoría adecuada que consulten al médico o concurran al hospital más cercano inmediatamente.
En caso de requerirse dosis de COMBIVENT más altas que las recomendadas para controlar los síntomas, se deberá revisar el plan terapéutico del paciente.
En asma, se debe considerar el tratamiento antiinflamatorio concomitante.
Se recomiendan las siguientes dosis de COMBIVENT en adultos (incluidos los pacientes de edad avanzada): COMBIVENT solución para nebulización en viales monodosis: COMBIVENT solución para nebulización en viales monodosis se puede administrar con un nebulizador adecuado o mediante ventilación positiva intermitente. El tratamiento debe iniciarse y administrarse bajo supervisión médica, por ejemplo, en el ámbito hospitalario. Puede recomendarse la modalidad de tratamiento en el hogar en casos excepcionales (síntomas severos o en pacientes experimentados que requieren dosis más altas) en aquellos casos en los que una dosis baja de un broncodilatador beta-agonista de acción rápida haya sido insuficiente para brindar alivio tras la consulta con un médico especialista.El tratamiento con la solución para nebulización en viales monodosis siempre debe iniciarse con la dosis recomendada más baja (1 vial monodosis). En casos muy severos pueden requerirse dos viales monodosis para el alivio de los síntomas. Debe suspenderse la administración una vez logrado un alivio suficiente de los síntomas. Tratamiento de episodios agudos: Generalmente 1 vial monodosis es suficiente para el rápido alivio de los síntomas. En los casos severos, cuando la crisis no ha sido resuelta por la administración de un vial monodosis, es posible que se requiera la administración de un segundo vial. En estos casos, se recomienda a los pacientes consultar al médico o concurrir al hospital más cercano, inmediatamente.
Tratamiento de mantenimiento: 1 vial monodosis, tres a cuatro veces por día.
Instrucciones de uso: Los viales monodosis están destinados solo a la inhalación con nebulizadores adecuados y no deben ser administrados por vía oral ni parenteral. El contenido de los viales monodosis no necesita ser diluido para la nebulización.
1. Prepare el nebulizador para el llenado, de acuerdo con las instrucciones proporcionadas por el fabricante o el médico.
2. Abra la bolsa de aluminio y desprenda un vial monodosis de la tira.
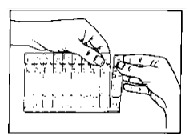
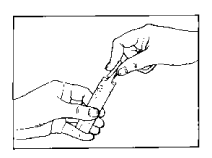
3. Abra el vial monodosis torciendo con firmeza la parte superior.
4. Exprima el contenido del vial monodosis dentro del depósito del nebulizador.
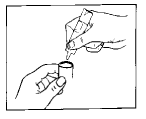
5. Arme el nebulizador y úselo como se indica.
6. Después de usarlo, deseche toda la solución que quede en el depósito y limpie el nebulizador siguiendo las instrucciones del fabricante.
Dado que los viales monodosis no contienen conservantes, es importante que el contenido se use pronto después de abrirlo y que se utilice un vial nuevo para cada administración a fin de evitar la contaminación microbiana. Los viales usados parcialmente, abiertos o dañados, deben desecharse.
No mezclar COMBIVENT solución para nebulización con otros fármacos en el mismo nebulizador.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis
Síntomas: Se espera que los efectos de la sobredosificación estén relacionados sobre todo con el salbutamol. Los síntomas previsibles de sobredosificación son los provocados por la estimulación beta-adrenérgica excesiva, entre los cuales los más prominentes son taquicardia, palpitaciones, temblor, hipertensión, hipotensión, hipopotasemia, aumento de la presión arterial diferencial, dolor anginoso, arritmias y sofocos. Se ha observado acidosis metabólica en la sobredosis con salbutamol. Los síntomas previsibles de sobredosificación con bromuro de ipratropio (como sequedad bucal, trastornos de la acomodación visual) son de naturaleza leve y transitoria, debido al amplio margen terapéutico y a la administración tópica.
Tratamiento: Debe interrumpirse el tratamiento con COMBIVENT. Debe considerarse el monitoreo de los valores de electrolitos y del equilibrio ácido-base. Administración de sedantes, tranquilizantes y en casos graves internación en sala de cuidados intensivos. Los betabloqueantes, de preferencia los bloqueadores selectivos de los receptores beta1, son adecuados como antídotos específicos; sin embargo, se debe tomar en cuenta el posible aumento de la obstrucción bronquial y deberá ajustarse la dosis con cuidado en los pacientes con asma bronquial.
PRESENTACIÓN:
COMBIVENT solución para nebulización en viales monodosis. Registro Sanitario: 29859-06-11.
LEYENDAS DE PROTECCIÓN:
Consérvese a una temperatura no mayor a 30ºC. Manténgase fuera del alcance de los niños.
Venta bajo receta médica.