
CARDIOXANE
DEXRAZOXANO
Ampollas
Caja , 1 Frasco ampolla
COMPOSICIÓN:
Fórmula cualicuantitativa: Cada frasco AMPOLLA, contiene: Dexrazoxane 500 mg.
Venta bajo receta archivada.
INDICACIONES TERAPÉUTICAS:
Indicaciones y uso: CARDIOXANE está indicado para reducir la incidencia y severidad de la cardiomiopatia asociada con la administración de Doxorubicina en mujeres con cáncer de mama con metástasis que han recibido una dosis acumulativa de Doxorubicina de 300 mg/m2 y que continuarán recibiendo terapia de Doxorubicina para mantener el control del tumor. No es recomendado para uso con el inicio de la terapia con Doxorubicina (Ver ADVERTENCIAS).
Acción terapéutica: Agente detoxificante para el tratamiento con Doxorubicina.
MECANISMO DE ACCIÓN:
El mecanismo por el cual CARDIOXANE ejerce su actividad cardioprotectora no es comprendido por completo. Dexrazoxane es un derivado de EDTA que penetra fácilmente las membranas celulares. Resultados de laboratorio sugieren que Dexrazoxane es convertido –intracelularmente– en un agente quelante de anillo abierto que interfiere con la generación de radicales libres mediados por hierro que se cree son responsables, en parte, de la cardiomiopatía inducida por antraciclinas.
FARMACOCINÉTICA:
La farmacocinética de Dexrazoxane ha sido estudiada en pacientes con cáncer avanzado con función renal y hepática normal. Por lo general la farmacocinética de Dexrazoxane ha sido adecuadamente descripta como un modelo abierto de 2 compartimientos, con eliminación de primer orden. Dexrazoxane ha sido administrado como una perfusión IV de 15 minutos en un rango de dosis de 60 a 900 mg/m2 con 60 mg/m2 de Doxorubicina, y una dosis fija de 500 mg/m2 con 50 mg/m2 de Doxorubicina. La cinética de disposición de Dexrazoxane es independiente de la dosis, como se presenta por la relación lineal entre el área bajo las curvas de concentración-tiempo en plasma y dosis administradas que oscilan entre 60 a 900 mg/m2. La concentración media pico de Dexrazoxane fue de 36.5 μg/mL al final de la perfusión IV de 15 minutos de una dosis de 500 mg/m2 de Doxorubicina. Los importantes parámetros farmacocinéticos de Dexrazoxane están resumidos a continuación:
|
RESUMEN DE PARÁMETROS FARMACOCINÉTICOS DE DEXRAZOXANE MEDIO (% CVa) EN UNA PROPORCIÓN DE DOSIS DE 10:1 DE CARDIOXANE; Doxorubicina |
||||||
|
Dosis Doxorubicina (mg/m2) |
Dosis Cardioxane |
Nro. de Sujetos |
Vida Media de eliminación (h) |
Excreción en plasma (L/h/m2) |
Excreción renal |
b Volumen de distribución (L/m2) |
|
50 |
500 |
10 |
2.5 (16) |
7.88 (18) |
3.35 (36) |
22.4 (22) |
|
60 |
600 |
5 |
2.1 (29) |
6.25 (31) |
--- |
22.0 (55) |
|
a.- Coeficiente de variación |
||||||
|
b.- Volumen de distribución en estado constante |
||||||
Después de una rápida fase distributiva (≈ 0.2 a 0.3 horas, Dexrazoxane alcanza un equilibrio dentro de dos a cuatro horas). El volumen de distribución en estado constante estimado de Dexrazoxane sugiere su distribución primariamente en el agua corporal total (25 L / m2). La excreción sistémica media y el volumen de distribución de estado constante de Dexrazoxane en dos pacientes femeninas asiáticas con 500 mg/m2 Dexrazoxane conjuntamente con 50 mg/m2 Doxorubicina fueron 15.15 l/H/M2 Y 36.27 l/Um2. respectivamente, pero su vida media de eliminación y excreción renal de Dexrazoxane fueron similares a aquellas de 10 pacientes caucásicos del mismo estudio. Los estudios de metabolismo cualitativo con CARDIOXANE han confirmado la presencia de droga inalterada, un producto de escisión diácido-diamida y dos productos de anillo monoácido-monoamida en orina de animales y del hombre. Los niveles de metabolito no fueron medidos en los estudios farmacocinéticos. La excreción urinaria desempeña un papel importante en la eliminación de Dexrazoxane. El 42% de los 500 mg/m2 dosis de CARDIOXANE fue excretada en orina.
Combinación proteica: Los estudios in vitro han demostrado que CARDIOXANE no está combinado con las proteínas plasmáticas.
Poblaciones especiales
Pediátrica
No se ha evaluado la farmacocinética de CARDIOXANE en pacientes pediátricos.
Género
El análisis de información reunida de dos estudios farmacéuticos indica que los pacientes masculinos presentan un menor valor medio de excreción que las pacientes femeninas (110 mL/min/m2) versus 133 mL/min/m2). Este efecto por sexo no es clínicamente relevante.
Insuficiencia renal
La farmacocinética de CARDIOXANE no ha sido evaluada en pacientes con insuficiencia renal.
Insuficiencia hepática
La farmacocinética de CARDIOXANE no ha sido evaluada en pacientes con insuficiencia hepática. La dosis de CARDIOXANE depende de la dosis de Doxorubicina. Desde que se recomienda la reducción de dosis de Doxorubicina en presencia de hiperbilirubinemia, la dosis de CARDIOXANE es reducida proporcionalmente en pacientes con deterioro hepático.
CONTRAINDICACIONES:
CARDIOXANE NO DEBE SER USADO CON REGÍMENES DE QUIMIOTERAPIA QUE NO CONTIENEN UNA ANTRACICLINA.
CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y TRASTORNOS DE LA FERTILIDAD:
(Ver sección de ADVERTENCIAS para información sobre carcinogenicidad humana).
No se han realizado estudios de carcinogenicidad a largo plazo con Dexrazoxane en animales. Dexrazoxane no fue mutagénico en la prueba Ames, pero se vió que es clastogénico en linfocitos humanos in vitro y en eritrocitos de médula ósea de ratón in vivo (test de micronúcleo). Los posibles efectos adversos de CARDIOXANE sobre la fertilidad de los humanos y animales experimentales, machos o hembras, no han sido estudiados adecuadamente. Se observó atrofia testicular con la administración de Dexrazoxane en dosis tan bajas como 30 mg/kg por semana, durante 6 semanas en ratas (1/3 de la dosis humana sobre una base de mg/m2) y tan baja como 20 mg/kg semanal durante 13 semanas en perros (aproximadamente igual a la dosis humana sobre una base de mg/m2).
Embarazo Categoría C
Dexrazoxane fue tóxico para la madre en dosis de 2 mg/kg (1/40 la dosis humana sobre una base de mg/m2) y embriotóxica y teratogénica a 8 mg/kg (aprox. 1/10) la dosis humana sobre una base de mg/m2) en administración diaria a ratas preñadas durante el período de organogénesis. Los efectos teratogénicos en la rata incluyeron ano no perforado, microftalmia y anoftalmia. En las crías que se desarrollaron hasta la madurez, la fertilidad fue afectada en ratas macho y hembras tratadas in útero durante la organogénesis a 8 mg/kg. En conejos, dosis de 5 mg/kg (aproximadamente 1/10 la dosis humana sobre una base de mg/m2), a diario durante el período de organogénesis fueron materno-tóxicos y dosis de 20 mg/kg (mitad de la dosis humana sobre una base de mg/m2) fueron embrio-tóxicos y teratogénicos. Los efectos teratogénicos en el conejo incluyeron varias malformaciones del esqueleto tales como una cola corta, malformaciones de costillas y del tórax, y variaciones de tejido blando incluyendo áreas hemorrágicas subcutáneas, oculares y cardíacas, así como agénesis de la vesícula biliar y del lóbulo intermedio del pulmón. No hay estudios adecuados y bien controlados en mujeres embarazadas. CARDIOXANE debe ser usado durante el embarazo solamente si el beneficio potencial justifica el riesgo para el feto.
Madres Lactantes
Se desconoce si Dexrazoxane es excretado en la leche humana. Debido a que muchas drogas son excretadas en la leche humana y debido al potencial de serias reacciones adversas en niños a leche materna expuestos a Dexrazo-xane, se les debe aconsejar a las madres a discontinuar la lactancia durante la terapia con Dexrazoxane.
Uso pediátrico: No se ha establecido la seguridad y efectividad de Dexrazoxane en pacientes pediátricos. Uso geriátrico: Estudios clínicos de CARDIOXANE no incluyeron números suficientes de sujetos de 65 y más años de edad para determinar si ellos responden en forma diferente de los sujetos más jóvenes. Otras experiencias clínicas informadas no han identificado diferencias entre las respuestas entre pacientes de edad avanzada y más jóvenes. Por lo general, los pacientes mayores deben ser tratados con cautela debido a la mayor frecuencia de función disminuída del hígado, riñón o corazón, y una enfermedad concomitante u otra terapia con droga.
REACCIONES ADVERSAS:
Cacardioxane en dosis de 500 mg/m2 ha sido administrado en combinación con fac en estudios aleatorios, controlados a placebo, doble-ciego a pacientes con cáncer mamario metastático. La dosis de doxorubicina fue de 50 mg/m2 en cada uno de los ensayos. Los cursos fueron repetidos cada 3 semanas, siempre que haya habido recuperación de la toxicidad. El cuadro 2 enuncia la incidencia de experiencias adversas para pacientes que recibieron fac ya fuera con CARDIOXANE o placebo en los estudios de cáncer de mama. Experiencias adversas que ocurrieron durante los cursos 1 a 6 son presentadas para pacientes que recibieron CARDIOXANE o placebo, con fac comenzando con su primer curso de terapia respectivamente. Experiencias adversas que ocurrieron en el curso 7 y más allá para pacientes que recibieron placebo con fac durante los primeros seis cursos y los que recibieron después CARDIOXANE o placebo con fac también son presentadas.
|
Experiencia adversa |
Porcentaje (%) de pacientes con cáncer de mama con experiencia adversa |
|||
|
FAC + CARDIOXANE |
FAC + PLACEBO |
|||
|
Cursos 1-6 N = 413 |
Cursos > 7 N = 102 |
Cursos 1-6 N = 458 |
Cursos > 7 N = 99 |
|
|
Alopecia |
94 |
100 |
97 |
98 |
|
Náuseas |
77 |
51 |
84 |
60 |
|
Vómitos |
59 |
42 |
72 |
49 |
|
Fatiga / malestar |
61 |
48 |
58 |
55 |
|
Anorexia |
42 |
27 |
47 |
38 |
|
Estomatitis |
34 |
26 |
41 |
28 |
|
Fiebre |
34 |
22 |
29 |
18 |
|
Infección |
23 |
19 |
18 |
21 |
|
Diarrea |
21 |
14 |
24 |
7 |
|
Dolor por inyección |
12 |
13 |
3 |
0 |
|
Sepsis |
17 |
12 |
14 |
9 |
|
Neurotoxicidad |
17 |
10 |
13 |
5 |
|
Rayado / eritema |
5 |
4 |
4 |
2 |
|
Flebitis |
6 |
3 |
3 |
5 |
|
Esofagitis |
6 |
3 |
7 |
4 |
|
Disfagia |
8 |
0 |
10 |
5 |
|
Hemorragia |
2 |
3 |
2 |
1 |
|
Extravasación |
1 |
3 |
1 |
2 |
|
Urticaria |
2 |
2 |
2 |
0 |
|
Anulación de reacción de piel |
1 |
1 |
2 |
0 |
Las reacciones adversas enumeradas arriba son probablemente atribuibles al régimen FAC con excepción de dolor por inyección que fue vista principalmente en el grupo CARDIOXANE.
Mielosupresión: Los pacientes que recibieron FAC con CARDIOXANE experimentaron leucopenia, granulocitopenia y trombocitopenia más severas en el punto más bajo que los pacientes que recibieron FAC sin CARDIOXANE, pero los recuentos de recuperación fueron similares para los dos grupos de pacientes.
Hepática y renal: algunos pacientes que reciben FAC + CARDIOXANE o FAC + PLACEBO experimentaron marcadas anormalidades en las pruebas funcionales hepáticas o renales, pero la frecuencia y severidad de las anormalidades en bilirrubina, fosfatasa alcalina, BUN y creatinina fueron similares en pacientes que recibieron FAC con CARDIOXANE o sin él.
INTERACCIONES:
CARDIOXANE no influye sobre la farmacocinética de la Doxorubicina.
INTERACCIONES DE DROGAS:
No hubo un cambio significativo de la farmacocinética de Doxorubicina (50 mg/m2) y su metabolito predominante, doxorubicinol, en presencia de Dexrazoxane (500 mg/m2) en un estudio cruzado en pacientes con cáncer.
ADVERTENCIAS:
CARDIOXANE puede agregarse a la mielosupresión causada por agentes quimioterapéuticos.
Existe cierta evidencia que el uso de Dexrazoxane en forma concurrente con el inicio de la terapia con fluorouracilo, Doxorubicina y ciclofosfamida (FAC) interfiere con la eficacia antitumoral del régimen; por lo que su uso no es recomendado. En el más importante de tres ensayos de cáncer de mama, las pacientes que recibieron Dexrazoxane comenzando con su primer ciclo de terapia FAC presentaron una proporción de respuesta más baja (48% vs. 63%; p = 0.007) y menor tiempo de progresión que las pacientes que no recibieron Dexrazoxane. Por ello CARDIOXANE sólo debe ser usado en aquellas pacientes que hayan recibido una dosis cumulativa de Doxorubicina de 300 mg/m2 y están continuando con la terapia de Doxorubicina.
Si bien los estudios clínicos han demostrado que los pacientes que reciben FAC con CARDIOXANE pueden recibir una dosis acumulativa más alta de Doxorubicina antes de experimentar toxicidad cardíaca que los pacientes que reciben FAC sin CARDIOXANE, el uso de CARDIOXANE en pacientes que ya han recibido una dosis acumulativa de Doxorubicina de 300 mg/m2 sin CARDIOXANE, no elimina el potencial de toxicidad cardíaca inducida por Antraciclina. Por lo tanto la función cardíaca debe ser controlada cuidadosamente.
Las neoplasias secundarias (primariamente leucemia mieloide aguda) han sido informadas en pacientes tratados crónicamente con Dexrazoxane oral. Dexrazoxa-ne es la mezcla racémica, de la que Dexrazoxane es el enantiómero S (+).
En estos pacientes la dosis total cumulativa de Dexrazoxane osciló desde 26 a 480 gramos y la duración del tratamiento era de 42 a 319 semanas. Un caso de linfoma de célula T, un caso de linfoma de célula B y seis a 8 casos de célula basal cutánea o carcinoma de célula escamosa también han sido informados en pacientes tratadas con Dexrazoxane.
PRECAUCIONES:
General
Doxorubicina no debe ser administrada en forma previa a la inyección intravenosa de CARDIOXANE.
CARDIOXANE debe ser administrado por perfusión lenta IV o rápida por goteo a partir de una bolsa de perfusión IV. Doxorubicina debe ser administrada en el plazo de 30 minutos desde el inicio de la perfusión IV con CARDIOXANE.
Dado que CARDIOXANE será usado siempre con drogas citotóxicas, las pacientes deben ser controladas estrechamente. Si bien los efectos mielosupresivos de CARDIOXANE con la dosis recomendada son leves, pueden ocurrir efectos aditivos sobre la actividad mielo-supresora de agentes quimioterapéuticos.
Pacientes con insuficiencia renal moderada o severa Mayor exposición de Dexrazoxane puede ocurrir en pacientes con función renal comprometida. La dosis de CARDIOXANE debe ser reducida en un 50% en pacientes con valores de excreción de creatinina < 40 mL/min. Pruebas de laboratorio
Como CARDIOXANE puede agregarse a los efectos mielosupresores de drogas citotóxicas, se recomiendan frecuentes recuentos completos de sangre.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis y administración: La proporción de dosaje recomendada de CARDIOXANE: Doxorubicina es de 10: 1 (a saber, 500 mg/m2 CARDIOXANE; 50 mg/m2 Doxorubicina). Dado que una reducción de la dosis de Doxorubicina es recomendada en presencia de hiperbilirrubinemia, la dosis de CARDIOXANE debe ser reducida en forma proporcional (manteniendo la proporción de 10:1) en pacientes con deterioro hepático. CARDIOXANE debe ser reconstituído con lactato de sodio molar 0.167 (M/6) inyección de lactato de sodio, USP, para dar una concentración de 10 mg de CARDIOXANE por cada mL de lactato de sodio. La solución reconstituída debe ser aplicada por perfusión IV lenta o rápida por goteo desde una bolsa de perfusión. Después de completada la perfusión IV de CARDIOXANE, y previo a un período total transcurrido de 30 minutos (desde el inicio de la infusión de CARDIOXANE), se debe aplicar la inyección intravenosa de Doxorubicina.
Es estable durante 6 horas desde el momento de la reconstitución cuando es almacenado a temperatura ambiental controlada, 15 a 30ºC) o bajo refrigeración, 2 a 8ºC. DESCARTAR SOLUCIONES NO USADAS.
CARDIOXANE solución reconstituída puede ser diluida con Cloruro de Sodio 0,9%, USP ó Dextrosa inyección 5.0%, USP, en un rango de concentración de 1.3 a 5.0 mg/mL en bolsas para infusión intravenosa. Las soluciones resultantes son estables durante 6 horas cuando son almacenadas a temperatura ambiente controlada, 15 a 30ºC o bajo refrigeración, 2 a 8ºC.
SOBREDOSIS:
No hubo casos de sobredosis de droga en los estudios clínicos patrocinados ya sea por Pharmacia & Upjohn Company o el National Cancer Institute. La máxima dosis administrada durante los ensayos cardioprotectores fue de 1000 mg/m2 cada tres semanas.
Los estudios de disposición con CARDIOXANE no fueron realizados en pacientes cancerosos sometidos a diálisis, pero la retención de una fracción significativa de dosis (>0.4) de droga inalterada, mínima separación o unión tisular y disponibilidad de más del 90% de los niveles de droga sistémica en forma no combinada sugieren que podría ser eliminada usando hemodiálisis o peritoneal convencional.
No hay un antídoto conocido para Dexrazoxane. Los casos de sobredosis sospechada deben ser manejados con buen cuidado de apoyo hasta la resolución de la mielosupresión y completadas las condiciones relacionadas. El manejo de la sobredosis debiera incluir el tratamiento de infecciones, regulación de líquido y mantenimiento de los requerimientos nutricionales.
FARMACOLOGÍA:
CARDIOXANE (Dexrazoxane, para inyección) es un liofilizado estéril libre de pirógeno para administración intravenosa. Es un agente cardioprotector para ser usado conjuntamente con Doxorubicina.
La fórmula estructural es:
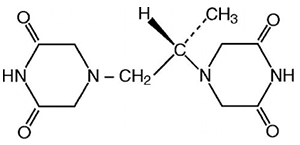
Dexrazoxane es un potente agente quelante intracelular derivado de la EDTA. Dexrazoxane es un polvo cristalino blancuzco que funde a 191ºC a 197ºC. Es escasamente soluble en agua y 0,1n HCl, ligeramente soluble en etanol y metanol y prácticamente insoluble en solventes orgánicos no-polares. El pKa es 2.1. Dexrazoxane tiene un coeficiente de partición octanol/agua de 0,025 y degrada rápidamente por encima de pH de 7.0.
CARDIOXANE es presentado en frasco ampolla de 250 mg y 500 mg, de uso único.
Cada frasco ampolla de 250 mg contiene Dexrazoxane clorhidrato equivalente a 250 mg Dexrazoxane. Ácido clorhídrico NF es agregado para ajuste de pH. Cuando es reconstituido como se indica con el vial de 25 mL de 0.167 Molar (M/6) inyección de Lactato de sodio, diluyente USP proporcionado, cada mL contiene: 10 mg Dexrazoxane. El pH de la solución resultante es 3.5 a 5.5.
PRESENTACIÓN:
CARDIOXANE (Dexrazoxane para inyección) es presentado en las siguientes potencias como liofilizados estériles, libres de pirógeno.
Caja con 1 frasco ampolla con 500 mg.
ALMACENAMIENTO:
Conservar entre 15º y 30ºC (Ver USP temperatura ambiental controlada). Las soluciones reconstituidas de CARDIOXANE son estables durante 6 horas a temperatura ambiente controlada o bajo refrigeración, 2 a 8ºC.
MEDICAMENTA
Casilla 17-21-027 Quito, Ecuador