
AMGEVITA
ADALIMUMAB
Solución inyectable
1 Caja, 1 Jeringa(s) prellenada(s), 0,4 mL, 20 mg
1 Caja, 1 Jeringa(s) prellenada(s), 0,8 mL, 40 mg
COMPOSICIÓN:
Composición cualitativa y cuantitativa
Cada jeringa prellenada (PFS) de 20 mg/0,4 mL contiene:
Adalimumab 20 mg
Ácido acético glacial 0,24 mg
Sacarosa 36 mg
Polisorbato 80 0,4 mg
Hidróxido sódico Para ajuste de pH
Agua para inyectables cs
Cada jeringa prellenada (PFS) o autoinyector prellenado de 40 mg/0,8 mL contiene:
Adalimumab 40 mg
Ácido acético glacial 0,48 mg
Sacarosa 72 mg
Polisorbato 80 0,8 mg
Hidróxido sódico Para ajuste de pH
Agua para inyectables cs
Adalimumab es un anticuerpo monoclonal humano recombinante producido en células de ovario de hámster chino.
Lista de excipientes
Ácido acético glacial
Sacarosa
Polisorbato 80
Hidróxido sódico (para ajuste de pH)
Agua para preparaciones inyectables
Forma farmacéutica
AMGEVITA 20 mg solución inyectable en jeringa prellenada.
AMGEVITA 40 mg solución inyectable en jeringa prellenada.
Solución inyectable (inyección).
AMGEVITA 40 mg solución inyectable en autoinyector prellenado (SureClick).
Solución inyectable (inyección).
Solución transparente de incolora a ligeramente amarillenta.
INDICACIONES TERAPÉUTICAS:
Artritis reumatoide
AMGEVITA en combinación con metotrexato, está indicado para:
• El tratamiento de la artritis reumatoide activa moderada a grave en pacientes adultos, cuando la respuesta a fármacos antirreumáticos modificadores de la enfermedad incluyendo metotrexato haya sido insuficiente.
• El tratamiento de la artritis reumatoide activa, grave y progresiva en adultos no tratados previamente con metotrexato.
AMGEVITA puede ser administrado como monoterapia en caso de intolerancia al metotrexato o cuando el tratamiento continuado con metotrexato no sea posible.
AMGEVITA reduce la tasa de progresión del daño de las articulaciones medido por rayos X y mejora el rendimiento físico, cuando se administra en combinación con metotrexato.
Artritis idiopática juvenil
Artritis idiopática juvenil poliarticular: AMGEVITA en combinación con metotrexato está indicado para el tratamiento de la artritis idiopática juvenil poliarticular activa en pacientes a partir de 2 años que han presentado una respuesta insuficiente a uno o más Fármacos Antirreumáticos Modificadores de la Enfermedad (FAMEs). AMGEVITA puede ser administrado en monoterapia en caso de intolerancia al metotrexato o cuando el tratamiento continuado con metotrexato no sea posible (para consultar los datos de eficacia en monoterapia ver sección Propiedades farmacodinámicas). No se ha estudiado el uso de adalimumab en pacientes menores de 2 años. Artritis asociada a entesitis
AMGEVITA está indicado para el tratamiento de la artritis asociada a entesitis activa en pacientes a partir de 6 años que han presentado una respuesta insuficiente, o son intolerantes, al tratamiento convencional (ver sección Propiedades farmacodinámicas).
Espondiloartritis axial
Espondilitis Anquilosante (EA): AMGEVITA está indicado para el tratamiento de adultos con espondilitis anquilosante activa grave que hayan presentado una respuesta insuficiente al tratamiento convencional. Espondiloartritis axial sin evidencia radiográfica de EA: AMGEVITA está indicado para el tratamiento de adultos con espondiloartritis axial grave sin evidencia radiográfica de EA pero con signos objetivos de inflamación por elevada Proteína C Reactiva (PCR) y/o Imagen por Resonancia Magnética (RMN), que presentan una respuesta insuficiente o son intolerantes a fármacos antiinflamatorios no esteroideos.
Artritis psoriásica: AMGEVITA está indicado para el tratamiento de la artritis psoriásica activa y progresiva en adultos cuando la respuesta al tratamiento previo con antirreumáticos modificadores de la enfermedad haya sido insuficiente. AMGEVITA reduce la progresión del daño en las articulaciones periféricas medido por rayos X en pacientes que presentaban el patrón poliarticular simétrico de la enfermedad (ver Propiedades farmacodinámicas) y mejora la función física de los pacientes.
Psoriasis: AMGEVITA está indicado para el tratamiento de la psoriasis en placas crónica de moderada a grave en pacientes adultos que sean candidatos para un tratamiento sistémico.
Psoriasis pediátrica en placas: AMGEVITA está indicado para el tratamiento de la psoriasis crónica en placas grave en niños y adolescentes desde los 4 años de edad que hayan presentado una respuesta inadecuada o no sean candidatos apropiados para tratamiento tópico y fototerapias.
Hidradenitis Supurativa (HS): AMGEVITA está indicado para el tratamiento de hidradenitis supurativa activa (acné inverso) de moderada a grave en pacientes adultos y adolescentes a partir de 12 años de edad con una respuesta insuficiente al tratamiento sistémico convencional de hidradenitis supurativa (ver Propiedades farmacodinámicas y Propiedades farmacocinéticas).
Enfermedad de Crohn: AMGEVITA está indicado para el tratamiento de la enfermedad de Crohn activa de moderada a grave, en pacientes adultos que no hayan respondido a un tratamiento, completo y adecuado, con corticoesteroides y/o inmunosupresores; o que son intolerantes o tienen contraindicaciones médicas para este tipo de tratamientos.
Enfermedad de Crohn pediátrica: AMGEVITA está indicado para el tratamiento de la enfermedad de Crohn activa de moderada a grave en pacientes pediátricos (a partir de los 6 años de edad) que han presentado una respuesta insuficiente al tratamiento convencional incluyendo tratamiento nutricional primario y un corticoesteroide y/o un inmunomodulador, o que son intolerantes o tienen contraindicados dichos tratamientos.Colitis ulcerosa: AMGEVITA está indicado en el tratamiento de la colitis ulcerosa activa, de moderada a grave, en pacientes adultos que han presentado una respuesta inadecuada al tratamiento convencional, incluidos corticosteroides y 6-mercaptopurina (6-MP) o azatioprina (AZA), o que presentan intolerancia o contraindicaciones a dichos tratamientos.
Uveítis: AMGEVITA está indicado en el tratamiento de la uveítis no infecciosa intermedia, posterior y panuveítis en pacientes adultos que han presentado una respuesta inadecuada a corticoesteroides, que necesiten disminuir su tratamiento con corticoesteroides, o en aquellos en los que el tratamiento con corticoesteroides sea inapropiado.Uveítis pediátrica: AMGEVITA está indicado para el tratamiento de la uveítis pediátrica anterior crónica no infecciosa en pacientes desde los 2 años de edad que han tenido una respuesta inadecuada o son intolerantes a la terapia convencional, o en los que la terapia convencional no es adecuada.
MECANISMO DE ACCIÓN:
Propiedades farmacológicas
Propiedades farmacodinámicas
Grupo farmacoterapéutico: Inmunosupresores, inhibidores del Factor de Necrosis Tumoral alfa (TNFα). Código ATC: L04AB04
AMGEVITA es un medicamento biosimilar.
Mecanismo de acción: Adalimumab se une específicamente al TNF y neutraliza su función biológica al bloquear su interacción con los receptores p55 y p75 del TNF en la superficie celular.
Adalimumab también modula la respuesta biológica inducida o regulada por el TNF, incluyendo cambios en los niveles de las moléculas de adhesión responsables de la migración leucocitaria (ELAM-1, VCAM-1, e ICAM-1 con una CI50 de 0,1-0,2 nM).
Efectos farmacodinámicos: Tras el tratamiento con adalimumab, se observó una rápida disminución de los niveles de los componentes de fase aguda de inflamación (PCR) y Velocidad de Sedimentación Globular (VSG) y de las citoquinas plasmáticas (IL-6) en comparación con el inicial en pacientes con artritis reumatoide. Los niveles plasmáticos de metaloproteinasas de la matriz (MMP-1 y MMP-3) que participan en la remodelación tisular responsable de la destrucción del cartílago también disminuyeron tras la administración de adalimumab. Los pacientes tratados con adalimumab generalmente experimentaron mejorías en los signos hematológicos de inflamación crónica.
En pacientes con artritis idiopática juvenil poliarticular, enfermedad de Crohn, colitis ulcerosa e hidradenitis supurativa se ha observado un rápido descenso en los niveles de PCR, después del tratamiento con adalimumab. En pacientes con enfermedad de Crohn se observó una reducción en el número de células que expresan marcadores inflamatorios en el colon, incluyendo una reducción significativa en la expresión del TNFα. Los estudios endoscópicos de la mucosa intestinal han mostrado evidencias de cicatrización de mucosa en pacientes tratados con adalimumab.
Datos de eficacia de AMGEVITA
Estudio comparativo entre AMGEVITA y adalimumab en Artritis Reumatoide (AR) (Estudio 1 de ABP en AR)
La eficacia y seguridad de AMGEVITA en comparación con adalimumab fueron evaluadas en un estudio aleatorizado, con control activo, doble ciego en pacientes ≥ 18 años de edad con artritis reumatoide activa diagnosticada según los criterios del Colegio Americano de Reumatología (ACR)/Liga Europea Contra el Reumatismo (LECR) 2010. Los pacientes presentaban AR de al menos 3 meses de duración y al menos 6 articulaciones inflamadas y 6 articulaciones sensibles con VSG o PCR elevadas al momento de ingreso al estudio. Los pacientes eran positivos para el factor reumatoide o anti-péptido cíclico citrulinado. El estudio evaluó 526 pacientes que presentaban respuesta inadecuada a dosis de entre 7,5 mg y 25 mg de MTX. Los pacientes recibieron 40 mg de AMGEVITA o adalimumab por vía subcutánea cada dos semanas por hasta 22 semanas.
Respuesta clínica
En la Tabla 7 se muestra el porcentaje de participantes tratados con AMGEVITA que alcanzaron ACR 20 en la semana 24 en el Estudio 1 de ABP en AR. El Cociente de Riesgos (CR) del criterio de valoración primario ACR 20 se encontró dentro del margen de equivalencia preestablecido y demostró equivalencia clínica entre AMGEVITA y adalimumab.
|
Tabla 7. Respuestas clínicas en el estudio 1 de ABP en AR |
||
|
AMGEVITA (24 semanas) |
Adalimumab (24 semanas) |
|
|
ACR 20 |
74,6% |
72,4% |
En la semana 24, el 74,6% (194/260) de los participantes en el grupo con AMGEVITA y el 72,4% (189/261) de los participantes en el grupo con adalimumab cumplieron los criterios de respuesta ACR 20. El CR de ACR 20 entre AMGEVITA y adalimumab fue 1,039 con Intervalo de Confianza Bilateral (IC) del 90% (0,954; 1,133). El IC del 90% se encontró dentro del margen de equivalencia preestablecido. La Diferencia de Riesgo (DR) de ACR 20 entre AMGEVITA y adalimumab fue 2,604% con Intervalo de Confianza (IC) bilateral del 90% (-3,728%, 8,936%). Por lo tanto, se demostró la equivalencia clínica entre AMGEVITA y adalimumab.
En la Tabla 8 se presentan los resultados de los componentes de los criterios de respuesta ACR para el Estudio 1 de ABP en AR. Los Cocientes de Respuesta ACR y la mejoría en todos los componentes de respuesta ACR evidencian la ausencia de diferencias clínicamente significativas entre los dos grupos en la semana 24.
|
Tabla 8. Componentes de la respuesta ACR |
||||
|
Parámetro (mediana) |
AMGEVITAa N = 264 |
Adalimumaba N = 262 |
||
|
Línea de base |
Semana 24 |
Línea de base |
Semana 24 |
|
|
Número de articulaciones sensibles (0 a 68) |
21,0 |
4,0 |
20,5 |
4,0 |
|
Número de articulaciones inflamadas (0 a 66) |
12,0 |
2,0 |
12,0 |
2,0 |
|
Valoración global por el médicob |
7,0 |
2,0 |
7,0 |
2,0 |
|
Valoración global por el pacienteb |
7,0 |
3,0 |
7,0 |
3,0 |
|
Dolorc |
60,0 |
19,0 |
65,0 |
21,0 |
|
Índice de discapacidad (HAQ)d |
1,5 |
1,0 |
1,5 |
0,9 |
|
PCR (mg/L) |
6,1 |
3,0 |
7,6 |
3,0 |
|
a 40 mg administrados cada dos semanas b Escala visual análoga; 0 = el mejor, 10 = el peor c Escala de dolor; 0 = sin dolor; 100 = dolor severo d El índice de discapacidad del Cuestionario de Evaluación del Estado de Salud; 0 = el mejor, 3 = el peor, mide la capacidad del paciente de realizar las siguientes actividades: vestirse/arreglarse, levantarse, comer, caminar, alcanzar, sujetar, mantener la higiene y realizar actividades habituales |
||||
En la Figura 1 se presenta el comportamiento de la respuesta ACR 20 con respecto al tiempo.
Figura 1. Estudio 1 de ABP en AR, Respuestas ACR 20 con AMGEVITA y Adalimumab durante 24 semanas
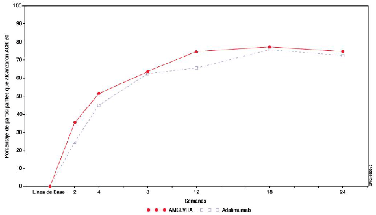
Estudio comparativo entre AMGEVITA y adalimumab en psoriasis en placa (Ps) (Estudio 1 de ABP en Ps).
La eficacia y seguridad de AMGEVITA fueron evaluadas en un estudio aleatorizado, con control activo, doble ciego en 350 pacientes ≥ 18 años de edad con psoriasis en placa (Ps) moderada a severa que eran candidatos para terapia sistémica o fototerapia. Los pacientes presentaban Ps moderada a severa de al menos 6 meses de duración, ASC ≥ 10% e Índice de Severidad y Extensión de la Psoriasis (PASI) ≥ 12 al momento de ingreso al estudio. Los pacientes recibieron AMGEVITA o adalimumab a una dosis de carga inicial de 80 mg administrados por vía SC el día 1 de la semana 1; seguidos de dosis de 40 mg por vía SC cada dos semanas, iniciando una semana después de la dosis de carga. El porcentaje de mejoría del PASI desde la línea de base se midió y comparó con adalimumab (ver Tabla 9) y se encontró dentro del margen de equivalencia preestablecido, lo que demuestra la equivalencia clínica entre AMGEVITA y adalimumab.
|
Tabla 9. Resultados para eficacia en la semana 16 en el estudio 1 de ABP en Ps |
||
|
AMGEVITA N = 175 |
N = 175 Adalimumab |
|
|
% de mejoría del PASI con respecto a la línea de base |
80,91 |
83,06 |
El criterio de valoración primario fue el porcentaje de mejoría del PASI con respecto a la línea de base hasta la semana 16. En la semana 16, el porcentaje de mejoría del PASI con respecto a la línea de base fue 80,9 en el grupo con AMGEVITA y 83,1 en el grupo con adalimumab. La diferencia de las medias por Mínimos Cuadrados (MC) del porcentaje de mejoría del PASI con respecto a la línea de base hasta la semana 16 entre AMGEVITA y adalimumab fue -2,18 con IC del 95% bilateral (-7,39; 3,02). El IC del 95% se encontró dentro del margen de equivalencia preestablecido, lo que demuestra la evidencia clínica de AMGEVITA y adalimumab.
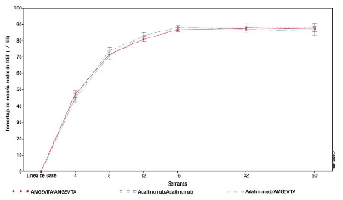
Después de que los participantes con respuesta PASI 50 (mejoría de 50% o más) se volvieron a asignar de forma aleatoria en la semana 16 para continuar el estudio, se observaron resultados similares en la semana 50 (final del estudio), donde el porcentaje medio de mejoría del PASI desde la línea de base fue similar entre los grupos de tratamiento: grupo AMGEVITA/AMGEVITA 87,16; grupo adalimumab/adalimumab 88,11 y grupo adalimumab/AMGEVITA 85,82.
En la Figura 2 se muestra el porcentaje medio de mejoría del PASI con respecto a la línea de base durante el estudio.
Figura 2. Porcentaje medio de mejoría del PASI con respecto a la línea de base durante la duración del estudio 1 de ABP en Ps
Eficacia y seguridad de adalimumab
Artritis reumatoide
Adalimumab se evaluó en más de 3.000 pacientes en el conjunto de los ensayos clínicos de artritis reumatoide. La eficacia y seguridad de adalimumab en el tratamiento de la artritis reumatoide fue evaluada mediante cinco ensayos aleatorios, doble ciego y controlados. Algunos de estos pacientes fueron sometidos a tratamiento durante un máximo de 120 meses.
En el ensayo de artritis reumatoide I se evaluaron 271 pacientes con artritis reumatoide moderada a grave con edades ≥ 18 años, que no habían respondido al tratamiento con al menos un fármaco antirreumático modificador de la enfermedad y mostraban una respuesta no suficientemente eficaz al metotrexato a dosis entre 12,5 y 25 mg (10 mg si no toleraban el metotrexato) semanales y cuyas dosis de metotrexato se mantuvieron fijas de 10 a 25 mg semanales. Se administraron dosis de 20, 40 y 80 mg de adalimumab o de placebo en semanas alternas durante un período de 24 semanas.
En el ensayo de artritis reumatoide II se evaluaron 544 pacientes con artritis reumatoide activa moderada a grave con edades ≥ 18 años, que no habían respondido al tratamiento con al menos un fármaco antirreumático modificador de la enfermedad. Se administraron dosis de 20 o de 40 mg de adalimumab mediante inyección subcutánea en semanas alternas con placebo en las semanas intermedias, o cada semana durante un período de 26 semanas; el placebo se administró cada semana durante el mismo período. No se permitió el tratamiento con ningún otro fármaco antirreumático modificador de la enfermedad.
En el ensayo de artritis reumatoide III se evaluaron 619 pacientes con artritis reumatoide moderada a grave con edades ≥ 18 años, y que mostraban una respuesta ineficaz al metotrexato a dosis entre 12,5 y 25 mg o mostraron intolerancia a 10 mg de metotrexato semanales. Había tres grupos en este ensayo. Al primero se le administraron inyecciones de placebo durante 52 semanas. Al segundo se le administraron 20 mg de adalimumab semanales durante 52 semanas. Al tercero se le administraron 40 mg de adalimumab en semanas alternas, con inyecciones de placebo en las semanas intermedias. Una vez completadas las primeras 52 semanas, 457 pacientes fueron incluidos en una fase de extensión abierta en la cual se administraron 40 mg de adalimumab/MTX en semanas alternas durante un máximo de 10 años.
En el ensayo de artritis reumatoide IV se evaluó fundamentalmente la seguridad en 636 pacientes con artritis reumatoide moderada a grave con edades ≥ 18 años. Los pacientes podían bien no haber sido tratados previamente con fármacos antirreumáticos modificadores de la enfermedad o bien seguir con su tratamiento reumatológico anterior, siempre y cuando hubiese sido un tratamiento continuado durante al menos 28 días. Estos tratamientos incluyen metotrexato, leflunomida, hidroxicloroquina, sulfasalazina y/o sales de oro. Los pacientes se aleatorizaron a los grupos de tratamiento con 40 mg de adalimumab o placebo en semanas alternas durante un período de 24 semanas.
En el ensayo de artritis reumatoide V se evaluaron 799 pacientes adultos sin tratamiento previo con metotrexato con artritis reumatoide temprana moderada a grave (duración media de la enfermedad menor de 9 meses). Este ensayo evaluó la eficacia de adalimumab 40 mg administrado en semanas alternas en tratamiento combinado con metotrexato, adalimumab 40 mg administrado en semanas alternas en monoterapia y la monoterapia con metotrexato en la reducción de los signos, síntomas y velocidad de progresión del daño articular en la artritis reumatoide durante 104 semanas. Tras completar las primeras 104 semanas, se incluyeron 497 pacientes en una fase de extensión abierta en la que se administraron 40 mg de adalimumab en semanas alternas hasta un período de 10 años.
La variable principal de los ensayos de artritis reumatoide I, II y III, y la secundaria del ensayo de artritis reumatoide IV era el porcentaje de pacientes que alcanzaron una respuesta ACR 20 en la semana 24 o en la 26. La variable principal del ensayo de artritis reumatoide V era el porcentaje de pacientes que alcanzaron una respuesta ACR 50 en la semana 52. Los ensayos de artritis reumatoide III y V tenían otro objetivo primario adicional a las 52 semanas, el retraso en la progresión de la enfermedad (detectado por medio de rayos-X). El ensayo de artritis reumatoide III tenía también el objetivo principal de cambios en la calidad de vida.
Respuesta ACR
El porcentaje de pacientes tratados con adalimumab que alcanzaron respuestas ACR 20, 50 y 70 fue constante durante los ensayos de artritis reumatoide I, II y III. Los resultados de los pacientes que recibieron dosis de 40 mg en semanas alternas se resumen en la Tabla 10.
|
Tabla 10. Respuestas ACR en ensayos controlados con placebo |
||||||
|
Respuesta |
Ensayo de artritis reumatoide Ia** |
Ensayo de artritis reumatoide IIa** |
Ensayo de artritis reumatoide IIIa** |
|||
|
Placebo/ MTXc n = 60 |
Adalimumabb/ MTXc n = 63 |
Placebo n = 110 |
Adalimumabb n = 113 |
Placebo/ MTXc |
Adalimumabb/ MTXc n = 207 |
|
|
ACR 20 |
||||||
|
6 meses |
13,3% |
65,1% |
19,1% |
46,0% |
29,5% |
63,3% |
|
12 meses |
NA |
NA |
NA |
NA |
24,0% |
58,9% |
|
ACR 50 |
||||||
|
6 meses |
6,7% |
52,4% |
8,2% |
22,1% |
9,5% |
39,1% |
|
12 meses |
NA |
NA |
NA |
NA |
9,5% |
41,5% |
|
ACR 70 |
||||||
|
6 meses |
3,3% |
23,8% |
1,8% |
12,4% |
2,5% |
20,8% |
|
12 meses |
NA |
NA |
NA |
NA |
4,5% |
23,2% |
|
a Ensayo de artritis reumatoide I a las 24 semanas, Ensayo de artritis reumatoide II a las 26 semanas, y Ensayo de artritis reumatoide III a las 24 y 52 semanas b 40 mg adalimumab administrados en semanas alternas c MTX = metotrexato ** p < 0,01, adalimumab versus placebo |
||||||
En los ensayos de artritis reumatoide I-IV, todos los componentes individuales de los criterios de respuesta ACR (número de articulaciones doloridas e inflamadas, valoración por parte del médico y del paciente de la actividad de la enfermedad y dolor, resultados del índice de discapacidad (HAQ) y valores PCR (mg/dL) mejoraron a las 24 o 26 semanas en comparación con placebo. En el ensayo de artritis reumatoide III, estas mejorías se mantuvieron durante 52 semanas.
En la fase de extensión abierta del ensayo III de AR, la mayoría de los pacientes con respuesta ACR mantuvieron esta respuesta a los 10 años. De 207 pacientes que fueron aleatorizados a adalimumab 40 mg en semanas alternas, 114 pacientes continuaron con adalimumab 40 mg en semanas alternas durante 5 años. De estos, 86 pacientes (75,4%) tenían respuesta ACR 20; 72 pacientes (63,2%) tenían respuesta ACR 50; y 41 pacientes (36%) tenían respuesta ACR 70. De 207 pacientes, 81 continuaron con adalimumab 40 mg en semanas alternas durante 10 años. De estos, 64 pacientes (79,0%) tenían respuesta ACR 20; 56 pacientes (69,1%) tenían respuesta ACR 50; y 43 pacientes (53,1%) tenían respuesta ACR 70.
En el ensayo de artritis reumatoide IV, la respuesta ACR 20 en pacientes tratados con adalimumab y cuidados estándar fue mejor de forma estadísticamente significativa que en pacientes tratados con placebo y cuidados estándar (p < 0,001).
En los ensayos de artritis reumatoide I-IV, los pacientes tratados con adalimumab alcanzaron respuestas ACR 20 y 50 estadísticamente significativas en comparación con placebo tan solo una a dos semanas después de iniciar el tratamiento.
En el ensayo de artritis reumatoide V con pacientes con artritis reumatoide temprana sin tratamiento previo con metotrexato, el tratamiento combinado con adalimumab y metotrexato resultó en a una respuesta ACR significativamente mayor y más rápida que en la monoterapia con metotrexato y en la monoterapia con adalimumab en la semana 52 y dichas respuestas se mantuvieron en la semana 104 (ver Tabla 11).
|
Tabla 11. Respuestas ACR en el ensayo de artritis reumatoide V |
||||||
|
Respuesta |
MTX n = 257 |
Adalimumab n = 274 |
Adalimumab /MTX n = 268 |
Valor pa |
Valor pb |
Valor pc |
|
ACR 20 |
||||||
|
Semana 52 |
62,6% |
54,4% |
72,8% |
0,013 |
< 0,001 |
0,043 |
|
Semana 104 |
56,0% |
49,3% |
69,4% |
0,002 |
< 0,001 |
0,140 |
|
ACR 50 |
||||||
|
Semana 52 |
45,9% |
41,2% |
61,6% |
< 0,001 |
< 0,001 |
0,317 |
|
Semana 104 |
42,8% |
36,9% |
59,0% |
< 0,001 |
< 0,001 |
0,162 |
|
ACR 70 |
||||||
|
Semana 52 |
27,2% |
25,9% |
45,5% |
< 0,001 |
< 0,001 |
0,656 |
|
Semana 104 |
28,4% |
28,1% |
46,6% |
< 0,001 |
< 0,001 |
0,864 |
|
a Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con metotrexato y el tratamiento combinado con adalimumab/metotrexato usando el test de Mann-Whitney U b Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con adalimumab y el tratamiento combinado con adalimumab/metotrexato usando el test de Mann-Whitney U c Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con adalimumab y la monoterapia con metotrexato usando el test de Mann-Whitney U |
||||||
En la extensión abierta del ensayo de artritis reumatoide V, se mantuvieron las respuestas ACR tras un seguimiento de hasta un período de 10 años. De los 542 pacientes que fueron aleatorizados a recibir adalimumab 40 mg en semanas alternas, 170 pacientes continuaron con adalimumab 40 mg en semanas alternas hasta completar 10 años de tratamiento. Entre esos, 154 pacientes (90,6%) obtuvieron respuestas ACR 20; 127 pacientes (74,7%) obtuvieron respuestas ACR 50; y 102 pacientes (60,0%) obtuvieron respuestas ACR 70.
En la semana 52, el 42,9% de los pacientes en tratamiento con el tratamiento combinado adalimumab/metotrexato alcanzó la remisión clínica (DAS28 (PCR) < 2,6) comparado con el 20,6% de los pacientes en monoterapia con metotrexato y el 23,4% de los pacientes en monoterapia con adalimumab. La combinación adalimumab/metotrexato era clínica y estadísticamente superior a la monoterapia con metotrexato (p < 0,001) y a la monoterapia con adalimumab (p < 0,001) a la hora de reducir la gravedad de la enfermedad en pacientes diagnosticados con artritis reumatoide reciente moderada a grave. La respuesta a las dos monoterapias fue similar (p = 0,447). De los 342 sujetos inicialmente aleatorizados a recibir adalimumab en monoterapia o la combinación adalimumab/metotrexato que se incluyeron en la extensión abierta del estudio, 171 sujetos completaron 10 años de tratamiento con adalimumab. Entre esos, se reportó que 109 sujetos (63,7%) estaban en remisión a los 10 años.
Respuesta radiográfica: En el ensayo de artritis reumatoide III, en el que los pacientes tratados con adalimumab habían tenido artritis reumatoide durante una media de 11 años, se valoró radiográficamente el daño estructural en las articulaciones y se expresó como el cambio en el Índice Total de Sharp modificado (ITSm) y sus componentes, el índice de erosión y el índice de estrechamiento del espacio articular. Los pacientes tratados con adalimumab/metotrexato demostraron una progresión radiográfica significativamente menor que los pacientes tratados sólo con metotrexato a los 6 y 12 meses (ver Tabla 12).
En la extensión abierta del estudio de artritis reumatoide III, la reducción en la frecuencia de la progresión del daño estructural se mantuvo durante 8 y 10 años en un subgrupo de pacientes. A los 8 años se evaluaron radiográficamente 81 de los 207 pacientes tratados con adalimumab 40 mg en semanas alternas. De los pacientes analizados, 48 no mostraron progresión del daño estructural, definido como un cambio desde el inicio en el ITSm de 0,5 o menos. A los 10 años, 79 de 207 pacientes originalmente tratados con 40 mg de adalimumab en semanas alternas se evaluaron radiográficamente. De estos, 40 pacientes no mostraron progresión del daño estructural definido por un cambio desde el basal en el ITSm de 0,5 o menos.
|
Tabla 12. Cambios radiográficos medios durante 12 meses en el ensayo de artritis reumatoide III |
||||
|
Placebo/MTXa |
Adalimumab /MTX 40 mg en semanas alternas |
Placebo/MTX-adalimumab/MTX (Intervalo de confianzab del 95%) |
Valor p |
|
|
Índice Total de Sharp |
2,7 |
0,1 |
2,6 (1,4 – 3,8) |
< 0,001c |
|
Índice de Erosión |
1,6 |
0,0 |
1,6 (0,9 – 2,2) |
< 0,001 |
|
Índice JSNd |
1,0 |
0,1 |
0,9 (0,3 – 1,4) |
0,002 |
|
a Metotrexato b Intervalo de confianza del 95% para las diferencias en el cambio de los índices entre metotrexato y adalimumab c Basado en análisis de rango d Estrechamiento del Espacio Articular |
||||
En el ensayo de artritis reumatoide V, el daño estructural en las articulaciones se valoró radiográficamente y se expresó como cambio en el ITSm (Índice Total de Sharp modificado) (ver Tabla 13).
|
Tabla 13. Principales cambios radiográficos en la semana 52 |
||||||
|
MTX n = 257 (Intervalo de confianza del 95%) |
Adalimumab n = 274 (Intervalo de confianza del 95%) |
Adalimumab /MTX n = 268 (Intervalo de confianza del 95%) |
Valor pa |
Valor pb |
Valor pc |
|
|
Índice Total de Sharp |
5,7 (4,2 - 7,3) |
3,0 (1,7 - 4,3) |
1,3 (0,5 - 2,1) |
< 0,001 |
0,0020 |
< 0,001 |
|
Índice de Erosión |
3,7 (2,7 - 4,7) |
1,7 (1,0 - 2,4) |
0,8 (0,4 - 1,2) |
< 0,001 |
0,0082 |
< 0,001 |
|
Índice JSN |
2,0 (1,2 - 2,8) |
1,3 (0,5 - 2,1) |
0,5 (0 - 1,0) |
< 0,001 |
0,0037 |
0,151 |
|
a Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con metotrexato y el tratamiento combinado con adalimumab/metotrexato usando el test de Mann-Whitney U b Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con adalimumab y el tratamiento combinado con adalimumab/metotrexato usando el test de Mann-Whitney U c Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con adalimumab y la monoterapia con metotrexato usando el test de Mann-Whitney U |
||||||
En las siguientes 52 semanas y en las 104 semanas de tratamiento, el porcentaje de pacientes sin progresión (cambio de la línea base del Índice Total de Sharp modificado ≤ 0,5) fue significativamente mayor con el tratamiento, combinado adalimumab/metotrexato (63,8% y 61,2% respectivamente) en comparación con la monoterapia con metotrexato (37,4% y 33,5%, respectivamente, p < 0,001) y con la monoterapia con adalimumab (50,7%, p < 0,002 y 44,5%, p < 0,001, respectivamente).
En la extensión abierta del ensayo de artritis reumatoide V, el cambio medio desde el inicio en el Índice Total de Sharp modificado a los 10 años fue de 10,8, 9,2 y 3,9 en los pacientes inicialmente aleatorizados a recibir metotrexato en monoterapia, adalimumab en monoterapia y la combinación adalimumab/metotrexato, respectivamente. La proporción correspondiente de pacientes sin progresión radiográfica fue de 31,3%, 23,7% y 36,7%, respectivamente.Calidad de vida y rendimiento físico: La calidad de vida relacionada con la salud y el rendimiento físico se evaluaron usando el índice de discapacidad del Cuestionario de Evaluación del Estado de Salud HAQ (Health Assessment Questionnaire) en los cuatro ensayos originales controlados, siendo este uno de los objetivos fundamentales a la semana 52 en el ensayo de artritis reumatoide III. En los cuatro ensayos, todas las dosis/pautas de adalimumab mostraron de forma estadísticamente significativa superioridad en la mejoría en el índice de discapacidad del HAQ desde el nivel inicial hasta el mes 6 comparado con placebo, y en el ensayo de artritis reumatoide III se observó lo mismo a la semana 52. Los resultados del Cuestionario de Salud Abreviado SF 36 (Short Form Health Survey) para todas las dosis/pautas de adalimumab en los cuatro ensayos respaldan estos hallazgos, con unos resultados del resumen del componente físico PCS (Physical Component Summary) estadísticamente significativos, así como unos resultados estadísticamente significativos en la escala de dolor y de la vitalidad para la dosis de 40 mg en semanas alternas. Se ha observado una disminución estadísticamente significativa de la fatiga, medida mediante la escala de valoración funcional del tratamiento de enfermedades crónicas FACIT (Functional Assessment of Chronic Illness Therapy) en los tres ensayos en los que se evaluó (ensayos de artritis reumatoide I, III, IV).
En el ensayo de artritis reumatoide III, la mayoría de los pacientes que consiguieron mejora en la función física y continuaron el tratamiento, mantuvieron la mejora durante las 520 semanas (120 meses) de tratamiento abierto. La mejora en la calidad de vida se midió hasta la semana 156 (36 meses) manteniéndose a lo largo de este período de tiempo.
En el ensayo de artritis reumatoide V, la mejoría en el índice de discapacidad del Cuestionario HAQ y del componente físico del SF 36 mostró una mejora superior (p < 0,001) para la combinación adalimumab/metotrexato frente a la monoterapia con metotrexato y la monoterapia con adalimumab en la semana 52, que se mantuvo en la semana 104. Entre los 250 sujetos que completaron la extensión abierta del estudio, las mejorías en la función física se mantuvieron durante los 10 años de tratamiento.Artritis Idiopática Juvenil (AIJ)
Artritis Idiopática Juvenil Poliarticular (AIJp)
Se han evaluado la seguridad y la eficacia de adalimumab en dos ensayos (AIJp I y II) en niños con artritis idiopática juvenil poliarticular o de curso poliarticular, que tenían una variedad de tipos de AIJ (más frecuentemente factor reumatoide negativo o poliartritis positiva y oligoartritis extendida).
AIJp I
Se ha evaluado la seguridad y eficacia de adalimumab en un ensayo multicéntrico, aleatorizado, doble ciego, de grupo paralelo en 171 niños (de 4 a 17 años) con AIJ poliarticular. En una fase inicial abierta los pacientes fueron estratificados en dos grupos, tratados con metotrexato (MTX) o no tratados con metotrexato (no-MTX). Los pacientes del estrato no-MTX fueron tanto pacientes naïve como pacientes a los que se les había retirado el metotrexato al menos dos semanas antes de la administración del fármaco. Los pacientes permanecieron en dosis estables de AINEs o prednisona (≤ 0,2 mg/kg/día o 10 mg/día máximo). En la fase inicial abierta todos los pacientes recibieron 24 mg/m2 hasta un máximo de 40 mg de adalimumab en semanas alternas durante 16 semanas. La distribución de pacientes por edad y dosis mínima, media y máxima recibida durante la fase inicial abierta se presenta en la Tabla 14.
|
Tabla 14. Distribución de pacientes por edad y dosis de adalimumab recibida en la fase inicial abierta |
||
|
Grupo de edad |
Número inicial de pacientes n (%) |
Dosis mínima, media y máxima |
|
4 a 7 años |
31 (18,1) |
10, 20 y 25 mg |
|
8 a 12 años |
71 (41,5) |
20, 25 y 40 mg |
|
13 a 17 años |
69 (40,4) |
25, 40 y 40 mg |
Los pacientes que demostraron respuesta ACR pediátrico-30 en la semana 16 fueron candidatos para ser aleatorizados en una fase Doble Ciego (DC), y recibir durante 32 semanas adicionales o hasta el recrudecimiento de la enfermedad adalimumab 24 mg/m2 hasta un máximo de 40 mg, o placebo en semanas alternas. Los criterios de recrudecimiento se definieron como un empeoramiento ≥ 30% desde el nivel basal en ≥ 3 de 6 criterios ACR-pediátricos básicos, ≥ 2 articulaciones activas, y una mejora > 30% en no más de 1 de 6 criterios. Después de 32 semanas de tratamiento o en el recrudecimiento de la enfermedad, los pacientes fueron candidatos para ser enrolados en la fase de extensión abierta.
|
Tabla 15. Respuesta ACR-pediátrico 30 en el ensayo de AIJ |
||||
|
Estrato |
MTX |
No-MTX |
||
|
Fase |
||||
|
Inicial abierta tras 16 semanas |
||||
|
Respuesta ACR-pediátrico 30 (n/N) |
94,1% (80/85) |
74,4% (64/86) |
||
|
Resultados de eficacia |
||||
|
32 semanas doble ciego |
Adalimumab/MTX (N = 38) |
Placebo/MTX (N = 37) |
Adalimumab (N = 30) |
Placebo (N = 28) |
|
Recrudecimiento de la enfermedad después de 32 semanasa (n/N) |
36,8% (14/38) |
64,9% (24/37)b |
43,3% (13/30) |
71,4% (20/28)c |
|
Tiempo medio de recrudecimiento de la enfermedad |
> 32 semanas |
20 semanas |
> 32 semanas |
14 semanas |
|
a Respuestas ACR-pediátrico 30/50/70 en la semana 48 significativamente mayores que aquellos pacientes tratados con placebo. b p = 0,015 c p = 0,031 |
||||
Entre aquellos pacientes respondedores a la semana 16 (n = 144), las respuestas ACR-pediátrico 30/50/70/90 se mantuvieron durante seis años en la fase de extensión abierta en pacientes que recibieron adalimumab a lo largo del ensayo. Un total de 19 sujetos, de los cuales 11 pertenecían inicialmente al grupo de edad de 4 a 12 y 8 al grupo de 13 a 17 años, fueron tratados durante 6 años o más.
La respuesta global fue generalmente mejor y, menos pacientes desarrollaron anticuerpos cuando fueron tratados con adalimumab y metotrexato en comparación con adalimumab sólo. Teniendo en cuenta estos resultados, se recomienda el uso de adalimumab en combinación con metotrexato y para uso en monoterapia en pacientes para los que el uso de metotrexato no es apropiado (ver sección Posología).
AIJp II
Se ha evaluado la eficacia y la seguridad de adalimumab en un estudio abierto, multicéntrico en 32 niños (2 - < 4 años o con 4 años y peso inferior < 15 kg) con AIJ poliarticular activa de moderada a grave. Los pacientes recibieron 24 mg/m2 de área de superficie corporal (ASC) de adalimumab hasta un máximo de 20 mg en semanas alternas como una dosis única vía inyección subcutánea durante al menos 24 semanas. Durante el estudio la mayoría de los sujetos se trataron con metotrexato concomitante, con unas pocas notificaciones de tratamientos con corticoesteroides o AINEs.
En las semanas 12 y 24, la respuesta PedACR30 fue del 93,5%y del 90,0%, respectivamente, usando la aproximación de observación de datos. La proporción de pacientes con PedACR50/70/90 en la semana 12 y en la semana 24 fue del 90,3%/61,3%/38,7% y del 83,3%/73,3%/36,7%, respectivamente. De aquellos pacientes que respondieron (ACR 30 pediátrico) en la semana 24 (n = 27 de 30 pacientes), la respuesta ACR 30 pediátrica se mantuvo hasta 60 semanas en la fase de extensión abierta en los pacientes que recibieron adalimumab a lo largo de este período de tiempo. En total, 20 sujetos fueron tratados durante 60 semanas o más.
Artritis asociada a entesitis
Se evaluó la seguridad y eficacia de adalimumab en un estudio multicéntrico, aleatorizado, doble ciego en 46 pacientes pediátricos (de 6 a 17 años) con artritis asociada a entesitis moderada. Los pacientes se aleatorizaron para recibir 24 mg/m2 de Área de Superficie Corporal (ASC) de adalimumab hasta un máximo de 40 mg o placebo durante 12 semanas. Tras el período doble ciego se continuó con un Período Abierto (PA) durante el que los pacientes recibieron 24 mg/m2 de ASC de adalimumab hasta un máximo de 40 mg en semanas alternas por vía subcutánea durante 192 semanas adicionales. La variable principal del ensayo fue el porcentaje de cambio respecto al basal de la semana 12 en el número de articulaciones activas con artritis (inflamación no atribuida a la deformación o articulaciones con pérdida de movilidad más dolor y/o sensibilidad), que se alcanzó con una media de -62,6% (cambio porcentual medio de -88,9%) en pacientes en el grupo de adalimumab comparado con el -11,6% (cambio porcentual medio -50,0%) en pacientes en el grupo placebo. Durante el PA se mantuvo la mejora en el número de articulaciones activas con artritis hasta la semana 156 para los 26 de 31 pacientes (84%) del grupo de adalimumab que permanecieron en el estudio. A pesar de que no sea estadísticamente significativo, la mayoría de los pacientes mostraron mejoras clínicas en variables secundarias como el número de zonas de entesitis, el Recuento de Articulaciones Dolorosas (RAD), el Recuento de Articulaciones Inflamadas (RAI), la repuesta ACR 50 pediátrica y la respuesta ACR 70 pediátrica.
Espondiloartritis axial
Espondilitis Anquilosante (EA)
Se evaluó el tratamiento con adalimumab 40 mg cada 2 semanas mediante dos ensayos aleatorizados, doble ciego controlados con placebo de 24 semanas de duración en 393 pacientes con espondilitis anquilosante activa (la media de partida de la actividad basal de la enfermedad según el índice funcional de Bath [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] fue de 6,3 en todos los grupos) que habían presentado una respuesta inadecuada al tratamiento convencional. 79 pacientes (20,1%) fueron tratados concomitantemente con un fármaco antirreumático modificador de la enfermedad, y 37 pacientes (9,4%) con glucocorticoides. Tras el período doble ciego se continuó con un período abierto durante el cual los pacientes recibieron adalimumab 40 mg cada dos semanas por vía subcutánea, durante 28 semanas adicionales. Los pacientes (n = 215; 54,7%) que no consiguieron una puntuación de 20 en el índice ASAS (Assessments in Ankylosing Spondylitis, o Evaluaciones en Espondilitis Anquilosante) a las semanas 12, 16 o 20 recibieron prematuramente tratamiento de rescate con adalimumab 40 mg subcutáneo administrado en semanas alternas y, posteriormente fueron considerados como no-respondedores en los análisis estadísticos doble ciego.En el ensayo de espondilitis anquilosante más amplio I, con 315 pacientes, los resultados mostraron una mejora estadísticamente significativa de los signos y síntomas de la espondilitis anquilosante en pacientes tratados con adalimumab comparado con placebo. La primera respuesta significativa fue observada en la segunda semana y se mantuvo durante 24 semanas (Tabla 16).
|
Tabla 16. Respuesta de eficacia en el ensayo de Espondilitis Anquilosante controlado con placebo - estudio I reducción de signos y síntomas |
||
|
Respuesta |
Placebo N = 107 |
Adalimumab N = 208 |
|
ASASa 20 |
||
|
Semana 2 |
16% |
42%*** |
|
Semana 12 |
21% |
58%*** |
|
Semana 24 |
19% |
51%*** |
|
ASAS 50 |
||
|
Semana 2 |
3% |
16%*** |
|
Semana 12 |
10% |
38%*** |
|
Semana 24 |
11% |
35%*** |
|
ASAS 70 |
||
|
Semana 2 |
0% |
7%** |
|
Semana 12 |
5% |
23%*** |
|
Semana 24 |
8% |
24%*** |
|
BASDAIb 50 |
||
|
Semana 2 |
4% |
20%*** |
|
Semana 12 |
16% |
45%*** |
|
Semana 24 |
15% |
42%*** |
|
***, ** Estadísticamente significativa a p < 0,001, < 0,01 para todas las comparaciones entre adalimumab y placebo en las semanas 2, 12 y 24 a Evaluaciones en Espondilitis Anquilosante b Índice de Bath para la Actividad de la Enfermedad Espondilitis Anquilosante |
||
Los pacientes tratados con adalimumab tienen una mejoría significativamente mayor en la semana 12, la cual se mantiene hasta la semana 24 tanto en el SF 36 como en el Cuestionario de Calidad de Vida de Espondilitis Anquilosante (ASQoL).
Se observaron tendencias similares (no todas estadísticamente significativas) en un ensayo de espondilitis anquilosante más pequeño aleatorizado, doble ciego, controlado con placebo (II) de 82 pacientes adultos con espondilitis anquilosante activa.
Espondiloartritis axial sin evidencia radiográfica de EA
Se evaluó la seguridad y eficacia de adalimumab en dos ensayos aleatorizados, doble ciego, controlados con placebo en pacientes con espondiloartritis axial no radiográfica (EspA ax-nr). El ensayo EspA ax-nr I evaluó pacientes con EspA ax-nr activa. El ensayo EspA ax-nr II era un estudio de retirada de tratamiento en pacientes con EspA ax-nr activa que alcanzaron la remisión durante la fase abierta del tratamiento con adalimumab. Ensayo EspA ax-nr I
En el ensayo EspA ax-nr I, se evaluó el tratamiento con adalimumab 40 mg en semanas alternas en un ensayo aleatorizado, doble ciego, controlado con placebo de 12 semanas de duración en 185 pacientes con EspA ax-nr activa (la media de partida de la actividad basal de la enfermedad según el índice funcional de Bath [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] fue de 6,4 en pacientes tratados con adalimumab y 6,5 en aquellos en placebo) que presentaron respuesta insuficiente o intolerancia a ≥ 1 AINEs, o contraindicación para AINEs.
Al inicio del ensayo treinta y tres paceintes (18%) fueron tratados concomitantemente con un fármaco antirreumático modificador de la enfermedad, y 146 paceintes (79%) con AINEs. Tras el período doble ciego se continuó con un período de extensión abierto durante el cual los pacientes recibieron adalimumab 40 mg en semanas alternas por vía subcutánea durante un período adicional de 144 semanas. Los resultados de la semana 12 mostraron una mejoría estadísticamente significativa de los signos y síntomas de la EspA ax-nr activa en pacientes tratados con adalimumab comparado con placebo (Tabla 17).
|
Tabla 17. Respuesta de eficacia en el ensayo de Espondiloartritis Axial no radiográfica I controlado con placebo |
||
|
Respuesta Doble Ciego en la semana 12 |
Placebo N = 94 |
Adalimumab N = 91 |
|
ASASa 40 |
15% |
36%*** |
|
ASAS 20 |
31% |
52%** |
|
ASAS 5/6 |
6% |
31%*** |
|
ASAS Remisión Parcial |
5% |
16%* |
|
BASDAIb 50 |
15% |
35%** |
|
ASDASc,d,e |
-0,3 |
-1,0*** |
|
ASDAS Enfermedad Inactiva |
4% |
24%*** |
|
hs-PCRd,f,g |
-0,3 |
-4,7*** |
|
SPARCCh RMN Articulaciones Sacroilíacasd,i |
-0,6 |
-3,2** |
|
SPARCC RMN Espinald,j |
-0,2 |
-1,8** |
|
a Sociedad Internacional de Evaluación de las Espondiloartritis (Assessment of Spondyloarthritis International Society) b Índice de Bath para la Actividad de la Enfermedad Espondilitis Anquilosante c Puntuación de la Actividad de la Enfermedad de Espondilitis Anquilosante d Cambio medio a partir del valor basal e n = 91 placebo y n = 87 adalimumab f Proteína C-Reactiva de alta sensibilidad (mg/L) g n = 73 placebo y n = 70 adalimumab h Consorcio de Canadá de Investigación de Espondiloartritis i n = 84 placebo y adalimumab j n = 82 placebo y n = 85 adalimumab ***, **, * Estadísticamente significativa a p < 0,001; < 0,01 y < 0,05, respectivamente, para todas las comparaciones entre adalimumab y placebo |
||
Durante la fase de extensión abierta, las mejoras de los signos y síntomas del tratamiento con adalimumab se mantuvieron hasta la semana 156.
Inhibición de la inflamación
En los pacientes tratados con adalimumab se mantuvo una mejoría significativa de los signos de inflamación en las articulaciones sacroilíacas y espinal, medido por PCR hs y RMN, hasta las semanas 156 y 104, respectivamente.Calidad de vida y rendimiento físico
La calidad de vida relacionada con la salud y el rendimiento físico se evaluaron usando los cuestionarios HAQ-S y SF-36. Adalimumab mostró, de forma estadísticamente significativa, superioridad en la mejoría en el índice total del HAQ-S y en el Índice del Componente Físico (PCS) del SF-36 desde el nivel basal hasta la semana 12 comparado con placebo. Se mantuvieron las mejoras en la calidad de vida relacionada con la salud y la función física durante la fase de extensión abierta hasta la semana 156.
Ensayo EspA ax-nr II
673 pacientes con EspA ax-nr activa (la media de partida de la actividad basal de la enfermedad [BASDAI] fue de 7,0) que tuvieron respuesta inadecuada a ≥ 2 AINEs, o intolerancia o contraindicación a AINEs participaron en la fase abierta del Estudio EspA ax-nr II durante el cual recibieron adalimumab 40 mg en semanas alternas durante 28 semanas. Estos pacientes también presentaban evidencia objetiva de inflamación en RMN en las articulaciones sacroilíacas o vertebral o PCR-us elevado. Los pacientes que alcanzaron remisión sostenida durante al menos 12 semanas (n=305) (ASDAS < 1,3 en las semanas 16, 20, 24, y 28) durante la fase abierta fueron posteriormente aleatorizados para continuar recibiendo tratamiento con adalimumab 40 mg en semanas alternas (n=152) o placebo (n=153) durante 40 semanas adicionales en la fase de doble ciego controlada con placebo (duración total del estudio 68 semanas). A los pacientes que recayeron durante la fase de doble ciego se les administró tratamiento de rescate con adalimumab 40 mg en semanas alternas durante al menos 12 semanas. La variable principal de eficacia fue la proporción de pacientes sin recaída antes de la semana 68 del estudio. Se definió recaída como ASDAS ≥ 2,1 en dos de las visitas consecutivas con cuatro semanas de diferencia. Durante la fase de doble ciego, una mayor proporción de pacientes tratados con adalimumab no tuvo brote de enfermedad, comparado con los tratados con placebo (70,4% vs 47,1%, p < 0,001) (Figura 3).
Figura 3: Curvas de Kaplan-Meier que resumen el tiempo de recaída en el Ensayo EspA ax-nr II
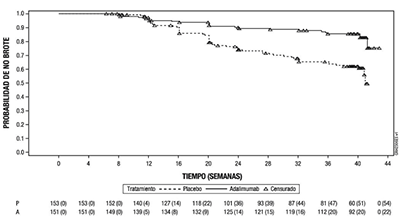
Nota: P = Placebo (Número en riesgo (con brote)); A = Adalimumab (Número en riesgo (con brote)).
Entre los 68 pacientes que recayeron en el grupo de retirada del tratamiento, 65 completaron 12 semanas de tratamiento de rescate con adalimumab, de los cuales 37 (56,9%) volvieron a entrar en remisión (ASDAS < 1,3) después de 12 semanas de volver a empezar con el tratamiento en fase abierta.
Antes de la semana 68, los pacientes que continuaron con el tratamiento con adalimumab mostraron una mejoría mayor estadísticamente significativa de los signos y síntomas de la EspA ax-nr activa comparado con los pacientes asignados a la retirada del tratamiento durante la fase de doble ciego del ensayo (Tabla 18).
|
Tabla 18. Respuesta de eficacia en la fase controlada con placebo del Ensayo EspA ax-nr II |
||
|
Doble ciego Respuesta en la semana 68 |
Placebo N=153 |
Adalimumab N=152 |
|
ASASa,b 20 |
47,1% |
70,4%*** |
|
ASASa,b 40 |
45,8% |
65,8%*** |
|
ASASa Remisión parcial |
26,8% |
42,1%** |
|
ASDASc Inactividad de la enfermedad |
33,3% |
57,2%*** |
|
Brote parciald |
64,1% |
40,8%*** |
|
a Sociedad internacional de Evaluación de las Espondiloartritis b Base definida como punto de partida de la fase abierta cuando los pacientes presentan enfermedad activa c Puntuación de actividad de enfermedad de Espondilitis Anquilosante d Brote parcial definida como ASDAS ≥ 1,3 pero < 2,1 en 2 visitas consecutivas ***, ** Estadísticamente significativa p < 0,001 y < 0,01, respectivamente, en todas las comparaciones entre adalimumab y placebo |
||
Artritis psoriásica
Adalimumab, 40 mg administrado en semanas alternas, se ha estudiado en pacientes con artritis psoriásica activa moderada a grave en dos ensayos controlados con placebo, ensayos de artritis psoriásica I y II. El ensayo de artritis psoriásica I de 24 semanas de duración, incluyó a 313 pacientes adultos con una respuesta inadecuada al tratamiento con antiinflamatorios no esteroideos, y de éstos el 50% estaban tomando metotrexato. El ensayo de artritis psoriásica II, de 12 semanas de duración, incluyó a 100 pacientes con respuesta inadecuada al tratamiento con Fármacos Antirreumáticos Modificadores de la Enfermedad (FAME). Una vez finalizados ambos estudios, 383 pacientes se incluyeron en un ensayo de extensión abierto, en el que se administraron 40 mg de adalimumab en semanas alternas.
No existe suficiente evidencia acerca de la eficacia de adalimumab en pacientes con artropatía psoriásica similar a la espondilitis anquilosante, debido al bajo número de pacientes estudiados.
|
Tabla 19. Respuesta ACR en ensayos de artritis psoriásica controlados con placebo (porcentaje de pacientes) |
||||
|
Ensayo de artritis psoriásica I |
Ensayo de artritis psoriásica II |
|||
|
Respuesta |
Placebo N = 162 |
Adalimumab N = 151 |
Placebo N = 49 |
Adalimumab N = 51 |
|
ACR 20 |
||||
|
Semana 12 |
14% |
58%*** |
16% |
39%* |
|
Semana 24 |
15% |
57%*** |
N/A |
N/A |
|
ACR 50 |
||||
|
Semana 12 |
4% |
36%*** |
2% |
25%*** |
|
Semana 24 |
6% |
39%*** |
N/A |
N/A |
|
ACR 70 |
||||
|
Semana 12 |
1% |
20%*** |
0% |
14%* |
|
Semana 24 |
1% |
23%*** |
N/A |
N/A |
|
*** p < 0,001 en todas las comparaciones entre adalimumab y placebo * p < 0,05 en todas las comparaciones entre adalimumab y placebo N/A no aplicable |
||||
Las respuestas ACR en el ensayo de artritis psoriásica I eran similares con o sin tratamiento concomitante con metotrexato. Las respuestas ACR se mantuvieron en el ensayo de extensión abierto hasta la semana 136. En los ensayos en artritis psoriásica se evaluaron los cambios radiográficos. Se obtuvieron radiografías de manos, muñecas y pies al inicio del ensayo y en la semana 24 durante el período doble ciego, en el que los pacientes estaban en tratamiento con adalimumab o con placebo, y también en la semana 48, durante la fase abierta del ensayo en la que todos los pacientes estaban en tratamiento con adalimumab. Se utilizó un Índice Total de Sharp modificado, que incluía las articulaciones interfalángicas distales (es decir, no es idéntico al Índice Total de Sharp usado para la artritis reumatoide). El tratamiento con adalimumab redujo la progresión del daño articular periférico en comparación con el tratamiento con placebo. Esta reducción fue medida como el cambio en el ITSm respecto a la situación basal (media ± DS) 0,8 ± 2,5 en el grupo de placebo (en la semana 24) frente a 0,0 ± 1,9; (p < 0,001), en el grupo de adalimumab (en la semana 48).
De los pacientes en tratamiento con adalimumab que en la semana 48 de tratamiento no mostraron progresión radiográfica respecto a la situación basal (n = 102), el 84% tampoco mostró progresión radiográfica tras 144 semanas de tratamiento. En la semana 24 del ensayo, los pacientes tratados con adalimumab mostraron una mejoría estadísticamente significativa en el rendimiento físico comparados con el grupo placebo. Esta mejoría en el rendimiento físico se evaluó con los cuestionarios HAQ y de salud abreviado (SF 36) Short Form Health Survey. La mejora en el rendimiento físico continuó durante la fase abierta de extensión del ensayo hasta la semana 136.
Psoriasis
Se valoró la seguridad y eficacia de adalimumab en pacientes adultos con psoriasis en placas (ASC ≥ 10% e Índice de Gravedad y Área de Psoriasis (PASI – Psoriasis Area and Severity Index) ≥ 12 o ≥ 10) que eran candidatos para tratamiento sistémico o fototerapia en ensayos doble ciego aleatorizados. El 73% de los pacientes reclutados en los ensayos de psoriasis I y II habían recibido previamente tratamiento sistémico o fototerapia. Se estudió también la seguridad y eficacia de adalimumab en pacientes adultos con psoriasis crónica en placas de moderada a grave con psoriasis de mano y/o pie concomitante que eran candidatos para tratamiento sistémico en un ensayo aleatorizado doble ciego (ensayo de psoriasis III). En el ensayo clínico Psoriasis I (REVEAL) se evaluaron 1.212 pacientes dentro de tres períodos de tratamiento. En el período A los pacientes recibieron placebo o una dosis inicial de 80 mg de adalimumab seguido de 40 mg en semanas alternas, comenzando en la semana 1 después de la dosis inicial. Después de 16 semanas de tratamiento, los pacientes que alcanzaron como mínimo una respuesta PASI 75 (mejora de la puntuación PASI de al menos el 75% respecto al valor inicial), entraron en el período abierto B y recibieron 40 mg de adalimumab en semanas alternas. Los pacientes que mantuvieron una respuesta ≥ PASI 75 en la semana 33 y que habían sido aleatorizados inicialmente a tratamiento activo en el período A, fueron re-aleatorizados en el período C para recibir 40 mg de adalimumab en semanas alternas o placebo durante otras 19 semanas. Considerando todos los grupos de tratamiento, la puntuación PASI media inicial fue de 18,9 y la valoración global del médico al inicio (PGA – Physician´s Global Assessment) abarcó desde “moderado” (53% de los pacientes incluidos) a “grave” (41%) o “muy grave” (6%). El ensayo clínico Psoriasis II (CHAMPION) comparó la eficacia y seguridad de adalimumab frente a metotrexato y placebo en 271 pacientes. Los pacientes recibieron placebo, una dosis inicial de metotrexato de 7,5 mg que se fue incrementando hasta la semana 12, con un máximo de 25 mg, o una dosis inicial de 80 mg de adalimumab seguida de 40 mg en semanas alternas (comenzando una semana después de la dosis inicial) durante 16 semanas. No se dispone de datos comparativos de adalimumab y metotrexato pasadas las 16 semanas de tratamiento. A los pacientes en tratamiento con metotrexato que consiguieron una respuesta ≥ PASI 50 a la semana 8 y/o 12 no se les realizaron incrementos adicionales de dosis. A lo largo de todos los grupos de tratamiento, la puntuación media PASI inicial era 19,7 y la puntuación PGA inicial comprendía desde “media” (< 1%) a “moderada” (48%), a “grave” (46%) o a “muy grave” (6%).
Los pacientes que participaron en todos los estudios de psoriasis fase 2 y fase 3 fueron candidatos para ser incluidos en un estudio de extensión abierto, en el que recibieron adalimumab durante al menos 108 semanas adicionales.
En los ensayos de psoriasis I y II, la variable principal de eficacia fue la proporción de pacientes que consiguieron respuesta PASI 75 respecto al valor inicial en la semana 16 (ver Tablas 20 y 21).
|
Tabla 20. Ensayo Ps I (REVEAL) resultados de eficacia a las 16 semanas |
||
|
Placebo n (%) |
40 mg de adalimumab en semanas alternas N = 814 n (%) |
|
|
≥ PASI 75a |
26 (6,5) |
578 (70,9)b |
|
PASI 100 |
3 (0,8) |
163 (20,0)b |
|
PGA: Aclaramiento total/mínimo |
17 (4,3) |
506 (62,2)b |
|
a Porcentaje de pacientes que consiguieron respuesta PASI 75 calculada como ratio ajustado por centro b p < 0,001, adalimumab versus placebo |
||
|
Tabla 21. Ensayo Ps II (CHAMPION) Resultados de eficacia a las 16 semanas |
|||
|
Placebo N = 53 n (%) |
MTX N = 110 n (%) |
40 mg de adalimumab en semanas alternas N = 108 n (%) |
|
|
≥ PASI 75 |
10 (18,9) |
39 (35,5) |
86 (79,6)a,b |
|
PASI 100 |
1 (1,9) |
8 (7,3) |
18 (16,7)c,d |
|
PGA: Aclaramiento total/mínimo |
6 (11,3) |
33 (30,0) |
79 (73,1)a,b |
|
a p < 0,001 adalimumab versus placebo b p < 0,001 adalimumab versus metotrexato c p < 0,01 adalimumab versus placebo d p < 0,05 adalimumab versus metotrexato |
|||
En el ensayo de psoriasis I, el 28% de pacientes respondedores PASI 75 re-aleatorizados a placebo en la semana 33 experimentaron una “pérdida de respuesta adecuada” (puntuación PASI entre las semanas 33 y 52 resultante en < PASI 50 respecto al valor inicial, con un incremento mínimo de 6 puntos relativa a la semana 33), comparado con el 5% que continuaron con adalimumab, p < 0,001. De los pacientes que dejaron de responder adecuadamente después de la re-aleatorización a placebo e incluidos en la extensión abierta del ensayo, el 38% (25/66) y el 55% (36/66) recuperaron la respuesta PASI 75 después de 12 y 24 semanas de tratamiento, respectivamente.
Un total de 233 respondedores PASI 75 en las semanas 16 y 33 recibieron tratamiento continuo con adalimumab durante 52 semanas en el estudio de psoriasis I, y continuaron con adalimumab en el estudio de extensión abierto. Las tasas de respuesta PASI 75 y PGA sin lesiones o mínimas lesiones en estos pacientes fue de 74,7% y 59,0%, respectivamente, después de 108 semanas de tratamiento abierto (un total de 160 semanas). En un análisis en el cual todos los pacientes que salieron del estudio por efectos adversos o falta de eficacia, o quienes aumentaron la dosis, fueron considerados no respondedores, los índices de respuesta PASI 75 y PGA “sin lesiones” o “mínimas lesiones” después de 108 semanas adicionales de tratamiento abierto (total de 160 semanas) fue de 69,6% y 55,7%, respectivamente. Un total de 347 respondedores estables participaron en una evaluación de retirada y re-tratamiento en un estudio de extensión abierto. Durante el período de retirada, los síntomas de psoriasis reaparecieron con un tiempo medio de recaída (descenso a PGA “moderado” o peor) de aproximadamente 5 meses. Ninguno de estos pacientes experimentó un rebote durante el período de retirada. Un total del 76,5% (218/285) de los pacientes que entraron en el período de retratamiento tuvieron una respuesta PGA de “sin lesiones” o “mínimas lesiones” después de 16 semanas de retratamiento, independientemente de si recayeron o no durante la retirada (69,1% [123/178] y 88,8% [95/107] para los pacientes que recayeron y no recayeron durante la retirada, respectivamente). El perfil de seguridad observado durante el retratamiento fue similar al de antes de la retirada.
El DLQI (Dermatology Life Quality Index – índice de calidad de vida en dermatología) demostró mejoras significativas en la semana 16 respecto al nivel basal comparado con placebo (ensayos I y II) y metotrexato (ensayo II). En el ensayo I las mejoras en la puntuación del resumen de los componentes físico y mental del SF-36 también fueron significativas comparadas con placebo.
En una extensión abierta del ensayo, en aquellos pacientes que habían incrementado la dosis de 40 mg en semanas alternas a 40 mg semanales debido a una respuesta PASI inferior al 50%, 92 de 349 pacientes (26,4%) y 132 de 349 pacientes (37,8%) consiguieron respuesta PASI 75 en las semanas 12 y 24, respectivamente.
El ensayo de psoriasis III (REACH) comparó la eficacia y seguridad de adalimumab versus placebo en 72 pacientes con psoriasis crónica en placas de moderada a grave y psoriasis de mano y/o pie. Los pacientes recibieron una dosis inicial de 80 mg de adalimumab seguida de 40 mg en semanas alternas (comenzando una semana después de la dosis inicial) o placebo durante 16 semanas. En la semana 16, una proporción estadísticamente significativa mayor de pacientes que recibieron adalimumab, obtuvieron una PGA de “sin lesiones” a “casi sin lesiones” para manos y/o pies comparada con los pacientes que recibieron placebo (30,6% versus 4,3%, respectivamente [P = 0,014]).
En el ensayo Psoriasis IV se comparó la eficacia y seguridad de adalimumab frente a placebo en 217 pacientes adultos con psoriasis ungueal de moderada a grave. Los pacientes recibieron una dosis inicial de 80 mg de adalimumab seguido de 40 mg en semanas alternas (comenzando una semana después de la dosis inicial) o placebo durante 26 semanas seguido de un período de tratamiento abierto de adalimumab durante 26 semanas más. La valoración de la afectación ungueal de la psoriasis incluyó el Índice de Gravedad de la Psoriasis Ungueal Modificado (mNAPSI), la Evaluación Global del Médico de la Psoriasis Ungueal (PGA-F) y el Índice de Gravedad de la Psoriasis Ungueal (NAPSI) (ver Tabla 22). Adalimumab demostró un beneficio para el paciente en el tratamiento de la psoriasis ungueal con diferentes grados de afectación cutánea (ASC ≥ 10% (60% de los pacientes) y ASC < 10% y ≥ 5% (40% de los pacientes)).
|
Tabla 22. Ensayo Ps IV resultados de eficacia a las semanas 16, 26 y 52 |
|||||
|
Variable |
Semana 52 Placebo-Control |
Semana 16 Placebo-Control |
Semana 26 abierto |
||
|
Placebo N = 108 |
Adalimumab 40 mg en semanas alternas N = 109 |
Placebo N = 108 |
Adalimumab 40 mg en semanas alternas N = 109 |
Adalimumab 40 mg en semanas alternas N = 80 |
|
|
≥ mNAPSI 75 (%) |
2,9 |
26,0a |
3,4 |
46,6a |
65,0 |
|
PGA-F sin lesiones/mínimas lesiones y ≥ 2 grados de mejoría (%) |
2,9 |
29,7a |
6,9 |
48,9a |
61,3 |
|
Cambio porcentual en la puntuación NAPSI (%) |
-7,8 |
-44,2a |
-11,5 |
-56,2a |
-72,2 |
|
a p< 0,001, adalimumab vs. placebo |
|||||
Los pacientes tratados con adalimumab mostraron mejoría estadísticamente significativa en la semana 26 en comparación con placebo en el DLQI.
Psoriasis pediátrica en placas
La eficacia de adalimumab fue evaluada en un ensayo aleatorizado, doble ciego y controlado de 114 pacientes pediátricos desde los 4 años de edad con psoriasis crónica en placas grave (definida por un PGA ≥ 4 o un ASC > 20% o > 10% con lesiones muy gruesas o con una respuesta PASI ≥ 20 o ≥ 10 con afectación clínica relevante en cara, genitales o manos/pies) con un control inadecuado con tratamiento tópico, helioterapia o fototerapia.
Se administró a los pacientes adalimumab 0,8 mg/kg (hasta 40 mg) o 0,4 mg/kg (hasta 20 mg) en semanas alternas, o metotrexato (MTX) 0,1 - 0,4 mg/kg semanalmente (hasta 25 mg). En la semana 16, el número de pacientes aleatorizados al tratamiento con adalimumab 0,8 mg/kg con respuesta de eficacia positiva (p. ej: PASI 75) fue mayor que de los pacientes aleatorizados al tratamiento 0,4 mg/kg en semanas alternas o aquellos con MTX.
|
Tabla 23. Resultados de eficacia |
||
|
MTXa N = 37 |
Adalimumab 0,8 mg/kg en semanas alternas N = 38 |
|
|
PASI 75b |
12 (32,4%) |
22 (57,9%) |
|
PGA: Sin lesiones/mínimas lesionesc |
15 (40,5%) |
23 (60,5%) |
|
a MTX = metotrexato b P = 0,027, adalimumab 0,8 mg/kg versus MTX c P = 0,083, adalimumab 0,8 mg/kg versus MTX |
||
A los pacientes que alcanzaron una respuesta PASI 75 y PGA de sin lesiones o mínimas lesiones se les retiró el tratamiento durante un máximo de 36 semanas y fueron monitorizados para evaluar la pérdida del control de la enfermedad (es decir, empeoramiento de PGA en al menos 2 grados). Tras este período de tiempo se reinició el tratamiento con adalimumab 0,8 mg/kg en semanas alternas durante 16 semanas observándose un índice de respuesta muy similar al obtenido previamente en el ensayo doble ciego: respuesta PASI 75 de 78,9% (15 de 19 pacientes) y PGA de sin lesiones o mínimas lesiones de 52,6% (10 de 19 pacientes).
Durante la fase abierta del estudio, las respuestas PASI 75 y el PGA de sin lesiones o mínimas lesiones se mantuvieron durante al menos 52 semanas adicionales sin nuevos hallazgos relevantes de seguridad.
Hidradenitis supurativa
Se evaluó la seguridad y la eficacia de adalimumab en estudios aleatorizados, doble ciego, controlados con placebo y en un estudio de extensión abierto en pacientes adultos con Hidradenitis Supurativa (HS) de moderada a grave que eran intolerantes, tenían contraindicación o falta de respuesta a tratamiento con antibióticos sistémicos durante al menos tres meses. Los pacientes en HS-I y HS-II estaban en un estadio de la enfermedad Hurley II o Hurley III con al menos tres abscesos o nódulos inflamatorios.
En el estudio HS-I (PIONEER I) se evaluó a 307 pacientes en dos períodos de tratamiento. En el Período A, los pacientes recibieron placebo o adalimumab a una dosis inicial de 160 mg, en la semana 0, 80 mg en la semana 2, y 40 mg semanales comenzando en la semana 4 hasta la semana 11. No se permitió el uso concomitante de antibiótico durante el estudio. Después de 12 semanas de tratamiento, los pacientes que habían recibido adalimumab en el Período A fueron re-aleatorizados en el Período B a 1 de 3 grupos de tratamiento (adalimumab 40 mg semanales, adalimumab 40 mg en semanas alternas o placebo de la semana 12 a la semana 35). Los pacientes aleatorizados a placebo en el Período A fueron asignados para recibir adalimumab 40 mg semanales en el Período B.
En el estudio HS-II (PIONEER II) se evaluó a 326 pacientes en dos períodos de tratamiento. En el Período A, los pacientes recibieron placebo o adalimumab a una dosis inicial de 160 mg, en la semana 0, 80 mg en la semana 2, y 40 mg semanales comenzando en la semana 4 hasta la semana 11. Un 19,3% de los pacientes tenían tratamiento inicial continuado con antibióticos orales durante el estudio. Después de 12 semanas de tratamiento, los pacientes que habían recibido adalimumab en el Período A fueron re-aleatorizados en el Período B a 1 de 3 grupos de tratamiento (adalimumab 40 mg semanales, adalimumab 40 mg en semanas alternas o placebo de la semana 12 a la semana 35). Los pacientes aleatorizados al grupo placebo en el Período A fueron asignados para recibir placebo en el Período B.
Los pacientes que participaron en los Estudios HS-I y HS-II fueron reclutados en un estudio de extensión abierto en el que se administraba adalimumab 40 mg semanales. La exposición media en toda la población con adalimumab fue de 762 días. Durante los tres estudios los pacientes utilizaron líquido antiséptico tópico a diario.
Respuesta Clínica
Se evaluó la reducción de las lesiones inflamatorias y la prevención del empeoramiento de abscesos y fistulas drenantes utilizando la respuesta clínica de Hidradenitis Supurativa (HiSCR, reducción del recuento total de abscesos y nódulos inflamatorios de al menos un 50% sin incremento en el recuento de abscesos ni incremento en el recuento de fístulas drenantes respecto al Inicial). La reducción del dolor cutáneo asociado a la HS se evaluó utilizando una Escala de Evaluación Numérica en los pacientes que entraron al estudio con una puntuación basal al inicio de 3 o más en una escala de 11 puntos.
Una proporción significativamente mayor de pacientes tratados con adalimumab versus placebo alcanzó el HiSCR en la semana 12. En la semana 12, una proporción significativamente mayor de pacientes en el Estudio HS-II experimentó una disminución clínicamente relevante en el dolor cutáneo asociado a HS (ver Tabla 24). El riesgo de brote de la enfermedad estaba significativamente reducido en los pacientes tratados con adalimumab durante las 12 semanas iniciales de tratamiento.
|
Tabla 24. Resultados de eficacia a la semana 12, estudios HS-I y II |
||||
|
Estudio HS I |
Estudio HS II |
|||
|
Placebo |
Adalimumab 40 mg semanales |
Placebo |
Adalimumab 40 mg semanales |
|
|
Respuesta clínica de la Hidradenitis Supurativa (HiSCR)a |
N = 154 40 (26,0%) |
N = 153 64 (41,8%)* |
N = 163 45 (27,6%) |
N = 163 96 (58,9%)*** |
|
≥ 30% Reducción en el dolor cutáneob |
N = 109 27 (24,8%) |
N = 122 34 (27,9%) |
N = 111 23 (20,7%) |
N = 105 48 (45,7%)*** |
|
* P < 0,05, ***p < 0,001, adalimumab versus placebo a. De todos los pacientes aleatorizados b. De todos los pacientes con una evaluación inicial de dolor cutáneo asociado a HS ≥ 3, según una Escala de Evaluación Numérica de 0 – 10; 0 = sin dolor cutáneo, 10 = tanto dolor cutáneo como puedas imaginar |
||||
El tratamiento con adalimumab 40 mg semanales redujo significativamente el riesgo de empeoramiento de abscesos y fistulas drenantes. En las 12 primeras semanas de tratamiento en los Estudios HS-I y HS-II, de manera aproximada dos veces la proporción de pacientes en el grupo de placebo comparado con aquellos en el grupo de adalimumab experimentaron un empeoramiento de abscesos (23,0% versus 11,4%, respectivamente) y fístulas drenantes (30,0% versus 13,9%, respectivamente). En la semana 12 se demostraron mejorías superiores desde el inicio comparado con placebo en la calidad de vida relacionada con la salud específica para piel, medida por el Índice de Calidad de Vida en Dermatología (DLQI, Estudios HS-I y HS-II), la satisfacción global del paciente con el tratamiento farmacológico medida por el Cuestionario de Satisfacción con el Tratamiento – medicación (TSQM, Estudios HS-I y HS-II), y la salud física medida por la puntuación del componente físico de la SF-36 (estudio HS-I).
En la semana 12, en los pacientes con al menos una respuesta parcial a adalimumab 40 mg semanales, la tasa HiSCR en la semana 36 fue superior entre aquellos pacientes que continuaron en tratamiento semanal con adalimumab que en aquellos pacientes en los que se redujo la frecuencia de la dosis a semanas alternas o en los que se interrumpió el tratamiento (ver Tabla 25).
|
Tabla 25. Proporción de pacientesa que alcanzaron respuesta HiSCRb en las semanas 24 y 36 después de la reasignación de tratamiento desde adalimumab semanal en la semana 12 |
|||
|
Placebo (retirada de tratamiento) N = 73 |
Adalimumab 40 mg semanas alternas |
Adalimumab 40 mg semanales N = 70 |
|
|
Semana 24 |
24 (32,9%) |
36 (51,4%) |
40 (57,1%) |
|
Semana 36 |
22 (30,1%) |
28 (40,0%) |
39 (55,7%) |
|
a. Pacientes con al menos una respuesta parcial a adalimumab 40 mg semanales después de 12 semanas de tratamiento b. Pacientes que cumplieron el criterio especificado en protocolo para pérdida de respuesta o no mejoría y que requirieron abandonar los estudios y ser contabilizados como no-respondedores |
|||
En aquellos pacientes que tuvieron al menos una respuesta parcial en la semana 12, y que recibieron tratamiento semanal continuo con adalimumab, el índice HiSCR en la semana 48 fue del 68,3% y del 65,1% en la semana 96. No se identificaron nuevos hallazgos de seguridad durante el tratamiento a largo plazo con adalimumab 40 mg semanal durante 96 semanas.
En aquellos pacientes en los que el tratamiento con adalimumab fue retirado en la semana 12 en los Estudios HS-I y HS-II, el índice HiSCR alcanzó niveles similares a los observados antes de la retirada 12 semanas después de la reintroducción de adalimumab 40 mg semanales (56,0%).Hidradenitis supurativa en adolescentes
No hay ensayos clínicos con adalimumab en pacientes adolescentes con HS. La eficacia de adalimumab para el tratamiento de pacientes adolescentes con HS se predice en base a la eficacia demostrada y la relación exposición/respuesta en pacientes adultos con HS y la probabilidad de que el curso de la enfermedad, la fisiopatología, y los efectos del fármaco sean sustancialmente similares a los de adultos con los mismos niveles de exposición. La seguridad de la dosis recomendada de adalimumab en la población adolescente con HS está basada en el perfil de seguridad del conjunto de indicaciones de adalimumab en pacientes adultos y pediátricos a dosis similares o más frecuentes (ver sección Propiedades farmacocinéticas). Enfermedad de Crohn
Se valoró la seguridad y la eficacia de adalimumab en más de 1.500 pacientes con enfermedad de Crohn moderada a grave (Índice de Actividad de la Enfermedad de Crohn (CDAI) ≥ 220 y ≤ 450) en ensayos aleatorizados doble ciego controlados con placebo. Se permitieron tratamientos con dosis estables de aminosalicilatos, corticoesteroides y/o agentes inmunomoduladores, y el 80% de los pacientes continuaron recibiendo como mínimo uno de estos medicamentos.
Se evaluó la inducción de la remisión clínica (definida como CDAI < 150) en dos ensayos, ensayo de enfermedad de Crohn I (CLASSIC I) y ensayo de enfermedad de Crohn II (GAIN). En el ensayo de enfermedad de Crohn I, 299 pacientes que no habían recibido tratamiento previo con antagonistas del TNF, fueron aleatorizados a uno de los siguientes 4 grupos de tratamiento: placebo en las semanas 0 y 2, 160 mg de adalimumab en la semana 0 y 80 mg en la semana 2, 80 mg en la semana 0 y 40 mg en la semana 2, o bien 40 mg en la semana 0 y 20 mg en la semana 2. En el ensayo de enfermedad de Crohn II, 325 pacientes que habían dejado de responder o eran intolerantes a infliximab fueron aleatorizados para recibir 160 mg de adalimumab en la semana 0 y 80 mg en la semana 2 o bien placebo en las semanas 0 y 2. Los pacientes no-respondedores primarios fueron excluidos de los ensayos y por tanto no fueron evaluados.
En el ensayo de enfermedad de Crohn III (CHARM) se evaluó el mantenimiento de la remisión clínica. En el ensayo de enfermedad de Crohn III, 854 pacientes recibieron en el período abierto 80 mg en la semana 0 y 40 mg en la semana 2. En la semana 4 los pacientes fueron aleatorizados a 40 mg en semanas alternas, 40 mg semanales o placebo, con una duración total del ensayo de 56 semanas. Los pacientes que respondieron clínicamente (disminución en CDAI ≥ 70) en la semana 4 fueron estratificados y analizados por separado de aquellos que no habían respondido en la semana 4. La reducción de la dosis de corticoesteroides se permitió después de la semana 8.
Las tasas de inducción de la remisión y respuesta de los ensayos de enfermedad de Crohn I y II se presentan en la Tabla 26.
|
Tabla 26. Inducción de remisión clínica y |
|||||
|
Ensayo de enfermedad de Crohn I: pacientes sin tratamiento previo con Infliximab |
Ensayo de enfermedad de Crohn II: pacientes con tratamiento previo con Infliximab |
||||
|
Placebo N = 74 |
Adalimumab 80/40 mg N = 75 |
Adalimumab 160/80 mg N = 76 |
Placebo N = 166 |
Adalimumab 160/80 mg N = 159 |
|
|
Semana 4 |
|||||
|
Remisión Clínica |
12% |
24% |
36%* |
7% |
21%* |
|
Respuesta Clínica (CR-100) |
24% |
37% |
49%** |
25% |
38%** |
|
Todos los valores-p se refieren a la comparación del par de valores proporcionales para adalimumab versus placebo * p < 0,001 ** p < 0,01 |
|||||
Se observaron incidencias similares de remisión para los regímenes de inducción 160/80 mg y 80/40 mg en la semana 8, siendo los efectos adversos más frecuentes en el grupo 160/80 mg.
En el ensayo de enfermedad de Crohn III, en la semana 4, el 58% de pacientes (499/854) presentaban respuesta clínica, y fueron evaluados en el análisis primario. En aquellos pacientes que presentaban respuesta clínica en la semana 4, el 48% habían recibido previamente tratamiento con otro antagonista del TNF. Las tasas de mantenimiento de la remisión y la respuesta se presentan en la Tabla 27. Los resultados de remisión clínica permanecieron relativamente constantes, independientemente de si había un tratamiento previo con antagonistas del TNF o no.
Las hospitalizaciones y cirugías relacionadas con la enfermedad se redujeron de forma estadísticamente significativa con adalimumab comparado con placebo en la semana 56.
|
Tabla 27. Mantenimiento de la remisión clínica y la respuesta (porcentaje de pacientes) |
|||
|
Placebo |
40 mg adalimumab en semanas alternas |
40 mg adalimumab semanales |
|
|
Semana 26 |
N = 170 |
N = 172 |
N = 157 |
|
Remisión clínica |
17% |
40%* |
47%* |
|
Respuesta clínica (CR-100) |
27% |
52%* |
52%* |
|
Pacientes con remisión libre de esteroides durante ≥90 díasa |
3% (2/66) |
19% (11/58)** |
15% (11/74)** |
|
Semana 56 |
N = 170 |
N = 172 |
N = 157 |
|
Remisión clínica |
12% |
36%* |
41%* |
|
Respuesta clínica (CR-100) |
17% |
41%* |
48%* |
|
Pacientes con remisión libre de esteroides durante ≥ 90 díasa |
5% (3/66) |
29% (17/58)* |
20% (15/74)** |
|
* p < 0,001 comparación del par de valores proporcionales para adalimumab versus placebo ** p < 0,02 comparación del par de valores proporcionales para adalimumab versus placebo a De aquellos que recibían corticoesteroides al inicio del ensayo |
|||
Entre los pacientes que no respondieron en la semana 4, el 43% de los pacientes en tratamiento de mantenimiento con adalimumab respondió hasta la semana 12, comparado con el 30% de los pacientes con placebo. Estos resultados sugieren que algunos pacientes que no habían respondido en la semana 4 se benefician del tratamiento continuado de mantenimiento hasta la semana 12. El tratamiento continuado pasada la semana 12 no dio lugar a una tasa de respuesta significativamente superior (ver sección Posología y forma de administración).
Se realizó un seguimiento durante 3 años en tratamiento abierto con adalimumab en 117/276 pacientes del ensayo I de enfermedad de Crohn y 272/777 pacientes de los ensayos II u III de enfermedad de Crohn. De estos, 88 y 189 pacientes, respectivamente, continuaron en remisión clínica. Se mantuvo la respuesta clínica (CR-100) en 102 y 233 pacientes, respectivamente.
Calidad de vida
En los ensayos de enfermedad de Crohn I y II, se consiguió una mejora estadísticamente significativa de la puntuación total en el Cuestionario de la Enfermedad Inflamatoria Intestinal (IBDQ) específico de la patología, realizado en la semana 4 en pacientes aleatorizados al tratamiento con adalimumab 80/40 mg y 160/80 mg comparado con placebo. Estos resultados se pudieron reproducir en las semanas 26 y 56 en los grupos de tratamiento con adalimumab comparado con placebo durante el ensayo de enfermedad de Crohn III.
Enfermedad de Crohn pediátrica
Se valoró adalimumab mediante un ensayo clínico multicéntrico, aleatorizado, doble ciego diseñado para evaluar la eficacia y seguridad del tratamiento de inducción y mantenimiento con dosis dependientes del peso corporal (< 40 kg o ≥ 40 kg) en 192 pacientes pediátricos con edades comprendidas entre 6 y 17 años (inclusive) , con Enfermedad de Crohn (EC) de moderada a grave definida como una puntuación en el índice de Actividad de la Enfermedad de Crohn Pediátrica (PCDAI) > 30. Los sujetos tenían que haber fallado a tratamiento convencional (incluyendo un corticoesteroide y/o un inmunomodulador) para EC. Además, previamente los sujetos podían haber perdido respuesta o sido intolerantes a infliximab.
Todos los sujetos recibieron un tratamiento de inducción abierto con dosis dependientes del peso corporal basal: 160 mg en la semana 0 y 80 mg en la semana 2 para pacientes ≥ 40 kg, y 80 mg y 40 mg, respectivamente, para pacientes con peso < 40 kg.
En la semana 4, los sujetos fueron aleatorizados 1:1 según su peso corporal en ese momento a los regímenes de mantenimiento a dosis bajas o a dosis estándar que se muestran en la Tabla 28.
|
Tabla 28. Régimen de mantenimiento |
||
|
Peso del paciente |
Dosis bajas |
Dosis estándar |
|
< 40 kg |
10 mg semanas alternas |
20 mg semanas alternas |
|
≥ 40 kg |
20 mg semanas alternas |
40 mg semanas alternas |
Resultados de eficacia
La variable principal del estudio fue la remisión clínica en la semana 26, definida como una puntuación en el PCDAI ≤ 10.
Las tasas de remisión clínica y de respuesta clínica (definidas como una reducción en la puntuación del PCDAI de al menos 15 puntos desde el basal) se presentan en la Tabla 29. Las tasas de interrupción de corticosteroides o inmunomoduladores se presentan en la Tabla 30.
|
Tabla 29. Estudio de EC pediátrica PCDAI remisión y respuesta clínica |
|||
|
Dosis estándar 40/20 mg semanas alternas N = 93 |
Dosis bajas 20/10 mg semanas alternas N = 95 |
Valor-p* |
|
|
Semana 26 |
|||
|
Remisión clínica |
38,7% |
28,4% |
0,075 |
|
Respuesta clínica |
59,1% |
48,4% |
0,073 |
|
Semana 52 |
|||
|
Remisión clínica |
33,3% |
23,2% |
0,100 |
|
Respuesta clínica |
41,9% |
28,4% |
0,038 |
|
* Valor-p para la comparación dosis estándar versus dosis baja |
|||
|
Tabla 30. Estudio de EC pediátrica interrupción de corticoesteroides o inmunomoduladores y remisión de fistulas |
|||
|
Dosis estándar 40/20 mg semanas alternas |
Dosis bajas 20/10 mg semanas alternas |
Valor-p1 |
|
|
Interrupción de corticoesteroides |
N = 33 |
N = 38 |
|
|
Semana 26 |
84,8% |
65,8% |
0,066 |
|
Semana 52 |
69,7% |
60,5% |
0,420 |
|
Interrupción de inmunomoduladores2 |
N = 60 |
N = 57 |
|
|
Semana 52 |
30,0% |
29,8% |
0,983 |
|
Remisión de fistulas3 |
N = 15 |
N = 21 |
|
|
Semana 26 |
46,7% |
38,1% |
0,608 |
|
Semana 52 |
40,0% |
23,8% |
0,303 |
|
1 Valor-p para la comparación dosis estándar versus dosis bajas 2 El tratamiento con inmunosupresores solo se puede interrumpir en o después de la semana 26 a criterio del investigador si el sujeto cumple los criterios de respuesta clínica 3 Definido como cierre de todas las fistulas que fueron drenando desde el basal hasta al menos dos visitas consecutivas post-basal |
|||
En ambos grupos de tratamiento se observaron aumentos estadísticamente significativos (mejoras) desde el basal hasta las semanas 26 y 52 en el Índice de Masa Corporal y velocidad de altura.
En ambos grupos de tratamiento se observaron también mejoras estadística y clínicamente significativas para parámetros de calidad de vida (incluyendo IMPACT III). 100 pacientes (n = 100) del estudio de enfermedad de Crohn pediátrica continuaron en una extensión abierta del estudio a largo plazo. Tras 5 años de tratamiento con adalimumab, el 74,0% de los 50 pacientes que siguieron en el estudio (37/50) continuaron en remisión clínica, y el 92,0% de los pacientes (46/50) continuaron en respuesta clínica según PCDAI.
Colitis ulcerosa
La seguridad y eficacia de múltiples dosis de adalimumab se evaluó en pacientes adultos con colitis ulcerosa activa de moderada a grave (puntuación Mayo 6 a 12 con subpuntuación endoscópica de 2 a 3) en ensayos aleatorizados controlados con placebo y doble ciego. En el estudio UC-I, se aleatorizó a 390 pacientes sin tratamiento previo con el antagonista de TNF que recibieron bien placebo en las semanas 0 y 2; bien 160 mg de adalimumab en la semana 0 seguidos de 80 mg en la semana 2; o bien 80 mg de adalimumab en la semana 0 seguidos de 40 mg en la semana 2. Después de la semana 2, los pacientes en ambos brazos de adalimumab recibieron 40 mg cada dos semanas. Se evaluó la remisión clínica (definida como índice Mayo puntuación ≤ 2 con ninguna subpuntuación > 1) en la semana 8.
En el estudio UC-II, se administró a 248 pacientes 160 mg de adalimumab en la semana 0, 80 mg en la semana 2 y después 40 mg cada dos semanas; y se administró placebo a 246. Se evaluaron los resultados clínicos de la inducción de la remisión en la semana 8 y el mantenimiento de la remisión en la semana 52.
Los pacientes inducidos con 160/80 mg de adalimumab alcanzaron remisión clínica en la semana 8 en mayores porcentajes de forma estadísticamente significativa frente a placebo en el estudio UC-I (18% versus 9%, respectivamente, p = 0,031) y en el estudio UC-II (17% versus 9%, respectivamente, p = 0,019). En el estudio UC-II, entre aquellos tratados con adalimumab que estaban en remisión en la semana 8, 21/41 (51%) estaban en remisión en la semana 52.
Los resultados del estudio poblacional UC-II se muestran en la Tabla 31.
|
Tabla 31. Respuesta, remisión y curación de la mucosa en el ensayo UC-II (porcentaje de pacientes) |
||
|
Placebo |
Adalimumab 40 mg en semanas alternas |
|
|
Semana 52 |
N = 246 |
N = 248 |
|
Respuesta clínica |
18% |
30%* |
|
Remisión clínica |
9% |
17%* |
|
Curación de la mucosa |
15% |
25%* |
|
Remisión libre de esteroides ≥ 90 díasa |
6% (N = 140) |
13%* (N = 150) |
|
Semanas 8 y 52 |
||
|
Respuesta mantenida |
12% |
24%** |
|
Remisión mantenida |
4% |
8%* |
|
Curación mantenida de la mucosa |
11% |
19%* |
|
La Remisión Clínica es una puntuación Mayo ≤ 2 con ninguna subpuntuación > 1; La Respuesta Clínica se reduce en una puntuación Mayo respecto al estado basal ≥ 3 puntos y ≥ 30%, más una reducción de la subpuntación del sangrado rectal [RBS] ≥ 1 o una RBS absoluta de 0 o 1; * p < 0,05 se refiere a la comparación del par de valores proporcionales para adalimumab versus placebo ** p < 0,001 se refiere a la comparación del par de valores proporcionales para adalimumab versus placebo a En aquellos que recibían corticoesteroides en estado basal |
||
De aquellos pacientes que respondieron en la semana 8, el 47% estaban en respuesta, el 29% estaban en remisión, el 41% presentaban curación de la mucosa y el 20% estuvieron en remisión libre de esteroides por ≥ 90 días en la semana 52.
Aproximadamente, en el 40% de los pacientes del estudio UC-II habían fracasado tratamientos previos anti-TNF con infliximab. La eficacia de adalimumab se redujo en estos pacientes en comparación con los pacientes naïve (sin tratamiento previo) para anti-TNF. Entre los pacientes en los que habían fracasado tratamientos previos anti-TNF en la semana 52 estaban en remisión un 3% con placebo y un 10% con adalimumab.
Los pacientes de los estudios UC-I y UC-II tenían la opción de formar parte en una extensión del estudio abierto a largo plazo (UC-III). Después de 3 años de tratamiento con adalimumab, el 75% (301/402) continuaban estando en remisión clínica por puntuación Mayo parcial.
Tasas de hospitalización
Durante las 52 semanas de los estudios UC-I y UC-II, se observaron tasas menores de hospitalizaciones por cualquier causa y de hospitalizaciones relacionadas con la UC en pacientes del brazo de tratamiento con adalimumab comparado con los pacientes del brazo placebo. El número de hospitalizaciones por cualquier causa en el grupo de tratamiento con adalimumab fue de 0,18 por paciente/año versus 0,26 por paciente/año en el grupo placebo y las cifras correspondientes para las hospitalizaciones relacionadas con la UC fue de 0,12 por paciente/año versus 0,22 por paciente/año.
Calidad de vida
En el estudio UC-II, el tratamiento con adalimumab consiguió una mejoría en la puntuación del Cuestionario de la Enfermedad Inflamatoria Intestinal (IBDQ).
Uveítis
Se evaluó la seguridad y la eficacia de adalimumab en pacientes adultos con uveítis no infecciosa intermedia y posterior, y panuveítis, excluyendo pacientes con uveítis anterior aislada, en dos estudios aleatorizados, doble ciego, controlados con placebo (UV I y II). Los pacientes recibieron placebo o adalimumab a una dosis inicial de 80 mg seguido de 40 mg en semanas alternas comenzando una semana después de la dosis inicial. Se permitieron dosis estables concomitantes con un inmunosupresor no biológico.
En el estudio UV I se evaluaron 217 pacientes con uveítis activa a pesar del tratamiento con corticoesteroides (prednisona oral a una dosis de entre 10 y 60 mg/día). Al comienzo del estudio todos los pacientes recibieron una dosis estandarizada de 60 mg/día de prednisona durante 2 semanas seguido de una pauta de reducción obligatoria, con una discontinuación completa de corticoesteroides en la semana 15.
En el estudio UV II se evaluaron 226 pacientes con uveítis inactiva que requerían tratamiento crónico basal con corticoesteroides (de 10 a 35 mg/día de prednisona oral) para controlar su enfermedad. Posteriormente, los pacientes se sometieron a una pauta de reducción obligatoria con una discontinuación completa de corticoesteroides en la semana 19.
La variable principal de eficacia en ambos estudios fue “tiempo hasta fallo de tratamiento”. Se definió el fallo a tratamiento mediante un resultado multi-componente basado en lesiones vasculares inflamatorias coriorretinianas y/o retinianas, grado de celularidad en la cámara anterior (CA), grado de turbidez vítrea (TV) y mejor agudeza visual corregida (MAVC).
Los pacientes que completaron los estudios UV I y UV II fueron elegibles para inscribirse en un estudio de extensión a largo plazo no controlado con una duración originalmente planificada de 78 semanas. A los pacientes se les permitió continuar con la medicación del estudio más allá de la semana 78 hasta que tuvieron acceso a adalimumab.
Respuesta clínica
Los resultados de ambos estudios demostraron una reducción estadísticamente significativa del riesgo de fallo a tratamiento en pacientes tratados con adalimumab versus aquellos pacientes que recibieron placebo (ver Tabla 32). Ambos estudios demostraron un efecto temprano y sostenido de adalimumab en la tasa de fallo a tratamiento versus placebo (ver Figura 4).
|
Tabla 32. Tiempo hasta fallo a tratamiento |
||||||
|
Análisis tratamiento |
N |
Fallo N (%) |
Tiempo medio hasta fallo (meses) |
HRa |
95% IC para HRa |
Valor-pb |
|
Tiempo hasta fallo a tratamiento hasta o después de la semana 6 en el estudio UV I Análisis primario (ITT) |
||||||
|
Placebo |
107 |
84 (78,5) |
3,0 |
-- |
-- |
-- |
|
Adalimumab |
110 |
60 (54,5) |
5,6 |
0,50 |
0,36 - 0,70 |
< 0,001 |
|
Tiempo hasta fallo a tratamiento hasta o después de la semana 2 en el estudio UV II |
||||||
|
Análisis tratamiento |
N |
Fallo N (%) |
Tiempo medio hasta fallo (meses) |
HRa |
95% IC para HRa |
Valor-pb |
|
Análisis primario (ITT) |
||||||
|
Placebo |
111 |
61 (55,0) |
8,3 |
-- |
-- |
-- |
|
Adalimumab |
115 |
45 (39,1) |
NEc |
0,57 |
0,39 - 0,84 |
0,004 |
|
Nota: El fallo a tratamiento hasta o después de la semana 6 (estudio UV I), o hasta o después de la semana 2 (estudio UV II), se contabilizó como evento. Las retiradas por razones diferentes al fallo a tratamiento fueron monitorizadas hasta el momento de la retirada a HR de adalimumab versus placebo de regresión proporcional de riesgos con el tratamiento como factor b Valor p bilateral del test Log Rank c NE = no estimable. Menos de la mitad de que un sujeto en riesgo tuviera un evento |
||||||
Figura 4. Curvas de Kaplan-Meier resumiendo el tiempo hasta fallo a tratamiento en o después de la semana 6 (estudio UV I) o de la semana 2 (estudio UV II)
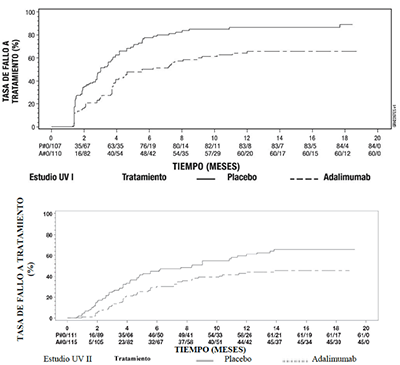
Nota: P# = Placebo (número de eventos/número en riesgo); A# = Adalimumab (número de eventos/número en riesgo).
En el estudio UV I se observaron diferencias estadísticamente significativas para cada componente del fallo a tratamiento en favor de adalimumab versus placebo. En el estudio UV II, sólo se observaron diferencias estadísticamente significativas para la agudeza visual, pero los otros componentes fueron numéricamente favorables a adalimumab.
De los 424 sujetos incluidos en la extensión no controlada a largo plazo de los Estudios UV I y UV II, 60 de los sujetos se consideraron no elegibles (p.ej., debido a desviaciones o debido a complicaciones secundarias a retinopatía diabética, debido a la cirugía de cataratas o a una vitrectomía) y fueron excluidos del análisis primario de eficacia. De los 364 pacientes restantes, 269 pacientes evaluables (74%) alcanzaron las 78 semanas de tratamiento abierto con adalimumab. Basándose en el enfoque de los datos observados, 216 (80,3%) fueron en inactividad (no lesiones inflamatorias activas, grado de celularidad en la cámara anterior ≤ 0,5+, grado VH ≤ 0,5+) con una dosis concomitante de esteroides ≤ 7,5 mg al día, y 178 (66,2%) estaban en inactividad sin esteroides. La BCVA fue mejorada o mantenida (< 5 letras de deterioro) en el 88,6% de los ojos a la semana 78. Los datos más allá de la semana 78 fueron generalmente, consistentes con estos resultados, pero el número de sujetos inscritos disminuyó después de este tiempo. En general, entre los pacientes que descontinuaron el estudio, el 18% fue debido a efectos adversos, y el 8% fue debido a una respuesta insuficiente al tratamiento de adalimumab.
Calidad de vida
Se midieron los resultados notificados por los pacientes respecto a la funcionalidad relacionada con la visión usando el cuestionario NEI VFQ-25. Adalimumab fue numéricamente favorable para la mayoría de las sub-puntuaciones con diferencias medias estadísticamente significativas para visión general, dolor ocular, visión cercana, salud mental, y puntuación total en el estudio UV I, y para visión general y salud mental en el estudio UV II. En los efectos relacionados con la visión, no hubo resultados numéricamente favorables a adalimumab para visión de color en el estudio UV I y para visión de color, visión periférica y visión cercana en el estudio UV II.
Uveítis pediátrica
La seguridad y la eficacia de adalimumab se evaluaron en un ensayo controlado, aleatorizado, doble ciego con 90 pacientes pediátricos de edades entre 2 y < 18 años con uveítis anterior no infecciosa asociada a AIJ activa, los cuales fueron refractarios a al menos 12 semanas de tratamiento con metotrexato. Los pacientes recibieron placebo, o 20 mg de adalimumab (si < 30 kg) o 40 mg de adalimumab (si ≥ 30 kg) en semanas alternas en combinación con su dosis basal de metotrexato. La variable principal fue “el tiempo hasta fallo al tratamiento”. Los criterios determinantes del fallo fueron un empeoramiento o una no mejora mantenida de la inflamación ocular; una mejora parcial con desarrollo de comorbilidades oculares mantenidas; o un empeoramiento de las comorbilidades, uso de medicamentos concomitantes no permitidos y una suspensión del tratamiento por un largo período de tiempo.
Respuesta clínica
Adalimumab retrasó de forma significativa el tiempo hasta fallo al tratamiento en comparación con el placebo (ver figura 5, P < 0,0001 del log rank test). La mediana del tiempo hasta fallo al tratamiento fue de 24,1 semanas para los pacientes tratados con placebo, mientras que la mediana del tiempo hasta fallo al tratamiento no se pudo estimar para los pacientes tratados con adalimumab porque menos de la mitad de ellos experimentaron fallo al tratamiento. Adalimumab disminuyó significativamente el riesgo de fallo al tratamiento en un 75% respecto a placebo, tal y como muestra el cociente de riesgo (HR = 0,25 [IC del 95%:0,12- 0,49]).
Figura 5: Curva de Kaplan-Meier que resume el tiempo hasta el fallo al tratamiento en el estudio de uveítis pediátrica
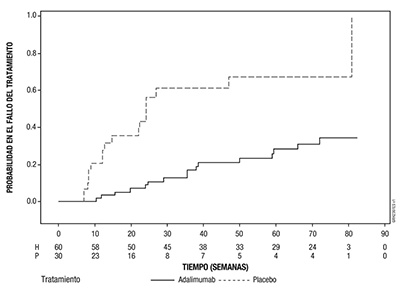
Nota: P = Placebo (Número en riesgo); H = Adalimumab (Número en riesgo).
Inmunogenicidad
Se pueden formar anticuerpos anti-adalimumab durante el tratamiento con adalimumab. La formación de anticuerpos anti-adalimumab se asocia con un incremento en el aclaramiento y una reducción de la eficacia de adalimumab. No existe una correlación aparente entre la presencia de anticuerpos anti-adalimumab y la incidencia de los efectos adversos.
Datos de Artritis Reumatoide (AR) con AMGEVITA Las diferencias en la metodología de ensayo para la medición de la inmunogenicidad no permiten la comparación directa de las tasas de inmunogenicidad de AMGEVITA y adalimumab u otros biológicos en estudios diferentes. En el Estudio 1 de ABP en AR, se determinó la actividad de unión de los anticuerpos anti-medicamento (AAM) a partir de un inmunoensayo puente y la actividad neutralizante de los AAM se determinó a partir de un bioensayo basado en células.
Los pacientes en el Estudio 1 de ABP en AR se sometieron a pruebas para detectar anticuerpos contra adalimumab y AMGEVITA en diferentes puntos de tiempo, durante el período de estudio de 26 semanas. La incidencia de desarrollo de anticuerpos de unión fue 38,3% (101/264) en el grupo con AMGEVITA y 38,2% (100/262) en el grupo con adalimumab. La incidencia de desarrollo de anticuerpos neutralizantes fue 9,1% (24/264) en el grupo con AMGEVITA y 11,1% (29/262) en el grupo con adalimumab. Con base en los datos del Estudio 1 de ABP en AR se encuentra que el perfil de inmunogenicidad de AMGEVITA es similar al de adalimumab.
Datos de Psoriasis (Ps) con AMGEVITA
Las diferencias en la metodología de ensayo para medir inmunogenicidad evitan la comparación directa de inmunogenicidad entre AMGEVITA y adalimumab u otros biológicos en diferentes estudios. En el Estudio 1 de ABP en Ps, se determinó la actividad de unión de los AAM a partir de un inmunoensayo puente y la actividad neutralizante de los AAM se determinó a partir de un bioensayo basado en células.
Los pacientes en el Estudio 1 de ABP en Ps se sometieron a pruebas para detectar anticuerpos contra adalimumab y AMGEVITA en diferentes puntos de tiempo durante el estudio de 52 semanas. La incidencia de desarrollo de anticuerpos de unión durante todo el estudio fue 68,4% (104/152) en el grupo AMGEVITA/AMGEVITA, 74,7% (59/79) en el grupo adalimumab/adalimumab y 72,7% (56/77) en el grupo adalimumab/AMGEVITA. La incidencia de desarrollo de anticuerpos neutralizantes fue 13,8% (21/152) en el grupo AMGEVITA/AMGEVITA, 20,3% (16/79) en el grupo adalimumab/adalimumab y 24,7% (19/77) en el grupo adalimumab/AMGEVITA. El grupo adalimumab/AMGEVITA refleja datos para participantes que recibieron tanto adalimumab como AMGEVITA antes y después del cambio de los participantes con adalimumab a AMGEVITA. Los perfiles de seguridad e inmunogenicidad de los pacientes que cambiaron de adalimumab a AMGEVITA son comparables a los de los pacientes que continuaron con adalimumab hasta completar el estudio (semana 52). Propiedades farmacocinéticas
Absorción y distribución
La absorción y distribución de adalimumab tras la administración subcutánea de una dosis única de 40 mg, fue lenta, alcanzándose las concentraciones plasmáticas máximas a los 5 días después de la administración. La media de biodisponibilidad absoluta de adalimumab fue del 64%, estimada a partir de tres ensayos con una dosis subcutánea única de 40 mg. Tras la administración intravenosa de dosis únicas en un rango de 0,25 a 10 mg/kg, las concentraciones fueron proporcionales a la dosis. Tras la administración de dosis de 0,5 mg/kg (~40 mg), el aclaramiento osciló en el rango de 11 a 15 mL/hora, el volumen de distribución (Vss) entre 5 y 6 litros, y la semivida media de eliminación terminal fue aproximadamente, dos semanas. Las concentraciones de adalimumab en el líquido sinovial, determinadas en varios pacientes con artritis reumatoide, oscilaron entre el 31-96% de las plasmáticas.
Tras la administración subcutánea de 40 mg de adalimumab en semanas alternas en pacientes adultos con Artritis Reumatoide (AR), la media de las concentraciones en el punto mínimo en el estado estacionario fue aproximadamente 5 mcg/mL (sin tratamiento concomitante con metotrexato) y 8 a 9 mcg/mL (con metotrexato concomitante). Los niveles plasmáticos de adalimumab en el estado estacionario aumentaron más o menos proporcionalmente con la dosis tras la administración subcutánea de 20, 40 y 80 mg en semanas alternas y cada semana.
Tras la administración subcutánea en semanas alternas de 24 mg/m2 (hasta un máximo de 40 mg) en pacientes con Artritis Idiopática Juvenil Poliarticular (AIJ), que tenían entre 4 y 17 años, la concentración plasmática media de adalimumab en estado estacionario (valores medidos de la semana 20 a la 48) fue 5,6 ± 5,6 mcg/mL (102% CV) con adalimumab sin metotrexato concomitante y 10,9 ± 5,2 mcg/mL (47,7% CV) con metotrexato concomitante. En pacientes con AIJ poliarticular que tenían de 2 a < 4 años o con 4 años y un peso inferior a 15 kg dosificados con 24 mg/m2 de adalimumab, la concentración plasmática media de adalimumab en estado estacionario fue 6,0 ± 6,1 mcg/mL (101% CV) para adalimumab sin metotrexato concomitante y 7,9 ± 5,6 mcg/mL (71,2% CV) con metotrexato concomitante.
Tras la administración de 24 mg/m2 (hasta un máximo de 40 mg) por vía subcutánea en semanas alternas en pacientes de 6 a 17 años con artritis asociada entesitis, la concentración media de adalimumab en estado estacionario (valores medidos en la semana 24) fue de 8,8 ± 6,6 mcg/mL para adalimumab sin metotrexato concomitante y 11,8 ± 4,3 mcg/mL con metotrexato concomitante.
Tras la administración subcutánea de 40 mg de adalimumab en semanas alternas en pacientes adultos con espondiloartritis axial no radiográfica, la concentración media (±SD) en el estado estacionario en la semana 68 fue de 8,0 ± 4,6 mcg/mL.
En pacientes adultos con psoriasis, la media de la concentración en el punto mínimo en el estado estacionario fue de 5 mcg/mL durante el tratamiento en monoterapia con adalimumab 40 mg en semanas alternas.
Tras la administración subcutánea de 0,8 mg/kg (hasta un máximo de 40 mg) en semanas alternas a pacientes pediátricos con psoriasis en placas crónica, la media (± DS) de las concentraciones de adalimumab en el punto mínimo del estado estacionario fue 7,4 ± 5,8 mcg/mL (79% CV). En pacientes adultos con hidradenitis supurativa, con una dosis de 160 mg de adalimumab en la semana 0 seguido de 80 mg en la semana 2 se alcanzaron concentraciones séricas mínimas de adalimumab de aproximadamente 7 a 8 mcg/mL en la semana 2 y la semana 4. La concentración media en el estado estacionario en la semana 12 hasta la semana 36 fue aproximadamente de 8 a 10 mcg/mL durante el tratamiento con adalimumab 40 mg semanal.La exposición de adalimumab en pacientes adolescentes con HS se predijo usando modelos de farmacocinética poblacional y simulación basado en la farmacocinética de indicación cruzada en otros pacientes pediátricos (psoriasis pediátrica, artritis idiopática juvenil, enfermedad de Crohn pediátrica, y artritis asociada a entesitis). La pauta posológica recomendada para HS en adolescentes es 40 mg en semanas alternas. Debido a que la exposición a adalilumab se puede ver afectada por el tamaño corporal, los adolescentes con mayor peso corporal y una respuesta inadecuada se pueden beneficiar de la dosis recomendada en adultos de 40 mg semanales.
En pacientes con enfermedad de Crohn, con la dosis de carga de 80 mg de adalimumab en la semana 0, seguida de 40 mg de adalimumab en la semana 2, se alcanzaron concentraciones plasmáticas de adalimumab de aproximadamente 5,5 mcg/mL durante el período de inducción. Con la dosis de carga de 160 mg de adalimumab en la semana 0, seguida de 80 mg de adalimumab en la semana 2, se alcanzaron concentraciones plasmáticas de adalimumab de aproximadamente, 12 mcg/mL durante el período de inducción. Se observaron niveles medios en el punto mínimo en el estado estacionario de aproximadamente 7 mcg/mL en pacientes con enfermedad de Crohn que recibieron una dosis de mantenimiento de 40 mg de adalimumab en semanas alternas.
En pacientes pediátricos con enfermedad de Crohn de moderada a grave, la dosis de inducción con adalimumab fue de 160/80 mg o 80/40 mg en las semanas 0 y 2, respectivamente, dependiendo de un corte de 40 kg de peso corporal. En la semana 4, los pacientes fueron aleatorizados 1:1 en grupos de tratamiento de mantenimiento según su peso corporal a la Dosis Estándar (40/20 mg en semanas alternas) o Dosis Baja (20/10 mg en semanas alternas). La media (± DS) de la concentración sérica valle de adalimumab alcanzada en la semana 4 fue 15,7 ± 6,6 mcg/mL para pacientes ≥ 40 kg (160/80 mg) y 10,6 ± 6,1 mcg/mL para pacientes < 40 kg (80/40 mg). Para aquellos pacientes que permanecieron en el tratamiento aleatorizado, la media (± DS) de la concentración valle de adalimumab en la semana 52 fue de 9,5 ± 5,6 mcg/mL para el grupo de la dosis estándar y 3,5 ± 2,2 mcg/mL para el grupo de dosis bajas. Se mantuvo la media de las concentraciones valle en los sujetos que continuaron el tratamiento con adalimumab en semanas alternas durante 52 semanas. Para aquellos pacientes en los que se produjo una escalada de dosis del régimen de semanas alternas a semanalmente, la media (± DS) de las concentraciones séricas de adalimumab en la semana 52 fueron 15,3 ± 11,4 mcg/mL (40/20 mg semanalmente) y 6,7 ± 3,5 mcg/mL (20/10 mg semanalmente).
En pacientes con colitis ulcerosa, con la dosis de carga de 160 mg de adalimumab en la semana 0, seguida de 80 mg de adalimumab en la semana 2 se alcanzaron concentraciones plasmáticas de adalimumab de aproximadamente 12 mcg/mL durante el período de inducción. Se observaron niveles medios en el punto mínimo en el estado estacionario de 8 mcg/mL en pacientes con colitis ulcerosa que recibieron una dosis de mantenimiento de 40 mg de adalimumab en semanas alternas.
En pacientes adultos con uveítis, una dosis de carga de 80 mg de adalimumab en la semana 0 seguida de 40 mg de adalimumab en semanas alternas comenzando en la semana 1, permitió alcanzar concentraciones medias en el estado estacionario de aproximadamente 8 a 10 mcg/mL.
La exposición de adalimumab en pacientes pediátricos con uveítis se predijo utilizando el modelo farmacocinético de población y la simulación basada en la farmacocinética de indicación cruzada en otros pacientes pediátricos (psoriasis pediátrica, artritis idiopática juvenil, enfermedad de Crohn pediátrica y artritis asociada a entesitis). No se dispone de datos de exposición clínica sobre el uso de una dosis de carga en niños menores de 6 años. Las exposiciones predichas indican que, en ausencia de metotrexato, una dosis de carga puede llevar a un aumento inicial de la exposición sistémica.
La modelización y simulación de la farmacocinética/farmacodinámica y la farmacocinética de la población predijo una exposición a adalimumab y eficacia similar en pacientes tratados con 80 mg en semanas alternas comparado con 40 mg semanal (incluyendo pacientes adultos con AR, HS, CU, EC o Ps, pacientes con HS adolescente, y pacientes pediátricos ≥ 40 kg con EC). Relación exposición-respuesta en población pediátrica
Basándose en los datos de ensayos clínicos en pacientes con AIJ (AIJp y ARE) se estableció una relación exposición-respuesta entre las concentraciones plasmáticas y la respuesta PedACR50. La concentración plasmática aparente de adalimumab que produce la mitad del máximo de probabilidad de respuesta PedACR50 (EC50) fue 3 mcg/mL (IC del 95 % IC: 1-6 mcg/mL).
Las relaciones exposición-respuesta entre la concentración de adalimumab y la eficacia en pacientes pediátricos con placas psoriásicas crónicas graves se establecieron para PASI 75 y PGA de sin lesiones o mínimas, respectivamente. PASI 75 y PGA de sin lesiones o mínimas aumentó con el aumento de las concentraciones de adalimumab ambas con un EC50 similar aparente de aproximadamente 4,5 mcg/mL (IC del 95 % IC 0,4-47,6 y 1,9-10,5, respectivamente).Eliminación
Los análisis farmacocinéticos poblacionales con datos de aproximadamente 1.300 pacientes con AR revelaron una tendencia a una correlación directa entre el incremento aparente del aclaramiento de adalimumab y el peso corporal. Después de un ajuste según las diferencias de peso corporal, se observó que el efecto del sexo y la edad sobre el aclaramiento de adalimumab era mínimo. Los niveles plasmáticos de adalimumab libre (no unido a anticuerpos anti-adalimumab, AAA) se observó que eran inferiores en pacientes con AAA cuantificables.
Insuficiencia renal o hepática
Adalimumab no se ha estudiado en pacientes con insuficiencia hepática o renal.
CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes, incluidos en la sección Lista de excipientes. Tuberculosis activa u otras infecciones graves tales como sepsis, e infecciones oportunistas (ver Advertencias y precauciones).
Insuficiencia cardíaca moderada a grave (NYHA clases III/IV) (ver Advertencias y precauciones).
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: Adalimumab se ha estudiado en 9.506 pacientes en ensayos pivotales controlados y abiertos durante un máximo de 60 meses o más. Estos ensayos clínicos incluyeron pacientes con artritis reumatoide reciente o de larga duración, artritis idiopática juvenil (artritis idiopática juvenil poliarticular y artritis asociada a entesitis) así como con espondiloartritis axial (espondilitis anquilosante, y espondiloartritis axial sin evidencia radiográfica de EA), artritis psoriásica, enfermedad de Crohn, colitis ulcerosa, psoriasis, hidradenitis supurativa y uveítis. Los datos están basados en ensayos pivotales controlados que abarcaron 6.089 pacientes tratados con adalimumab y 3.801 pacientes con placebo o comparador activo durante el período controlado.
La proporción de pacientes que interrumpió el tratamiento debido a reacciones adversas durante la fase doble ciego y controlada de los ensayos pivotales fue 5,9% para los pacientes tratados con adalimumab y 5,4% para el grupo control.
Las reacciones adversas notificadas más frecuentemente fueron infecciones (como nasofaringitis, infección del tracto respiratorio superior y sinusitis), reacciones en el lugar de inyección (eritema, picores, hemorragia, dolor o hinchazón), cefalea y dolor músculo esquelético. Se han notificado reacciones adversas graves con adalimumab. Los antagonistas del TNF, como AMGEVITA, afectan al sistema inmune, y su uso puede afectar a la defensa del cuerpo contra infecciones y cáncer.
Se han notificado también en asociación con el uso de adalimumab infecciones mortales o que amenazan la vida del paciente (incluyendo sepsis, infecciones oportunistas y tuberculosis), reactivación del VHB y varios tipos de tumores (incluyendo leucemia, linfoma y linfoma hepatoesplénico de células T).
También se han notificado reacciones hematológicas, neurológicas y autoinmunes graves. Estas incluyen notificaciones raras de pancitopenia, anemia aplásica, acontecimientos desmielinizantes centrales y periféricos y notificaciones de lupus, enfermedades relacionadas con lupus y síndrome de Stevens-Johnson. Población pediátrica: En general, las reacciones adversas en pacientes pediátricos fueron similares en frecuencia y tipo a las observadas en pacientes adultos.
Tabla de reacciones adversas: La siguiente lista de reacciones adversas se basa en la experiencia de ensayos clínicos y en la experiencia postcomercialización y se enumeran según el sistema de clasificación por órganos y frecuencia en la Tabla 6: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1.000 a < 1/100); raras (≥ 1/10.000 a < 1/1.000); y frecuencia no conocida (no pueden estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las frecuencias incluidas son las más altas observadas en las diferentes indicaciones. En los casos en los que se incluye información adicional en las secciones 3.3, 3.4 y 3.8, aparece un asterisco (*) en la columna Clasificación de órganos del sistema MedDRA.
|
Tabla 6. Reacciones adversas |
||
|
Clasificación de órganos del sistema MedDRA |
Frecuencia |
Reacciones adversas |
|
Infecciones e infestaciones* |
Muy frecuentes |
Infecciones del tracto respiratorio (incluyendo infecciones respiratorias del tracto inferior y superior, neumonía, sinusitis, faringitis, nasofaringitis y neumonía por herpes viral) |
|
Frecuentes |
Infecciones sistémicas (incluyendo sepsis, candidiasis y gripe), Infecciones intestinales (incluyendo gastroenteritis viral), Infecciones de la piel y tejidos blandos (incluyendo paroniquia, celulitis, impétigo, fascitis necrotizante y herpes zoster), Infección de oídos, Infecciones orales (incluyendo herpes simple, herpes oral e infecciones dentales), Infecciones del tracto reproductor (incluyendo infección micótica vulvovaginal), Infecciones del tracto urinario (incluyendo pielonefritis), Infecciones fúngicas, Infecciones de las articulaciones |
|
|
Poco frecuentes |
Infecciones neurológicas (incluyendo meningitis viral), Infecciones oportunistas y tuberculosis (incluyendo coccidiomicosis, histoplasmosis, infecciones por el complejo Mycobacterium avium), Infecciones bacterianas, Infecciones oculares, Diverticulitis1) |
|
|
Neoplasias benignas, malignas y no especificadas (incluyendo quistes y pólipos)* |
Frecuentes |
Cáncer de piel excluido el melanoma (incluyendo carcinoma de células basales y carcinoma de células escamosas), Neoplasia benigna |
|
Poco frecuentes |
Linfoma**, Neoplasia de órganos sólidos (incluyendo cáncer de mama, neoplasia pulmonar y neoplasia tiroidea), Melanoma** |
|
|
Raras |
Leucemia1) |
|
|
No conocida |
Linfoma hepatoesplénico de células T1), Carcinoma de células de Merkel (carcinoma neuroendocrino de la piel)1) |
|
|
Trastornos de la sangre y del sistema linfático* |
Muy frecuentes |
Leucopenia (incluyendo neutropenia y agranulocitosis), Anemia |
|
Frecuentes |
Leucocitosis, Trombocitopenia |
|
|
Poco frecuentes |
Púrpura trombocitopénica idiopática |
|
|
Raras |
Pancitopenia |
|
|
Trastornos del sistema inmunológico* |
Frecuentes |
Hipersensibilidad, Alergias (incluyendo alergia estacional) |
|
Poco frecuentes |
Sarcoidosis1), Vasculitis |
|
|
Raras |
Anafilaxia1) |
|
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Muy frecuentes |
|
Frecuentes |
Hipopotasemia, Incremento de ácido úrico, Sodio plasmático anormal, Hipocalcemia, Hiperglucemia, Hipofosfatemia, Deshidratación |
|
|
Trastornos psiquiátricos |
Frecuentes |
Cambios de humor (incluyendo depresión), Ansiedad, Insomnio |
|
Trastornos del sistema nervioso* |
Muy frecuentes |
Cefalea |
|
Frecuentes |
Parestesia, (incluyendo hipoastesia), Migraña, Compresión de la raíz nerviosa |
|
|
Poco frecuentes |
Accidente cerebrovascular1), Temblor, Neuropatía |
|
|
Raras |
Esclerosis múltiple, Trastornos desmielinizantes (p.ej neuritis óptica, síndrome de Guillain-Barré)1) |
|
|
Trastornos oculares |
Frecuentes |
Alteración visual, Conjuntivitis, Blefaritis, Hinchazón de ojos |
|
Poco frecuentes |
Diplopía |
|
|
Trastornos del oído y del laberinto |
Frecuentes |
Vértigo |
|
Poco frecuentes |
Sordera, Tinnitus |
|
|
Trastornos cardíacos* |
Frecuentes |
Taquicardia |
|
Poco frecuentes |
Infarto de miocardio1), Arritmia, Insuficiencia cardíaca congestiva |
|
|
Raras |
Paro cardíaco |
|
|
Trastornos vasculares |
Frecuentes |
Hipertensión, Rubor, Hematomas |
|
Poco Frecuentes |
Aneurisma aórtico, Oclusión vascular arterial, Tromboflebitis |
|
|
Trastornos respiratorios, torácicos y mediastínicos* |
Frecuentes |
Asma, Disnea, Tos |
|
Poco frecuentes |
Embolia pulmonar1), Enfermedad pulmonar intersticial, Enfermedad pulmonar obstructiva crónica, Neumonitis, Efusión pleural1) |
|
|
Raras |
Fibrosis pulmonar1) |
|
|
Trastornos gastrointestinales |
Muy frecuentes |
Dolor abdominal, Náuseas y vómitos |
|
Frecuentes |
Hemorragia gastrointestinal, Dispepsia, Enfermedad de reflujo gastroesofágico, Síndrome del ojo seco |
|
|
Poco frecuentes |
Pancreatitis, Disfagia, Edema facial |
|
|
Raras |
Perforación intestinal1) |
|
|
Trastornos hepatobiliares* |
Muy frecuentes |
Incremento de enzimas hepáticas |
|
Poco frecuentes |
Colecistitis y colelitiasis, Esteatosis hepática, Incremento de la bilirrubina |
|
|
Raras |
Hepatitis, Reactivación de la hepatitis B1), Hepatitis autoinmune1) |
|
|
No conocida |
Fallo hepático1) |
|
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Erupción (incluyendo erupción exfoliativa) |
|
Frecuentes |
Empeoramiento de la psoriasis existente o psoriasis de nueva aparición (incluyendo psoriasis pustulosa palmoplantar)1), Urticaria, Moratones (incluyendo púrpura), Dermatitis (incluyendo eccema), Onicoclasis, Hiperhidrosis, Alopecia1), Prurito |
|
|
Poco frecuentes |
Sudores nocturnos, Cicatrices |
|
|
Raras |
Eritema multiforme1), Síndrome de Stevens-Johnson1), Angioedema1), Vasculitis cutánea1) Reacción liquenoide en la piel1) |
|
|
No conocida |
Empeoramiento de los síntomas de la dermatomiositis1) |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Muy frecuentes |
Dolor musculoesquelético |
|
Frecuentes |
Espasmos musculares (incluyendo incrementos plasmáticos de la creatina fosfoquinasa) |
|
|
Poco frecuentes |
Rabdomiólisis, Lupus eritematoso sistémico |
|
|
Raros |
Síndrome similar al lupus 1) |
|
|
Trastornos renales y urinarios |
Frecuentes |
Insuficiencia renal, Hematuria |
|
Poco frecuentes |
Nocturia |
|
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Disfunción eréctil |
|
Trastornos generales y alteraciones en el lugar de administración* |
Muy frecuentes |
Reacción en el lugar de inyección (incluyendo eritema en el lugar de inyección) |
|
Frecuentes |
Dolor de pecho, Edema, Pirexia1) |
|
|
Poco frecuentes |
Inflamación |
|
|
Exploraciones complementarias* |
Frecuentes |
Alteraciones en la coagulación y el sangrado (incluyendo prolongación del tiempo de tromboplastina parcial activada), Presencia de autoanticuerpos (incluyendo anticuerpos de ADN bicatenario), Incremento de la lactato deshidrogenasa plasmática |
|
Lesiones traumáticas, intoxicaciones y complicaciones procedimentales |
Frecuentes |
Alteraciones de la cicatrización |
|
* se incluye información adicional en las secciones 3.3, 3.4 y 3.8 |
||
|
** incluyendo los estudios de extensión abierta |
||
|
1) incluyendo los datos de notificaciones espontáneas |
||
Hidradenitis supurativa: El perfil de seguridad de los pacientes con hidradenitis supurativa en tratamiento semanal con adalimumab fue consistente con el perfil de seguridad conocido de adalimumab.
Uveítis: El perfil de seguridad de los pacientes con uveítis en tratamiento con adalimumab en semanas alternas fue consistente con el perfil de seguridad conocido de adalimumab.
Descripción de reacciones adversas seleccionadas Reacciones en el lugar de inyección: En los ensayos controlados pivotales en adultos y niños, el 12,9% de los pacientes tratados con adalimumab desarrollaron reacciones en el sitio de inyección (eritema y/o picores, hemorragia, dolor o hinchazón), comparado con el 7,2% de los pacientes tratados con placebo o control activo. No se consideró necesario interrumpir el medicamento debido a las reacciones en el lugar de administración. Infecciones: En los ensayos controlados pivotales en adultos y niños, la incidencia de infecciones fue de 1,51 por paciente/año en los pacientes tratados con adalimumab y 1,46 por paciente/año en los pacientes tratados con placebo y control activo. Las infecciones consistieron fundamentalmente en nasofaringitis, infecciones del tracto respiratorio superior y sinusitis. La mayoría de los pacientes continuaron con adalimumab tras resolverse la infección.
La incidencia de infecciones graves fue de 0,04 por paciente/año en los pacientes tratados con adalimumab y 0,03 por paciente/año en los pacientes tratados con placebo y control activo.
En ensayos controlados abiertos en adultos y pediátricos con adalimumab, se han notificado infecciones graves (incluyendo las mortales, que han ocurrido en casos raros), entre las que se incluyen notificaciones de tuberculosis (incluida la miliar y la localización extrapulmonar) e infecciones oportunistas invasivas (por ejemplo: histoplasmosis diseminada o extrapulmonar, blastomicosis, coccidiomicosis, pneumocistis, candidiasis, aspergilosis y listeriosis). La mayoría de los casos de tuberculosis tuvieron lugar durante los primeros ocho meses del tratamiento y reflejan la exacerbación de una enfermedad latente.
Enfermedades neoplásicas malignas y trastornos linfoproliferativos: No se han observado enfermedades neoplásicas malignas durante los ensayos con adalimumab en 249 pacientes pediátricos de artritis idiopática juvenil (artritis idiopática juvenil poliarticular y artritis asociada a entesitis) con una exposición de 655,6 pacientes/año. Adicionalmente, no se observaron enfermedades neoplásicas malignas en 192 pacientes pediátricos con una exposición de 498,1 pacientes/año durante un ensayo de adalimumab en pacientes pediátricos con enfermedad de Crohn. No se han observado enfermedades neoplásicas malignas en 77 pacientes pediátricos con una exposición de 80,0 pacientes/año durante un ensayo de adalimumab en pacientes pediátricos con psoriasis en placas crónica. No se observaron enfermedades neoplásicas malignas en 60 pacientes pediátricos con una exposición de 58,4 pacientes al año durante un ensayo de adalimumab en pacientes pediátricos con uveítis.
Durante las fases controladas de los ensayos clínicos pivotales con adalimumab en adultos que duraron un mínimo de 12 semanas en pacientes con artritis reumatoide activa de moderada a grave, espondilitis anquilosante, espondiloartritis axial sin evidencia radiográfica de EA, artritis psoriásica, psoriasis, hidradenitis supurativa, enfermedad de Crohn, colitis ulcerosa y uveítis, se observaron enfermedades neoplásicas malignas, diferentes a linfoma y cáncer de piel tipo no melanoma, con una incidencia de 6,8 (4,4 – 10,5) por 1.000 pacientes/año (intervalo de confianza del 95%) en los 5.291 pacientes tratados con adalimumab, frente a una incidencia de 6,3 (3,4 – 11,8) por 1.000 pacientes/año en los 3.444 pacientes del grupo control (la duración media del tratamiento fue de 4,0 meses para los pacientes tratados con adalimumab y de 3,8 meses para los pacientes tratados del grupo control). La incidencia de cáncer de piel tipo no melanoma fue de 8,8 (6,0 – 13,0) por 1.000 pacientes/año (intervalo de confianza del 95%) en los pacientes tratados con adalimumab y 3,2 (1,3 – 7,6) por 1.000 pacientes/año en los pacientes control. De estos casos de cáncer de piel, el carcinoma de células escamosas se produjo con una incidencia de 2,7 (1,4 – 5,4) por 1.000 pacientes/año (intervalo de confianza del 95%) en los pacientes tratados con adalimumab y de un 0,6 (0,1 – 4,5) por 1.000 pacientes/año en los pacientes del grupo control. La incidencia de linfomas fue de 0,7 (0,2 – 2,7) por 1.000 pacientes/año (intervalo de confianza del 95%) entre los pacientes tratados con adalimumab y de 0,6 (0,1 – 4,5) por 1.000 pacientes/año en los pacientes del grupo control. Cuando se combinan los datos obtenidos en las fases controladas de estos ensayos clínicos de adalimumab y los ensayos de extensión abiertos en curso y completados, con una duración media aproximada de 3,3 años que incluyen 6.427 pacientes y más de 26.439 pacientes/año de tratamiento, la incidencia observada de enfermedades neoplásicas malignas, excluyendo linfomas y cáncer de piel tipo no melanoma, es de aproximadamente 8,5 por 1.000 pacientes/año. La incidencia observada de cáncer de piel tipo no melanoma es de aproximadamente un 9,6 por 1.000 pacientes/año. La incidencia observada de linfomas es de aproximadamente 1,3 por 1.000 pacientes/año.
En la experiencia postcomercialización desde enero de 2003 a diciembre de 2010, principalmente en pacientes con artritis reumatoide, la incidencia registrada de enfermedades neoplásicas malignas es aproximadamente, de 2,7 por 1.000 pacientes tratados/año. La frecuencia registrada para cáncer de piel tipo no melanoma y linfomas es de aproximadamente 0,2 y 0,3 por 1.000 pacientes tratados/año, respectivamente (ver sección Advertencias y precauciones).Durante la comercialización se han notificado casos raros de linfoma hepatoesplénico de células T en pacientes tratados con adalimumab (ver sección Advertencias y precauciones).
Autoanticuerpos: Se analizaron muestras séricas a distintos tiempos de los pacientes para la detección de autoanticuerpos en los ensayos I-V de artritis reumatoide. En dichos ensayos, el 11,9% de los pacientes tratados con adalimumab y el 8,1% de los pacientes tratados con placebo y control activo que tuvieron títulos de anticuerpos antinucleares basales negativos dieron títulos positivos en la semana 24. Dos pacientes de los 3.441 tratados con adalimumab en todos los ensayos de artritis reumatoide y artritis psoriásica desarrollaron signos clínicos que sugerían un síndrome tipo lupus de reciente aparición. Los pacientes mejoraron tras interrumpir el tratamiento. Ningún paciente desarrolló lupus, nefritis o síntomas a nivel del sistema nervioso central.
Efectos hepatobiliares: En los ensayos clínicos controlados fase 3 de adalimumab en pacientes con artritis reumatoide y artritis psoriásica con un rango de duración del período de control de 4 a 104 semanas, se produjo un aumento de ALT ≥ 3 × SLN en un 3,7% de los pacientes tratados con adalimumab y en un 1,6% de los pacientes del grupo control.
En los ensayos clínicos controlados fase 3 de adalimumab en pacientes de 4 a 17 años con artritis idiopática juvenil poliarticular y en pacientes de 6 a 17 años con artritis asociada a entesitis, se produjo un aumento de ALT ≥ 3 × SLN en un 6,1% de los pacientes tratados con adalimumab y en un 1,3% de los pacientes del grupo control. La mayoría de los aumentos de ALT se produjeron con el uso en combinación con metotrexato. No se produjeron aumentos de la ALT ≥ 3 × SLN en los ensayos de fase 3 de adalimumab en pacientes con artritis idiopática juvenil poliarticular de 2 a < 4 años de edad.
En los ensayos clínicos controlados fase 3 de adalimumab en pacientes con enfermedad de Crohn y colitis ulcerosa con un rango de duración del período de control de 4 a 52 semanas, se produjo un aumento de ALT ≥ 3 × SLN en un 0,9% de los pacientes tratados con adalimumab y en un 0,9% de los pacientes del grupo control.
En los ensayos fase 3 de adalimumab en pacientes con enfermedad de Crohn pediátrica en los que se evaluó la eficacia y la seguridad de dos regímenes de dosificación ajustados por peso corporal en mantenimiento tras un tratamiento de inducción ajustado por peso corporal hasta 52 semanas de tratamiento, se observaron aumentos de la ALT ≥ 3 × SLN en el 2,6% (5/192) de los pacientes, 4 de los cuales recibieron inmunosupresores concomitantes inicialmente.
En los ensayos clínicos controlados fase 3 de adalimumab en pacientes con psoriasis en placas con un rango de duración del período de control de 12 a 24 semanas, se produjo un aumento de ALT ≥ 3 × SLN en un 1,8% de los pacientes tratados con adalimumab y en un 1,8% de los pacientes del grupo control.
No se produjeron aumentos de ALT ≥ 3 × SLN en los ensayos clínicos fase 3 de adalimumab en pacientes pediátricos con psoriasis en placas.
En ensayos controlados con adalimumab (dosis inicial de 160 mg en la semana 0 y 80 mg en la semana 2, seguido de 40 mg semanales a partir de la semana 4), se produjeron aumentos de ALT ≥ 3 × SLN en un 0,3% de los pacientes tratados con adalimumab y un 0,6% de los pacientes del grupo control, en pacientes con hidradenitis supurativa con una duración del período control de 12 a 16 semanas.
En los ensayos clínicos controlados con adalimumab (dosis inicial de 80 mg en la semana 0 seguido de 40 mg en semanas alternas comenzando en la semana 1) en pacientes adultos con uveítis hasta 80 semanas con una exposición media de 166,5 días y 105,0 días para pacientes, en tratamiento con adalimumab y pacientes control respectivamente, se produjeron aumentos de ALT ≥ 3 × SLN en un 2,4% de los pacientes en tratamiento con adalimumab y en un 2,4% en los pacientes control.
En los ensayos clínicos de todas las indicaciones, los pacientes con ALT elevada fueron asintomáticos y en la mayoría de los casos estos aumentos fueron transitorios y se resolvieron en el curso del tratamiento. Sin embargo, en pacientes que han recibido adalimumab, se han notificado además casos de fallo hepático así como afecciones hepáticas menos graves que pueden preceder a la insuficiencia hepática, tales como hepatitis, incluida la hepatitis autoinmune, en el período de post comercialización.
Tratamiento concomitante con azatioprina/6-mercaptopurina: En estudios de enfermedad de Crohn con pacientes adultos, se vieron mayores incidencias de neoplasias malignas y efectos adversos relacionados con infecciones graves con la combinación de adalimumab y azatioprina/6-mercaptopurina comparado con adalimumab solo.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
Efectos sobre la capacidad de conducir y utilizar máquinas: La influencia de AMGEVITA sobre la capacidad para conducir y utilizar máquinas es pequeña. Se pueden producir vértigos y alteraciones de la visión tras la administración de AMGEVITA (ver sección Reacciones adversas).
Incompatibilidades: En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros medicamentos y otras formas de interacción: Adalimumab ha sido estudiado en pacientes con artritis reumatoide, artritis idiopática juvenil poliarticular y artritis psoriásica tratados con adalimumab tanto en monoterapia como con metotrexato de forma concomitante. Cuando se administró adalimumab junto con metotrexato, la formación de anticuerpos fue inferior en comparación con el uso como monoterapia. La administración de adalimumab sin metotrexato resultó en un incremento de la formación de anticuerpos, del aclaramiento y redujo la eficacia de adalimumab (ver sección Propiedades farmacodinámicas).
La administración conjunta de AMGEVITA y anakinra no está recomendada (ver sección Administración concomitante de FAMES biológicos o antagonistas del TNF).
La administración conjunta de AMGEVITA y abatacept no está recomendada (ver sección Administración concomitante de FAMES biológicos o antagonistas del TNF).
INFORMACIÓN COMPLEMENTARIA:
Fecha de referencia
Febrero 2020.
glomerular según el cuadro siguiente:
|
FILTRACIÓN GLOMERULAR |
DOSIS |
|
10-50 ml/min |
500 mg cada 6h |
|
<10 ml/min |
500 mg cada 8h |
MEDICAMENTA
Casilla 17-21-027 Quito, Ecuador
RECOMENDACIONES:
Advertencias y precauciones especiales de empleo Trazabilidad: Para mejorar la trazabilidad de los medicamentos biológicos, debe anotarse claramente el nombre y el número de lote del medicamento administrado.
Infecciones: Los pacientes que están en tratamiento con antagonistas del TNF son más susceptibles de padecer infecciones graves. La función pulmonar alterada puede incrementar el riesgo de desarrollar infecciones. Los pacientes deben ser, por lo tanto, estrechamente monitorizados para la detección de infecciones incluyendo tuberculosis, antes, durante y después del tratamiento con AMGEVITA. Dado que la eliminación de adalimumab puede tardar hasta cuatro meses, la monitorización se debe continuar durante este período.
El tratamiento con AMGEVITA no se debe iniciar en pacientes con infecciones activas, incluyendo infecciones crónicas o localizadas, hasta que las infecciones estén controladas. Se debe considerar el riesgo y el beneficio antes de iniciar el tratamiento con AMGEVITA en pacientes que han estado expuestos a tuberculosis y en pacientes que han viajado a áreas de alto riesgo de tuberculosis o áreas endémicas de micosis, como histoplasmosis, coccidiomicosis o blastomicosis (ver Otras infecciones oportunistas).
Los pacientes que desarrollen una nueva infección mientras estén bajo tratamiento con AMGEVITA deben ser estrechamente monitorizados y sometidos a una evaluación diagnóstica completa. La administración de AMGEVITA debe interrumpirse si un paciente desarrolla una infección grave nueva o sepsis, y se debe iniciar el tratamiento antimicrobiano o antifúngico apropiado hasta que la infección esté controlada. Los médicos deben tener precaución cuando consideren el uso de AMGEVITA en pacientes con antecedentes de infección recurrente o con condiciones subyacentes que puedan predisponer a los pacientes a infecciones, incluido el uso concomitante de medicamentos inmunosupresores.
Infecciones graves: Se han notificado infecciones graves, incluyendo sepsis, de origen bacteriano, micobacteriano, fúngicas invasivas, parasitarias, virales u otras infecciones oportunistas como listeriosis, legionelosis y pneumocistis en pacientes en tratamiento con adalimumab. Otras infecciones graves observadas en los ensayos clínicos incluyen neumonía, pielonefritis, artritis séptica y septicemia. Se han notificado casos de hospitalizaciones o desenlaces mortales asociados a estas infecciones. Tuberculosis: Se han notificado casos de tuberculosis, incluyendo reactivación y tuberculosis de nueva aparición, en pacientes en tratamiento con adalimumab. Las notificaciones incluyeron casos de tuberculosis pulmonar y extrapulmonar (es decir, diseminada).
Antes de iniciar el tratamiento con AMGEVITA, se debe evaluar en todos los pacientes la existencia de tuberculosis activa o inactiva (“latente”). Esta evaluación debe incluir una valoración médica detallada del paciente con antecedentes de tuberculosis o posible exposición previa a personas con tuberculosis activa y tratamiento inmunosupresor previo y/o actual. Se deben realizar pruebas de detección adecuadas (es decir, prueba cutánea de la tuberculina y radiografía de tórax) en todos los pacientes (aplicando recomendaciones locales). Se recomienda anotar en la Tarjeta de Recordatorio para el paciente la realización y resultados de estas pruebas. Se recuerda a los médicos el riesgo de falsos negativos, en la prueba cutánea de la tuberculina, especialmente en pacientes que están gravemente enfermos o inmunodeprimidos.
Si se diagnostica tuberculosis activa, no se debe iniciar el tratamiento con AMGEVITA (ver sección Contraindicaciones).
En todas las situaciones descritas a continuación, el balance beneficio/riesgo del tratamiento debe ser cuidadosamente considerado.
Si se tienen sospechas de tuberculosis latente, se debe consultar con un médico con experiencia en el tratamiento de la tuberculosis.
Si se diagnostica tuberculosis latente, se debe iniciar el tratamiento con una profilaxis antituberculosa antes de comenzar el tratamiento con AMGEVITA y de acuerdo con las recomendaciones locales.
Se debe considerar también el uso de profilaxis antituberculosa antes del inicio del tratamiento con AMGEVITA en pacientes con factores de riesgo múltiples o significativos a pesar de un resultado negativo en la prueba para la tuberculosis y en pacientes con antecedentes de tuberculosis latente o activa en los que no se haya podido confirmar el curso adecuado del tratamiento.
A pesar de la profilaxis para la tuberculosis, se han producido casos de reactivación de la misma en pacientes tratados con adalimumab. Algunos pacientes que habían recibido un tratamiento satisfactorio para la tuberculosis activa han vuelto a desarrollar tuberculosis mientras estaban en tratamiento con adalimumab.
Se deben dar instrucciones a los pacientes para que consulten con su médico si apareciesen signos/síntomas que sugieran tuberculosis (p.ej. tos persistente, debilidad/pérdida de peso, febrícula, apatía) durante o después del tratamiento con AMGEVITA.
Otras infecciones oportunistas: Se han observado infecciones oportunistas, incluyendo infecciones fúngicas invasivas, en pacientes en tratamiento con adalimumab. Estas infecciones no se han identificado de forma sistemática en pacientes en tratamiento con antagonistas del TNF lo que ha originado retrasos en el tratamiento apropiado, en ocasiones con consecuencias mortales.
Se tendrá en cuenta la posibilidad de una infección fúngica invasiva en aquellos pacientes que desarrollen signos y síntomas como fiebre, malestar, pérdida de peso, sudoración, tos, disnea y/o infiltraciones pulmonares u otros síntomas de enfermedad sistémica grave con o sin shock concomitante. En estos pacientes se debe suspender inmediatamente la administración de AMGEVITA. El diagnóstico y la administración de tratamiento antifúngico empírico en estos pacientes se debe realizar de acuerdo con un médico con experiencia previa en el cuidado de pacientes con infecciones fúngicas invasivas.
Reactivación de Hepatitis B: Se han producido casos de reactivación de la hepatitis B en pacientes que estaban recibiendo antagonistas del TNF, incluyendo adalimumab, los cuales son portadores crónicos del virus (es decir, antígeno de superficie positivo), en algunos casos con desenlace mortal. Se debe analizar una posible infección previa con VHB en los pacientes antes de iniciar un tratamiento con AMGEVITA. Para aquellos pacientes con análisis positivo para infección de hepatitis B, se recomienda consultar con un médico especialista en el tratamiento de la hepatitis B.
Se monitorizarán estrechamente los signos y síntomas de infección activa por VHB durante todo el tratamiento y hasta varios meses después de la finalización del tratamiento en aquellos portadores de VHB que requieran tratamiento con AMGEVITA. No existen datos adecuados acerca de la prevención de la reactivación del VHB en pacientes portadores del VHB que reciban de forma conjunta tratamiento antiviral y un antagonista del TNF. En pacientes que sufran una reactivación del VHB, se debe interrumpir el tratamiento con AMGEVITA e iniciar un tratamiento antiviral efectivo con el tratamiento de soporte apropiado.
Efectos neurológicos: Los antagonistas del TNF incluyendo adalimumab se han asociado en casos raros con la nueva aparición o exacerbación de los síntomas clínicos y/o evidencia radiográfica de enfermedad desmielinizante del sistema nervioso central, incluyendo esclerosis múltiple y neuritis óptica, y enfermedad desmielinizante del sistema nervioso periférico, incluyendo Síndrome de Guillain-Barré. Los médicos deben considerar con precaución el uso de AMGEVITA en pacientes con trastornos desmielinizantes del sistema nervioso central o periférico preexistentes o de reciente aparición; si se desarrolla cualquiera de estos trastornos se debe considerar la interrupción del tratamiento con AMGEVITA. Existe una asociación conocida entre la uveítis intermedia y los trastornos desmielinizantes centrales. Antes del inicio del tratamiento con AMGEVITA y de forma regular durante el tratamiento se debe realizar una evaluación neurológica en pacientes con uveítis intermedia no infecciosa para valorar trastornos desmielinizantes centrales preexistentes o en desarrollo.
Reacciones alérgicas: Las reacciones alérgicas graves asociadas a adalimumab fueron raras durante los ensayos clínicos. Las reacciones alérgicas no-graves asociadas con adalimumab fueron poco frecuentes durante los ensayos clínicos. Se han recibido notificaciones de reacciones alérgicas graves que incluyeron anafilaxia tras la administración de adalimumab. Si aparece una reacción anafiláctica u otra reacción alérgica grave, se debe interrumpir inmediatamente la administración de AMGEVITA e iniciar el tratamiento apropiado.
Caucho natural: El capuchón de la aguja del autoinyector prellenado está fabricado con caucho natural (un derivado del látex), que puede causar reacciones alérgicas.
Inmunosupresión: En un estudio de 64 pacientes con artritis reumatoide que fueron tratados con adalimumab, no se observó evidencia de descenso de hipersensibilidad retardada, descenso de los niveles de inmunoglobulinas, o cambio en el recuento de células efectoras T, B y células NK, monocitos/macrófagos, y neutrófilos.
Enfermedades neoplásicas malignas y trastornos linfoproliferativos: En las partes controladas de los ensayos clínicos de adalimumab de los antagonistas del TNF, se han observado más casos de enfermedades neoplásicas malignas, incluido el linfoma, entre los pacientes que recibieron un antagonista del TNF en comparación con el grupo control. Sin embargo, la incidencia fue rara. En el entorno post-autorización se han notificado casos de leucemia en pacientes tratados con antagonistas del TNF. Existe un mayor riesgo basal de linfomas y leucemia en pacientes con artritis reumatoide con enfermedad inflamatoria de alta actividad, que complica la estimación del riesgo. Con el conocimiento actual, no se puede excluir un posible riesgo de desarrollo de linfomas, leucemia, y otras enfermedades neoplásicas malignas en pacientes tratados con antagonistas del TNF.Se ha notificado la aparición de enfermedades neoplásicas malignas, algunas mortales, entre niños, adolescentes y jóvenes adultos (hasta 22 años de edad) tratados con agentes antagonistas del TNF (inicio del tratamiento ≤ 18 años), incluyendo adalimumab en el entorno postautorización. Aproximadamente, la mitad de los casos fueron linfomas. Los demás casos representan una variedad de enfermedades neoplásicas malignas e incluyen cánceres raros normalmente asociados con inmunosupresión. No se puede excluir el riesgo de desarrollar enfermedades neoplásicas malignas en niños y adolescentes tratados con antagonistas del TNF. Durante la comercialización, se han identificado casos raros de linfoma hepatoesplénico de células T en pacientes tratados con adalimumab. Estos casos raros de linfoma de células T cursan con una progresión muy agresiva y por lo general mortal de la enfermedad. Algunos de estos linfomas hepatoesplénicos de células T con adalimumab se han presentado en pacientes adultos jóvenes en tratamiento concomitante con azatioprina o 6-mercaptopurina utilizada para la enfermedad inflamatoria intestinal. El riesgo potencial de la combinación de azatioprina o 6-mercaptopurina y AMGEVITA debe ser cuidadosamente considerado. No se puede descartar el riesgo de desarrollar linfoma hepatoesplénico de células T en pacientes tratados con AMGEVITA (ver sección Reacciones adversas).
No se han realizado estudios que incluyan pacientes con historial de enfermedades neoplásicas malignas o en los que el tratamiento con adalimumab continúe tras desarrollar una enfermedad neoplásica maligna. Por tanto, se deben tomar precauciones adicionales al considerar el tratamiento de estos pacientes con AMGEVITA (ver sección Reacciones adversas).
En todos los pacientes, y particularmente en aquellos que hayan recibido un tratamiento inmunosupresor extensivo o pacientes con psoriasis y tratamiento previo con PUVA, se debe examinar la presencia de cáncer de piel de tipo no melanoma antes y durante el tratamiento con AMGEVITA. Se han notificado también casos de melanoma y carcinoma de células de Merkel en pacientes en tratamiento con antagonistas del TNF incluyendo adalimumab (ver sección Reacciones adversas).
En un ensayo clínico exploratorio que evaluaba el uso de otro antagonista del TNF, infliximab, en pacientes con Enfermedad Pulmonar Obstructiva Crónica (EPOC) de moderada a grave, se registraron más casos de enfermedades neoplásicas malignas, la mayoría del pulmón, o cabeza y cuello, en pacientes en tratamiento con infliximab en comparación con el grupo control. Todos los pacientes presentaban antecedentes de tabaquismo importante. Por tanto se debe tener especial cuidado cuando se utilice cualquier antagonista de TNF en pacientes con EPOC, así como en pacientes con un elevado riesgo de sufrir enfermedades neoplásicas malignas por fumar en exceso.
Con los datos disponibles actualmente se desconoce si el tratamiento con adalimumab influye en el riesgo de desarrollar displasia o cáncer de colon. Se debe cribar para displasia a intervalos regulares antes del tratamiento y durante el curso de la enfermedad a todos los pacientes con colitis ulcerosa que presenten un riesgo incrementado de displasia o carcinoma de colon (p.ej. pacientes con colitis ulcerosa de larga duración o con colangitis esclerosante primaria), o que tengan antecedentes de displasia o carcinoma de colon. Esta evaluación deberá incluir colonoscopia y biopsias según recomendaciones locales.
Reacciones hematológicas: En raras ocasiones se han descrito casos de pancitopenia, incluyendo anemia aplásica, con antagonistas del TNF. Se han descrito con adalimumab reacciones adversas del sistema hematológico, incluyendo citopenias significativas desde el punto de vista médico (p.ej. trombocitopenia, leucopenia). Se debe aconsejar a todos los pacientes que consulten inmediatamente con su médico en caso de presentar signos y síntomas de discrasias sanguíneas (p.ej. fiebre persistente, moratones, sangrado, palidez) cuando estén siendo tratados con AMGEVITA. En pacientes con anomalías hematológicas significativas confirmadas debe considerarse la interrupción del tratamiento con AMGEVITA.
Vacunas: En un ensayo con 226 sujetos adultos con artritis reumatoide que fueron tratados con adalimumab o placebo se observó una respuesta de anticuerpos similar frente a la vacuna estándar neumocócica 23-valente y la vacuna trivalente para el virus de la gripe. No se dispone de datos sobre la transmisión secundaria de infecciones por vacunas vivas en pacientes tratados con adalimumab.En pacientes pediátricos se recomienda, si es posible, una actualización del calendario de vacunaciones de acuerdo con las guías actuales de vacunación antes de iniciar el tratamiento con AMGEVITA.
Los pacientes en tratamiento con AMGEVITA pueden ser vacunados, excepto con vacunas de microorganismos vivos (p.ej. vacuna BCG). No se recomienda la administración de vacunas a lactantes expuestos a AMGEVITA en el útero durante los 5 meses siguientes a la última inyección de AMGEVITA de la madre durante el embarazo.
Insuficiencia cardíaca congestiva: En un ensayo clínico con otro antagonista del TNF se ha observado empeoramiento de la insuficiencia cardíaca congestiva y aumento de la mortalidad debida a esta patología. También se han notificado casos de empeoramiento de la insuficiencia cardíaca congestiva en pacientes tratados con adalimumab. AMGEVITA debe utilizarse con precaución en pacientes con insuficiencia cardíaca leve (NYHA clases I/II). AMGEVITA está contraindicado en insuficiencia cardíaca moderada o grave (ver sección Contraindicaciones). El tratamiento con AMGEVITA debe interrumpirse en pacientes que desarrollen insuficiencia cardíaca congestiva nueva o presenten un empeoramiento de los síntomas.
Procesos autoinmunes: El tratamiento con AMGEVITA puede dar lugar a la formación de autoanticuerpos. Se desconoce el impacto del tratamiento a largo plazo con AMGEVITA sobre el desarrollo de enfermedades autoinmunes. Si un paciente desarrolla síntomas parecidos a los de un síndrome tipo lupus después del tratamiento con AMGEVITA y da positivo a los anticuerpos frente al ADN bicatenario, se debe interrumpir el tratamiento con AMGEVITA (ver sección Reacciones adversas).
Administración concomitante de FAMES biológicos o antagonistas del TNF: En ensayos clínicos se han observado infecciones graves con el uso concurrente de anakinra y otro antagonista del TNF, etanercept, sin beneficio clínico añadido en comparación con el uso de etanercept solo. Por la naturaleza de los efectos adversos observados en el tratamiento combinado de etanercept y anakinra, la combinación de anakinra y otros antagonistas del TNF puede producir una toxicidad similar. Por lo tanto, no se recomienda la combinación AMGEVITA y anakinra (ver sección Interacciones).
Basándose en el posible incremento del riesgo de infecciones, incluyendo infecciones graves, y otras interacciones farmacológicas potenciales, no se recomienda la administración concomitante de AMGEVITA con otros FAMES biológicos (p.ej. anakinra y abatacept) u otros antagonistas del TNF (ver sección Interacciones. Cirugía: La experiencia de seguridad de intervenciones quirúrgicas en pacientes tratados con adalimumab es limitada. Si se planifica una intervención quirúrgica debe considerarse la larga semivida de eliminación de adalimumab. Los pacientes tratados con AMGEVITA que requieran cirugía, deben controlarse muy de cerca por la aparición de infecciones y tomar las medidas apropiadas. La experiencia de seguridad en los pacientes a los que se les ha practicado una artroplastia, mientras estaban en tratamiento con adalimumab, es limitada.
Obstrucción del intestino delgado: Un fallo en la respuesta al tratamiento para la enfermedad de Crohn puede indicar la presencia de estenosis fibróticas establecidas que pueden requerir tratamiento quirúrgico. Los datos disponibles sugieren que adalimumab no empeora ni causa las estenosis.
Pacientes de edad avanzada: La frecuencia de infecciones graves en sujetos mayores de 65 años (3,7%) tratados con adalimumab fue mayor que para aquellos menores de 65 años (1,5%). Algunas de dichas infecciones tuvieron un resultado mortal. Se debe prestar una atención particular en relación al riesgo de infecciones cuando se trate a pacientes de edad avanzada.
Población pediátrica: Ver Vacunas arriba.
Excipientes con efecto conocido: Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis de 0,8 mL, esto es, esencialmente “exento de sodio”. Fertilidad, embarazo y lactancia
Mujeres en edad fértil: Las mujeres en edad fértil deben considerar utilizar un método anticonceptivo adecuado para prevenir el embarazo y continuar su uso durante al menos cinco meses tras el último tratamiento con AMGEVITA.
Embarazo: Un gran número de embarazos (aproximadamente 2100) seguidos de forma prospectiva y expuestos a adalimumab, resultando en nacimientos con vida conocidos, incluyendo más de 1500 expuestos durante el primer trimestre, no indican un aumento en la tasa de malformación en el recién nacido.
En un registro de cohortes prospectivo, fueron reclutadas 257 mujeres con Artritis Reumatoide (AR) o Enfermedad de Crohn (EC) tratadas con adalimumab al menos durante el primer trimestre, y 120 mujeres con AR o EC no tratadas con adalimumab. La variable principal fue la prevalencia de las principales anomalías congénitas que se dan al nacer. La tasa de embarazos que termina con, al menos, un recién nacido vivo con un defecto congénito grave fue de 6/69 (8,7%) en mujeres con AR tratadas con adalimumab y 5/74 (6,8%) en mujeres con AR sin tratamiento (OR no ajustado 1,31, IC del 95% 0,38-4,52) y 16/152 (10,5%) en mujeres con EC tratadas con adalimumab y 3/32 (9,4%) en mujeres con EC no tratadas (OR no ajustado 1,14, IC del 95 % 0,31-4,16). El OR ajustado (teniendo en cuenta las diferencias basales) fue de 1,10 (IC del 95% 0,45-2,73) para AR y EC combinadas. No hubo diferencias claras entre las mujeres tratadas con adalimumab y las no tratadas para las variables secundarias de abortos espontáneos, defectos congénitos menores, parto prematuro, tamaño al nacer e infecciones graves u oportunistas, y no se notificaron nacimientos de niños muertos o neoplasias malignas. La interpretación de los datos puede verse afectada debido a las limitaciones metodológicas del estudio, incluyendo el pequeño tamaño de la muestra y el diseño no aleatorizado.
En un estudio de toxicidad para el desarrollo realizado en monos, no hubo indicios de toxicidad materna, embriotoxicidad o teratogenicidad. No se dispone de datos preclínicos sobre toxicidad postnatal de adalimumab (ver sección Datos preclínicos sobre seguridad).
Debido a la inhibición del TNFα, la administración de adalimumab durante el embarazo podría afectar a la respuesta inmune normal en el recién nacido. AMGEVITA solo debe usarse durante el embarazo en caso de ser claramente necesario.
Adalimumab puede atravesar la placenta al suero de niños nacidos de madres tratadas con adalimumab durante el embarazo. Como consecuencia, estos niños pueden tener un riesgo incrementado de infecciones. No se recomienda la administración de vacunas vivas (p.ej., vacuna BCG) a niños expuestos a adalimumab en el útero hasta 5 meses después de la última inyección de adalimumab de la madre durante el embarazo.
Lactancia: La información limitada extraída de la literatura publicada indica que adalimumab se excreta a través de la leche materna en concentraciones muy bajas con una presencia de adalimumab en leche humana en concentraciones del 0,1% al 1% del nivel sérico materno. Administrada por vía oral, la inmunoglobulina G se somete a proteólisis intestinal y tiene una biodisponibilidad escasa. No se prevén efectos en neonatos/lactantes alimentados con leche materna. En consecuencia, AMGEVITA puede usarse durante la lactancia.
Fertilidad: No hay datos preclínicos disponibles sobre el efecto de adalimumab en la fertilidad.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y forma de administración: El tratamiento con AMGEVITA debe ser iniciado y supervisado por médicos especialistas con experiencia en el diagnóstico y el tratamiento de aquellas indicaciones autorizadas para AMGEVITA. Se aconseja a los oftalmólogos consultar con un especialista apropiado antes de iniciar el tratamiento con AMGEVITA (ver sección Advertencias y precauciones). A los pacientes tratados con AMGEVITA se les debe entregar la Tarjeta de Recordatorio para el Paciente. Tras un adecuado aprendizaje de la técnica de inyección, los pacientes pueden autoinyectarse AMGEVITA si el médico lo considera apropiado y les hace el seguimiento médico necesario.
Durante el tratamiento con AMGEVITA, se deben optimizar otros tratamientos concomitantes (p.ej. corticoesteroides y/o agentes inmunomoduladores).
Posología
Artritis reumatoide: La dosis recomendada de AMGEVITA para pacientes adultos con artritis reumatoide es 40 mg de adalimumab administrados en semanas alternas como dosis única en inyección por vía subcutánea. El metotrexato debe mantenerse durante el tratamiento con AMGEVITA.Glucocorticoides, salicilatos, fármacos antiinflamatorios no esteroideos, o analgésicos pueden mantenerse durante el tratamiento con AMGEVITA. Para la combinación con fármacos antirreumáticos modificadores de la enfermedad distintos del metotrexato (ver secciones 3.4 y 4.1). En monoterapia, los pacientes que experimenten una disminución en su respuesta con AMGEVITA 40 mg en semanas alternas pueden beneficiarse de un aumento de la dosis a 40 mg de adalimumab cada semana u 80 mg cada dos semanas.
Los datos disponibles de adalimumab sugieren que la respuesta clínica normalmente se alcanza dentro de las 12 semanas de tratamiento.
La continuación del tratamiento se debe reconsiderar en pacientes que no hayan respondido en este período de tiempo.
Interrupción del tratamiento: Puede ser necesaria la interrupción del tratamiento, por ejemplo antes de una cirugía o si se produce una infección grave.
Cuando se vuelve a iniciar el tratamiento con AMGEVITA tras una interrupción de 70 días de duración o superior, se debe obtener una respuesta clínica y un perfil de seguridad similar al observado antes de la interrupción del tratamiento.
Espondilitis anquilosante, espondiloartritis axial sin evidencia radiográfica de EA y artritis psoriásica: La dosis recomendada de AMGEVITA para pacientes con espondilitis anquilosante, espondiloartritis axial sin evidencia radiográfica de EA y para pacientes con artritis psoriásica es de 40 mg de adalimumab administrados en semanas alternas como dosis única en inyección por vía subcutánea.
Los datos disponibles sugieren que la respuesta clínica se consigue, por lo general, dentro de las primeras 12 semanas de tratamiento. La continuación con el tratamiento se debe reconsiderar en los pacientes que no hayan respondido en este período de tiempo.
Psoriasis: La posología recomendada de AMGEVITA para pacientes adultos es de una dosis inicial de 80 mg por vía subcutánea, seguida de 40 mg administrados por vía subcutánea en semanas alternas comenzando una semana después de la dosis inicial.
La continuación del tratamiento tras 16 semanas debe reconsiderarse cuidadosamente en pacientes que no hayan respondido en este período de tiempo.
Tras 16 semanas, los pacientes con una respuesta inadecuada con AMGEVITA 40 mg en semanas alternas se pueden beneficiar de un incremento de la dosis a 40 mg semanales u 80 mg cada dos semanas. Los beneficios y riesgos de la continuación del tratamiento semanal con 40 mg u 80 mg en semanas alternas se deben reconsiderar cuidadosamente en pacientes con una respuesta inadecuada tras el incremento de la dosis (ver sección 4.1). Si se alcanza una respuesta adecuada con 40 mg semanales u 80 mg en semanas alternas, la dosis se puede reducir posteriormente a 40 mg en semanas alternas.
Hidradenitis supurativa: La posología recomendada de AMGEVITA para pacientes adultos con hidradenitis supurativa (HS) es de una dosis inicial de 160 mg en el día 1 (administrada como 4 inyecciones de 40 mg en un día o 2 inyecciones diarias de 40 mg en dos días consecutivos), seguida de 80 mg dos semanas después, en el día 15 (administrada como 2 inyecciones de 40 mg en un día). Dos semanas después (día 29) continuar con una dosis de 40 mg semanales u 80 mg en semanas alternas (administrada como dos inyecciones de 40 mg en un día). Si es necesario se puede continuar el tratamiento con antibióticos durante el tratamiento con AMGEVITA. Durante el tratamiento con AMGEVITA se recomienda que el paciente utilice a diario un líquido antiséptico tópico en las lesiones de hidradenitis supurativa.
La continuación del tratamiento tras 12 semanas debe reconsiderarse cuidadosamente en pacientes que no hayan presentado mejoría en este período de tiempo.
Si se necesita interrumpir el tratamiento, se puede reintroducir AMGEVITA 40 mg semanalmente u 80 mg en semanas alternas (ver sección 4.1).
Se debe evaluar periódicamente el balance beneficio/riesgo del tratamiento a largo plazo (ver sección 4.1). Enfermedad de Crohn: El régimen de dosificación inicial recomendado de AMGEVITA para pacientes adultos con enfermedad de Crohn activa de moderada a grave es de 80 mg en la semana 0 seguido de 40 mg en la semana 2. En caso de que sea necesaria una respuesta más rápida al tratamiento, se puede cambiar la posología a 160 mg en la semana 0 (administrada mediante 4 inyecciones de 40 mg en un día o con 2 inyecciones de 40 mg por día durante dos días consecutivos), 80 mg en la semana 2 (administrada mediante dos inyecciones de 40 mg en un día), siendo consciente del mayor riesgo de reacciones adversas durante el inicio del tratamiento.
Después de iniciar el tratamiento, la dosis recomendada es de 40 mg administrados en semanas alternas vía inyección subcutánea. De forma alternativa, si un paciente interrumpe el tratamiento con AMGEVITA y los signos y síntomas de la enfermedad recurren, se puede readministrar AMGEVITA. Hay poca experiencia en la re-administración transcurridas más de 8 semanas desde la dosis previa.
Los corticoesteroides se pueden reducir durante el tratamiento de mantenimiento, de acuerdo con las guías de práctica clínica.
Para algunos pacientes que han experimentado una disminución de su respuesta con AMGEVITA 40 mg en semanas alternas, puede ser beneficioso un aumento de la dosis de AMGEVITA 40 mg semanales u 80 mg en semanas alternas.
Para algunos pacientes que no han respondido al tratamiento en la semana 4, puede ser beneficioso continuar con un tratamiento de mantenimiento hasta la semana 12. El tratamiento continuado debe ser cuidadosamente reconsiderado en pacientes que no hayan respondido dentro de este período de tiempo.
Colitis ulcerosa: La dosis de inducción recomendada de AMGEVITA para pacientes adultos con colitis ulcerosa de moderada a grave es de 160 mg en la semana 0 (administrada mediante 4 inyecciones de 40 mg en un día o con 2 inyecciones de 40 mg por día durante dos días consecutivos) y 80 mg en la semana 2 (administrada mediante 2 inyecciones de 40 mg en un día). Después del tratamiento de inducción, la dosis recomendada es de 40 mg cada dos semanas mediante inyección subcutánea. Los corticoesteroides se pueden reducir durante el tratamiento de mantenimiento, de acuerdo con las guías de práctica clínica.
Para algunos pacientes que han experimentado una disminución de su respuesta con AMGEVITA 40 mg en semanas alternas puede ser beneficioso un aumento en la dosis de AMGEVITA a 40 mg semanales u 80 mg en semanas alternas.
La respuesta clínica se alcanza generalmente, dentro de 2-8 semanas de tratamiento. El tratamiento con AMGEVITA no debería continuarse en pacientes que no respondan dentro de este período de tiempo.
Uveítis: La dosis recomendada de AMGEVITA para pacientes adultos con uveítis es de una dosis inicial de 80 mg, seguida de 40 mg administrado en semanas alternas comenzando una semana después de la dosis inicial. Hay experiencia limitada en el inicio del tratamiento con adalimumab en monoterapia. El tratamiento con AMGEVITA se puede iniciar en combinación con corticoesteroides y/o con otros agentes inmunomoduladores no biológicos. El tratamiento concomitante con corticoesteroides puede ser ajustado de acuerdo con la práctica clínica comenzando dos semanas tras el inicio del tratamiento con AMGEVITA. Se recomienda una evaluación anual del beneficio y riesgo del tratamiento continuado a largo plazo (ver Propiedades farmacodinámicas).
Poblaciones especiales
Pacientes de edad avanzada: No se requiere ajuste de dosis.
Insuficiencia renal y/o hepática: Adalimumab no se ha estudiado en estas poblaciones de pacientes, por lo que no hay recomendaciones de dosis.
Población pediátrica
Artritis idiopática juvenil
Artritis idiopática juvenil poliarticular desde los 2 años de edad: La dosis recomendada de AMGEVITA para pacientes con artritis idiopática juvenil poliarticular, a partir de los 2 años de edad se basa en el peso corporal (Tabla 1). AMGEVITA se administra en semanas alternas en inyección por vía subcutánea.
|
Tabla 1. Dosis de AMGEVITA para pacientes con |
|
|
Peso del paciente |
Pauta Posológica |
|
10 kg hasta < 30 kg |
20 mg en semanas alternas |
|
≥ 30 kg |
40 mg en semanas alternas |
La respuesta clínica se consigue, por lo general, dentro de las primeras 12 semanas de tratamiento. La continuación con el tratamiento debe ser reconsiderada cuidadosamente en los pacientes que no hayan respondido en este período de tiempo.
No hay un uso relevante de adalimumab en pacientes menores de 2 años para esta indicación.
Artritis asociada a entesitis: La dosis recomendada de AMGEVITA para pacientes con artritis asociada a entesitis en pacientes a partir de 6 años se basa en el peso corporal (Tabla 2). AMGEVITA se administra en semanas alternas en inyección por vía subcutánea.
|
Tabla 2. Dosis de AMGEVITA para pacientes con |
|
|
Peso del paciente |
Pauta Posológica |
|
15 kg hasta < 30 kg |
20 mg en semanas alternas |
|
≥ 30 kg |
40 mg en semanas alternas |
No se ha estudiado el uso de adalimumab en pacientes con artritis asociada a entesitis menores de 6 años. Psoriasis pediátrica en placas: La dosis recomendada de AMGEVITA para pacientes con psoriasis pediátrica en placas desde los 4 a los 17 años de edad se basa en el peso corporal (Tabla 3). AMGEVITA se administra en inyección por vía subcutánea.
|
Tabla 3. Dosis de AMGEVITA para pacientes pediátricos con Psoriasis en Placas |
|
|
Peso del paciente |
Pauta Posológica |
|
15 kg hasta < 30 kg |
Dosis inicial de 20 mg, seguida de 20 mg administrados en semanas alternas empezando una semana después de la dosis inicial |
|
≥ 30 kg |
Dosis inicial de 40 mg, seguida de 40 mg administrados en semanas alternas empezando una semana después de la dosis inicial |
La continuación del tratamiento más allá de 16 semanas se debe reconsiderar de forma cuidadosa en pacientes que no hayan respondido en este período de tiempo. En el caso de que esté indicado el retratamiento con AMGEVITA, se deben seguir las indicaciones anteriores en cuanto a la dosis y la duración del tratamiento.
La seguridad de adalimumab en pacientes pediátricos con psoriasis en placas ha sido evaluada durante una media de 13 meses.
No existe una recomendación de uso específica para adalimumab en niños menores de 4 años para esta indicación.
Hidradenitis supurativa en adolescentes (a partir de 12 años de edad, con un peso de al menos 30 kg): No hay ensayos clínicos con adalimumab en pacientes adolescentes con HS. La posología de AMGEVITA en estos pacientes se ha determinado a partir de modelos farmacocinéticos y simulación (ver Propiedades farmacocinéticas).
La dosis recomendada de AMGEVITA es de 80 mg en la semana 0 seguida de 40 mg en semanas alternas comenzando en la semana 1 mediante inyección subcutánea.
En pacientes adolescentes con una respuesta inadecuada con AMGEVITA 40 mg en semanas alternas, se puede considerar un incremento de dosis a 40 mg semanales u 80 mg en semanas alternas.
Si es necesario se puede continuar el tratamiento con antibióticos durante el tratamiento con AMGEVITA. Durante el tratamiento con AMGEVITA se recomienda que el paciente utilice a diario un líquido antiséptico tópico en las lesiones de hidradenitis supurativa.
La continuación del tratamiento más allá de 12 semanas se debe reconsiderar de forma cuidadosa en pacientes que no hayan mejorado en este período de tiempo. Si se necesita interrumpir el tratamiento, se puede reintroducir AMGEVITA según proceda.
Se debe evaluar periódicamente el beneficio y el riesgo del tratamiento continuado a largo plazo (ver datos en adultos en Propiedades farmacodinámicas).
El uso de AMGEVITA en niños menores de 12 años para esta indicación no es relevante.
Enfermedad de Crohn pediátrica: La dosis recomendada de AMGEVITA para pacientes con enfermedad de Crohn desde los 6 a los 17 años de edad se basa en el peso corporal (Tabla 4). AMGEVITA se administra en inyección por vía subcutánea.
|
Tabla 4. Dosis de AMGEVITA para pacientes pediátricos con enfermedad de Crohn |
||
|
Peso del paciente |
Dosis de inducción |
Dosis de mantenimiento empezando en la semana 4 |
|
< 40 kg |
• 40 mg en la semana 0 y 20 mg en la semana 2. En caso de que sea necesario una respuesta más rápida al tratamiento siendo conscientes de que el riesgo de los efectos adversos podría aumentar con el uso de una dosis de inducción mayor, se puede usar la siguiente dosis: • 80 mg en la semana 0 y 40 mg en la semana 2. |
20 mg en semanas alternas. |
|
≥ 40 kg |
• 80 mg en la semana 0 y 40 mg en la semana 2. En caso de que sea necesario una respuesta más rápida al tratamiento siendo conscientes de que el riesgo de los efectos adversos podría aumentar con el uso de una dosis de inducción mayor, se puede usar la siguiente dosis: • 160 mg en la semana 0 y 80 en la semana 2. |
40 mg en semanas alternas. |
Pacientes que tengan una respuesta insuficiente pueden beneficiarse de un aumento de la dosis:
• < 40 kg: 20 mg cada semana
• ≥ 40 kg: 40 mg cada semana u 80 mg en semanas alternas
El tratamiento continuado debe ser cuidadosamente reconsiderado en pacientes que no hayan respondido en la semana 12.
El uso de adalimumab en niños menores de 6 años para esta indicación no es relevante.
Uveítis pediátrica: La dosis recomendada de AMGEVITA en pacientes pediátricos con uveítis desde los 2 años de edad se basa en el peso corporal (Tabla 5). AMGEVITA se administra en inyección por vía subcutánea.
En uveítis pediátrica, no hay experiencia en el tratamiento con AMGEVITA sin un tratamiento concomitante con metotrexato.
|
Table 5. Dosis de AMGEVITA para pacientes pediátricos con Uveítis |
|
|
Peso del paciente |
Pauta Posológica |
|
< 30 kg |
20 mg en semanas alternas en combinación con metotrexato. |
|
≥ 30 kg |
40 mg en semanas alternas en combinación con metotrexato. |
Cuando se inicie la terapia con AMGEVITA, se puede administrar una dosis de carga de 40 mg para pacientes de < 30 kg o de 80 mg para pacientes ≥ 30 kg una semana antes de empezar la terapia de mantenimiento. No hay datos clínicos disponibles sobre el uso de una dosis de carga de AMGEVITA en niños menores de 6 años (ver Propiedades farmacocinética).
No hay un uso relevante de AMGEVITA en niños menores de 2 años en esta indicación.
Se recomienda evaluar anualmente el beneficio y el riesgo en tratamientos continuados a largo plazo (ver Propiedades farmacodinámicas).
Colitis ulcerosa pediátrica: No se ha establecido la seguridad y eficacia de adalimumab en niños con edades comprendidas entre los 4 y 17 años. No hay datos disponibles. El uso de adalimumab en niños menores de 4 años para esta indicación no es relevante.
Artritis psoriásica y espondiloartritis axial incluyendo espondilitis anquilosante: El uso de adalimumab en la población pediátrica para las indicaciones de espondilitis anquilosante y artritis psoriásica no es relevante. Forma de administración: AMGEVITA se administra mediante inyección subcutánea. Las instrucciones completas para su uso se describen en el inserto. Instrucciones para el uso
Paso 1: Preparación
A. Saque del envase el número de jeringas prellenadas de AMGEVITA que necesita.
Coja la jeringa por el cuerpo de la jeringa para sacarla de la bandeja.
Coloque su dedo o pulgar en el borde de la bandeja para asegurarlo cuando retire la jeringa.
Coja por aquí
Vuelva a meter en la nevera el envase original con las jeringas sin usar.
Por motivos de seguridad:
- No coja la jeringa por el émbolo.
- No coja la jeringa por el capuchón de la aguja.
- No retire el capuchón de la aguja hasta que esté listo para la inyección.
- No retire las alas. Forman parte de la jeringa.
Para una inyección más confortable, deje la jeringa a temperatura ambiente durante 15 a 30 minutos antes de aplicar la inyección.
- No vuelva a colocar la jeringa en la nevera una vez haya alcanzado la temperatura ambiente.
- No intente calentar la jeringa utilizando una fuente de calor como agua caliente o un microondas.
- No deje la jeringa bajo la luz directa del sol.
- No agite la jeringa.
Importante: Sujete siempre la jeringa prellenada por el cuerpo de la jeringa.
B. Inspeccione la jeringa prellenada de AMGEVITA.
Sujete siempre la jeringa prellenada por el cuerpo de jeringa.
Compruebe que el medicamento contenido en la jeringa sea transparente y entre incoloro y ligeramente amarillento. No utilice la jeringa si:
- El medicamento está turbio o decolorado o contiene copos o partículas.
- Alguno de sus componentes parece agrietado o roto.
- El capuchón de la aguja no está o está suelto.
- Ha expirado la fecha de caducidad que aparece en la etiqueta.
En cualquiera de estos casos, utilice una jeringa nueva.
C. Reúna todos los materiales que necesita para la(s) inyección(es).
Lávese bien las manos con agua y jabón. Sobre una superficie de trabajo limpia y bien iluminada, coloque una jeringa prellenada nueva. Además, necesitará estos ítems adicionales, ya que no están incluidos en el envase:
- Toallitas con alcohol
- Un algodón o una gasa
- Una tirita
- Un contenedor para desechar objetos punzantes
D. Prepare y limpie la(s) zona(s) de inyección.
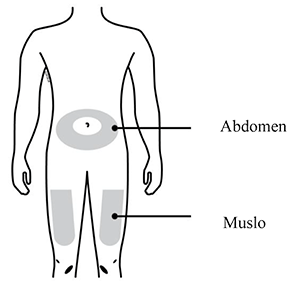
Puede utilizar:
- Muslo
- Abdomen, excepto la zona de 2 pulgadas (5 centímetros) alrededor del ombligo.
- Limpie la zona de inyección con una toallita con alcohol. Deje que la piel se seque.
- No vuelva a tocar esta zona antes de la inyección.
- Si quiere volver a usar la misma zona de inyección, asegúrese de no aplicar la inyección en el mismo punto que la última vez.
- No aplique las inyecciones en zonas donde la piel presente dolor a la palpación o esté amoratada, enrojecida o dura. Evite inyectar en las zonas con cicatrices o estrías.
- Si tiene psoriasis, debe evitar inyectarse directamente en la lesión o piel levantada, espesa, enrojecida o escamosa.
Paso 2: Prepárese
E. Cuando esté preparado para la inyección, tire del capuchón de la aguja en línea recta alejándolo del cuerpo.
Es normal que en la punta de la aguja haya una gota de líquido.
- No retuerza o doble el capuchón de la aguja.
- No vuelva a poner el capuchón de la aguja en la jeringa.
- No retire el capuchón de la jeringa hasta que esté listo para la inyección.
Importante: Tire el capuchón de la aguja en el contenedor para desechar objetos punzantes proporcionado. F. Pellizque la zona de inyección para crear una superficie firme.
Pellizque firmemente la piel entre el pulgar y los dedos abarcando una zona de unas 2 pulgadas (5 centímetros) de ancho.
Importante: Mantenga la piel pellizcada durante la inyección.
Paso 3: Inyecte
G. Mantenga la piel pellizcada. Con el capuchón de la aguja retirado, inserte la aguja en la piel con un ángulo de entre 45 y 90 grados.
No ponga el dedo en el émbolo mientras inserta la aguja.
H. Lentamente y ejerciendo una presión constante, empuje el émbolo del todo hasta que no se mueva más.
I.Cuando haya acabado, retire el pulgar y saque con cuidado la jeringa de la piel.
Paso 4: Terminar
J. Deseche la jeringa usada y el capuchón de la aguja.
- No vuelva a utilizar la jeringa usada.
- No utilice el medicamento que pueda quedar en la jeringa usada.
- Deposite la jeringa usada de AMGEVITA en un contenedor para desechar objetos punzantes inmediatamente tras su uso. No tire (deseche) la jeringa a la basura.
- Pregunte a su médico o farmacéutico cómo eliminar correctamente las jeringas. Es posible que exista una normativa local al respecto.
- No recicle la jeringa prellenada o el contenedor para desechar objetos punzantes, ni los tire a la basura.
Importante: Mantenga el contenedor para desechar objetos punzantes fuera de la vista y del alcance de los niños.
K. Examine el lugar de la inyección.
Si observa sangre, presione el lugar de la inyección con un algodón o una gasa. No frote el lugar de la inyección. Aplique una tirita si es necesario.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: No se observó toxicidad limitante de la dosis durante los ensayos clínicos en pacientes. El nivel de dosis más alto evaluado ha sido la administración intravenosa repetida de dosis de 10 mg/kg, que supone aproximadamente 15 veces la dosis recomendada.
PRESENTACIÓN:
Naturaleza y contenido del envase
Caja × 1 jeringa prellenada conteniendo 0,4 mL de solución inyectable con 20 mg de adalimumab + prospecto.
Caja × 1, 2 jeringa prellenada conteniendo 0,8 mL de solución inyectable con 40 mg de adalimumab + prospecto.
Caja × 1, 2 autooinyector prellenado conteniendo 0,8 mL de solución inyectable con 40 mg de adalimumab + prospecto.
AMGEVITA 20 mg solución inyectable en jeringa prellenada
0,4 mL de solución en jeringa prellenada (vidrio tipo I) con un émbolo (goma de bromobutilo) y una aguja de acero inoxidable con protector de aguja (elastómero termoplástico).
Tamaño de envase de una jeringa prellenada.
AMGEVITA 40 mg solución inyectable en jeringa prellenada
0,8 mL de solución en jeringa prellenada (vidrio tipo I) con un émbolo (goma de bromobutilo) y una aguja de acero inoxidable con protector de aguja (elastómero termoplástico).
Tamaño de envases de una y dos jeringas prellenadas.
Puede que solamente estén comercializados algunos tamaños de envases.
AMGEVITA 40 mg solución inyectable en autoinyector prellenado
0,8 mL de solución inyectable en autoinyector prellenado para uso del paciente que contiene una jeringa prellenada (vidrio tipo I). La pluma es de un solo uso, un dispositivo manual, inyectable, mecánico, desechable. El capuchón de la aguja del autoinyector prellenado está fabricado con caucho natural (un derivado del látex) (ver sección Advertencias y precauciones).
Tamaño de envases de una y dos autoinyectores prellenados.
Puede que solamente estén comercializados algunos tamaños de envases.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de conservación
Conservar en nevera (2°C a 8°C).
No congelar.
Conservar AMGEVITA dentro del embalaje para protegerlo de la luz.
La jeringa prellenada o el autoinyector prellenado se puede almacenar a una temperatura máxima de 30°C durante un período de hasta 7 días. La jeringa prellenada o el autoinyector prellenado se tienen que proteger de la luz y desechar si no se usan dentro de este período de 7 días.Precauciones especiales de eliminación
Se proporcionan instrucciones detalladas de uso en el inserto.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
BIBLIOGRAFÍA:
Datos preclínicos sobre seguridad: Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis única, a dosis repetidas y genotoxicidad.
Se ha llevado a cabo un estudio de toxicidad en el desarrollo embrio-fetal/perinatal en monos cynomolgus con dosis de 0,30 y 100 mg/kg (9-17 monos/grupo) que no ha revelado evidencia de daños fetales debidos a adalimumab. No se llevaron a cabo ni estudios de carcinogénesis ni de evaluación estándar de la fertilidad y de la toxicidad postnatal con adalimumab debido a la falta de modelos apropiados para estudiar un anticuerpo con reactividad cruzada limitada al TNF del roedor y al desarrollo de anticuerpos neutralizantes en roedores.