ACTILYSE 50MG
ALTEPLASA
Polvo y disolvente para solución inyectable
1 Vial inyectable, 50 Miligramos
1 Caja, 2 Vial(es), 50 mg
COMPOSICIÓN:
Cada VIAL de liofilizado contiene:
50 mg de activador tisular de plasminógeno humano recombinante (Alteplasa).
Excipientes (ácido fosfórico, L-arginina, polisorbato 80), c.s.
Traza residual: gentamicina proveniente del proceso de fabricación.
Cada VIAL de solvente contiene:
50 ml de agua estéril para inyectables.
La solución reconstituida contiene 1 mg de alteplasa por ml.
INDICACIONES TERAPÉUTICAS:
Indicaciones
Tratamiento trombolítico en el infarto agudo de miocardio
Régimen posológico de 90 minutos (acelerado) (véase la sección Posología, modo de administración): para aquellos pacientes en los cuales el tratamiento puede iniciarse dentro de las 6 horas subsiguientes a la aparición de los síntomas.
Régimen posológico de 3 horas (véase la sección Posología, modo de administración): para aquellos pacientes en los cuales el tratamiento puede iniciarse dentro de las 6 a 12 horas subsiguientes a la aparición de los síntomas. ACTILYSE® ha demostrado reducir la mortalidad a los 30 días en pacientes con infarto agudo de miocardio. Tratamiento trombolítico en la embolia pulmonar aguda con inestabilidad hemodinámica
El diagnóstico debe ser confirmado siempre que sea posible por un medio objetivo, como la angiografía pulmonar o procedimientos no invasivos como el scanner pulmonar.
No se han realizado estudios clínicos sobre la mortalidad y la morbilidad tardía relacionadas con la embolia pulmonar.
Tratamiento trombolítico del accidente cerebrovascular isquémico agudo
El tratamiento debe iniciarse a la mayor brevedad posible dentro de las 4,5 horas subsiguientes al inicio de los síntomas de accidente cerebrovascular y luego de haberse descartado una hemorragia intracraneal mediante técnicas de diagnóstico por imágenes adecuadas (p. ej., tomografía computarizada craneal u otro método de diagnóstico por imágenes que tenga sensibilidad para detectar la presencia de hemorragia). El efecto del tratamiento depende del tiempo; por lo tanto, cuanto antes se inicie el tratamiento, mayores son las probabilidades de un resultado favorable.
MECANISMO DE ACCIÓN:
Acción terapéutica: Trombolítico.
Código ATC: B01AD02.
Acción farmacológica
Modo de acción
El ingrediente activo del ACTILYSE, es alteplasa, un activador tisular del plasminógeno recombinante humano, una glucoproteína que activa el plasminógeno directamente a plasmina. Cuando se administra por vía endovenosa, alteplasa permanece relativamente inactivo en el sistema circulatorio. Una vez unido a la fibrina, se activa induciendo la conversión de plasminógeno a plasmina, conduciendo a la disolución del coágulo de fibrina.
Farmacodinamia
Debido a su relativa especificidad por la fibrina, ACTILYSE a una dosis de 100 mg lleva a una escasa reducción de los niveles de fibrinógeno circulante, hasta cerca del 60% en 4 horas, lo cual generalmente, es revertido hasta más del 80% después de 24 horas. El plasminógeno y la alfa-2-antiplasmina, disminuyen a cerca del 20% y 35%, respectivamente, después de 4 horas, y aumentan de nuevo, a más del 80% a las 24 horas. Una reducción marcada y prolongada del nivel de fibrinógeno circulante sólo se observa en unos pocos pacientes.
Farmacocinética
ACTILYSE se elimina rápidamente de la sangre circulante y se metaboliza principalmente en el hígado (depuración plasmática 550-680 ml/min). El t½ alfa, vida media plasmática relevante, es de 4-5 minutos. Esto significa que después de 20 minutos, menos del 10% del valor inicial está presente en el plasma. Para la cantidad residual que queda en un compartimiento profundo, se midió una vida media beta de alrededor de 40 minutos.
Toxicología
En estudios de toxicidad subcrónica en ratas y monos tití no se observaron otros efectos secundarios inesperados más que el aumento en la tendencia al sangrado en dosis altas. En las pruebas de mutagenia no se observaron indicios de potencial mutagénico.
En animales preñados, no se observaron efectos teratogénicos luego de la perfusión intravenosa de dosis farmacológicamente efectivas. En conejos, dosis superiores a 3 mg/kg/día dieron lugar a efectos embriotóxicos (embrioletalidad, retraso en el crecimiento). En ratas, no se observaron efectos en el desarrollo peri-postnatal ni en los parámetros de fertilidad con dosis de hasta 10 mg/kg/día.
CONTRAINDICACIONES:
ACTILYSE® está contraindicado en:
- Pacientes con hipersensibilidad conocida al principio activo alteplasa, a la gentamicina (una traza residual del proceso de fabricación) o a cualquiera de los excipientes.
- Casos en que existe un alto riesgo de hemorragia como:
• Trastorno de sangrado significativo, actual o dentro de los últimos 6 meses, diátesis hemorrágica conocida.
• Pacientes en tratamiento efectivo con anticoagulantes orales, p.ej. warfarina sódica (INR> 1,3) (ver ADVERTENCIAS Y PRECAUCIONES, sección Sangrado).
• Antecedente de daño al sistema nervioso central (p.ej., neoplasia, aneurisma, cirugía intracraneana o de médula espinal).
• Antecedente, evidencia o sospecha de hemorragia intracraneana incluyendo, hemorragia subaracnoidea.
• Hemorragia severa o grave, manifiesta o reciente.
• Masaje cardíaco externo traumático o prolongado reciente (> 2 minutos) en los últimos 10 días.
• Parto dentro de los últimos 10 días.
• Punción reciente de un vaso sanguíneo no comprimible (p.ej. vena subclavia o yugular).
• Hipertensión arterial severa no controlada.
• Endocarditis bacteriana, pericarditis.
• Pancreatitis aguda.
• Enfermedad ulcerosa gastrointestinal comprobada durante los 3 últimos meses.
• Enfermedad hepática severa, incluyendo falla hepática, cirrosis, hipertensión portal (várices esofágicas) y hepatitis activa.
• Cirugía mayor, traumatismos importantes en los últimos 10 días (esto incluye cualquier trauma asociado con el infarto agudo de miocardio actual).
• Traumatismos recientes de la cabeza o el cráneo.
• Aneurismas arteriales, malformaciones arterio/venosas.
• Neoplasias con riesgo de sangrado aumentado.
En el caso de infarto agudo de miocardio aplican además las siguientes contraindicaciones adicionales:
- ACV hemorrágico o ACV de origen desconocido en cualquier momento.
- ACV isquémico o Accidente Isquémico Transitorio (AIT) en los 6 meses anteriores, excepto
- ACV isquémico agudo reciente dentro de las 4.5 horas.
En las indicaciones de embolia pulmonar aguda, también aplican las siguientes contraindicaciones:
- Antecedentes de accidente cerebrovascular hemorrágico o accidente cerebrovascular de origen desconocido.
- Accidente cerebrovascular isquémico o Ataques Isquémicos Transitorios (AIT) dentro de los 6 meses previos, excepto accidente cerebrovascular isquémico agudo actual producido dentro de las últimas 4,5 horas.
En el caso de ACV isquémico agudo se agregan a las anteriores, las siguientes contraindicaciones:
- Síntomas ACV isquémico que comenzaron más de 4,5 horas antes del inicio de la perfusión o cuando el tiempo de inicio de los síntomas es desconocido.
- Síntomas de ACV isquémico agudo que hayan mejorado rápidamente o que hayan resultado sólo mínimos, antes del inicio de la perfusión.
- ACV severo según la evaluación clínica (por ej. NIHSS > 25) y/o según las técnicas de imagen apropiadas.
- Convulsiones al inicio del ACV.
- Antecedente de ACV previo o traumatismo de cabeza severo, dentro de los últimos 3 meses.
- Combinación de ACV previo y diabetes mellitus.
- Administración de heparina dentro de las 48 horas previas al inicio del ACV con un Tiempo de Tromboplastina Parcial Activado (TPTa/KPTT) elevado al momento del inicio.
- Recuento de plaquetas menor a 100.000 / mm3.
- Presión arterial sistólica > 185 mmHg o presión arterial diastólica > 110 mm Hg, o necesidad de manejo agresivo (medicación IV) necesario para reducir la presión arterial a estos límites.
- Glucemia < 50mg/dl ó > 400 mg/dl.
- Niños menores de 16 años (para obtener información sobre niños ≥16 años véanse las secciones Advertencias y Precauciones)
REACCIONES ADVERSAS:
En indicación infarto agudo de miocardio, tromboembolismo agudo de pulmón y ACV isquémico agudo:
La reacción adversa más frecuente asociada con ACTILYSE® es el sangrado (≥1:100 a <1:10: sangrados importantes; ≥1:10: cualquier hemorragia) que provoca una disminución en los valores de hematocrito y/o hemoglobina. Puede producirse hemorragia en cualquier lugar o cavidad corporal y puede resultar en situaciones de riesgo para la vida, discapacidad permanente o muerte.
Los tipos de sangrados asociados con la terapia trombo lítica se pueden dividir en dos grandes categorías:
- Sangrado superficial, normalmente como consecuencia de la punción de los vasos o vasos sanguíneos lesionados.
- Hemorragias internas en cualquier sitio o cavidad corporal.
Puede asociarse con síntomas neurológicos hemorrágicos intracraneales, tales como somnolencia, afasia, hemiparesia, convulsión.
El número de pacientes tratados en ensayos clínicos con las indicaciones de embolismo pulmonar agudo y accidente cerebro vascular isquémico agudo (dentro del período ventana de 0 – 4,5 horas) fue muy pequeño en comparación al número estudiado en el infarto agudo de miocardio. Por lo tanto, pequeñas diferencias numéricas podrían atribuirse al pequeño tamaño de la muestra. Con excepción de hemorragia intracraneal como efecto secundario en la indicación de ACV así como en el caso de arritmias de reperfusión en la indicación de infarto de miocardio, no hay fundamentos médicos para asumir que el perfil cualicuantitativo de los efectos adversos de ACTILYSE en las indicaciones de embolismo pulmonar y ACV isquémico agudo es diferente al perfil en la indicación infarto de miocardio.
Trastornos del sistema inmunitario:
- reacciones anafilactoides, generalmente leves, pero que en casos aislados pueden ser potencialmente mortales.
Pueden presentarse como:
• exantema
• urticaria
• broncoespasmo
• angioedema
• hipotensión
• shock o cualquier otro síntoma asociado con hipersensibilidad
Trastornos del sistema nervioso:
- hemorragias intracraneales, como:
• hemorragia cerebral
• hematoma cerebral
• ACV hemorrágico
• transformación hemorrágica de ACV
• hematoma intracraneal
• hemorragia subaracnoidea
Trastornos oftalmológicos:
- hemorragia conjuntival.
Trastornos cardíacos:
- hemorragia del pericardio.
Trastornos vasculares:
- hemorragia tal como hematoma
- embolización, que puede llevar hacia las correspondientes consecuencias según el órgano afectado.
- sangrado de órganos parenquimatosos tal como hemorragia hepática.
Trastornos respiratorios, torácicos y mediastinales:
- hemorragia del tracto respiratorio tal como hemorragia de faringe, hemoptisis, epistaxis, hemorragia pulmonar
Trastornos gastrointestinales:
- hemorragia gastrointestinal tal como hemorragia gástrica, úlcera gástrica con hemorragia, hemorragia rectal, hematemesis, melena, hemorragia bucal, hemorragia gingival.
- hemorragia retroperitoneal tal como hematoma retroperitoneal,
- naúseas
- vómitos
Las náuseas y vómitos, también pueden aparecer como síntomas de un infarto de miocardio.
Trastornos de la piel y del tejido subcutáneo:
- equimosis.
Trastornos renales y urinarios:
- hemorragia urogenital tal como hematuria, hemorragia del tracto urinario.
Trastornos generales y complicaciones en el sitio de administración:
- sangrado en los lugares de inyección o punción tales como hematoma en el sitio del catéter, hemorragia en el sitio del catéter, hemorragia en el sitio de punción.
Parámetros clínicos:
- caída en presión arterial.
- aumento de la temperatura corporal.
Heridas, intoxicación y complicaciones del procedimiento:
- embolismo graso*, los cuales pueden producir las consecuencias correspondientes en el órgano afectado.
* El evento de embolia grasa no fue observado en la población del estudio clínico, sino que se detectó en reportes espontáneos.
Procedimientos quirúrgicos y médicos:
- transfusión sanguínea
Lista de reacciones adversas adicionales para la indicación de infarto agudo de miocardio:
Trastornos cardíacos:
- arritmias por reperfusión, como:
• arritmia
• extrasístoles
• fibrilación auricular
• bloqueo auriculoventricular de grado I hasta bloqueo auriculoventricular completo
• bradicardia
• taquicardia
• arritmia ventricular
• fibrilación ventricular
• la taquicardia ventricular se relaciona estrechamente con el tiempo de tratamiento con ACTILYSE®
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones
No se han realizado estudios formales de interacciones entre ACTILYSE® y los medicamentos administrados comúnmente a pacientes con infarto agudo de miocardio. Medicamentos que afectan la coagulación / función plaquetaria
Los medicamentos que afectan la coagulación o aquellos que alteran la función plaquetaria pueden aumentar el riesgo de sangrado antes, durante o después del tratamiento con ACTILYSE®, véase la sección Contraindicaciones.
Inhibidores de la ECA
El tratamiento concomitante con inhibidores de la ECA puede aumentar el riesgo de sufrir una reacción de hipersensibilidad (véanse las secciones Advertencias y Precauciones).
INFORMACIÓN COMPLEMENTARIA:
Elaborado por Boehringer Ingelheim Pharma GmbH & Co. KG, Biberach an der Riss, Alemania.
Industria Alemana.
Bajo licencia de Boehringer Ingelheim International GmbH, Ingelheim am Rhein, Alemania.
Importado y distribuido por Boehringer Ingelheim del Ecuador Cía. Ltda., Quito, Ecuador.
RECOMENDACIONES:
Advertencias
ACTILYSE debe ser usado por médicos experimentados en el uso de tratamientos trombolíticos y con las instalaciones para monitorizar dicho uso.
Como con otros trombolíticos, se recomienda que en todos los casos que se administre ACTILYSE, esté disponible el equipamiento estándar y la medicación para resucitación.
Hipersensibilidad
Las reacciones de hipersensibilidad mediadas por el sistema inmunitario asociadas a la administración de ACTILYSE® pueden ser causadas por el principio activo alteplasa, la gentamicina (una traza residual del proceso de fabricación), cualquiera de los excipientes (véase también la sección Contraindicaciones) o el tapón de los viales de vidrio (polvo ACTILYSE® y agua estéril para inyectable) que contiene caucho natural (un derivado del látex).
Tras el tratamiento no se ha observado formación sostenida de anticuerpos contra la molécula del activador recombinante del plasminógeno tisular humano. No hay experiencia sistemática con la readministración de ACTILYSE®.
También existe el riesgo de reacciones de hipersensibilidad mediada por un mecanismo no inmunitario.
El angioedema representa la reacción de hipersensibilidad más frecuentemente informada con ACTILYSE®. Este riesgo puede aumentar en la indicación de accidente cerebrovascular isquémico agudo y/o por el tratamiento concomitante con inhibidores de la Enzima Convertidora de Angiotensina (ECA) (véase la sección Interacciones).
Se debe monitorear a los pacientes tratados por cualquiera de las indicaciones autorizadas a fin de detectar casos de angioedema durante la perfusión y hasta las 24 h posteriores.
En el caso de producirse una reacción de hipersensibilidad severa (ej. angioedema), debe suspenderse la perfusión e iniciarse de inmediato el tratamiento adecuado, que puede incluir la intubación.
Sangrado
La complicación más común observada durante el tratamiento con ACTILYSE® es el sangrado. El uso concomitante de anticoagulación con heparina puede contribuir al sangrado. Como la fibrina es lisada durante el tratamiento con ACTILYSE®, puede presentarse sangrado en lugares de punción reciente. Por lo tanto, el tratamiento trombolítico requiere prestar cuidadosa atención a todos los posibles lugares de sangrado (incluyendo los de inserción de catéteres, punción arterial y venosa y punción con agujas). El uso de catéteres rígidos, inyecciones intramusculares y todo manejo innecesario del paciente debe ser evitado durante el tratamiento con ACTILYSE®. En caso de presentarse sangrado severo, en particular hemorragia cerebral, debe interrumpirse el tratamiento fibrinolítico y la administración concomitante de heparina debe suspenderse inmediatamente. Debe considerarse la administración de protamina si se ha administrado heparina dentro de las 4 horas previas al inicio del sangrado. Puede indicarse el uso racional de productos de transfusión en los pocos pacientes que no respondan a estas medidas conservadoras.
Después de cada administración debe realizarse una reevaluación clínica y de laboratorio, para considerar la necesidad de transfundir crioprecipitado, plasma fresco congelado y plaquetas. Es deseable alcanzar un nivel de fibrinógeno de 1 g/l con la perfusión de crioprecipitado. También debe considerarse el uso de antifibrinolíticos.
No debe administrarse una dosis superior a 100 mg de ACTILYSE® en el infarto agudo de miocardio ni en la embolia pulmonar, así como tampoco una dosis superior a 90 mg en el accidente cerebrovascular isquémico agudo, ya que esto ha sido asociado con un aumento del sangrado intracraneal.
Al igual que con todos los trombolíticos, el uso del tratamiento con ACTILYSE® tiene que ser evaluado cuidadosamente para balancear los posibles riesgos de sangrado con los beneficios esperados en las siguientes condiciones:
- inyecciones intramusculares recientes o traumatismos menores recientes, como biopsias, punción de vasos mayores, masaje cardíaco para reanimación.
- afecciones en las que existe un riesgo incrementado de hemorragia que no estén mencionadas en las contraindicaciones.
- pacientes que reciben tratamiento anticoagulante oral:
Puede considerarse el uso de ACTILYSE® cuando las pruebas de actividad anticoagulante apropiadas para los productos correspondientes no muestren actividad clínicamente relevante.
Para el tratamiento del infarto agudo de miocardio aplican además las siguientes advertencias y precauciones especiales:
- presión arterial sistólica >160 mmHg, véase también la sección Contraindicaciones
- edad avanzada, lo cual puede aumentar el riesgo de hemorragia intracerebral. Como el beneficio terapéutico también es positivo en pacientes de edad avanzada, debe evaluarse cuidadosamente la relación riesgo-beneficio.
Arritmias
La trombólisis coronaria puede conducir a arritmia asociada con la reperfusión. Las arritmias por reperfusión pueden producir un paro cardíaco, pueden ser potencialmente mortales y pueden requerir el uso de tratamientos antiarrítmicos convencionales.
Antagonistas de la glicoproteína IIb/IIIa
El uso concomitante de antagonistas de la GPIIb/IIIa aumenta el riesgo de sangrado.
Tromboembolismo
El uso de trombolíticos puede incrementar el riesgo de eventos tromboembólicos en los pacientes con trombos en el lado izquierdo del corazón, p. ej., estenosis mitral o fibrilación auricular.
Para el tratamiento de la embolia pulmonar aguda aplican además las siguientes advertencias y precauciones especiales:
- presión arterial sistólica >160 mmHg, véase también la sección Contraindicaciones
- edad avanzada, lo cual puede aumentar el riesgo de hemorragia intracerebral. Como el beneficio terapéutico también es positivo en pacientes de edad avanzada, debe evaluarse cuidadosamente la relación riesgo-beneficio.
Para el tratamiento del accidente cerebrovascular isquémico agudo aplican además las siguientes advertencias y precauciones especiales:
El tratamiento debe ser realizado bajo la responsabilidad de un médico entrenado y con experiencia en cuidados neurológicos. Para verificar la indicación a tratar, las medidas de diagnóstico remoto pueden considerarse adecuadas (véase la sección Indicaciones; tratamiento trombolítico del accidente cerebrovascular isquémico agudo).
Sangrado
Las hemorragias intracerebrales representan el principal evento adverso (hasta aproximadamente, 15% de los pacientes). Sin embargo, esto no ha evidenciado un aumento en la morbilidad y mortalidad general. En comparación con otras indicaciones, los pacientes con accidente cerebrovascular isquémico agudo tratados con ACTILYSE® tienen un riesgo considerablemente mayor de hemorragia intracraneal ya que el sangrado se produce principalmente en la región infartada. Esto aplica especialmente en los siguientes casos:
- todas las situaciones citadas en la sección Contraindicaciones y, en general, todas las situaciones que involucran un alto riesgo de hemorragia.
- demora en el inicio del tratamiento.
- los pacientes pretratados con Ácido Acetilsalicílico (AAS) pueden tener un mayor riesgo de hemorragia intracerebral, particularmente si se demora el tratamiento con ACTILYSE®.
- en comparación con los pacientes más jóvenes, los pacientes de edad avanzada (más de 80 años) pueden tener resultados ligeramente peores independientemente del tratamiento y un riesgo incrementado de hemorragia intracerebral cuando son tratados con trombólisis. En general, el índice riesgo/beneficio de la trombólisis en los pacientes de edad avanzada sigue siendo positivo. En los pacientes con Accidente Cerebrovascular Isquémico Agudo (ACIA), la trombólisis debe evaluarse en función de la relación riesgo-beneficio en cada caso.
El tratamiento no debe iniciarse más de 4,5 horas después de la aparición de los síntomas puesto que la relación riesgo-beneficio es desfavorable, principalmente debido a lo siguiente:
- los efectos positivos del tratamiento disminuyen con el tiempo.
- particularmente en los pacientes con tratamiento previo con AAS, la tasa de mortalidad se incrementa.
- existe un mayor riesgo de hemorragia sintomática.
Control de la presión arterial
Es necesario controlar la presión arterial durante la administración del tratamiento y durante las 24 horas posteriores. Se recomienda tratamiento antihipertensivo intravenoso si la presión arterial sistólica es superior a 180 mmHg o la presión arterial diastólica es superior a 105 mmHg.
Grupos especiales de pacientes con relación riesgo-beneficio reducida
El beneficio terapéutico se reduce en los pacientes con accidente cerebrovascular previo (véase también la sección Contraindicaciones) o con diabetes no controlada. La relación riesgo-beneficio en estos pacientes se considera menos favorable pero todavía positiva.
Los pacientes con infartos extensos presentan un mayor riesgo de un resultado desfavorable, incluidas hemorragia severa y muerte. En estos pacientes, debe considerarse cuidadosamente la relación riesgo-beneficio.
En los pacientes con accidente cerebrovascular, la probabilidad de un resultado favorable disminuye cuanto mayor es el tiempo transcurrido desde el inicio de los síntomas hasta el tratamiento, con el aumento de la edad, el aumento de la severidad del accidente cerebrovascular y el aumento de los niveles de glucemia al momento del ingreso, mientras que la probabilidad de discapacidad severa y muerte o sangrado intracraneal sintomático aumenta, independientemente del tratamiento. Edema cerebral
La reperfusión del área afectada por la isquemia puede inducir edema cerebral en la zona infartada.
Población pediátrica
Por el momento, sólo existe experiencia limitada con el uso de ACTILYSE® en los niños. En los niños ≥ 16 años de edad, el beneficio debe sopesarse cuidadosamente frente a los riesgos para cada paciente en particular.
Después de confirmarse un accidente cerebrovascular isquémico por tromboembolia arterial, los niños ≥ 16 años de edad deben ser tratados de acuerdo con las guías de tratamiento para la población adulta (descartando “imitadores del accidente cerebrovascular”).
Fertilidad, embarazo y lactancia
Existe una limitada cantidad de datos clínicos del uso de ACTILYSE durante el embarazo. En estudios preclínicos realizados con alteplasa en dosis mayores a las dosis usadas en el ser humano, se observa inmadurez fetal y/o embriotoxicidad, secundaria a la conocida actividad farmacológica de la droga. Alteplasa no es considerada una droga teratogénica. En casos de una enfermedad aguda que ponga en peligro la vida, se debe evaluar el beneficio contra el riesgo potencial.
No se conoce si alteplasa se excreta por leche materna.
No existe disponibilidad de datos clínicos sobre el impacto sobre la fertilidad de ACTILYSE. En estudios preclínicos realizados con alteplasa, no se ha observado eventos adversos sobre la fertilidad.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología, modo de administración
La administración de ACTILYSE debe ser iniciada tan pronto como se presenten los síntomas.
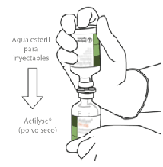
En condiciones de asepsia, debe disolverse el contenido de un vial de liofilizado de ACTILYSE de 50 mg con agua para inyectables estéril (50 ml), llevando la solución a una concentración de 1 mg de ACTILYSE por ml de solución y luego debe ser administrado en forma intravenosa de inmediato.
Instrucciones para la reconstitución de ACTILYSE®
1. Reconstituir inmediatamente antes de la administración.
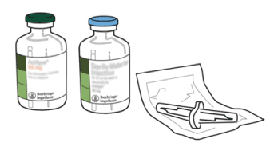
2. Retire las tapas protectoras de los dos viales que contienen el agua estéril y el polvo seco de ACTILYSE® deslizándolas hacia arriba con el pulgar.
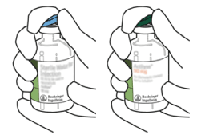
3. Limpie la parte superior de caucho de cada vial con un paño impregnado en alcohol.
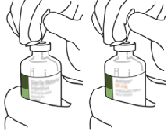
4. Retire la cánula de transferencia* de su cubierta. No desinfecte ni esterilice la cánula de transferencia; es estéril.
Quite una de las tapas.
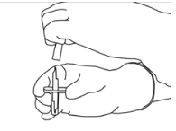
5. Coloque el vial de agua estéril hacia arriba en una superficie estable. Directamente desde arriba, pinche el centro del tapón de caucho verticalmente con la cánula de transferencia, presionando suave pero firmemente, sin girar.
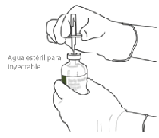
6. Sostenga constantemente el vial de agua estéril y la cánula de transferencia con una mano, usando las dos aletas laterales.
Retire la tapa que queda en la parte superior de la cánula de transferencia.
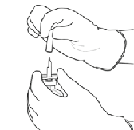
7. Sostenga constantemente el vial de agua estéril y la cánula de transferencia con una mano, usando las dos aletas laterales.
Mantenga el vial con polvo seco de ACTILYSE® arriba de la cánula de transferencia y coloque la punta de la cánula de transferencia justo en el medio del tapón.
Presione el vial con el polvo seco contra la cánula de transferencia directamente desde arriba, pinchando el tapón de caucho en forma vertical y suave, pero firmemente sin girar.
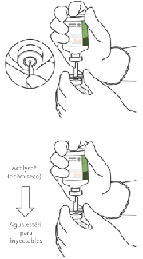
8. Invertir los dos viales y dejar que el agua drene completamente en el polvo seco.
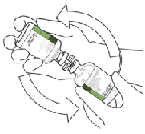
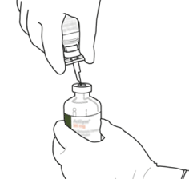
9. Retire el vial de agua vacío junto con la cánula de transferencia.
Ya puede desecharlos.
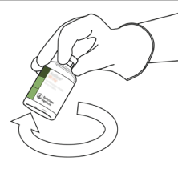
10.Tome el vial con ACTILYSE® reconstituido y agítelo suavemente para disolver el polvo que pudiera quedar, pero no lo agite bruscamente ya que eso produce espuma.
Si hay burbujas, deje reposar la solución durante unos minutos para que desaparezcan.
11. La solución consiste en 1 mg/ml de ACTILYSE®. Debe ser límpida, entre incolora y ligeramente amarillenta y no debe contener ninguna partícula.
12. Retire la cantidad requerida usando una aguja y una jeringa. No use el lugar donde pinchó con la cánula de transferencia a fin de evitar filtraciones.
13. Use inmediatamente.
Deseche la solución que no utilice.
(* si el kit incluye una cánula de transferencia. La reconstitución también puede realizarse con una jeringa y una aguja).
La solución reconstituida de 1mg/ml puede diluirse más con solución estéril para inyectables de cloruro de sodio 9 mg/ml (0,9%) hasta una concentración mínima de 0,2 mg/ml dado que no puede descartarse que la solución reconstituida presente turbidez.
No se recomienda una dilución adicional de la solución reconstituida de 1mg/ml con agua para inyectables estéril o el uso de soluciones que contengan glúcidos en general (por ej. dextrosa), debido a la creciente formación de turbidez de la solución reconstituida.
ACTILYSE no debe ser administrado junto con otros fármacos (ni siquiera heparina) ni en el mismo equipo de perfusión, ni en la misma vena.
Infarto agudo de miocardio
a) Régimen posológico de 90 minutos (acelerado) para los pacientes con infarto agudo de miocardio en los cuales el tratamiento puede iniciarse dentro de las 6 horas subsiguientes al inicio de los síntomas.
En pacientes con un peso corporal ≥ 65 kg:
• 15 mg como bolo intravenoso, seguido inmediatamente de:
• 50 mg como perfusión intravenosa durante los primeros 30 minutos, seguida de una perfusión intravenosa de:
• 35 mg durante 60 minutos, hasta la dosis máxima de 100 mg.
En pacientes con un peso corporal < 65 kg, la dosis total debe ajustarse en función del peso a
• 15 mg como bolo intravenoso, seguido inmediatamente de:
• 0,75 mg/kg de peso corporal como perfusión intravenosa durante los primeros 30 minutos (máximo 50 mg), seguido de una perfusión intravenosa de:
• 0,5 mg/kg durante 60 minutos (hasta un máximo de 35 mg).
b) Régimen posológico de 3 horas para los pacientes con infarto agudo de miocardio en los cuales el tratamiento puede iniciarse dentro de las 6 a 12 horas subsiguientes al inicio de los síntomas.
En pacientes con un peso corporal ≥ 65 kg:
• 10 mg como bolo intravenoso, seguido inmediatamente de:
• 50 mg como perfusión intravenosa durante la primera hora, seguida de una perfusión intravenosa de:
• 40 mg durante las dos horas siguientes, hasta alcanzar la dosis máxima de 100 mg.
En pacientes con un peso corporal inferior < 65 kg:
• 10 mg como bolo intravenoso, seguido inmediatamente de una perfusión intravenosa hasta alcanzar una dosis total máxima de 1,5 mg/kg.
Tratamiento complementario
Se recomienda tratamiento antitrombótico complementario de acuerdo a las guías internacionales actuales para el tratamiento de pacientes con infarto de miocardio con elevación del segmento ST.
Embolia pulmonar aguda
En pacientes con un peso corporal ≥ 65 kg:
Debe administrarse una dosis total de 100 mg en 2 horas. La mayor experiencia disponible corresponde al siguiente régimen posológico:
- 10 mg como bolo intravenoso durante 1-2 minutos, seguido inmediatamente de:
- 90 mg como perfusión intravenosa durante 2 horas hasta alcanzar la dosis total de 100 mg.
En pacientes con un peso corporal inferior a < 65 kg:
- 10 mg como bolo intravenoso durante 1-2 minutos, seguido inmediatamente de:
- una perfusión intravenosa hasta alcanzar una dosis total máxima de 1,5 mg/kg.
Tratamiento complementario
Después del tratamiento con ACTILYSE® debe iniciarse (o reanudarse) el tratamiento con heparina cuando los valores de Tiempo de Tromboplastina Parcial activada (TTPa) sean inferiores al doble del límite normal superior. La perfusión debe ajustarse de manera tal de mantener los valores de TTPa entre 50-70 segundos (1,5 a 2,5 veces el valor de referencia).
Accidente cerebrovascular isquémico agudo
La dosis total recomendada es de 0,9 mg/kg de peso corporal (máximo de 90 mg), comenzando con el 10 % de la dosis total en forma de bolo intravenoso inicial, seguido inmediatamente del resto de la dosis total administrada por perfusión intravenosa durante 60 minutos.
El tratamiento debe iniciarse a la mayor brevedad posible dentro de las 4,5 horas subsiguientes al inicio de los síntomas (véanse las secciones de Advertencias y Precauciones). El efecto del tratamiento depende del tiempo; por lo tanto, cuanto antes se inicie el tratamiento, mayores son las probabilidades de un resultado favorable.
|
Tabla de dosificación para el accidente |
||||||
|
Peso (kg) |
Dosis total (mg) |
Dosis en bolo (mg) |
Dosis de perfusión (mg) |
Administración de la perfusión (Jeringas de 50 ml, concentración de 1mg/ml) |
||
|
1ra. jeringa |
2da. jeringa |
Velocidad de perfusión* (ml/hora) |
||||
|
40 |
36,0 |
3,6 |
32,4 |
32,4 |
No aplica |
32,4 |
|
42 |
37,8 |
3,8 |
34,0 |
34,0 |
No aplica |
34,0 |
|
44 |
39,6 |
4,0 |
35,6 |
35,6 |
No aplica |
35,6 |
|
46 |
41,4 |
4,1 |
37,3 |
37,3 |
No aplica |
37,3 |
|
48 |
43,2 |
4,3 |
38,9 |
38,9 |
No aplica |
38,9 |
|
50 |
45,0 |
4,5 |
40,5 |
40,5 |
No aplica |
40,5 |
|
52 |
46,8 |
4,7 |
42,1 |
42,1 |
No aplica |
42,1 |
|
54 |
48,6 |
4,9 |
43,7 |
43,7 |
No aplica |
43,7 |
|
56 |
50,4 |
5,0 |
45,4 |
45,4 |
No aplica |
45,4 |
|
58 |
52,2 |
5,2 |
47,0 |
47,0 |
No aplica |
47,0 |
|
60 |
54,0 |
5,4 |
48,6 |
48,6 |
No aplica |
48,6 |
|
62 |
55,8 |
5,6 |
50,2 |
50,2 |
No aplica |
50,2 |
|
64 |
57,6 |
5,8 |
51,8 |
50,0 |
1,8 |
51,8 |
|
66 |
59,4 |
5,9 |
53,5 |
50,0 |
3,5 |
53,5 |
|
68 |
61,2 |
6,1 |
55,1 |
50,0 |
5,1 |
55,1 |
|
70 |
63,0 |
6,3 |
56,7 |
50,0 |
6,7 |
56,7 |
|
72 |
64,8 |
6,5 |
58,3 |
50,0 |
8,3 |
58,3 |
|
74 |
66,6 |
6,7 |
59,9 |
50,0 |
9,9 |
59,9 |
|
76 |
68,4 |
6,8 |
61,6 |
50,0 |
11,6 |
61,6 |
|
78 |
70,2 |
7,0 |
63,2 |
50,0 |
13,2 |
63,2 |
|
80 |
72,0 |
7,2 |
64,8 |
50,0 |
14,8 |
64,8 |
|
82 |
73,8 |
7,4 |
66,4 |
50,0 |
16,4 |
66,4 |
|
84 |
75,6 |
7,6 |
68,0 |
50,0 |
18,0 |
68,0 |
|
86 |
77,4 |
7,7 |
69,7 |
50,0 |
19,7 |
69,7 |
|
88 |
79,2 |
7,9 |
71,3 |
50,0 |
21,3 |
71,3 |
|
90 |
81,0 |
8,1 |
72,9 |
50,0 |
22,9 |
72,9 |
|
92 |
82,8 |
8,3 |
74,5 |
50,0 |
24,5 |
74,5 |
|
94 |
84,6 |
8,5 |
76,1 |
50,0 |
26,1 |
76,1 |
|
96 |
86,4 |
8,6 |
77,8 |
50,0 |
27,8 |
77,8 |
|
98 |
88,2 |
8,8 |
79,4 |
50,0 |
29,4 |
79,4 |
|
100+ |
90,0 |
9,0 |
81,0 |
50,0 |
31,0 |
81,0 |
|
* La velocidad de perfusión es la misma tanto para la primera como para la segunda jeringa. |
||||||
Tratamiento complementario
La seguridad y la eficacia de este régimen con la administración concomitante de heparina o antiagregantes plaquetarios tales como ácido acetilsalicílico durante las primeras 24 horas después de la presentación de los síntomas no han sido suficientemente evaluadas. Por lo tanto, debe evitarse la administración de heparina intravenosa o de inhibidores de la agregación plaquetaria tales como ácido acetilsalicílico en las primeras 24 horas luego del tratamiento con ACTILYSE® debido al mayor riesgo de hemorragia.
Si se requiere heparina para otras indicaciones (p. ej., para la prevención de la trombosis venosa profunda), la dosis no debe superar las 10.000 UI por día, administrada por vía subcutánea.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosificación
Síntomas
Si se excede la dosis máxima recomendada, aumenta el riesgo de sangrado intracraneal.
A pesar de la relativa especificidad por la fibrina, puede producirse una reducción clínicamente significativa de los niveles de fibrinógeno y otros componentes involucrados en la coagulación sanguínea luego de una sobredosis.
Tratamiento
En la mayoría de los casos, es suficiente con aguardar la regeneración fisiológica de estos factores luego de finalizado el tratamiento con ACTILYSE®. Si, a pesar de ello, se produjera un sangrado severo, se recomienda la perfusión de plasma fresco congelado o de sangre fresca y, en el caso de ser necesario, pueden administrarse antifibrinolíticos sintéticos.
En Argentina: "Ante esta eventualidad concurrir al hospital o comunicarse con los centros de toxicología: Htal. de Niños R. Gutiérrez tel. (011)-4962-6666/2247, Htal. P. de Elizalde tel. (011)-4300-2115, Htal. Fernández (011)-4801-5555 y Htal. A. Posadas tel. (011)-4658-7777/4654-6648."
En Ecuador: Notificación de Reacciones adversas a medicamentos: “Es importante notificar las sospechas de reacciones adversas después de la autorización del medicamento. Se invita a los usuarios así como a los profesionales de la salud a notificar las sospechas de reacciones adversas al siguiente e-mail: pv_local_ecuador@boehringer-ingelheim.com; cel. +593 994870886.
“Mediante la notificación Ud. puede contribuir a proporcionar mayor información sobre la seguridad del medicamento.”
En Paraguay: En caso de una sobredosificación acudir al hospital más cercano o comunicarse con el Hospital de Emergencia Médicas Centro Nacional de Toxicología.
Tel.: 220-418 – Gral. Santos y Teodoro Mongelos. En Uruguay: Ante una eventualidad concurrir al hospital, al Centro de Tóxico y Farmacovigilancia, Hospital de Clínicas-Facultad de Medicina, Tel. 1722.
PRESENTACIÓN:
2 viales de ACTILYSE 50 mg + 2 viales con 50 ml de agua para inyectables + 2 cánulas para transferencia.
Reg. San. Actilyse 50 mg: 29776-05-11
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Observaciones sobre conservación y almacenamiento
Consérvese a una temperatura no mayor de 30 ºC. Proteger de la luz.
Se ha demostrado que la solución reconstituida es estable durante 24 horas a 2 – 8 °C y durante 8 horas a 30 ºC.
Estabilidad microbiológica durante el uso
Desde el punto de vista microbiológico, el producto debe ser utilizado inmediatamente luego de ser reconstituido. De no usarse de inmediato, el tiempo y las condiciones de conservación durante el uso antes de ser administrado son responsabilidad del usuario y normalmente, no deben superar las 24 horas a 2-8 °C.
BIBLIOGRAFÍA:
Estudios clínicos
Pacientes con Infarto Agudo de Miocardio (IAM) Se han estudiado dos regímenes de dosis de ACTILYSE en pacientes con infarto agudo de miocardio agudo. No se ha evaluado la eficacia comparativa de estos dos regímenes.
Perfusión acelerada en pacientes con IAM
Se investigó la perfusión acelerada de ACTILYSE en un estudio internacional, multicéntrico (GUSTO), que randomizó 41,021 pacientes con infarto agudo de miocardio a cuatro regímenes trombolíticos. La administración de 100 mg de ACTILYSE durante 90 minutos con perfusión de heparina intravenosa concomitante, dio como resultado menor mortalidad después de 30 días (6,3%) comparado con la administración de estreptoquinasa 1,5 millones de UI durante 60 minutos con heparina subcutánea o intravenosa (7,3%). La disminución absoluta de 1% en la mortalidad a 30 días para ACTILYSE comparado con la estreptoquinasa fue estadísticamente significativa (p = 0,001).
Los pacientes tratados con ACTILYSE mostraron tasas de distensibilidad vascular relacionada con infarto mayores a los 60 y 90 minutos después de la trombólisis que los pacientes tratados con estreptoquinasa. No se observaron diferencias en las tasas de distensibilidad a más de 180 minutos.
Un estudio de mortalidad a gran escala (ASSENT 2) en aproximadamente 17,000 pacientes mostró que alteplasa y tenecteplasa son terapéuticamente equivalentes en la reducción de la mortalidad (6,2% para ambos tratamientos a los 30 días). El uso de tenecteplasa se asoció con una incidencia significativamente menor de sangrados intracraneales comparado con alteplasa (26,4% versus 28,9%, p = 0,0003). La reducción del riesgo de sangrado está probablemente relacionada con el aumento de la especificidad a fibrina de tenecteplasa y su régimen adaptado al peso corporal.
Perfusión de 3 horas en pacientes con IAM
En un estudio doble ciego, randomizado (5.013 pacientes) que comparó ACTILYSE con placebo (estudio ASSET) los pacientes infundidos con ACTILYSE en las 5 horas del comienzo de los síntomas de infarto agudo de miocardio experimentaron mejor supervivencia a los 30 días comparado con los tratados con placebo. Al mes, las tasas de mortalidad global fueron 7,2% para el grupo tratado con ACTILYSE y 9,8% para el grupo tratado con placebo (p = 0,001). Este beneficio se mantuvo a los 6 meses para los pacientes tratados con ACTILYSE (10,4%) comparado con los tratados con placebo (13,1%, p = 0,008).
En un estudio doble ciego, randomizado (721 pacientes) que comparó ACTILYSE con placebo, los pacientes infundidos con ACTILYSE dentro de las 5 horas del comienzo de los síntomas experimentaron mejor función ventricular 10 - 22 días después del tratamiento comparado con el grupo placebo, cuando la fracción de eyección global se midió por ventriculografía de contraste (50,7% versus 48,5%, p = 0,01). Los pacientes tratados con ACTILYSE tuvieron una reducción de 19% en el tamaño del infarto, medido mediante la liberación acumulativa de actividad de HBD (α-hidroxibutirato deshidrogenasa) comparado con los pacientes tratados con placebo (p = 0,001). Los pacientes tratados con ACTILYSE tuvieron significativamente menos episodios de shock cardiogénico (p = 0,02), fibrilación ventricular (p < 0,04) y pericarditis (p = 0,01) comparado con los pacientes tratados con placebo. La mortalidad a los 21 días en los pacientes tratados con ACTILYSE se redujo a 3,7% comparado con 6,3% en los pacientes tratados con placebo (p = 0,05 unilateral). Aunque estos datos no demuestran inequívocamente una reducción significativa en la mortalidad para este estudio, indican una tendencia que es avalada por los resultados del estudio ASSET.
En un estudio controlado con placebo (LATE) en 5.711 pacientes con IAM con comienzo de síntomas entre 6 y 24 horas, se comparó una perfusión de 100 mg de ACTILYSE durante 3 horas con placebo. Se observó una reducción no significativa de 14,1% (IC 95% 0 - 28,1%, p > 0,05) en la mortalidad a 30 días con ACTILYSE. En un análisis de supervivencia pre-especificado en pacientes tratados dentro de las 12 horas de comienzo de los síntomas, se observó una reducción significativa de 25,6% en la mortalidad a favor de ACTILYSE (IC 95% 6,3 - 45%, p = 0,023).
Pacientes con embolismo pulmonar aguda
En un estudio comparativo, randomizado, de alteplasa versus uroquinasa en 63 pacientes con embolia pulmonar aguda documentada angiográficamente, ambos grupos de tratamiento experimentaron una reducción significativa en la hipertensión pulmonar inducida por embolia pulmonar. La hemodinámica pulmonar mejoró significativamente más rápido con ACTILYSE que con uroquinasa.
Pacientes con accidente cerebrovascular isquémico agudo: Se han llevado a cabo varios estudios en el área del accidente cerebrovascular isquémico agudo. El estudio NINDS es el único sin límite superior de edad, es decir, que también incluyó pacientes de más de 80 años. Todos los demás estudios randomizados han excluido pacientes de más de 80 años. En los pacientes con Accidente Cerebrovascular Isquémico Agudo (ACIA), la trombólisis debe evaluarse en función de la relación riesgo-beneficio en cada caso.
Dos estudios controlados con placebo, doble ciego (NINDS t-PA Stroke Trial, Parte 1 y Parte 2), enrolaron pacientes con déficit neurológico mensurable que pudieron completar la selección y empezaron el tratamiento del estudio dentro de las 3 horas del comienzo de los síntomas. Se realizó una Tomografía Computada (TC) craneal antes del tratamiento para descartar la presencia de Hemorragia Intracraneal Sintomática (SICH). También se excluyó a pacientes por la presencia de condiciones relacionadas con el riesgo de sangrado, déficit neurológico menor, mejoría rápida de síntomas previa al inicio del tratamiento del estudio, o glucosa sanguínea < 50 mg/dl o > 400 mg/dl. Se randomizó a los pacientes para recibir 0,9 mg/kg de ACTILYSE (máximo de 90 mg) o placebo. Se administró ACTILYSE como bolo inicial de 10% durante 1 minuto seguido por perfusión intravenosa continua del remanente durante 60 minutos.
El estudio inicial (NINDS-Parte 1, n = 291) evaluó la mejoría neurológica a las 24 horas después del comienzo del accidente cerebrovascular. El criterio de valoración primario, la proporción de pacientes con una mejoría de 4 o más puntos en el puntaje de la Escala de Accidente Cerebrovascular de los Institutos Nacionales de Salud (NIHSS) o recuperación completa (puntaje NIHSS = 0), no fue significativamente diferente entre los grupos de tratamiento. Un análisis secundario sugirió mejoría en el resultado a los 3 meses asociado con el tratamiento con ACTILYSE usando las siguientes escalas de evaluación de accidente cerebrovascular: Índice de Barthel, Escala de Rankin Modificada (mRS), Escala de Resultado de Glasgow y NIHSS. Un segundo estudio (NINDS-Parte 2, n = 333) evaluó el resultado clínico a los 3 meses como resultado primario. Un resultado favorable se definió como discapacidad mínima o ausente usando las cuatro escalas de evaluación de accidente cerebrovascular: Índice de Barthel (puntaje > 95), Escala de Rankin Modificada (puntaje < 1), Escala de Resultado de Glasgow (puntaje = 1) y NIHSS (puntaje < 1). El índice de probabilidades para resultado favorable en el grupo ACTILYSE fue 1,7 (IC 95%; 1,2 - 2,6). Comparado con el placebo hubo un aumento absoluto de 13% en el número de pacientes con discapacidad mínima o ausente (mRS 0 – 1) (OR 1,7 (IC 95% 1,1 - 2,6). Hubo también un beneficio consistente observado con ACTILYSE en otras escalas neurológicas y de discapacidad. Los análisis secundarios demostraron mejoría funcional y neurológica consistente en las cuatro escalas de accidente cerebrovascular como indican las medianas de los puntajes. Estos resultados fueron altamente consistentes con los resultados a los 3 meses de los efectos del tratamiento observados en el estudio Parte 1. Las incidencias de mortalidad a los 90 días por todas las causas, SICH y accidente cerebrovascular isquémico nuevo después del tratamiento con ACTILYSE comparado con placebo indicaron un aumento significativo en la SICH sintomática (de acuerdo con la definición de NINDS) después del tratamiento con ACTILYSE dentro de las 36 horas (ACTILYSE 6,4%; Placebo 0,65%). En los pacientes tratados con ACTILYSE no hubo aumento comparado con placebo en las incidencias de mortalidad a los 90 días o de discapacidad severa (ACTILYSE 20,5%; Placebo 17,3%.)
Un análisis agrupado de 2.775 pacientes de 6 estudios clínicos randomizados principales (NINDS Parte 1 y 2, dos estudios ECASS y ATLANTIS parte A y B) evaluaron el estado de discapacidad de pacientes tratados con ACTILYSE o placebo. En este análisis, las probabilidades de un resultado favorable a los 3 meses aumentaron a medida que disminuía el tiempo al tratamiento con ACTILYSE. Se observó una tasa de SICH en 5,9% de los pacientes tratados con ACTILYSE versus 1,1% de los controles (p < 0,0001) lo cual se asoció con la edad pero no con el tiempo al tratamiento. Este análisis confirma fuertemente que el tratamiento rápido con ACTILYSE se asocia con mejores resultados a los 3 meses. También proporciona evidencia de que la ventana terapéutica puede ser tanto como de 4,5 horas.
En un gran estudio observacional (SITS-MOST: The Safe Implementation of Thrombolysis in Stroke-Monitoring Study) se evaluó la seguridad y eficacia de ACTILYSE para el tratamiento del accidente cerebrovascular agudo dentro de las 3 horas en un contexto clínico de rutina y se comparó con los resultados de estudios clínicos randomizados (RCTs). Todos los pacientes debían cumplir con el resumen de las características del producto ACTILYSE para Europa. Se recolectaron datos del tratamiento y el resultado de 6.483 pacientes de 285 centros en 14 países europeos. El resultado primario fue hemorragia intracraneal sintomática dentro de las 24 horas y mortalidad a los 3 meses. La tasa de SICH encontrada en el estudio SITS-MOST fue comparable con la tasa de SICH informada en estudios randomizados de 7,3% (IC 95% 6,7 - 8,0) en SITS-MOST versus 8,6% (IC 95% 6,1 – 11,1) en RCTs. La mortalidad fue 11,3% (IC 95% 10,5 - 12,1) en SITS-MOST versus 17% (IC 95% 13,9 - 20,7) en RCTs. Los resultados del estudio SITS-MOST indican que el uso clínico de rutina de ACTILYSE dentro de las 3 horas de comienzo del accidente cerebrovascular es tan seguro como se informó en los estudios clínicos randomizados.
ECASS III fue un estudio controlado con placebo, doble ciego, conducido en pacientes con accidente cerebrovascular agudo en una ventana temporal de 3 a 4,5 horas. El estudio enroló pacientes con déficit neurológico mensurable que cumplían con el resumen de características del producto (SmPC) para Europa, excepto por la ventana temporal. Después de excluir hemorragia cerebral o infarto mayor por tomografía computada, los pacientes con accidente cerebrovascular isquémico fueron randomizados 1:1 en forma doble ciego a alteplasa intravenoso (0,9 mg/kg de peso corporal) o placebo. El criterio de valoración primario fue discapacidad a los 90 días, dicotomizada para resultado favorable (escala de Rankin modificada [mRS] 0 a 1) o desfavorable (mRS 2 a 6). El criterio de valoración secundario principal fue un análisis de resultado global de cuatro puntajes neurológicos y de discapacidad combinados. Los criterios de valoración de seguridad incluían mortalidad, SICH y eventos adversos serios. Se randomizó un total de 821 pacientes (418 alteplasa/403 placebo). Más pacientes lograron un resultado favorable con alteplasa (52,4%) versus placebo (45,2%, índice de probabilidades [OR], 1,34; (IC 95% 1,02 - 1,76; p = 0,038). En el análisis global, mejoró también el resultado (OR, 1,28 (IC 95% 1,00 - 1,65; p = 0,048). La incidencia de algún SICH fue mayor con alteplasa versus placebo (cualquier SICH 27,0% versus 17,6%, p = 0,0012; SICH por definición de NINDS 7,9% versus 3,5%, p = 0,006; SICH por definición ECASS III 2,4% versus 0,2%, p=0,008). La mortalidad fue baja y no significativamente diferente entre alteplasa (7,7%) y placebo (8,4%; p = 0,681). Los resultados del estudio ECASS III mostraron que ACTILYSE entre 3 y 4,5 horas después del comienzo de los síntomas mejora significativamente los resultados clínicos en pacientes con accidente cerebrovascular isquémico agudo. La seguridad y eficacia de ACTILYSE para el tratamiento de accidente cerebrovascular isquémico agudo hasta 4,5 horas de tiempo desde el inicio de los síntomas hasta el comienzo del tratamiento (OTT) se ha evaluado en un estudio de registro AIS en curso (SITS-ISTR: The Safe Implementation of Thrombolysis in Stroke registry). Los datos de resultado primario y mortalidad de 21.566 pacientes en la ventana temporal de 0 a 3 horas se compararon con datos de 2.376 pacientes tratados entre 3 a 4,5 horas después del inicio de AIS (datos de 2010). La incidencia de hemorragia intracerebral sintomática (de acuerdo con la definición de NINDS) era ligeramente superior en la ventana temporal de 3 a 4,5 horas (7,4%) comparado con la ventana temporal de hasta 3 horas (IC 7,1%) cociente de probabilidades ajustada IC 95 %: 1,18 (0,99 -1,41) p =0,06). Las tasas de mortalidad a los 3 meses fueron similares comparando la ventana temporal de 3 a 4,5 horas (12,4%) con la ventana temporal de 0 a 3 horas (12,3%).
LEYENDAS DE PROTECCIÓN:
Consérvese a temperatura no mayor a 30°C.
Manténgase fuera del alcance de los niños.
Producto de uso delicado.
Adminístrese por prescripción y bajo vigilancia médica. Venta bajo receta médica.
Uso hospitalario.
Medicamento Innovador.
Mayor información disponible a
solicitud del cuerpo médico.
Boehringer-Ingelheim
del Ecuador Cía. Ltda.
Quito
Av. Shyris N-344 y Av. Eloy Alfaro.
Edificio Parque Central, Piso 15
Teléfono: 593 2 3979900