
TYGACIL
TIGECICLINA
Polvo liofilizado para reconstituir
Caja , 10 Vial(es) , Inyectable , 50 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
Composición y características farmacéuticas: La tigeciclina para inyección está disponible en viales de vidrio Tipo 1, unidosis de 5 mL, que contienen 50 mg de polvo liofilizado para infusión.
Cada vial contiene 100 mg de lactosa monohidrato. El pH es ajustado con acido clorhídrico y si es necesario con hidróxido de sodio.
Naturaleza y contenido del envase: Vial de vidrio Tipo I por 5 mL.
INDICACIONES
La tigeciclina está indicada para el tratamiento de las siguientes infecciones en adultos
— Infecciones ocasionadas por bacterias gram-positivas, gram-positivas resistentes, gram-negativas y gram-negativas resistentes, anaerobias y atípicas susceptibles a tigeciclina.
— Infecciones complicadas de la piel y tejidos blandos (IPTBc), incluyendo las causadas por Staphylococcus aureus resistentes a la meticilina (SARM).
La tigeciclina no está indicada para el tratamiento de infecciones del pie diabético (IPD) (ver Farmacodinámica, Eficacia clínica).
— Infecciones intraabdominales complicadas (IAIc).
— Neumonía adquirida en la comunidad (NAC).
La tigeciclina no está indicada para el tratamiento de la neumonía adquirida en el hospital o asociada con el ventilador.
MODO DE ACCIÓN: La tigeciclina, un antibiótico de la clase de las glicilciclinas, inhibe la traducción de las proteínas en las bacterias al unirse a la subunidad ribosomal 30S y bloquear la entrada de las moléculas del amino-acil del ARNt en el sitio A del ribosoma. Esto impide la incorporación de los residuos del aminoácido en las cadenas peptídicas elongadas. La tigeciclina contiene una molécula glicilamido unida a la posición 9 de la minociclina. Este modelo de sustitución no está presente en ninguna tetraciclina natural o semisintética e imparte propiedades microbiológicas que trascienden cualquier actividad in vitro e in vivo de cualquier derivado conocido de las tetraciclinas. Adicionalmente, la tigeciclina puede superar los dos mecanismos principales de resistencia a las tetraciclinas, protección ribosomal y bombas de eflujo. Por consiguiente, la tigeciclina ha mostrado su actividad in vitro e in vivo contra un amplio espectro de bacterias patógenas. No se ha observado resistencia cruzada entre la tigeciclina y otros antibióticos. En los estudios in vitro, no se ha observado antagonismo entre la tigeciclina y otros antibióticos comúnmente utilizados. En general, la tigeciclina se considera bacteriostática. Se observó una reducción de 2-log del recuento de colonias, a 4 veces la concentración inhibitoria mínima (CIM), con tigeciclina contra Enterococcus spp., Staphylococcus aureus, y Escherichia coli. Sin embargo, la tigeciclina ha mostrado actividad bactericida, y una reducción de 3-log contra Neisseria gonorrhoeae. La tigeciclina ha mostrado además actividad bactericida contra cepas de patógenos respiratorios comunes como Streptococcus pneumoniae, Haemophilus influenzae y Legionella pneumophilia.
Métodos de pruebas de susceptibilidad
Técnicas de dilución: Se utilizan métodos cuantitativos para determinar las CIMs antimicrobianas. Estas CIMs proveen estimados de la susceptibilidad de la bacteria a los compuestos antimicrobianos. Las CIMs se pueden determinar utilizando un procedimiento estandarizado basado en métodos de dilución (caldo, agar o microdilución) o su equivalente utilizando inóculos estandarizados y concentraciones de tigeciclina. Para pruebas de dilución en caldo para organismos aerobios, las CIMs deben ser determinadas utilizando un medio de ensayo que esté fresco (<12 horas de preparado). Los valores de la CIM deben ser interpretados de acuerdo con los criterios suministrados en la Tabla 2.
Técnicas de difusión: Los métodos cuantitativos que requieren la medida de diámetros de la zona también suministran estimados reproducibles de la susceptibilidad de la bacteria a los compuestos antimicrobianos. El procedimiento requiere el uso de concentraciones estandarizadas del inóculo. Este procedimiento usa discos de papel impregnados con 15 mcg de tigeciclina para probar la susceptibilidad de los microorganismos a la tigeciclina. La interpretación implica la correlación del diámetro, obtenido en la prueba del disco, con la CIM para la tigeciclina. Los reportes de laboratorio que suministran los resultados de la prueba de susceptibilidad de disco sencillo estándar, con un disco de 15 mcg de tigeciclina, deben ser interpretados de acuerdo con los criterios de la Tabla 2.
|
Tabla 2. Criterios de Interpretación del Resultado de la Prueba de Susceptibilidad para Tigeciclina |
||||||
|
Patógeno |
Concentraciones Inhibitorias Mínimas (mcg/mL) |
Difusión del Disco |
||||
|
S |
=I |
R |
S |
I |
R |
|
|
Staphylococcus aureus (incluye meticilino resistentes) |
= 0.5a |
- |
- |
= 19 |
- |
- |
|
Streptococcus spp. excepto el S. Pneumoniae |
= 0.25a |
- |
- |
= 19 |
- |
- |
|
Streptococcus pneumoniae |
= 0.12a |
- |
- |
= 21 |
- |
- |
|
Enterococcus faecalis (únicamente susceptibles a vancomicina) |
= 0.25a |
- |
- |
= 19 |
- |
- |
|
Enterobacteriaceaeb |
= 2 |
4 |
=8 |
= 19 |
15-18 |
=14 |
|
Haemophilus influenzae |
=1 a |
- |
- |
= 21 |
- |
- |
|
Moraxella catarrhalis |
=0.12a |
- |
- |
= 27 |
- |
- |
|
Anaerobiosc |
= 4 |
8 |
=16 |
n/a |
n/a |
n/a |
|
S= susceptible; I= intermedio; R= resistente aLa ausencia actual de cepas bacterianas resistentes descarta la posibilidad de definir algún resultado excepto “susceptible”. En aislamientos, en los cuales la concentración mínima inhibitoria en la categoría de “No susceptibilidad” debería ser sometida en un laboratorio de referencia para ser evaluada. b La tigeciclina tiene actividad “in vitro” disminuida contra la Morganella spp., Proteus spp., y Providencia spp. cDilución en agar. |
||||||
Un reporte de “Susceptible” indica que es probable que el patógeno sea inhibido si el compuesto antimicrobiano alcanza las concentraciones usualmente indicadas. Un reporte de “Intermedio” indica que el resultado debe ser considerado ambiguo, y si el microorganismo no es completamente susceptible a fármacos alternativos y clínicamente viables, la prueba debe repetirse. Esta categoría implica posible aplicabilidad clínica en los sitios del cuerpo en donde el fármaco está fisiológicamente concentrado o en situaciones en donde pueden ser usadas altas dosis del fármaco. Esta categoría también proporciona una zona de amortiguación que impide que pequeños factores técnicos no controlados causen grandes discrepancias en la interpretación. Un reporte de “Resistente” indica que es probable que el patógeno no sea inhibido aún si el compuesto antimicrobiano alcanza las concentraciones usualmente indicadas; en este caso debe seleccionarse otra terapia.
Control de calidad: Como con otras técnicas de susceptibilidad, se requiere el uso de microorganismos de control de laboratorio para controlar los aspectos técnicos de los procedimientos estandarizados del laboratorio. El polvo estándar de la tigeciclina debe suministrar los valores de CIM indicados en la Tabla 3. Para la técnica de difusión utilizando el disco con 15 mcg de tigeciclina, los laboratorios deben usar los criterios suministrados en la Tabla 2 para realizar la prueba de control de calidad de las cepas.
|
Tabla 3. Rangos de Control de Calidad Aceptables para Pruebas de Susceptibilidad |
||
|
Organismo de Control de Calidad |
Concentraciones Inhibitorias Mínimas (mcg/mL) |
Difusión del Disco |
|
Staphylococcus aureus ATCC 25923 |
No aplicable |
20-25 |
|
Staphylococcus aureus ATCC 29213 |
0,03-0,25 |
No aplicable |
|
Escherichia coli ATCC 25922 |
0,03-0,25 |
20-27 |
|
Enterococcus faecalis ATCC 29212 |
0,03-0,12 |
No aplicable |
|
Pseudomonas aeruginosa ATCC 27853 |
No aplicable |
9-13 |
|
Streptococcus pneumoniae ATCC 49619 |
0,016-0,12 |
23-29 |
|
Haemophilus influenzae ATCC 49247 |
0,06-0,5 |
23-31 |
|
Neisseria gonorrhoeae ATCC 49226 |
No aplicable |
30-40 |
|
Bacteroides fragilis ATCC 25285 |
0,12-1 |
No aplicable |
|
Bacteroides thetaiotaomicron ATCC 29741 |
0,5-2 |
No aplicable |
|
Eubacterium lentum ATCC 43055 |
0,06-05 |
No aplicable |
|
Clostridium difficile ATCC 70057 |
0.12-1 |
No aplicable |
|
ATCC= American Type Culture Collection |
||
La prevalencia de resistencia adquirida para las especies seleccionadas puede variar geográficamente y con el tiempo, por tanto es deseable tener información local sobre resistencia, particularmente cuando se traten infecciones severas. La siguiente información solamente suministra una guía aproximada de la probabilidad de que el microorganismo sea susceptible o no a la tigeciclina:
Susceptibles
Aerobios Gram-positivos
— Enterococcus avium
— Enterococcus casseliflavus
— Enterococcus faecalis* (incuye cepas susceptibles a vancomicina)
— Enterococcus faecalis (incluye cepas resistentes a vancomicina)
— Enterococcus faecium (incluye cepas susceptibles y resistentes a vancomicina)
— Enterococcus gallinarum
— Listeria monocytogenes
— Staphylococcus aureus* (incluye cepas susceptibles y resistentes a meticilina, incluyendo aislados que llevan marcadores virulentos y moleculares comúnmente asociados con SARM adquirido en la comunidad incluyendo el elemento SCCmec tipo IV el gene pvl)
— Staphylococcus epidermidis (incluye cepas resistentes y susceptibles a meticilina)
— Staphylococcus haemolyticus
— Streptococcus agalactiae*
— Streptococcus anginosus* (incluye S. anginosus, S. intermedius, S. constellatus)
— Streptococcus pyogenes*
— Streptococcus pneumoniae* (incluye cepas susceptibles a penicilina)
— Streptococcus pneumoniae (incluye cepas resistentes a penicilina)
— Grupo del estreptococo iiridans
Aerobios Gram-negativos
— Complejo Acinetobacter calcoaceticus /baumannii
— Aeromonas hydrophilia
— Citrobacter freundii*
— Citrobacter koseri
— Enterobacter aerogenes
— Enterobacter cloacae*
— Escherichia coli *(incluyendo cepas productoras de betalactamasas de espectro extendido)
— Haemophilus influenzae*
— Haemophilus parainfluenzae
— Klebsiella oxytoca*
— Klebsiella pneumoniae*(incluyendo cepas productoras de betalactamasas de espectro extendido
— Klebsiella pneumoniae (incluyendo cepas productoras de AMPc )
— Legionella pneumophila*
— Moraxella catarrhalis*
— Neisseria gonorrhoeae
— Neisseria meningitidis
— Pasteurella multocida
— Salmonella enterica ser. Enteritidis
— Salmonella enterica ser. Paratyphi
— Salmonella enterica ser. Typhi
— Salmonella enterica ser. Typhimurium
— Serratia marcescens
— Shigella boydii
— Shigella dysenteriae
— Shigella flexneri
— Shigella sonnei
— Stenotrophomonas maltophilia
Bacterias anaerobias
— Bacteroides fragilis*
— Bacteroides distasonis
— Bacteroides ovatus
— Bacteroides thetaiotaomicron*
— Bacteroides uniformis*
— Bacteroides vulgatus*
— Clostridium difficile
— Clostridium perfringens*
— Peptostreptococcus spp.
— Peptostreptococcus micros*
— Porphyromonas spp.
— Prevotella spp.
Bacterias atípicas
— Clamydia pneumoniae*
— Mycobacterium abscessus
— Mycobacterium chelonae
— Mycobacterium fortuitum
— Mycoplasma pneumoniae*
* Se ha demostrado eficacia clínica en aislados susceptibles en las indicaciones clínicas aprobadas.
Resistentes
Aerobios Gram-negativos
— Pseudomonas aeruginosa.
Bacterias anaerobias: No se han hallado especies que naturalmente sean inherentemente resistentes a la tigeciclina.
Resistencia: No se ha observado resistencia cruzada entre la tigeciclina y otros antibióticos.
La tigeciclina es capaz de superar los dos principales mecanismos de resistencia a las tetraciclinas, protección ribosomal y bombas de eflujo.
En estudios in vitro, no se ha observado antagonismo entre la tigeciclina y cualquier otra clase de antibióticos comúnmente usados.
USO EN PACIENTES GERIÁTRICOS: En un análisis agrupado de 3900 sujetos que recibieron tigeciclina en estudios clínicos Fase 3 y 4, 1026 tenían una edad de 65 años y más. De estos, 419 tenían 75 años y más. No se observaron diferencias generales inesperadas entre estos sujetos y sujetos de menor edad. No es necesario el ajuste de la dosis en pacientes ancianos.
USO EN PACIENTES PEDIÁTRICOS: La seguridad y eficacia en pacientes menores de 18 años de edad no han sido establecidas. Por lo tanto el uso en pacientes menores de 18 años de edad no está recomendado. (Ver Advertencias especiales).
COMPATIBILIDADES, INCOMPATIBILIDADES: Las soluciones intravenosas compatibles con tigeciclina incluyen cloruro de sodio al 0,9% para inyección USP, dextrosa al 5% para inyección USP y lactato de Ringer para inyección USP.
La tigeciclina es compatible con los siguientes fármacos o diluyentes cuando es usada con cloruro de sodio al 0,9% para inyección USP o dextrosa al 5% para inyección USP y administrada simultáneamente a través de la misma línea: amikacina, dobutamina, dopamina HCl, gentamicina, haloperidol, lactato de Ringer, lidocaína HCl, metoclopramida, morfina, norepinefrina, piperacilina/tazobactam (formulación con EDTA), cloruro de potasio, propofol, ranitidina HCl, teofilina y tobramicina.
Los siguientes fármacos no deben administrarse simultáneamente a través de la misma línea de la tigeciclina: anfotericina B, complejo lipídico de anfotericina B, diazepam, esomeprazol y omeprazol.
FARMACOCINÉTICA: El promedio de los parámetros farmacocinéticos de tigeciclina para el régimen de dosificación recomendado después de dosis intravenosa única y dosis intravenosas múltiples, se resume en la Tabla 14.
Las infusiones intravenosas de tigeciclina deben administrarse durante 30 a 60 minutos aproximadamente.
|
Tabla 14. Parámetros farmacocinéticos promedio de tigeciclina (CV%) |
||
|
Dosis única |
Dosis múltiple C |
|
|
Cmax (mcg/mL )a |
1,45 (22%) |
0,87 (27%) |
|
Cmax (mcg/mL )b |
0,90 (30%) |
0,63 (15%) |
|
AUC (mcg.h/mL) |
5,19 (36%) |
- |
|
AUC0-24h (mcg.h/mL) |
- |
4,70 (36%) |
|
Cmin (mcg/mL) |
- |
0,13 (59%) |
|
t½ (h) |
27,1 (53%) |
42,4 (83%) |
|
CL (L/h) |
21,8 (40%) |
23,8 (33%) |
|
CLr (mL/min) |
38,0 (82%) |
51,0 (58%) |
|
Vss (L) |
568 (43%) |
639 (48%) |
|
a infusión de 30 min b infusión de 60 min c 100 mg iniciales, seguidos por 50 mg cada 12 horas |
||
Absorción: La tigeciclina se administra por vía intravenosa, y por lo tanto tiene 100% de biodisponibilidad.
Distribución: In vitro, la unión de tigeciclina a proteínas plasmáticas ocurre en rangos aproximadamente de 71% a 89% a concentraciones observadas en los estudios clínicos (0,1 a 1,0 mcg/mL). Los estudios de farmacocinética en animales y en humanos han demostrado que la tigeciclina se distribuye fácilmente en los tejidos. En ratas que recibieron dosis única o múltiple de tigeciclina marcada con 14C, la radioactividad fue bien distribuida en la mayoría de los tejidos, con una mayor exposición total observada en hueso, médula, tiroides, riñón, bazo y glándulas salivares. En humanos, el volumen de distribución en estado estable de la tigeciclina estuvo en promedio entre 500 a 700 L (7 a 9 L/kg), indicando que la tigeciclina se distribuye extensamente en los tejidos humanos, más allá del volumen del plasma.
Dos estudios examinaron el perfil farmacocinético en estado estable de tigeciclina en tejidos o fluidos específicos de sujetos sanos que recibían 100 mg seguidos por 50 mg cada 12 horas. En un estudio de lavado broncoalveolar, el área bajo la curva AUC0-12 h de tigeciclina (134 mcg.h/mL) en células alveolares fue aproximadamente 77,5 veces mayor que el área bajo la curva AUC0-12 h en el suero de estos sujetos, y el AUC0-12 h (2,28 mcg.h/mL) en fluido epitelial fue aproximadamente 32% mayor que el AUC0-12 h en suero. En un estudio de ampollas cutáneas, el área bajo la curva AUC0-12h (1,61 mcg.h/mL) de tigeciclina en el fluido de la ampolla fue aproximadamente 26% menor que el área bajo la curva AUC0-12 h en el suero de estos sujetos.
En un estudio de dosis única, se administró a los sujetos 100 mg de tigeciclina antes de que fueran sometidos a procedimientos quirúrgicos ó médicos para la extracción del tejido. 4 horas después de la administración de tigeciclina, se midieron las concentraciones en las siguientes muestras de tejidos y fluidos: Vesícula biliar, pulmón, colon, líquido sinovial y hueso. La tigeciclina alcanzó concentraciones mayores en tejidos versus en el suero, en la vesícula biliar (38 veces, n=6), pulmón (3,7 veces, n=5) y colon (2,3 veces, n=6). No se ha estudiado la concentración de tigeciclina en estos tejidos después de dosis múltiples.
Metabolismo: La tigeciclina no es metabolizada extensamente. En estudios in vitro con tigeciclina utilizando microsomas de hígado humano, trozos de hígado, y hepatocitos condujeron a la formación de solo trazas de metabolitos. En hombres voluntarios sanos recibiendo tigeciclina radiomarcada con 14C, la tigeciclina fue el material primario radiomarcado recuperado en orina y heces, pero un glucurónido, un metabolito N-acetilo y un epímero de la tigeciclina (cada uno no más del 10% de la dosis administrada) también estuvieron presentes.
Eliminación: La recuperación del total de radioactividad en heces y orina siguientes a la administración de tigeciclina radiomarcada con 14C indica que el 59% de la dosis es eliminada por excreción biliar y fecal, y 33% es excretada en orina. Por lo general, la ruta primaria de eliminación de la tigeciclina es la excreción biliar de tigeciclina inalterada. La glucuronidación y la excreción renal de la tigeciclina inalterada son rutas secundarias.
La tigeciclina es un sustrato de la P-gp basado en un estudio in vitro empleando una línea celular con sobreexpresión de P-gp. Se desconoce la contribución potencial del transporte mediado por P-gp a la disposición in vivo de la tigeciclina.
FARMACODINAMIA, EFICACIA CLÍNICA
Infecciones complicadas de piel y tejidos blandos (IPTBc): Se evaluó la actividad de la tigeciclina en pacientes adultos para el tratamiento de IPTBc en dos estudios multicéntricos, multinacionales, con control activo, doble enmascarados y aleatorizados. Estos estudios compararon la tigeciclina (dosis inicial de 100 mg IV seguidos por 50 mg cada 12 horas) con vancomicina (1 g IV cada 12 horas)/aztreonam (2g IV cada 12 horas) por 5 a 14 días. Se incluyeron pacientes con infecciones complicadas de tejidos blandos profundos, incluyendo infecciones de heridas y celulitis (= 10 cm), que requerían cirugía/drenaje o con enfermedad de base complicada), abscesos grandes, úlceras infectadas y quemaduras. El punto primario final de eficacia fue la respuesta clínica en la prueba de curación (PDC) en poblaciones coprimarias de pacientes evaluables clínicamente (EC) y en pacientes con intención de tratamiento clínicamente modificada (ITMc). Ver Tabla 4.
|
Tabla 4. Porcentajes de Curación Clínica de dos Estudios Pivotales en Infecciones Complicadas de Piel y Tejidos Blandos (IPTBc) después de 5 a 14 Días de Terapia |
||
|
Tigeciclinaa |
Vancomicina/Aztreonam b |
|
|
EC ITMc |
365/422 (86,5) 429/538 (79,7) |
364/411 (88,6) 425/519 (81,9) |
|
a 100 mg inicialmente, seguidos por 50 mg cada 12 horas b Vancomicina (1 g IV cada 12 horas) / Aztreonam (2 g IV cada 12 horas) |
||
Los porcentajes de curación clínica en la PDC por patógeno, en pacientes evaluables microbiológicamente (ME) con IPTBc se presentan en la Tabla 5.
|
Tabla 5. Porcentajes de Curación Clínica en Pacientes Evaluables Microbiológicamente |
||
|
Patógeno |
Tigeciclina |
Vancomicina/ |
|
Escherichia coli Enterobacter cloacae Enterococcus faecalis (susceptible solo a vancomicina) Staphylococcus aureus susceptible a Meticilina (SASM)b Staphylococcus aureus resistente a Meticilina (SARM)b CA-SARMc Streptococcus agalactiae Streptococcus anginosus grp.d Streptococcus pyogenes Bacteroides fragilis |
29/36 (80.6) 10/12 (83.3) 15/21 (71.4) 124/137 (90.5) 79/95 (83.2) 13/20 (65.0) 8/8 (100) 17/21 (81.0) 31/32 (96.9) 7/9 (77.8) |
26/30 (86,7) 15/15 (100) 19/24 (79.2) 13/12 (94.2) 46/57 (80.7) 10/12 (83.3) 11/14 (78.6) 9/10 (90.0) 24/27 (88.9) 4/5 (80.0) |
|
a Dos estudios pivotales de infecciones de piel y tejidos blandos complicadas (IPTBc) y un estudio fase 3 de patógenos resistentes b Incluye casos de bacteremia concurrente. c CA-SARM = adquirida en la comunidad (aislados de SARM que portan marcadores moleculares y de virulencia asociados comúnmente con SARM adquirido en la comunidad, incluyendo el elemento SCCmec tipo IV y el gen pvl) d Incluye Streptococcus anginosus, Streptococcus intermedius y Streptococcus constellatus |
||
La tigeciclina no cumplió los criterios de no inferioridad en comparación con ertapenem en un estudio de pacientes con infección de pie diabético (ver Tabla 6). Este fue un ensayo aleatorizado, doble ciego, multinacional y multicéntrico que comparaba tigeciclina (150 mg cada 24 horas) con ertapenem (1 g cada 24 horas, con y sin vancomicina) por hasta 28 días. El resultado de eficacia primaria fue la respuesta clínica en la evaluación de la prueba de curación (PC) en la población coprimaria clínicamente evaluable (CE) y en la población clínica con intención de tratar modificada (c-mITT). El margen de no inferioridad fue -10% para la diferencia en las tasas de curación entre los dos tratamientos.
|
Tabla 6. Tasas de Curación Clínica en Pacientes con Infección de Pie Diabético hasta 28 Días de Tratamiento |
||
|
Tigeciclinaa |
Ertapenemb (±Vancomicina) |
|
|
CE |
316/408 (77,5%)c |
334/405 (82,5%)c |
|
c-mITT |
340/476 (71,4%)d |
363/466 (77,9%)d |
|
a 150 mg una vez cada 24 horas b 1 g una vez cada 24 horas c Diferencia ajustada = -5,5; IC 95% = -11,0, 0,1 d Diferencia ajustada = -6,7; IC 95% = -12,3; -1,1 |
||
Infecciones Intraabdominales Complicadas (IAIc): Se evaluó tigeciclina en adultos para el tratamiento de (IAIc) en dos estudios multicéntricos, multinacionales, con control activo, doble enmascarados y aleatorizados. Los estudios compararon tigeciclina (dosis inicial de 100 mg IV seguidos por 50 mg cada 12 horas) con imipenem/cilastatina (500 mg IV cada 6 horas) por 5 a 14 días. Se incluyeron pacientes con diagnósticos complicados incluyendo apendicitis, colecistitis, diverticulitis, perforación gástrica/duodenal, absceso intraabdominal, perforación del intestino y peritonitis. El punto final de eficacia primaria fue la respuesta clínica en la PDC para poblaciones coprimarias de pacientes ME y con intención de tratamiento microbiológicamente modificada (ITMm). Ver Tabla 7.
|
Tabla 7. Porcentajes de Curación Clínica de dos Estudios Pivotales en Infecciones Intraabdominales Complicadas (IAIc) |
||
|
Tigeciclinaa |
Imipenem/Cilastatinab |
|
|
ME ITMm |
441/512 (86,1) 506/631 (80,2) |
442/513 (86,2) 514/631 (81,5) |
|
a 100 mg inicialmente, seguidos por 50 mg cada 12 horas b Imipenem/Cilastatina (500 mg cada 6 horas) |
||
En la Tabla 8 se presentan los porcentajes de curación clínica de la PDC por patógeno, en pacientes ME con IAIc.
|
Tabla 8. Porcentajes de Curación Clínica por Patógeno en Pacientes evaluables Microbiológicamente (ME) con IAIca |
||
|
Patógeno |
Tigeciclina |
Imipenem/Cilastatina |
|
Citrobacter freundii |
12/16 (75,0) |
3/4 (75,0) |
|
Enterobacter cloacae |
15/17 (88.2) |
16/17 (94,1) |
|
Escherichia coli |
284/336 (84.5) |
297/342 (86,8) |
|
Klebsiella oxytoca |
19/20 (95,0) |
17/19 (89.5) |
|
Klebsiella pneumoniaeb |
42/47 (89.4) |
46/53 (86,8) |
|
Enterococcus faecalis |
29/38 (76,3) |
35/47 (74,5) |
|
Staphylococcus aureus Susceptible a Meticilina (SASM)c |
26/28 (92.9) |
22/24 (91,7) |
|
Staphylococcus aureus Resistente a la Meticilina (SARM)c |
16/18 (88.9) |
1/3 (33.3) |
|
Streptococcus anginosus grp.d |
101/119 (84,9) |
60/79 (75,9) |
|
Bacteroides fragilis |
68/88 (77,3) |
59/73 (80.8) |
|
Bacteroides thetaiotaomicron |
36/41 (87,8) |
31/36 (86,1) |
|
Bacteroides uniformis |
12/17 (70,6) |
14/16(87.5) |
|
Bacteroides vulgatus |
14/16 (87,5) |
4/6 (66.7) |
|
Clostridium perfringens |
18/19 (94,7) |
20/22 (90,9) |
|
Peptostreptococcus micros |
13/17 (76,5) |
8/11 (72,7) |
|
a Dos estudios pivotales de IIAc y dos estudios fase 3 de patógenos resistentes. b Incluye aislamientos productores de BLEE c Incluye casos de bacteremia concurrente. d Incluye Streptococcus anginosus, Streptococcus intermedius y Streptococcus constellatus |
||
Neumonía Adquirida en Comunidad (NAC): Se evaluó tigeciclina en adultos para el tratamiento de NAC en dos estudios (308 y 313) multicéntricos, multinacionales, con control activo, doble ciegos, aleatorizados. Los estudios compararon la tigeciclina (dosis inicial de 100 mg IV seguida por 50 mg cada 12 horas) con levofloxacina (500 mg IV cada 12 o 24 horas). En un estudio (Estudio 308), después de al menos tres días de tratamiento IV, se permitió para ambas ramas de tratamiento un cambio a levofloxacina oral (500 mg diarios). La duración total de la terapia fue de 7 a 14 días. Se incluyeron en el estudio pacientes con NAC que requirieron hospitalización y tratamiento IV. El criterio de valoración primaria de eficacia fue la respuesta clínica en la visita de PDC en las poblaciones coprimarias de pacientes CE y los pacientes con ITMc. Ver Tabla 9. Las tasas de curación clínica en la PDC por patógeno en los pacientes ME se presentan en la Tabla 10.
|
Tabla 9. Tasas de curación clínica en dos estudios pivotales de neumonía adquirida en la comunidad (NAC) después de 7 a 14 días de tratamiento |
||
|
Tigeciclinaa |
Levofloxacinab |
|
|
Integrado |
||
|
CE |
253/282 (89,7) |
252/292 (86,3) |
|
c-mITT |
319/394 (81,0) |
321/403 (79,7) |
|
Estudio 308 |
||
|
CE |
125/138 (90,6) |
136/156 (87,2) |
|
c-mITT |
149/191 (78,0) |
158/203 (77,8) |
|
Estudio 313 |
||
|
CE |
128/144 (88,9) |
116/136 (85,3) |
|
c-mITT |
170/203 (83,7) |
163/200 (81,5) |
|
a Inicialmente 100 mg seguido por 50 mg cada 12 horas b Levofloxacina (500 mg IV cada 12 o 24 horas); en un estudio (Estudio 308), después de al menos 3 días de tratamiento IV, se permitió en ambas ramas de tratamiento cambiar a levofloxacina oral (500 mg diarios). |
||
|
Tabla 10. Tasas de curación clínica por patógenos infectantes en sujetos ME con NACa |
||
|
Patógeno |
Tigeciclina |
Levofloxacina |
|
Chlamydia pneumoniae |
18/19 (94,7) |
26/27 (96,3) |
|
Haemophilus influenzae |
14/17 (82,4) |
13/16 (81,3) |
|
Legionella pneumophila |
10/10 (100,0) |
6/6 (100,0) |
|
Moraxella catarrhalis |
3/3 (100,0) |
3/5 (60,0) |
|
Mycoplasma pneumoniae |
37/39 (94,9) |
44/48 (91,7) |
|
Staphylococcus aureus susceptible a Meticilina (MSSA) |
9/12 (75,0) |
8/10 (80,0) |
|
Streptococcus pneumoniae (solamente susceptible a penicilina)b |
44/46 (95,7) |
39/44 (88,6) |
|
a Dos estudios pivotales de NAC b Incluye casos de bacteremia concurrente |
||
Staphylococcus aureus resistente a meticilina (SARM) y Enterococcus spp. resistente a vancomicina (VRE): En el Estudio 307 se evaluó tigeciclina en adultos para el tratamiento de varias infecciones serias (IAIc, IPTBc y otras infecciones) debidas a EVR y SARM.
El estudio 307 fue un estudio aleatorizado doble ciego, con controlador activo, multicéntrico, multinacional que evaluó tigeciclina (dosis inicial de 100 mg IV seguida por 50 mg cada 12 horas) y vancomicina (1 g IV cada 12 horas) para el tratamiento de infecciones debidas por SARM y evaluó también la tigeciclina (dosis inicial de 100 mg IV seguida por 50 mg cada 12 horas) y linezolid (600 mg IV cada 12 horas) para el tratamiento de infecciones por ERV durante 7 a 28 días. Se incluyeron en el estudio pacientes con IAIc, IPTBc y otras infecciones. El punto final de eficacia primaria fue la respuesta clínica en la consulta de PDC para las poblaciones coprimarias de los pacientes ME y los pacientes con ITM-m. Para las tasas de curación clínica ver Tabla 11 para SARM y Tabla 12 para ERV.
|
Tabla 11. Tasas de curación clínica para SARM obtenidas en el Estudio 307a de patógenos resistentes después de 7 a 28 días de tratamiento |
||
|
Tigeciclinab |
Vancomicinac |
|
|
Estudio 307 |
||
|
ME |
70/86 (81,4) |
26/31 (83,9) |
|
IAIc |
13/14 (92,9) |
4/4 (100,0) |
|
IPTBc |
51/59 (86,4) |
20/23 (87,0) |
|
-ITM-m |
75/100 (75,0) |
27/33 (81,8) |
|
IAIc |
13/15 (86,7) |
5/6 (83,3) |
|
IPTBc |
55/70 (78,6) |
20/23 (87,0) |
|
a El estudio incluyó pacientes con IAIc, IPTBc y otras infecciones. b Inicialmente 100 mg seguidos por 50 mg cada 12 horas. c 1 g IV cada 12 horas. |
||
|
Tabla 12. Tasas de curación clínica para ERV obtenidas en el Estudio 307a de patógenos resistentes después de 7 a 28 días de tratamiento |
||
|
Tigeciclinab |
Linezolidc |
|
|
Estudio 307 |
||
|
ME |
3/3 (100,0) |
2/3 (66,7) |
|
IAIC |
1/1 (100,0) |
0/1 (0,0) |
|
IPTBC |
1/1 (100,0) |
2/2 (100,0) |
|
m-mITT |
3/8 (37,5) |
2/3 (66,7) |
|
IAIC |
1/2 (50,0) |
0/1 (0,0) |
|
IPTBC |
1/2 (50,0) |
2/2 (100,0) |
|
a El estudio incluyó pacientes con IAIc, IPTBc y otras infecciones. b Inicialmente 100 mg seguidos por 50 mg cada 12 horas. c Linezolid (600 mg IV cada 12 horas) |
||
Patógenos Gram-negativos resistentes: El Estudio 309 evaluó la tigeciclina en adultos para el tratamiento de varias infecciones serias (IAIc, IPTBc, NAC y otras infecciones) debidas a patógenos gram-negativos resistentes.
El Estudio 309 fue de etiqueta abierta, multicéntrico, multinacional, evaluó tigeciclina (dosis inicial de 100 mg IV seguida por 50 mg cada 12 horas) para el tratamiento de infecciones debido a patógenos gram-negativos resistentes durante 7 a 28 días. Se incluyeron en este estudio pacientes con IAIc, IPTBc, NAC y otras infecciones. El criterio de valoración de eficacia primaria fue la respuesta clínica en la visita para PDC en las poblaciones de pacientes ME y los sujetos con ITM-m. Ver Tabla 13.
|
Tabla 13. Tasas de curación clínica obtenidas en el Estudio 309a de Patógenos Gram-Negativos Resistentes después de 5 a 28 días de tratamiento |
||||
|
Tigeciclinab |
Tigeciclinab |
Tigeciclinab |
||
|
Estudio 309 |
Todosc |
E. coli |
Klebsiella pneumoniae |
Enterobacter spp. |
|
ME |
26/36 (72,2) |
4/9 (44,4) |
5/6 (83,3) |
3/4 (75,0) |
|
IAIc |
2/2 (100,0)d |
1/1 (100,0)d |
1/1 (100,0) |
- |
|
IPTBc |
20/24 (83,3) |
3/5 (60,0) |
3/3 (100,0) |
3/3 (100,0) |
|
NAC |
0/1 (0,0) |
- |
- |
0/1 (0,0) |
|
ITM-m |
40/75 (53,3) |
5/10 (50,0) |
9/13 (69,2) |
8/15 (53,3) |
|
IAIc |
6/9 (66,7)d |
2/2 (100,0)d |
1/1 (100,0) |
1/1 (100,0)d |
|
IPTBc |
27/38 (71,1) |
3/5 (60,0) |
6/7 (85,7) |
7/8 (87,5) |
|
NAC |
0/1 (0,0) |
- |
- |
0/1 (0,0) |
|
a El estudio incluyó pacientes con IAIc, IPTBc, NAC y otras infecciones b Inicialmente 100 mg seguidos por 50 mg cada 12 horas c Incluye otros patógenos además de E. coli, Klebsiella pneumoniae y Enterobacter spp. d Excluye pacientes con control inadecuado de la fuente |
||||
Infecciones micobacterianas de rápido crecimiento: En estudios clínicos no controlados y experiencias de uso compasivo en ocho países, 52 pacientes con infecciones micobacterianas de rápido crecimiento (con mayor frecuencia enfermedad pulmonar por M. abscessus) se trataron con tigeciclina junto con otros antibióticos. La media y la mediana de las duraciones de los tratamientos fueron aproximadamente 5,5 meses y 3 meses, respectivamente (intervalo: 3 días hasta 3,5 años). Aproximadamente la mitad de los pacientes obtuvo mejoría clínica (es decir, mejora en los signos y síntomas de la enfermedad pulmonar, o curación de la herida, lesiones cutáneas o nódulos en la enfermedad diseminada). Aproximadamente la mitad de los pacientes requirió reducciones de dosis o descontinuación del tratamiento debido a náuseas, vómito o anorexia.
Electrofisiología cardíaca: No se detectó un efecto importante con una dosis única intravenosa de tigeciclina de 50 mg o 200 mg sobre el intervalo QTc en un estudio exhaustivo de QTc, aleatorizado, controlado con placebo y activo, de cuatro ramas, cruzado, en 46 sujetos sanos.
CONTRAINDICACIONES: La tigeciclina está contraindicada en pacientes con hipersensibilidad conocida a la tigeciclina.
USO DURANTE EL EMBARAZO: La tigeciclina puede causar daño fetal cuando se administra a mujeres embarazadas. Los resultados de estudios en animales indican que la tigeciclina cruza la placenta y se encuentra en los tejidos fetales. Se ha observado disminución del peso fetal en ratas y conejos (con retraso asociado en la osificación) y pérdidas fetales en conejos.
La tigeciclina no fue teratogénica en ratas y conejos. En los estudios preclínicos de seguridad, la tigeciclina marcada con 14C atravesó la placenta y se encontró en los tejidos fetales, incluyendo estructuras óseas fetales. La administración de tigeciclina se asoció con leve disminución del peso fetal y una incidencia aumentada de anomalías esqueléticas menores (retraso en la osificación) a exposiciones de 4,7 veces y 1,1 veces la dosis diaria humana, basados en el área bajo la curva (AUC), en ratas y conejos, respectivamente. Se observó incidencia aumentada de pérdidas fetales a exposiciones de 1,1 veces la dosis diaria humana, basándose en el AUC, en conejos, a dosis que producen mínima toxicidad materna.
No hay estudios adecuados y bien controlados de tigeciclina en mujeres embarazadas. La tigeciclina debería usarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial del feto.
La tigeciclina no ha sido estudiada para uso durante el trabajo de parto y el parto.
USO DURANTE LA LACTANCIA: Los resultados de estudios en animales utilizando tigeciclina marcada con 14C, indican que la tigeciclina se excreta rápidamente por la leche en ratas lactantes. Conforme con la limitada biodisponibilidad oral de la tigeciclina, existe muy poca o ninguna exposición sistémica a tigeciclina en las crías lactantes como resultado de exposición a la leche materna.
Se desconoce si éste fármaco se excreta en la leche humana. Debido a que muchos fármacos son excretados en la leche humana, debe tenerse precaución cuando se administre tigeciclina a mujeres lactando. (Ver Advertencias especiales).
EFECTOS SOBRE ACTIVIDADES QUE REQUIEREN CONCENTRACIÓN Y DESEMPEÑO: La tigeciclina puede causar mareos (ver Reacciones adversas), lo cual puede perjudicar la habilidad para manejar y/o operar maquinaria.
REACCIONES ADVERSAS
Las reacciones adversas esperadas están enumeradas de acuerdo con las categorías de frecuencia CIOMs
Muy común: > 10%
Común: > 1% y < 10%
Poco común: > 0,1% y < 1%
Raro: > 0,01% y < 0,1%
Muy raro: < 0,01%
Se reportaron las siguientes reacciones adversas en pacientes que recibieron tigeciclina
|
Sistema Corporal |
Reacción Adversa |
|
Alteraciones del sistema sanguíneo y linfático |
|
|
Común |
Prolongación del tiempo de tromboplastina parcial activada (PTTa), prolongación del tiempo de protrombina (PT), trombocitopenia |
|
Poco común |
Aumento de la relación normalizada internacional (INR) |
|
Desordenes en el Sistema Inmune |
|
|
Frecuencia indeterminada |
Anafilaxia, reacciones anafilactoides. |
|
Alteraciones del metabolismo y la nutrición |
|
|
Común |
Bilirrubinemia, aumento del nitrógeno uréico sérico (BUN), Hipoproteinemia, Hipoglicemia. |
|
Alteraciones del sistema nervioso |
|
|
Común |
Mareos |
|
Alteraciones cardiacas |
|
|
Común |
Flebitis |
|
Poco común |
Tromboflebitis |
|
Desordenes respiratorios, torácicos y del mediastino |
|
|
Común |
Neumonía |
|
Alteraciones del sistema gastrointestinal |
|
|
Muy común |
Náusea, vómito, diarrea |
|
Común |
Anorexia, dolor abdominal, dispepsia |
|
Poco común |
Pancreatitis Aguda |
|
Alteraciones Hepato-biliares |
|
|
Común |
Aspartato aminotransferasa sérica (AST) elevada, Alanina aminotransferasa sérica (ALT) elevada *. |
|
Poco común |
Ictericia |
|
Frecuencia no determinada |
Colestasis hepática |
|
Alteraciones de piel y tejidos subcutáneos |
|
|
Común |
Prurito, rash cutáneo |
|
Frecuencia no determinada |
Reacciones severas de la piel, incluyendo Síndrome de Steven -Johnson. |
|
Alteraciones generales y condiciones en el sitio de la inyección |
|
|
Común |
Cefalea, cicatrización anormal, reacción en el sitio de la inyección. |
|
Poco común |
Inflamación, dolor, edema y flebitis en el sitio de la inyección |
|
Exámenes de laboratorio |
|
|
Común |
Amilasa sérica elevada |
|
*Anormalidades en la AST y la ALT en pacientes en tratamiento con tigeciclina fueron reportadas más frecuentemente después de la terapia, en comparación con los pacientes que se encontraban en tratamiento con el comparador. |
|
En un análisis combinado de todos los 13 ensayos de Fase 3 y 4 que incluyeron un medicamento de comparación, se presentaron muertes en el 4,0% (150/3788) de los pacientes que recibían tigeciclina y en el 3,0% (110/3646) de los pacientes que recibían el medicamento de comparación. En un análisis combinado de estos ensayos, la diferencia en el riesgo de mortalidad, por cualquier causa, fue del 0,9% (IC 95% 0,1, 1,8) entre los pacientes tratados con tigeciclina y el medicamento de comparación. En un análisis combinado de estos ensayos, basado en un modelo de efectos aleatorios por peso de estudio, la diferencia de la mortalidad por cualquier causa fue de 0,6% (IC 95% 0,1, 1,2) entre los pacientes tratados con tigeciclina y los tratados con el comparador. No se observaron diferencias significativas entre tigeciclina y el comparador por tipo de infección (ver Tabla 1). No se ha establecido la causa del desequilibrio. Generalmente, las muertes fueron resultado del empeoramiento de la infección o de las complicaciones de la infección o debido a las comorbilidades subyacentes.
|
Tabla 1 : Pacientes con eventos adversos que produjeron la muerte por tipo de infección |
|||||
|
-Tigeciclina- |
-Medicamento de comparación- |
Diferencia en el riesgo* |
|||
|
Tipo de Infección |
n / N |
% |
n / N |
% |
% (IC 95%) |
|
IPTBc |
12/834 |
1,4 |
6/813 |
0,7 |
0,7 (-0,5, 1,9) |
|
AIc |
42/1382 |
3,0 |
31/1393 |
2,2 |
0,8 (-0,4, 2,1) |
|
NAC |
12/424 |
2,8 |
11/422 |
2,6 |
0,2 (-2,3; 2,7) |
|
NN |
66/467 |
14,1 |
57/467 |
12,2 |
1,9 (-2,6; 6,4) |
|
No NAVa |
41/336 |
12,2 |
42/345 |
12,2 |
0,0 (-5,1, 5,2) |
|
NAVa |
25/131 |
19,1 |
15/122 |
12,3 |
6,8 (-2,9, 16,2) |
|
PR |
11/128 |
8,6 |
2/43 |
4,7 |
3,9 (-9,1, 11,6) |
|
IPD |
7/553 |
1,3 |
3/508 |
0,6 |
0,7 (-0,8, 2,2) |
|
General No Ajustado |
150/3788 |
4,0 |
110/3646 |
3,0 |
0,9 (0,1, 1,8) |
|
General Ajustado |
150/3788 |
4,0 |
110/3646 |
3,0 |
0,6 (0,1, 1,2)** |
|
IPTBc= Infecciones complicadas de la piel y tejidos blandos; IAIc = Infecciones intraabdominales complicadas; NAC= Neumonía adquirida en comunidad; NN= Neumonía nosocomial; NAV = Neumonía asociada a ventilación mecánica PR = patógenos resistentes; IPD = Infecciones de pie diabético. * Diferencia entre los porcentajes de pacientes que murieron en los grupos de tratamiento con tigeciclina y con el medicamento comparador. El IC de 95% se calculó utilizando el Método de Puntuación de Wilson con corrección de continuidad. ** Estimado de diferencia de riesgo general ajustado (modelo de efectos aleatorios por peso del estudio) e IC de 95%. aEstos son subgrupos de la población con NN Nota: Los ensayos incluyeron 300, 305, 900 (pacientes con IPTBc), 301, 306, 315, 316, 400 (pacientes con IAIc), 308 y 313 (pacientes con NAC), 311 (con NN), 307 [Estudio de patógenos gram positivos resistentes en pacientes con SARM o enterococos resistentes a vancomicina (ERV)] y 319 (IPD con y sin osteomielitis). |
|||||
Las reacciones adversas más comunes emergentes durante el tratamiento en pacientes con tigeciclina fueron náusea 29,9% (19,3% leve; 9,2% moderada; 1,4% severa) y vómito 19,9% (12,1% leve; 6,8% moderado; 1,1% severo). En general, náusea o vómito tuvieron ocurrencia temprana (días 1 - 2).
La descontinuación de la tigeciclina fue asociada con mayor frecuencia con náusea (1,6%) y vómito (1,3%).
INTERACCIONES: En un estudio de interacciones farmacológicas en sujetos sanos, se coadministraron tigeciclina (100 mg seguidos por 50 mg cada 12 horas) y digoxina (0,5 mg seguidos por 0,25 mg cada 24 horas). La tigeciclina disminuyó levemente la Cmax de digoxina en un 13%, pero no afectó el AUC o la depuración de digoxina. Este pequeño cambio en la Cmax no afectó los efectos farmacodinámicos en estado estable de digoxina, como se midió por los cambios en los intervalos del ECG. Adicionalmente, la digoxina no afectó el perfil farmacocinético de la tigeciclina. Por tanto, no es necesario el ajuste de la dosis de tigeciclina cuando se coadministra con digoxina.
La administración concomitante de tigeciclina (100 mg seguidos por 50 mg cada 12 horas) y warfarina (25 mg en única dosis) en sujetos sanos resultó en disminución en la depuración de R-warfarina y S-warfarina en 40% y 23%, y un aumento en el AUC en 68% y 29%, respectivamente. La tigeciclina no alteró significativamente los efectos de la warfarina sobre el aumento de la relación normalizada internacional (INR). Adicionalmente, la warfarina no afectó el perfil farmacocinético de tigeciclina. Sin embargo, el tiempo de protrombina y otras pruebas de anticoagulación apropiadas deben ser monitorizadas si se coadministra tigeciclina con warfarina.
Estudios in vitro de microsomas de hígado humano indicaron que tigeciclina no inhibe el metabolismo mediado por ninguna de las 6 isoformas del citrocromo CYP450: 1A2, 2C8, 2C9, 2C19, 2D6 y 3A4. Por lo tanto, no se espera que tigeciclina altere el metabolismo de los fármacos metabolizados por estas enzimas. Además, y debido a que la tigeciclina no se metaboliza extensamente, no se espera que la depuración de tigeciclina se afecte por fármacos que inhiban o induzcan la actividad de estas isoformas del CYP450.
Estudios in vitro utilizando células Caco-2 indican que la tigeciclina no inhibe el flujo de digoxina, lo que sugiere que la tigeciclina no es un inhibidor de la glicoproteína P (P-gp). Esta información in vitro es consistente con la falta de efecto de la tigeciclina sobre la depuración de la digoxina observada en el estudio de interacciones medicamentosas in vivo descrito anteriormente.
La tigeciclina es un sustrato de la P-gp basado en un estudio in vitro empleando una línea celular con sobreexpresión de P-gp. Se desconoce la contribución potencial del transporte mediado por P-gp a la disposición in vivo de tigeciclina. La coadministración de inhibidores P-gp (por ejemplo, ketoconazol o ciclosporina) o inductores P-gp (por ejemplo, rifampicina) podría afectar la farmacocinética de la tigeciclina.
El uso concurrente de antibióticos con anticonceptivos orales puede ocasionar menor eficacia de los anticonceptivos orales.
INFORMACIÓN DE SEGURIDAD PRECLÍNICA
Carcinogenicidad: No se han realizado estudios de por vida en animales para evaluar el potencial carcinogénico de la tigeciclina.
Mutagenicidad: No se encontró potencial mutagénico o clastogénico en una serie de ensayos, incluyendo un ensayo in vitro de aberración cromosómica en células de ovario de hámster Chino (OHC), ensayo in vitro de mutación prematura en células de OHC (HGRPT locus), ensayo in vitro de mutación prematura en células de linfoma de ratón y ensayo in vivo de micronúcleo.
Deterioro de la fertilidad: La tigeciclina no afectó el apareamiento o la fertilidad en ratas con exposiciones hasta de 4,7 veces la dosis diaria humana basada en el AUC. En ratas hembras, no hubo efectos relacionados con el compuesto, sobre los ovarios o los ciclos del estro a exposiciones hasta 4,7 veces la dosis diaria humana basada en el AUC.
Otros: Se ha observado con tigeciclina una disminución de eritrocitos, reticulocitos, leucocitos y plaquetas, en asociación con hipocelularidad de la médula ósea, a exposiciones de 8,1 veces y 9,8 veces la dosis diaria humana, basados en el AUC, en ratas y perros, respectivamente. Estas alteraciones mostraron ser reversibles después de dos semanas de dosificación.
En estudios preclínicos, la administración intravenosa en bolo de tigeciclina se ha asociado con una respuesta histamínica. Estos efectos fueron observados a exposiciones de 14,3 y 2,8 veces la dosis diaria humana basada en el AUC en ratas y perros, respectivamente.
No se observó evidencia de fotosensibilidad en ratas después de la administración de tigeciclina.
INTERFERENCIA CON EXÁMENES DE LABORATORIOS Y OTROS DIAGNÓSTICOS: No se han reportado interacciones del fármaco con exámenes de laboratorio.
PRECAUCIONES: Debe tenerse precaución cuando la tigeciclina sea considerada como monoterapia en pacientes con IAIc secundarias a perforación intestinal clínica aparente. En estudios de IAIc fase 3 y 4 (n=2775), 140/1382 pacientes tratados con tigeciclina y 142/1392 pacientes tratados con comparador presentaron perforación intestinal. De esos pacientes, 8/140 pacientes tratados con tigeciclina y 8/142 pacientes tratados con comparador desarrollaron sepsis/choque séptico. La relación de este resultado con el tratamiento no puede establecerse.
Se han reportado casos aislados de disfunción hepática e insuficiencia hepática en pacientes que estaban siendo tratados con tigeciclina.
Antibióticos de la clase de las glicilciclinas son estructuralmente similares a las tetraciclinas y pueden tener reacciones adversas similares. Dentro de los efectos adversos se pueden incluir: fotosensibilidad, pseudotumor cerebral, pancreatitis y acción antianabólica (lo cual conlleva a incremento del BUN, azotemia, acidosis e hiperfosfatemia).
Pancreatitis aguda, que puede ser fatal, se ha presentado (frecuencia: poco común) asociada con el tratamiento con tigeciclina (ver Reacciones adversas). Se debe considerar el diagnóstico de pancreatitis aguda en pacientes que estén tomando tigeciclina y desarrollen síntomas clínicos, signos o anomalías de laboratorio que sugieran pancreatitis aguda. Se han reportado casos en pacientes sin factores de riesgo conocidos para pancreatitis. Los pacientes usualmente mejoran después de descontinuar el tratamiento con tigeciclina. En los pacientes en quienes se sospeche desarrollo de pancreatitis, se debe considerar la interrupción del tratamiento con tigeciclina.
La seguridad y eficacia de tigeciclina en pacientes con neumonía intrahospitalaria (NAH) no ha sido establecida. En un estudio de pacientes con NAH, los pacientes fueron aleatorizados para recibir tigeciclina (100 mg inicialmente y luego 50 mg cada 12 horas) o un comparador. Además, a los pacientes se les permitió recibir terapia específica complementaria. El subgrupo de pacientes con neumonía asociada al ventilador (NAV) que recibieron tigeciclina tuvieron menores tasas de curación (47.9% frente a 70.1% para la población clínicamente evaluable) y mayor mortalidad que el comparador (25/131 [19.1%] frente a 15/122 [12,3%]. De los pacientes con NAV y bacteremia al inicio del estudio, los que recibieron tigeciclina presentaron mayor mortalidad que los tratados con el comparador (9/18 [50,0%] versus 1/13 [7,7%]). Al igual que con otros antibióticos, el uso de este medicamento puede resultar en un crecimiento excesivo de organismos no susceptibles, incluyendo hongos. Los pacientes deben vigilarse cuidadosamente durante la terapia. Si ocurre superinfección, deben tomarse las medidas pertinentes.
ABUSO Y DEPENDENCIA: No se ha demostrado abuso o dependencia al fármaco, y estos son improbables.
ADVERTENCIAS ESPECIALES: Un aumento en la mortalidad por cualquier causa se ha observado en los ensayos clínicos de Fase 3 y 4 en los pacientes tratados con tigeciclina versus los pacientes tratados con el comparador. En un análisis combinado de todos los 13 ensayos de Fase 3 y 4 que incluyeron un comparador, el 4% (150/3788) de los pacientes que estaban recibiendo tigeciclina murieron versus el 3,0% (110/3646) de los pacientes que estaban recibiendo el medicamento comparador, presentando una diferencia de riesgo no ajustada de 0,9% (IC 95% 0,1, 1,8). En un análisis combinado de estos ensayos, basado en un modelo de efectos aleatorios por peso del ensayo, la diferencia de riesgo ajustada para todas las causas de mortalidad fue 0,6% (IC 95% 0,1, 1,2) entre los pacientes tratados con tigeciclina y los tratados con el comparador. La causa de este aumento no ha sido establecida. Este incremento de la mortalidad por cualquier causa debe considerarse cuando se estén seleccionado las diferentes opciones terapéuticas (ver Precauciones y reacciones adversas).
Anafilaxia/Reacciones Anafilactoides que pueden ser amenazantes para la vida han sido reportadas con casi todos los agentes antibacterianos, incluyendo tigeciclina.
Los antibióticos de la clase de las glicilciclinas son similares estructuralmente a las tetraciclinas. Por lo tanto, la tigeciclina debe administrarse con precaución en pacientes con hipersensibilidad conocida a los antibióticos de la clase de las tetraciclinas.
Los resultados de estudios con tigeciclina en ratas han mostrado cambio en la coloración ósea. La tigeciclina puede asociarse con cambio permanente del color de los dientes en humanos durante el desarrollo de los mismos.
Ha sido reportada colitis pseudomembranosa con casi todos los antibióticos, que puede variar en un rango de severidad de leve hasta amenazar la vida. Por lo tanto, es importante considerar este diagnóstico en pacientes que presenten diarrea subsiguiente a la administración de cualquier antibiótico.
DOSIS Y ADMINISTRACIÓN: El régimen de dosificación recomendado para tigeciclina es una dosis inicial de 100 mg, seguida de 50 mg cada 12 horas.
Las infusiones intravenosas (IV) de tigeciclina deben administrarse aproximadamente durante 30 a 60 minutos cada 12 horas.
La duración recomendada del tratamiento con tigeciclina para IPTBc, o para IAIc es de 5 a 14 días. La duración recomendada del tratamiento con tigeciclina para la NAC está entre 7 a 14 días. La duración de la terapia debe guiarse por la severidad y el sitio de la infección y el progreso clínico y bacteriológico del paciente.
Uso en pacientes con deterioro renal: No es necesario el ajuste de la dosis de tigeciclina en pacientes con deterioro renal o en pacientes bajo hemodiálisis. (Ver sección Farmacocinética).
Uso en pacientes con deterioro hepático: No es necesario el ajuste de la dosis de tigeciclina en pacientes con deterioro hepático leve a moderado (Child Pugh A y Child Pugh B). Basados en el perfil farmacocinético de la tigeciclina en pacientes con deterioro hepático severo (Child Pugh C), la dosis de tigeciclina debe ajustarse a 100 mg seguida por 25 mg cada 12 horas. Los pacientes con deterioro hepático severo (Child Pugh C) deben ser tratados con precaución y monitoreados en la respuesta al tratamiento. (Ver Farmacocinética, Insuficiencia hepática).
Uso en niños: No se han llevado a cabo ensayos clínicos para establecer la seguridad y eficacia de tigeciclina en pacientes menores de 18 años de edad. Por lo tanto, el uso en pacientes menores de 18 años de edad no está recomendado a menos que no se encuentren disponibles otros medicamentos antibacterianos. (Ver Advertencias especiales). Bajo estas circunstancias, se sugieren las siguientes dosis
— Los pacientes pediátricos de 8 a 11 años deberían recibir 1.2 mg/kg de tigeciclina cada 12 horas, en forma intravenosa a una dosis máxima de 50 mg de tigeciclina cada 12 horas.
— Los pacientes pediátricos de 12 a 17 años deberían recibir 50 mg de tigeciclina cada 12 horas.
— Las dosis pediátricas propuestas de tigeciclina se eligieron con base en las concentraciones observadas en ensayos de farmacocinética, que incluyeron una pequeña cantidad de pacientes pediátricos.
Uso en ancianos: En un análisis agrupado de 3900 sujetos que recibieron tigeciclina en estudios clínicos Fase 3 y 4, 1026 tenían una edad de 65 años y más. No se observaron diferencias generales inesperadas entre estos sujetos y los de menor edad. (Ver Uso geriátrico).
Raza y género: No es necesario el ajuste de la dosis de tigeciclina basado en la raza o el género (ver Farmacocinética).
Modo de administración: Infusión intravenosa.
FORMAS DE DOSIFICACIÓN Y VÍAS DE ADMINISTRACIÓN: Polvo estéril, liofilizado para infusión intravenosa.
POBLACIONES ESPECIALES
Insuficiencia hepática: En un estudio que comparó 10 pacientes con deterioro hepático leve, (Child Pug A), 10 pacientes con deterioro hepático moderado (Child Pug B), y cinco pacientes con deterioro hepático severo (Child Pugh C) con 23 sujetos sanos de control, equivalentes en edad y peso, la disposición farmacocinética de una dosis única de tigeciclina no se modificó en los pacientes con deterioro hepático leve. Sin embargo, la depuración sistémica de tigeciclina se redujo en 25%, y la vida media de tigeciclina se prolongó 23% en pacientes con deterioro hepático moderado (Child Pugh B). Adicionalmente, la depuración sistémica de tigeciclina se redujo 55%, y la vida media de tigeciclina se prolongó 43% en pacientes con deterioro hepático severo (Child Pugh C).
Basados en el perfil farmacocinético de la tigeciclina, no se requiere ajuste de la dosis en pacientes con deterioro hepático leve a moderado (Child Pugh A y Child Pugh B). Sin embargo, en pacientes con deterioro hepático severo (Child Pugh C), la dosis de tigeciclina debe reducirse a 100 mg seguidos de 25 mg cada 12 horas. Los pacientes con deterioro hepático severo (Child Pugh C) deben tratarse con precaución y debe monitorearse la respuesta al tratamiento (ver Dosis y administración, Uso en pacientes con deterioro hepático).
Insuficiencia renal: Un estudio con dosis única compararon 6 sujetos con deterioro renal severo (depuración de creatinina ClCr = 30 mL/min), 4 sujetos con enfermedad renal terminal que recibieron tigeciclina 2 horas antes de la hemodiálisis, 4 sujetos con enfermedad renal terminal recibieron tigeciclina después de la hemodiálisis y 6 sujetos sanos de control. El perfil farmacocinético de la tigeciclina no se alteró en ningún grupo de sujetos con deterioro renal, tampoco se removió la tigeciclina con la hemodiálisis. No es necesario el ajuste de la dosis de tigeciclina en pacientes con deterioro renal o en pacientes que están bajo hemodiálisis. (Ver Dosis y administración, Uso en pacientes con deterioro renal).
Ancianos: No se observaron diferencias en la farmacocinética de ancianos sanos (n=15), entre 65-75 años; n=13, mayores de 75 años, y sujetos más jóvenes (n=18) recibiendo una dosis única de 100 mg de tigeciclina. Por lo tanto, no es necesario el ajuste de la dosis basado en la edad.
Niños: Se llevó a cabo un estudio de seguridad, tolerabilidad y farmacocinética, de dosis única de tigeciclina en pacientes pediátricos de 8 a 16 años que se recuperaron recientemente de infecciones. Las dosis administradas fueron de 0.5; 1 o 2 mg/kg. El estudio mostró que para los niños de 12 a 16 años (n= 16) una dosis de 50 mg dos veces al día resultaría en exposiciones comparables a aquellas observadas en adultos con el régimen de dosificación aprobado. La gran variabilidad observada en niños de 8 a 11 años (n= 8) requiere estudios adicionales para determinar la dosificación apropiada.
Se llevó a cabo un estudio posterior de búsqueda de dosis de tigeciclina en pacientes de 8 a 11 años con IAIc, IPTBc, o CABP. Las dosis estudiadas de tigeciclina fueron de 0.75 mg/kg (n= 17), 1 mg/kg (n= 21), y 1.25 mg/kg (n= 20). Este estudio mostró que para los niños de 8 a 11 años, una dosis de 1.2 mg/kg resultaría en exposiciones comparables a aquellas observadas en adultos con el régimen de dosificación aprobado.
Género: En un análisis agrupado de 38 mujeres y 298 hombres que participaron en estudios farmacológicos clínicos, no hubo diferencia significativa en la media (±SD) de depuración de la tigeciclina entre mujeres (20,7±6,5 L/h), y hombres (22,8±8,7 L/h). Por lo tanto, no es necesario el ajuste de la dosis basado en el género.
Raza: En un análisis agrupado de 73 sujetos asiáticos, 53 sujetos afroamericanos, 15 sujetos hispánicos, 190 sujetos blancos y 3 sujetos clasificados como “otros”, que participaron en estudios clínicos farmacológicos, no hubo diferencias significativas en la media (±SD) de depuración de tigeciclina entre los asiáticos (28,8±8,8 L/h), negros (23,0±7,8 L/h), hispánicos (24,3±6,5 L/h), blancos (22,1±8,9 L/h) y “otros” (25,0±4,8 L/h). Por lo tanto, no es necesario el ajuste de la dosis basado en la raza.
SOBREDOSIS: No hay información específica disponible para el tratamiento de sobredosis con tigeciclina. La administración intravenosa de tigeciclina como única dosis de 300 mg durante 60 minutos en voluntarios sanos resultó en una incidencia aumentada de náusea y vómito. En estudios de toxicidad realizados en ratones con una única dosis intravenosa de tigeciclina, la mediana de la dosis letal estimada (LD50) era de 124 mg/kg en machos y 98 mg/kg en hembras. En ratas, la LD50 era de 106 mg/kg para ambos sexos. La tigeciclina no es removida en cantidades significativas con la hemodiálisis.
DESCRIPCIÓN:
Ingredientes activos, moléculas activas: Tigeciclina.
Nombre químico: (4S,4aS,5aR,12aS)-9-[2-(tert-butilamino)acetamida]-4,7-bis(demitilamino)-1,4,4a,5,5 a,6,11,12 a -octahidro-3,10,12,12a -tetrahidroxi-1,11-dioxo-2-naftacenecarboxamida.
Estructura
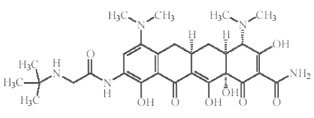
Fórmula molecular: C29H39N5O8
Peso molecular: 585.64
Características físicas: La tigeciclina es un polvo liofilizado de color naranja.
Clase farmacológica, clase terapéutica
— Antibiótico.
— Glicilciclina antimicrobiano.
— Código ATC: J01AA12
PRESENTACIÓN: TYGACIL 50 mg vial inyectable (Reg. San. INVIMA 2005M-0004889).
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
(Con base en CDS v 23.0)
LLD_Col_CDSv.23.0_12Feb2014_v.1.0_Aprobado por Resol. 2014041788_16Dic-2014
PFIZER S.A.S.
ALMACENAMIENTO Y VIDA ÚTIL
Producto liofilizado: La tigeciclina se debe almacenar a una temperatura no mayor a 30 °C antes de la reconstitución. No congelar. Una vez reconstituida, la tigeciclina debe ser administrada inmediatamente.
La solución reconstituida debe ser transferida posteriormente y diluida para la infusión IV.
MANEJO: El polvo liofilizado debe reconstituirse con 5,3 mL de cloruro de sodio al 0,9% para inyección USP, de dextrosa al 5% para inyección USP, o lactato de Ringer para inyección USP, para alcanzar una concentración de 10 mg/mL de tigeciclina. El vial debe agitarse suavemente hasta que el fármaco se disuelva. Luego, deben extraerse del vial 5 mL de la solución reconstituida y añadirse a una bolsa para infusión IV de 100 mL. Para una dosis de 100 mg, reconstituir utilizando dos viales en una bolsa para infusión IV de 100 mL. (Nota: el vial contiene un 6% de exceso. Por tanto 5 mL de solución reconstituida es equivalente a 50 mg del fármaco). La solución reconstituida debe ser de color amarillo a naranja; si no lo es, la solución debe ser descartada. Antes de su administración, los productos parenterales deben ser inspeccionados visualmente para verificar si existen partículas suspendidas y cambio en el color (por ejemplo, verde o negro), siempre que la solución y envase lo permitan. Una vez reconstituida, la tigeciclina debe ser administrada inmediatamente.
La tigeciclina puede administrarse por vía intravenosa a través de una línea exclusiva o a través de un catéter en Y. Si la misma línea intravenosa se usa para infusión secuencial de varios fármacos, la línea debe limpiarse antes y después de la infusión de tigeciclina con cloruro de sodio al 0,9% para inyección USP, o dextrosa al 5% para inyección USP. La inyección debe hacerse con una solución de infusión compatible con tigeciclina y con cualquier otro(s) fármaco(s) que se administre(n) por esta línea común. (Ver Compatibilidades e incompatibilidades).