
TRAYENTA DUO
LINAGLIPTINA, METFORMINA (BIGUANIDAS)
Comprimidos recubiertos
Caja , 60 Tabletas recubiertas
Caja , 30 Tabletas recubiertas , 5 Miligramos
Caja , 10 y 60 Tabletas cubiertas , 2,5/500 mg/mg
Caja , 10 y 60 Tabletas cubiertas , 2,5/850 mg/mg
Caja , 10 y 60 Tabletas cubiertas , 2,5/1000 mg/mg
Caja , 60 Tabletas recubiertas
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: 1 COMPRIMIDO Recubierto contiene (liberación inmediata): 1H-Purina-2,6-diona, 8-[(3R)-3-amino-1-piperidinil]-7-(2-butin-1-il)-3,7-dihidro-3-metil-1-[(4-metil-2-quinazolinil)metil]- (= linagliptina) 2,5 mg y N,N-dimetilimidodicarbonimídico diamida (= metformina) 500 mg, 850 mg o 1000 mg.
USO EN POBLACIONES ESPECÍFICAS:
• Fertilidad, embarazo y lactancia: Embarazo: No existen estudios adecuados y bien controlados en mujeres embarazadas realizados con TRAYENTA® DUO o sus componentes individuales. Los estudios preclínicos de reproducción realizados en ratas preñadas con los productos combinados en TRAYENTA® DUO no indicaron ningún efecto teratogénico que fuera atribuido a la coadministración de linagliptina y metformina.
Los datos disponibles sobre el uso de linagliptina en mujeres embarazadas son limitados. Los estudios preclínicos no indican efectos nocivos directos ni indirectos en lo que se refiere a la toxicidad para la reproducción.
Los datos disponibles sobre el uso de metformina en mujeres embarazadas son limitados. La metformina no fue teratogénica en ratas en una dosis de 200 mg/kg/día, asociada con valores equivalentes a 4 veces la exposición en humanos. Con dosis más elevadas (500 y 1000 mg/kg/día, asociadas con 11 y 23 veces la exposición humana), se observó teratogenicidad de la metformina en las ratas.
Como medida de precaución, es preferible evitar el uso de TRAYENTA® DUO durante el embarazo.
Cuando la paciente tiene planes de quedar embarazada, y durante el embarazo, la diabetes no debe tratarse con TRAYENTA® DUO, sino que debe usarse insulina para mantener los niveles de glucosa en sangre lo más cercanos posible a los valores normales, a fin de reducir el riesgo de malformaciones fetales asociadas con la presencia de niveles anormales de glucosa en sangre.
Lactancia: No se han realizado estudios en animales en período de lactancia con la combinación de metformina y linagliptina. Los estudios preclínicos efectuados con los principios activos en forma individual han demostrado que tanto la metformina como la linagliptina se excretan en la leche en las ratas en período de lactancia. La metformina se excreta en la leche en los seres humanos. Se desconoce si la linagliptina se excreta en la leche humana. TRAYENTA® DUO no debe utilizarse durante la lactancia.
Fertilidad: No se han realizado estudios sobre los efectos de TRAYENTA® DUO en la fertilidad en los seres humanos. No se observó ningún efecto adverso de la linagliptina sobre la fertilidad en los estudios preclínicos hasta la dosis más alta estudiada, que fue de 240 mg/kg/día (>900 veces la exposición humana).
• Conducción de vehículos y uso de maquinarias: No se han llevado a cabo estudios en torno al efecto de este producto sobre la capacidad para conducir vehículos y operar maquinarias.
• Pacientes pediátricos:
No se recomienda el uso de TRAYENTA® DUO en niños menores de 18 años de edad, dada la falta de datos de seguridad y eficacia en esta población.
• Pacientes de edad avanzada: En vista de que la metformina se excreta por vía renal, y los pacientes de edad avanzada tienen una tendencia al deterioro de la función renal, debe efectuarse un control periódico de la función renal en los pacientes de edad avanzada que reciban tratamiento con TRAYENTA® DUO (véase la sección “Advertencias y precauciones especiales”).
• Pacientes con insuficiencia renal:
Se debe evaluar la TFG antes de iniciar el tratamiento con productos que contengan metformina y, al menos, una vez al año a partir de entonces.
En los pacientes expuestos a un mayor riesgo de progresión de la insuficiencia renal y en pacientes de edad avanzada, se debe evaluar la función renal con mayor frecuencia, por ej., cada 3-6 meses.
Se deben revisar los factores que puedan aumentar el riesgo de acidosis láctica (véase Advertencias y precauciones) antes de considerar el inicio del tratamiento con metformina en los pacientes con TFG <60 ml/min.
|
Tabla 1. Posología para pacientes con insuficiencia renal* |
||
|
TFGe ml/min |
Metformina |
Linagliptina |
|
60 - 89 |
La dosis diaria máxima es de 3000 mg*. Se puede considerar la reducción de la dosis en relación al deterioro de la función renal |
No se requiere un ajuste de la dosis. |
|
45 - 59 |
La dosis diaria máxima es de 2000 mg. La dosis inicial es, a lo sumo, la mitad de la dosis máxima. |
No se requiere un ajuste de la dosis. |
|
30 - 44 |
La dosis diaria máxima es de 1000 mg*. La dosis inicial es, a lo sumo, la mitad de la dosis máxima. |
No se requiere un ajuste de la dosis. |
|
<30 |
El uso de metformina está contraindicado. |
No se requiere un ajuste de la dosis. |
|
*Si no se dispone de la dosis adecuada de TRAYENTA® DUO, se deben utilizar los monocomponentes individuales en lugar de la combinación a dosis fija. |
||
• Pacientes con insuficiencia hepática:
TRAYENTA® DUO está contraindicado en los pacientes con insuficiencia hepática, debido al componente metformina (véase la sección “Contraindicaciones”).
PROPIEDADES FARMACOLÓGICAS: Grupo farmacoterapéutico: Combinaciones de fármacos hipoglucemiantes orales.
Código ATC: A10BD11
Modo de acción: La linagliptina es un inhibidor de la enzima DPP-4 (dipeptidil peptidasa 4, EC 3.4.14.5), una enzima que está involucrada en la inactivación de las hormonas incretinas GLP-1 y GIP (péptido símil glucagón 1, polipéptido insulinotrópico dependiente de la glucosa). Estas hormonas son degradadas rápidamente por la enzima DPP-4. Ambas hormonas incretinas están involucradas en la regulación fisiológica de la homeostasis de la glucosa. Las incretinas se segregan en un nivel basal bajo a lo largo del día, y sus niveles se elevan inmediatamente después de la ingesta de alimentos. La GLP-1 y la GIP incrementan la biosíntesis de insulina y la secreción de esta sustancia a partir de las células beta del páncreas en presencia de niveles de glucosa en sangre normales y elevados. Además, la GLP-1 también reduce la secreción de glucagón a partir de las células pancreáticas alfa, lo cual se traduce en una reducción de la generación hepática de glucosa. La linagliptina se une de manera muy efectiva a la DPP-4 de manera reversible y conduce así a un incremento sostenido y una prolongación de los niveles de incretina activas. La linagliptina incrementa de manera dependiente de la glucosa la secreción de insulina y reduce la secreción de glucagón, lo cual se traduce en una mejoría general de la homeostasis de la glucosa. La linagliptina se une selectivamente a la DPP-4 y evidencia una selectividad >10000 veces mayor en comparación con la actividad relacionada con la DPP-8 o la DPP-9 in vitro.
El clorhidrato de metformina es una biguanida con efectos antihiperglicémicos, que reduce los valores de glucosa plasmática tanto basales como posprandiales. Este fármaco no estimula la secreción de insulina y, por ende, no produce hipoglucemia.
El clorhidrato de metformina puede actuar a través de 3 mecanismos:
(1) Reducción de la producción hepática de glucosa, mediante la inhibición de la gluconeogénesis y la glucogenólisis;
(2) En los músculos, incrementando la sensibilidad a la insulina, lo cual se traduce en una mejor captación y utilización periférica de la glucosa; y
(3) Retardo de la absorción intestinal de la glucosa.
El clorhidrato de metformina estimula la síntesis de glucógeno intracelular a través de su acción sobre la glucógeno sintetasa.
El clorhidrato de metformina aumenta la capacidad de transporte de todos los tipos de transportadores de glucosa (GLUT) de membrana conocidos hasta la fecha.
En los seres humanos, independientemente de su acción sobre la glucemia, el clorhidrato de metformina ejerce efectos favorables sobre el metabolismo de los lípidos. Esto ha sido demostrado en dosis terapéuticas en estudios clínicos controlados a mediano o largo plazo: el clorhidrato de metformina reduce los niveles de colesterol total, colesterol LDL y triglicéridos.
• Estudios clínicos:
Linagliptina como complemento del tratamiento con metformina: La eficacia y la seguridad de la linagliptina en combinación con metformina en pacientes con un control glucémico insuficiente con monoterapia de metformina se evaluaron en un estudio doble ciego controlado con placebo de 24 semanas de duración.
La linagliptina sumada a la metformina brindó mejoras significativas en los valores de HbA1c, (cambio -0,64% en comparación con el placebo), respecto de una media de HbA1c basal de 8%. La linagliptina también evidenció mejoras significativas en los valores de glucosa plasmática en ayunas (GPA) de 21,1 mg/dl (-1,2 mmol/L) y de glucosa 2 horas posprandial (GPP) de -67,1 mg/dL (-3,7 mmol/L) en comparación con el placebo, así como una mayor proporción de pacientes que logran un valor objetivo de HbA1c de <7,0% (28,3% con linagliptina vs. 11,4% con placebo). La incidencia de hipoglucemia observada en los pacientes tratados con linagliptina fue similar a la del placebo. El peso corporal no difirió significativamente entre los grupos.
En un estudio factorial, controlado con placebo, de 24 semanas, de tratamiento inicial, la administración de linagliptina de 2,5 mg dos veces al día en combinación con metformina (500 mg o 1000 mg dos veces al día) brindó mejoras significativas en los parámetros de glucemia en comparación con cualquiera de dichos fármacos administrados como monoterapia, según se resume en la Tabla 2 (media de HbA1c basal: 8,65%).
|
Tabla 2. Parámetros de glucemia en la visita final (estudio de 24 semanas) para linagliptina y metformina, solas y en combinación, en pacientes con diabetes mellitus tipo 2 con un control inadecuado con dieta y ejercicio |
||||||
|
Placebo |
Linagliptina 5 mg una vez al día* |
Metformina 500 mg dos veces al día |
Linagliptina 2,5 mg dos veces al día* + Metformina 500 mg dos veces al día |
Metformina 1000 mg dos veces al día |
Linagliptina 2,5 mg dos veces al día* + Metformina 1000 mg dos veces al día |
|
|
HbA1c (%) |
||||||
|
Cant. de pacientes |
n = 65 |
n = 135 |
n = 141 |
n = 137 |
n = 138 |
n = 140 |
|
Nivel basal (media) |
8,7 |
8,7 |
8,7 |
8,7 |
8,5 |
8,7 |
|
Cambio respecto del nivel basal (media ajustada) |
0,1 |
-0,5 |
-0,6 |
-1,2 |
-1,1 |
-1,6 |
|
Diferencia respecto del placebo (media ajustada) (IC 95 %) |
-- |
-0,6 (-0,9; -0,3) |
-0,8 (-1,0; -0,5) |
-1,3 (-1,6; -1,1) |
-1,2 (-1,5; -0,9) |
-1,7 (-2,0; -1,4) |
|
Pacientes (n, %) que logran un valor de HbA1c <7% |
7 (10,8) |
14 (10,4) |
27 (19,1) |
42 (30,7) |
43 (31,2) |
76 (54,3) |
|
Pacientes (%) que reciben medicación de rescate |
29,2 |
11,1 |
13,5 |
7,3 |
8,0 |
4,3 |
|
GPA (mg/dl) |
||||||
|
Cant. de pacientes |
n = 61 |
n = 134 |
n = 136 |
n = 135 |
n = 132 |
n = 136 |
|
Nivel basal (media) |
203 |
195 |
191 |
199 |
191 |
196 |
|
Cambio respecto del nivel basal (media ajustada) |
10 |
-9 |
-16 |
-33 |
-32 |
-49 |
|
Diferencia respecto del placebo (media ajustada) (IC 95 %) |
-- |
-19 (-31; -6) |
-26 (-38; -14) |
-43 (-56; -31) |
-42 (-55; -30) |
-60 (-72; -47) |
|
* La dosis diaria total de linagliptina es igual a 5 mg. |
||||||
Las disminuciones medias de HbA1c respecto del nivel basal en general fueron mayores en los pacientes con valores basales más elevados de HbA1c. Los efectos sobre los lípidos plasmáticos fueron en general neutros. El descenso del peso corporal con la combinación de linagliptina y metformina fue similar al observado en el caso de metformina sola o del placebo; no hubo ningún cambio respecto del nivel basal en el caso de los pacientes tratados con linagliptina sola. La incidencia de hipoglucemia fue similar entre los diferentes grupos de tratamiento (placebo, 1,4%; linagliptina 5 mg, 0%; metformina, 2,1%; y linagliptina 2,5 mg más metformina dos veces al día, 1,4%).
Este estudio además incluyó pacientes (n = 66) con hiperglucemia más grave (HbA1c en el nivel basal ≥11%) que fueron tratados con un régimen de diseño abierto de dos tomas diarias de linagliptina 2,5 mg + metformina 1000 mg. En este grupo de pacientes, el valor medio de HbA1c basal fue 11,8%, y la media de GPA fue 261,8 mg/dL (14,5 mmol/L). Se observó una disminución media respecto del nivel basal de -3,74% en los valores de HbA1c (n = 48) y de 81,2 mg/dL (-4,5 mmol/L) para la GPA (n = 41) en los pacientes que completaron las 24 semanas del período del estudio sin recibir tratamiento de rescate (n = 48).
En el análisis de extrapolación de la última observación (LOCF), en el que se incluyeron todos los pacientes con mediciones del criterio de valoración primario (n = 65) en la última observación sin tratamiento de rescate, los cambios respecto del nivel basal fueron -3,19% para HbA1c y -73,6 mg/dL (-4,1 mmol/L) para GPA.
La eficacia y la seguridad de linagliptina 2,5 mg dos veces al día versus 5 mg una vez al día en combinación con metformina en pacientes con un control glucémico insuficiente con monoterapia de metformina se evaluó en un estudio doble ciego controlado con placebo de 12 semanas de duración. Linagliptina (2,5 mg dos veces al día y 5 mg una vez al día) sumada a la metformina brindó mejoras significativas en los parámetros de glucemia en comparación con el placebo. Linagliptina 5 mg una vez al día y 2,5 mg dos veces al día brindó reducciones comparables (IC: -0,07; 0,19) y significativas de los valores de HbA1c de -0,80% (respecto de un valor basal de 7,98%), y de -0,74 (respecto de un valor basal de 7,96%) en comparación con el placebo.
La incidencia de hipoglucemia observada en los pacientes tratados con linagliptina fue similar a la observada con el placebo (2,2% con linagliptina 2,5 mg dos veces al día, 0,9% con linagliptina 5 mg una vez al día, y 2,3% con placebo). El peso corporal no difirió significativamente entre los grupos.
Linagliptina como complemento de un tratamiento combinado de metformina y una sulfonilurea: Se llevó a cabo un estudio controlado con placebo de 24 semanas de duración para evaluar la eficacia y la seguridad de linagliptina 5 mg en comparación con placebo en pacientes que no lograron un control suficiente con una combinación de metformina y una sulfonilurea. La linagliptina brindó mejoras significativas en los valores de HbA1c (cambio -0,62% en comparación con el placebo), respecto de una media de HbA1c basal de 8,14%.
La linagliptina también evidenció mejorías significativas en los pacientes que lograron un valor objetivo de HbA1c de <7,0% (31,2% con linagliptina vs. 9,2% con placebo), y también en lo que se refiere a la GPA, con una reducción de -12,7 mg/dL (-0,7 mmol/L) en comparación con el placebo. El peso corporal no difirió significativamente entre los grupos.
Linagliptina como complemento de un tratamiento combinado de metformina y empagliflozina: En pacientes en los que no se ha logró un control adecuado con metformina y empagliflozina (10 mg (n=247) o 25 mg (n=217)), el tratamiento durante 24 semanas con terapia de adición de linagliptina 5 mg brindó una media ajustada de reducciones en los valores de HbA1c respecto del nivel basal de 0,53% (diferencia significativa respecto a la adición de placebo 0,32% (IC 95%, -0,25, -0,13) y 0,58% (diferencia significativa respecto a la adición de placebo -0,47% (IC 95%, -0,66, -0,28), respectivamente. Una proporción mayor de pacientes con un valor basal de HbA1c de ≥7,0% y tratados con linagliptina 5 mg lograron un valor objetivo de HbA1c de <7% en comparación con placebo, lo cual fue estadísticamente significativo.
En subgrupos preespecificados de pacientes con un nivel basal de HbA1c de 8,5% o más (n=66 y n=42 pacientes tratados con metformina más empagliflozina 10 mg o 25 mg, respectivamente), la media ajustada de reducciones en los valores de HbA1c desde el nivel basal hasta las 24 semanas de tratamiento complementario con linagliptina 5 mg fue de 0,97% (p=0,0875, para la diferencia respecto a la adición de placebo) y -1,16% (p=0,0046 para la diferencia respecto a la adición de placebo), respectivamente.
Linagliptina en combinación con metformina e insulina: Se llevó a cabo un estudio controlado con placebo de 24 semanas de duración para evaluar la eficacia y la seguridad de linagliptina (5 mg una vez al día) sumada a un régimen de insulina con o sin metformina. El 83% de los pacientes estaba tomando metformina en combinación con insulina en este estudio. La linagliptina en combinación con metformina más insulina brindó mejoras significativas en términos de HbA1c en este subgrupo, con una media ajustada de cambio respecto del nivel basal de 0,68 (IC: -0,78; -0,57) (media de HbA1c basal de 8,28%) en comparación con el placebo en combinación con metformina más insulina. No hubo ningún cambio significativo respecto del nivel basal en el peso corporal en ninguno de los grupos.
Datos de 24 meses de linagliptina como complemento de un régimen de metformina en comparación con la glimepirida: En un estudio en el cual se comparó la eficacia y la seguridad de la incorporación de linagliptina 5 mg o glimepirida (una sulfonilurea) en pacientes con un control glucémico inadecuado con la monoterapia de metformina, la linagliptina fue similar a la glimepirida en lo que se refiere a la reducción de los valores de HbA1c, con una diferencia media entre los tratamientos en términos de HbA1c entre el nivel basal y la semana 104 para linagliptina en comparación con la glimepirida de +0,20%.
En este estudio, la relación de proinsulina-insulina, un marcador de la eficiencia de la síntesis y liberación de insulina, evidenció una mejora estadísticamente significativa para linagliptina en comparación con el tratamiento con glimepirida. La incidencia de hipoglucemia en el grupo de linagliptina (7,5%) fue significativamente más baja que en el grupo de glimepirida (36,1%).
Los pacientes tratados con linagliptina evidenciaron una reducción media significativa respecto del nivel basal en el peso corporal, en tanto que en los pacientes que recibieron glimepirida se observó un aumento de peso significativo (-1,39 vs. + 1,29 kg).
Linagliptina como tratamiento complementario en los pacientes de edad avanzada (edad ≥70 años) con diabetes tipo 2: La eficacia y la seguridad de la linagliptina en los pacientes de edad avanzada (edad ≥70 años) con diabetes tipo 2 fueron evaluadas en un estudio de diseño doble ciego de 24 semanas de duración. Los pacientes recibieron metformina y/o sulfonilurea y/o insulina como tratamiento de base. Las dosis de las medicaciones antidiabéticas de base se mantuvieron estables durante las primeras 12 semanas, luego de lo cual estaban permitidos los ajustes. La linagliptina permitió lograr mejoras significativas en los valores de HbA1c, de 0,64% (IC del 95%: -0,81; -0,48; p < 0,0001) en comparación con el placebo al cabo de 24 semanas, respecto de un valor basal medio de HbA1c de 7,8%. La linagliptina también evidenció mejoras significativas en los valores de GPA, de -20,7 mg/dL (IC del 95%: 30,2; 11,2; p < 0,0001), en comparación con el placebo (-1,1 mmol/L). El peso corporal no difirió significativamente entre los grupos. En general, la incidencia de hipoglucemia fue comparable entre los pacientes tratados con linagliptina (2 de 45 pacientes; 4,4%) y los tratados con placebo (ninguno de los 22 pacientes; 0%) con un régimen de base de metformina sola. Las tasas de hipoglucemia también fueron comparables con un régimen de base de insulina con o sin metformina (13 de 35 pacientes, 37,1%, tratados con linagliptina, y 6 de 15 pacientes, 40,0%, tratados con placebo). Sin embargo, con un régimen de base de una sulfonilurea con o sin metformina, la hipoglucemia se informó en una mayor proporción de pacientes tratados con linagliptina (24 de 82 pacientes; 29,3%) en comparación con los pacientes tratados con placebo (7 de 42 pacientes; 16,7%). No hubo ninguna diferencia entre la linagliptina y el placebo en lo que respecta a los eventos de hipoglucemia grave.
En un análisis combinado de datos de pacientes de edad avanzada (≥ 70 años de edad) con diabetes tipo 2 (n = 183) que estaban tomando tanto metformina como insulina basal como tratamiento de base, linagliptina en combinación con metformina más insulina suministró mejoras significativas en los parámetros de HbA1c con una media ajustada de cambio respecto del nivel basal de -0,81 (IC: 1,01; 0,61) (media de HbA1c basal, 8,13%) en comparación con el placebo en combinación con metformina más insulina. No hubo ninguna diferencia clínicamente significativa en la incidencia de eventos de hipoglucemia, en los pacientes de ≥70 años (37,2% en los pacientes tratados con linagliptina en combinación con metformina más insulina vs. 39,8% en los pacientes tratados con placebo en combinación con metformina más insulina).
Linagliptina y combinación inicial con linagliptina y metformina en pacientes diagnosticados recientemente y sin tratamiento previo con hiperglucemia marcada: La eficacia y la seguridad de la combinación inicial de linagliptina 5 mg una vez al día y metformina dos veces al día (ajustada mediante incrementos graduales durante las primeras 6 semanas a 1500 mg o 2000 mg/d) en comparación con linagliptina 5 mg en una toma han sido evaluadas en un estudio de 24 semanas de duración en pacientes con DMT2 diagnosticada recientemente sin tratamiento previo y con hiperglucemia marcada (HbA1c basal, 8,5-12,0%). Al cabo de 24 semanas, tanto la monoterapia de linagliptina como la combinación inicial de linagliptina y metformina redujeron significativamente los niveles de HbA1c a razón de -2,0% y -2,8%, respectivamente, a partir de un valor basal de HbA1c de 9,9% y 9,8%, respectivamente. Esta diferencia entre los tratamientos de 0,8% (IC 95 %, 1,1 a 0,5) demostró la superioridad de la combinación inicial por sobre la monoterapia (p < 0,0001). Es de destacar que el 40% y el 61% de los pacientes de la rama de monoterapia y de la rama de la combinación alcanzaron valores de HbA1c <7,0%.
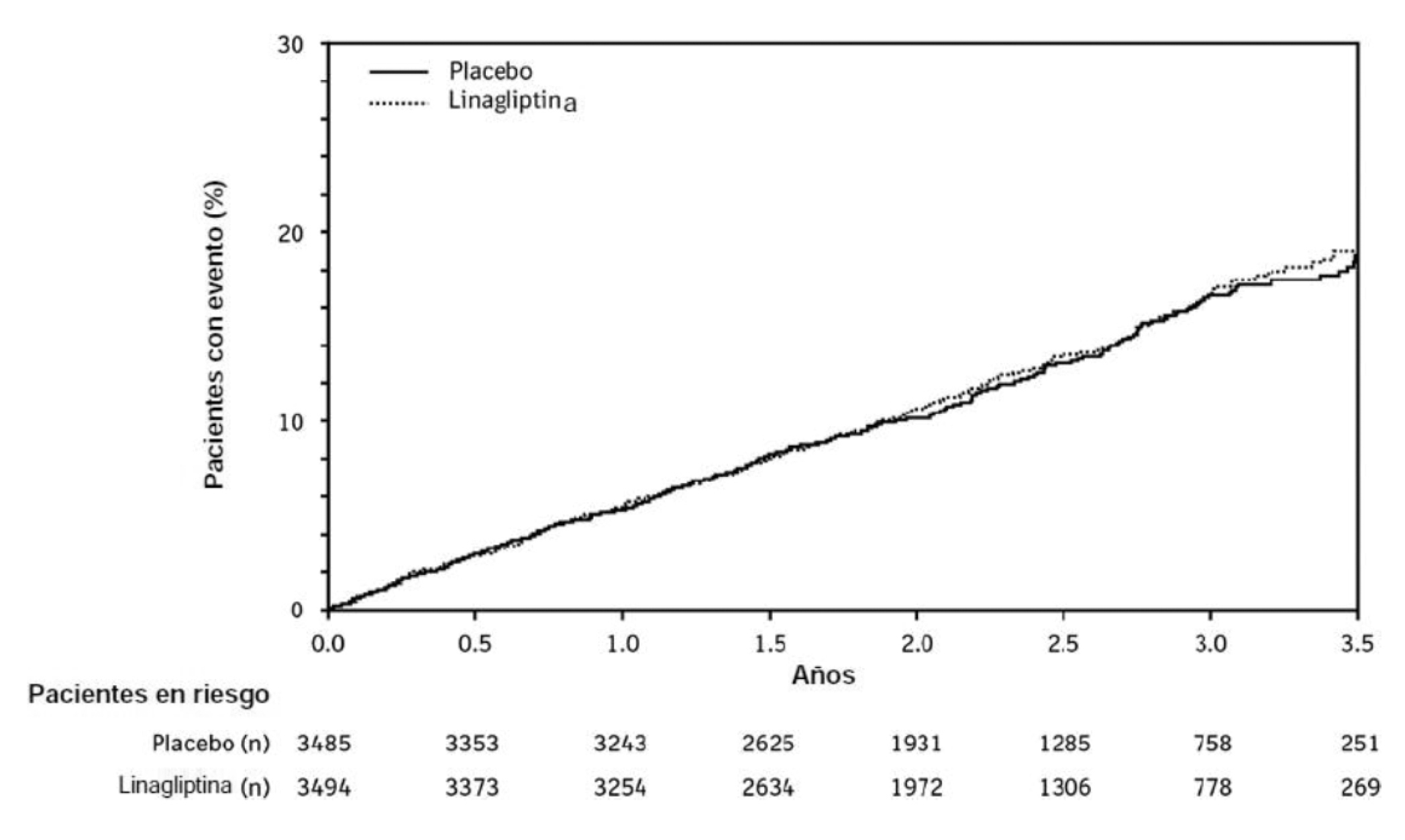
Estudio de seguridad cardiovascular y renal con linagliptina (CARMELINA): CARMELINA es un estudio aleatorizado que se llevó a cabo con 6979 pacientes con diabetes tipo 2 y con mayor riesgo cardiovascular evidenciado por antecedentes de enfermedad renal o macrovascular conocida tratados con linagliptina 5 mg (3494) o placebo (3485) en combinación al tratamiento estándar conforme a las normas regionales para abordar la HbA1c, los factores de riesgo cardiovasculares y la enfermedad renal. La población del estudio incluyó 1211 (17,4%) pacientes de >75 años de edad y 4348 (62,3%) pacientes con insuficiencia renal. Aproximadamente el 19% de la población tenía una TFGe ≥45 a <60 mL/min/1,73 m2, 28% con una TFGe ≥30 a <45 mL/min/1,73 m2 y 15% con una TFGe <30 mL/min/1,73 m2.
La HbA1c media basal fue de 8,0%.
El estudio fue diseñado para demostrar la no inferioridad del criterio de valoración cardiovascular primario, el cual consistía en la combinación de la primera aparición de muerte cardiovascular o infarto de miocardio (IM) no mortal o accidente cerebrovascular no mortal (3PMACE). El criterio de valoración renal combinado se definió como muerte renal o enfermedad renal terminal (ESRD) sostenida o disminución sostenida de la TFGe del 40% o más.
Luego de una mediana de seguimiento de 2,2 años, la linagliptina, administrada junto con el tratamiento estándar, no incrementó el riesgo de eventos cardiovasculares graves o de eventos renales (Tabla 3 y Figura 1). No se observó mayor riesgo de hospitalización por insuficiencia cardíaca, el cual fue un criterio de valoración observado evaluado en comparación con el tratamiento de referencia sin linagliptina en pacientes con diabetes tipo 2 (Tabla 4).
|
Tabla 3. Episodios cardiovasculares graves (MACE) y eventos renales por grupo de tratamiento en el estudio CARMELINA |
|||||
|
Linagliptina 5 mg |
Placebo |
HR |
|||
|
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
(IC 95%) |
|
|
Cant. de pacientes |
3494 |
3485 |
|||
|
CV primario combinado (muerte cardiovascular, IM no mortal, accidente cerebrovascular no mortal) |
434 (12,4) |
57,7 |
420 (12,1) |
56,3 |
1,02 (0,89; 1,17)** |
|
Renal secundario combinado (muerte renal, ESRD, disminución sostenida de la TFGe del 40% |
327 (9,4) |
48,9 |
306 (8,8) |
46,6 |
1,04 (0,89; 1,22) |
|
* AP = añospaciente ** Prueba de no inferioridad para demostrar que el límite superior del IC 95% de la razón de riesgos instantáneos es menor que 1,3. |
|||||
Figura 1. Tiempo hasta la primera aparición de 3PMACE en el estudio CARMELINA
|
Tabla 4. Hospitalización por insuficiencia cardíaca y mortalidad por grupo de tratamiento en el estudio CARMELINA |
|||||
|
Linagliptina 5 mg |
Placebo |
HR |
|||
|
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
(IC 95%) |
|
|
Cant. de pacientes |
3494 |
3485 |
|||
|
Muerte por todas las causas |
367 (10,5) |
46,9 |
373 (10,7) |
48,0 |
0,98 (0,84; 1,13 |
|
Muerte CV |
255 (7,3) |
32,6 |
264 (7,6) |
34 |
0,96 (0,81; 1,14) |
|
Hospitalización por insuficiencia cardíaca |
209 (6,0) |
27,7 |
226 (6,5) |
30,4 |
0,90 (0,74; 1,08) |
|
* AP = añospaciente |
|||||
En los análisis para progresión de albuminuria (cambio de normoalbuminuria a micro- o macroalbuminuria, o de microalbuminuria a macroalbuminuria) la razón de riesgos instantáneos estimada fue de 0,86 (IC 95% 0,78; 0,95) para linagliptina en comparación con placebo. El criterio de valoración microvascular se definió como la combinación de muerte renal, ESRD sostenida, disminución sostenida de la TFGe ≥50%, progresión de la albuminuria, uso de fotocoagulación retinal o inyecciones intravítreas de un tratamiento antiVEGF para retinopatía diabética, hemorragia vítrea o ceguera relacionada con la diabetes. La razón de riesgos instantáneos estimada para la primera aparición del criterio de valoración microvascular combinado fue 0,86 ((IC 95% 0,78; 0,95) para linagliptina en comparación con placebo, principalmente a causa de la progresión de la albuminuria.
Estudio de seguridad cardiovascular con linagliptina (CAROLINA): CAROLINA es un estudio aleatorizado que se llevó a cabo con 6033 pacientes con diabetes tipo 2 poco tiempo de evolución y con mayor riesgo cardiovascular o complicaciones conocidas tratados con linagliptina 5 mg (3023) o glimepirida 14 mg (3010) en combinación al tratamiento estándar (incluido tratamiento de base con metformina en 83% de los pacientes) conforme a las guías locales para el control de la HbA1c y los factores de riesgo cardiovasculares. La media de edad de la población del estudio fue de 64 años e incluyó a 2030 (34%) pacientes ≥70 años. La población del estudio incluyó 2089 (35%) pacientes con enfermedad cardiovascular y 1130 (19%) pacientes con insuficiencia renal y una TFGe < 60 ml/min/1,73m2 al inicio. La HbA1c media basal fue de 7,15%.
El estudio fue diseñado para demostrar la no inferioridad del criterio de valoración cardiovascular primario, el cual consistía en la combinación de la primera aparición de muerte cardiovascular o infarto de miocardio (IM) no mortal o accidente cerebrovascular no mortal (3PMACE).
Luego de una mediana de seguimiento de 6,25 años, la linagliptina, administrada junto con el tratamiento estándar, no incrementó el riesgo de eventos cardiovasculares graves (Tabla 5) en comparación con la glimepirida. Los resultados fueron consistentes para los pacientes tratados con metformina o sin ella.
|
Tabla 5. Episodios cardiovasculares graves (MACE) y mortalidad por grupo de tratamiento en el estudio CAROLINA |
|||||
|
Linagliptina 5 mg |
Glimepirida (1-4 mg) |
HR |
|||
|
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
Cant. de participantes (%) |
Tasa de incidencia por 1000 AP* |
(IC 95%) |
|
|
Cant. de pacientes |
3023 |
3010 |
|||
|
Criterio de valoración CV primario combinado (muerte cardiovascular, IM no mortal, accidente cerebrovascular no mortal) |
356 (11,8) |
20,7 |
362 (12,0) |
21,2 |
0,98 (0,84; 1,14)** |
|
* AP = añospaciente ** Prueba de no inferioridad para demostrar que el límite superior del IC 95% de la razón de riesgos instantáneos es menor que 1,3. |
|||||
Un criterio de valoración secundario clave fue la eficacia sostenida del tratamiento, definido como el porcentaje de pacientes que luego del período de ajuste de dosis inicial (16 semanas) mantenían el control glucémico (HbA1c ≤ 7,0%) en la última visita sin necesidad de tratamiento antidiabético adicional (medicación de rescate), sin episodios de hipoglucemia moderada (sintomática con valores de glucosa ≤70 mg/mL) o grave (que requirieran asistencia) y sin aumento de peso >2%. La cantidad de pacientes que alcanzaron este criterio de valoración secundario clave fue mayor para los pacientes tratados con linagliptina (481; 16,0%) en comparación con los que recibieron glimepirida (305; 10,2%).
Para todo el período de tratamiento (mediana de tratamiento 5,9 años) el porcentaje de pacientes con hipoglucemia moderada o grave fue de 6,5% para linagliptina en comparación con 30,9% para glimepirida. La hipoglucemia grave se observó en 0,3% de los pacientes tratados con linagliptina y 2,2% de los que recibieron glimepirida.
• Farmacocinética:
Comprimidos de liberación inmediata: Los estudios de bioequivalencia realizados en sujetos sanos demostraron que los comprimidos combinados de TRAYENTA® DUO (linagliptina/clorhidrato de metformina) son bioequivalentes a la coadministración de linagliptina y clorhidrato de metformina como comprimidos individuales.
La administración de TRAYENTA® DUO 2,5/1000 mg junto con los alimentos no produjo ningún cambio significativo en la exposición total de la linagliptina. Con la metformina, no hubo ningún cambio en el AUC; sin embargo, la concentración sérica pico media de la metformina se redujo a razón de un 18% cuando se administró junto con los alimentos. Se observó una prolongación del tiempo hasta las concentraciones séricas pico de 2 horas para la metformina administrada en estado posprandial. Es improbable que estos cambios tengan significancia clínica.
Linagliptina: La farmacocinética de la linagliptina ha sido ampliamente caracterizada en sujetos sanos y en pacientes con diabetes mellitus tipo 2. Tras la administración oral de una dosis de 5 mg a pacientes o voluntarios sanos, la linagliptina se absorbió rápidamente, con concentraciones plasmáticas pico (mediana de Tmax) alcanzadas 1,5 horas después de la administración de la dosis.
Las concentraciones plasmáticas de la linagliptina se reducen de manera al menos bifásica, con una vida media terminal prolongada (vida media terminal de linagliptina de más de 100 horas), que está principalmente relacionada con la unión estrecha y de tipo saturable de la linagliptina a la DPP-4 y no contribuye a la acumulación del fármaco. La vida media efectiva para la acumulación de la linagliptina, según lo determinado a partir de la administración oral de dosis múltiples de 5 mg de linagliptina, es de aproximadamente 12 horas. Tras la administración de un régimen de una toma diaria, las concentraciones plasmáticas en estado de equilibrio dinámico de linagliptina 5 mg se alcanzaron para la tercera dosis.
El AUC en plasma de la linagliptina se incrementó aproximadamente un 33% luego de la administración de dosis de 5 mg en estado de equilibrio dinámico en comparación con la primera dosis. Los coeficientes de variación individuales e interindividuales para el AUC de la linagliptina fueron bajos (12,6% y 28,5%, respectivamente).
El AUC en plasma de la linagliptina evidenció un incremento que no fue proporcional a la dosis. La farmacocinética de la linagliptina fue en general similar en los sujetos sanos y en pacientes con diabetes tipo 2.
Absorción: La biodisponibilidad absoluta de la linagliptina es de aproximadamente el 30%. Dado que la coadministración de la linagliptina junto con alimentos con un alto contenido graso no tuvo ningún efecto clínicamente relevante sobre la farmacocinética, la linagliptina puede administrarse con o sin alimentos. Los estudios in vitro indicaron que la linagliptina es un sustrato de la glucoproteína P y de la CYP3A4. Ritonavir, un inhibidor potente de la glucoproteína P y de la CYP3A4, incrementó por un factor de 2,0 la exposición (AUC), y la coadministración múltiple de linagliptina con rifampicina, un inductor potente de la gp-P y de la CYP3A condujo a una reducción de aproximadamente el 40% en el AUC en estado de equilibrio dinámico de la linagliptina, presumiblemente a través del aumento/reducción de la biodisponibilidad de la linagliptina mediante la inhibición/inducción de la glucoproteína P.
Distribución: Como resultado de la unión a los tejidos, la media del volumen aparente de distribución en estado de equilibrio dinámico tras la administración de una dosis intravenosa única de 5 mg de linagliptina a sujetos sanos es de aproximadamente 1110 litros, lo cual indica que la linagliptina se distribuye ampliamente a los tejidos. La unión a las proteínas plasmáticas de la linagliptina es dependiente de la concentración, y se reduce de aproximadamente un 99% con 1 nmol/L al 75-89% con ≥30 nmol/L, lo que refleja la saturación de la unión a la DPP-4 conforme mayor es la concentración de linagliptina. Con concentraciones altas, en las cuales la saturación de DPP-4 es completa, un 70-80% de la linagliptina se unió a otras proteínas plasmáticas fuera de la DPP-4, con lo cual un 30-20% correspondió a fármaco no ligado en plasma.
Biotransformación: Tras la administración de una dosis oral de linagliptina radiomarcada con [14C] de 10 mg, aproximadamente el 5% de la radioactividad se excretó en la orina. El metabolismo desempeña un papel secundario en la eliminación de la linagliptina. Se detectó un metabolito principal con una exposición relativa del 13,3% de la dosis de linagliptina en estado de equilibrio dinámico; este metabolito es farmacológicamente inactivo y, por ende, no contribuye a la acción inhibitoria de la DPP-4 en plasma de la linagliptina.
Excreción: Tras la administración de una dosis oral de linagliptina radiomarcada con [14C] a sujetos sanos, aproximadamente el 85% de la radioactividad administrada se eliminó en las heces (80%) o en la orina (5%) dentro de los 4 días subsiguientes a la administración. La depuración renal en estado de equilibrio dinámico fue de aproximadamente 70 ml/min.
• Poblaciones especiales:
Insuficiencia renal: Se llevó a cabo un estudio de diseño abierto de dosis múltiples con el fin de evaluar la farmacocinética de la linagliptina (dosis de 5 mg) en pacientes con diferentes grados de insuficiencia renal crónica en comparación con un control de sujetos sanos. Este estudio incluyó pacientes con grados de insuficiencia renal clasificados sobre la base de la depuración de creatinina como leve (50 a <80 ml/min), moderada (30 a <50 ml/min) y grave (<30 ml/min), y también pacientes con enfermedad renal en etapa terminal en tratamiento con hemodiálisis. Asimismo, pacientes con DMT2 e insuficiencia renal grave (<30 ml/min) se compararon con pacientes con DMT2 con función renal normal.
La depuración de creatinina se midió mediante determinaciones de depuración de creatinina urinaria de 24 horas o bien se estimó a partir de la creatinina sérica sobre la base de la fórmula de Cockcroft-Gault:
CrCl = [140 - edad (años)] × peso corporal (kg) (× 0,85 para las mujeres) / [72 × creatinina sérica (mg/dL)].
En condiciones de equilibrio, la exposición a la linagliptina en pacientes con insuficiencia renal leve fue comparable a la observada en los sujetos sanos. En los pacientes con insuficiencia renal moderada, se observó un incremento moderado en la exposición por un factor de aproximadamente 1,7 en comparación con los sujetos de control.
La exposición en los pacientes con DMT2 con insuficiencia renal grave se incrementó por un factor de aproximadamente 1,4 en comparación con los pacientes con DMT2 con función renal normal. Las predicciones en estado de equilibrio para el AUC de la linagliptina en pacientes con enfermedad renal en etapa terminal indicaron una exposición comparable a la de los pacientes con insuficiencia renal moderada o grave. Además, no se espera que la linagliptina se elimine en un grado terapéuticamente significativo por hemodiálisis o diálisis peritoneal. Por lo tanto, no resulta necesaria la implementación de un ajuste de la dosis de la linagliptina en los pacientes con algún grado de insuficiencia renal.
Asimismo, la insuficiencia renal leve no tuvo efecto alguno sobre la farmacocinética de la linagliptina en pacientes con diabetes tipo 2, según lo evaluado a través de los análisis de farmacocinética poblacional.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve, moderada y grave (según la clasificación de Child-Pugh), las medias de AUC y Cmax de la linagliptina fueron similares a las observadas en los controles sanos correspondientes tras la administración de dosis múltiples de 5 mg de linagliptina. No se requiere ningún ajuste de la posología de la linagliptina en los pacientes con insuficiencia hepática leve, moderada o grave.
Índice de masa corporal (IMC): No se requiere ningún ajuste de dosis en función del índice de masa corporal (IMC). El índice de masa corporal no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de la linagliptina según lo determinado mediante el análisis de farmacocinética poblacional de datos de Fase I y Fase II.
Género: No se requiere ningún ajuste de dosis en función del género. El género no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de la linagliptina según lo determinado mediante el análisis de farmacocinética poblacional de datos de Fase I y Fase II.
Pacientes de edad avanzada: No se requiere de un ajuste de dosis en función de la edad, ya que este factor no tiene ninguna repercusión clínicamente relevante sobre la farmacocinética de la linagliptina según lo determinado sobre la base de un análisis de farmacocinética poblacional de datos de Fase I y Fase II. Los sujetos de edad avanzada (65 a 80 años de edad) tuvieron concentraciones plasmáticas comparables de linagliptina en comparación con los sujetos de menor edad.
Pacientes pediátricos: Aún no se han realizado estudios para caracterizar la farmacocinética de la linagliptina en los pacientes pediátricos.
Raza: No se requiere ningún ajuste de dosis en función de la raza. La raza no tuvo ningún efecto evidente en las concentraciones plasmáticas de la linagliptina sobre la base de un análisis compuesto de los datos de farmacocinética disponibles, que incluyó pacientes de origen caucásico, hispano, afroamericano y asiático. Asimismo, en estudios de fase I específicos realizados en voluntarios sanos japoneses, chinos y caucásicos y en pacientes afroamericanos con diabetes mellitus tipo 2 se determinó que las características farmacocinéticas de la linagliptina eran similares.
• Metformina:
Absorción: Tras una dosis oral de metformina, el Tmax se alcanza en 2,5 horas. La biodisponibilidad absoluta de un comprimido de 500 mg o de 850 mg de clorhidrato de metformina es de aproximadamente un 50 - 60% en los sujetos sanos. Luego de una dosis oral, la fracción no absorbida recuperada en las heces fue del 20 - 30%.
Tras la administración oral, la absorción del clorhidrato de metformina es saturable e incompleta. Se asume que la farmacocinética de la absorción del clorhidrato de metformina es no lineal.
Con las dosis y los regímenes posológicos recomendados para el clorhidrato de metformina, las concentraciones plasmáticas en estado de equilibrio dinámico se alcanzan dentro de un lapso de 24 a 48 horas y por lo general son inferiores a 1 microgramo/ml. En los estudios clínicos controlados, los niveles plasmáticos máximos (Cmax) del clorhidrato de metformina no superaron los 5 microgramos/ml, ni siquiera con las dosis máximas.
La ingesta de alimentos reduce el grado de absorción y demora ligeramente la absorción del clorhidrato de metformina. Luego de la administración de una dosis de 850 mg, se observó una concentración plasmática pico un 40% más baja, un descenso del 25% en el AUC y una prolongación de 35 minutos en el tiempo hasta la concentración plasmática pico. Se desconoce la relevancia clínica de estos descensos.
Distribución: El grado de unión a las proteínas plasmáticas es insignificante. El clorhidrato de metformina se particiona dentro de los eritrocitos. El valor pico en sangre es menor que el pico plasmático y aparece aproximadamente en el mismo tiempo. Es muy probable que los glóbulos rojos representen un compartimiento de distribución secundario. El volumen medio de distribución (Vd) se ubicó en el rango de 63-276 L.
Biotransformación: El clorhidrato de metformina se excreta principalmente inalterado en la orina. No se han identificado metabolitos en los seres humanos.
Eliminación: La depuración renal del clorhidrato de metformina es >400 ml/min, lo que indica que el clorhidrato de metformina se elimina por filtración glomerular y secreción tubular. Luego de una dosis oral, la vida media de eliminación terminal aparente es de aproximadamente 6,5 horas.
En presencia de un deterioro de la función renal, la depuración renal se reduce en forma proporcional a la disminución de la depuración de creatinina y, por lo tanto, la vida media de eliminación se prolonga, lo que conduce a niveles incrementados de clorhidrato de metformina en el plasma.
• Poblaciones especiales:
Pacientes pediátricos:
— Estudio de dosis únicas: Tras la administración de dosis únicas de metformina de 500 mg, los pacientes pediátricos han evidenciado un perfil farmacocinético similar al observado en adultos sanos.
— Estudio de dosis múltiples: Los datos se limitan a un estudio. Tras la administración de dosis repetidas de 500 mg dos veces al día durante 7 días en pacientes pediátricos, la concentración plasmática pico (Cmax) y la exposición sistémica (AUC0-t) se redujeron aproximadamente un 33% y un 40%, respectivamente, en comparación con adultos diabéticos que recibieron dosis repetidas de 500 mg dos veces al día durante 14 días. Este aspecto tiene una relevancia clínica limitada, puesto que la dosis se ajusta en forma individual para cada caso en particular en función del control glucémico logrado.
Insuficiencia renal: Son escasos los datos disponibles sobre sujetos con insuficiencia renal moderada y no es posible estimar con certeza la exposición sistémica a la metformina en este subgrupo en comparación con los sujetos con función renal normal. Por consiguiente, la adaptación de la dosis debe hacerse teniendo en consideración la eficacia clínica/tolerabilidad (véase la sección “Posología y administración”).
CONTRAINDICACIONES:
— Hipersensibilidad a los principios activos linagliptina y/o clorhidrato de metformina, o a cualquiera de los excipientes.
— Cualquier tipo de acidosis metabólica aguda (como acidosis láctica, cetoacidosis diabética).
— Precoma diabético.
— Insuficiencia renal grave (CrCl <30 ml/min o TFGe <30 ml/min/1,73 m2).
— Cuadros agudos con el potencial de alterar la función renal, como: deshidratación, infección grave, shock, administración intravascular de medios de contraste yodados (véase la sección “Advertencias y precauciones especiales”).
— Afección que pueda provocar hipoxia tisular (en especial, afección aguda o empeoramiento de enfermedad crónica), como: insuficiencia cardíaca descompensada, insuficiencia respiratoria, infarto de miocardio reciente, shock.
— Insuficiencia hepática.
— Intoxicación alcohólica aguda.
— Alcoholismo.
REACCIONES ADVERSAS: Resumen del perfil de seguridad: La seguridad de linagliptina 2,5 mg dos veces al día (o su bioequivalente de 5 mg una vez al día) más metformina ha sido evaluada en más de 6800 pacientes con diabetes mellitus tipo 2 (DMT2).
En estudios controlados con placebo, más de 1800 pacientes fueron tratados con la dosis terapéutica de 2,5 mg de linagliptina dos veces al día (o su bioequivalente de 5 mg de linagliptina una vez al día) en combinación con metformina durante ≥12/24 semanas.
En el análisis combinado de los estudios controlados con placebo, la incidencia general de eventos adversos (EA) en los pacientes tratados con placebo y metformina fue comparable a la observada con linagliptina 2,5 mg y metformina (54,3% y 49,0%). Las tasas de interrupción del tratamiento a raíz de EA fue comparable en los pacientes que recibieron placebo y metformina y aquellos bajo tratamiento con linagliptina y metformina (3,8% y 2,9%). Debido al impacto que tuvo el tratamiento de base sobre los EA (p. ej., en los eventos de hipoglucemia), los eventos adversos fueron analizados y representados con base en los respectivos regímenes de tratamiento, complementario de la metformina y complementario de la metformina más una sulfonilurea.
Los estudios controlados con placebo incluyeron 7 estudios en los que la linagliptina se administró como tratamiento complementario de la metformina y 1 estudio en el que la linagliptina se administró como tratamiento complementario de un régimen de metformina + sulfonilurea.
Resumen tabulado de reacciones adversas: En la tabla que se presenta a continuación se incluyen las reacciones adversas surgidas con el uso de la combinación linagliptina/metformina o con el uso de los monocomponentes (linagliptina o metformina) en los ensayos clínicos o durante la farmacovigilancia. Los efectos no deseados informados previamente con uno de los componentes individuales pueden ser potenciales efectos no deseados de TRAYENTA® DUO incluso si no se observaron en los estudios clínicos con este medicamento.Terminología de la Clasificación por sistema y órgano (SOC) del MedDRA.
|
Reacciones adversas a la linagliptina y metformina |
|
|
Infecciones e infestaciones |
Nasofaringitis3 |
|
Trastornos del sistema inmunológico |
Hipersensibilidad 1; 3 Angioedema 4 Urticaria 2; 4 |
|
Trastornos del metabolismo y de la nutrición |
Acidosis láctica 2 Resultado anormal en la prueba de absorción de vitamina B12*; 2 Hipoglucemia (cuando la linagliptina y la metformina se combinaron con una sulfonilurea) |
|
Trastornos del sistema nervioso |
Alteración del gusto 2 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos 1; 3 |
|
Trastornos gastrointestinales** |
Disminución del apetito 3; 5 Diarrea 3; 5 Estreñimiento (cuando la linagliptina y la metformina se combinaron con insulina) Náuseas 3; 5 Pancreatitis 3 Vómitos 3; 5 Dolor abdominal 2 Ulceración en cavidad bucal 4 |
|
Trastornos hepatobiliares |
Resultado anormal en la prueba de función hepática 2 Hepatitis 2 |
|
Trastornos de la piel y del tejido subcutáneo |
Angioedema 4 Prurito 3; 5 Eritema 2 Exantema 4 Penfigoide ampolloso 4; § |
|
Exploraciones complementarias |
Aumento de la lipasa 3; † Aumento de la amilasa ? |
|
1 Reacciones adversas informadas también en pacientes tratados con linagliptina como monoterapia. 2 Reacciones adversas de la metformina como monoterapia; sírvase consultar el Resumen de Características del Producto correspondiente a la metformina para obtener información adicional. 3 Reacciones adversas de la combinación a dosis fija de linagliptina + metformina (análisis combinado de los estudios comparados con placebo). 4 Reacciones adversas identificadas durante la farmacovigilancia con linagliptina. 5 Reacciones adversas informadas en pacientes que recibieron la combinación a dosis fija de linagliptina + metformina y también en pacientes que recibieron metformina como monoterapia. * El tratamiento prolongado con metformina se ha asociado con una disminución de la absorción de la vitamina B12, lo cual en casos muy raros puede provocar una deficiencia de la vitamina B12 clínicamente significativa (p. ej., anemia megaloblástica). ** Los trastornos gastrointestinales, como el dolor abdominal y las náuseas, vómitos, diarrea y disminución del apetito presentan su mayor frecuencia durante el inicio del tratamiento con clorhidrato de metformina y se resuelven espontáneamente en la mayoría de los casos. Para prevenirlos, se recomienda tomar el clorhidrato de metformina en 2 dosis diarias durante las comidas o después de ellas si se lo administra como monoterapia. § Véase también el estudio de seguridad cardiovascular y renal con linagliptina (CARMELINA) a continuación. † Sobre la base de las elevaciones de lipasa > 3 veces el límite normal superior. ? En el estudio CAROLINA de linagliptina vs. el comparador activo glimepirida (véase la sección Ensayos clínicos) los análisis de laboratorio de la amilasa revelaron aumento de >3 veces el límite normal superior en 0,99% de los pacientes tratados con linagliptina y 0,54% de pacientes tratados con glimepirida. |
|
En los estudios controlados con placebo, la reacción adversa relacionada informada con mayor frecuencia para linagliptina + metformina fue la diarrea (1,6%), con una tasa comparable para metformina + placebo (2,4%).
Reacciones adversas informadas cuando la linagliptina y la metformina se combinaron con una SU: Cuando la linagliptina y la metformina se administraron en combinación con una sulfonilurea, la hipoglucemia fue el EA informado con mayor frecuencia (linagliptina más metformina más sulfonilurea 23,9% vs. 16,0% en el grupo de placebo), y se identificó como una reacción adversa adicional en estas condiciones. Ninguno de los episodios de hipoglucemia fue clasificado como grave (que requirieran asistencia).
Reacciones adversas informadas cuando la linagliptina y la metformina se combinaron con insulina: Cuando la linagliptina y la metformina se administraron en combinación con insulina, la hipoglucemia fue el EA informado con mayor frecuencia, pero se produjo en una tasa comparable cuando el placebo y la metformina se combinaron con insulina (linagliptina más metformina más insulina 29,5% vs. 30,9% en el grupo de placebo más metformina más insulina) con una tasa de episodios graves (que requirieron asistencia) baja (1,5% vs. 0,9%).
Estudio de seguridad renal y desenlaces cardiovasculares con linagliptina (CARMELINA): El estudio CARMELINA evaluó la seguridad cardiovascular y renal de la linagliptina en comparación con placebo en pacientes con diabetes tipo 2 y con mayor riesgo cardiovascular evidenciado por antecedentes de enfermedad renal o macrovascular conocida (véase la sección “Estudios clínicos”). El estudio incluyó 3494 pacientes tratados con linagliptina (5 mg) y 3485 pacientes que recibieron placebo. Ambos tratamientos se sumaron al tratamiento estándar conforme a las normas regionales para abordar la HbA1c y los factores de riesgo cardiovasculares. El 54% recibía metformina. La incidencia general de los eventos adversos y de los eventos adversos serios en los pacientes tratados con linagliptina fue similar a la de los pacientes que recibieron placebo. Los datos de seguridad de este estudio son concordantes con el perfil de seguridad ya conocido para la linagliptina.
En la población tratada, se informaron eventos hipoglucémicos graves (que requirieron asistencia) en 3,0% de los pacientes tratados con linagliptina y en 3,1% de los que recibieron placebo. Entre los pacientes que eran tratados con una sulfonilurea al inicio, la incidencia de hipoglucemia grave fue de 2,0% entre los pacientes tratados con linagliptina y de 1,7% para los que recibieron placebo. Entre aquellos tratados con insulina al inicio, la incidencia de hipoglucemia grave fue de 4,4% entre los pacientes tratados con linagliptina y de 4,9% para los que recibieron placebo.
En el período de observación general del estudio se informó pancreatitis aguda para el 0,3% de los pacientes tratados con linagliptina y 0,1% de los que recibieron placebo.
En el estudio CARMELINA, se informó penfigoide ampolloso en 0,2% de los pacientes tratados con linagliptina y en ninguno de los que recibieron placebo.
INTERACCIONES:
• Interacciones farmacocinéticas: Generales: La coadministración de dosis múltiples de linagliptina (10 mg una vez al día) y metformina (850 mg dos veces al día) no alteró significativamente la farmacocinética de la linagliptina ni de la metformina en los voluntarios sanos.
No se han llevado a cabo estudios de interacciones medicamentosas farmacocinéticas con TRAYENTA® DUO; sin embargo, dichos estudios sí han sido realizados con los principios activos de TRAYENTA® DUO, linagliptina y metformina, en forma individual.
Linagliptina: — Evaluación in vitro de las interacciones medicamentosas:
La linagliptina es un inhibidor débilmente competitivo, y con un mecanismo de acción entre débil y moderado, de la isoenzima CYP CYP3A4, pero no inhibe otras isoenzimas CYP. No es un inductor de las isoenzimas CYP.
La linagliptina es un sustrato de la glucoproteína P, e inhibe el transporte de digoxina mediado por glucoproteína P con una potencia baja. Sobre la base de estos resultados y de los estudios de interacción medicamentosa in vivo, se considera improbable que la linagliptina cause interacciones con otros sustratos de la gp-P.
— Evaluación in vivo de las interacciones medicamentosas: Los datos clínicos que se describen a continuación sugieren que el riesgo de que se produzcan interacciones clínicamente importantes por la coadministración de medicamentos es bajo. No se observaron interacciones clínicamente significativas que requirieran de un ajuste de la dosis.
La linagliptina no tuvo ningún efecto clínicamente relevante en la farmacocinética de la metformina, la glibenclamida, la simvastatina, la pioglitazona, la warfarina, la digoxina ni los anticonceptivos orales, lo cual brinda evidencia in vivo de una baja propensión a causar interacciones medicamentosas con sustratos de la CYP3A4, la CYP2C9, la CYP2C8, la glucoproteína P y transportadores de cationes orgánicos (OCT).
Metformina: La coadministración de dosis múltiples de 850 mg de metformina en tres tomas diarias junto con una dosis supraterapéutica de 10 mg de linagliptina una vez al día no dio lugar a ninguna alteración clínicamente significativa de la farmacocinética de la linagliptina o de la metformina en voluntarios sanos. Por ende, la linagliptina no es un inhibidor del transporte mediado por OCT.
Sulfonilureas: La farmacocinética en estado de equilibrio dinámico de 5 mg de linagliptina no se modificó por la coadministración de una dosis única de 1,75 mg de glibenclamida (gliburida) y dosis orales múltiples de 5 mg de linagliptina. Sin embargo, hubo una reducción clínicamente no significativa del 14% tanto en el AUC como en la Cmax de la glibenclamida. En vista de que la glibenclamida es metabolizada principalmente por la CYP2C9, estos datos también avalan la conclusión de que la linagliptina no es un inhibidor de la CYP2C9. No se esperan interacciones clínicamente significativas con otras sulfonilureas (p. ej., glipizida, tolbutamida y glimepirida), las cuales, al igual que la glibenclamida, son eliminadas principalmente por la vía de la CYP2C9.
Tiazolidinedionas: La coadministración de dosis diarias múltiples de 10 mg de linagliptina (nivel de dosis supraterapéutico) con dosis diarias múltiples de 45 mg de pioglitazona, un sustrato de la CYP2C8 y de la CYP3A4, no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de la linagliptina o de la pioglitazona y tampoco sobre los metabolitos activos de la pioglitazona, lo cual indica que la linagliptina no es un inhibidor del metabolismo mediado por CYP2C8 in vivo, y avala la conclusión de que la inhibición in vivo de la CYP3A4 provocada por la linagliptina es insignificante.
Ritonavir: Se llevó a cabo un estudio para evaluar el efecto de ritonavir, un inhibidor potente de la glucoproteína P y de la CYP3A4, sobre la farmacocinética de la linagliptina. La coadministración de una dosis oral única de 5 mg de linagliptina y dosis orales múltiples de 200 mg de ritonavir incrementó los valores de AUC y Cmax de la linagliptina por un factor de aproximadamente 2,0 y 3,0, respectivamente. Simulaciones de las concentraciones plasmáticas en estado de equilibrio dinámico de linagliptina con y sin ritonavir indicaron que el aumento de la exposición no estuvo asociado con un incremento de la acumulación. Estos cambios en la farmacocinética de la linagliptina no fueron considerados relevantes desde el punto de vista clínico. Por ende, no se espera que se produzcan interacciones clínicamente relevantes con otros inhibidores de la glucoproteína P/CYP3A4, y no se requiere un ajuste de la dosis.
Rifampicina: Se llevó a cabo un estudio para evaluar el efecto de la rifampicina, un inductor potente de la glucoproteína P y de la CYP3A4, sobre la farmacocinética de 5 mg de linagliptina. La coadministración múltiple de linagliptina con rifampicina condujo a una reducción del 39,6 % y del 43,8 % en los valores de AUC y Cmax en estado de equilibrio dinámico de la linagliptina y un descenso de aproximadamente un 30 % en la inhibición de la DPP-4 en los niveles de concentración mínima (valle). Por lo tanto, se espera que la linagliptina en combinación con inductores potentes de la gp-P sea clínicamente eficaz, si bien es posible que no se logre una eficacia completa.
Digoxina: La coadministración de dosis diarias múltiples de 5 mg de linagliptina junto con dosis múltiples de 0,25 mg de digoxina no tuvo efecto alguno sobre la farmacocinética de la digoxina en los voluntarios sanos. Esto permite afirmar que la linagliptina no es un inhibidor del transporte mediado por la glucoproteína P in vivo.
Warfarina: Dosis diarias múltiples de 5 mg de linagliptina no alteraron la farmacocinética de la warfarina S(-) o R(+), un sustrato de la CYP2C9, lo cual demuestra que la linagliptina no es un inhibidor de la CYP2C9.
Simvastatina: Dosis diarias múltiples de 10 mg de linagliptina (nivel de dosis supraterapéutico) tuvieron un efecto mínimo sobre la farmacocinética en estado de equilibrio dinámico de la simvastatina, un sustrato sensible de la CYP3A4, en voluntarios sanos. Tras la administración de 10 mg de linagliptina en forma concomitante con 40 mg de simvastatina a diario durante 6 días, el AUC en plasma de la simvastatina se incrementó a razón de un 34%, y la Cmax en plasma un 10%. Por lo tanto, la linagliptina se considera un inhibidor débil del metabolismo mediado por CYP3A4, y no se considera necesario un ajuste de la dosis de las sustancias metabolizadas por CYP3A4 que se administren en forma concomitante.
Anticonceptivos orales: La coadministración junto con 5 mg de linagliptina no alteró la farmacocinética en estado de equilibrio dinámico del levonorgestrel ni del etinilestradiol.
La biodisponibilidad absoluta de la linagliptina es de aproximadamente el 30%. Dado que la coadministración de la linagliptina junto con alimentos con un alto contenido graso no tuvo ningún efecto clínicamente relevante sobre la farmacocinética, la linagliptina puede administrarse con o sin alimentos.
• Metformina: Uso concomitante no recomendado. Alcohol: La intoxicación alcohólica está asociada con un mayor riesgo de acidosis láctica, particularmente en presencia de factores como ayuno, malnutrición o insuficiencia hepática.
Medios de contraste yodados: La administración de TRAYENTA® DUO debe suspenderse con anterioridad al procedimiento de diagnóstico por imágenes, o al momento de su realización, y podrá reanudarse después de que hayan transcurrido, por lo menos, 48 horas, siempre que se haya evaluado la función renal y comprobado que es estable (véanse las secciones “Posología” y “Advertencias y precauciones especiales”).
Combinaciones que requieren precauciones de uso: Algunos medicamentos pueden afectar de forma adversa la función renal, lo que puede incrementar el riesgo de acidosis láctica, p. ej., los AINEs, incluidos los inhibidores selectivos de la ciclooxigenasa (COX) II, los inhibidores de la ECA, los antagonistas del receptor de la angiotensina II y los diuréticos, en especial, los diuréticos del asa. Cuando se inicie un tratamiento con estos productos o se usen en combinación con metformina, es necesario un monitoreo estrecho de la función renal.
Transportadores de cationes orgánicos (OCT): La metformina es un sustrato de ambos transportadores OCT1 y OCT2.
La coadministración de metformina con:
— Los inhibidores de OCT1 (como el verapamilo) pueden reducir la eficacia de la metformina.
— Los inductores de OCT1 (como la rifampicina) pueden aumentar la absorción gastrointestinal y la eficacia de la metformina.
— Los inhibidores de OCT2 (como cimetidina, dolutegravir, ranolazina, trimetoprima, vandetanib, isavuconazol) pueden disminuir la eliminación renal de metformina y, por lo tanto, conducir a un aumento de la concentración plasmática de metformina.
— Los inhibidores de OCT1 y OCT2 (como crizotinib, olaparib) pueden alterar la eficacia y la eliminación renal de la metformina.
Por lo tanto, se recomienda precaución, especialmente en pacientes con insuficiencia renal, cuando estos fármacos son coadministrados con metformina, ya que la concentración plasmática de metformina puede aumentar. Si es necesario, se puede considerar el ajuste de la dosis de metformina, ya que los inhibidores / inductores de los OCT pueden alterar la eficacia de la metformina.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Generales: TRAYENTA® DUO no debe utilizarse en pacientes con diabetes tipo 1.
Pancreatitis: Se han observado cuadros de pancreatitis aguda en pacientes que tomaban linagliptina. Ante la sospecha de una posible pancreatitis, debe suspenderse la administración de TRAYENTA® DUO.
Hipoglucemia: La linagliptina como monoterapia ha evidenciado una incidencia de hipoglucemia comparable a la del placebo. En estudios clínicos de linagliptina administrada como parte de un tratamiento combinado junto con agentes que no se consideran causantes de hipoglucemia (metformina, tiazolidinedionas), las tasas de hipoglucemia informadas con linagliptina fueron similares a las observadas en los pacientes que recibieron placebo.
Se sabe que las sulfonilureas causan hipoglucemia. Por lo tanto, se recomienda precaución cuando TRAYENTA® DUO se utiliza en combinación con una sulfonilurea. Puede considerarse una reducción de la dosis de la sulfonilurea.
Se sabe que la insulina causa hipoglucemia. Por lo tanto, se recomienda precaución cuando TRAYENTA® DUO se utiliza en combinación con insulina. Puede considerarse una reducción de la dosis de insulina.
La metformina como monoterapia no causa hipoglucemia en las circunstancias de uso normales, pero podría presentarse un cuadro de hipoglucemia en el caso de una ingesta calórica insuficiente, cuando el ejercicio intenso no se compensa con una suplementación calórica o durante el uso concomitante con otros hipoglucemiantes (como sulfonilureas e insulina) o etanol.
Acidosis láctica: La acidosis láctica, una complicación metabólica muy rara pero grave, se produce con mayor frecuencia durante el empeoramiento agudo de la función renal, en caso de enfermedad cardiorrespiratoria o septicemia. La acumulación de metformina se produce durante el empeoramiento agudo de la función renal e incrementa el riesgo de acidosis láctica.
En caso de deshidratación (diarrea o vómitos intensos, fiebre o reducción de la ingesta de líquidos), la metformina se debe interrumpir de forma temporal y se recomienda contactar a un profesional de la salud.
El uso de medicamentos que puedan alterar de manera aguda la función renal (como antihipertensivos, diuréticos y AINEs) se debe iniciar con precaución en los pacientes tratados con metformina.
Otros factores de riesgo para la acidosis láctica son la ingesta excesiva de alcohol, la insuficiencia hepática, el control deficiente de la diabetes, la cetosis, el ayuno prolongado y cualquier trastorno asociado con hipoxia, así como el uso concomitante de medicamentos que puedan causar acidosis láctica (véanse también la secciones “Contraindicaciones” e “Interacciones”).
Se debe informar a los pacientes y/o a las personas que los cuidan acerca del riesgo de acidosis láctica.
La acidosis láctica se caracteriza por un cuadro de disnea acidótica, dolor abdominal, calambres musculares, astenia e hipotermia, seguido de coma. En caso de que se sospeche la presencia de síntomas, el paciente debe dejar de tomar metformina y buscar atención médica inmediata.
Los hallazgos de laboratorio diagnósticos son descenso de los valores de pH sanguíneo (<7,35), aumento de los niveles plasmáticos de lactato (>5 mmol/L) y aumento del anión gap y del cociente lactato/piruvato.
Administración de un medio de contraste yodado: La administración intravascular de medios de contraste yodados puede provocar nefropatía inducida por el contraste, lo que ocasiona la acumulación de metformina y aumenta el riesgo de acidosis láctica. La administración de metformina se debe interrumpir con anterioridad al procedimiento de diagnóstico por imágenes, o al momento de su realización, y deben dejarse transcurrir como mínimo 48 horas antes de reanudarlo, siempre que se haya reevaluado la función renal y comprobado que es estable, véanse las secciones “Posología” e “Interacciones”.
Función renal: Se debe evaluar la TFG antes de iniciar el tratamiento y periódicamente a partir de entonces, véase la sección “Posología”. TRAYENTA® DUO está contraindicado en pacientes con TFG <30 ml/min y se debe interrumpir de forma temporal en presencia de trastornos que alteren la función renal, véase la sección “Contraindicaciones”.
Función cardíaca: Los pacientes con insuficiencia cardíaca presentan mayor riesgo de hipoxia e insuficiencia renal. En los pacientes con insuficiencia cardíaca crónica estable, se podrá administrar TRAYENTA® DUO si se realiza un control regular de la función cardíaca y renal.
En los pacientes con insuficiencia cardíaca aguda e inestable, TRAYENTA® DUO está contraindicado debido a la presencia del componente metformina (véase la sección “Contraindicaciones”).
Cirugía: La metformina debe suspenderse en el momento de la realización de una cirugía con anestesia general, raquídea o epidural. El tratamiento podrá reiniciarse luego de que haya transcurrido un mínimo de 48 horas desde la cirugía o la reanudación de la alimentación oral, y siempre que se haya revaluado la función renal y comprobado que es estable.
Penfigoide ampolloso: Se han observado casos de penfigoide ampolloso en pacientes que toman linagliptina. Si se sospecha de penfigoide ampolloso, el tratamiento con TRAYENTA® DUO debe interrumpirse.
POSOLOGÍA Y ADMINISTRACIÓN:
• Posología: Comprimidos de liberación inmediata: Adultos con función renal normal (tasa de filtración glomerular [TFG] ≥90 ml/min).
La dosis recomendada es 2,5/500 mg, 2,5/850 mg o 2,5/1000 mg dos veces al día.
La posología debe adaptarse a cada caso en particular en función del régimen actual del paciente, su eficacia y tolerabilidad. La dosis diaria máxima recomendada de TRAYENTA® DUO es 5 mg de linagliptina y 2000 mg de metformina. (véase la Tabla 1 para acceder a información posológica adicional).
TRAYENTA® DUO debe tomarse junto con las comidas para reducir los efectos indeseables gastrointestinales asociados con la metformina.
Pacientes actualmente no tratados con metformina: En el caso de los pacientes que no son tratados actualmente con metformina, la dosis inicial recomendada es de 2,5 mg de linagliptina/500 mg de clorhidrato de metformina, dos veces al día.
Pacientes en los que no se logra un control adecuado con la dosis máxima tolerada de la monoterapia con metformina: En el caso de los pacientes en los que no se logra un control adecuado con metformina sola, la dosis inicial de TRAYENTA® DUO debe aportar linagliptina administrada en dos tomas diarias de 2,5 mg cada una (dosis diaria total de 5 mg) más la dosis de metformina que ya esté tomando el paciente.
Pacientes que pasan de un régimen previo de coadministración de linagliptina y metformina: En los pacientes que pasan de un régimen previo de coadministración de linagliptina y metformina a la combinación a dosis fijas, TRAYENTA® DUO debe iniciarse en un nivel que aporte la dosis de linagliptina y de metformina que el paciente ya estaba recibiendo.
Pacientes en los que no se logra un control adecuado con el tratamiento combinado doble con la dosis máxima tolerada de metformina y una sulfonilurea: La dosis de TRAYENTA® DUO debe aportar linagliptina administrada en dos tomas diarias de 2.5 mg cada una (dosis diaria total de 5 mg) y una dosis de metformina similar a la que ya estaba tomando el paciente. Cuando TRAYENTA® DUO se usa en combinación con una sulfonilurea, puede estar indicada una dosis más baja de la sulfonilurea, para reducir el riesgo de hipoglucemia (véase la sección “Advertencias y precauciones especiales”).
Pacientes en los que no se logra un control adecuado con el tratamiento combinado doble con insulina y la dosis máxima tolerada de metformina: La dosis de TRAYENTA® DUO debe aportar linagliptina administrada en dos tomas diarias de 2,5 mg cada una (dosis diaria total de 5 mg) y una dosis de metformina similar a la que ya estaba tomando el paciente. Cuando TRAYENTA® DUO se usa en combinación con insulina, puede estar indicada una dosis más baja de insulina, para reducir el riesgo de hipoglucemia (véase la sección “Advertencias y precauciones especiales”).
Para las diferentes dosis de metformina, TRAYENTA® DUO está disponible en concentraciones de 2,5 mg de linagliptina más 500 mg de clorhidrato de metformina, 850 mg de clorhidrato de metformina o 1000 mg de clorhidrato de metformina.
Pacientes actualmente no tratados con metformina: En el caso de los pacientes que no son tratados actualmente con metformina, se debe iniciar el tratamiento con 5 mg de linagliptina/1000 mg de clorhidrato de metformina de liberación prolongada una vez al día.
Dosis omitidas: Si el paciente olvida una dosis, deberá tomarla tan pronto como lo recuerde.
Sin embargo, no debe tomar una dosis doble en una misma toma. Si ese fuera el caso, deberá omitir la dosis olvidada.
SOBREDOSIS: Síntomas: Durante los estudios clínicos controlados que se efectuaron en sujetos sanos, dosis únicas de hasta 600 mg de linagliptina (equivalentes a 120 veces la dosis recomendada) fueron bien toleradas. No existe experiencia con dosis superiores a 600 mg en los seres humanos.
No se ha observado hipoglucemia con dosis de clorhidrato de metformina de hasta 85 g, si bien se han producido cuadros de acidosis láctica en dichas circunstancias. Una sobredosis de gran magnitud de clorhidrato de metformina o la presencia de riesgos concomitantes puede conducir a la aparición de un cuadro de acidosis láctica. La acidosis láctica es una emergencia médica y debe ser tratada en el ámbito hospitalario.
Tratamiento: En el caso de una sobredosis, resulta razonable aplicar las medidas de soporte habituales, p. ej., eliminar del aparato gastrointestinal el material no absorbido, implementar un monitoreo clínico e instituir medidas clínicas según sea necesario. El método más efectivo para eliminar el lactato y el clorhidrato de metformina es la hemodiálisis.
TOXICOLOGÍA: Se llevaron a cabo estudios de toxicidad general en ratas de hasta 13 semanas de duración con los productos combinados en TRAYENTA® DUO. La única interacción observada entre la linagliptina y la metformina fue una reducción del aumento de peso corporal. No se observó ninguna otra toxicidad sumatoria originada por la combinación de la linagliptina y la metformina.
Un estudio de reproducción animal realizado en ratas preñadas no indicó ningún efecto teratogénico atribuible a la coadministración de linagliptina y metformina.
Los datos que se brindan a continuación son hallazgos de estudios realizados con linagliptina o metformina en forma individual.
Linagliptina: Los efectos en los estudios preclínicos se observaron únicamente en niveles de exposición que superan por un amplio margen la exposición humana máxima, lo que indica que este factor es de escasa relevancia para el uso clínico.
Genotoxicidad: La linagliptina fue no mutagénica y no clastogénica en la prueba de mutagenicidad bacteriana de Ames con y sin activación metabólica, en una prueba de aberración cromosómica en linfocitos humanos y en una prueba de micronúcleo in vivo.
Carcinogenia: Se llevó a cabo un estudio de carcinogenia de 2 años de duración en ratas macho y hembra a las que se les administraron dosis orales de linagliptina de 6, 18 y 60 mg/kg/día. No hubo una mayor incidencia de tumores en ninguno de los sistemas de órganos con dosis de hasta 60 mg/kg/día. Esta dosis conduce a exposiciones aproximadamente 418 veces más altas que la exposición humana con la dosis diaria recomendada máxima en los seres humanos adultos (DMRH) de 5 mg/día sobre la base de las comparaciones de los valores de AUC. Se llevó a cabo un estudio de carcinogenia de 2 años de duración en ratones macho y hembra a los que se les administraron dosis orales de 8, 25 y 80 mg/kg/día. No hubo evidencia de un potencial carcinogénico con dosis de hasta 80 mg/kg/día, equivalentes a aproximadamente 242 veces la exposición humana observada con la DMRH.
Toxicidad para la reproducción: En estudios de fertilidad realizados en ratas con dosis orales de 10, 30 y 240 mg/kg/día administradas por sonda nasogástrica, los animales machos fueron tratados durante 4 semanas antes del apareamiento y durante el período de apareamiento; las hembras fueron tratadas durante 2 semanas antes del apareamiento y hasta el día 6 de gestación. No se observó ningún efecto adverso sobre el desarrollo embrionario temprano, el apareamiento, la fertilidad y la tasa de nacimientos con vida hasta la dosis más alta administrada, de 240 mg/kg/día (equivalente a aproximadamente 943 veces la exposición humana con la DMRH de 5 mg/día sobre la base de las comparaciones de los valores de AUC). En los estudios de desarrollo embriofetal en ratas y en conejos, se comprobó que la linagliptina no fue teratogénica en niveles de dosis de hasta 240 mg/kg/día (943 veces la DMRH), inclusive, en las ratas, y en niveles de dosis de hasta 150 mg/kg/día (1943 veces la DMRH), inclusive, en los conejos. Se calculó una NOAEL de 30 mg/kg/día (49 veces la DMRH) y de 25 mg/kg (78 veces la DMRH) para la toxicidad embriofetal en las ratas y en los conejos, respectivamente.
Metformina: Los datos no clínicos no revelaron ningún peligro especial para los seres humanos sobre la base de los estudios convencionales de farmacología de seguridad, genotoxicidad y potencial carcinogénico. En un estudio de toxicidad de 13 semanas de duración en ratas, se observó toxicidad relacionada con la metformina en el corazón, el hígado, los riñones, las glándulas salivales, los ovarios, el timo, el aparato gastrointestinal y las glándulas suprarrenales con posologías asociadas con una exposición sistémica de 7 veces la DMRH o más.
La metformina no fue teratogénica en ratas en una dosis de 200 mg/kg/día asociada con una exposición sistémica de 4 veces la DMRH (2000 mg de metformina). Con dosis más elevadas (500 y 1000 mg/kg/día, asociadas con 11 y 23 veces la DMRH), se observó teratogenicidad de la metformina en las ratas.
• ANEXO: Frecuencias de reacciones adversas:
TRAYENTA® DUO:
Categorías de frecuencia:
— Muy frecuente: ≥1/10
— Frecuente: ≥1/100 - <1/10
— Poco frecuente: ≥1/1000 - <1/100
— Rara: ≥1/10000 - <1/1000)
— Muy rara: <1/10000
— Frecuencia no conocida: No se puede estimar a partir de los datos disponibles
Nota: Las categorías de frecuencia descriptas se basan en la Guía del Resumen de las Características del Producto (SmPC) de la UE (de septiembre de 2009); por ende, en países que no pertenecen a la Unión Europea pueden ser apropiadas otras definiciones.
|
Tabla 1: Reacciones adversas listadas en la CCDS y correspondientes a las frecuencias* según la Guía de SmPC de la UE * Las categorías de frecuencia representan las frecuencias más altas calculadas. |
||
|
Terminología de la Clasificación por sistema y órgano (SOC) del MedDRA |
Términos preferentes (PT) del MedDRA (versión 18.1) |
Frecuencias conforme a la Guía del SmPC de la UE |
|
Infecciones e infestaciones |
Nasofaringitis 3 |
Poco frecuente |
|
Trastornos del sistema inmunológico |
Hipersensibilidad 1; 3 Angioedema 4 Urticaria 4 |
Poco frecuente Rara $ Rara $ |
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia 6 |
Muy frecuente |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos 1; 3 |
Poco frecuente |
|
Trastornos gastrointestinales |
Disminución del apetito 3; 5 Diarrea 3; 5 Náuseas 3; 5 Pancreatitis 3 Vómitos 3; 5 Estreñimiento (cuando la linagliptina y la metformina se combinaron con insulina) Ulceración en cavidad bucal †4 |
Poco frecuente Frecuente Poco frecuente Frecuencia no conocida # Poco frecuente Poco frecuente Rara |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito 3; 5 Exantema 4 Penfigoide ampolloso 4 |
Poco frecuente Poco frecuente Rara $ |
|
Exploraciones complementarias |
Aumento de la lipasa 3 Aumento de la amilasa |
Frecuente § Poco frecuente ? |
|
1 Reacciones adversas informadas también en pacientes tratados con linagliptina como monoterapia. 2 Reacciones adversas de la metformina como monoterapia; sírvase consultar el Resumen de Características del Producto correspondiente a la metformina para obtener información adicional. 3 Reacciones adversas de la combinación a dosis fija de linagliptina + metformina (análisis combinado de los estudios comparados con placebo). 4 Reacciones adversas identificadas durante la farmacovigilancia con linagliptina. 5 Reacciones adversas informadas también en pacientes tratados con metformina como monoterapia. 6 Reacción adversa informada para TRAJENTA® como complemento del tratamiento combinado de metformina + SU que no está descripta para TRAYENTA®DUO. # Este evento adverso no fue informado en los estudios clínicos como reacciones adversas (solo como eventos adversos); por ende, no se pudo calcular la frecuencia. Se asignó la frecuencia “no conocida” conforme a la Guía del Resumen de las características del producto de Europa. Guía de Resumen de las características del producto de septiembre de 2009: “En casos excepcionales, si no se puede estimar la frecuencia a partir de los datos disponibles se podrá utilizar la categoría adicional “no conocida”. En caso de utilizar la expresión “frecuencia no conocida”, se deberá agregar el siguiente texto a la lista de términos que explican las categorías de frecuencia: “no conocida (no se puede estimar a partir de los datos disponibles)”. † Reacción adversa basada en experiencia de farmacovigilancia, para la cual se informaron reacciones adversas al medicamento en el conjunto de datos de referencia. $ Reacción adversa basada en experiencia de farmacovigilancia, para la cual no se informaron eventos adversos relacionados con el medicamento en el conjunto de datos de referencia (SEA-combinado). Como se indica en la Guía de Resumen de las características de los productos de Europa “el límite superior del intervalo de confianza del 95% no es mayor que 3/X, donde X representa el total del tamaño de la muestra de todos los estudios clínicos relevantes (SEA-combinado). Por ejemplo, si no se ha observado una reacción adversa en particular entre 3600 sujetos expuestos al producto en los estudios y ensayos clínicos, entonces el límite superior del intervalo de confianza del 95% para la estimación puntual es 1/1200 o menor y la categoría de frecuencia debe ser “rara”, sobre la base del peor valor de la estimación puntual.” Cálculo de la frecuencia basada en el conjunto de datos combinados de SEA-combinado (Met sola (SEA-2) + met+insulina +/-ADO + met+SU sola + met+empa sola), linagliptina (N = 3463), abordaje similar al de Trajenta. § Frecuencia basada en el aumento de la lipasa >3ULN observada en el estudio MARLINA (1218.89); frecuencia similar a la de linagliptina como monoterapia y la combinación a dosis fija. ? Reacción adversa basada en los análisis de laboratorio para el aumento de la amilasa a >3ULN en el estudio CAROLINA (1218.74) de comparación de linagliptina con el comparador activo glimepirida. No se observaron reacciones adversas adicionales para la combinación Lina + Met + Empa. |
||
INDICACIONES/USO: TRAYENTA® DUO está indicado como tratamiento complementario de la dieta y el ejercicio para mejorar el control glicémico en adultos con diabetes mellitus tipo 2 en los cuales el tratamiento con un régimen combinado de linagliptina y metformina resulta apropiado, en pacientes en los que no se ha logrado un control adecuado con metformina sola, o en pacientes que ya están siendo tratados con éxito con la combinación libre de linagliptina y metformina.
TRAYENTA® DUO está indicado en combinación con una sulfonilurea (es decir, tratamiento combinado triple) como tratamiento complementario de la dieta y el ejercicio en pacientes en los que no se logra un control adecuado con su dosis máxima tolerada de metformina y una sulfonilurea.
TRAYENTA® DUO está indicado en combinación con un inhibidor del SGLT2 (es decir, tratamiento combinado triple) como tratamiento complementario de la dieta y el ejercicio en pacientes en los que no se logra un control adecuado con su dosis máxima tolerada de metformina y un inhibidor del SGLT2.
TRAYENTA® DUO está indicado como tratamiento complementario de la insulina (es decir, tratamiento combinado triple) como complemento de la dieta y el ejercicio para mejorar el control glicémico en pacientes en los cuales no se logra un control glicémico adecuado con insulina y metformina solas.
PRESENTACIÓN: TRAYENTA® DUO 2,5 mg/850 mg TABLETAS RECUBIERTAS, caja con frasco por 60 tabletas recubiertas. (Reg. San. No. INVIMA 2020M-0013446-R1). TRAYENTA® DUO 2,5 mg/1000 mg TABLETAS RECUBIERTAS: Caja con frasco por 60 tabletas recubiertas. (Reg. San. No. INVIMA 2020M-0013445-R1)
“¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (601) 319 91 00
e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A.
Versión 12 del 25 de abril de 2019