
TAZOCIN
PIPERACILINA, TAZOBACTAM
Polvo liofilizado para reconstituir
Caja , 1 Vial(es) , Polvo liofilizado , 500 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN Y CARACTERÍSTICAS FARMACÉUTICAS
Viales de POLVO liofilizado para reconstitución: Cada vial contiene un total de 2,79 mEq (64 mg) de sodio por gramo de piperacilina.
4.5 g vial: Cada vial de una dosis contiene piperacilina sódica equivalente a 4 g de piperacilina y tazobactam sódico equivalente a 0,5 g de tazobactam. También contiene 1 mg de edetato disódico (dihidrato) (EDTA) por vial.
Naturaleza y contenido del envase: Viales.
INDICACIONES: TAZOCIN® está indicado para el tratamiento de las siguientes infecciones bacterianas sistémicas y/o locales causadas por microorganismos grampositivos y gramnegativos aerobios y anaerobios susceptibles a piperacilina/tazobactam o piperacilina:
Adultos
• Infecciones del tracto respiratorio inferior.
• Infecciones del tracto urinario.
• Infecciones intraabdominales.
• Infecciones de piel y tejidos blandos no complicadas y complicadas que incluyen: celulitis, abscesos cutáneos, infecciones del pie diabético/isquémico.
• Septicemia bacteriana.
• Infecciones ginecológicas, incluidas endometritis posparto y enfermedad pélvica inflamatoria (EPI).
• Neutropenia febril. Se recomienda el tratamiento combinado con un aminoglucósido.
• Infecciones óseas y articulares.
• Infecciones polimicrobianas: (Aerobios y anaerobios grampositivos/gramnegativos).
Niños (2 años de edad o más)
• Neutropenia febril. Se recomienda el tratamiento combinado con un aminoglucósido.
• Infección intraabdominal.
En infecciones serias se puede iniciar terapia empírica con TAZOCIN® antes que estén disponibles las pruebas de susceptibilidad.
MODO DE ACCIÓN: TAZOCIN® (piperacilina sódica estéril/tazobactam sódico) es un antibacteriano inyectable combinado compuesto de piperacilina sódica, un antibiótico semisintético, y tazobactam sódico, un inhibidor de ß-lactamasa. Su administración se hace por vía intravenosa. De este modo, la piperacilina/tazobactam combina las propiedades de un antibiótico de amplio espectro y un inhibidor de ß-lactamasa.
La piperacilina sódica ejerce una actividad bactericida al inhibir la formación del septo y la síntesis de las paredes celulares. La piperacilina y otros antibióticos ß-lactámicos, en organismos sensibles, bloquean la etapa de transpeptidación terminal de la biosíntesis de peptidoglicano en la pared celular, mediante la interacción con las proteínas fijadoras de penicilina (PBP), las enzimas bacterianas que realizan esta reacción. En pruebas in vitro, la piperacilina actúa contra varias bacterias grampositivas y gramnegativas, aerobias y anaerobias. La piperacilina presenta una actividad reducida contra las bacterias que albergan ciertas enzimas de ß-lactamasa, que desactivan químicamente a la piperacilina y otros antibióticos ß-lactámicos. Tazobactam sódico, cuya actividad antimicrobiana intrínseca es mínima debido a su poca afinidad con las PBP, puede restablecer o mejorar la actividad de la piperacilina contra muchos de estos organismos resistentes. Tazobactam es un potente inhibidor de muchas ß-lactamasas clase A (penicilinasas, cefalosporinasas y enzimas de espectro ampliado). Su actividad contra las carbapenemasas clase A y las ß-lactamasas clase D es variable. No es activo contra la mayoría de cefalosporinasas clase C y es inactivo contra las metalo ß-lactamasas clase B.
Dos características de la piperacilina/tazobactam conducen a un aumento de la actividad contra algunos organismos que albergan ß-lactamasas y que, al someterse a prueba como preparaciones enzimáticas, son menos inhibidos por tazobactam y otros inhibidores: El tazobactam no induce ß-lactamasas de mediación cromosómica a los niveles de tazobactam logrados con la posología recomendada, y la piperacilina es relativamente resistente a la actividad de algunas ß-lactamasas.
Como sucede con otros antibióticos ß-lactámicos, la piperacilina, con o sin tazobactam, presenta contra los organismos sensibles una actividad bactericida dependiente del tiempo.
Mecanismo de resistencia: Existen tres mecanismos principales de resistencia contra los antibióticos ß-lactámicos: Cambios en los PBP diana, lo que reduce la afinidad por los antibióticos; destrucción de los antibióticos por ß-lactamasas bacterianas; bajos niveles de antibióticos intracelulares debido a una captación reducida o un eflujo activo de los antibióticos.
En las bacterias grampositivas, los cambios en PBP son el principal mecanismo de resistencia contra los antibióticos ß-lactámicos, incluida la piperacilina/tazobactam. Este mecanismo es responsable por la resistencia de los estafilococos a la meticilina y la resistencia a la penicilina en casos de Streptococcus pneumoniae y estreptococos del grupo viridans. La resistencia causada por los cambios en PBP ocurre también en las especies gramnegativas Haemophilus influenzae y Neisseria gonorrhoeae. La piperacilina/tazobactam no es activa contra las cepas en las que la resistencia a los antibióticos ß-lactámicos se determina por PBP alterados. Como se indicó anteriormente, existen ciertas ß-lactamasas no inhibidas por tazobactam.
• Microbiología
Espectro antibacteriano: Se ha demostrado que la piperacilina/tazobactam actúa contra la mayoría de cepas de los siguientes microorganismos, in vitro y en las infecciones clínicas señaladas.
Microorganismos aerobios y grampositivos facultativos: Staphylococcus aureus (solo las cepas sensibles a meticilina).
Microorganismos aerobios y gramnegativos facultativos
— Acinetobacter baumanii.
— Escherichia coli.
— Haemophilus influenzae (excepto los aislados ß-lactamasa negativos resistentes a la ampicilina).
— Klebsiella pneumoniae.
— Pseudomonas aeruginosa (suministrado en combinación con un aminoglucósido al cual el aislado es sensible).
Anaerobios gramnegativos: Grupo Bacteroides fragilis (B. fragilis, B. ovatus, B. thetaiotaomicron y B. vulgatus).
Se dispone de los siguientes datos de pruebas in vitro, aunque se desconoce su importancia clínica.
Al menos 90% de los siguientes microorganismos presentan in vitro una concentración inhibitoria mínima (MIC) inferior o igual al límite de sensibilidad para piperacilina/tazobactam. No obstante, la seguridad y eficacia de la piperacilina/tazobactam para tratar las infecciones clínicas por estas bacterias no se ha determinado aún en ensayos clínicos adecuados, debidamente controlados.
Microorganismos aerobios y grampositivos facultativos
— Enterococcus faecalis (solo aislados sensibles a ampicilina o penicilina).
— Staphylococcus epidermidis (solo aislados sensibles a meticilina).
— Streptococcus agalactiae†
— Streptococcus pneumoniae† (solo aislados sensibles a penicilina)
— Streptococcus pyogenes†
— Estreptococos del grupo viridans†
Microorganismos aerobios y gramnegativos facultativos
— Citrobacter koseri.
— Moraxella catarrhalis.
— Morganella morganii.
— Neisseria gonorrhoeae.
— Proteus mirabilis.
— Proteus vulgaris.
— Serratia marcescens.
— Providencia stuartii.
— Providencia rettgeri.
— Salmonella enterica.
Anaerobios grampositivos: Clostridium perfringens.
Anaerobios gramnegativos
— Bacteroides distasonis.
— Prevotella melaninogenica.
† Estas no son bacterias productoras de ß-lactamasa y por lo tanto son sensibles a la piperacilina por separado.149
• Pruebas de Susceptibilidad
Como se ha recomendado con otros antibióticos, cuando estén disponibles los resultados de las pruebas de susceptibilidad in vitro estos deben enviarse a los médicos como reportes periódicos, los cuales describen el perfil de susceptibilidad de los patógenos adquiridos en el hospital y en la comunidad. Estos reportes deben ayudar al médico a seleccionar el antibiótico más efectivo.
Las pruebas de sensibilidad deben efectuarse aplicando métodos homologados de laboratorio, p. ej. los señalados por el Clinical and Laboratory Standards Institute (CLSI). Estos estándares incluyen los métodos de dilución (determinación de la concentración inhibitoria mínima, MIC) y los métodos de sensibilidad de discos. CLSI y el Comité Europeo sobre Pruebas de Sensibilidad Antimicrobiana (EUCAST) señalan criterios interpretativos de sensibilidad para algunas especies bacterianas, de acuerdo con estos métodos. Téngase en cuenta que para el método de difusión con discos, CLSI y EUCAST utilizan discos con diferente contenido del medicamento.
Técnicas de dilución: Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (MIC). Estas MIC dan un estimado de susceptibilidad de la bacteria a los antimicrobianos. Las MIC deben determinarse usando procedimientos estandarizados. Los procedimientos estandarizados se basan en los métodos de dilución (en caldo o en agar) o su equivalente con concentraciones estándar de inóculo y concentraciones estándar en polvo de piperacilina y tazobactam. Los valores de MIC deben determinarse usando diluciones seriales de piperacilina combinadas con una concentración fija de 4 µg/ml de tazobactam. Los valores de MIC obtenidas deben interpretarse de acuerdo a los criterios suministrados en la Tabla 1.
Técnicas de difusión: Los métodos cuantitativos que requieran medidas del diámetro de la zona también pueden proporcionar estimados reproducibles de susceptibilidad de la bacteria a compuestos antimicrobianos. Uno de dichos procedimientos estándar requiere el uso de concentraciones estándar de inóculo. Este procedimiento utiliza discos de papel impregnados con 100 µg de piperacilina y 10 µg de tazobactam para probar la susceptibilidad de microorganismos a piperacilina/tazobactam. Los criterios para interpretación de la difusión de disco son proporcionados en la Tabla 1.
Técnicas para anaerobios: Para bacterias anaerobias, la susceptibilidad para piperacilina/tazobactam puede determinarse por el método de dilución en agar o por métodos alternos de pruebas estándar.
Los criterios interpretativos del CLSI para las pruebas de sensibilidad de piperacilina/tazobactam se indican en la siguiente tabla
|
Tabla 1. Criterios interpretativos de susceptibilidad del CLSI para la Piperacilina/Tazobactam |
||||||
|
Patógeno |
Concentración inhibitoria mínima (MIC) de piperacilina en mg/l a |
Zona de inhibición de difusión del disco b (diámetro en mm) |
||||
|
S |
I |
R |
S |
I |
R |
|
|
Enterobacteriaceae y Acinetobacter baumanii |
=16 |
32 - 64 |
=128 |
=21 |
18 - 20 |
=17 |
|
Pseudomonas aeruginosa |
=16 |
32 - 64 |
=128 |
=21 |
15 - 20 |
=14 |
|
Ciertos otros bacilos gramnegativos no fastidiosos c |
- |
- |
- |
=21 |
18 - 20 |
=17 |
|
Haemophilus influenzae |
=1 |
- |
=2 |
=21 |
- |
- |
|
Staphylococcus aureus |
=8 |
- |
=16 |
=18 |
- |
=17 |
|
Grupo Bacteroides fragilis d |
=32 |
64 |
=128 |
- |
- |
- |
|
Fuente: Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing; 22nd Informational Supplement. Documento M100-S22 del CLSI. CLSI, Wayne, PA, 2012. S = susceptible. I = intermedio. R = resistente. a Los MIC se determinan según una concentración fija de 4 mg/l de tazobactam y variando la concentración de piperacilina. b Los criterios interpretativos del CLSI se basan en discos con 100 µg de piperacilina y 10 µg de tazobactam. c Encontrará una lista de los organismos incluidos en el documento M100-S22 del CLSI, tabla 2B-5. d Salvo Bacteroides fragilis por sí mismo, las MIC se determinan solo mediante dilución en agar. |
||||||
Un informe de “Susceptibilidad” indica que el patógeno será probablemente inhibido si el antimicrobiano alcanza en sangre las concentraciones usualmente obtenidas. Un informe “Intermedio” indica que los resultados deben considerarse equívocos y la prueba debe ser repetida si el microorganismo no es completamente susceptible a la alternativa y los medicamentos son clínicamente útiles. Esta categoría implica aplicabilidad clínicamente posible en sitios del cuerpo en donde el antimicrobiano se concentra fisiológicamente o en condiciones en las cuales éste puede ser utilizado en dosis altas. Esta categoría también suministra una zona de amortiguación la cual previene discrepancias mayores de interpretación debidas a factores técnicos menores no controlados. Un informe “Resistente” indica la improbabilidad de que el patógeno pueda ser inhibido si el antimicrobiano en sangre alcanza las concentraciones usualmente factibles; otro tratamiento debe ser considerado.
• Control de calidad
Las pruebas de susceptibilidad estándar requieren el uso de microorganismos para el control de laboratorio, para controlar aspectos técnicos de los procedimientos de prueba. El polvo estándar de piperacilina/ tazobactam debe suministrar los rangos de valores que aparecen en la Tabla 2. Los microorganismos de control de calidad son pruebas microbiológicas realizadas con cepas específicas de organismos con propiedades biológicas intrínsecas relacionadas con los mecanismos de resistencia y con la expresión genética dentro de la bacteria. Estas cepas específicas usadas para las pruebas de sensibilidad de control de calidad no son clínicamente significativas.
Los organismos y márgenes de control de calidad para la piperacilina/tazobactam que se deben utilizar con la metodología y criterios interpretativos del CLSI para las pruebas de sensibilidad se indican en la siguiente tabla
|
Tabla 2. Márgenes de control de calidad para Piperacilina/Tazobactam que deben utilizarse junto con los criterios interpretativos de las pruebas de susceptibilidad del CLSI |
||
|
Margen de la concentración inhibitoria mínima de piperacilina en mg/l |
Margen del diámetro de la zona de inhibición de difusión del disco en mm |
|
|
Cepa de control de calidad |
||
|
Escherichia coli ATCC 25922 |
1-4 |
24-30 |
|
Escherichia coli ATCC 35218 |
0,5-2 |
24-30 |
|
Pseudomonas aeruginosa ATCC 27853 |
1-8 |
25-33 |
|
Haemophilus influenzae ATCC 49247 |
0,06-0,5 |
33-38 |
|
Staphylococcus aureus ATCC 29213 |
0,25-2 |
- |
|
Staphylococcus aureus ATCC 25923 |
- |
27-36 |
|
Bacteroides fragilis ATCC 25285 |
0,12-0.5 a |
- |
|
Bacteroides thetaiotaomicron ATCC 29741 |
4-16 a |
- |
|
Fuente: Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing; 22nd Informational Supplement. Documento M100-S22 del CLSI. CLSI, Wayne, PA, 2012. |
||
USO GERIÁTRICO: Pacientes mayores de 65 años no tienen riesgo aumentado de desarrollar efectos adversos solo por la edad. Sin embargo, en la presencia de insuficiencia renal, la dosis debe ajustarse.
USO PEDIÁTRICO: Vea Indicaciones, Dosis y administración.
COMPATIBILIDADES E INCOMPATIBILIDADES
Las soluciones conocidas compatibles con TAZOCIN® con EDTA para la reconstitución son
— Cloruro de sodio al 0,9% para inyección.
— Agua estéril para inyección.
— Dextrosa al 5%.
La solución reconstituida de TAZOCIN® con EDTA puede diluirse hasta el volumen deseado (v.g. 50 ml a 150 ml) con una de las soluciones compatibles para uso intravenoso indicadas abajo:
— Cloruro de sodio al 0.9% para inyección.
— Agua estéril para inyección.
— Dextrosa al 5%.
— Lactato de Ringer para inyección.
1El volumen máximo de agua estéril para inyección recomendado es de 50 ml por dosis.
Cuando TAZOCIN® se administra concomitantemente con otro antibiótico (p. ej., aminoglucósidos), los medicamentos se deben administrar de manera separada. La mezcla de TAZOCIN® con un aminoglucósido in vitro puede resultar en inactivación sustancial del aminoglucósido.
La mezcla de antibióticos beta-lactámicos con aminoglucósidos in vitro puede resultar en una inactivación sustancial del aminoglucósido. Sin embargo, se determinó que la amikacina y gentamicina son compatibles con TAZOCIN® in vitro en ciertos diluyentes y a ciertas concentraciones específicas (vea sección Dosis y administración).
TAZOCIN® no debe mezclarse con otros medicamentos en una jeringa o en el frasco de infusión ya que su compatibilidad no ha sido establecida.
Debido a su inestabilidad química, TAZOCIN® no se debe usar con soluciones que contengan bicarbonato de sodio.
TAZOCIN® no debe añadirse a hemoderivados o hidrolizados de albúmina.
• Estabilidad después de la reconstitución
Las soluciones de TAZOCIN® después de la reconstitución en los viales farmacéuticos, se pueden usar hasta las 24 horas siguientes si se almacenan a 30 °C o hasta las 48 horas siguientes si son refrigeradas (2 °C - 8 °C). Debe ser descartado cualquier remanente o solución no usada en este lapso.
Las soluciones de TAZOCIN® diluidas al volumen deseado (50 a 150 ml), luego de la reconstitución, han demostrado estabilidad química hasta por 24 horas si se almacenan a 30 °C o por una semana si se almacenan a temperaturas refrigeradas (2 °C - 8 °C).
FARMACOCINÉTICA
Distribución: Tanto piperacilina como tazobactam se fijan a las proteínas plasmáticas en 30% aproximadamente. La unión de la proteína a piperacilina o tazobactam no se ve afectada por la presencia de otros compuestos. La unión de proteína al metabolito de tazobactam es insignificante.
TAZOCIN® se distribuye a través de tejidos y líquidos corporales incluidos la mucosa intestinal, la vesícula biliar, pulmones, bilis y hueso. Las concentraciones promedio en tejido generalmente son 50 a 100% de aquellas en plasma.
Metabolismo: La piperacilina se metaboliza a desetil metabolito, microbiológicamente menos activo. Tazobactam se metaboliza a un metabolito único, que se halló microbiológicamente inactivo.
Eliminación: Piperacilina y tazobactam se eliminan por el riñón, por filtración glomerular y secreción tubular.
Piperacilina se excreta rápidamente en forma de medicamento inalterado por orina. El 68% de la dosis administrada está presente en orina. Tazobactam y su metabolito se eliminan principalmente por excreción renal, con el 80% de la dosis administrada en forma de medicamento inalterado y el resto de la dosis en forma de metabolito. Piperacilina, tazobactam, y desetilpiperacilina también son excretados por la bilis.
En sujetos sanos, la vida media de eliminación plasmática de TAZOCIN® varía desde 0,7 a 1,2 horas, después de administrarse en dosis única o múltiple y no se ve afectada por la dosis o la duración de la infusión. El tiempo de vida media de eliminación de la piperacilina y del tazobactam se incrementa con la disminución de la depuración renal.
No hay cambios significativos en la farmacocinética de piperacilina debido al tazobactam. Parece que la piperacilina reduce la tasa de eliminación del tazobactam.
Poblaciones especiales: La semivida de piperacilina y de tazobactam aumenta aproximadamente 25% y 18% respectivamente, en pacientes con cirrosis hepática en comparación con sujetos sanos.
La vida media de piperacilina y tazobactam aumenta cuando hay disminución en la depuración de creatinina. El aumento es de dos y cuatro veces para piperacilina y tazobactam, respectivamente, cuando la depuración de creatinina es menos de 20 ml/min, en comparación con pacientes con función renal normal.
La hemodiálisis extrae 30% - 50% de piperacilina/tazobactam, con un 5% adicional de la dosis de tazobactam extraído como metabolito tazobactam. La diálisis peritoneal extrae 6% y 21% de la dosis de piperacilina y tazobactam respectivamente, hasta con un 18% de la dosis de tazobactam extraída como metabolito tazobactam.
CONTRAINDICACIONES: Hipersensibilidad a cualquiera de los ß-lactámicos (incluidas penicilinas y cefalosporinas) o a inhibidores de ß-lactamasa.
EMBARAZO: Los estudios en animales no han mostrado teratogenicidad con la combinación de piperacilina-tazobactam en administración intravenosa, pero si han mostrado toxicidad reproductiva en ratas gestantes a dosis tóxicas al administrarse intravenosamente o intraperitonealmente. En mujeres embarazadas no existen estudios adecuados o bien controlados con la combinación de piperacilina-tazobactam o con piperacilina o tazobactam solos. La piperacilina y el tazobactam cruzan la placenta. Las mujeres embarazadas deben tratarse solamente si el beneficio esperado excede la posibilidad de riesgos para la mujer embarazada y al feto.
LACTANCIA: La piperacilina es excretada en concentraciones bajas por la leche materna; no se han estudiado las concentraciones de tazobactam en la leche materna. Las mujeres que se encuentran lactando deben tratarse sólo si el beneficio esperado excede los posibles riesgos para la mujer embarazada y el niño.
REACCIONES ADVERSAS
|
Tabla de reacciones adversas por medicamento |
||||||
|
Clasificación por órganos y sistemas |
Muy común =1/10 |
Común =1/100 a <1/10 |
Poco común =1/1000 a <1/100 |
Raro =1/10.000 a <1/1000 |
Muy raro <1/10.000 |
Frecuencia desconocida (no se puede estimar a partir de los datos disponibles) |
|
Infecciones e infestaciones |
Candidiasis* |
|||||
|
Trastornos sanguíneos y del sistema linfático |
Trombocitopenia, anemia*, prueba directa de Coombs positiva, tiempo parcial de tromboplastina activada prolongado |
Leucopenia, tiempo de protrombina prolongado |
Agranulocitosis, epistaxis |
Pancitopenia*, neutropenia, púrpura, tiempo de sangrado prolongado, anemia hemolítica *, eosinofilia*, trombocitosis* |
||
|
Trastornos del sistema inmunitario |
Reacción anafilactoide *, reacción anafiláctica *, choque anafilactoide *, choque anafiláctico *, hipersensibilidad* |
|||||
|
Trastornos del metabolismo y la nutrición |
Reducción de albúmina en sangre, reducción de proteína total en sangre |
Hipocalemia, reducción de glucosa en sangre |
||||
|
Trastornos del sistema nervioso |
Dolor de cabeza, insomnio |
|||||
|
Trastornos vasculares |
Hipotensión, flebitis, tromboflebitis, rubefacción |
|||||
|
Trastornos gastrointestinales |
Diarrea |
Dolor abdominal, náuseas, vómitos, estreñimiento, dispepsia |
Colitis pseudomembranosa, estomatitis |
|||
|
Trastornos hepatobiliares |
Aumento de aspartato aminotransferasa, aumento de alanina aminotransferasa, aumento de alcalina fosfatasa en sangre |
Aumento de bilirrubina en sangre |
Hepatitis*, ictericia, aumento de gammaglutamiltransferasa |
|||
|
Trastornos de la piel y tejido subcutáneo |
Erupción, prurito |
Eritema multiforme*, urticaria, erupción maculopapular* |
Necrólisis epidérmica tóxica * |
Síndrome de Stevens-Johnson*, dermatitis bulosa |
||
|
Trastornos óseos, del tejido conectivo y musculoesqueléticos |
Artralgia, mialgia |
|||||
|
Trastornos renales y urinarios |
Aumento de creatinina en sangre, aumento ureico en sangre |
Insuficiencia renal, nefritis tubulointersticial* |
||||
|
Trastornos generales y afecciones en el lugar de la administración |
Pirexia, reacción en el lugar de la inyección |
Escalofríos |
||||
|
*Reacciones adversas al medicamento identificadas después de la comercialización |
||||||
La terapia con piperacilina ha sido asociada con incremento en la incidencia de fiebre y rash en pacientes con fibrosis quística.
INTERACCIONES
Relajantes musculares no despolarizantes: Cuando la piperacilina ha sido administrada concomitantemente con vecuronio se le ha implicado en la prolongación de bloqueo neuromuscular de vecuronio. Debido a su mecanismo similar de acción, se espera que el bloqueo neuromuscular producido por cualquiera de los relajantes musculares no despolarizantes pudiera prolongarse en presencia de la piperacilina.
Anticoagulantes orales: Durante la administración simultánea de heparina, anticoagulantes orales y otros medicamentos que puedan afectar el sistema de coagulación sanguínea, incluida la función plaquetaria, deben realizarse con más frecuencia exámenes de coagulación apropiados y monitorearse regularmente (vea sección Precauciones).
Metotrexato: La piperacilina puede reducir la excreción de metotrexato, por lo tanto para evitar la toxicidad del medicamento deben monitorizarse los niveles séricos de metotrexato en los pacientes.
Probenecid: Así como con otras penicilinas, la administración concomitante de probenecid y TAZOCIN® produce una vida media más larga y una eliminación renal más baja tanto para piperacilina como para tazobactam; sin embargo, las concentraciones plasmáticas pico de ambas sustancias no resultan afectadas.
Aminoglucósidos: En sujetos con función renal normal y con alteración leve o moderada, de la función renal la piperacilina sola o con tazobactam no altera significativamente la farmacocinética de tobramicina.30 La farmacocinética de piperacilina, tazobactam y el metabolito M1 tampoco fueron significativamente alterados por la administración de tobramicina.
Vancomicina: No se han advertido interacciones farmacocinéticas entre TAZOCIN® y vancomicina.
DATOS DE SEGURIDAD PRECLÍNICA
Carcinogenicidad: No se han realizado estudios clínicos sobre carcinogenicidad con piperacilina, tazobactam o la combinación de ambos.
Mutagenicidad: Piperacilina/tazobactam fueron negativos en las pruebas de mutagenicidad microbiana. Piperacilina/tazobactam fue negativa en las pruebas no programadas de la síntesis de ADN (UDS). Piperacilina/tazobactam fueron negativos en la mutación dirigida en mamíferos (Células de ovario de Hámster Chino COHC). Piperacilina/tazobactam fue negativa en el ensayo de transformación de células de mamíferos (BALB/c-3T3). In vivo, piperacilina/tazobactam no indujo aberraciones cromosómicas en ratones dosificados por vía intravenosa.
Piperacilina fue negativa en las pruebas de mutagenicidad microbiana. No hubo daño en el ADN (Prueba Rec) de las bacterias expuestas a piperacilina. Piperacilina fue negativa en las pruebas de UDS. En las pruebas de mutación dirigida en mamíferos (linfoma en células de ratón), piperacilina fue positiva. Piperacilina fue negativa en la prueba de transformación de células (BALB/c-3T3.) In vivo, piperacilina no indujo aberraciones cromosómicas en ratones dosificados por vía intravenosa.
Tazobactam fue negativo en las pruebas de mutagenicidad microbiana. Tazobactam fue negativo en la prueba de síntesis UDS. Tazobactam fue negativo en la mutación dirigida en mamíferos (células de ovario de hámster chino, COHC). En otros ensayos dirigidos a mamíferos (linfoma en células de ratón), tazobactam fue positivo. Tazobactam fue negativo en la prueba de transformación de célula (BALB/c-3T3.) En una prueba in vitro, (células de pulmón de hámster chino), tazobactam fue negativo. In vivo, tazobactam no indujo aberraciones cromosómicas en ratones dosificados por vía intravenosa.
Toxicidad reproductiva: En estudios embrio-fetales desarrollados no se encontró evidencia de teratogenicidad después de la administración intravenosa de tazobactam o de la combinación piperacilina/tazobactam; sin embargo en ratas se produjeron leves reducciones en el peso corporal de los fetos a dosis tóxicas para las ratas gestantes.
La administración intraperitoneal de piperacilina/tazobactam estuvo asociada con leves reducciones en el tamaño de la camada y una mayor incidencia de anomalías esqueléticas menores (demoras en la osificación) a dosis que producen toxicidad en las ratas gestantes. El desarrollo peri/postnatal se vio afectado (disminución en el peso de las crías, aumento de nacimientos prematuros, incremento de mortalidad en las crías) concurrente con la toxicidad en las ratas gestantes.
Deterioro de la fertilidad: Los estudios sobre reproducción en ratas no mostraron evidencia de deterioro en la fertilidad debido al tazobactam, o piperacilina/tazobactam al administrarse intraperitonealmente.
INTERFERENCIA CON PRUEBAS DE LABORATORIO Y OTROS EXÁMENES DIAGNÓSTICOS: Como con otras penicilinas, la administración de TAZOCIN® puede resultar en reacción falsa-positiva para glucosa en orina usando el método de reducción de cobre. Se recomienda usar pruebas de glucosa basadas en reacciones enzimáticas de glucosa oxidasa.
Hay informes de resultados positivos para infección por Aspergillus usando la prueba de Laboratorio Bio-Rad Platelia Aspergillus EIA en pacientes que están recibiendo TAZOCIN® inyectable, quienes fueron subsecuentemente encontrados sin infección por Aspergillus. Se han informado reacciones cruzadas con polisacáridos no Aspergílicos y polifuranosas con la prueba de laboratorio Bio-Rad Platelia Aspergillus EIA. Por lo tanto, los resultados positivos en pacientes que reciben TAZOCIN® deben ser interpretados cuidadosamente y confirmados con otros métodos diagnósticos.
PRECAUCIONES: Algunos pacientes que estaban recibiendo antibióticos ß-lactámicos han presentado manifestaciones hemorrágicas. Algunas veces estas reacciones se han asociado con alteraciones en las pruebas de coagulación como tiempos de coagulación, de protrombina y agregación plaquetaria y ocurren con mayor probabilidad en pacientes con insuficiencia renal (vea sección Interacciones). En caso que se presenten manifestaciones hemorrágicas, debe descontinuarse el antibiótico e iniciarse el tratamiento apropiado.
TAZOCIN® contiene 2,79 mEq (64 mg) de sodio por gramo de piperacilina que puede aumentar la ingesta total de sodio del paciente. La hipocalemia puede ocurrir en pacientes con baja reserva de potasio o que se encuentren recibiendo medicamentos concomitantes que pueden disminuir los niveles de potasio; en dichos pacientes es aconsejable que se hagan determinaciones periódicas de electrolitos.
Puede ocurrir leucopenia y neutropenia especialmente durante el tratamiento prolongado. Por lo tanto debe realizarse una evaluación periódica de la función hematopoyética.
Como sucede con el tratamiento con otras penicilinas, pueden ocurrir complicaciones neurológicas en forma de convulsiones cuando se administran altas dosis, especialmente en pacientes con deterioro de la función renal.
Como sucede con el tratamiento con otras preparaciones de antibióticos, el uso de este medicamento puede llevar a un sobrecrecimiento de organismos no susceptibles, incluidos hongos. Los pacientes deben ser cuidadosamente monitoreados durante el tratamiento. Si llega a ocurrir una superinfección deberán tomarse las medidas apropiadas.
Uso en pacientes con deterioro hepático: Vea sección Dosis y administración.
Uso en pacientes con deterioro renal: En pacientes con insuficiencia renal o pacientes bajo hemodiálisis, la dosis intravenosa debe ajustarse al grado de alteración de la función renal.
ADVERTENCIAS ESPECIALES: Antes de iniciar el tratamiento con TAZOCIN®, se debe averiguar cuidadosamente cualquier reacción previa de hipersensibilidad a las penicilinas, cefalosporinas y otros alergenos. Se han recibido informes de reacciones de hipersensibilidad graves y ocasionalmente fatales (anafilácticas/anafilactoides, (incluido choque)) en pacientes bajo tratamiento con penicilinas, incluido TAZOCIN®. Es más probable que estas reacciones ocurran en personas con historial de sensibilidad a varios alergenos. Las reacciones graves de hipersensibilidad requieren la descontinuación del antibiótico y pueden requerir la administración de adrenalina y otras medidas de emergencia.
En pacientes que estaban recibiendo TAZOCIN® se informaron reacciones cutáneas graves como síndrome de Stevens-Johnson y necrosis epidérmica tóxica (vea sección Reacciones adversas). Si los pacientes desarrollan exantema deben observarse estrictamente y en caso de que las lesiones empeoren debe interrumpirse TAZOCIN®.
La colitis pseudomembranosa inducida por antibióticos puede manifestarse con diarrea grave y persistente que pueden poner en peligro la vida. El inicio de los síntomas de colitis pseudomembranosa puede ocurrir durante y después del tratamiento antibacteriano.
DOSIS Y ADMINISTRACIÓN: TAZOCIN® debe administrarse por inyección intravenosa lenta, por infusión (durante un período de 20 a 30 minutos o en infusión prolongada intermitente de 3 a 4 horas cada 6 a 8 horas, de acuerdo con la gravedad de la infección, la evolución clínica del paciente y el progreso bacteriológico de la condición subyacente).
Duración del tratamiento: La duración del tratamiento debe guiarse por la gravedad de la infección y por el progreso clínico y bacteriológico del paciente.
Adultos y niños de 12 años y mayores: En general se recomienda una dosis diaria total de 12 g piperacilina/1,5 g tazobactam en dosis divididas cada 6 - 8 horas. En infecciones severas pueden usarse dosis diarias mayores, p.e. 18 g piperacilina/2,25 g tazobactam en dosis dividas o 4,5 g cada 6 - 8 horas en infusión prolongada intermitente de 3 a 4 horas.
Neutropenia pediátrica: Neutropenia febril en pacientes pediátricos en combinación con un aminoglucósido.
En niños con función renal normal y peso menor que 50 kg, la dosis debe ajustarse a 80 mg piperacilina/10 mg tazobactam por kg, administrado cada 6 horas, en combinación con la dosis apropiada de un aminoglucósido.
Para niños que pesan más de 50 kg, seguir la dosificación de adultos, en combinación con la dosis apropiada de un aminoglucósido.
Infección intraabdominal pediátrica: Para niños de 2 a 12 años con función renal normal y un peso hasta 40 kg, la dosis recomendada es de 100 mg piperacilina/12,5 mg tazobactam por kilogramo de peso cada 8 horas.
Para niños de 2 a 12 años con función renal normal y con peso corporal mayor a 40 kg, siga la dosis de adultos. El tratamiento recomendado es de mínimo 5 días y un máximo de 14 días, considerando que la administración del medicamento debe continuarse al menos por 48 horas después de la resolución de los signos y síntomas clínicos.
Administración en pacientes con deterioro renal: En pacientes con insuficiencia renal o pacientes bajo hemodiálisis, la dosis intravenosa y los intervalos de administración deben ajustarse al grado de la disfunción renal.
Administración en pacientes con disfunción hepática: No es necesario el ajuste de la dosis de TAZOCIN® en pacientes con disfunción hepática.
Administración concomitante de TAZOCIN® con aminoglucósidos: Debido a la inactivación in vitro de los aminoglucósidos por los antibióticos beta-lactámicos, se recomienda que TAZOCIN® y el aminoglucósido sean administrados en forma separada. TAZOCIN® y el aminoglucósido deben ser reconstituidos y diluidos separadamente cuando está indicado un tratamiento concomitante con aminoglucósidos. (vea sección Compatibilidades e incompatibilidades).
En los casos en los que se prefiere la administración concomitante, TAZOCIN® con EDTA es compatible para administración simultánea vía infusión por un catéter en Y , sólo con los siguientes aminoglucósidos y bajo las siguientes condiciones:
|
Aminoglucósido |
Dosis de TAZOCIN® (gramos) |
Volumen de diluyente para TAZOCIN® (ml) |
Rango de concentración de aminoglucósido‡ (mg/ml) |
Diluyentes aceptables |
|
Amikacina |
4,5 |
150 |
1,75 - 7,5 |
Cloruro de sodio 0,9% o dextrosa 5% |
|
Gentamicina |
4,5 |
150 |
0,7 - 3,32 |
Cloruro de sodio 0,9% o dextrosa7 5% |
|
‡ La dosis del aminoglucósido debe estar basada en el peso del paciente, el estadio de la infección (grave o potencialmente mortal) y la función renal (depuración de creatinina). |
||||
La compatibilidad de TAZOCIN® con otros aminoglucósidos no ha sido establecida. Solo se ha establecido la compatibilidad para administración concomitante a través de un catéter en Y para las concentraciones y diluyentes de amikacina, y gentamicina con las dosis de TAZOCIN® listadas en la tabla anterior. La administración concomitante simultánea a través de un catéter en Y de cualquier otra manera no listada anteriormente, puede resultar en la inactivación del aminoglucósido por TAZOCIN®.
SOBREDOSIS
Síntomas: Se han recibido informes post-comercialización de sobredosis con TAZOCIN®. La mayoría de los eventos experimentados incluía: Náuseas, vómitos y diarrea que también han sido informados con la dosis usual recomendada. Los pacientes pueden experimentar excitación neuromuscular o convulsiones si se suministran dosis intravenosas mayores a las dosis recomendadas (particularmente en presencia de insuficiencia renal).
Tratamiento: El tratamiento debe ser de soporte y sintomático de acuerdo a la historia clínica de los pacientes. No se conoce un antídoto específico. Las concentraciones séricas excesivas de piperacilina o tazobactam pueden reducirse con hemodiálisis (vea sección Farmacocinética) 2
DESCRIPCIÓN
Ingredientes activos, moléculas activas: Piperacilina sódica/tazobactam sódico (INN).
Nombre químico: El nombre químico de piperacilina sódica es (2S,5R,6R)-6-[(R)-2-(4-etil-2,3-dioxo-1-piperacinacarboxamido)-2-fenilacetamido]-3,3-dimetil-7-oxo-4-tia-1-azabiciclo[3.2.0]heptano-2-ácido carboxílato sódico.
El nombre químico de tazobactam sódico es sodio (2S,3S,5R)-3-metil-7-oxo-3-(1H-1,2,3-triazol-1-metil)-4-tia-1-azabiciclo [3.2.0] heptano-2-carboxílato-4,4-dióxido.
Estructura
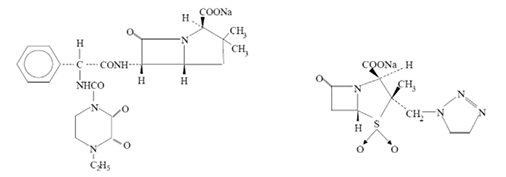
Piperacilina sódica Tazobactam sódico
Fórmula molecular
Piperacilina sódica: C23H26N5NaO7S; tazobactam sódico: C10H11N4NaO5S
Peso molecular: Piperacilina sódica: 539,5; tazobactam sódico: 322,3
Características físicas: Piperacilina sódica es un polvo blanco a cristalino. Piperacilina sódica es libremente soluble en agua, en alcohol, y en alcohol metílico; prácticamente insoluble en acetato de etilo.
Tazobactam sódico es un polvo de blanco a amarillo pálido, cristalino, no higroscópico.
Clase farmacológica, clase terapéutica
• Piperacilina sódica: Antinfecciosa, penicilina antibacterial. Código ATC: J01C A12
• Tazobactam sódico: Inhibidor de beta-lactamasa. Código ATC: J01C G02
• Antibacterianos sistémicos, combinación de penicilinas incluidos los inhibidores de beta-lactamasa; código ATC: J01C R05149
Formas farmacéuticas y vías de administración: Polvo estéril liofilizado para solución para inyección o infusión.
PRESENTACIÓN: TAZOCIN® 4.5 g inyectable (Reg. San. INVIMA 2007M-006238-R1).
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
(Con base en CDS v 22.0)
LLD_Pipe_Tazo_Col_07Nov2013_CDSv22.0_Resol.2014021481_04Ago2014
PFIZER S.A.S.
ALMACENAMIENTO: Almacene el producto a temperatura no mayor a 30 °C.
MANIPULACIÓN
Directrices para la reconstitución y dilución para utilización: Reconstituya cada vial con el volumen del solvente indicado en la siguiente tabla, usando uno de los diluyentes compatibles para la reconstitución. Agite hasta la disolución.
Con agitación constante, generalmente la reconstitución ocurre dentro de los 5 a 10 minutos.
|
Tamaño del vial (TAZOCIN®) |
Volumen del diluyente a añadir por vial |
|
4,50g |
20 ml |