
SPIOLTO RESPIMAT
OLODATEROL, TIOTROPIO
Inhalador
Caja, Inhalador, 4 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: SPIOLTO® RESPIMAT® es un inhalador que administra una neblina aerosolizada suave de la solución inhalable de tiotropio + olodaterol.
La dosis administrada es 2,5 microgramos de tiotropio y 2,5 microgramos de olodaterol por cada aplicación, o puff (2 aplicaciones conforman una dosis medicinal) y es equivalente a 3,124 microgramos de bromuro de tiotropio monohidrato y 2,7 microgramos de olodaterol clorhidrato.
La dosis administrada es la dosis que llega al paciente luego de atravesar la boquilla.
INDICACIONES: SPIOLTO® RESPIMAT® está indicado para el tratamiento de mantenimiento prolongado en un régimen de una administración diaria en pacientes con EPOC (lo cual comprende bronquitis crónica y enfisema) para reducir el grado de obstrucción de las vías aéreas, mejorar la calidad de vida, reducir la disnea asociada y aumentar la resistencia al ejercicio físico y reducir las exacerbaciones.
USO EN POBLACIONES ESPECÍFICAS:
• Fertilidad, embarazo y lactancia:
Embarazo: Existe una cantidad limitada de datos sobre el uso del tiotropio en las mujeres embarazadas. No existen datos clínicos disponibles sobre la exposición al olodaterol durante el embarazo.
Los estudios preclínicos realizados con tiotropio no indican efectos nocivos directos ni indirectos en lo que respecta a la toxicidad para la reproducción en las dosis clínicamente relevantes (véase la sección Toxicología).
Los datos preclínicos obtenidos en relación con el olodaterol revelaron efectos que son los típicos de los agonistas beta adrenérgicos administrados en múltiplos elevados de las dosis terapéuticas (véase la sección Toxicología).
Como medida de precaución, es preferible evitar el uso de SPIOLTO® RESPIMAT® durante el embarazo.
Debe tomarse en consideración el efecto inhibitorio que ejercen los agonistas beta adrenérgicos, como es el olodaterol, uno de los componentes de SPIOLTO® RESPIMAT®, sobre las contracciones uterinas.
Lactancia: No existen datos clínicos disponibles en torno a la exposición al tiotropio y/o al olodaterol en mujeres en período de lactancia.
En estudios preclínicos, se ha detectado la presencia de tiotropio y olodaterol y/o sus metabolitos en la leche de las ratas en período de lactancia, pero se desconoce si el tiotropio y/o el olodaterol pasa/n a la leche materna en los seres humanos.
Por lo tanto, SPIOLTO® RESPIMAT® no debe ser usado en mujeres en período de lactancia, a menos que el beneficio previsto supere todo posible riesgo para el lactante.
Fertilidad: No existen disponibles datos clínicos sobre el efecto en la fertilidad para el tiotropio ni para el olodaterol, y tampoco para la combinación de estos dos componentes. Los estudios preclínicos realizados con los componentes tiotropio y olodaterol, cada uno por separado, no reveló indicio alguno de efectos adversos sobre la fertilidad (véase la sección Toxicología).
PROPIEDADES FARMACOLÓGICAS: Grupo farmacoterapéutico: Fármacos para las enfermedades obstructivas de las vías aéreas, adrenérgicos en combinación con anticolinérgicos
Código ATC: RO3AL06
• Modo de acción:
El tiotropio, un antagonista muscarínico de acción prolongada, y olodaterol, un agonista beta2 adrenérgico de acción prolongada, se administran en forma conjunta en el inhalador de neblina aerosolizada suave SPIOLTO® RESPIMAT®. Estos dos principios activos confieren un efecto sumatorio de broncodilatación al producto, gracias a sus diferentes modos de acción y la diferente localización anatómica de los receptores pulmonares sobre los que actúan.
Tiotropio: El bromuro de tiotropio es un antagonista de los receptores muscarínicos de acción prolongada (LAMA, por su sigla en inglés), a menudo conocido en la práctica clínica con el nombre de anticolinérgico. Tiene una afinidad similar por los subtipos de receptores muscarínicos M1 a M5. En las vías aéreas, la inhibición de los receptores M3 en la musculatura lisa produce su relajación. La índole competitiva y reversible del antagonismo quedó demostrada en receptores de origen humano y animal y en preparados aislados de órganos. En estudios preclínicos in vitro e in vivo se observó que los efectos broncoprotectores eran dependientes de la dosis y duraban más de 24 horas. La prolongada duración del efecto probablemente se deba a que la disociación del tiotropio de los receptores M3 es muy lenta, con una vida media de disociación significativamente más prolongada que la observada en el caso del ipratropio. Por ser un anticolinérgico N-cuaternario, el tiotropio es tópicamente (bronco-) selectivo cuando se lo administra mediante inhalación y presenta un rango terapéutico aceptable antes de dar lugar a efectos anticolinérgicos sistémicos. La disociación de los receptores M2 es más rápida que de los receptores M3, lo cual, en los estudios in vitro funcionales, se tradujo en una selectividad (controlada cinéticamente) por el subtipo de receptores M3 mayor que por aquellos de tipo M2.
La elevada potencia y la lenta disociación de los receptores tuvieron como correlato clínico una broncodilatación significativa y prolongada en los pacientes con EPOC.
La broncodilatación que se produce tras la inhalación del tiotropio es primordialmente un efecto localizado (sobre las vías aéreas), y no un efecto sistémico.
Olodaterol: Olodaterol posee un alto grado de afinidad y un alto grado de selectividad por los adrenorreceptores beta2 humanos. Los estudios in vitro han demostrado que olodaterol ejerce sobre los adrenorreceptores beta2 una actividad agonista que es 241 veces mayor que la que ejerce sobre los adrenorreceptores beta1 y una actividad agonista que es 2299 mayor en comparación con la ejercida sobre los adrenorreceptores beta3. El compuesto ejerce sus efectos farmacológicos mediante la unión a los adrenorreceptores beta2, y su consiguiente activación, tras la administración tópica mediante inhalación.
La activación de estos receptores en las vías aéreas conduce a una estimulación de la adenilciclasa intracelular, una enzima que participa como mediadora en la síntesis de la adenosina 3’,5’-monofosfato cíclica (cAMP). Los niveles elevados de cAMP inducen la broncodilatación mediante la relajación de las células de la musculatura lisa de las vías aéreas. Olodaterol tiene el perfil preclínico de un agonista selectivo de los adrenorreceptores beta2 de acción prolongada, con un inicio de acción rápido y una duración de acción de 24 horas como mínimo.
Los adrenorreceptores beta se dividen en tres subtipos: los adrenorreceptores beta1 se expresan predominantemente sobre la musculatura cardíaca, los adrenorreceptores beta2 se expresan predominantemente en la musculatura lisa de las vías respiratorias y los adrenorreceptores beta3 se expresan predominantemente en el tejido adiposo. Los beta2 agonistas provocan broncodilatación. Si bien el adrenorreceptor beta2 es el tipo de receptor adrenérgico predominante en la musculatura lisa de las vías aéreas, también está presente en la superficie de varias otras células, incluidas las células epiteliales y las células endoteliales, y en el corazón. No se sabe con exactitud cuál es la función de los receptores beta2 en el corazón, pero su presencia plantea la posibilidad de que hasta los agonistas beta2 adrenérgicos altamente selectivos puedan tener efectos cardíacos.
• Estudios clínicos:
— Efectos sobre la electrofisiología cardíaca:
Tiotropio: El efecto del tiotropio (polvo inhalable, 18 y 54 microgramos una vez al día) sobre el intervalo QT/QTc del ECG se investigó en 56 voluntarios sanos de sexo masculino y femenino en un estudio doble ciego, aleatorizado, comparativo con placebo y controlado con tratamiento activo (moxifloxacina). Los cambios medios respecto del nivel basal en el intervalo QT a lo largo de 5 minutos a 2 horas después de la administración el día 12 fueron -1,4 mseg para el placebo, +0,6 mseg para el tiotropio en dosis de 18 microgramos y -2,1 mseg para el tiotropio en dosis de 54 microgramos; el límite superior de los intervalos de confianza del 95 % unilaterales de la diferencia respecto del nivel basal con ajuste para el placebo fue inferior a 10 mseg para ambas dosis de tiotropio (+4,9 mseg para tiotropio en dosis de 18 microgramos, +2,2 mseg para tiotropio en dosis de 54 microgramos).
Olodaterol: El efecto de olodaterol sobre el intervalo QT/QTc del ECG se investigó en 24 voluntarios sanos de sexo masculino y femenino en un estudio doble ciego, aleatorizado, comparativo con placebo y controlado con tratamiento activo (moxifloxacina). Olodaterol en dosis únicas de 10, 20, 30 y 50 microgramos fue comparable al placebo, con cambios medios respecto del nivel basal en el intervalo QT en un lapso de 20 minutos a 2 horas luego de la administración de la dosis que se incrementaron de manera dependiente de la dosis de 1,6 mseg (10 microgramos de olodaterol) a 6,5 mseg (50 microgramos de olodaterol), con un límite superior para los intervalos de confianza del 90 % bilaterales de menos de 10 mseg en todos los niveles de dosis.
El efecto de 5 microgramos y de 10 microgramos de olodaterol sobre la frecuencia y el ritmo cardíacos se evaluó mediante un estudio electrocardiográfico continuo de 24 horas (monitoreo Holter) en un subconjunto de 772 pacientes en los estudios de Fase 3 comparativos con placebo de 48 semanas de duración. No se observó ninguna tendencia ni ningún patrón relacionados con la dosis o con el tiempo en relación con las magnitudes de los cambios medios de la frecuencia cardíaca o los latidos prematuros. Los cambios entre el nivel basal y el fin del tratamiento en los latidos prematuros no indicaron ninguna diferencia significativa entre olodaterol 5 microgramos, olodaterol 10 microgramos y el placebo.
SPIOLTO® RESPIMAT®: En dos estudios aleatorizados, doble ciego, de 52 semanas, de SPIOLTO® RESPIMAT®, en los que se reclutaron 5162 pacientes con EPOC, se realizaron evaluaciones de ECG luego de la dosis en los días 1, 85, 169 y 365. En un análisis combinado del número de sujetos con cambios respecto del intervalo QT corregido en función del nivel basal de >30 mseg usando tanto la fórmula de Bazett (QTcB) como la de Fredericia (QTcF), las correcciones del QT para la frecuencia cardíaca se ubicaron en el rango de 4,9-6,4% (QTcB) y de 3,3-4,7 % (QTcF) para el grupo de SPIOLTO® RESPIMAT®, en tanto que dichos valores fueron 5,0-6,0 % (QTcB) y 3,4-4,4 % (QTcF) para olodaterol 5 microgramos y 5,3-6,5 % (QTcB) y 3,0-4,7 % (QTcF) para tiotropio 5 microgramos en las evaluaciones realizadas.
— Datos clínicos de eficacia y seguridad:
El programa de desarrollo clínico de Fase III de SPIOLTO® RESPIMAT® incluyó tres estudios aleatorizados de diseño doble ciego:
(i) Dos estudios replicados, de grupos paralelos, de 52 semanas, en los cuales se comparó SPIOLTO® RESPIMAT® con tiotropio 5 microgramos y olodaterol 5 microgramos (1029 recibieron SPIOLTO® RESPIMAT®) [Estudios 1 y 2]
(ii) un estudio de diseño cruzado de 6 semanas en el cual se comparó SPIOLTO® RESPIMAT® con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo (139 recibieron SPIOLTO® RESPIMAT®) [Estudio 3]
En estos estudios, los productos comparadores, tiotropio 5 microgramos, olodaterol 5 microgramos y placebo, fueron administrados mediante el inhalador RESPIMAT®.
Todos los estudios incluyeron mediciones de la función pulmonar (volumen espiratorio forzado en un segundo, VEF1). En los estudios de 52 semanas, la función pulmonar se midió hasta las 3 horas posdosis (12 horas posdosis en un subconjunto de pacientes) y a las 23-24 horas posdosis; los criterios de valoración primarios de eficacia para la función pulmonar fueron el cambio respecto del valor basal previo al tratamiento (respuesta) en el AUC0-3h del VEF1 y el valor valle de VEF1 luego de 24 semanas. En el estudio de 6 semanas, la función pulmonar se midió hasta las 12 horas posdosis y a las 22-24 horas posdosis; el criterio de valoración de eficacia primario fue la respuesta en términos de AUC0-24h de VEF1 luego de 6 semanas. Los estudios de 52 semanas también incluyeron el uso del Cuestionario Respiratorio de St. George’s (St. George’s Respiratory Questionnaire, SGRQ) como criterio de valoración primario, como parámetro de medida de la calidad de vida relacionada con la salud, y el Índice de Disnea Transicional (Transition Dyspnoea Index, TDI) de Mahler como criterio de valoración secundario clave, como parámetro de medida de la disnea.
Los pacientes que se reclutaron en el programa de Fase III tenían 40 años de edad o más, un diagnóstico clínico de EPOC, antecedentes de tabaquismo de más de 10 años-paquete e insuficiencia pulmonar entre moderada y muy grave (valor de VEF1 post-broncodilatador inferior al 80 % del valor normal pronosticado (Estadío GOLD 2-4); razón VEF1 a CVF post-broncodilatador de menos del 70%).
Características de los pacientes: La mayoría de los 5162 pacientes reclutados en los estudios internacionales de 52 semanas de duración [Estudios 1 y 2] fueron sujetos de sexo masculino (73%), de raza blanca (71%) o asiática (25%), con una edad promedio de 64 años. El VEF1 post-broncodilatador medio fue 1,37 L (GOLD 2 [50 %], GOLD 3 [39 %] y GOLD 4 [11 %]). La respuesta media a los agonistas β2 fue 16,6 % del valor basal (0,171 L). Las medicaciones pulmonares permitidas como terapia concomitante incluyeron esteroides inhalables [47 %] y xantinas [10 %].
El estudio de 6 semanas [Estudio 3] fue llevado a cabo en Europa y en América del Norte. La mayoría de los 219 pacientes reclutados fueron sujetos de sexo masculino (59 %) y de raza blanca (99 %), con una edad promedio de 61,1 años. El VEF1 post-broncodilatador medio fue 1,55 L (GOLD 2 [64 %], GOLD 3 [34 %], GOLD 4 [2 %]). La respuesta media a los agonistas β2 fue 15,9% del valor basal (0,193 L). Las medicaciones pulmonares permitidas como terapia concomitante incluyeron esteroides inhalables [41 %] y xantinas [4 %].
Función pulmonar: En los estudios de 52 semanas, SPIOLTO® RESPIMAT®, administrado una vez al día por la mañana, brindó una clara mejoría en la función pulmonar dentro de los 5 minutos posteriores a la primera dosis, en comparación con tiotropio 5 microgramos (aumento medio del VEF1 de 0,137 L para SPIOLTO® RESPIMAT® frente a 0,058 L para tiotropio 5 microgramos [p < 0,0001] y 0,125 L para olodaterol 5 microgramos [p = 0,16]). En los dos estudios se observaron mejorías significativas en la respuesta de AUC0-3h de VEF1 y en la respuesta de valor valle de VEF1 al cabo de 24 semanas (criterios de valoración primarios de función pulmonar) para SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos (Tabla 1).
|
Tabla 1. Diferencia en respuesta de AUC0-3h de VEF1 y respuesta de valor valle de VEF1 para SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos al cabo de 24 semanas (Estudios 1 y 2) |
||||||||
|
Respuesta de AUC0-3h de VEF1 |
Respuesta de VEF1 valle |
|||||||
|
Estudio 1 |
Estudio 2 |
Estudio 1 |
Estudio 2 |
|||||
|
n |
Media |
n |
Media |
n |
Media |
n |
Media |
|
|
SPIOLTO® RESPIMAT® versus |
522 |
-- |
502 |
-- |
521 |
-- |
497 |
-- |
|
Tiotropio 5 microgramos |
526 |
0,117 L |
500 |
0,103 L |
520 |
0,071 L |
498 |
0,050 L |
|
Olodaterol 5 microgramos |
525 |
0,123 L |
507 |
0,132 L |
519 |
0,082 L |
503 |
0,088 L |
|
Valor basal de VEF1 previo al tratamiento: Estudio 1 = 1,16 L; Estudio 2 = 1,15 L p ≤ 0,0001 para todas las comparaciones |
||||||||
Los mayores efectos broncodilatadores observados con SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos se mantuvieron a lo largo de todo el período de tratamiento de 52 semanas. SPIOLTO® RESPIMAT® también mejoró los valores matutinos y vespertinos de la tasa de flujo espiratorio máximo (peak expiratory flow rate, PEFR) en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos, según lo determinado sobre la base de los registros diarios de los pacientes.
En el subconjunto de pacientes que completaron las mediciones de función pulmonar extendidas hasta las 12 horas posdosis, SPIOLTO® RESPIMAT® evidenció una respuesta de VEF1 significativamente mayor en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos a lo largo de todo el intervalo de dosis de 24 horas (Figura 1, Tabla 2).
Figura 1. Perfil de VEF1 para SPIOLTO® RESPIMAT®, tiotropio 5 microgramos y olodaterol 5 microgramos a lo largo de un intervalo de dosis ininterrumpido de 24 horas al cabo de 24 semanas (subconjunto de función pulmonar de 12 horas de los Estudios 1 y 2; conjunto de datos combinados)
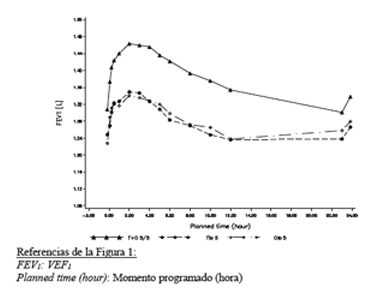
|
Tabla 2. Diferencia en VEF1 para SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos a lo largo de un intervalo de dosis ininterrumpido de 24 horas al cabo de 24 semanas (subconjunto de función pulmonar de 12 horas de los Estudios 1 y 2; conjunto de datos combinados) |
|||
|
n |
Promedio 12 horas |
Promedio 24 horas |
|
|
SPIOLTO® RESPIMAT® versus |
167 |
||
|
Tiotropio 5 microgramos |
160 |
0,123 |
0,106 |
|
Olodaterol 5 microgramos |
194 |
0,118 |
0,098 |
|
1 VEF1 basal previo al tratamiento = 1,17 L p < 0,0001 para todas las comparaciones |
|||
En el estudio de 6 semanas, SPIOLTO® RESPIMAT® evidenció una respuesta de VEF1 significativamente mayor en comparación con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo a lo largo de todo el intervalo de dosis de 24 horas (Figura 2, Tabla 3).
Figura 2. Perfil de VEF1 para SPIOLTO® RESPIMAT®, tiotropio 5 microgramos, olodaterol 5 microgramos y placebo a lo largo de un intervalo de dosis ininterrumpido de 24 horas al cabo de 6 semanas (Estudio 3)
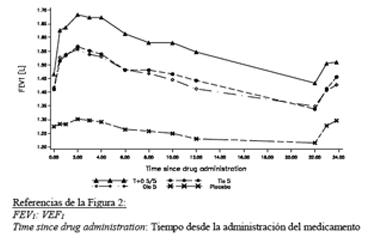
|
Tabla 3. Diferencia en VEF1 (L) para SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo a lo largo de un intervalo de dosis ininterrumpido de 24 horas al cabo de 6 semanas (Estudio 3) |
||||||
|
n |
3 horas promedio |
n |
12 horas promedio |
24 horas promedio1 |
Valle |
|
|
SPIOLTO® RESPIMAT® versus |
138 |
138 |
||||
|
Tiotropio 5 microgramos |
137 |
0,109 |
135 |
0,119 |
0,110 |
0,079 |
|
Olodaterol 5 microgramos |
138 |
0,109 |
136 |
0,126 |
0,115 |
0,092 |
|
Placebo |
135 |
0,325 |
132 |
0,319 |
0,280 |
0,207 |
|
Valor basal de VEF1 previo al tratamiento = 1,30 L 1 Criterio de valoración primario p < 0,0001 para todas las comparaciones |
||||||
Disnea: Al cabo de 24 semanas (Estudios 1 y 2), SPIOLTO® RESPIMAT® mejoró significativamente la media del puntaje focal de TDI en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos (Tabla 4). Un mayor número de pacientes tratados con SPIOLTO® RESPIMAT® tuvo una mejoría clínicamente significativa en el puntaje focal de TDI (MCID, definido como un valor de al menos 1 unidad), en comparación con tiotropio 5 microgramos (54,9 % frente a 50,6 %, p = 0,0546) y olodaterol 5 microgramos (54,9 % frente a 48,2 %, p = 0,0026).
|
Tabla 4: Puntaje focal de TDI luego de 24 semanas de tratamiento (Estudios 1 y 2) |
|||
|
n |
Media del tratamiento |
Diferencia respecto de SPIOLTO® RESPIMAT® |
|
|
Media (valor p) |
|||
|
SPIOLTO® RESPIMAT® |
992 |
1,98 |
|
|
Tiotropio 5 microgramos |
978 |
1,63 |
0,36 (p = 0,008) |
|
Olodaterol 5 microgramos |
984 |
1,56 |
0,42 (p = 0,002) |
Uso de medicación de rescate: Los pacientes tratados con SPIOLTO® RESPIMAT® tuvieron un menor uso diurno y nocturno de terapia de rescate de salbutamol en comparación con los pacientes tratados con tiotropio 5 microgramos y olodaterol 5 microgramos (Estudios 1 y 2).
Calificación general del paciente: Los pacientes tratados con SPIOLTO® RESPIMAT® percibieron una mayor mejoría en su afección respiratoria en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos, según lo medido por la escala de Calificación General del Paciente (Patient´s Global Rating, PGR) (Estudios 1 y 2).
Exacerbaciones: Ya se había demostrado anteriormente que tiotropio 5 microgramos ofrece una reducción estadísticamente significativa en el riesgo de una exacerbación de la EPOC en comparación con el placebo. El criterio de valoración de exacerbaciones de la EPOC fue incluido como un criterio de evaluación adicional en los estudios pivote de 52 semanas (Estudios 1 y 2). En el conjunto de datos combinados, la proporción de pacientes que tuvieron una exacerbación moderada/grave de la EPOC fue 27,7% para SPIOLTO® RESPIMAT® y 28,8% para tiotropio 5 microgramos.
En un estudio clínico doble ciego, aleatorizado, controlado con tratamiento activo, de grupos paralelos, de un año de duración (Estudio 9), se comparó SPIOLTO® RESPIMAT® con tiotropio 5 microgramos en relación con las exacerbaciones de la EPOC. Todos los medicamentos respiratorios, excepto los anticolinérgicos, los agonistas beta de acción prolongada y sus combinaciones, se permitieron como tratamiento concomitante, es decir, los agonistas beta de acción corta, corticosteroides inhalables y xantinas. El criterio de valoración primario fue la tasa anual de exacerbaciones de moderadas a severas de la EPOC (3939 pacientes recibieron SPIOLTO® RESPIMAT® y 3941 pacientes recibieron tiotropio 5 microgramos).
La mayoría de los pacientes fueron sujetos de sexo masculino (71,4%) y de raza blanca (79,3 %). La edad promedio fue de 66,4 años, y el VEF1 post-broncodilatador medio fue 1,187 L (SD 0,381), y 29,4 % de los pacientes tenía antecedentes de enfermedad cardiovascular clínicamente importante.
Las exacerbaciones de la EPOC fueron definidas como “un complejo de eventos/síntomas en las vías respiratorias inferiores (aumento o nuevo) relacionado con la EPOC subyacente, que dura 3 días o más, y que requiere antibióticos o esteroides sistémicos, o internación”.
El tratamiento con SPIOLTO® RESPIMAT® produjo una reducción adicional del 7 % en la tasa anual de exacerbaciones moderadas a severas de la EPOC en comparación con tiotropio 5 microgramos (Razón de tasas (RR): 0,93; Intervalo de confianza (IC) del 99 %: 0,85-1,02; p = 0,0498). El estudio estaba diseñado para alcanzar un nivel de significancia del 1%.
El tratamiento con SPIOLTO® RESPIMAT® produjo una reducción del 11% en la tasa anual de internaciones debidas a una exacerbación de la EPOC (RR 0,89; IC del 95 %: 0,76-1,03; p = 0,1265). Aparte de esto, el tratamiento con SPIOLTO® RESPIMAT® produjo una reducción del 20 % en la tasa anual de exacerbaciones moderadas a severas que requerían tratamiento con corticosteroides sistémicos (RR: 0,80; IC del 95 %: 0,68-0,94; p = 0,0068) y una reducción del 9 % en la tasa anual de exacerbaciones moderadas a severas que requerían tratamiento con corticosteroides sistémicos y antibióticos (RR: 0,91; IC del 95%: 0,83-1,00; p = 0,0447).
El tratamiento con SPIOLTO® RESPIMAT® no produjo una reducción en la tasa de exacerbaciones moderadas a severas tratadas con antibióticos solamente (RR: 1,07; IC del 95 %: 0,96-1,20; p = 0,2062).
El tiempo hasta la mortalidad por todas las causas se incluyó como criterio de valoración secundario en este estudio. No hubo una diferencia significativa en el riesgo de mortalidad por todas las causas entre SPIOLTO® RESPIMAT® y tiotropio 5 microgramos. Durante el período de tratamiento real (es decir, durante el tratamiento más un día), se observaron 36 versus 32 muertes (Razón de riesgos instantáneos (HR): 1,09; IC del 95 %: 0,67; 1,75; p = 0,7357), mientras que durante el período de estudio planificado (381 días) se observaron 107 versus 121 muertes (HR: 0,88; IC del 95 %: 0,68; 1,15; p = 0,3485) con SPIOLTO® RESPIMAT® y tiotropio 5 microgramos, respectivamente.
El análisis del estudio adicional de la exacerbación (Estudio 9) se presenta en la Tabla 5.
|
Tabla 5: Efecto de SPIOLTO® RESPIMAT® sobre las exacerbaciones (Estudio 9) |
|||||
|
Estudio (NSpiolto, Ntio 5) |
Criterios de valoración |
SPIOLTO® RESPIMAT® |
Tiotropio 5 microgramos |
Razón |
Valor p |
|
Estudio de la exacerbación, de Fase IIIb, de 1 año de duración (grupo tratado: 3939, 3941) |
Tasa anual de exacerbación de la EPOC Moderada a severa |
0,90 |
0,97 |
RR 0,93 (0,85; 1,02) IC del 99 % |
0,0498 |
|
Tiempo hasta la primera exacerbación de la EPOC Moderada a severa |
Número de pacientes con evento: 1746 |
Número de pacientes con evento: 1777 |
HR 0,95 (0,87; 1,03) IC del 99 % |
0,1188 |
|
|
Tasa anual de exacerbaciones con internación |
0,18 |
0,20 |
RR 0,89 (0,76; 1,03) IC del 95 % |
0,1265 |
|
|
Tiempo hasta la primera exacerbación de la EPOC con internación |
Número de pacientes con evento: 450 |
Número de pacientes con evento: 469 |
HR 0,93 (0,82; 1,06) IC del 95 % |
0,2773 |
|
Calidad de vida relacionada con la salud: Al cabo de 24 semanas (Estudios 1 y 2), SPIOLTO® RESPIMAT® mejoró significativamente la media del puntaje total de SGRQ en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos (Tabla 4); las mejorías se observaron en todos los dominios del SGRQ. Un mayor número de pacientes tratados con SPIOLTO® RESPIMAT® tuvo una mejoría clínicamente significativa en el puntaje total de SGRQ (MCID [minimal clinically important difference; diferencia mínima clínicamente importante], definida como una reducción de al menos 4 unidades respecto del nivel basal), en comparación con tiotropio 5 microgramos (57,5 % frente a 48,7 % , p = 0,0001) y olodaterol 5 microgramos (57,5% frente a 44,8%, p < 0,0001).
|
Tabla 6: Puntaje total del SGRQ y puntajes de los dominios al cabo de 24 semanas de tratamiento (Estudios 1 y 2) |
||||
|
n |
Media del tratamiento (cambio respecto del nivel basal) |
Diferencia respecto de SPIOLTO® RESPIMAT® |
||
|
Media (valor p) |
||||
|
Media del tratamiento (Cambio respecto del nivel basal) |
Diferencia respecto de SPIOLTO® RESPIMAT® Media (valor p) |
|||
|
Puntaje |
Nivel basal |
43,5 |
||
|
Total |
SPIOLTO® RESPIMAT® |
979 |
36,7 (-6,8) |
|
|
Tiotropio 5 microgramos |
954 |
37,9 (-5,6) |
-1,23 (p=0,025) |
|
|
Olodaterol 5 microgramos |
954 |
38,4 (-5,1) |
-1,69 (p=0,002) |
|
|
Síntomas |
Nivel basal |
51,9 |
||
|
SPIOLTO® RESPIMAT® |
982 |
42,6 |
||
|
Tiotropio 5 microgramos |
957 |
45,5 |
-2,94 (p=0,0008) |
|
|
Olodaterol 5 microgramos |
958 |
45,0 |
-2,48 (p=0,0046) |
|
|
Actividades |
Nivel basal |
58,0 |
||
|
SPIOLTO® RESPIMAT® |
981 |
51,9 |
||
|
Tiotropio 5 microgramos |
959 |
53,2 |
-1,34 (p=0,052) |
|
|
Olodaterol 5 microgramos |
958 |
54,0 |
-2,11 (p=0,002) |
|
|
Impacto |
Nivel basal |
32,6 |
||
|
SPIOLTO® RESPIMAT® |
983 |
26,1 |
||
|
Tiotropio 5 microgramos |
960 |
26,8 |
-0,67 (p=0,283) |
|
|
Olodaterol 5 microgramos |
959 |
27,2 |
-1,11 (p=0,075) |
|
En otros dos estudios clínicos, comparativos con placebo, de 12 semanas de duración (Estudios 7 y 8), el puntaje total del SGRQ a la semana 12 también se incluyó como criterio de valoración primario, como una medida de la calidad de vida relacionada con la salud.
En los estudios de 12 semanas, SPIOLTO® RESPIMAT® mostró una mejoría en comparación con placebo en la semana 12, en el puntaje total medio del SGRQ (criterio de valoración primario) de -4,9 (IC del 95 %: -6,9, -2,9; p<0,0001) y -4,6 (IC del 95%: -6,5, -2,6; p<0,0001). En un análisis de datos combinados de los estudios de 12 semanas, la proporción de pacientes con una disminución clínicamente significativa en el puntaje total del SGRQ (definida como una disminución de al menos 4 unidades respecto del nivel basal) en la semana 12 fue mayor para SPIOLTO® RESPIMAT® (52 %) en comparación con tiotropio 5 microgramos (41 %; cociente de probabilidades: 1,56 (IC del 95 %: 1,17, 2,07), p = 0,0022) y placebo (32 %; cociente de probabilidades: 2,35 (IC del 95%: 1,75; 3,16), p<0,0001).
En el Estudio 9, el tratamiento con SPIOLTO® RESPIMAT® mostró mejorías en el puntaje del COPD Assessment Test (CAT, una medida de la calidad de vida relacionada con la salud) frente a tiotropio 5 microgramos en todas las visitas del estudio (diferencia media ajustada frente a tiotropio de -0,7 (IC del 95 % (-1,0; -0,5)) el día 90 hasta -0,4 (IC del 95 % (-0,7; -0,1)) el día 360, todo p<0,01). En un análisis de respondedores, la proporción de pacientes que presentó mejorías clínicamente relevantes en el puntaje del CAT (definida como una reducción de 2 puntos o más) fue mayor con SPIOLTO® RESPIMAT® frente a tiotropio 5 microgramos (44,51 % vs. 40,77 % respectivamente, cociente de probabilidades: 1,17, IC del 95 % 1,06-1,28 p<0,001).
Capacidad inspiratoria, dificultad respiratoria y resistencia al ejercicio:
El efecto de SPIOLTO® RESPIMAT® sobre la capacidad inspiratoria, la dificultad respiratoria y la resistencia al ejercicio limitada por síntomas fue investigado en tres estudios aleatorizados de diseño doble ciego en pacientes con EPOC:
(I) Dos estudios replicados de diseño cruzado de 6 semanas en los cuales se comparó SPIOLTO® RESPIMAT® con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo durante una sesión de cicloergometría con carga de trabajo constante (450 recibieron SPIOLTO® RESPIMAT®) [Estudios 4 y 5]
(II) Un estudio de grupos paralelos de 12 semanas en el cual se comparó SPIOLTO® RESPIMAT® con placebo durante una sesión de cicloergometría con carga de trabajo constante (139 recibieron SPIOLTO® RESPIMAT®) y una sesión de caminata a velocidad constante (subconjunto de pacientes) [Estudio 6]
SPIOLTO® RESPIMAT® mejoró significativamente la capacidad inspiratoria en comparación con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo al cabo de 6 semanas (Estudios 4 y 5; Tabla 6) y en comparación con el placebo luego de 12 semanas (0,234 L, p < 0,0001; Estudio 6).
|
Tabla 7. Diferencia en capacidad inspiratoria (inspiratory capacity, IC) en reposo (L) para SPIOLTO® RESPIMAT® en comparación con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo luego de 6 semanas (Estudios 4 y 5) |
||||
|
n |
Estudio 41 |
N |
Estudio 52 |
|
|
SPIOLTO® RESPIMAT® versus |
219 |
218 |
||
|
Tiotropio 5 microgramos |
213 |
0,114 (p<0,0001) |
208 |
0,088 (p=0,0005) |
|
Olodaterol 5 microgramos |
214 |
0,119 (p<0,0001) |
208 |
0,080 (p=0,0015) |
|
Placebo |
211 |
0,244 (p<0,0001) |
202 |
0,265 (p<0,0001) |
|
1 Nivel basal previo al tratamiento: 2,53 L 2 Nivel basal previo al tratamiento: 2,59 L |
||||
En los Estudios 4 y 5, SPIOLTO® RESPIMAT® mejoró el tiempo de resistencia durante una sesión de cicloergometría con carga de trabajo constante en un 20,9 % y un 13,4 % en comparación con el placebo (Tabla 7). En el Estudio 6, SPIOLTO® RESPIMAT® mejoró el tiempo de resistencia durante una sesión de cicloergometría con carga de trabajo constante en un 12,6 % luego de la primera dosis (en un subconjunto de pacientes), en un 22,9 % luego de 6 semanas y en un 13,8 % luego de 12 semanas en comparación con el placebo e incrementó el tiempo de resistencia durante una sesión de caminata a velocidad constante (en un subconjunto de pacientes) en un 20,6 % luego de 6 semanas y en un 20,9 % luego de 12 semanas en comparación con el placebo (Tabla 8).
|
Tabla 8. Medias geométricas del tiempo de resistencia (segundos) durante una ergometría de cicloergometría con carga de trabajo constante para SPIOLTO® RESPIMAT® en comparación con el placebo luego de 6 semanas (Estudios 4 y 5) |
||||
|
N |
Estudio 41 |
n |
Estudio 52 |
|
|
SPIOLTO® RESPIMAT® |
212 |
454,1 |
216 |
465,7 |
|
Placebo |
209 |
375,5 |
205 |
410,8 |
|
Razón |
1,209 (p < 0,0001) |
1,134 (p < 0,0001) |
||
|
1 Nivel basal previo al tratamiento: 460,0 seg 2 Nivel basal previo al tratamiento: 434,3 seg |
||||
|
Tabla 9. Medias geométricas del tiempo de resistencia (segundos) durante una sesión de cicloergometría con carga de trabajo constante y una sesión de caminata a una velocidad constante para SPIOLTO® RESPIMAT® en comparación con el placebo después de la primera dosis y luego de 6 y 12 semanas (Estudio 6) |
||||||||
|
Cicloergometría |
Caminata |
|||||||
|
n |
Primera dosis1 |
n |
6 semanas2 |
12 semanas2,3 |
n |
6 semanas4 |
12 semanas4,5 |
|
|
SPIOLTO® RESPIMAT® |
80 |
538,8 |
135 |
525,6 |
527,5 |
59 |
376,2 |
376,4 |
|
Placebo |
77 |
478,6 |
121 |
427,7 |
463,6 |
50 |
312,0 |
311,4 |
|
Razón |
1,126 (p=0,025) |
1,229 (p=0,0002) |
1,138 (p=0,021) |
1,206 (p=0,058) |
1,209 (p=0,055) |
|||
|
1 Nivel basal previo al tratamiento: 461,5 seg 2 Nivel basal previo al tratamiento: 443,0 seg; 3 Criterio de valoración primario 4 Nivel basal previo al tratamiento: 311,2 seg; 5 Criterio de valoración secundario clave |
||||||||
En los Estudios 4 y 5, SPIOLTO® RESPIMAT® redujo la pendiente de disnea durante la sesión de cicloergometría con carga de trabajo constante en comparación con el placebo (p < 0,0005; Tabla 9).
|
Tabla 10. Pendiente de disnea (unidades Borg/seg) durante una cicloergometría con carga de trabajo constante para SPIOLTO® RESPIMAT® en comparación con el placebo luego de 6 semanas (Estudios 4 y 5) |
||||
|
n |
Estudio 41 |
n |
Estudio 52 |
|
|
SPIOLTO® RESPIMAT® |
212 |
0,016 |
216 |
0,015 |
|
Placebo |
209 |
0,018 |
205 |
0,018 |
|
Diferencia |
-0,003 (p=0,0004) |
-0,003 (p<0,0001) |
||
|
1 Nivel basal previo al tratamiento: 0,015 unidades Borg/seg 2 Nivel basal previo al tratamiento: 0,016 unidades Borg/seg |
||||
FARMACOCINÉTICA: Cuando el tiotropio y el olodaterol se administraron en combinación por vía inhalatoria, los parámetros farmacocinéticos de cada componente fueron similares a los observados cuando cada principio activo se administró por separado.
El tiotropio y el olodaterol evidencian una farmacocinética lineal dentro del rango terapéutico [49-55]. Con la administración repetida por vía inhalatoria en un régimen de una dosis al día, el equilibrio dinámico del tiotropio se alcanza para el día 7 . El equilibrio dinámico de olodaterol se logra al cabo de 8 días tras la administración una vez al día por vía inhalatoria, y la acumulación es de hasta 1,8 veces en comparación con una dosis única.
• Absorción:
Tiotropio: Los datos de excreción urinaria obtenidos de voluntarios sanos jóvenes sugieren que aproximadamente el 33 % de la dosis inhalada mediante el inhalador RESPIMAT® llega a la circulación sistémica [24]. La biodisponibilidad absoluta de una solución administrada por vía oral fue del 2–3 % [59]. Las concentraciones plasmáticas máximas del tiotropio se observan 5-7 minutos después de la inhalación mediante el dispositivo RESPIMAT®.
Olodaterol: En los voluntarios sanos, para la biodisponibilidad absoluta de olodaterol luego de la inhalación se estimó un valor de aproximadamente 30 %, mientras que la biodisponibilidad absoluta fue inferior al 1% cuando el fármaco se administró como una solución oral. Las concentraciones plasmáticas máximas de olodaterol generalmente se alcanzan 10 a 20 minutos después de la inhalación del fármaco mediante el dispositivo RESPIMAT®.
Distribución: El tiotropio tiene un grado de unión a las proteínas plasmáticas del 72 % y presenta un volumen de distribución de 32 L/kg . Los estudios en ratas demostraron que el tiotropio no penetra la barrera hematoencefálica en un grado relevante.
El olodaterol tiene un grado de unión a las proteínas plasmáticas de aproximadamente un 60 % y presenta un volumen de distribución de 1110 L.
— Biotransformación:
Tiotropio: El grado de metabolismo es reducido. Esto se evidencia por el hecho de que el 74% de una dosis intravenosa se excreta en la orina como fármaco inalterado. El éster tiotropio experimenta una escisión no enzimática con la consecuente transformación en su componente alcohol y ácido (N-metilescopina y ácido ditienilglicólico, respectivamente), ninguno de los cuales se une a los receptores muscarínicos. Los experimentos in vitro con microsomas hepáticos humanos y hepatocitos humanos sugieren que otra fracción del fármaco (<20% de la dosis tras la administración intravenosa) es metabolizada por un proceso de oxidación dependiente de la vía del citocromo P450 (CYP) 2D6 y 3A4 y posterior conjugación con glutatión con la consecuente formación de diversos metabolitos de fase II.
El olodaterol es metabolizado principalmente por glucuronidación directa y por O-desmetilación en la fracción metoxi, seguidas de conjugación. De los seis metabolitos identificados, sólo el producto de desmetilación no conjugado (SOM 1522) se une a los receptores ß2; este metabolito, sin embargo, no es detectable en el plasma tras la inhalación crónica de la dosis terapéutica recomendada o bien de dosis hasta 4 veces más altas que la dosis terapéutica recomendada. Las isoenzimas CYP2C9 y CYP2C8 del citocromo P450, con una contribución insignificante de CYP3A4, están involucradas en la O-desmetilación de olodaterol, mientras que, según se ha comprobado, las isoformas uridina difosfato glucosil transferasas UGT2B7, UGT1A1, 1A7 y 1A9 están involucradas en la formación de los conjugados glucurónidos del olodaterol.
— Eliminación:
Tiotropio: Cuando se administra por vía intravenosa, el tiotropio se excreta mayormente inalterado en la orina (74 %). La depuración total en los voluntarios sanos es 880 ml/min. Tras la inhalación en pacientes con EPOC hasta alcanzar el equilibrio dinámico, la excreción urinaria es del 18,6 % de la dosis; el resto del fármaco básicamente no experimenta absorción a nivel intestinal y se elimina a través de las heces. La depuración renal del tiotropio es superior a la tasa de filtración glomerular, lo cual indica una excreción activa en la orina. La vida media efectiva del tiotropio tras la inhalación en pacientes con EPOC se ubica en el rango de 27 a 45 horas.
Olodaterol: La depuración total del olodaterol en los voluntarios sanos es 872 ml/min, y la depuración renal es 173 ml/min. La vida media terminal tras la administración intravenosa es de 22 horas. En contraste, la vida media terminal luego de la inhalación es de aproximadamente 45 horas, lo cual indica que este último parámetro está determinado por la absorción más que por los procesos de eliminación.
Luego de la administración intravenosa de olodaterol radiomarcado con [14C], el 38% de la dosis radioactiva se recuperó en la orina y el 53% se recuperó en las heces. La cantidad de olodaterol inalterado que se recuperó en la orina tras la administración intravenosa fue del 19 %. Luego de la administración por vía oral, sólo el 9 % de la radioactividad se recuperó en la orina, mientras que la mayor parte se recuperó en las heces (84 %). Más del 90 % de la dosis se excretó dentro de los 6 días y los 5 días subsiguientes a la administración por vía intravenosa y oral, respectivamente. Tras la inhalación, la excreción de olodaterol inalterado en la orina dentro del intervalo de dosis en los sujetos voluntarios en equilibrio dinámico representó el 5-7 % de la dosis.
— Características en los pacientes:
Tiotropio: Tal como es de esperar con todos los fármacos cuya excreción se produce predominantemente por vía renal, el incremento de la edad estuvo asociado con una disminución de la depuración renal del tiotropio de 347 ml/min, en los pacientes con EPOC <65 años de edad, a 275 ml/min, en los pacientes con EPOC ≥65 años de edad. Esto no se tradujo en un consecuente incremento de los valores de AUC0-6,ss ni de Cmáx,ss.
Olodaterol: Un metaanálisis de farmacocinética realizado en base a datos de 2 estudios clínicos controlados que incluyeron 405 pacientes con EPOC y 296 pacientes con asma [76] indicó que no es necesario ningún ajuste de la dosis en función de los efectos de la edad, el sexo o el peso corporal sobre la exposición sistémica a olodaterol.
La comparación de los datos de farmacocinética dentro de un mismo estudio y entre los diversos estudios realizados con olodaterol reveló una tendencia hacia una mayor exposición sistémica en los japoneses y otros asiáticos que en los caucásicos.
No se ha identificado ninguna inquietud en torno a la seguridad del fármaco en estudios clínicos con olodaterol en caucásicos y asiáticos de hasta un año de duración realizados con dosis de olodaterol de hasta el doble de la dosis terapéutica recomendada.
— Insuficiencia renal:
Tiotropio: Tras la administración de tiotropio en un régimen de una dosis diaria mediante inhalación hasta alcanzar el equilibrio dinámico en pacientes con EPOC, en presencia de un deterioro leve de la función renal (CLCR 50-80 ml/min), se observaron valores ligeramente más altos de AUC0-6,ss (entre 1,8 % y 30 % más altos) y valores de Cmáx,ss similares en comparación con los pacientes con función renal normal (ClCR >80 ml/min). En sujetos con insuficiencia renal moderada a grave (CLCR <50 ml/min), la administración por vía intravenosa de tiotropio se tradujo en una exposición total dos veces más alta (AUC0-4h un 82 % más alto y Cmáx un 52 % más alto ) en comparación con los sujetos con función renal normal, lo cual fue confirmado por observaciones realizadas tras la inhalación del polvo seco.
Olodaterol: En los sujetos con insuficiencia renal grave (CLCR <30 ml/min), la exposición sistémica al olodaterol se vio incrementada a razón de un promedio de 1,4 veces. La magnitud del incremento de la exposición no plantea ninguna inquietud en torno a la seguridad en vista de la experiencia que existe en relación con el tratamiento con olodaterol en estudios clínicos durante un lapso de hasta un año en dosis hasta dos veces más altas que la dosis terapéutica recomendada.
— Insuficiencia hepática:
Tiotropio: No se prevé que la insuficiencia hepática tenga ninguna incidencia importante sobre la farmacocinética del tiotropio. El tiotropio se depura predominantemente por eliminación renal (un 74 % en los voluntarios jóvenes sanos) y mediante escisión simple no enzimática del éster con consiguiente formación de productos farmacológicamente inactivos.
Olodaterol: La exposición sistémica a olodaterol no resultó afectada en los sujetos con insuficiencia hepática leve y moderada. El efecto de la insuficiencia hepática grave sobre la exposición sistémica al olodaterol no ha sido investigado.
— Interacciones medicamentosas:
Olodaterol: Los estudios de interacciones medicamentosas fueron llevados a cabo utilizando fluconazol como inhibidor modelo de la CYP 2C9 y utilizando ketoconazol como un inhibidor potente de la P-gp y la CYP.
Fluconazol: La coadministración de 400 mg de fluconazol una vez al día durante 14 días no ejerció ningún efecto relevante sobre la exposición sistémica al olodaterol.
Ketoconazol: La coadministración de 400 mg de ketoconazol una vez al día durante 14 días incrementó la Cmáx y el AUC01 de olodaterol en un 66% y un 68%, respectivamente.
CONTRAINDICACIONES: El uso de SPIOLTO® RESPIMAT® está contraindicado en los pacientes con hipersensibilidad al tiotropio o al olodaterol o a cualquiera de los excipientes del producto.
SPIOLTO® RESPIMAT® también está contraindicado en pacientes con antecedentes de hipersensibilidad a la atropina o sus derivados, p. ej., ipratropio u oxitropio.
EFECTOS SECUNDARIOS: El programa de desarrollo clínico de SPIOLTO® RESPIMAT® incluyó más de 19 000 pacientes con EPOC, de los cuales, más de 5900 pacientes con EPOC recibieron una dosis de 5 microgramos de tiotropio y 5 microgramos de olodaterol.
Los efectos secundarios de SPIOLTO® RESPIMAT® se identificaron principalmente a partir de datos obtenidos en 2 estudios clínicos, controlados con tratamiento activo, de grupos paralelos, de tratamiento prolongado (52 semanas) en pacientes con EPOC en los que se comparó SPIOLTO® RESPIMAT® con tiotropio y olodaterol. Además, se realizó un tercer estudio clínico, controlado con tratamiento activo, de grupos paralelos, de tratamiento prolongado (52 semanas) en pacientes con EPOC en el que se comparó SPIOLTO® RESPIMAT® con tiotropio (Estudio 9).
En los dos estudios pivotales (Estudios 1 y 2) la incidencia general de eventos adversos en los pacientes tratados con SPIOLTO® RESPIMAT® fue comparable a la observada en los pacientes tratados con el componente individual olodaterol en una dosis de 5 microgramos (74 %, 76,6 %, respectivamente). En el análisis de datos combinados de los tres estudios clínicos a largo plazo (Estudio 1, 2 y Estudio 9), la incidencia general de eventos adversos en los pacientes tratados con SPIOLTO® RESPIMAT® fue comparable a la observada en los pacientes tratados con el componente individual tiotropio en una dosis de 5 microgramos (74,1 % y 74,3 %, respectivamente). Todos los efectos indeseables previamente informados con uno de los componentes individuales se consideran efectos indeseables de SPIOLTO® RESPIMAT® y se incluyen en el listado de reacciones adversas que se brinda a continuación. En el Estudio 9, en el que participaron más de 3900 pacientes con EPOC tratados con SPIOLTO® RESPIMAT®, no se identificaron efectos secundarios nuevos; asimismo, el perfil de seguridad coincidió con el documentado en los estudios pivotales.
También se incluyen efectos indeseables que fueron informados con SPIOLTO® RESPIMAT®, pero no así con los componentes individuales.
Infecciones e infestaciones: Nasofaringitis.
Trastornos del metabolismo y la nutrición: Deshidratación.
Trastornos del sistema nervioso: Mareos, Insomnio.
Trastornos oculares: Glaucoma, aumento de la presión intraocular, visión borrosa.
Trastornos cardíacos: Fibrilación auricular, palpitaciones, taquicardia supraventricular, taquicardia.
Trastornos vasculares: Hipertensión.
Trastornos respiratorios, torácicos y mediastínicos: Tos, epístaxis, faringitis, disfonía, broncoespasmo, laringitis, sinusitis.
Trastornos gastrointestinales: Boca seca, usualmente de intensidad leve. Estreñimiento, candidiasis orofaríngea, disfagia, enfermedad de reflujo gastroesofágico, gingivitis, glositis, estomatitis, obstrucción intestinal, incluyendo íleo paralítico.
Trastornos de la piel y del tejido subcutáneo: Exantema, prurito, edema angioneurótico, urticaria, infección de piel y úlcera de piel, piel seca, hipersensibilidad (incluyendo reacciones inmediatas).
Trastornos musculoesqueléticos y del tejido conectivo: Artralgia, Inflamación de articulaciones, Dolor de espalda1
Trastornos renales y urinarios: Retención urinaria (usualmente en hombres con factores predisponentes), disuria, infección de las vías urinarias.
1 Efectos indeseados informados con SPIOLTO® RESPIMAT®, pero no así con los componentes individuales.
Muchos de los efectos indeseables citados pueden ser atribuidos ya sea a las propiedades anticolinérgicas del tiotropio o bien a las propiedades ß-adrenérgicas del olodaterol, los componentes de SPIOLTO® RESPIMAT®.
Asimismo, debe tomarse en consideración la ocurrencia de otros efectos indeseables relacionados con la clase de los agonistas beta-adrenérgicos, los cuales no están incluidos en el listado anterior, tales como arritmia, isquemia de miocardio, angina de pecho, hipotensión, temblores, cefalea, nerviosismo, náuseas, espasmos musculares, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
CONDUCCIÓN DE VEHÍCULOS Y USO DE MAQUINARIA: No se han realizado estudios en torno a los efectos de este producto sobre la capacidad para conducir vehículos y operar maquinaria.
No obstante ello, debe advertirse a los pacientes que se han informado mareos y visión borrosa con el uso de SPIOLTO® RESPIMAT®. Por lo tanto, se debe recomendar a los pacientes que deben tener precaución al conducir vehículos u operar maquinaria. Si los pacientes tuvieran dichos síntomas, deberán evitar tareas potencialmente peligrosas como conducir vehículos u operar maquinaria.
INTERACCIONES: Si bien no se han realizado estudios formales de interacciones medicamentosas, el bromuro de tiotropio se ha usado en forma concomitante con otros medicamentos que se prescriben comúnmente para el tratamiento de la EPOC, incluyendo metilxantinas y esteroides orales e inhalables, sin que se observara evidencia clínica de interacciones medicamentosas.
La coadministración crónica de bromuro de tiotropio con otros fármacos anticolinérgicos no ha sido estudiada. Por lo tanto, se desaconseja la coadministración crónica de otros anticolinérgicos junto con SPIOLTO® RESPIMAT®.
Agentes adrenérgicos: La administración concomitante de otros adrenérgicos puede potenciar los efectos indeseables de SPIOLTO® RESPIMAT®.
Derivados xantínicos, esteroides o diuréticos: El tratamiento concomitante con derivados xantínicos, esteroides o diuréticos no ahorradores de potasio puede potenciar el efecto hipopotasémico de los agonistas adrenérgicos (véase Advertencias y precauciones especiales).
Betabloqueantes: Los bloqueantes beta adrenérgicos pueden debilitar o antagonizar el efecto del olodaterol. Debe considerarse el uso de beta bloqueantes cardioselectivos, aunque deben administrarse con precaución.
Inhibidores de la MAO, antidepresivos tricíclicos y fármacos que prolongan el QTc: Los inhibidores de la monoamino oxidasa, los antidepresivos tricíclicos u otros fármacos con un efecto conocido de prolongación del intervalo QTc pueden potenciar la acción de SPIOLTO® RESPIMAT® sobre el sistema cardiovascular.
Interacciones medicamentosas farmacocinéticas: En un estudio de interacción con fármacos realizado con olodaterol en el cual se utilizó el inhibidor potente dual de CYP y P-gp ketoconazol, se observó un incremento de 1,7 veces en la exposición sistémica (véase la sección Farmacocinética). No se identificó ninguna inquietud en torno a la seguridad del fármaco en estudios clínicos de hasta un año de duración realizados con olodaterol en dosis de hasta el doble de la dosis terapéutica recomendada. No es necesario ningún ajuste de la dosis para el uso de SPIOLTO® RESPIMAT®.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Advertencias generales: SPIOLTO® RESPIMAT® no debe usarse con una frecuencia mayor a una vez al día.
Asma: SPIOLTO® RESPIMAT® no debe utilizarse en los cuadros de asma. La eficacia y la seguridad de SPIOLTO® RESPIMAT® en el asma no han sido estudiadas.
Aumento del riesgo de exacerbaciones severas y de muerte, relacionado con su consumo, como monoterapia en el tratamiento del asma.
El uso de un LABA solo, sin el uso de un medicamento para el control del asma a largo plazo, tal como un corticosteroide inhalado, está contraindicado en el tratamiento del asma.
Broncoespasmo agudo: SPIOLTO® RESPIMAT® no está indicado para el tratamiento de los episodios agudos de broncoespasmo, es decir, como terapia de rescate.
Hipersensibilidad: Al igual que con todos los medicamentos, existe la posibilidad de que se produzcan reacciones de hipersensibilidad inmediatas tras la administración de SPIOLTO® RESPIMAT®.
Broncoespasmo paradojal: Tal como sucede también con otros medicamentos inhalables, existe la posibilidad de que SPIOLTO® RESPIMAT® provoque un broncoespasmo paradojal, cuadro éste que puede ser potencialmente fatal. En el caso de producirse un broncoespasmo paradojal, debe suspenderse de inmediato el uso de SPIOLTO® RESPIMAT® y debe utilizarse otra terapia en su reemplazo.
Glaucoma de ángulo estrecho, hiperplasia de próstata u obstrucción del cuello de la vejiga urinaria: En concordancia con lo que es de esperar en vista de la actividad anticolinérgica que posee el tiotropio, SPIOLTO® RESPIMAT® debe ser utilizado con precaución en pacientes con glaucoma de ángulo estrecho, hiperplasia de próstata u obstrucción del cuello de la vejiga urinaria.
Pacientes con insuficiencia renal: Por ser el tiotropio un fármaco cuya principal vía de excreción es la renal, SPIOLTO® RESPIMAT® debe ser utilizado con un estrecho monitoreo del paciente en los casos de insuficiencia renal moderada a grave (depuración de creatinina de < 50 ml/min) [5-7] (véase la sección Posología y administración).
Síntomas oculares: Se deberá indicar a los pacientes la forma correcta de administrar SPIOLTO® RESPIMAT®. Debe tenerse la precaución de evitar que la solución o la vaporización entre en contacto con los ojos. La presencia de dolor o molestia ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con enrojecimiento ocular por congestión de la conjuntiva y edema de córnea pueden ser signos de glaucoma de ángulo estrecho agudo. Si se presentara alguna combinación de estos síntomas, se deberá consultar de inmediato a un especialista.
* Los colirios mióticos no son considerados un tratamiento efectivo.
Efectos sistémicos: SPIOLTO® RESPIMAT® contiene un agonista beta2 adrenérgico de acción prolongada. Los agonistas beta2 adrenérgicos de acción prolongada deben ser administrados con precaución en los pacientes con trastornos cardiovasculares, especialmente en casos de insuficiencia coronaria, arritmias cardíacas, cardiomiopatía obstructiva hipertrófica e hipertensión; en los pacientes con trastornos convulsivos o tirotoxicosis, en los pacientes con prolongación conocida o sospechada del intervalo QT; y en los pacientes que en general no responden a las aminas simpatomiméticas.
Efectos cardiovasculares: Al igual que otros agonistas beta2 adrenérgicos, olodaterol puede producir un efecto cardiovascular clínicamente significativo en algunos pacientes, según lo medido por incrementos en el pulso, la presión arterial y/o los síntomas. De producirse dichos efectos, puede ser necesario suspender el tratamiento. Asimismo, se han informado cambios electrocardiográficos (ECG) como consecuencia de los agonistas beta-adrenérgicos, como aplanamiento de la onda T y depresión del segmento ST, si bien se desconoce la significancia clínica de estas observaciones.
Hipopotasemia: Los agonistas beta2 adrenérgicos pueden producir grados significativos de hipopotasemia en algunos pacientes, cuadro éste que tiene el potencial de provocar efectos cardiovasculares adversos. El descenso provocado en los niveles séricos de potasio es usualmente transitorio y no requiere de suplementación. En los pacientes con EPOC grave, la hipopotasemia puede verse potenciada por la hipoxia y por el tratamiento concomitante (véase la sección Interacciones), lo cual puede incrementar la susceptibilidad a las arritmias cardíacas.
Hiperglucemia: La inhalación de dosis elevadas de agonistas beta2 adrenérgicos puede producir incrementos en los niveles plasmáticos de glucosa. SPIOLTO® RESPIMAT® no debe utilizarse en forma conjunta con otros medicamentos que contengan agonistas beta2 adrenérgicos de acción prolongada. A los pacientes que hayan estado recibiendo agonistas beta2 adrenérgicos de acción breve inhalables en forma regular (p. ej., cuatro veces al día) debe indicárseles que los usen únicamente para el alivio sintomático de los síntomas respiratorios agudos.
POSOLOGÍA Y ADMINISTRACIÓN: La dosis recomendada para los adultos es 5 microgramos de tiotropio y 5 microgramos de olodaterol administrada como dos aplicaciones (puffs) del inhalador Respimat una vez al día a la misma hora del día (ver Modo de empleo).
MODO DE EMPLEO:
Introducción: SPIOLTO® RESPIMAT® (bromuro de tiotropio y olodaterol). Lea estas instrucciones de uso antes de empezar a usar SPIOLTO® RESPIMAT®.
Debe usar este inhalador solo UNA VEZ AL DÍA. Cada vez que lo utilice, realice DOS APLICACIONES.
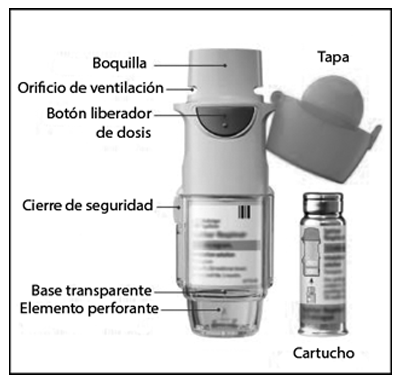
• Cuidado del SPIOLTO® RESPIMAT®
— Limpie la boquilla, incluida la parte metálica de su interior, solamente con un paño o papel tisú húmedo, al menos una vez a la semana.
— Las decoloraciones mínimas de la boquilla no afectan el rendimiento del inhalador SPIOLTO® RESPIMAT®.
• Cuándo renovar el SPIOLTO® RESPIMAT®

— Asumiendo que se utiliza del modo indicado (dos aplicaciones/una vez al día), el inhalador SPIOLTO® RESPIMAT® contiene 60 aplicaciones (30 dosis).
— El indicador de dosis muestra la cantidad aproximada de medicamento que queda.
— Cuando el indicador entra en la zona roja de la escala, es necesario obtener una nueva receta porque queda medicamento suficiente para 7 días (14 aplicaciones) aproximadamente.
— Una vez que el indicador llegue al final de la escala roja, el inhalador SPIOLTO® RESPIMAT® se trabará automáticamente y no se podrá aplicar ninguna dosis más. Llegado ese momento, no se podrá volver a girar la base transparente.
— Tres meses después del primer uso, se debe desechar el SPIOLTO® RESPIMAT®, aunque no se haya utilizado.
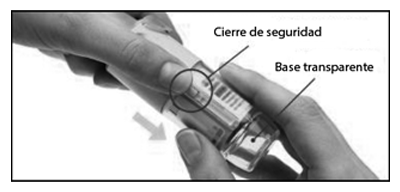
• Preparación para el primer uso:
1. Retirar la base transparente
— Mantenga la tapa cerrada.
— Presione el cierre de seguridad con firmeza mientras retira la base transparente con la otra mano.
2. Insertar el cartucho
— Inserte el extremo más estrecho del cartucho en el inhalador.
— Coloque el inhalador sobre una superficie firme y empuje con firmeza hasta que encastre en su lugar.
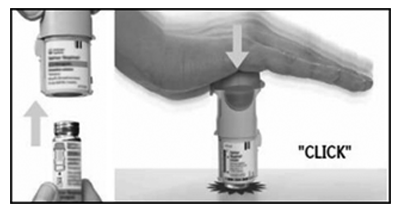
3. Volver a colocar la base transparente
— Coloque la base transparente en su lugar; tiene que hacer clic.
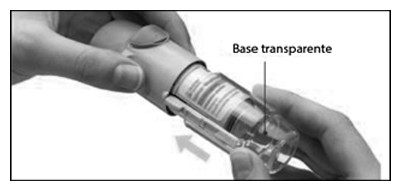
4. Girar la base
— Mantenga la tapa cerrada.
— Gire la base transparente en el sentido de las flechas de la etiqueta hasta que haga clic (media vuelta).

5. Abrir
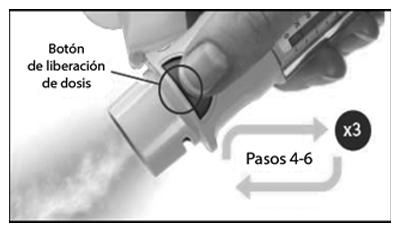
— Saque la tapa hasta que salga por completo.

6. Presionar
— Apunte el inhalador hacia el suelo.
— Presione el botón de liberación de dosis.
— Ponga la tapa.
— Repita los pasos 4 a 6 hasta que se forme una nube visible.
— Una vez que se forme una nube visible, repita los pasos 4 a 6 tres veces más.
• Uso diario:
— Girar la base:
- Mantenga la tapa puesta.
- GIRE la base transparente en el sentido de las flechas de la etiqueta hasta que haga clic (media vuelta).

— Abra
- SAQUE la tapa hasta que salga por completo.
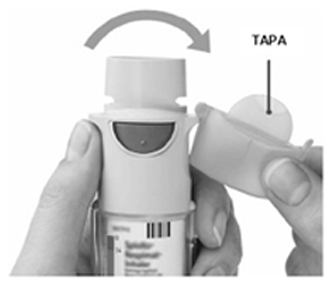
— Presionar
- Exhale lentamente todo el aire de los pulmones.
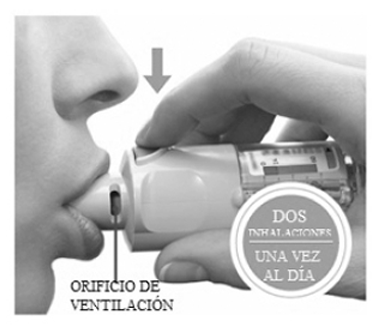
- Coloque los labios alrededor de la boquilla sin cubrir los orificios de ventilación.
- Inhalando lenta y profundamente por la boca, PRESIONE el botón de liberación de dosis y continúe inhalando.
- Contenga la respiración unos 10 segundos o hasta que empiece a sentir dificultades.
- Repita los pasos “girar la base”, “abrir” y “presionar” hasta completar 2 aplicaciones.
POBLACIONES ESPECIALES:
Pacientes de edad avanzada: Los pacientes de edad avanzada pueden usar SPIOLTO® RESPIMAT® en la dosis recomendada.
Insuficiencia hepática e insuficiencia renal: SPIOLTO® RESPIMAT® contiene tiotropio, que es un fármaco cuya principal vía de excreción es la renal, y olodaterol, que es primordialmente metabolizado en el hígado.
Insuficiencia hepática: Los pacientes con insuficiencia hepática leve o moderada pueden usar SPIOLTO® RESPIMAT® en la dosis recomendada.
No existen datos disponibles para el uso de olodaterol en pacientes con insuficiencia hepática grave.
Insuficiencia renal: Los pacientes con insuficiencia renal pueden usar SPIOLTO® RESPIMAT® en la dosis recomendada.
SPIOLTO® RESPIMAT® contiene tiotropio, que es un fármaco que se excreta principalmente por la vía renal. Por lo tanto, se deberá efectuar un estrecho control del uso de SPIOLTO® RESPIMAT® en los pacientes con insuficiencia renal moderada a grave.
Población pediátrica: No hay ningún uso relevante de SPIOLTO® RESPIMAT® en la población pediátrica en la indicación de EPOC. La seguridad y la eficacia de SPIOLTO® RESPIMAT® en la población pediátrica no han sido determinadas.
SOBREDOSIS: Síntomas: Las dosis altas de tiotropio pueden provocar la aparición de signos y síntomas anticolinérgicos.
No se observaron efectos adversos relevantes, excepto sequedad de la boca/garganta y sequedad de la mucosa nasal, cuya incidencia fue dependiente de la dosis [10-40 μg diarios], luego de la administración durante 14 días de dosis de hasta 40 μg de solución inhalable de tiotropio en voluntarios sanos, a excepción de una pronunciada reducción de la salivación desde el día 7 en adelante. No se ha observado ningún efecto indeseado significativo en seis estudios a largo plazo realizados en pacientes con EPOC tratados con una dosis diaria de 10 μg de solución inhalable de tiotropio durante 4 a 48 semanas.
Una sobredosis de olodaterol probablemente provocará manifestaciones exageradas de los efectos típicos de los agonistas beta2 adrenérgicos, es decir, isquemia de miocardio, hipertensión o hipotensión, taquicardia, arritmias, palpitaciones, mareos, nerviosismo, insomnio, ansiedad, cefalea, temblores, boca seca, espasmos musculares, náuseas, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
Tratamiento: Debe suspenderse el tratamiento con SPIOLTO® RESPIMAT®. En estos casos, está indicado el tratamiento de soporte y sintomático. Los casos serios requieren internación. Puede considerarse el uso de beta bloqueantes cardioselectivos, pero únicamente cuando su uso se implemente con suma precaución, ya que el uso de medicación bloqueante de los receptores beta adrenérgicos puede provocar broncoespasmos.
TOXICOLOGÍA:
• Tiotropio + Olodaterol:
Toxicidad de dosis únicas: Para la combinación de tiotropio + olodaterol se han realizado estudios de toxicidad de dosis únicas tras la administración por vía inhalatoria para tres relaciones de dosis en ratones y ratas, los cuales revelaron un nivel de toxicidad aguda bajo. En los ratones, las dosis letales aproximadas (approximate lethal doses, ALD) fueron 34,8+36,6 mg/kg para tiotropio+olodaterol en la proporción de 1:1. En las ratas, no se produjeron muertes; por lo tanto, los valores de ALD fueron >17,9+18,8 mg/kg para tiotropio/olodaterol en la proporción de 1:1.
Toxicidad de las dosis repetidas: Se llevaron a cabo estudios de toxicidad de dosis repetidas administradas por vía inhalatoria para la combinación de tiotropio+olodaterol en ratas (4 semanas) y en perros (hasta 13 semanas) con diferentes proporciones de dosis. En los estudios de 13 semanas en perros, la evolución del peso corporal, los signos clínicos, los cambios del sistema cardiovascular y de las respectivas actividades enzimáticas, así como también la patología macroscópica y microscópica, fueron los efectos característicos de los anticolinérgicos y los agonistas β2. En los estudios de toxicidad de 13 semanas realizados con la relación de dosis de 1:1 de tiotropio/olodaterol, los niveles sin efectos adversos observados (no observed adverse effect levels, NOAEL) fueron 14+16 microgramos/kg/día.
Toxicidad para la reproducción: No se han realizado estudios de toxicidad reproductiva para esta combinación.
Tiotropio: En los estudios de reproducción en conejos y ratas, sólo fue posible demostrar efectos nocivos en relación con el embarazo, el desarrollo embriofetal, el parto o el desarrollo posnatal con los niveles de dosis que implican toxicidad materna. En un estudio general de reproducción y fertilidad en ratas, no hubo ningún indicio de efectos adversos sobre la fertilidad ni sobre el desempeño de apareamiento en los animales progenitores tratados, como tampoco en su descendencia, con ninguno de los niveles de dosis.
Olodaterol: En las ratas, no se produjeron efectos teratogénicos tras la inhalación con dosis de 1054 microgramos/kg/día (>2600 veces la exposición humana (AUC(0-24h)) con la dosis de 5 microgramos). En conejas NZW embarazadas, una dosis inhalable de 2489 microgramos/kg/día (aproximadamente 7130 veces la exposición humana con 5 microgramos sobre la base del AUC(0-24)) de olodaterol evidenció la toxicidad fetal que característicamente se produce como consecuencia de la estimulación de los adrenorreceptores beta; las manifestaciones de dicha toxicidad incluyeron osificaciones irregulares, huesos cortos/curvos, apertura ocular incompleta, paladar hendido y anomalías cardiovasculares. No se produjeron efectos significativos con una dosis de 974 microgramos/kg (aproximadamente 1353 veces la dosis de 5 microgramos sobre la base del AUC(0-24h)). No se observó ningún deterioro de la fertilidad masculina o femenina ni del desarrollo embrionario temprano en las ratas con dosis inhalables de hasta 3068 microgramos/kg (valor éste aproximadamente 2332 veces más alto que la dosis de 5 mg sobre la base del AUC(0-24 h)).
No se observó ningún efecto sobre el apareamiento, la fertilidad ni la conservación de las implantaciones con vida hasta el Día 14/15/16 de gestación en las ratas del grupo F1 con dosis inhaladas de hasta 3665 microgramos/kg/día (aproximadamente 2332 veces la dosis de 5 mg sobre la base del AUC(0-24h)).
Genotoxicidad: La mutagenicidad in vitro para el tiotropio o para el olodaterol solos no indicó ningún potencial genotóxico. En la prueba de micronúcleo de médula ósea de rata in vivo, tras la inhalación en niveles de dosis de hasta 2266+2174 microgramos/kg/día de tiotropio+olodaterol durante 4 semanas (proporción de dosis de 1:1), la combinación no evidenció potencial genotóxico alguno.
Carcinogenicidad: No se han realizado estudios de carcinogenicidad para esta combinación.
Tiotropio: El tiotropio no evidenció ningún potencial carcinogénico en los respectivos estudios realizados en ratones y ratas.
Olodaterol: El tratamiento de las ratas durante su lapso vital indujo la formación de leiomiomas del mesovario específicos de la clase y de los roedores con exposiciones que fueron aproximadamente 2235 veces y 715 veces más altas que la exposición lograda con la dosis de 5 microgramos (sobre la exposición sistémica). El tratamiento de ratones durante su lapso vital indujo la formación de tumores de la musculatura lisa específicos de la clase y de los roedores (leiomiomas, leiomiosarcomas) del útero e incidencias de hiperplasia focal de estroma del cordón sexual e hiperplasia focal lútea en los ovarios con exposiciones aproximadamente 477 a 3596 veces más altas que la exposición lograda con la dosis de 5 microgramos (en la exposición sistémica), lo cual también es considerado específico de la clase y de los roedores (múltiplos de exposición). Ninguno de estos dos estudios reveló evidencia alguna de riesgos relacionados con el olodaterol para los seres humanos en lo que respecta a la carcinogenicidad o la toxicidad crónica.
En la prueba de micronúcleo de médula ósea de ratas in vivo efectuada tras la exposición por inhalación (hasta aproximadamente 1092 veces la dosis de 5 microgramos sobre la base del AUC(0-24h)) y las pruebas de mutagenicidad (prueba de Ames, prueba de linfoma de ratón) in vitro, olodaterol no evidenció ningún potencial genotóxico hasta niveles de dosis muy altos. Se observó una frecuencia incrementada de micronúcleos en las ratas tras la exposición i.v. en dosis de como mínimo 5500 veces la dosis de 5 microgramos sobre la base del AUC(0-24h), la cual podría estar relacionada con la potenciación de la eritropoyesis (compensatoria) que genera este fármaco.
• Anexo – composición del producto
SPIOLTO® * RESPIMAT® (CCDS Versión 0287-04, de fecha 27 de noviembre de 2017):
Advertencia: Solamente se mencionarán los excipientes que necesiten una advertencia.
|
PCID No. 2595115 Solución inhalable para RESPIMAT 2,5 µg/2,5 µg (1 dosis = 2 aplicaciones) |
Texto referido a la seguridad (sección “Advertencias y precauciones”) |
|
Excipientes |
|
|
Cloruro de banzalconio |
Este medicamento contiene 0,0011 mg de cloruro de benzalconio en cada aplicación. El cloruro de benzalconio puede provocar sibilancias y dificultades respiratorias (broncoespasmo), especialmente si padece de asma. |
• Anexo – frecuencias de efectos secundarios:
SPIOLTO® * RESPIMAT®
Anexo de frecuencias de efectos secundarios 0287-04se01 de fecha 27 de noviembre de 2017
• Categorías de frecuencia:
— Muy frecuente: ≥ 1/10
— Frecuente: ≥ 1/100 - < 1/10
— Poco frecuente: ≥ 1/1000 - < 1/100
— Rara: ≥ 1/10 000 - < 1/1000
— Muy rara: < 1/10 000
— Frecuencia desconocida: No se puede estimar a partir de los datos disponibles
Nota: Las categorías de frecuencia mencionadas anteriormente están basadas en la Guía de SmPC de la UE (Septiembre de 2009); por consiguiente, en los países no pertenecientes a la Unión Europea pueden resultar aplicables otras definiciones.
|
Tabla 1: Frecuencias de reacciones adversas al medicamento según la Guía de SmPC de la UE |
||
|
Clasificación por sistema y órgano - Terminología del MedDRA- |
Término textual de la CCDS TP del MedDRA (versión 18.1) |
Categoría de frecuencia según la Guía de SmPC de la UE |
|
Infecciones e infestaciones |
Nasofaringitis |
Frecuencia desconocida* |
|
Trastornos del metabolismo y la nutrición |
Deshidratación |
Frecuencia desconocida* |
|
Trastornos del sistema nervioso |
Mareos |
Poco frecuente |
|
Insomnio |
Rara |
|
|
Trastornos oculares |
Visión borrosa |
Rara |
|
Glaucoma |
Frecuencia desconocida* |
|
|
Aumento de la presión intraocular |
Frecuencia desconocida* |
|
|
Trastornos cardíacos |
Fibrilación auricular |
Rara |
|
Taquicardia |
Poco frecuente |
|
|
Palpitaciones |
Rara |
|
|
Taquicardia supraventricular |
Rara |
|
|
Trastornos vasculares |
Hipertensión |
Rara |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Poco frecuente |
|
Disfonía |
Poco frecuente |
|
|
Laringitis |
Rara |
|
|
Faringitis |
Rara |
|
|
Epístaxis |
Rara |
|
|
Broncoespasmo |
Rara |
|
|
Sinusitis |
Frecuencia desconocida* |
|
|
Trastornos gastrointestinales |
Boca seca |
Poco frecuente |
|
Estreñimiento |
Rara |
|
|
Candidiasis orofaríngea |
Rara |
|
|
Gingivitis |
Rara |
|
|
Obstrucción intestinal, incluyendo íleo paralítico |
Frecuencia desconocida* |
|
|
Enfermedad de reflujo gastroesofágico |
Frecuencia desconocida* |
|
|
Disfagia |
Frecuencia desconocida* |
|
|
Glositis |
Frecuencia desconocida* |
|
|
Estomatitis |
Rara |
|
|
Trastornos de la piel y del tejido subcutáneo, Trastornos del sistema inmunológico |
Hipersensibilidad (incluyendo reacciones inmediatas) |
Rara |
|
Edema angioneurótico |
Rara |
|
|
Urticaria |
Rara |
|
|
Prurito |
Rara |
|
|
Exantema |
Rara |
|
|
Infección de piel y úlcera de piel |
Frecuencia desconocida* |
|
|
Piel seca |
Frecuencia desconocida* |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia |
Rara |
|
Dolor de espalda |
Rara |
|
|
Inflamación de articulaciones |
Rara |
|
|
Trastornos renales y urinarios |
Retención urinaria |
Rara |
|
Infección de las vías urinarias |
Rara |
|
|
Disuria |
Rara |
|
|
* La frecuencia no puede estimarse con precisión ya que nunca se observó la reacción adversa en estudios clínicos. El límite superior del intervalo de confianza del 95 % no debe ser mayor que 3/n, donde n representa el tamaño total de la muestra sumado a través de todos los estudios clínicos relevantes (3/1,707 = 0,0017 = “poco frecuente”). |
||
PRESENTACIÓN COMERCIAL: Caja con cilindro de aluminio, tapa de polipropileno, anillo de cierre de silicona.
Inhalador RESPIMAT® con tapa y cuerpo de plástico (polietileno /polipropileno).
Caja con cilindro por 4 ml (60 aplicaciones (30 dosis medicinales) (volumen de llenado nominal 4,5 ml). Inhalador RESPIMAT®.
¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (+601) 319 91 00
e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A.
Versión 4 del 27 de noviembre de 2017