
SERETIDE DISKUS
FLUTICASONA, SALMETEROL
Polvo para inhalación
Inhalador , 50/100 mcg
Inhalador , 50/500 mcg
Inhalador , 50/250 mcg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Dispositivo de plástico moldeado que contiene una tira de aluminio con 28 ó 60 envases alveolados colocados en forma regular; cada uno de los cuales contiene 50 microgramos de salmeterol, como xinafoato de salmeterol, y 100 microgramos de propionato de fluticasona.
Dispositivo de plástico moldeado que contiene una tira de aluminio con 28 ó 60 envases alveolados colocados en forma regular; cada uno de los cuales contiene 50 microgramos de salmeterol, como xinafoato de salmeterol, y 250 microgramos de propionato de fluticasona.
Dispositivo de plástico moldeado que contiene una tira de aluminio con 28 ó 60 envases alveolados colocados en forma regular; cada uno de los cuales contiene 50 microgramos de salmeterol, como xinafoato de salmeterol, y 500 microgramos de propionato de fluticasona.
CARACTERÍSTICAS CLÍNICAS:
Indicaciones:
Asma (Enfermedad obstructiva reversible de las vías aéreas): SERETIDE se indica en el tratamiento periódico del asma (Enfermedad Obstructiva Reversible de las Vías Aéreas).
Esto podría incluir:
• Pacientes que reciban un tratamiento eficaz de mantenimiento con dosis de agonistas beta de acción prolongada y corticoesteroides inhalados.
• Pacientes sintomáticos que se encuentren actualmente bajo tratamiento con algún corticoesteroide inhalado.
• Pacientes bajo tratamiento periódico con algún broncodilatador que requieran corticoesteroides inhalados.
Enfermedad pulmonar obstructiva crónica (EPOC): SERETIDE se indica en el tratamiento regular de la enfermedad pulmonar obstructiva crónica (EPOC), incluyendo bronquitis crónica y enfisema,
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de Excipientes: Lactosa (la cual contiene proteína de leche).
Incompatibilidades: Ninguna comunicada.
Vida de Anaquel: 18 meses.
#2 años
[#Solo para los mercados dentro de la zona IVb que tienen registrada la envoltura de papel aluminio].
Precauciones Especiales de Almacenamiento: No almacenar a temperaturas superiores a 30 °C.
*El dispositivo Accuhaler/Diskus se encuentra sellado en una envoltura de papel aluminio que sólo debe abrirse cuando se va a utilizar el dispositivo por primera vez. Una vez abierta, se debe desechar la envoltura de papel aluminio.
[* Esta declaración sólo es aplicable si usted toma el empaque protegido con la envoltura de papel aluminio]
Naturaleza y Contenido del Envase: Como estén registrados localmente.
Instrucciones de Uso/Manejo:
*El dispositivo Accuhaler/Diskus se encuentra sellado en una envoltura de papel aluminio. La envoltura ofrece protección contra la humedad y sólo debe abrirse cuando usted esté listo(a) para utilizar el dispositivo por primera vez. Una vez abierta, se debe desechar la envoltura de papel aluminio.
[* Esta declaración sólo es aplicable si usted toma el empaque protegido con la envoltura de papel aluminio]
El dispositivo Accuhaler/Diskus libera un polvo que es inhalado en los pulmones.
Al deslizar la palanca, el dispositivo se abre y queda listo para usarse. Luego la boquilla se coloca en la boca, con los labios cerrados alrededor de la misma. Posteriormente, se puede inhalar la dosis y luego se cierra el dispositivo.
El dosímetro instalado en el Accuhaler/Diskus le indica cuántas dosis quedan disponibles.
Instrucciones para usar su Accuhaler/Diskus SERETIDE:
CERRADO: Cuando saque su Accuhaler/Diskus de su caja, éste se encontrará en la posición de cerrado.
[†La declaración anterior debe reemplazarse con la siguiente, si usted toma el empaque protegido con la envoltura de papel aluminio:]
Cuando saque su Accuhaler/Diskus de su caja, y retire la envoltura de papel aluminio, éste se encontrará en la posición de cerrado.
ABIERTO: Un dispositivo Accuhaler/Diskus nuevo contiene 28 ó 60 dosis de su medicina, en forma de polvo y protegidas de manera individual. El dosímetro le indica cuántas dosis quedan disponibles.
Cada una de las dosis fue medida con precisión y protegida en cuanto a higiene. No requiere mantenimiento ni recarga.
El dosímetro que se localiza en la parte superior de su Accuhaler/Diskus le indica cuántas dosis quedan disponibles. Los números del 5 al 0 aparecerán en ROJO, con el fin de advertirle cuando sólo queden pocas dosis disponibles.
El dispositivo Accuhaler/Diskus es fácil de usar. Cuando necesite una dosis, sólo siga los cinco simples pasos que se ilustran a continuación:
1. Abrir.
2. Deslizar.
3. Inhalar.
4. Cerrar.
5. Enjuagar
Cómo funciona su Accuhaler/Diskus:
Al deslizar la palanca de su Accuhaler/Diskus, se abre un pequeño orificio en la boquilla y se libera una dosis para que usted pueda inhalarla. Cuando cierra su Accuhaler/Diskus, la palanca regresa automáticamente a su posición original, quedando lista para cuando requiera la próxima dosis. El estuche externo protege su Accuhaler/Diskus cuando no lo utiliza.
1. Abrir - Cómo usar el Accuhaler/Diskus:
Para abrir su Accuhaler/Diskus, sostenga el estuche externo en una mano y coloque el pulgar de la otra sobre la parte diseñada para este dedo. Empuje su pulgar hacia afuera tanto como sea posible.
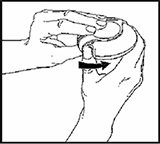
2. Deslizar:
Sostenga su Accuhaler/Diskus con la boquilla apuntando hacia usted. Deslice la palanca hacia afuera tanto como sea posible - hasta que se escuche un clic. Su Accuhaler/Diskus ya está listo para usarse. Cada vez que la palanca vuelve a su posición original, queda disponible una nueva dosis para inhalación. Esto se muestra en el dosímetro. No juegue con la palanca, ya que ésta libera dosis que serán desperdiciadas.
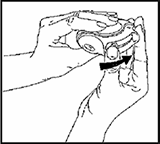
3. Inhalar:
— Antes de comenzar a inhalar la dosis, lea cuidadosamente toda esta sección.
— Sostenga el dispositivo Accuhaler/Diskus lejos de su boca. Exhale tanto como le sea cómodo. Recuerde - nunca exhale dentro de su Accuhaler/Diskus.
— Coloque la boquilla en sus labios. Aspire constante y profundamente - a través del Accuhaler/Diskus, no de su nariz.
— Retire el Accuhaler/Diskus de su boca.
— Mantenga la respiración durante 10 segundos, aproximadamente, o tanto como le sea cómodo.
— Exhale lentamente.
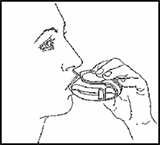
4. Cerrar
Para cerrar su Accuhaler/Diskus, coloque su pulgar en la parte diseñada para el mismo. Deslice esta parte hacia usted tanto como sea posible.
Cuando cierra el Accuhaler/Diskus, se escucha un clic. La palanca regresa automáticamente a su posición y estado original. Su Accuhaler/Diskus ya está listo para usarse nuevamente.
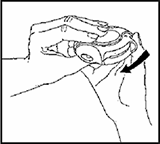
5. Enjuagar:
Después, enjuague su boca con agua y escupa esta.
Si se le ha indicado tomar dos inhalaciones, deberá cerrar el Accuhaler/Diskus y repetir las etapas 1, 2, 3 y 4.
RECUERDE:
Mantenga seco su Accuhaler/Diskus.
Manténgalo cerrado cuando no lo use.
Nunca exhale dentro de su Accuhaler/Diskus.
Deslice la palanca únicamente cuando esté listo(a) para tomar una dosis.
No exceda la dosis establecida.
Mantenga este producto fuera del alcance de los niños.
No todas las presentaciones se encuentran disponibles en todos los países.
Versión número: GDS33/IPI18
Fecha de emisión: 30 marzo 2015
PROPIEDADES FARMACOLÓGICAS
Farmacodinamia:
Estudios clínicos realizados con SEREVENT
Asma: El Estudio Multicéntrico sobre Asma realizado con Salmeterol (SMART por sus siglas en inglés [Salmeterol Multi-center Asthma Research Trial]) fue un estudio a gran escala realizado en los Estados Unidos en el que se comparó la seguridad de SEREVENT y la de placebo como terapia adicional a la terapia usual del paciente. En este estudio no se detectaron diferencias significativas en el criterio principal de valoración que consistió en una combinación del número de muertes relacionadas con problemas respiratorios y el número de experiencias relacionadas con el aparato respiratorio que pusieron en riesgo la vida del paciente. Este estudio mostró un incremento significativo en el número de muertes relacionadas con el asma en el grupo de pacientes que se encontraban recibiendo SEREVENT (13 fallecimientos de 13,176 pacientes tratados con SEREVENT por 28 semanas contra 3 fallecimientos de 13,179 pacientes tratados con placebo). El estudio no fue diseñado para valorar el impacto del uso concurrente de una terapia con corticoesteroides inhalados. Sin embargo, en los análisis post-hoc se demostró que no existió una diferencia significativa entre los grupos de tratamiento en cuanto a los muertes relacionadas con el asma para aquellos pacientes que utilizaban corticoesteroides inhalados en la línea basal (4/6127 pacientes en el grupo de SEREVENT contra 3/6138 pacientes en el grupo de placebo). El número de muertes relacionadas con el asma en aquellos grupos que no usaban conrticoesteroides inhalados fue de 9/7049 pacientes en el grupo de SEREVENT contra 0/7041 pacientes en el grupo de placebo. Adicionalmente, en un meta análisis de 42 estudios clínicos que involucraron un total de 8,030 pacientes bajo tratamiento con SERETIDE y 7,925 pacientes bajo tratamiento con FLIXOTIDE no se demostró una diferencia significativa entre SERETIDE y FLIXOTIDE en cuanto a la incidencia de eventos graves del aparato respiratorio o en la incidencia de hospitalizaciones debidas a eventos asmáticos.
Estudios clínicos realizados con SERETIDE:
Asma: En un estudio a gran escala de doce meses de duración (Logrando un Control Óptimo del Asma [Gaining Optimal Asthma ControL], GOAL), realizado en 3416 pacientes asmáticos, se compararon los perfiles de eficacia y seguridad de SERETIDE frente a una monoterapia con un corticoesteroide inhalado, en lo concerniente al logro de niveles predefinidos de control del asma. El régimen de tratamiento se aumentó progresivamente cada 12 semanas, hasta que se logró un ##‘Control total’ o se alcanzó la dosis más alta del fármaco del estudio. Uno de los requisitos era que el control se mantuviera durante cuando menos 7 de las últimas 8 semanas de tratamiento. En el estudio se demostró que:
• 71% de los pacientes tratados con SERETIDE logró un asma #‘Bien controlada’, en comparación con 59% de los pacientes tratados con la monoterapia con corticoesteroides inhalados.
• 41% de los pacientes tratados con SERETIDE logró un ##‘Control total’ del asma, en comparación con 28% de los pacientes tratados con la monoterapia con corticoesteroides inhalados.
Estos efectos se observaron en una etapa más temprana del tratamiento con SERETIDE, en comparación con la monoterapia con corticoesteroides inhalados, y a una dosificación más baja del corticoesteroide inhalado.
En el estudio GOAL también se demostró que:
• La tasa de exacerbaciones fue 29% más baja con el tratamiento con SERETIDE que con la monoterapia con corticoesteroides inhalados.
• El logro de un asma ‘Bien controlada’ y ‘Totalmente controlada’ mejoró la Calidad de Vida (CdV). El 61% de los pacientes notificó un deterioro mínimo o nulo en la CdV, cuantificado mediante un cuestionario específico para evaluar la calidad de vida de los pacientes asmáticos, después de administrar el tratamiento con SERETIDE, en comparación con un 8% en la línea basal.
#Asma bien controlada; 2 días o menos con síntomas de valor mayor a 1 (definiendo síntomas con valor de 1 como ‘síntomas durante un corto periodo durante el día’), uso de agonistas beta2 de corta acción (ABCDA) durante menos de o hasta 2 días, y menos de o hasta en 4 ocasiones/semana, 80% o mas del valor predicho del volumen espiratorio máximo matutino, sin despertares nocturnos, sin exacerbaciones y sin efectos secundarios que obliguen a cambiar el tratamiento.
##Control total del asma; sin síntomas, sin uso de agonistas beta de acción corta, o igual o más del 80% del valor predicho del volumen espiratorio máximo matutino, sin despertares nocturnos, ni exacerbaciones, ni efectos secundarios que condujeran a un cambio en el tratamiento.
En dos estudios ulteriores, se han demostrado mejoras en la función pulmonar y en el porcentaje de días libres de síntomas, así como una reducción en el uso de medicamentos de rescate, a una dosis de corticoesteroides inhalados 60% menor con SERETIDE, en comparación con la monoterapia con corticoesteroides inhalados, manteniendo al mismo tiempo el control de la inflamación subyacente de las vías respiratorias, cuantificada mediante una biopsia bronquial y un lavado broncoalveolar.
Estudios adicionales han demostrado que el tratamiento con SERETIDE mejora significativamente los síntomas asmáticos y la función pulmonar, y reduce el uso de medicamentos de rescate, en comparación con las monoterapias con los componentes individuales y el placebo. Los resultados obtenidos del estudio GOAL demuestran que las mejoras observadas con la administración de SERETIDE, en estos criterios de valoración, se mantienen durante un periodo de cuando menos 12 meses.
EPOC:
Pacientes sintomáticos con EPOC sin restricción a una reversibilidad de 10% a un agonista beta2 de acción corta: En estudios clínicos controlados con placebo, realizados durante 6 meses, se ha demostrado que el uso periódico de SERETIDE, tanto de 50/250 microgramos como de 50/500 microgramos, mejora rápida y significativamente la función pulmonar, y reduce significativamente la tasa de incidencia de disnea y el uso de medicamentos de rescate. También se observaron mejoras significativas en el estado de salud.
Pacientes sintomáticos con EPOC que demostraron una reversibilidad menor de 10% a un agonista beta2 de acción corta: En estudios clínicos controlados con placebo, realizados durante 6 y 12 meses, se ha demostrado que el uso periódico de SERETIDE 50/500 microgramos mejora rápida y significativamente la función pulmonar, y reduce significativamente la tasa de incidencia de disnea y el uso de medicamentos de rescate. A lo largo de un periodo de 12 meses, se redujo significativamente el riesgo de experimentar exacerbaciones de la EPOC, así como la necesidad de instituir ciclos adicionales de tratamiento con corticoesteroides orales. También se observaron mejoras significativas en el estado de salud.
La formulación SERETIDE 50/500 microgramos fue eficaz para mejorar la función pulmonar y el estado de salud, y para reducir el riesgo de experimentar exacerbaciones de la EPOC, tanto en fumadores actuales como en exfumadores.
Estudio TORCH (TOwards a Revolution in COPD Health [Hacia una Revolución en la Salud de los Pacientes con EPOC]): El estudio TORCH fue un estudio de 3 años de duración que se realizó para evaluar el efecto que ejerce el tratamiento con 50/500 microgramos de SERETIDE Accuhaler/Diskus dos veces al día, 50 microgramos de salmeterol en Accuhaler/Diskus dos veces al día, 500 microgramos de PF en Accuhaler/Diskus dos veces al día, o placebo, en la tasa de mortalidad por todas las causas, en pacientes que padecen EPOC. Aquellos pacientes que exhibieron una EPOC de grado moderado a severo, con un VEF1 en la línea basal (antes de utilizar algún broncodilatador) <60% del valor normal predicho, fueron distribuidos aleatoriamente para recibir un tratamiento con medicamento doblemente ciego. Durante el estudio, se permitió que los pacientes recibieran un tratamiento ordinario de la EPOC, a excepción de otros corticoesteroides inhalados, broncodilatadores de acción prolongada y corticoesteroides sistémicos a largo plazo. En todos los pacientes se determinó el estado de supervivencia a los 3 años, independientemente del retiro de la medicación del estudio. El criterio principal de valoración fue la reducción en la tasa de mortalidad por todas las causas, a los 3 años de tratamiento con SERETIDE frente a placebo.
|
Placebo |
Salmeterol |
PF 500 |
SERETIDE 50/500 |
|
|
Mortalidad por todas las causas a los 3 años de tratamiento |
||||
|
Número de muertes (%) |
231 |
205 |
246 |
193 |
|
Índice de Riesgo vs Placebo (ICs) valor p |
N/A |
0.879 |
1.060 |
0.825 |
|
Índice de Riesgo de SERETIDE 50/500 vs componentes (ICs) valor p |
N/A |
0.932 |
0.774 |
N/A |
|
1. Valor p ajustado en 2 análisis provisionales sobre la comparación principal de eficacia a partir de un análisis logarítmico-ordinal estratificado por estado de tabaquismo |
||||
Durante los 3 años de tratamiento, SERETIDE redujo el riesgo de muerte en cualquier momento en 17.5%, en comparación con el placebo (Índice de Riesgo de 0.825 (IC del 95%: 0.68, 1.00, p=0.052; todos ajustados en análisis provisionales). En el grupo tratado con salmeterol, hubo una reducción de 12% en el riesgo de muerte en cualquier momento, y por cualquier causa, durante los 3 años de tratamiento, en comparación con el grupo que recibió tratamiento con placebo (p=0.180), así como un aumento de 6% en el grupo tratado con PF en comparación con el placebo (p=0.525).
Un análisis complementario que hizo uso del modelo de Riesgos Proporcionales de Cox arrojó un índice de riesgo de 0.811 (IC del 95%: 0.670, 0.982, p=0.031) en la comparación de SERETIDE frente al placebo, lo cual representa una reducción de 19% en el riesgo de muerte en cualquier momento durante los 3 años de tratamiento. El modelo se ajustó a factores importantes (estado de tabaquismo, edad, género, región, VEF1 basal e Índice de Masa Corporal). No hubo indicios de variaciones, ocasionadas por estos factores, en los efectos del tratamiento.
El porcentaje de pacientes que murieron durante los 3 años de tratamiento, debido a causas relacionadas con la EPOC, fue de 6.0% en el grupo tratado con placebo, 6.1% en el grupo tratado con salmeterol, 6.9% en el grupo tratado con PF y 4.7% en el grupo tratado con SERETIDE.
SERETIDE redujo la tasa de exacerbaciones de grado moderado a severo en 25% (IC del 95%: 19% a 31%; p<0.001), en comparación con el placebo. SERETIDE redujo la tasa de exacerbaciones en 12%, en comparación con el salmeterol (IC del 95%: 5% a 19%, p=0.002), y 9% en comparación con el PF (IC del 95%: 1% a 16%, p=0.024). El salmeterol y el PF redujeron significativamente las tasas de exacerbaciones en comparación con el placebo; es decir, en un 15% (IC del 95%: 7% a 22%; p<0.001) y 18% (IC del 95%: 11% a 24%; p<0.001), respectivamente.
La Calidad de Vida Relacionada con la Salud, cuantificada a través del Cuestionario Respiratorio de St George (SGRQ, por sus siglas en inglés), experimentó una mejoría con todos los tratamientos activos, en comparación con el placebo. El promedio de la mejoría observada durante los tres años de tratamiento con SERETIDE, fue de -3.1 unidades en comparación con el placebo, (IC del 95%: -4.1 a -2.1; p<0.001), de -2.2 unidades (p<0.001) en comparación con el salmeterol y de -1.2 unidades (p=0.017) en comparación con el PF.
Durante el periodo de tratamiento de 3 años de duración, los valores de VEF1 fueron superiores en los sujetos tratados con SERETIDE que en los que recibieron placebo (diferencia promedio durante los 3 años de tratamiento de 92mL, IC del 95%: 75 a 108 mL; p<0.001). Además, SERETIDE fue más eficaz que el salmeterol o el PF en mejorar los valores de VEF1 (diferencia promedio de 50 mL, p<0.001 en el grupo tratado con salmeterol y 44 mL, p<0.001 en el grupo tratado con PF).
La probabilidad estimada durante los 3 años de padecer neumonía notificada como un efecto adverso fue de 12.3% en el grupo tratado con placebo, 13.3% en el grupo tratado con salmeterol, 18.3% en el grupo tratado con PF y 19.6% en el grupo tratado con SERETIDE (Índice de riesgo en la comparación SERETIDE frente a placebo: 1.64, IC del 95%: 1.33 a 2.01, p<0.001). No hubo aumento alguno en la tasa de muerte relacionada con neumonía; las muertes ocurridas durante el tratamiento que se adjudicaron como relacionadas principalmente con la neumonía fueron 7 en el grupo tratado con placebo, 9 en el grupo tratado con salmeterol, 13 en el grupo tratado con PF y 8 en el grupo tratado con SERETIDE. No hubo diferencias significativas en la probabilidad de ocurrencia de fracturas óseas (5.1% en el grupo que recibió placebo, 5.1% en el grupo que recibió salmeterol, 5.4% en el grupo que recibió PF y 6.3% en el grupo que recibió SERETIDE; Índice de riesgo en la comparación SERETIDE frente a placebo: 1.22, IC del 95%: 0.87 a 1.72, p=0.248). La tasa de incidencia de efectos adversos de trastornos oculares, trastornos óseos y trastornos en el eje HHS fue baja y, además, no se observó diferencia alguna entre los tratamientos. En los grupos de tratamiento que recibieron salmeterol, no hubo indicios de aumentos en la tasa de incidencia de efectos adversos cardiacos.
Medicación conteniendo propionato de fluticasona en asma durante el embarazo: Se llevó a cabo un estudio epidemiológico observacional retrospectivo con cohortes utilizando registros electrónicos de salud en el Reino Unido para evaluar el riesgo de MCMs después de la exposición durante el primer trimestre por FP inhalados solos y SERETIDE relacionado con CSI no conteniendo PF. En este estudio no se incluyó placebo como comparador.
Dentro del cohorte de asma de 5362 embarazos con exposición a CSI durante el primer trimestre, se identificaron 131 diagnosticados como MCMs; 1612 (30%) fueron expuestos a FP o SERETIDE de los cuales se identificaron 42 diagnosticados como MCMs. La proporción de probabilidad ajustada para diagnóstico de MCMs durante 1 año en mujeres con asma moderada fue 1.1 (95%IC: 0.5 – 2.3) para expuestos a PF vs no expuestos a CSI sin PF y 1.2 (95%IC: 0.7 – 2.0) para mujeres con asma de considerable a grave. No se identificó diferencia en el riesgo de MCMs después de exposición, durante el primer trimestre, a PF sola versus SERETIDE. El riesgo absoluto de MCM a través de los estratos de gravedad del asma varió de 2.0 a 2.9 por 100 embarazos expuestos a PF lo cual es comparable a los resultados de un estudio de 15,840 embarazos no expuestos a tratamiento de asma en la Base de Datos de Investigación en la Práctica General (2.8 eventos de MCM por 100 embarazos).
Mecanismo de acción: SERETIDE contiene salmeterol y propionato de fluticasona, los cuales poseen diferentes mecanismos de acción. El salmeterol brinda una protección contra los síntomas, mientras el propionato de fluticasona mejora la función pulmonar y previene las exacerbaciones de la enfermedad. SERETIDE puede ofrecer un régimen terapeútico más conveniente en pacientes que reciben tratamiento concurrente con agonistas beta y corticoesteroides inhalados. A continuación se describen los mecanismos de acción correspondientes a los dos fármacos:
Salmeterol: El salmeterol es un agonista selectivo de acción prolongada (12 horas), de los receptores beta-2 adrenérgicos, con una larga cadena lateral que se fija al exo-sitio del receptor.
Estas propiedades farmacológicas del salmeterol ofrecen una protección más eficaz contra la broncoconstricción inducida por histamina y, además, proporcionan una broncodilatación más prolongada, de cuando menos 12 horas, que la obtenida con las dosis recomendadas de agonistas beta2 convencionales de acción corta.
Pruebas in vitro han mostrado que, en el ser humano, el salmeterol es un potente inhibidor de larga duración de la liberación pulmonar de mediadores de células cebadas, como la histamina, leucotrienos y prostaglandina D2.
En el ser humano, el salmeterol inhibe la respuesta de fase temprana y tardía a los alérgenos inhalados, lo cual persiste por más de 30 horas después de la administración de una dosis única, cuando ya no hay más indicios del efecto broncodilatador. La dosificación única con salmeterol atenúa la hiperreactividad bronquial. Estas propiedades indican que el salmeterol posee una actividad adicional no broncodilatadora, pero aún no es clara su importancia clínica total. Este mecanismo difiere del efecto antiinflamatorio de los corticoesteroides.
Propionato de fluticasona: El propionato de fluticasona, administrado por inhalación a las dosis recomendadas, exhibe una potente acción antiinflamatoria glucocorticoesteroide en los pulmones, la cual reduce los síntomas y exacerbaciones del asma sin producir los efectos adversos que se observan al administrar corticoesteroides de manera sistémica.
La producción diaria de hormonas corticosuprarrenales suele permanecer en el intervalo normal durante el tratamiento crónico con propionato de fluticasona inhalado, aún cuando se administra a las dosis más altas recomendadas en niños y adultos. Después de realizar la transferencia de pacientes de otros tratamientos con esteroides inhalados, la producción diaria mejora gradualmente, a pesar del uso intermitente, tanto previo como actual, de esteroides orales, demostrando de esta forma una normalización de la función suprarrenal en pacientes que reciben tratamiento con propionato de fluticasona inhalado. La reserva suprarrenal también permanece normal durante la administración de un tratamiento crónico, según un incremento normal observado en una prueba de estimulación. Sin embargo, cualquier deterioro residual en la reserva suprarrenal, resultante de un tratamiento previo, podría persistir durante un periodo considerable, lo cual deberá ser tomado en cuenta (véase Advertencias y Precauciones).
Farmacocinética: En animales o humanos, no hay indicios de que la administración concomitante de salmeterol y propionato de fluticasona por inhalación afecte el perfil farmacocinético de alguno de los componentes.
Por tanto, para fines farmacocinéticos, se puede considerar cada componente de manera separada.
En un estudio sobre interacciones medicamentosas, entrecruzado, controlado con placebo y realizado en 15 sujetos sanos, la coadministración de SEREVENT (50 mcg administrados dos veces al día por inhalación) y el inhibidor de la CYP3A4, ketoconazol (400 mg administrados una vez al día vía oral), durante 7 días, produjo un aumento significativo en el grado de exposición plasmática al salmeterol (1.4 veces la Cmax y 15 veces el AUC). No hubo aumento alguno en la acumulación de salmeterol cuando se administraron dosis repetidas. Tres sujetos fueron retirados del tratamiento concomitante con SEREVENT y ketoconazol debido a que experimentaron una prolongación en el intervalo QTc, o palpitaciones con taquicardia sinusal. En los 12 sujetos restantes, la coadministración de SEREVENT y ketoconazol no produjo efectos clínicamente significativos en la frecuencia cardiaca, el potasio sanguíneo o la duración del intervalo QTc. (véanse Advertencias y Precauciones e Interacciones).
Salmeterol: El salmeterol actúa localmente en los pulmones, por lo cual no es posible conocer los efectos terapéuticos a través de las concentraciones plasmáticas. Además, sólo se dispone de muy poca información sobre el perfil farmacocinético del salmeterol, debido a la dificultad técnica experimentada al analizar el fármaco en el plasma, pues las concentraciones plasmáticas alcanzadas después de la administración por inhalación de dosis terapéuticas (aproximadamente 200 picogramos/mL o menos) son bajas. Después de administrar un régimen posológico periódico con xinafoato de salmeterol, es posible que se detecte ácido hidroxinaftoico en la circulación sistémica, alcanzando concentraciones en estado estacionario de aproximadamente 100 nanogramos/mL. Estas concentraciones son hasta 1000 veces más bajas que las concentraciones en estado estacionario observadas en estudios de toxicidad. No se han observado efectos perjudiciales, posteriores a la administración de un régimen posológico periódico a largo plazo (más de 12 meses), en pacientes con obstrucción de las vías respiratorias.
En un estudio in vitro, se demostró que el salmeterol se metaboliza ampliamente a a-hidroxisalmeterol (oxidación alifática), a través de la isoenzima 3A4 del citocromo P450 (CYP3A4). En un estudio realizado en voluntarios sanos que recibieron dosis repetidas de salmeterol y eritromicina, no se observaron cambios clínicamente significativos en los efectos farmacodinámicos al administrar un régimen posológico de 500 mg de eritromicina tres veces al día. Sin embargo, en un estudio sobre interacciones de salmeterol-ketoconazol ocurrió un aumento significativo en el grado de exposición plasmática al salmeterol. (véase Advertencias y Precauciones e Interacciones).
Propionato de fluticasona: La biodisponibilidad absoluta del propionato de fluticasona en cada uno de los dispositivos inhaladores disponibles ha sido estimada a partir de las comparaciones realizadas en y entre los estudios de los datos farmacocinéticos de las formulaciones inhalada e intravenosa. En sujetos adultos sanos, se ha estimado la biodisponibilidad absoluta para el propionato de fluticasona en Accuhaler/Diskus (7.8%), el propionato de fluticasona en Diskhaler (9.0%), el propionato de fluticasona en Evohaler (10.9%), la combinación de salmeterol-propionato de fluticasona en Evohaler (5.3%) y la combinación de salmeterol-propionato de fluticasona en Accuhaler/Diskus (5.5%), respectivamente.. En pacientes que padecen asma o EPOC, se ha observado un menor grado de exposición sistémica al propionato de fluticasona inhalado. La absorción sistémica ocurre principalmente a través de los pulmones, siendo inicialmente rápida y después prolongada. El resto de la dosis inhalada puede deglutirse, pero representa una mínima contribución a la exposición sistémica debido a su escasa solubilidad acuosa y limitado metabolismo presistémico, lo cual produce una disponibilidad oral inferior a 1%. Al aumentar la dosificación por inhalación, se produce un aumento lineal en la exposición sistémica. La eliminación de propionato de fluticasona se caracteriza por una depuración plasmática considerable (1150 mL/min), un gran volumen de distribución en estado estacionario (aproximadamente 300 L) y una vida media terminal de aproximadamente 8 horas. Su grado de fijación a proteínas plasmáticas es moderadamente alto (91%). El propionato de fluticasona se depura de la circulación sistémica con gran rapidez, principalmente por la vía metabólica, a través de la enzima CYP3A4 del citocromo P450, para transformarse en un metabolito inactivo de ácido carboxílico. La depuración renal de propionato de fluticasona es insignificante (<0.2%) y menos del 5% se depura como metabolito. Se debe tener cuidado al coadministrar inhibidores conocidos de la CYP3A4, ya que existe un riesgo potencial de que aumente el grado de exposición sistémica al propionato de fluticasona.
Poblaciones de Pacientes Especiales
SERETIDE:
Accuhaler/Diskus: El análisis farmacocinético poblacional se realizó utilizando los datos obtenidos en sujetos asmáticos (nueve estudios clínicos realizados con PF y cinco estudios clínicos realizados con salmeterol) y demostró lo siguiente:
— Después de administrar SERETIDE (50/100 microgramos), se observó un mayor grado de exposición al PF, en comparación con la administración de PF solo (100 microgramos), en adolescentes y adultos (relación de 1.52 [IC del 90% 1.08, 2.13]) y niños (relación de 1.20 [IC del 90% 1.06, 1.37]).
— En los niños que tomaron SERETIDE (50/100 microgramos), se observó un mayor grado de exposición al PF, en comparación con los adolescentes y adultos (relación de 1.63 [IC del 90% 1.35, 1.96]).
— Se desconoce la importancia clínica de estos hallazgos; sin embargo, no se observaron diferencias en los efectos producidos en el eje HHS en los estudios clínicos de hasta 12 semanas de duración, en los cuales se comparó SERETIDE (50/100 microgramos) y PF (100 microgramos), tanto en adolescentes y adultos como en niños.
— Al administrar la dosis más alta de SERETIDE (50/500 microgramos), el grado de exposición al PF fue similar al observado con la dosis equivalente de PF solo.
— En los niños que tomaron SERETIDE (50/100 microgramos), se observó un mayor grado de exposición al salmeterol, en comparación con los adolescentes y adultos (relación de 1.23 [IC del 90% 1.10, 1.38]).
— Se desconoce la importancia clínica de estos hallazgos; sin embargo, no se observaron diferencias en los efectos cardiovasculares o notificaciones de temblores, entre adultos, adolescentes y niños, en los estudios clínicos de hasta 12 semanas de duración.
CONTRAINDICACIONES: SERETIDE se contraindica en pacientes con antecedentes de hipersensibilidad a cualquiera de los ingredientes (véase Lista de Excipientes).
EMBARAZO Y LACTANCIA: No hay datos en acerca del efecto en la fertilidad humana. Estudios con animales indican que no hay efectos de propionato de fluticasona o xinafoato de salmeterol en la fertilidad de machos o hembras.
Hay datos limitados en mujeres embarazadas. La administración de fármacos durante el embarazo sólo debe contemplarse si el beneficio esperado para la madre excede cualquier posible riesgo para el feto o niño.
En los resultados de un estudio epidemiológico retrospectivo no se encontró un aumento en el riesgo de malformaciones congénitas mayores (MCMs) después de la exposición a propionato de fluticasona en comparación con otros cortico-esteroides inhalados, durante el primer trimestre del embarazo (véase Farmacodinámica).
Los estudios realizados en animales para evaluar la toxicidad en la reproducción, ya sea con el fármaco administrado como monoterapia o en combinación, revelaron los efectos fetales esperados a niveles excesivos de exposición sistémica a un glucocorticoesteroide y a un potente agonista de los receptores beta-2 adrenérgicos.
La vasta experiencia clínica que se tiene con estas clases de fármacos no ha revelado indicios de que los efectos estén relacionados con la administración de dosis terapéuticas.
Después de administrar dosis terapéuticas inhaladas, las concentraciones plasmáticas de salmeterol y propionato de fluticasona son muy bajas, por lo cual es probable que sean correspondientemente bajas en la leche materna humana. Esta teoría se encuentra sustentada por estudios realizados en animales lactantes, en los cuales se detectaron bajas concentraciones medicamentosas en la leche. No se dispone de información relacionada con la leche materna humana.
La administración durante la lactancia sólo debe considerarse si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el recién nacido.
EFECTOS EN LA CAPACIDAD DE CONDUCIR Y OPERAR MAQUINARIA: No se han realizado estudios específicos para evaluar el efecto que ejerce SERETIDE en las actividades arriba mencionadas, pero el perfil farmacológico de ambos fármacos no indica la existencia de algún efecto.
EFECTOS ADVERSOS: Más adelante se enlistan todas las reacciones adversas asociadas con los componentes individuales, xinafoato de salmeterol y propionato de fluticasona. No hay reacciones adversas adicionales atribuidas a la combinación cuando se compara con los perfiles de eventos adversos de los componentes individuales.
Se enlistan más adelante los eventos adversos por órgano / sistema y frecuencia. Las frecuencias se definen como: muy comunes (≥ 1/10), comunes (≥1/100 a <1/10), poco comunes (≥1/1000 a <1/100), raras (≥1/10,000 a <1/1000) y muy raras (<1/10,000). La mayor parte de las frecuencias se determinó del conjunto de los estudios clínicos, 23 en asma y 7 de los estudios en EPOC. No todos los eventos fueron reportados en los estudios clínicos. Para esos eventos, la frecuencia se calculó basándose en datos espontáneos.
Datos de los Estudios Clínicos:
Infecciones e infestaciones:
Comunes: Candidiasis de boca y garganta, neumonía (en pacientes con EPOC).
Raros: Candidiasis Esofágica
Trastornos del sistema inmunológico:
Reacciones de hipersensibilidad:
Poco comunes: Reacciones cutáneas de hipersensibilidad, disnea.
Raros: Reacciones anafilácticas
Trastornos endocrinos:
Posibles efectos sistémicos incluyen (véase Advertencias y Precauciones):
Poco comunes: Cataratas
Raros: Glaucoma
Trastornos del metabolismo y nutrición:
Poco comunes: Hiperglucemia.
Trastornos psiquiátricos:
Poco comunes: Ansiedad, trastornos del sueño.
Raros: Cambios de comportamiento, incluyendo hiperactividad e irritabilidad (predominantemente en niños).
Trastornos de sistema nervioso:
Muy comunes: Cefalea. (véase Advertencias y Precauciones).
Poco comunes: Temblor. (véase Advertencias y Precauciones).
Trastornos cardiacos:
Poco comunes: Palpitaciones (véase Advertencias y Precauciones), taquicardia, fibrilación auricular.
Raros: Arritmias cardiacas incluyendo taquicardia supraventricular y extrasístoles.
Trastornos respiratorios, torácicos y del mediastino:
Comunes: Ronquera/disfonia.
Poco comunes: Irritación de garganta.
Trastornos de piel y tejido subcutáneos:
Poco comunes: Contusiones.
Trastornos músculo-esqueléticos y del tejido conectivo:
Comunes: Calambres musculares, artralgia.
Datos Post-mercadeo:
Trastornos del sistema inmunológico:
Reacciones por hipersensibilidad como: Raras: Angioedema (principalmente facial y edema orofaringeo) y broncoespasmo.
Trastornos endocrinos:
Posibles efectos sistémicos incluyen (véase Advertencias y Precauciones):
Raros: Síndrome de Cushing, manifestaciones cushinoides, supresión suprarrenal, retardo en el crecimiento en niños y adolescentes, disminución en la densidad mineral ósea.
Trastornos respiratorios, torácicos y del mediastino:
Raros: Bronco-espasmo paradójico (véase Advertencias y Precauciones)
INTERACCIONES: Se debe evitar el uso de agentes betabloqueadores, tanto selectivos como no selectivos, a menos que existan razones convincentes para su uso.
En circunstancias normales, se alcanzan concentraciones plasmáticas bajas de propionato de fluticasona, después de la dosificación por inhalación, debido al amplio metabolismo de primer paso y al alto grado de depuración sistémica mediados por la isoenzima 3A4 del citocromo P450 en el intestino e hígado. Por tanto, es improbable que se produzcan interacciones medicamentosas, clínicamente significativas, mediadas por el propionato de fluticasona.
En un estudio sobre interacciones medicamentosas, realizado en sujetos sanos, se demostró que el ritonavir (un inhibidor altamente potente de la isoenzima 3A4 del citocromo P450) es capaz de aumentar significativamente las concentraciones plasmáticas de propionato de fluticasona, dando como resultado una evidente reducción en las concentraciones séricas de cortisol. Durante su uso posterior a la comercialización, se han producido notificaciones de interacciones medicamentosas clínicamente significativas en pacientes que reciben tratamiento concomitante con propionato de fluticasona intranasal o inhalado y ritonavir, dando como resultado efectos relacionados con la administración de corticoesteroides sistémicos, incluyendo síndrome de Cushing y deterioro suprarrenal. Por tanto, se debe evitar el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente exceda el riesgo de experimentar efectos secundarios relacionados con la administración de corticoesteroides sistémicos.
Los estudios han demostrado que otros agentes inhibidores de la isoenzima 3A4, del citocromo P450, producen aumentos insignificantes (eritromicina) y leves (ketoconazol) en la exposición sistémica al propionato de fluticasona, sin reducciones evidentes en las concentraciones séricas de cortisol. Sin embargo, se recomienda tener cuidado al coadministrar inhibidores potentes de la isoenzima 3A4 del citocromo P450 (p.ej., ketoconazol), ya que existe un riesgo de que aumente el grado de exposición sistémica al propionato de fluticasona.
La coadministración de ketoconazol y SEREVENT produce un aumento significativo en el grado de exposición plasmática al salmeterol (1.4 veces la Cmax y 15 veces el AUC), lo cual podría ocasionar una prolongación en el intervalo QTc. (véanse Advertencias y Precauciones y Farmacocinética).
DATOS PRECLÍNICOS DE SEGURIDAD: En análisis de toxicidad realizados en animales, se han efectuado extensas evaluaciones del xinafoato de salmeterol y propionato de fluticasona. Se observaron toxicidades significativas sólo a dosis superiores a las recomendadas para uso en seres humanos, las cuales fueron las esperadas para un glucocorticoesteroide y un potente agonista de receptores beta2 adrenérgicos. Ni el xinafoato de salmeterol o el propionato de fluticasona han mostrado toxicidad genética potencial.
En estudios realizados a largo plazo, el xinafoato de salmeterol indujo la aparición de tumores benignos del músculo liso en el mesovario de ratas y útero de ratonas.
Los roedores son sensibles a la formación de estos tumores inducidos farmacológicamente. No se considera que el salmeterol represente algún riesgo oncogénico significativo para el hombre.
La coadministración de salmeterol y propionato de fluticasona ocasionó algunas interacciones cardiovasculares a dosis altas. En ratas, la arteritis coronaria focal y miocarditis auricular de grado leve fueron efectos transitorios que se resolvieron al administrar un régimen posológico periódico. En perros, los aumentos en la frecuencia cardiaca fueron mayores después de la coadministración, en comparación con la monoterapia con salmeterol. En estudios realizados en seres humanos, no se han observado efectos adversos graves, de tipo cardiaco, clínicamente significativos.
En animales, la coadministración no modificó otras toxicidades relacionadas con la clase.
ADVERTENCIAS Y PRECAUCIONES: La formulación SERETIDE Accuhaler/Diskus no debe utilizarse para mitigar síntomas agudos, para los cuales se requiere un agente broncodilatador de rápida acción y corta duración (p.ej., salbutamol). Se debe aconsejar a los pacientes que tengan disponible su medicamento de rescate en todo momento.
El uso más frecuente de agentes broncodilatadores de acción corta, para aliviar los síntomas, indica un deterioro en el control de la enfermedad. Por tanto, los pacientes deberán ser evaluados por un médico.
El deterioro súbito y progresivo en el control del asma es potencialmente mortal, por lo cual los pacientes deberán ser evaluados por un médico. Se deberá contemplar un aumento en la dosificación de la terapia corticoesteroide. Además, cuando el régimen posológico actual de SERETIDE haya sido incapaz de proporcionar un control adecuado del asma, el paciente deberá ser evaluado por un médico.
Debido al riesgo de exacerbaciones, el tratamiento con SERETIDE no deberá suspenderse de manera abrupta en pacientes asmáticos; el régimen posológico deberá reducirse gradualmente bajo la supervisión de un médico. En pacientes que padezcan EPOC, la suspensión de la terapia podría asociarse con una descompensación sintomática, por lo cual deberá ser supervisada por un médico.
# En los estudios realizados en pacientes con EPOC que recibieron tratamiento con SERETIDE, se produjo un aumento en la tasa de notificaciones de neumonía (véase Efectos Adversos). Los médicos deberán instituir una vigilancia continua para evitar el posible desarrollo de neumonía en pacientes que padezcan EPOC, ya que las características clínicas de la neumonía suelen coincidir con la exacerbación de la enfermedad.
Al igual que con todos los medicamentos inhalados que contienen corticoesteroides, SERETIDE debe administrarse con precaución a pacientes que padezcan tuberculosis pulmonar activa o latente.
SERETIDE debe administrarse con precaución a pacientes con tirotoxicosis.
En algunas ocasiones se pueden observar efectos cardiovasculares, como aumentos en la tensión arterial sistólica y frecuencia cardiaca, con todos los fármacos simpaticomiméticos, especialmente cuando se administran a dosis superiores a las terapéuticas. Por esta razón, SERETIDE debe administrarse con precaución a los pacientes que padezcan enfermedades cardiovasculares preexistentes.
Con todos los fármacos simpaticomiméticos que se administran a dosis terapéuticas más altas, existe la posibilidad de que se produzca un decremento transitorio en las concentraciones séricas de potasio. Por tanto, SERETIDE debe administrarse con precaución a pacientes que sean propensos a desarrollar bajas concentraciones séricas de potasio.
Es posible que se produzcan efectos sistémicos con cualquier corticoesteroide inhalado, especialmente a dosis altas prescritas durante periodos prolongados; hay una probabilidad mucho mayor de que estos efectos se produzcan al administrar corticoesteroides orales (véase Sobredosis). Entre los posibles efectos sistémicos se incluyen síndrome de Cushing, características Cushingoides, deterioro suprarrenal, crecimiento retardado en niños y adolescentes, disminución en la densidad mineral ósea, cataratas y glaucoma. Por tanto, en pacientes que padezcan asma, es importante que se ajuste la dosificación de corticoesteroides inhalados a la dosis más baja con la cual se mantenga un control eficaz.
En situaciones optativas y de urgencia que puedan producir estrés, siempre debe tenerse presente la posibilidad de que se produzca un deterioro en la respuesta suprarrenal y contemplarse un tratamiento adecuado con corticoesteroides (véase Sobredosis).
Se recomienda vigilar periódicamente la estatura de los niños que se encuentren bajo tratamiento prolongado con corticoesteroides inhalados.
Debido a un posible deterioro en la respuesta suprarrenal, los pacientes transferidos de una terapia con esteroides orales, a un tratamiento con propionato de fluticasona inhalado, deben recibir un cuidado especial. Además, se debe vigilar periódicamente su función corticosuprarrenal.
Después de introducir la terapia con propionato de fluticasona inhalado, se deberá suspender la terapia sistémica en forma gradual y exhortar a los pacientes a que porten una tarjeta de alerta que indique la posible necesidad de terapia adicional con esteroides en situaciones de estrés.
En muy raras ocasiones, se han producido notificaciones de aumentos en las concentraciones de glucemia (véase Efectos Adversos). Esto deberá tomarse en cuenta cuando el medicamento se prescriba a pacientes con antecedentes de diabetes mellitus.
Durante su uso posterior a la comercialización, se han producido notificaciones de interacciones medicamentosas clínicamente significativas en pacientes que reciben tratamiento concomitante con propionato de fluticasona y ritonavir, dando como resultado efectos relacionados con la administración de corticoesteroides sistémicos, incluyendo síndrome de Cushing y deterioro suprarrenal. Por tanto, se debe evitar el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente exceda el riesgo de experimentar efectos secundarios relacionados con la administración de corticoesteroides sistémicos (véase Interacciones).
La información proveniente de un estudio a gran escala realizado en Estados Unidos (SMART), el cual comparó la seguridad de SEREVENT (un componente de SERETIDE) o de placebo, cuando fueron administrados en forma adicional a la terapia regular del paciente, mostró un incremento significativo en el número de muertes relacionadas con el asma en el grupo de pacientes que se encontraban recibiendo terapia con SEREVENT. La información de este estudio, sugiere que los pacientes afro-americanos bajo terapia con SEREVENT, podrían encontrarse bajo un riesgo mayor de desarrollar eventos respiratorios graves relacionados con el medicamento en comparación con los pacientes a los que se administró placebo. Se desconoce si este incremento se debió a factores farmacogenéticos o a otros factores. El estudio SMART no fue diseñado para determinar si el uso concurrente de corticoesteroides inhalados modifica el riesgo de experimentar muerte relacionada con el asma (véase Estudios Clínicos).
En un estudio sobre interacciones medicamentosas, se observó que el uso concomitante de ketoconazol sistémico incrementa el grado de exposición a SEREVENT. Esto podría ocasionar una prolongación en el intervalo QTc. Se debe tener cuidado al coadministrar potentes inhibidores de la isoenzima CYP3A4 (p.ej., ketoconazol) con SEREVENT. (véanse Interacciones y Farmacocinética).
[# Esta información deberá ser incluída también en el marbete local en aquellos mercados en los que se encuentre aprobada la indicación para EPOC].
Como ocurre con otras terapias inhaladas, puede ocurrir broncoespasmo paradójico con un aumento inmediato de las sibilancias después de la dosificación. Esto debe tratarse inmediatamente con la administración de un broncodilatador inhalado de efecto rápido y corto. Salmeterol-FP Accuhaler/Diskus o Evohaler debe descontinuarse inmediatamente, se debe evaluar al paciente e instituir una terapia alternativa si fuera necesario. (véase Reacciones Adversas).
Se han reportado reacciones adversas del tratamiento farmacológico con agonistas beta-2, tales como temblor, palpitaciones subjetivas y cefalea, pero tienden a ser transitorias y a disminuir con la regularización de la terapia. (véase Reacciones Adversas).
DOSIS Y ADMINISTRACIÓN: SERETIDE Accuhaler/Diskus sólo debe administrarse mediante inhalación.
Se debe concienciar a los pacientes de que deben utilizar la formulación SERETIDE Accuhaler/Diskus con regularidad para obtener un beneficio óptimo, incluso cuando se encuentren asintomáticos.
Un médico deberá reevaluar periódicamente a los pacientes, con la finalidad de garantizar que la potencia de SERETIDE que se encuentren recibiendo siga siendo óptima, y que sólo se cambie de acuerdo a su criterio médico.
Asma (Enfermedad obstructiva reversible de las vías aéreas): Se deberá ajustar la dosificación a la dosis más baja, con la cual se mantenga un control eficaz de los síntomas. Cuando el control de los síntomas se mantenga con un régimen posológico de SERETIDE dos veces al día, el ajuste a la dosis eficaz más baja podría incluir la administración de SERETIDE una vez al día.
Se deberá administrar a los pacientes la potencia de SERETIDE que contenga la dosis de propionato de fluticasona adecuada a la severidad de su enfermedad.
Si alguno de los pacientes no está siendo controlado adecuadamente con una monoterapia con corticoesteroides inhalados, la sustitución por SERETIDE, a una dosis corticoesteroide terapéuticamente equivalente, podría producir una mejora en el control del asma. En aquellos pacientes cuyo asma esté siendo controlada aceptablemente con una monoterapia con corticoesteroides inhalados, la sustitución por SERETIDE podría permitir una reducción en la dosificación del corticoesteroide mientras se mantiene el control del asma. Para obtener información adicional, favor de consultar la sección ‘Farmacodinamia’.
Dosis Recomendadas:
Adultos y adolescentes de 12 años de edad y mayores:
Una inhalación (50 microgramos de salmeterol y 100 microgramos de propionato de fluticasona) suministrada dos veces al día.
o
Una inhalación (50 microgramos de salmeterol y 250 microgramos de propionato de fluticasona) suministrada dos veces al día.
o
Una inhalación (50 microgramos de salmeterol y 500 microgramos de propionato de fluticasona) suministrada dos veces al día.
Niños de 4 años de edad y mayores: Una inhalación (50 microgramos de salmeterol y 100 microgramos de propionato de fluticasona) suministrada dos veces al día.
No se dispone de información sobre el uso de SERETIDE en niños menores de 4 años de edad.
Enfermedad pulmonar obstructiva crónica (EPOC): En pacientes adultos, la dosis recomendada consiste en una inhalación de 50/250 microgramos a 50/500 microgramos de salmeterol/propionato de fluticasona, suministrada dos veces al día. Se ha demostrado que SERETIDE reduce la tasa de mortalidad por todas las causas, cuando se administra a una dosis de 50/500 microgramos dos veces al día (véase Estudios Clínicos).
Grupos de pacientes especiales: No es necesario ajustar la dosificación en pacientes de edad avanzada, ni en aquellos que padezcan insuficiencia renal o hepática.
SOBREDOSIS: A continuación se presenta la información disponible en cuanto a sobredosificaciones con SERETIDE, salmeterol y/o propionato de fluticasona:
Los signos y síntomas esperados de la sobredosificación con salmeterol son aquellos que se presentan comúnmente como resultado de una estimulación beta2 adrenérgica excesiva, incluyendo temblor, cefalea, taquicardia, aumentos en la tensión arterial sistólica e hipokalemia. No hay tratamiento específico para una sobredosis con salmeterol y propionato de fluticasona. Si se presenta sobredosis, se debe dar al paciente medidas de soporte y monitoreo apropiado según sea necesario.
La inhalación aguda de dosis de propionato de fluticasona superiores a las aprobadas podría ocasionar un deterioro temporal del eje hipotálamo-hipófiso-suprarrenal. Por lo general, no es necesario llevar a cabo ninguna acción de emergencia, ya que normalmente la función suprarrenal se recupera en pocos días.
Si se siguen administrando dosis de SERETIDE superiores a las aprobadas durante periodos prolongados, es posible que se produzca un deterioro corticosuprarrenal significativo. En muy raras ocasiones, se han producido notificaciones de crisis suprarrenal aguda, principalmente en niños expuestos a dosis superiores a las aprobadas durante periodos prolongados (varios meses o años); entre las características observadas se incluye hipoglucemia asociada con secuelas de desmayos y/o convulsiones. Entre las situaciones que tienen el potencial de desencadenar una crisis suprarrenal aguda se incluyen: exposición a traumatismos, intervenciones quirúrgicas, infecciones o cualquier reducción rápida en la dosificación del componente propionato de fluticasona inhalado.
No se recomienda que los pacientes reciban dosis de SERETIDE superiores a las aprobadas. Es importante que se revise la terapia con regularidad y se disminuya la dosificación a la dosis más baja aprobada, con la cual se mantenga un control eficaz de la enfermedad (véase Dosis y Administración).
PRESENTACIONES: SERETIDE DISKUS 50/100 MCG. Información exclusiva para Colombia. (Registro Sanitario No: INVIMA 2009 M-13571-R1). Presentaciones comerciales: Inhalador diskus (multidosis) por 60 dosis.
SERETIDE DISKUS 50/250 MCG. (Registro Sanitario No: INVIMA 2016M-0011071-R1). Presentaciones comerciales: Inhalador diskus (multidosis) por 60 dosis. Inhalador diskus (multidosis) por 28 dosis.
SERETIDE DISKUS 50/500 MCG. (Registro Sanitario No: INVIMA 2009 M-13778-R1). Presentaciones comerciales: Inhalador diskus (multidosis) por 60 dosis. Inhalador diskus (multidosis) por 28 dosis.
No todas las presentaciones comerciales contenidas en el presente documento están disponibles en Colombia.
SERETIDE, ACCUHALER, diskus son marcas registradas del grupo de compañías GlaxoSmithKline.
GLAXOSMITHKLINE COLOMBIA S.A.
PRESENTACIÓN FARMACÉUTICA: Polvo para inhalación.