
RHINOCORT® AQUA RHINOCORT® AQUA 32 MCG /DOSIS
BUDESONIDA
Suspensión en aerosol
Frasco de vidrio,120 Dosis,32 µg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Una dosis (0.05 ml) contiene 32 microgramos o 64 microgramos de budesonida.
INDICACIONES TERAPÉUTICAS
— Profilaxis y tratamiento de la rinitis.
— Tratamiento de pólipos nasales.
— Prevención de pólipos nasales después de una polipectomía.
FORMA FARMACÉUTICA: Suspensión para aerosol nasal.
PROPIEDADES FARMACOCINÉTICAS
Absorción: La disponibilidad sistémica de la budesonida administrada en forma de RHINOCORT® AQUA corresponde al 33% de la dosis medida.
La cinética es proporcional a la dosis en el intervalo de dosis terapéuticas. En los adultos, después de la administración de 256 microgramos de budesonida en forma de RHINOCORT® AQUA, la concentración plasmática máxima es de 0.64 nmol/l y se alcanza después de 0.7 horas. Después de la administración de 256 microgramos de budesonida en forma de RHINOCORT® AQUA, el ABC (área bajo la curva de la concentración plasmática en función del tiempo) es de 2.7 nmol x hora/litro en los adultos y de 5.5 nmol x hora/litro en los niños, lo cual indica que la exposición sistémica a los glucocorticoides es mayor en los niños.
Distribución y metabolismo: La budesonida tiene un volumen de distribución de unos 3 l/kg y se une aproximadamente en un 85%-90% a las proteínas plasmáticas. La budesonida es objeto de un extenso metabolismo de primer paso en el hígado (?90%), convirtiéndose en metabolitos con una baja actividad glucocorticoide. La actividad glucocorticoide de los principales metabolitos (6-ß-hidroxibudesonida y 16-a-hidroxiprednisolona) es inferior al 1% de la actividad de la budesonida. La budesonida no es objeto de metabolismo local en la nariz.
Eliminación: La budesonida se elimina por metabolismo, el cual es catalizado principalmente por la enzima CYP3A4. Los metabolitos de la budesonida se eliminan en forma intacta o conjugada, principalmente por la vía renal. Solo se han detectado cantidades insignificantes de budesonida intacta en la orina. La budesonida muestra una gran depuración sistémica (0.9-1.4 l/min) y su vida media plasmática después de la administración intravenosa es de aproximadamente de 2 a 3 horas en promedio.
PROPIEDADES FARMACODINÁMICAS
Grupo farmacoterapéutico: Glucocorticoides.
Código ATC: R01AD05.
La budesonida es un glucocorticoide con potentes efectos antiinflamatorios locales.
No se ha esclarecido por completo el modo de acción preciso de los glucocorticoides en el tratamiento de la rinitis. Es probable que tengan un papel importante los efectos antiinflamatorios como la inhibición de la liberación de mediadores inflamatorios y la inhibición de la respuesta inmunitaria mediada por citoquinas. Basándose en su afinidad por los receptores de glucocorticoides, la budesonida ejerce una actividad aproximadamente 15 veces mayor que la prednisolona.
Se ha demostrado que la budesonida administrada de manera profiláctica antes de una provocación nasal ejerce efectos protectores contra la infiltración de eosinófilos y la hiperreactividad.
Con las dosis recomendadas, RHINOCORT® AQUA no provoca modificaciones de importancia clínica de las concentraciones plasmáticas basales de cortisol o de la respuesta a la estimulación con ACTH. En cambio, después de la administración de RHINOCORT® AQUA a corto plazo en voluntarios sanos, se ha observado una supresión de las concentraciones plasmáticas y urinarias de cortisol en función de la dosis.
Los estudios clínicos han demostrado una relación entre la dosis y la respuesta en niños con rinitis alérgica estacional o perenne o en adultos con rinitis alérgica perenne.
No se ha documentado el tratamiento de la rinitis vasomotora (rinitis perenne no alérgica) con la presentación de RHINOCORT® AQUA de 32 µg por dosis.
CONTRAINDICACIONES Y ADVERTENCIAS: Hipersensibilidad al medicamento, tuberculosis pulmonar activa o quiescente.
Precauciones y advertencias: Su uso durante el embarazo se establecerá teniendo en cuenta el balance riesgo beneficio para la paciente.
Advertencias y precauciones especiales de uso: Durante el tratamiento a largo plazo con dosis elevadas, pueden presentarse efectos sistémicos característicos de los glucocorticoides como hipercortisolismo, supresión suprarrenal y/o retraso del crecimiento en los niños. No se han establecido los efectos a largo plazo de los esteroides nasales en niños. El tratamiento con medicamentos a base de cortisona puede conducir a un retraso del crecimiento. Se recomienda vigilar regularmente la estatura de los niños y adolescentes que reciben un tratamiento a largo plazo con corticosteroides, independientemente de la forma de administración. Si se sospecha de un retraso del crecimiento, éste debe investigarse. Los beneficios del tratamiento con glucocorticoides deben sopesarse con respecto a los posibles riesgos de inhibición del crecimiento.
Se requiere precaución al tratar a pacientes con micosis o herpes nasales.
En los pacientes que cambian de un tratamiento con glucocorticoides sistémicos a RHINOCORT® AQUA, se recomienda precaución si se sospecha de trastornos del eje hipotálamo-hipófisis-suprarrenales. En tales pacientes, la dosis del esteroide sistémico debe reducirse cuidadosamente y debe considerarse la posibilidad de efectuar pruebas de la función del eje hipotálamo-hipófisis-suprarrenales. Dichos pacientes también pueden necesitar la adición de esteroides sistémicos durante periodos de estrés, como por ejemplo en caso de una intervención quirúrgica, un traumatismo, etc.
La insuficiencia hepática severa afecta la farmacocinética de la budesonida administrada por vía oral, provocando una disminución de la velocidad de eliminación y un aumento de la disponibilidad sistémica. Puede ser necesario tomar en cuenta los posibles efectos sistémicos.
Los pacientes con tuberculosis pulmonar pueden necesitar una atención especial.
RHINOCORT® AQUA no debe entrar en contacto con los ojos. Si esto sucediera, enjuagar inmediatamente con agua.
Debe evitarse el tratamiento concomitante con el ketoconazol u otros inhibidores potentes de la CYP3A4. Si esto es imposible, debe dejarse un intervalo de tiempo lo más largo posible entre las administraciones de los medicamentos (véase Interacciones con otros medicamentos y otras formas de interacción).
EMBARAZO Y LACTANCIA
Embarazo: Los datos de más de 2000 embarazos no indican una elevación del riesgo de malformaciones en general con la administración de RHINOCORT® AQUA. Con respecto a la incidencia prevista, se ha detectado un pequeño aumento de las malformaciones cardiacas menores en niños cuyas madres habían recibido RHINOCORT® AQUA al principio de la gestación; sin embargo, se considera improbable que exista alguna relación de causa y efecto con la exposición.
Durante el embarazo, el objetivo debe ser administrar la mínima dosis de RHINOCORT® AQUA que sea eficaz, durante el periodo terapéutico más corto posible.
Lactancia: La budesonida se secreta en la leche materna. Sin embargo, no se prevén efectos en el lactante con las dosis terapéuticas de RHINOCORT® AQUA. Por lo tanto, RHINOCORT® AQUA puede usarse durante la lactancia.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: RHINOCORT® AQUA no afecta la capacidad para conducir o utilizar máquinas.
EFECTOS INDESEABLES: Se estima que alrededor de 5% de los pacientes tratados presentarán efectos secundarios consistentes en irritación local.
En la siguiente tabla, las reacciones adversas aparecen clasificadas por sistema/órgano y por categoría de frecuencia: frecuentes (=1/100, <1/10), poco frecuentes (=1/1000, <1/100), raras (=1/10000, <1/1000), muy raras (<1/10000).
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Irritación local, epistaxis, secreción nasal hemorrágica leve |
|
Muy raros |
Perforación del tabique nasal, ulceración de las mucosas |
|
|
Trastornos del sistema inmunitario |
Poco frecuentes |
Edema angioneurótico, urticaria, dermatitis, exantema, prurito |
|
Muy raros |
Reacción anafiláctica |
Se han notificado reacciones de hipersensibilidad inmediata o diferida, que han incluido urticaria, exantema, dermatitis, edema angioneurótico y prurito.
En casos muy raros, el uso de esteroides por vía nasal ha provocado ulceración de la mucosa y perforación del tabique nasal. No es clara la causa de estos efectos secundarios (el esteroide en sí, la enfermedad subyacente u otros factores).
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: La administración oral de 200 mg de ketoconazol una vez al día aumentó en promedio seis veces las concentraciones plasmáticas de budesonida administrada simultáneamente por vía oral (3 mg en una dosis única). Al administrar el ketoconazol 12 horas después de la budesonida, la concentración aumentó en promedio tres veces. Se carece de información sobre esta interacción con la budesonida nasal, pero se prevé también un aumento importante de las concentraciones plasmáticas. Dado que por falta de información resulta imposible recomendar una dosis para la administración nasal, debe evitarse esta asociación. Si esto es imposible, el intervalo de tiempo entre la administración del ketoconazol y la budesonida debe ser lo más largo posible. También debe considerarse la reducción de la dosis de budesonida. Otros inhibidores potentes de la CYP3A4 también podrían provocar un aumento pronunciado de las concentraciones plasmáticas de budesonida.
DATOS PRECLÍNICOS SOBRE LA SEGURIDAD: Los estudios convencionales de toxicidad general, genotoxicidad y potencial carcinógeno no han revelado riesgos especiales para el ser humano. Los estudios de reproducción en animales han demostrado que los corticosteroides como la budesonida inducen malformaciones de distintos tipos (palatosquisis, malformaciones del esqueleto). Sin embargo, estos resultados experimentales en animales no parecen revestir importancia en el ser humano al utilizar las dosis recomendadas de RHINOCORT® AQUA.
Lista de excipientes: Celulosa microcristalina, carboximetil celulosa sódica, glucosa anhidra, polisorbato 80, edetato disódico, sorbato de potasio (E 202), ácido clorhídrico, agua purificada.
La cantidad del conservante E 202 (sorbato de potasio) es de 1.2 mg/ml en las dos concentraciones del producto.
Plazo de caducidad: Véase la fecha de caducidad en la etiqueta o en la caja de cartón.
Precauciones especiales de conservación: No conservar a más de 30 °C. No congelar.
Naturaleza y contenido del envase: Frascos de vidrio de color café equipados con una bomba de aerosol y un aplicador nasal.
Tamaño del envase:Véase la caja de cartón.
INSTRUCCIONES DE USO, MANIPULACIÓN Y ELIMINACIÓN: Lea esta información antes de utilizar el aerosol nasal RHINOCORT® AQUA y siga estrictamente las instrucciones.
Antes de usar RHINOCORT® AQUA por primera vez, el medicamento debe cargarse en el aplicador nasal. Para ello, agite el envase y accione la bomba hacia el aire hasta obtener un aerosol uniforme. El efecto de esta operación dura aproximadamente 24 horas. Si transcurre más tiempo antes de la aplicación de la siguiente dosis, debe volver a cargar el medicamento en el aplicador nasal. Esta vez, basta accionar la bomba una (1) sola vez hacia el aire.
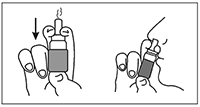
1. Suénese la nariz.
Agite el envase.
Retire la tapa protectora de color café.
2. Sostenga el envase como muestran las ilustraciones.
3. Introduzca la punta en un orificio nasal y aplique el número de dosis prescritas. Administre el aerosol en el otro orificio nasal de la misma manera.
4. Vuelva a poner la tapa protectora de color café. No use el aerosol nasal RHINOCORT® AQUA más veces de las prescritas.
Niños: Los niños solo deben usar el aerosol nasal RHINOCORT® AQUA bajo la supervisión de un adulto para garantizar una administración correcta y para que la dosis corresponda a la prescripción del médico.
Limpieza: Limpie regularmente las piezas de plástico superiores. Retire la tapa protectora café y levante el aplicador nasal blanco. Lave las piezas de plástico con agua tibia. Espere a que las piezas de plástico se sequen perfectamente al aire antes de instalarlas nuevamente.
POSOLOGÍA Y VÍA DE ADMINISTRACIÓN: La posología debe ajustarse individualmente.
Rinitis
Adultos y niños mayores de 6 años: La dosis inicial recomendada es de 256 microgramos al día. La dosis puede administrarse una vez al día por la mañana o dividirse en dos aplicaciones en la mañana y en la noche. Esto corresponde a 128 microgramos (2 x 64 microgramos) en cada orificio nasal por la mañana, o bien, 64 microgramos en cada orificio nasal por la mañana y la noche.
No se ha observado un efecto adicional con dosis diarias superiores a 256 microgramos.
La posología para los pacientes de edad avanzada es la misma que para los adultos.
Cuando se haya obtenido el efecto clínico deseado, la dosis debe reducirse hasta la mínima necesaria para controlar los síntomas. Los estudios clínicos muestran que una dosis de 32 microgramos en cada orificio nasal por la mañana puede ser suficiente para algunos pacientes.
En algunos pacientes se consigue un alivio sintomático en tan solo 5 a 7 horas después de empezar el tratamiento. El efecto máximo se obtiene solamente después de varios días de tratamiento (en casos raros, no antes de 2 semanas). Por lo tanto, si es posible, el tratamiento de la rinitis alérgica estacional debe empezar antes de la exposición a los alergenos.
En caso de congestión nasal severa, puede ser necesario añadir un vasoconstrictor.
En algunos casos puede ser necesario un tratamiento complementario para combatir los posibles síntomas oftalmológicos provocados por la alergia.
Tratamiento sintomático y prevención de pólipos nasales: La dosis recomendada es de 256 microgramos al día. La dosis puede administrarse una vez al día por la mañana o dividirse en dos aplicaciones por la mañana y la noche. Una vez que se haya obtenido el efecto clínico deseado, la dosis de mantenimiento debe reducirse hasta el nivel mínimo necesario para controlar los síntomas.
Instrucciones para utilizar correctamente RHINOCORT® AQUA: Es importante recomendar al paciente que lea detenidamente las Instrucciones de uso, manipulación y eliminación.
SOBREDOSIS: Se prevé que una sobredosis aguda de RHINOCORT® AQUA, incluso con dosis elevadas, no causará problemas clínicos. Si se utilizan dosis elevadas de RHINOCORT® AQUA durante un periodo prolongado, pueden surgir efectos sistémicos característicos de los glucocorticoides tales como hipercortisolismo y supresión suprarrenal.
PRESENTACIONES COMERCIALES: RHINOCORT® AQUA 32 µg/dosis, frasco de vidrio por 120 dosis con válvula dosificadora especial (Reg. San. INVIMA 2009 M-012575 R2).
Venta con fórmula médica. Mantener fuera del alcance de los niños.
Clave: 1-2011 (2)- fuente.
Traducción de: RITA.000-049-703.4.0
Fecha de revisión del texto: Diciembre de 2010.
Fecha de preparación de la versión: Abril de 2011.
Las marcas registradas mencionadas son propiedad del grupo AstraZeneca.
©AstraZeneca 2003-2011.
AstraZeneca AB, Sördertälje, Suecia.
Mayor información Departamento Médico de
AstraZeneca Colombia, S.A.S.
Bogotá, D.C., Colombia