
RECORMON
ERITROPOYETINA HUMANA RECOMBINANTE
Solución inyectable
Caja , Jeringa(s) prellenada(s) , Solución inyectable
Caja , 6 Jeringas precargadas
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Principio activo: Epoetina beta (eritropoyetina humana recombinante, producida mediante tecnología de ADN recombinante en la línea celular CHO).
Recormon se presenta en forma de solución inyectable en jeringas precargadas.
Solución inyectable en jeringas precargadas:
30.000 UI = 250 microgramos de epoetina beta con 0,6 ml de solución inyectable
Excipientes: Todas las presentaciones contienen fenilalanina (hasta 5.0 mg por vial multidosis, 0.3 mg por jeringa precargada) (v. Advertencias y precauciones generales).
El disolvente utilizado para los viales contiene alcohol bencílico (hasta 40 mg por ampolla de disolvente multidosis) (v. Contraindicaciones).
INDICACIONES TERAPÉUTICAS: Recormon está indicado en:
En tratamiento de la anemia sintomática asociada a la insuficiencia renal crónica (IRC) en pacientes dializados.
El tratamiento de la anemia renal sintomática en pacientes todavía no dializados.
La prevención de la anemia de la prematuridad en recién nacidos con un peso al nacer de 750 a 1500 g y una edad de gestación inferior a 34 semanas.
El tratamiento de la anemia sintomática en pacientes adultos con enfermedades neoplásicas no mieloides que reciben quimioterapia.
El aumento de la producción de sangre autóloga en pacientes participantes en un programa de predonación.
Su uso en esta indicación debe sopesarse con el aumento descrito del riesgo de episodios tromboembólicos. En los pacientes con anemia moderada (Hb 10 - 13 g/dl [6.21 - 8.07 mmol/L], sin ferropenia) sólo se aplicará este tratamiento si no se dispone de sistemas para la conservación de sangre o éstos son insuficientes ante una intervención de cirugía mayor programada que requiera un gran volumen de sangre (4 o más unidades de sangre en las mujeres o 5 unidades o más en los varones).
USO EN POBLACIONES ESPECIALES: Embarazo: Los estudios en animales no indican que se produzcan efectos nocivos directos o indirectos en lo que respecta al embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal.
En cuanto a la epoetina beta, toda la información sobre seguridad con respecto a la exposición a NeoRecormon durante el embarazo procede de la experiencia poscomercialización. En una revisión de los datos de poscomercialización disponibles, no se evidenció ninguna asociación causal entre el tratamiento con NeoRecormon y efectos nocivos en el embarazo, el desarrollo embrionario o fetal o el desarrollo posnatal. Sin embargo, al no haber datos de estudios clínicos, se debe actuar con precaución cuando se prescriba a mujeres embarazadas.
Parto: Los estudios en animales no indican que se produzcan efectos nocivos directos o indirectos en el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal.
Toda la información sobre la seguridad de la exposición a la epoetina beta durante el parto se ha obtenido en la experiencia poscomercialización. No se han observado indicios de efectos nocivos en el parto. Sin embargo, al no haber datos de estudios clínicos, se debe actuar con precaución cuando se recete a mujeres embarazadas durante el parto.
Lactancia: La experiencia en la lactancia humana es solo limitada. La eritropoyetina endógena se excreta en la leche materna y se absorbe fácilmente en el tubo digestivo del recién nacido. La decisión de continuar o interrumpir la lactancia materna o de proseguir o retirar el tratamiento con epoetina beta debe tomarse teniendo en cuenta el beneficio de la lactancia materna para el niño y el beneficio del tratamiento con epoetina beta para la madre.
Uso en pediatría: Se han realizado ensayos clínicos de registro farmacéutico en niños y adolescentes con anemia debida a insuficiencia renal crónica y en neonatos para la prevención de la anemia debida a la prematuridad.
En la indicación de la anemia por insuficiencia renal crónica, NeoRecormon no debe usarse en lactantes (es decir, antes de los 2 años de edad) (v. Pautas posológicas especiales y Advertencias y precauciones generales).
En las indicaciones de la anemia en pacientes con cáncer que reciben quimioterapia y tratamiento para aumentar la cantidad de sangre autóloga, NeoRecormon no está indicado en la población pediátrica.
DATOS FARMACÉUTICOS:
Conservación: Consérvese en un refrigerador (2-8°C).
Las jeringas precargadas deben mantenerse en el envase externo para protegerlas de la luz.
Solución inyectable en jeringas precargadas: A efectos del uso ambulatorio, el paciente puede sacar el producto del refrigerador y conservarlo a temperatura ambiente (no superior a 25 ºC) durante un período único de hasta 3 días
PROPIEDADES FARMACOLÓGICAS: Se ha demostrado la eficacia biológica de la epoetina beta tras la administración intravenosa y subcutánea en diversos modelos in vivo en animales (ratas normales y urémicas, ratones con policitemia, perros). Después de administrar epoetina beta, el número de eritrocitos, la concentración de Hb y la cifra de reticulocitos aumentan, así como la velocidad de incorporación del 59Fe.
Se ha observado in vitro (cultivo de células esplénicas de ratón) un aumento de la incorporación de 3Htimidina en las células nucleadas eritroides del bazo tras la incubación con epoetina beta.
Las investigaciones en cultivos de células de médula ósea humanas mostraron que la epoetina beta estimula la eritropoyesis específicamente y que no afecta a la leucopoyesis. No se han detectado acciones citotóxicas de la epoetina beta en la médula ósea ni en células cutáneas humanas.
Después de administrar una dosis única de epoetina beta, no se observó ningún efecto en el comportamiento o la actividad locomotora en ratones ni en la función circulatoria o respiratoria en perros.
PROPIEDADES FARMACODINÁMICAS: La epoetina beta es idéntica en su composición de aminoácidos y carbohidratos a la eritropoyetina que se ha aislado en la orina de pacientes urémicos.
La eritropoyetina es una glucoproteína que estimula la formación de eritrocitos a partir de sus progenitores comprometidos. Actúa como factor estimulante de la mitosis y como hormona de diferenciación.
Mecanismo de acción: La eritropoyetina es una glicoproteína que, como factor de crecimiento, estimula fundamentalmente la formación de eritrocitos a partir de los progenitores comprometidos. Actúa como factor estimulante de la mitosis y hormona de diferenciación.
CONTRAINDICACIONES: Recormon está contraindicado en pacientes con: Hipersensibilidad conocida al principio activo o a cualquiera de los excipientes.
Hipertensión arterial mal controlada.
En la indicación “aumentar el rendimiento de la sangre autóloga”, Recormon no debe utilizarse en pacientes que hayan sufrido un infarto de miocardio o un accidente cerebrovascular en el mes anterior al tratamiento, que presenten angina de pecho inestable o en pacientes con riesgo aumentado de trombosis venosa profunda, como los que tengan antecedentes de enfermedad tromboembólica venosa.
Multidosis solamente: El disolvente contiene alcohol bencílico como conservante y, por tanto, no debe administrarse a lactantes o niños de hasta 3 años de edad.
INSTRUCCIONES ESPECIALES DE USO, MANIPULACIÓN Y ELIMINACIÓN:
Solución inyectable en jeringas precargadas
Incompatibilidades: Ante la ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
Instrucciones de uso y manipulación
¡Lávese primero las manos!
Extraiga una jeringa del envase y compruebe que la solución es límpida, incolora y no contiene prácticamente partículas visibles. Retire la cubierta protectora de la jeringa.
Extraiga una aguja del envase, conéctela a la jeringa y retire la cubierta de la aguja.
Expulse el aire de la jeringa y la aguja sosteniendo la jeringa verticalmente y presionando el émbolo con suavidad hacia arriba. Mantenga la presión del émbolo hasta que la jeringa contenga la cantidad de Recormon prescrita.
Limpie la piel en el lugar de la inyección con una toallita empapada en alcohol. Forme un pliegue de piel pellizcándola con el pulgar y el índice. Sujete el cuerpo de la jeringa por la parte más próxima a la aguja e inserte la aguja en la piel con un movimiento rápido y firme. Inyecte la solución de Recormon. Extraiga la aguja rápidamente y haga presión sobre el lugar de inyección con una gasa seca y estéril.
Este producto es únicamente para un solo uso.
Eliminación:
Los siguientes puntos deben adherirse estrictamente al uso y la eliminación de jeringas y otros objetos medicinales punzantes:
• Las agujas y jeringas no deben ser reutilizados.
• Coloque todas las agujas y las jeringas usadas en un contenedor de objetos punzantes (recipiente para desechos a prueba de punciones).
• Mantenga este contenedor fuera del alcance de los niños
• Depositar dichos recipientes usados en la basura debe ser evitado.
Elimine el recipiente completo conforme a las normas locales o según le indique el profesional sanitario que le atiende.
La emisión de productos farmacéuticos al medio ambiente debe reducirse al mínimo. Evítese tirar los medicamentos por los desagües o a la basura doméstica, y utilícense los sistemas de recogida disponibles localmente.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: NeoRecormon no influye o tiene una influencia insignificante en la capacidad para conducir y utilizar máquinas.
REACCIONES ADVERSAS: Ensayos clínicos: Según los resultados de ensayos clínicos en los que participaron 1725 pacientes, se prevé que aproximadamente el 8 % de los pacientes tratados con NeoRecormon presenten reacciones adversas.
Resumen tabulado de las reacciones adversas registradas en ensayos clínicos: Las reacciones adversas registradas en ensayos clínicos (tabla 1, tabla 2 y tabla 3) se enumeran por categoría de órgano, aparato o sistema del MedDRA. La correspondiente categoría de frecuencia de cada reacción adversa se basa en la siguiente convención: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1000 a <1/100), rara (≥1/10 000 a <1/1000), muy rara (<1/10 000).
— Pacientes con anemia debida a insuficiencia renal crónica
Las reacciones adversas más frecuentes (frecuente, 1-10%), en particular durante la fase inicial del tratamiento con NeoRecormon, son los eventos hipertensivos, incluidos la hipertensión, la crisis hipertensiva con o sin síntomas de tipo encefalopático (por ejemplo: cefalea y estado confusional, trastornos sensitivomotores ?como alteraciones del habla o trastorno de la marcha— hasta crisis tonicoclónicas). Estas elevaciones de la tensión arterial pueden producirse en pacientes normotensos o pueden consistir en un agravamiento de una hipertensión ya existente (v. Advertencias y precauciones generales).
Pueden producirse trombosis de la derivación arteriovenosa, sobre todo en pacientes con tendencia a la hipotensión y en los que hayan presentado complicaciones de la derivación (por ejemplo: estenosis, aneurismas) (v. Advertencias y precauciones generales). En la mayoría de los casos, se observa una reducción de los valores séricos de ferritina simultáneamente con un aumento de la Hb. Además, en casos aislados se han observado aumentos transitorios de las concentraciones de potasio y fosfato en suero.
En la siguiente tabla se presenta la incidencia de reacciones adversas en los ensayos clínicos. En la tabla se indica la diferencia en la frecuencia de eventos adversos entre los pacientes tratados con NeoRecormon y los sujetos de referencia.
|
Tabla 1: Reacciones adversas en pacientes con anemia debida a insuficiencia renal crónica, tratada con NeoRecormon |
|
|
Categoría de órgano, aparato o sistema |
Categoría de frecuencia |
|
Trastornos vasculares |
|
|
Hipertensión |
Frecuente |
|
Crisis hipertensiva |
Poco frecuente |
|
Trastornos del sistema nervioso |
|
|
Cefalea |
Frecuente |
|
Trastornos de la sangre y del sistema linfático |
|
|
Trombosis de una derivación |
Rara |
|
Trombocitosis |
Muy rara |
Pacientes con cáncer tratados con quimioterapia que presentan anemia sintomática: Los episodios hipertensivos son reacciones adversas frecuentes (1-10%), en especial durante la fase inicial del tratamiento.
En algunos pacientes se observa una reducción de los valores de hierro sérico.
Los estudios clínicos han evidenciado una mayor frecuencia de episodios tromboembólicos en los pacientes con cáncer tratados con Recormon que en los sujetos de control no tratados o tratados con placebo. En los pacientes tratados con Recormon, esta incidencia era del 7%, frente al 4% en los sujetos de control (“frecuente” en ambos casos); ahora bien, no se ha asociado a un aumento de la mortalidad tromboembólica en comparación con los sujetos de control.
En la tabla siguiente se presenta la incidencia de las reacciones adversas observada en los ensayos clínicos. Se indica la diferencia existente en la frecuencia de acontecimientos adversos entre los pacientes tratados con Recormon y los del grupo de control.
|
Tabla 2: Resumen de las reacciones adversas que se registraron en pacientes con cáncer tratados con quimioterapia y con anemia sintomática, tratada con NeoRecormon |
|
|
Categoría de órgano, aparato o sistema |
Categoría de frecuencia |
|
Trastornos vasculares |
|
|
Hipertensión |
Frecuente |
|
Trastornos de la sangre y del sistema linfático |
|
|
Evento tromboembólico |
Frecuente |
|
Trastornos del sistema nervioso |
|
|
Cefalea |
Frecuente |
— Pacientes participantes en un programa de predonación de sangre autóloga
Se ha señalado que los pacientes incluidos en un programa de predonación de sangre autóloga muestran una frecuencia ligeramente mayor de eventos tromboembólicos. Sin embargo, no se ha podido demostrar que exista una relación causal con el tratamiento con NeoRecormon.
En la siguiente tabla se presenta la incidencia de reacciones adversas observada en ensayos clínicos. En la tabla se indica la diferencia en la frecuencia de eventos adversos entre los pacientes tratados con NeoRecormon y los sujetos de referencia.
|
Tabla 3: Resumen de las reacciones adversas que se registraron en pacientes que se encontraban en un programa de predonación de sangre autóloga y recibieron tratamiento con NeoRecormon |
|
|
Categoría de órgano, aparato o sistema |
Categoría de frecuencia |
|
Trastornos del sistema nervioso |
|
|
Cefalea |
Frecuente |
— Recién nacidos prematuros:
Es muy frecuente que se produzca una caída de los valores de ferritina en suero (>10%) (v. Advertencias y precauciones generales).
— Todas las indicaciones:
Raramente (≥1/10 000 a ≤1/1000) pueden producirse reacciones cutáneas como erupción, prurito, urticaria o reacciones en la zona de inyección. En casos muy raros (≤1/10 000) se han notificado reacciones anafilactoides. Sin embargo, en estudios clínicos comparativos no se ha encontrado un aumento de la incidencia de hipersensibilidad.
En casos muy raros (≤1/10 000), sobre todo al comenzar el tratamiento, se han referido casos de síntomas gripales, como fiebre, escalofríos, cefalea, dolor en las extremidades, malestar general o dolor óseo. Estas reacciones fueron de naturaleza leve o moderada y disminuyeron al cabo de un par de horas o días.
Experiencia tras la comercialización: Las siguientes reacciones adversas se han identificado a partir de la experiencia o clase de órgano, aparato o sistema del MedDRA, y la estimación de la categoría de frecuencia correspondiente a cada reacción adversa se basa en la siguiente convención: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1000 a <1/100), rara (≥1/10 000 a <1/1000), muy rara (<1/10 000) y de frecuencia desconocida (no se puede calcular la frecuencia a partir de los datos disponibles).
|
Tabla 4: Reacciones adversas registradas en la experiencia poscomercialización |
|
|
Categoría de órgano, aparato o sistema |
Categoría de frecuencia |
|
Trastornos de la sangre y del sistema linfático |
|
|
Aplasia eritrocitaria pura1,2 |
Desconocida |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Síndrome de Stevens-Johnson/Necrólisis epidérmica tóxica2 |
Desconocida |
|
1 V. el apartado Advertencias y precauciones 2 No se puede calcular la tasa de incidencia ni la categoría de frecuencia a partir de los datos disponibles. |
|
Alteraciones analíticas: Las anomalías de laboratorio registradas en la farmacovigilancia tras la comercialización reflejan la experiencia obtenida en los ensayos clínicos (v. Advertencias y precauciones generales y Ensayos clínicos).
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: No se han realizado estudios específicos de interacciones clínicas.
La experiencia clínica no muestra ningún indicio de posibles interacciones de Recormon con otros medicamentos.
En experimentos con animales la epoetina no aumentó la mielotoxicidad de los medicamentos citostáticos, tales como etopósido, cisplatino, ciclofosfamida y fluorouracilo.
ADVERTENCIAS Y PRECAUCIONES: Advertencias y precauciones generales: Recormon debe utilizarse con precaución en presencia de anemia refractaria con exceso de blastos en transformación, epilepsia, trombocitosis o insuficiencia hepática crónica. De igual modo, debe comprobarse que el paciente no sufre una carencia de ácido fólico o vitamina B12, ya que reduciría la eficacia de Recormon.
Con objeto de asegurar una eritropoyesis eficaz, debe evaluarse el estado del hierro en todos los pacientes, antes del tratamiento y durante éste, pudiendo ser necesario un tratamiento con suplementos de hierro, que deberá realizarse siguiendo las directrices terapéuticas.
Recormon contiene fenilalanina como excipiente. Esto debe tenerse en cuenta en los pacientes con formas graves de fenilcetonuria.
Ausencia de efecto: Las razones más frecuentes de respuesta incompleta a los agentes estimulantes de la eritropoyesis (AEE) son la ferropenia y la inflamación crónica (por ejemplo, la debida a uremia o cáncer metastásico avanzado). Los siguientes trastornos pueden comprometer también la eficacia del tratamiento con AEE: pérdida hemática crónica, fibrosis de médula ósea, sobrecarga grave de aluminio debida al tratamiento de la insuficiencia renal, carencia de ácido fólico o vitamina B12 y hemólisis. Si se han descartado todos los trastornos citados y el paciente presenta una disminución súbita de la hemoglobina asociada a reticulocitopenia y anticuerpos antieritropoyetina, debe contemplarse un examen de la médula ósea para el diagnóstico de una posible aplasia eritrocitaria pura (AEP). Si se diagnostica una aplasia eritrocitaria pura, se debe retirar el tratamiento con epoetina beta y los pacientes no deben pasar a recibir ningún otro estimulante de la eritropoyesis.
Se ha descrito aplasia eritrocitaria pura causada por anticuerpos neutralizantes antieritropoyetina en asociación con el tratamiento con eritropoyetina, incluido Recormon. Se ha observado que estos anticuerpos presentan una reacción cruzada con todas las proteínas eritropoyéticas, por lo que en los pacientes con sospecha o presencia confirmada de anticuerpos neutralizantes contra la eritropoyetina no debe cambiarse el tratamiento a Recormon (v. Reacciones adversas).
Efectos sobre el crecimiento tumoral: Las epoetinas son factores de crecimiento que estimulan fundamentalmente la producción de eritrocitos. Los receptores de la eritropoyetina pueden expresarse sobre la superficie de diversas células tumorales. Como con todos los factores de crecimiento, existe la preocupación de que las epoetinas puedan estimular el crecimiento de cualquier tipo de neoplasia maligna.
Un estudio clínico controlado, en el que se administró epoetina beta a pacientes con cáncer de cabeza y cuello, ha puesto de manifiesto una supervivencia sin progresión locorregional inferior en pacientes tratados con epoetina beta. Otro estudio clínico en el cáncer de mama, diseñado para identificar un posible efecto positivo de la epoetina beta sobre la supervivencia global en comparación con los controles no tratados, no mostró efectos estadísticamente significativos en la supervivencia global ni en la progresión tumoral. Además, un metaanálisis de los datos de estudios clínicos controlados y aleatorizados con epoetina beta en el tratamiento de la anemia en pacientes con cáncer (12 estudios, 2.301 pacientes, incluidos los dos estudios antes mencionados) no reveló ningún efecto negativo estadísticamente significativo sobre la supervivencia o la progresión tumoral.
En pacientes con insuficiencia renal crónica (IRC) y pacientes con cáncer tratados con quimioterapia puede producirse un aumento de la tensión arterial (episodios hipertensivos) o un agravamiento de la hipertensión existente, sobre todo en casos de aumento rápido de la Hb. El aumento de la tensión arterial puede tratarse con fármacos antihipertensivos. Si las elevaciones tensionales no pueden controlarse con tratamiento farmacológico, se recomienda una interrupción transitoria del tratamiento con Recormon. En los pacientes con anemia renal se recomienda, sobre todo al principio del tratamiento, vigilar la tensión arterial regularmente, incluso entre las sesiones de diálisis. En los pacientes con IRC pueden producirse también crisis hipertensivas con síntomas de tipo encefalopático en pacientes que, por lo demás, tienen una tensión arterial normal o baja. Esto requiere la atención inmediata de un médico y cuidados intensivos médicos. Se debe prestar especial atención, como posible signo de alarma, a la aparición súbita de cefaleas de tipo migrañoso con dolor punzante.
La sobrecarga grave de aluminio debida al tratamiento de la insuficiencia renal puede comprometer la eficacia de Recormon.
En pacientes con insuficiencia renal crónica, con frecuencia es necesario aumentar la dosis de heparina durante la hemodiálisis en el curso del tratamiento con NeoRecormon, como resultado del aumento de la concentración de Hb. Si la heparinización no es óptima, se puede producir una oclusión del sistema de diálisis. En los pacientes con insuficiencia renal crónica en riesgo de presentar una trombosis de la derivación arteriovenosa, se debe considerar la revisión temprana de esta y la profilaxis de la trombosis mediante la administración de ácido acetilsalicílico, por ejemplo.
En los pacientes con insuficiencia renal crónica, puede producirse un aumento moderado y dependiente de la dosis de la cifra de plaquetas, dentro del intervalo normal, durante el tratamiento con NeoRecormon, sobre todo después de la administración intravenosa. Esta elevación remite en el transcurso del tratamiento continuado. Se recomienda vigilar la cifra de plaquetas regularmente durante las 8 primeras semanas de tratamiento.
En los pacientes que se encuentran en un programa de predonación de sangre autóloga puede haber un aumento de la cifra de plaquetas, principalmente dentro del intervalo normal. En consecuencia, se recomienda determinar la cifra de plaquetas al menos una vez por semana en estos pacientes. Se debe suspender el tratamiento con NeoRecormon si se produce un aumento del número de plaquetas superior a 150 × 109/l o si aumenta la cantidad de plaquetas hasta valores por encima del intervalo normal.
En cuanto al uso de NeoRecormon en un programa de predonación de sangre autóloga, deben considerarse las directrices oficiales sobre los principios de donación de sangre, en particular las siguientes:
— solo deben donar los pacientes con un hematocrito ≥ 33 % (Hb ≥11 g/dl [6,83 mmol/l]);
— se debe tener especial precaución con los pacientes que pesen menos de 50 kg;
— el volumen de sangre de una sola extracción no debe exceder de aproximadamente el 12 % del volumen sanguíneo calculado del paciente.
El tratamiento debe reservarse para los pacientes en los que se considere particularmente importante evitar la transfusión de sangre homóloga, teniendo en cuenta la evaluación de los riesgos y beneficios de dichas transfusiones.
En los pacientes que reciben tratamiento por una anemia de la prematuridad, puede producirse un ligero aumento del recuento plaquetario, en especial hasta el día 12-14 de vida, por lo que debe efectuarse una vigilancia regular de las plaquetas.
Pruebas de laboratorio: La cifra de plaquetas, el hematocrito y la concentración de Hb deben vigilarse a intervalos regulares en todos los pacientes.
En los pacientes con insuficiencia renal crónica, se han notificado elevaciones del potasio sérico en pacientes que recibían NeoRecormon, aunque no se ha determinado la causalidad. Ante una concentración de potasio elevada o en aumento, se considerará la interrupción de la administración de NeoRecormon hasta que la concentración se haya corregido.
Abuso farmacológico y dependencia: El uso inapropiado por personas sin anemia puede provocar un aumento excesivo de la Hb, que puede asociarse a complicaciones potencialmente mortales relacionadas con el sistema cardiovascular.
No se han notificado casos de dependencia cuando se utiliza la epoetina beta.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: El tratamiento con Recormon debe ser instaurado por médicos con experiencia en las indicaciones antes citadas. Como se han registrado reacciones anafilactoides en casos aislados, se recomienda administrar la primera dosis bajo supervisión médica.
Solución inyectable en jeringas precargadas: Las jeringas precargadas de Recormon están listas para el uso. Bajo ninguna circunstancia debe administrarse más de una dosis por jeringa; el producto es únicamente para un solo uso (v. Instrucciones especiales de uso, manipulación y eliminación).
Tratamiento de pacientes anémicos con insuficiencia renal crónica: La solución reconstituida puede administrarse por vía subcutánea o intravenosa. Si la vía elegida es la intravenosa, se inyectará la solución a lo largo de 2 minutos, aproximadamente; por ejemplo a los pacientes hemodializados a través de la fístula arteriovenosa al final de la diálisis.
En los pacientes no hemodializados debe preferirse siempre la administración subcutánea, con objeto de evitar la punción de venas periféricas.
En los pacientes con IRC, el objetivo del tratamiento es alcanzar un valor de Hb de 10-12 g/dL. No debe superarse una cifra de Hb de 12 g/dL. Si el aumento de la hemoglobina es superior a 2 g/dL (1,3 mmol/L) en 4 semanas, deberá contemplarse una reducción apropiada de la dosis. En presencia de hipertensión o de enfermedades cardiovasculares, cerebrovasculares o vasculares periféricas ya existentes, el aumento semanal de Hb y el valor diana de Hb deberán determinarse de forma individualizada, teniendo en cuenta el cuadro clínico. Debe mantenerse una vigilancia estrecha de los pacientes para garantizar la utilización de la dosis más baja posible de Recormon que proporcione un control adecuado de los síntomas de anemia.
El tratamiento con Recormon consta de dos fases.
1. Fase de corrección
— Administración subcutánea (todas las formas farmacéuticas):
La dosis inicial es de 3 x 20 UI/kg de peso por semana. Puede aumentarse la dosis cada 4 semanas en 3 x 20 UI/kg por semana si el incremento de la Hb no es suficiente (< 0,25 g/dL por semana).
La dosis semanal puede fraccionarse en dosis diarias.
— Administración intravenosa (polvo y disolvente para solución inyectable y jeringas precargadas únicamente):
La dosis inicial es de 3 x 40 UI/kg por semana. Al cabo de 4 semanas, puede aumentarse la dosis a 80 UI/kg (tres veces por semana). Si es preciso aumentarla de nuevo, deberá hacerse a razón de 20 UI/kg tres veces por semana, a intervalos mensuales.
Con ambas vías de administración, la dosis máxima no debe exceder de 720 UI/kg por semana.
2. Fase de mantenimiento:
Para mantener el valor diana de Hb de aproximadamente 10-12 g/dL, primero debe reducirse la dosis a la mitad de la previamente administrada. A continuación, se ajustará la dosis a intervalos de dos a cuatro semanas, de manera individualizada en cada paciente (dosis de mantenimiento). Si la administración es subcutánea, la dosis semanal puede administrarse en una inyección o fraccionarse en tres o siete dosis a la semana. Los pacientes que permanezcan estables con el régimen de una sola dosis semanal pueden pasar a una sola administración cada dos semanas. En este caso, puede ser necesario un aumento de la dosis.
Por lo general, el tratamiento con Recormon es de larga duración. Ahora bien, se puede interrumpir en cualquier momento en caso de necesidad. Los datos sobre la pauta de una vez a la semana se han obtenido de estudios clínicos con una duración del tratamiento de 24 semanas.
Tratamiento de la anemia sintomática en pacientes con cáncer que reciben quimioterapia: La solución reconstituida se administra por vía subcutánea; la dosis semanal puede administrarse en una única inyección o fraccionarse en 3-7 dosis semanales.
La dosis inicial recomendada es de 30.000 UI por semana (equivalentes a aproximadamente 450 UI/kg de peso por semana en un paciente de peso medio).
El tratamiento con Recormon está indicado cuando el valor de hemoglobina es ≤ 11 g/dL (6.83 mmol/L). El valor de hemoglobina no debe exceder de 13 g/dL (8.07 mmol/L) (v. 3.1.2 Estudios clínicos / eficacia).
Si al cabo de 4 semanas se ha elevado el valor de hemoglobina por lo menos en 1 g/dL (0.62 mmol/L), debe mantenerse la dosis utilizada. Si el valor de hemoglobina no se ha elevado por lo menos en 1 g/dL (0.62 mmol/L), debe considerarse una dosis semanal dos veces mayor. Si al cabo de 8 semanas no se ha elevado el valor de hemoglobina por lo menos en 1 g/dL (0.62 mmol/L), no es probable que haya respuesta y debe suspenderse el tratamiento.
El tratamiento debe mantenerse hasta 4 semanas después de finalizada la quimioterapia.
La dosis máxima no debe exceder de 60.000 UI por semana.
Una vez alcanzado el objetivo terapéutico en un paciente determinado, debe reducirse la dosis en un 25-50% para mantener la concentración de hemoglobina en ese nivel. Si es necesario, puede reducirse la dosis aún más con el fin de que la concentración de hemoglobina no supere los 13 g/dL.
Si el aumento de la concentración de hemoglobina en 4 semanas es superior a 2 g/dL (1.3 mmol/L), debe reducirse la dosis en un 25-50%.
Tratamiento para aumentar la cantidad de sangre autóloga: La solución reconstituida se administra por vía intravenosa, a lo largo de unos 2 minutos, o por vía subcutánea.
Recormon se administra dos veces por semana, durante 4 semanas. Cuando el hematócrito del paciente permita la donación de sangre, es decir, cuando sea ≥ 33 %, se administrará Recormon al final de la donación.
En ningún momento del tratamiento debe sobrepasarse un hematócrito del 48 %.
La dosis ha de determinarla el equipo quirúrgico en cada paciente, individualmente, a partir del volumen requerido de sangre predonada y de la reserva endógena de eritrocitos:
1. El volumen necesario de sangre predonada dependerá de la pérdida prevista de sangre, del uso de medios para conservarla y del estado físico del paciente. Este volumen debería ser el que se prevea que será suficiente para evitar transfusiones de sangre homóloga.
La cantidad requerida de sangre predonada se expresa en unidades, equivaliendo una unidad del nomograma a 180 ml de eritrocitos.
2. La capacidad de donar sangre depende fundamentalmente del volumen sanguíneo y del hematócrito basal del paciente. Una y otra variable determinan la reserva eritrocitaria endógena, la cual puede calcularse mediante la fórmula siguiente:
— Reserva eritrocitaria endógena = volumen sanguíneo (ml) x (hematócrito - 33) ÷ 100
— Mujeres: volumen sanguíneo (ml) = 41 (ml/kg) x peso corporal (kg) + 1200 (ml)
— Hombres: volumen sanguíneo (ml) = 44 (ml/kg) x peso corporal (kg) + 1600 (ml) (peso corporal ≥ 45 kg)
La indicación para un tratamiento con Recormon y, en su caso, la dosis única deben determinarse en función del volumen requerido de sangre predonada y la reserva endógena de eritrocitos, según los gráficos siguientes:
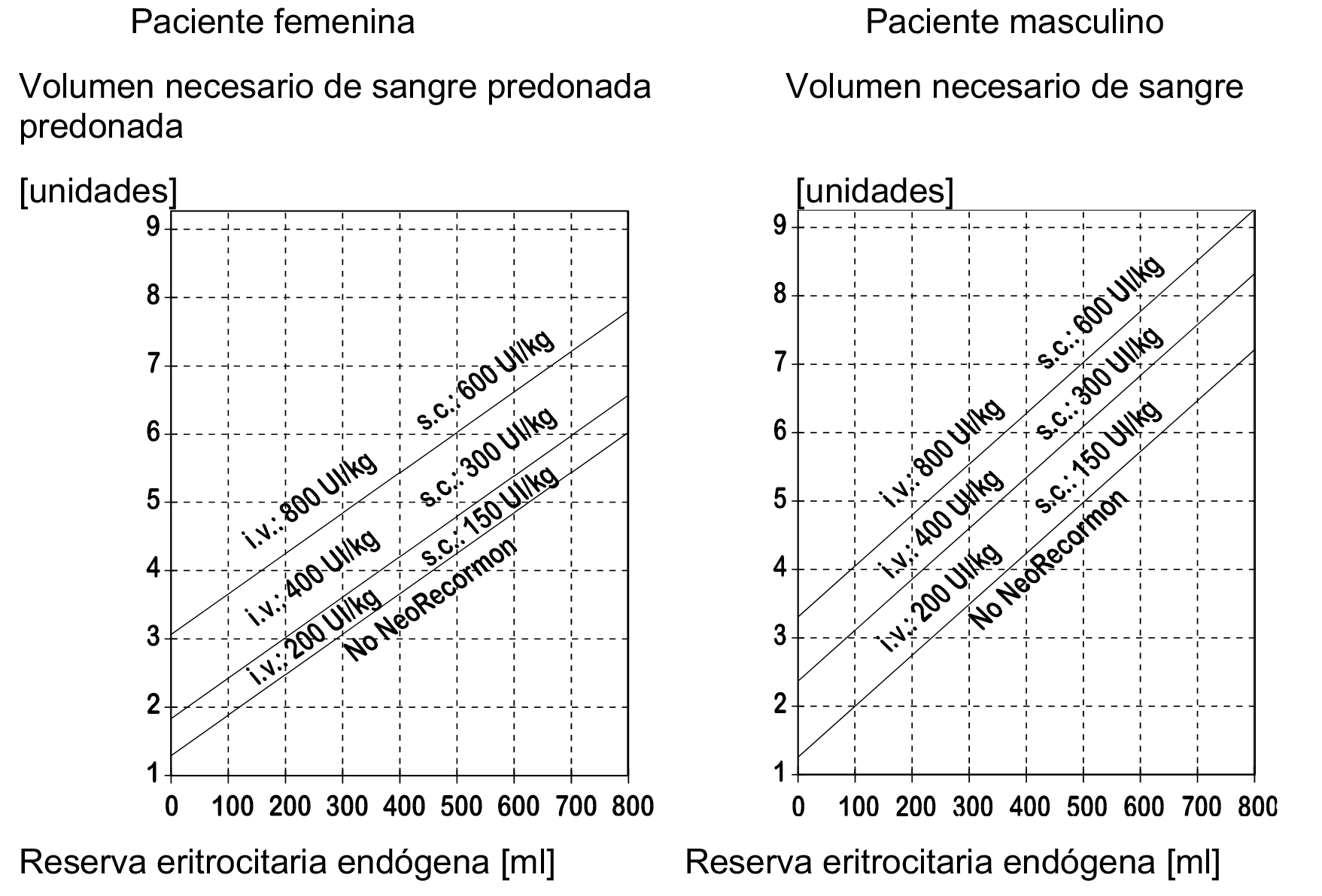
La dosis así determinada se administra dos veces por semana, durante 4 semanas. La dosis máxima no debe exceder de 1.600 UI/kg/semana por vía intravenosa o de 1200 UI/kg/semana por vía subcutánea.
Prevención de la anemia en los prematuros: Para esta indicación, solamente puede utilizarse la solución inyectable en jeringas precargadas.
La solución se administra por vía subcutánea en una dosis de 3 x 250 UI/kg de peso por semana. El tratamiento con Recormon debe iniciarse lo antes posible, preferiblemente en los tres primeros días de vida. En los recién nacidos prematuros que hayan recibido una transfusión antes de iniciar el tratamiento con Recormon no es probable que el efecto favorable sea tan alto como el observado en los recién nacidos que no han recibido ninguna transfusión. La duración del tratamiento debe ser de 6 semanas.
Pautas posológicas especiales
Uso en pedriatría: Los resultados de los estudios clínicos pediatrícos han demostrado que, en general, cuanto menor es la edad del paciente, mayores son las dosis de Recormon necesarias. No obstante, debe seguirse la pauta de administración recomendada, puesto que no es posible predecir la respuesta individual (v. Uso en pediatría).
Uso en geriatría: No se han realizado estudios específicos en geriátricos. Ahora bien, en los ensayos clínicos realizados con Recormon se incluyó un porcentaje importante de pacientes ancianos, sin que fueran necesarios ajustes especiales de la dosis en este grupo de edad.
Insuficiencia hepática: No se realizaron ensayos clínicos específicos en pacientes con insuficiencia hepática. No se dispone de pautas posológicas especiales.
SOBREDOSIS: El intervalo terapéutico de NeoRecormon es amplio, y se debe considerar la respuesta individual al tratamiento cuando se inicie su administración. La sobredosis puede dar lugar a manifestaciones de un efecto farmacodinámico exagerado, como una excesiva eritropoyesis, que puede asociarse a complicaciones relacionadas con el sistema cardiovascular potencialmente mortales. Si la concentración de Hb sea excesiva, se suspenderá temporalmente el tratamiento con NeoRecormon (v. Posología y forma de administración). Si está indicado desde el punto de vista clínico, se puede hacer una flebotomía.
PRESENTACIÓN: Recormon 30000UI/0,6mL: caja x 1 ó 4 jeringas precargadas. (Reg. San. No. INVIMA 2021MBT-0004029-R2)
Mayor información:
PRODUCTOS ROCHE, S. A.
Bogotá, Colombia
CDS 3.0 - Mayo 2018