
PREMARIN 0,3 MG / PREMARIN 0,625 MG / PREMARIN CREMA VAGINAL
ESTRÓGENOS CONJUGADOS
Crema vaginal
Caja , Tubo , Crema vaginal , 26 y 43 Gramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INDICACIONES:
PREMARIN® 0,3 mg Grageas y PREMARIN® 0,625 mg Grageas.
Tratamiento de síntomas vasomotores moderados a severos debidos a la menopausia.
Tratamiento de atrofia vaginal y vulvar debidas a la menopausia: Cuando se prescribe únicamente para tratamiento de los síntomas de la atrofia vulvar y vaginal, se debe considerar la utilización de productos vaginales de aplicación tópica.
Prevención de la osteoporosis posmenopáusica: Prevención de la osteoporosis posmenopáusica en mujeres con riesgo de futuras fracturas.1
Manejo de la osteoporosis posmenopáusica: Manejo de osteoporosis posmenopáusica en mujeres con riesgo de futuras fracturas.2
PREMARIN® Crema Vaginal
Tratamiento de la atrofia vaginal, vulvar o craurosis vulvar debidas a la menopausia.
Tratamiento de dispareunia moderada a severa, un síntoma de la atrofia vulvar y vaginal, debido a menopausia.
MECANISMO DE ACCIÓN: Los estrógenos endógenos son ampliamente responsables del desarrollo y mantenimiento del sistema reproductor femenino y de las características sexuales secundarias. Aunque los estrógenos circulantes existen en un equilibrio dinámico de interconversiones metabólicas, el estradiol es el estrógeno humano intracelular principal y es sustancialmente más potente que sus metabolitos, la estrona y el estriol, a nivel de receptores.
La principal fuente de estrógenos en mujeres adultas con ciclo normal es el folículo ovárico, que secreta 70 a 500 mcg de estradiol diariamente, dependiendo de la fase del ciclo menstrual. Después de la menopausia la mayoría de los estrógenos endógenos se producen mediante conversión de androstenediona, secretada por la corteza suprarrenal, en estrona en los tejidos periféricos. Así, la estrona y la forma conjugada en sulfato, el sulfato de estrona, son los estrógenos circulantes más abundantes en mujeres postmenopáusicas.
Los estrógenos actúan a través de uniones a receptores nucleares en tejidos con respuesta a estrógenos. A la fecha se han identificado dos receptores de estrógenos: Estos varían en proporción entre tejidos. Los estrógenos circulantes modulan la secreción de la pituitaria de gonadotropinas, hormona luteinizante (LH) y hormona estimulante del folículo (FSH), a través de un mecanismo de retroalimentación negativa. Los estrógenos actúan para reducir los niveles elevados de estas gonadotropinas presentes en mujeres posmenopáusicas.111,112
USO PEDIÁTRICO: No se ha establecido la seguridad y eficacia en pacientes pediátricos. El tratamiento con estrógenos en niñas en la prepubertad induce el desarrollo prematuro de las mamas, la cornificación vaginal y puede inducir hemorragia uterina.
Como las dosis grandes y repetidas de estrógeno durante periodos prolongados de tiempo aceleran el cierre epifisario, no se debe iniciar la terapia hormonal antes del cierre epifisario para no comprometer el crecimiento final.59
PREMARIN® Crema Vaginal no está indicada para niñas.
Uso geriátrico: No ha existido un número suficiente de mujeres geriátricas participando en estudios clínicos que utilicen PREMARIN® para determinar si la respuesta a PREMARIN® de las mayores de 65 años de edad difiere de las mujeres más jóvenes.
Estudio de la iniciativa de la salud para la mujer.
En el subestudio de la terapia con solo estrógenos de la Iniciativa de la Salud para la Mujer (WHI) (EC diarios [0,625 mg] versus placebo), existió un riesgo relativo mayor de accidente cerebrovascular en las mujeres mayores de 65 años de edad (ver Farmacodinámica y eficacia clínica).60
Estudio de la memoria de la iniciativa de salud para la mujer.
En el studio de la Memoria de la Iniciativa de Salud para la Mujer (WHIMS) con mujeres postmenopáusicas de 65 a 79 años de edad, no existió aumento del riesgo de desarrollar probable demencia en mujeres que recibían estrógeno solo cuando se comparaban con placebo. Se desconoce si este hallazgo aplica a mujeres postmenopáusicas más jóvenes (ver Demencia y Farmacodinámica y eficacia clínica).61
FARMACOCINÉTICA
Absorción: Los estrógenos conjugados son solubles en agua y se absorben bien en las vías gastrointestinales después de la liberación desde la fórmula del medicamento. La tableta de EC libera estrógenos conjugados lentamente durante varias horas. Las concentraciones plasmáticas máximas se obtiene aproximadamente 6-10 horas después de la administración de la tableta de EC. Los estrógenos generalmente se eliminan, de acuerdo con las necesidades, casi de forma paralela con un rango de vida media entre 10-20 horas, durante la corrección de las concentraciones endógenas.172
Distribución: La distribución de estrógenos exógenos es similar a la de los estrógenos endógenos. Los estrógenos se distribuyen a lo largo de todo el cuerpo y son generalmente encontrados en concentraciones mayores en los órganos objetivos de la hormona sexual. Los estrógenos circulan en la sangre unidos a la globulina de unión a hormonas (SHBG) y la albúmina.173
Metabolismo: Los estrógenos exógenos se metabolizan de la misma manera que los estrógenos endógenos. Los estrógenos circulantes existen en un equilibrio dinámico de interconversiones metabólicas. Estas transformaciones toman lugar principalmente en el hígado. El estradiol se convierte de forma reversible a estrona y ambos pueden ser convertidos a estriol que es el metabolito urinario mayor. Los estrógenos también experimentan recirculación enterohepática vía la conjugación en el hígado con sulfatos y la glucurónida, la secreción biliar de conjugados dentro del intestino, y la hidrólisis en el intestino seguida por la reabsorción. En mujeres posmenopáusicas, una proporción significativa de los estrógenos circulantes existen como conjugados sulfatados, especialmente el sulfato de estrona, que sirve como reserva circulante para la formación de más estrógenos activos.174
Excreción: El Estradiol, la Estrona y el Estriol se excretan en la orina, junto con la glucurónida y los conjugados sulfatados.175
Poblaciones especiales: No se realizaron estudios farmacocinéticos con poblaciones especiales, incluyendo mujeres con deterioro renal o hepático.
FARMACODINÁMICA Y EFICACIA CLÍNICA
Farmacodinámica: Actualmente no existen datos farmacodinámicos conocidos para los EC solos.
Efectos sobre síntomas vasomotores: En el primer año del estudio Salud y Osteoporosis, Gestágeno y Estrógeno (Health and Osteoporosis, Progestin and Estrogen) (HOPE), un total de 2805 mujeres posmenopáusicas (edad promedio 53,3+ 4,9 años) fueron asignadas de forma aleatoria a uno de los 8 grupos de tratamiento para recibir placebo o estrógenos conjugados, con o sin acetato de medroxiprogesterona. La eficacia para síntomas vasomotores fue evaluada durante las primeras 12 semanas de tratamiento en el subgrupo de mujeres sintomáticas (n=241) que tuvieron al menos siete sofocos al día de moderados a intensos, o al menos 50 sofocos de moderados a intensos durante la semana anterior a la asignación aleatoria. Con EC (tabletas de 0,3 mg, 0,45 mg y 0,625 mg), el alivio tanto de la frecuencia como de la severidad de los síntomas vasomotores moderados a intensos demostró ser estadísticamente significativo comparado con placebo a las semanas 4 y 12. Tabla 1.113
|
Tabla 1. Tabulación de resumen del número de sofocos por día – valores medios y comparación entre los grupos de tratamiento con ec y el grupo de placebo: mujeres con al menos 7 sofocos moderados a severos por día o al menos 50 por semana al inicio del estudio última observación considerada (locf)114 |
||||
|
Tratamiento (No. de mujeres) |
No. de Sofocos /Día |
|||
|
Periodo de Tiempo |
Inicio del Estudio |
Observado |
Media de |
Valores P vs. Placeboa |
|
0,625 mg EC |
||||
|
4 |
12,29 + 3,89 |
1,95 + 2,77 |
-10,34 + 4,73 |
< 0,001 |
|
12 |
12,29 + 3,89 |
0,75+ 1,82 |
-11,54 + 4,62 |
< 0,001 |
|
0,45 mg EC |
||||
|
4 |
12,25 + 5,04 |
5,04 + 5,31 |
-7,21 + 4,75 |
< 0,001 |
|
12 |
12,25 + 5,04 |
2,32 + 3,32 |
-9,93 + 4,64 |
< 0,001 |
|
0,3 mg EC |
||||
|
4 |
13,77 + 4,78 |
4,65 + 3,71 |
-9,12 + 4,71 |
< 0,001 |
|
12 |
13,77 + 4,78 |
2,52 + 3,23 |
-11,25 + 4,60 |
< 0,001 |
|
Placebo |
||||
|
4 |
11,69 + 3,87 |
7,89 + 5,28 |
-3,80 + 4,71 |
— |
|
12 |
11,69 + 3,87 |
5,71 + 5,22 |
-5,98 + 4,60 |
— |
|
a: Basado en el análisis de covarianza utilizando como factor el tratamiento y como covariable el valor al inicio del estudio. |
||||
Efectos sobre la atrofia vulvar y vaginal: Los resultados obtenidos para el índice de maduración vaginal en los ciclos 6 y 13 demostraron que para todos los grupos de tratamiento las diferencias con respecto al grupo de placebo fueron estadísticamente significativas (p < 0,001).115
Crema vaginal con EC: Efectos sobre la atrofia vaginal116, 117: Se realizó un estudio prospectivo aleatorizado doble ciego, controlado con placebo de 12 semanas, para comparar la seguridad y eficacia de dos regímenes con crema vaginal de estrógenos conjugados de 0,5 g [0,3 mg de estrógenos conjugados (EC)] administrados dos veces a la semana y 0,5 g (0,3 mg de EC) administrados secuencialmente durante 21 días con medicamento seguidos por 7 días de descanso con respecto a dos regímenes con placebo equivalentes para el tratamiento de síntomas severos a moderados de atrofia vulvar y vaginal debidos a menopausia. Después de la fase inicial doble ciega controlada con placebo de 12 semanas se siguió con una fase de etiqueta abierta para evaluar la seguridad endometrial hasta la semana 52. El estudio asignó aleatoriamente 423 mujeres posmenopáusicas con estado de salud general bueno entre 44 y 77 años de edad (media 57,8 años), que al inicio del estudio presentaron <5% de células superficiales en la citología vaginal, un pH vaginal >5,0 y que identificaron más de un síntoma molesto moderado a severo de la atrofia vulvar y vaginal. La mayoría (92,2 por ciento) de las mujeres eran de raza blanca (n=390); 7,8% eran de otra raza (n=33). En la semana 12 se evaluaron todas las mujeres para determinar el cambio medio en la mejoría con relación al inicio del estudio en las covariables de eficacia primaria: síntomas más molestos de atrofia vulvar y vaginal (definidos como síntomas moderados a severos que fueron identificados por las mujeres al inicio del estudio como los más molestos); porcentaje de células vaginales superficiales y porcentaje de células vaginales parabasales y pH vaginal.
En la fase doble ciega de 12 semanas, se observó un cambio medio estadísticamente significativo en el síntoma de dispareunia entre el inicio del estudio y la semana 12 para los regímenes de crema vaginal de estrógenos conjugados (0,5 g dos veces a la semana y 0,5 g diarios durante 21 días seguidos de 7 días de descanso) comparados con placebo; ver Tabla 2. Además se demostró que cada régimen de crema vaginal de estrógenos conjugados presentaba un aumento estadísticamente significativo en el porcentaje de células superficiales en la semana 12 cuando se comparaba con placebo (28% y 26%, respectivamente, comparados con 3% y 1% para el grupo de placebo respectivo), una disminución estadísticamente significativa en las células parabasales (-61 por ciento y -58 por ciento, respectivamente, comparado con -21% y -7% para los grupos de placebo respectivos) y una reducción media estadísticamente significativa entre el pH vaginal al inicio del estudio y en la semana 12 (-1,62 y -1,57 respectivamente, comparados con -0,36 y -0,26 para los grupos de placebo respectivos).118 En este estudio no se encontraron diferencias significativas entre crema vaginal con EC y placebo.119
En la semana 52 se evaluó la seguridad endometrial mediante biopsia endometrial en todas las mujeres asignadas aleatoriamente. Para las 155 mujeres (83 bajo el régimen 21/7, 72 bajo el régimen de 2 veces a la semana) que finalizaron el periodo de 52 semanas con seguimiento completo y para las que las biopsias endometriales eran evaluables, no se reportó hiperplasia endometrial o carcinoma endometrial.120
|
Tabla 2. Cambio medio en la severidad de la dispareunia comparada con placebo121 |
||||
|
Dispareunia* |
Crema vaginal con EC 0,5 g |
Placebo 0,5 g |
Crema vaginal con EC |
Placebo |
|
n Media (DE) |
n Media (DE) |
n Media (DE) |
n Media (DE) |
|
|
Inicio del Estudio |
52 2,43 (0,76) |
22 2,28 (1,04) |
50 2,26 (0,99) |
18 2,32 (0,88) |
|
Semana 12 |
52 0,88 (0,96) |
21 1,63 (1,16) |
50 0,77 (1,05) |
18 1,92 (1,03) |
|
Cambio en la Semana 12 con respecto al Inicio del Estudio |
52 -1,55 (0,92) |
21 -0,62 (1,23) |
50 -1,48 (1,17) |
18 -0,40 (1,01) |
|
Valor P vs. Placebo |
-0,001c |
-- |
-0,001d |
-- |
|
a. Crema Vaginal con EC dos veces/semana = aplicación de Crema Vaginal con EC dos veces a la semana b. Crema Vaginal con EC 21/7 = aplicación de Crema Vaginal con EC durante 21 días seguido de 7 días sin tratamiento c. Comparación de Crema Vaginal con EC dos veces/semana con placebo dos veces/semana d. Comparación de Crema Vaginal con EC 21/7 con placebo 21/7 * Escala de Evaluación de Síntomas: 0 (ninguno), 1 (leve), 2 (moderado), 3 (grave)122 |
||||
Efectos sobre la densidad mineral ósea
Estudio Salud y Osteoporosis, Gestágeno y Estrógeno (Health and Osteoporosis, Progestin and Estrogen) (HOPE): El estudio HOPE fue un estudio doble ciego, enmascarado, controlado por placebo/medicamento activo, multicéntrico con mujeres sanas, posmenopáusicas, de útero intacto. Para las mujeres (edad media de 53,3 + 4,9 años) habían transcurrido 2,3 + 0,9 años desde la menopausia y estaban tomando diariamente una tableta de 600 mg de calcio elemental (Caltrate).
Las mujeres que no tomaban complementos de Vitamina D fueron tratadas con EC 0,625 mg, 0,45 mg, 0,3 mg, o placebo. Se evaluó la prevención de la osteoporosis a través de la medición de la densidad mineral ósea (DMO), principalmente en la columna lumbar anteroposterior (L2 a L4). De forma secundaria, se analizaron también las mediciones de la DMO total corporal, el cuello femoral y el trocánter. En los ciclos 6, 13, 19 y 26 se utilizaron como marcadores de producción ósea la osteocalcina sérica, el calcio urinario y N-telopéptido urinario123
Mujeres con intención de tratar: Todos los grupos de tratamiento con el medicamento activo mostraron diferencias significativas de DMO con respecto al grupo de placebo para cada uno de los cuatro criterios de valoración de DMO en los ciclos 6, 13, 19, y 26. Los cambios en porcentaje desde el inicio del estudio hasta la evaluación final se presentan en la Tabla 3.124
|
Tabla 3. Cambio en porcentaje de la densidad mineral ósea: comparación entre los grupos con ec y el grupo de placebo en la población con intención de tratar, locf125 |
||||
|
Región Evaluada |
No. de Mujeres |
Inicio del Estudio |
Cambio desde el Inicio del Estudio (%) Media Ajustada + DE |
Valores de p vs. Placebo |
|
DMO de L2 a L4 |
||||
|
0,625 |
83 |
1,17 + 0,15 |
2,46 + 0,37 |
<0,001 |
|
0,45 |
91 |
1,13 + 0,15 |
2,26 + 0,35 |
<0,001 |
|
0,3 |
87 |
1,14 + 0,15 |
1,13 + 0,36 |
<0,001 |
|
Placebo |
85 |
1,14 + 0,14 |
-2,45 + 0,36 |
|
|
DMO total corporal |
||||
|
0,625 |
84 |
1,15 + 0,08 |
0,68 + 0,17 |
<0,001 |
|
0,45 |
91 |
1,14 + 0,08 |
0,74 + 0,16 |
<0,001 |
|
0,3 |
87 |
1,14 + 0,07 |
0,40 + 0,17 |
<0,001 |
|
Placebo |
85 |
1,13 + 0,08 |
-1,50 + 0,17 |
|
|
DMO de cuello femoral |
||||
|
0,625 |
84 |
0,91 + 0,14 |
1,82 + 0,45 |
<0,001 |
|
0,45 |
91 |
0,89 + 0,13 |
1,84 + 0,44 |
<0,001 |
|
0,3 |
87 |
0,86 + 0,11 |
0,62 + 0,45 |
<0,001 |
|
Placebo |
85 |
0,88 + 0,14 |
-1,72 + 0,45 |
|
|
DMO del trocánter femoral |
||||
|
0,625 |
84 |
0,78 + 0,13 |
3,82 + 0,58 |
<0,001 |
|
0,45 |
91 |
0,76 + 0,12 |
3,16 + 0,56 |
0,003 |
|
0,3 |
87 |
0,75 + 0,10 |
3,05 + 0,57 |
0,005 |
|
Placebo |
85 |
0,75 + 0,12 |
0,81 + 0,58 |
|
|
a: Identificados por la dosis (mg) de EC o placebo. |
||||
La Figura 1 muestra el porcentaje acumulativo de mujeres con cambios en la DMO de la columna desde el inicio del estudio iguales o mayores al valor presentado en el eje x.
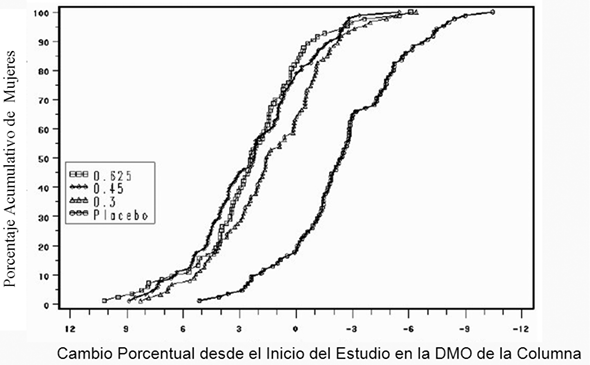
Figura 1. Porcentaje acumulado de las mujeres de los grupos de ec y placebo que presentaron cambios de la dmo en la columna vertebral de una magnitud específica o mayor con respecto al inicio del estudio126
La media de los cambios porcentuales con respecto al inicio del estudio para DMO en L2 a L4 para mujeres que completaron el estudio de densidad ósea se muestra en la Figura 2 en barras de error estándar por grupo de tratamiento. En los ciclos 6, 13, 19, y 26 se encontraron diferencias significativas entre cada uno de los grupos de dosis de EC y placebo.
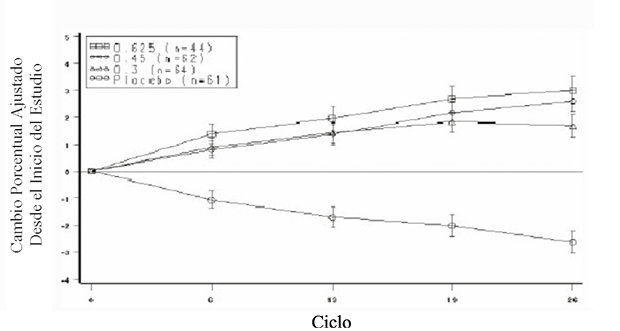
Figura 2. Cambio porcentual medio ajustado (se) para dmo en la columna desde el inicio del estudio para cada ciclo: mujeres en los grupos ec y placebo que completaron el estudio127
Los marcadores de producción ósea osteocalcina sérica y N-telopéptido urinario disminuyeron significativamente (p < 0,001) en todos los grupos de tratamiento con el medicamento activo en los ciclos 6, 13, 19, y 26 comparado con el grupo de placebo. Se observaron disminuciones medias mayores con respecto a los valores al inicio del estudio en los grupos activos que las observadas en el grupo de placebo. En el grupo de placebo se observaron con menos frecuencia diferencias significativas en el calcio urinario.128
Efectos sobre el hipogonadismo femenino
Tabletas de EC: En estudios clínicos sobre pubertad tardía debido a hipogonadismo femenino, el desarrollo de las mamas se indujo por dosis bajas de hasta 0,15 mg. La dosis puede titularse gradualmente de forma ascendente a intervalos de 6 a 12 meses como sea necesario para lograr el avance a la edad ósea apropiada y el cierre epifisario eventual. Los datos existentes sugieren que la dosis de 0,625 mg es suficiente para inducir menstruaciones cíclicas artificiales con un tratamiento de gestágeno secuencial y para mantener la densidad mineral ósea después de que se ha alcanzado la madurez ósea. 129,130,131,132,133
Estudios de la Iniciativa de Salud para la Mujer (WHI): La Iniciativa de Salud para la Mujer (WHI) incluyó en dos subestudios aproximadamente 27.000 mujeres posmenopáusicas predominantemente sanas para evaluar los riesgos y beneficios de los estrógenos conjugados (EC) [0,625 mg diarios] solos o combinados con acetato de medroxiprogesterona (AMP) [0,625 mg/2,5 mg diarios] comparados con placebo para prevenir algunas enfermedades crónicas. El criterio de valoración principal fue la incidencia de la cardiopatía coronaria (CC), definida como infarto de miocardio (IM) no mortal, IM silencioso y muerte por CC, con cáncer de mama invasivo como el principal pronóstico adverso. Un “índice global” incluyó la primera ocurrencia de CC, cáncer de mama invasivo, accidentes cerebrovascular, embolia pulmonar (EP), cáncer de endometrio (únicamente en el subestudio de EC más AMP), cáncer colorrectal, fractura de cadera o muerte por otras causas. El estudio no evalúo el efecto de los EC solos o de los EC más AMP sobre los síntomas menopáusicos.
Subestudio con estrógeno solo de WHI: El subestudio con estrógeno solo de WHI fue interrumpido tempranamente porque se observó un aumentó en el riesgo de accidente cerebrovascular y se consideró que no se podría obtener más información relacionada con los riesgos y beneficios del estrógeno sólo para los criterios de valoración primarios preestablecidos.
En la Tabla 4 se presentan los resultados del subestudio de estrógeno solo, que incluyó 10.739 mujeres (con edad promedio de 63 años, que variaba entre 50 y 79 años; 75,3% blancas: 15,1% negras; 6,1% hispánicas; 3,6% otras), después de un seguimiento promedio de 7,1 años.
En el subestudio con estrógeno sólo de WHI, no existieron efectos generales significativos sobre el riesgo relativo (RR) de CC (RR 0,95, intervalo de confianza nominal [ICn] del 95% 0,78-1,16);134 se reportó un RR de CC levemente elevado al comienzo del periodo de seguimiento y disminuyó con el paso del tiempo. No se reportó un efecto significativo sobre el RR de cáncer invasivo de mama (RR 0,80; ICn de 95% 0,62-1,04)135 o cáncer colorrectal (RR 1,08, Cn del 95%; 0,75-1,55).136 La utilización de estrógeno se asoció con el aumento estadísticamente significativo del riesgo de accidente cerebrovascular (RR 1,33, ICn de 95% 1,05-1,68)137 y trombosis venosa profunda (DVT) (RR 1,47, ICn de 95% 1,06-2,06).138 El RR de EP (Embolia Pulmonar) (RR 1,37, ICn de 95% 0,90-2,07),139 no aumentó significativamente. Con la utilización de estrógeno se reportó una reducción estadísticamente significativa del riesgo de fractura de cadera, vertebral y del total de fracturas [(RR 0,65, nCI del 95% 0,45-0,94), (RR 0,64, ICn de 95% 0,44-0,93), y (RR 0,71, ICn de 95% 0,64-0,80), respectivamente].140 El subestudio de estrógeno sólo no reportó un efecto estadísticamente significativo sobre la muerte debida a otras causas (RR 1,08, ICn de 95% 0,88-1,32)141 o un efecto sobre el riesgo de mortalidad total (RR 1,04, ICn de 95% 0,88-1,22).142 Estos intervalos de confianza no están ajustados para perspectivas múltiples y comparaciones múltiples.
|
Tabla 4. Riesgo relativo y absoluto observado en el subestudio con estrógeno solo de WHIa |
|||
|
Evento |
Riesgo Relativo EC vs. Placebo |
Placebo |
EC |
|
Riesgo Absoluto por 10.000 mujeres-año |
|||
|
Eventos CCc143 IM no mortalc144 Muerte por CCc145 |
0,95 (0,78-1,16) 0,91 (0,73-1,14) 1,01 (0,71-1,43) |
57 43 16 |
54 40 16 |
|
Todos los Accidentes Cerebrovascularesb146 |
1,33 (1,05-1,68) |
33 |
45 |
|
Accidente cerebrovascular isquémicoc147 |
1,55 (1,19-2,01) |
25 |
38 |
|
Trombosis venosa profundac,d148 |
1,47 (1,06-2,06) |
15 |
23 |
|
Embolia pulmonarc149 |
1,37 (0,90-2,07) |
10 |
14 |
|
Cáncer invasivo de mama c150 |
0,80 (0,62-1,04) |
34 |
28 |
|
Cáncer colorrectale151 |
1,08 (0,75-1,55) |
16 |
17 |
|
Fractura de caderac152 |
0,65 (0,45-0,94) |
19 |
12 |
|
Fracturas vertebralesc,d, 153 |
0,64 (0,44-0,93) |
18 |
11 |
|
Fracturas de antebrazo/muñecac,d154 |
0,58 (0,47-0,72) |
59 |
35 |
|
Fracturas totalesc,d155 |
0,71 (0,64-0,80) |
197 |
144 |
|
Muerte debida a otras causase,f, 156 |
1,08 (0,88-1,32) |
50 |
53 |
|
Mortalidad total c,d157 |
1,04 (0,88-1,22) |
75 |
79 |
|
Índice globalg158 |
1,02 (0.92-1,13) |
201 |
206 |
|
a Adaptado de varias publicaciones de WHI. Las publicaciones de WHI se pueden encontrar en www.nhlbi.nih.gov/whi. b Intervalos de confianza nominales no ajustados para perspectivas múltiples y comparaciones múltiples. c Los resultados se basan en datos asignados centralmente durante un seguimiento promedio de 7,1 años. d No incluido en el índice global e. Los resultados se basan en un seguimiento promedio de 6,8 años. f Todas las muertes, excepto las producidas por cáncer de mama o colorrectal, CC probable/confirmada, PE o enfermedad cerebrovascular. g.Un subconjunto de eventos fue combinado en un “índice global”, definido como la ocurrencia más temprana de eventos CC, cáncer invasivo de mama, accidente cerebrovascular, embolia pulmonar, cáncer colorrectal, fractura de cadera o muerte debida a otras causas. |
|||
La Tabla 5 presenta los principales resultados del subestudio de estrógeno sólo estratificados por edad al inicio del estudio.
|
Tabla 5. Resultados del Subestudio con Estrógeno Solo de la Iniciativa de Salud para la Mujer Estratificado por Edad al Inicio del Estudio |
|||||||
|
EDAD |
|||||||
|
Punto Final |
50-59 años |
60-69 años |
70-79 años |
||||
|
EC |
Placebo |
EC |
Placebo |
EC |
Placebo |
||
|
CC a,b,159 |
|||||||
|
Número de Casos |
21 |
34 |
96 |
106 |
84 |
77 |
|
|
Riesgo Absoluto (N)c |
17 |
27 |
58 |
62 |
98 |
88 |
|
|
Razón de Peligro (IC de 95%) |
0,63 (0,36-1,09) |
0,94 (0,71-1,24) |
1,13 (0,82-1,54) |
||||
|
Accidente Cerebrovascular b160 |
|||||||
|
Número de casos |
18 |
21 |
84 |
54 |
66 |
52 |
|
|
Riesgo Absoluto (N)c |
15 |
17 |
51 |
31 |
76 |
59 |
|
|
Razón de Peligro (IC del 95%) |
0,89 (0,47-1,69) |
1,62 (1,15-2,27) |
1,21 (0,84-1,75) |
||||
|
DVT b161 |
|||||||
|
Número de casos |
16 |
10 |
39 |
29 |
30 |
20 |
|
|
Riesgo Absoluto (N)c |
13 |
8 |
23 |
17 |
34 |
22 |
|
|
Razón de Peligrod (IC del 95%) |
1,64 (0,74-3,60) |
3,02 (1,51-6,06) |
4,54 (2,22-9,31) |
||||
|
VTE b162 |
|||||||
|
Número de casos |
20 |
15 |
54 |
43 |
37 |
28 |
|
|
Riesgo Absoluto (N)c |
16 |
12 |
32 |
25 |
42 |
31 |
|
|
Razón de Peligrod (IC del 95%) |
1,37 (0,70-2,68) |
2,82 (1,59-5,01) |
3,77 (2,07-6,89) |
||||
|
Embolia Pulmonarb163 |
|||||||
|
Número de casos |
12 |
8 |
28 |
17 |
12 |
14 |
|
|
Riesgo Absoluto (N)c |
10 |
6 |
17 |
10 |
14 |
16 |
|
|
Razón de Peligrod (IC del 95%) |
1,54 (0,63-3,77) |
2,80 (1,28-6,16) |
2,36 (0,96-5,80) |
||||
|
Cáncer Invasivo de Mama164 |
|||||||
|
Número de casos |
25 |
35 |
42 |
60 |
27 |
29 |
|
|
Riesgo Absoluto (N)c |
21 |
29 |
26 |
36 |
32 |
34 |
|
|
Razón de Peligro (IC del 95%) |
0,72 (0,43-1,21) |
0,72 (0,49-1,07) |
0,94 (0,56-1,60) |
||||
|
Cáncer Colorectal165 |
|||||||
|
Número de casos |
8 |
14 |
26 |
31 |
27 |
13 |
|
|
Riesgo Absoluto (N)c |
7 |
12 |
16 |
19 |
32 |
15 |
|
|
Razón de Peligro (IC del 95%) |
0,59 (0,25-1,41) |
0,88 (0,52-1,48) |
2,09 (1,08-4,04) |
||||
|
Fractura de Caderab166 |
|||||||
|
Número de casos |
5 |
1 |
9 |
20 |
32 |
52 |
|
|
Riesgo Absoluto (N)c |
4 |
1 |
5 |
12 |
37 |
52 |
|
|
Razón de Peligro (IC del 95%) |
5,02 (0,59-43,02) |
0,47 (0,22-1,04) |
0,64 (0,41-0,99) |
||||
|
Total Fracturasb167 |
|||||||
|
Número de casos |
153 |
173 |
220 |
348 |
167 |
240 |
|
|
Riesgo Absoluto (N)c |
126 |
139 |
132 |
201 |
191 |
269 |
|
|
Razón de Peligro (IC del 95%) |
0,90 (0,72-1,12) |
0,63 (0,53-0,75) |
0,70 (0,57-0,85) |
||||
|
Mortalidad Generalb168 |
|||||||
|
Número de casos |
34 |
48 |
129 |
131 |
134 |
113 |
|
|
Riesgo Absoluto (N) |
28 |
38 |
77 |
75 |
153 |
127 |
|
|
Razón de Peligro (IC del 95%) |
0,71 (0,46-1,11) |
1,02 (0,80-1,30) |
1,20 (0,93-1,55) |
||||
|
a CC se define como infarto del miocardio o muerte coronaria. |
|||||||
El momento de inicio de la terapia con estrógenos con relación al comienzo de la menopausia puede afectar el perfil general de riesgo-beneficio. El subestudio de estrógeno sólo de WHI estratificado por edad mostró en mujeres de 50-59 años de edad, una tendencia no significativa hacia la reducción del riesgo para CC y Mortalidad general comparada con el grupo de placebo en mujeres que iniciaron terapias con hormonas más pronto después del inicio de la menopausia que las que iniciaron terapia mucho después del momento de inicio de la menopausia.169
Estudio de la memoria realizado por la iniciativa de salud para la mujer: En el Estudio de la Memoria Realizado por la Iniciativa de Salud para la Mujer (WHIMS) con estrógeno solo, que es un estudio auxiliar de WHI, se incluyeron 2.947 mujeres posmenopáusicas y en su mayoría sanas sometidas a histerectomía de 65 o más años de edad (45 por ciento eran de 65 a 69 años de edad; 36 por ciento eran de 70 a 74 años de edad y 19 por ciento eran de 75 o más años de edad) para evaluar los efectos de los EC (0,625 mg) administrados diariamente sobre la incidencia de probable demencia (criterio de valoración principal) comparado con placebo.
Después de un seguimiento promedio de 5,2 años, el riesgo relativo de probable demencia para EC solo versus placebo fue 1,49 (IC de 95 por ciento: 0,83-2,66). El riesgo absoluto de probable demencia para EC sólo versus placebo fue 37 versus 25 casos por cada 10.000 mujeres-año. En la forma como se define en este estudio la demencia probable incluye la Enfermedad de Alzheimer (EA), demencia vascular (DVa) y los tipos de demencia combinados (que presentan características de EA y DVa). La clasificación más común de demencia probable en los grupos de tratamiento y con placebo fue la EA170 Como el estudio se realizó en mujeres entre 65 y 79 años de edad, se desconoce si estos hallazgos aplican a mujeres posmenopáusicas más jóvenes (ver Demencia y Uso geriátrico).171
CONTRAINDICACIONES
Embarazo o sospecha de embarazo (ver Embarazo).
Hemorragia uterina anormal sin diagnóstico
Cáncer de mama confirmado, antecedentes o sospecha del mismo, (excepto en mujeres apropiadamente seleccionadas que están siendo tratadas con tabletas por enfermedad metastásica).
Neoplasia estrógeno dependiente, conocida o sospechada (por ejemplo, cáncer endometrial, hiperplasia endometrial)
Enfermedad tromboembólica arterial activa o antecedentes de enfermedad tromboembólica arterial confirmada (por ejemplo accidente cerebrovascular, infarto del miocardio) o tromboembolia venosa (como por ejemplo tromboembolia venosa profunda, embolia pulmonar).
Disfunción o enfermedad hepática activa o crónica.
Trastornos trombofílicos conocidos (por ejemplo deficiencia de proteína C, proteína S o antitrombina).6,7,8,9
Hipersensibilidad a cualquier componente de este medicamento.
EMBARAZO: PREMARIN® no debe utilizarse durante el embarazo (ver Contraindicaciones).
LACTANCIA: La administración de estrógenos a madres lactantes ha demostrado disminuir la cantidad y la calidad de la leche materna. Cantidades detectables de estrógenos se han identificado en la leche materna de mujeres que recibieron el medicamento. Se debe tener precaución cuando se administra terapia estrogénica a madres lactantes.58
REACCIONES ADVERSAS: Las reacciones adversas están enumeradas en la Tabla de acuerdo con las categorías de frecuencias de los CIOMS.63
Muy común >10%
Común >1% y < 10%
Poco común >0.1% y < 1%
Raro 0.01% y < 0.1%
Muy Raro <0.01%
PREMARIN® 0,3 mg Grageas y PREMARIN® 0,625 mg Grageas
|
Sistema de órganos |
Reacción adversa |
|
Trastornos del sistema reproductivo y de la mama |
|
|
Común: |
Hemorragia uterina anormal, dolor en las mamas (mastalgia), aumento de la sensibilidad en las mamas, aumento del volumen y secreción, leucorrea.64 |
|
Poco Común: |
Cambios en el flujo menstrual y cambios en el ectropión cervical y secreción |
|
Raro: |
Dismenorrea, dolor pélvico, galactorrea y aumento del tamaño de los leiomiomas uterinos |
|
Muy Raro: |
Hiperplasia endometrial |
|
Desconocido |
Ginecomastia en hombres.65 |
|
Trastornos Gastrointestinales |
|
|
Poco Común: |
Náuseas, distensión abdominal y dolor abdominal |
|
Raro: |
Vómito, pancreatitis, colitis isquémica.66 |
|
Trastornos del Sistema Nervioso |
|
|
Poco Común: |
Mareo, dolor de cabeza, migraña, nerviosismo |
|
Raro: |
Accidentes cerebrovascular/apoplejía/”derrame”, exacerbación de la epilepsia |
|
Muy Raro: |
Exacerbación de la Corea67 |
|
Trastornos músculo esqueléticos, del tejido conectivo y de los huesos: |
|
|
Común: |
Artralgia, calambres en las piernas |
|
Trastornos psiquiátricos |
|
|
Poco Común: |
Cambios en la libido, alteración del humor, depresión y demencia68 |
|
Raro: |
Irritabilidad. |
|
Trastornos vasculares |
|
|
Poco común: |
Trombosis venosa69, embolia pulmonar70,71,72 |
|
Raro: |
Tromboflebitis superficial73 |
|
Trastornos generales y condiciones en el sitio de aplicación |
|
|
Poco Común: |
Edema |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Común: |
Alopecia |
|
Poco Común: |
Cloasma/ melasma, hirsutismo, prurito y erupción cutánea |
|
Muy Raro: |
Eritema multiforme, eritema nodular |
|
Trastornos hepatobiliares |
|
|
Poco común: |
Enfermedad vesiculobiliar74 |
|
Muy Raro: |
Ictericia colestática |
|
Infecciones e Infestaciones |
|
|
Poco Común: |
Vaginitis, incluyendo candidiasis vaginal |
|
Neoplasias benignas y malignas (incluyendo quistes y pólipos) |
|
|
Raro: |
Cáncer de mama, cáncer ovárico75, cambios fibroquísticos de las mamas76, potenciación del crecimiento de meningioma maligno. 77,78 |
|
Muy Raro: |
Cáncer endometrial, aumento de hemangiomas hepáticos79 |
|
Trastornos del sistema inmune |
|
|
Poco Común |
Hipersensibilidad.80 |
|
Muy Raro: |
Urticaria, angioedema,81 reacciones anafilácticas/anafilactoides, |
|
Trastornos de metabolismo y la nutrición |
|
|
Raro: |
Intolerancia a la glucosa |
|
Muy Raro: |
Exacerbación de la porfiria. Hipocalcemia (en mujeres con enfermedad que las pueda predisponer a hipocalcemia severa).82 |
|
Trastornos de los ojos |
|
|
Poco Común: |
Intolerancia a los lentes de contacto |
|
Muy Raro: |
Trombosis vascular retiniana |
|
Trastornos Cardíacos |
|
|
Raro: |
Infarto de miocardio83 |
|
Trastornos respiratorios, torácicos y mediastinales |
|
|
Raro: |
Exacerbación del asma |
|
Investigaciones |
|
|
Común: |
Cambios en el peso (aumento o disminución), Incremento de los triglicéridos84 |
|
Muy Raro: |
Incremento de la presión arterial |
PREMARIN® Crema Vaginal
Con la utilización de PREMARIN® Crema Vaginal se puede presentar absorción sistémica. Se deben tener en cuenta las reacciones adversas asociadas con PREMARIN® Grageas.
En un estudio aleatorizado doble ciego, controlado con placebo de 12 semanas, realizado con la crema vaginal de estrógenos conjugados (EC), un total de 423 mujeres posmenopáusicas recibieron al menos una dosis del medicamento del estudio y fueron incluidas en todos los análisis de seguridad: 143 mujeres en el grupo de tratamiento con Crema Vaginal con EC-21/7 (0,5 g de Crema Vaginal con EC diarios durante 21 días y 7 días de descanso) y 72 mujeres en el grupo correspondiente de tratamiento con placebo; 140 mujeres en el grupo de tratamiento con Crema Vaginal con EC 2 veces por semana (0,5 g de Crema Vaginal con EC dos veces a la semana) y 68 mujeres en el grupo correspondiente de tratamiento con placebo.85 Este estudio se continuó con una extensión de etiqueta abierta de 40 semanas, en la que un total de 394 mujeres recibieron tratamiento con Crema Vaginal con EC, entre las que se incluían las mujeres que al inicio del estudio fueron asignadas aleatoriamente a placebo. En este estudio no fueron encontradas diferencias estadísticamente significativas entre Crema Vaginal con EC y placebo.86
Las siguientes reacciones adversas se han reportado, ya sea con la crema vaginal de estrógenos conjugados o son efectos indeseables asociados con los estrógenos. No es posible calcular las frecuencias para estos eventos basados en los informes de las prescripciones para la exposición de las mujeres, ya que la dosis de la crema vaginal de estrógenos conjugados varía entre pacientes y el producto está disponible a nivel mundial en varias formas de presentación (diferentes tamaños).
|
Sistema de órganos |
Reacción adversa |
|
Sistema reproductivo y trastornos de las mamas |
|
|
Hemorragia por escape y manchado entre ciclos, dismenorrea/dolor pélvico,87 mastalgia, aumento de la sensibilidad en las mamas, aumento del volumen y secreción, reacciones locales en el sitio de aplicación o incomodidad vulvo-vaginal incluyendo sensación de ardor, irritación y prurito genital; secreción vaginal. Leucorrea,88 ginecomastia en hombres.89 Aumento del tamaño de los leiomiomas uterinos. Hiperplasia endometrial90 |
|
|
Trastornos gastrointestinales |
|
|
Náusea, vómito, distensión abdominal y dolor abdominal, pancreatitis. Colitis isquémica.91 |
|
|
Trastornos del sistema nervioso |
|
|
Mareo, cefalea, migraña, nerviosismo92, accidente cerebrovascular/ apoplejía/ derrame; exacerbación de Corea.93 |
|
|
Trastornos músculo esqueléticos, del tejido conectivo y de los huesos |
|
|
Artralgia, calambres en las piernas |
|
|
Trastornos psiquiátricos |
|
|
Cambios en la libido, alteración del humor,94 irritabilidad,95 depresión y demencia |
|
|
Trastornos vasculares |
|
|
Embolia pulmonar, trombosis venosa96 |
|
|
Trastornos generales y condiciones en el sitio de administración |
|
|
Edema |
|
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Alopecia, cloasma/melasma, hirsutismo, prurito, brote, eritema multiforme, eritema nodular |
|
|
Trastornos hepatobiliares |
|
|
Enfermedad vesiculobiliar, 97 ictericia colestática |
|
|
Infecciones e Infestaciones |
|
|
Vaginitis incluyendo candidiasis vaginal98, cistitis como síndrome. |
|
|
Neoplasias benignas y malignas (incluyendo quistes y pólipos) |
|
|
Cáncer de mama, cáncer de ovario99, cambios fibroquísticos de las mamas100, cáncer endometrial,101 aumento de hemangiomas hepáticos102. Potenciación de crecimiento de meningioma benigno. 103 |
|
|
Trastornos del sistema inmune |
|
|
Urticaria, angioedema,104 hipersensibilidad,105 reacciones anafilácticas/anafilactoides |
|
|
Trastornos de metabolismo y la nutrición |
|
|
Intolerancia a la glucosa, hipocalcemia (en mujeres con condiciones preexistentes de hipocalcemia). |
|
|
Trastornos de los ojos |
|
|
Intolerancia a los lentes de contacto Trombosis retinal vascular |
|
|
Trastornos Cardiacos |
|
|
Infarto del miocardio106 |
|
|
Investigaciones |
|
|
Cambios en el peso (aumento o disminución), aumento de los triglicéridos107, aumento en la presión arterial 106. |
|
|
Endocrino |
|
|
Pubertad precoz |
|
INTERACCIONES: Datos de un estudio de interacciones medicamentosas entre estrógenos conjugados y acetato de medroxiprogesterona indican que la disposición farmacocinética de ambos medicamentos no se altera cuando son coadministradas. Otros estudios clínicos de interacciones medicamentosas con otros medicamentos no se han realizado con estrógenos conjugados.
Estudios in vitro e in vivo han demostrado que los estrógenos son metabolizados parcialmente por el citocromo P450 3A4 (CYP3A4). Por lo tanto, los inductores o inhibidores de CYP3A4 pueden afectar el metabolismo de los estrógenos. Los inductores de CYP3A4, tales como preparaciones de la Yerba de San Juan (Hypericum perforatum), fenobarbital, fenitoína, carbamazepina, rifampicina y dexametasona pueden reducir la concentración plasmática de los estrógenos, resultando posiblemente en una reducción de los efectos terapéuticos y/o cambio en el perfil del hemorragia uterina. Los Inhibidores de CYP3A4, como por ejemplo cimetidina, eritromicina, claritromicina, ketoconazol, itraconazol, ritonavir y jugo de toronja, pueden incrementar las concentraciones plasmáticas de estrógeno y pueden producir efectos secundarios.
INTERFERENCIAS CON PRUEBAS DE LABORATORIO Y OTROS EXÁMENES DIAGNÓSTICOS
Interacciones con pruebas de laboratorio: Se puede presentar aceleramiento en el tiempo de protrombina, el tiempo parcial de protrombina, el tiempo de agregación plaquetaria; aumento en el conteo de plaquetas, aumento de los factores II, antígeno del factor VII, antígeno del factor VIII, actividad coagulante del factor VIII, complejos IX, X, XII, VII-X, complejo II-VII-X y betatromboglobulina; disminución en los niveles del antifactor Xa y antitrombina III, disminución de la actividad de antitrombina III, aumento en los niveles de fibrinógeno y de la actividad de fibrinógeno; aumento del antígeno plasminógeno y de su actividad.
Los estrógenos aumentan la globulina transportadora de hormona tiroidea (TBG) que produce aumento de la hormona tiroidea total circulante, medida por la proteína fijadora de yodo (PBI), los niveles de T4 por columna o por radioinmunoanálisis o niveles de T3 por radioinmunoanálisis, la captación por resina de T3 se disminuye, como reflejo de la TBG elevada. Las concentraciones libres de T4 y T3 permanecen inalteradas.
Otras proteínas fijadoras pueden presentar niveles séricos elevados, como por ejemplo, la globulina transportadora de corticosteroides (CBG) o la globulina transportadora de hormona sexual (SHBG), lo que produce aumento de corticosteroides y esteroides sexuales circulantes respectivamente. Las concentraciones de hormonas libres o biológicamente activas pueden reducirse.62 Otras proteínas plasmáticas pueden aumentar (angiotensinógeno /substrato de renina, a-1-antitripsina, ceruloplasmina).
Aumento de las concentraciones plasmáticas de las subfracciones de colesterol HDL y HDL2, reducción de las concentraciones de colesterol LDL, aumento en los niveles de triglicéridos.
Afectación de la tolerancia a la glucosa.
Se puede reducir la respuesta a la metirapona.
PRECAUCIONES
Retención de líquidos: Debido a que los estrógenos pueden causar cierto grado de retención de líquidos, a las mujeres con condiciones que puedan ser influenciadas por este factor, tales como disfunción cardiaca o renal, se les debe asegurar una observación cuidadosa cuando se les prescriben estrógenos.
Hipertrigliceridemia: En el estudio Salud y Osteoporosis, Gestágeno y Estrógeno (HOPE por sus siglas en inglés) el porcentaje promedio de aumento en los triglicéridos séricos con relación al inicio del estudio después de un año de tratamiento con EC 0,625 mg, 0,45 mg y 0,3 mg comparado con placebo fueron 34,3; 30,2; 25,1 y 10,8 por ciento con respecto al inicio del estudio, respectivamente.37
Se debe tener prcaución en mujeres con hipertrigliceridemia preexistente, ya que se ha informado de casos poco frecuentes de grandes aumentos en los triglicéridos plasmáticos que producen pancreatitis, cuando se utiliza la terapia con estrógenos en este tipo de población.
Deterioro de la función hepática y antecedentes de ictericia colestática: Se debe tener precaución en mujeres con antecedentes de ictericia colestática asociada con la utilización de estrógenos en ocasiones anteriores o durante el embarazo, y si se presenta recurrencia debe descontinuarse el medicamento. Los estrógenos pueden ser metabolizados lentamente en pacientes con deterioro de la función hepática.38
Aumento de la tensión arterial: En un número reducido de informes de casos, se ha reportado un aumento sustancial de la tensión arterial durante la TE, lo cual se ha atribuido a reacciones idiosincráticas a los estrógenos. En un estudio grande, aleatorizado y controlado con placebo no se pudo observar este efecto generalizado de la TE sobre la tensión arterial. 39, 40, 41, 42, 43, 44, 45
Exacerbación de otras condiciones: La terapia de estrógenos puede causar exacerbación de asma, epilepsia, migraña con o sin aura 46,47,48, otosclerosis 49,50, porfiria, lupus eritematoso sistémico y hemangiomas hepáticos 51 y debe utilizarse con precaución en mujeres con estas condiciones.
Con la administración de terapia de estrógenos se puede exacerbar la endometriosis. Se han reportado algunos casos de transformación maligna de implantes endometriales residuales en mujeres tratadas después de histerectomía con terapia de estrógenos solos. Se debe considerar la adición de gestágeno en las mujeres que se conoce tienen endometriosis residual después de histerectomía. 52,53
Hipocalcemia: Los estrógenos se deben utilizar con precaución en pacientes con enfermedad que predisponga a hipocalcemia severa.54
Hipotiroidismo: La administración de estrógenos lleva al incremento en los niveles de globulina transportadora de hormona tiroidea (TBG). Las pacientes que dependen de terapia de hormonas tiroideas, que están recibiendo estrógenos, pueden requerir aumento de la dosis de subterapia de reemplazo de hormonas tiroideas. Estas mujeres deberán tener bajo control su función tiroidea con el fin de mantener un rango aceptable en sus niveles de hormonas tiroideas libres 55 (ver Interferencias con pruebas de laboratorio y otros exámenes diagnósticos).
Controles de laboratorio: La administración de estrógenos se debe guiar con base en la respuesta clínica más que en los niveles hormonales (por ejemplo: Estradiol, FSH).
La siguiente subsección aplica únicamente a PREMARIN® Crema Vaginal
Condones de látex: La crema vaginal de EC ha mostrado debilitar los condones de látex. Se debe tener en cuenta el potencial de la crema vaginal para debilitar y contribuir a la falla de los condones, diafragmas o cubiertas cervicales hechos de látex o caucho.56,57
ADVERTENCIAS ESPECIALES
General
PREMARIN® crema vaginal: Con la utilización de la crema vaginal de estrógenos conjugados se puede presentar absorción sistémica. Las advertencias y precauciones asociadas con el tratamiento de estrógenos conjugados por vía oral deben tenerse en cuenta.
Terapia combinada de estrógenos-gestágeno: Existen riesgos adicionales y/o aumento de los riesgos asociados con la utilización de la terapia combinada de estrógenos y un gestágeno en comparación con la terapia de solo estrógenos. Estos riesgos incluyen el aumento en el riesgo del infarto de miocardio, embolia pulmonar, cáncer de mama invasivo y cáncer de ovario.10,11,12,13
Riesgo cardiovascular: Con la TE se ha reportado un incremento en el riesgo de accidente cerebrovascular14 y trombosis venosa profunda (TVP).15
Los pacientes que presentan factores de riesgo de trastornos trombóticos deberán permanecer bajo estricta observación.
Los pacientes que están en riesgo de desarrollar migrañas con aura puede estar en riesgo de accidente cerebrovascular isquémico y deben mantenerse bajo observación cuidadosa.16
Accidente cerebrovascular: En el subestudio del WHI (Iniciativa de la salud en la Mujer), en la administración de solo estrógeno, se reportó un incremento estadísticamente significativo en el riesgo de accidente cerebrovascular en las mujeres de 50 a 79 años de edad que recibían EC (0,625 mg) diariamente comparado con las que recibían placebo (45 versus 33 por 10.000 mujeres/año). El incremento en el riesgo fue demostrado en el primer año y persistió.17
El análisis de subgrupos de mujeres de 50 a 59 años de edad sugirió que no existió aumento del riesgo de accidente cerebrovascular en las mujeres que recibían EC (0,625 mg) con respecto a las que recibían placebo (18 versus 21 por 10.000 mujeres/año).18
Si se sospecha u ocurre accidente cerebrovascular, deberá suspenderse inmediatamente la administración de PREMARIN® (ver Farmacodinámica y eficacia clínica).19
Tromboembolia venosa: En el subestudio con sólo estrógenos de la WHI, se reportó aumento estadísticamente significativo del riesgo de trombosis venosa profunda (TVP) (23 vs. 15 por 10.000 mujeres-año). Se reportó también aumento del riesgo de embolia pulmonar (EP) aunque no alcanzó significancia estadística. El aumento en el riesgo de tromboembolia venosa (TEV) (TVP y EP) fue demostrado durante los primeros dos años (30 vs. 22 por 10.000 mujeres-año).
Si un episodio de tromboembolia venosa ocurre o se sospecha, se debe descontinuar inmediatamente PREMARIN® (ver Farmacodinámica y eficacia clínica).20
Si se desarrollan anomalías visuales, suspenda PREMARIN® mientras espera el examen que permite determinar si existe pérdida repentina parcial o completa de la visión o inicio repentino de exoftalmía, displopía o migraña. Si el examen revela papiledema o lesiones vasculares retinianas, PREMARIN® deberá interrumpirse. La trombosis vascular retiniana se ha reportado en pacientes que reciben estrógenos con o sin gestágenos. 21,22,23,24,25,26
Si es posible, PREMARIN® debe descontinuarse al menos cuatro a seis semanas antes de una cirugía con la que se asocia mayor riesgo de tromboembolia, o durante periodos de inmovilización prolongada.
Neoplasias malignas
Cáncer endometrial: La utilización de estrógenos sin oposición en mujeres con el útero intacto se ha asociado con aumento del riesgo de cáncer endometrial (ver Exacerbación de otras condiciones y Farmacodinámica y eficacia clínica)
El riesgo de cáncer endometrial informado entre las usuarias de estrógenos sin oposición es de 2 a 12 veces mayor que en las no usuarias, y parece depender de la duración del tratamiento y de la dosis del estrógeno. El mayor riesgo parece estar asociado con el uso prolongado, con un incremento de riesgo de 15 a 24 veces durante 5 a 10 años o más, y se ha demostrado que este riesgo persiste durante por lo menos 8 a 15 años después de que la TE se ha descontinuado. La adición de un gestágeno en la terapia estrogénica posmenopáusica ha demostrado reducir el riesgo de hiperplasia, que puede ser un precursor del cáncer endometrial (ver General).
Es muy importante la vigilancia clínica de todas las mujeres que toman estrógeno o combinaciones de estrógeno con gestágeno. Las medidas de diagnósticas adecuadas, deben efectuarse para descartar la malignidad en todos los casos de hemorragia uterina anormal recurrente o persistente, sin diagnóstico.
Cáncer de mama: Los estudios que involucraron la utilización de estrógenos en mujeres postmenopáusicas, han reportado resultados inconsistentes sobre el riesgo de cáncer de mama. El estudio clínico aleatorio más importante es la Iniciativa de Salud para la Mujer (WHI, por sus siglas en inglés) (ver Farmacocinética y Eficacia clínica). En este subestudio de estrógenos solos del estudio WHI, después de un promedio de 7.1 años de seguimiento, EC (0.625 mg por día) no fue asociado con un incremento en el cáncer de mama invasivo. 27 El análisis de los resultados de salud después de la intervención con EC a través de un promedio de 10,7 años de seguimiento demostró que el cáncer de mama invasivo en mujeres sometidas a histerectomía, asignadas aleatoriamente a EC con relación a placebo fue similar durante las fases de intervención y postintervención. Se observó una incidencia acumulada estadísticamente significativa menor de cáncer de mama de 0,27 por ciento (HR, 0,77; IC 95%, 0,62-0,95) en el grupo de EC (N=151) comparado con 0,35 por ciento en el grupo de placebo (N=199). 28
Algunos estudios observacionales han reportado un incremento del riesgo de cáncer de mama para la terapia de solo estrógenos después de muchos años de uso. El riesgo aumentó con la duración de la utilización, y pareció retornar a los valores iniciales aproximadamente cinco años después de finalizar el tratamiento.
Se ha reportado que la terapia de estrógenos produce un incremento de las mamografías anormales que requieren evaluaciones adicionales. 29
Cáncer ovárico: En algunos estudios epidemiológicos, la utilización de terapia de estrógenos, se ha asociado con aumento del riesgo relativo de cáncer ovárico después de múltiples años de utilización. Otros estudios epidemiológicos no han encontrado esas asociaciones.30
Demencia: El grupo de solo estrógeno en el Estudio de la Memoria de la Iniciativa de Salud para la Mujer (WHIMS por sus siglas en inglés), un estudio complementario de WHI que incluyó mujeres postmenopáusicas entre 65-79 años de edad, reportó un riesgo relativo (RR) de demencia probable por estrógenos conjugados solos con respecto a placebo de 1,49 [RR 1,49 (IC 95% 0,83-2,66)] (ver Uso geriátrico y Farmacodinámica y eficacia clínica).31
Se desconoce si estos hallazgos aplican a mujeres postmenopáusicas jóvenes (ver Uso geriátrico).32
Enfermedad vesiculobiliar: Se ha informado aumento de 2 a 4 veces del riesgo de enfermedad vesiculobiliar que requiere cirugía en mujeres que reciben TE.
Inmunitario: Angioedema.
Los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema, particularmente en mujeres con angioedema hereditario. 33, 34, 35, 36
DOSIS Y ADMINISTRACIÓN: Siempre deberá evaluarse cuidadosamente los beneficios con respecto a los riesgos de la TE, incluida la posible aparición de riesgos durante terapia continua (ver Advertencias especiales). Los estrógenos con o sin gestágenos se deben prescribir a las dosis efectiva más baja y durante el periodo más corto consistente con las metas del tratamiento y los riesgos para cada mujer. Si se carece de datos para comparación, los riesgos de la TE deben asumirse similares a la de todos los estrógenos y las combinaciones de estrógeno/gestágeno.
Las mujeres deben ser reevaluadas periódicamente para determinar si el tratamiento de los síntomas continúa siendo necesario.
PREMARIN® Crema Vaginal
Síntomas vasomotores y/o atrofia vulvar o vaginal debidos a menopausia: Los productos vaginales tópicos se consideraran cuando el tratamiento es solamente para la atrofia vulvar y vaginal.3
En un estudio de 52 semanas utilizando crema vaginal de estrógenos conjugados sola (sin ningún progestágeno), 0,5 g dos veces a la semana o 3 semanas de aplicación continua y 1 semana de descanso, no se encontró evidencia de hiperplasia endometrial ni de carcinoma endometrial.4
PREMARIN® 0,3 mg y 0,625 mg.
Si se prescribe estrógeno a una mujer posmenopáusica con útero, podría ser apropiada la adición de un gestágeno, (ver sección Neoplasia Maligna). En algunos casos, las mujeres histerectomizadas con antecedentes de endometriosis podrían necesitar un gestágeno (ver sección Exacerbación de otras condiciones).5
Las grageas se deben administrar enteras; no se deberán partir, aplastar, masticar o disolver en la boca.
Con base en la respuesta del paciente se pueden realizar ajustes a la dosis.
Prevención/manejo de la osteoporosis posmenopáusica: Se debe considerar la terapia en mujeres posmenopáusicas con riesgo de futuras fracturas y deberá iniciarse tan pronto como sea posible después del inicio de la menopausia.
SOBREDOSIS: Los síntomas en niños y adultos después de una sobredosis de productos que contienen estrógenos puede incluir náuseas, vómito, mastalgia, mareo, dolor abdominal, somnolencia/fatiga, en las mujeres se puede presentar metrorragia de privación. No existe un antídoto específico y en caso de que sea necesario el tratamiento debe ser sintomático. 110
DESCRIPCIÓN: Aplica a los estrógenos conjugados (EC).
PRESENTACIÓN: PREMARIN® 0.3 mg Grageas (Reg. San. INVIMA 2012M-0001070-R1). PREMARIN® 0.625 mg Grageas (Reg. San. INVIMA 2006M-006103- R1). PREMARIN® Crema vaginal (Reg. San. INVIMA 2009 M-012158-R1).
Basado en CDS v 27.0 de febrero 6 de 2012
ALMACENAMIENTO Y TIEMPO DE VIDA ÚTIL
PREMARIN® Crema vaginal: Almacenar a una temperatura no mayor a 30°C.
Vida útil: 2 años.
PREMARIN® Grageas 0.3 mg y 0.625 mg: Almacenar a una temperatura no mayor a 30°C.
Vida útil: 3 años.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá, D.C., Colombia.
REFERENCIAS
1. The Board of The International Menopause Society, Pines A, Sturdee DW, Birkhauser MH, Schneider HP, Gambacciani M, Panay N. IMS Updated Recommendations on postmenopausal hormone therapy. Climacteric. 2007 Jun;10(3):181-194.
2 The Board of The International Menopause Society, Pines A, Sturdee DW, Birkhauser MH, Schneider HP, Gambacciani M, Panay N. IMS Updated Recommendations on postmenopausal hormone therapy. Climacteric. 2007 Jun;10(3):181-194.
3 The North American Menopause Society. The role of local vaginal estrogen for treatment of vaginal atrophy in postmenopausal women: 2007 position statement of The North American Menopause Society. Menopause. 2007;14(3):357-369.
4 CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
5 Justification Document: Conjugated Estrogens: Endometriosis.
6 Justification Document: Estrogen-Progestin Combination Oral Contraceptives: Contraindication: Hereditary or acquired thrombophilias.
7 Rosendaal FR. Venous thrombosis: a multicausal disease. Lancet. 1999;353:1167-1173.
8 Rossouw JE, Cushman M, Greenland P, et al. Inflammatory, lipid, thrombotic, and genetic markers of coronary heart disease risk in the Women’s Health Initiative Trials of hormone therapy. Arch Intern Med. 2008;168(20):2245-2253.
9 Shifren JL, Schiff I. Role of hormone therapy in the management of menopause. Obstet Gynec. 2010;115(4):839-855.
10 Justification for a Safety Labeling Decision for Conjugated Estrogens: Ovarian cancer, 01-Aug-2007.
11 Cushman M, Kuller LH, Prentice R, et al. Estrogen plus progestin and risk of venous thrombosis. JAMA. 2004;292(13):1573-1580.
12 Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: The Women’s Health Initiative. Arch Intern Med. 2006;166:357-365.
13 Chlebowski RT, Hendrix SL, Langer RD, et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: The Women’s Health Initiative randomized trial. JAMA. 2003;289(24):3243-3253.
14 Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of conjugated equine estrogen on stroke in the Women’s Health Initiative. Circulation. 2006;113:2425-2434.
15 Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006 Apr 10;166:772-780.
16 Clinical Overview in Support of Estrogen-Containing Hormone Therapy Products CDS Revisions, 14-Apr-2011.
17 Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of conjugated equine estrogen on stroke in the Women’s Health Initiative. Circulation. 2006:113:2425-2434.
18 Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of
cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
19 Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of conjugated equine estrogen on stroke in the Women’s Health Initiative. Circulation. 2006:113:2425-2434.
20 Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006 Apr 10;166:772-780.
21 Kirwan JF, Tsaloumas MD, Vinall H, et al. Sex hormone preparations and retinal vein occlusion. Eye. 1997;11(1):53-56.
22 Risk factors for central retinal vein occlusion. The Eye Disease Case-Control Study Group. Archives of Ophthalmology. 1996;114(5):545-554.
23 Fraunfelder FT, Fraunfelder FW, Chambers, WA. Section 7 Hormones and Agents Affecting Hormonal Mechanisms. In: DRUG-INDUCED OCULAR SIDE EFFECTS. 1st ed. Philadelphia, PA: Elsevier Health Science Books; 2008:169-180.
24 Murray DC, Christopoulou D, Hero M. Combined central retinal vein occlusion and cilioretinal artery occlusion in a patient on hormone replacement therapy. British Journal of Ophthalmology. 2000:84(5):549-550.
25 Rousso DH, Rousso IH, Karayannis V, Klearchou N, Panidis D. Inferior temporal branch of the central retinal vein thrombosis associated with short-term estradiol valerate administration. Assisted Reproductive Technology/Andrology. 1997:9(1-2):75-78.
26 Anderson GL, Judd HL, Kaunitz AM, et al. Effects of estrogen plus progestin on gynecologic cancers and associated diagnostic procedures: The Women’s Health Initiative randomized trial. JAMA. 2003;290(13):1739-1748.
27 Stefanick ML, Anderson GL, Margolis KL, et al. Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. JAMA. 2006 April 12;295:1647-1657.
28 Clinical Overview. Estrogen-Containing Hormone Therapy Products Dec 2011 CO Justification for CDS Revisions.
29 Stefanick ML, Anderson GL, Margolis KL, et al. Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. JAMA. 2006 April 12;295:1647-1657.
30Justification for a Safety labeling decision for Conjugated Estrogens: Ovarian cancer, 01-Aug-2007.
31. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA 2004 Jun 23/30;291(24):2947-58.
32 Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA 2004 Jun 23/30;291(24):2947-58
33 Justification Document: Hypercalcemia.
34 The coronary drug project research group: The coronary drug project. Findings leading to discontinuation of the 2.5-mg/day estrogen group. JAMA 1973:652-657.
35 Binkley KE, Davis A, 3rd. Clinical, biochemical, and genetic characterization of a novel estrogen-dependent inherited form of angioedema. J Allergy Clin Immunol. 2000;106(3):546-550.
36 Bork K, Fischer B, Dewald G. Recurrent episodes of skin angioedema and severe attacks of abdominal pain induced by oral contraceptives or hormone replacement therapy. Am J Med. 2003;114(4):294-298.
37 Nzeako UC, Frigas E, Tremaine WJ. Hereditary angioedema: A broad review for clinicians. Arch Intern Med. 2001;161:2417-2429.
38 Justification for a safety labeling decision for Hormone Replacement Therapy: Angioedema, 13-Jan-2010.
39 Lobo RA, et al. Effects of lower doses of conjugated equine estrogen and medroxyprogesterone on plasma lipids and lipoproteins, coagulation factors and carbohydrate metabolism. Fert and Ster. 2001;76(1):13-24.
40 Tsuchiya Y, Makajima M, Tsuyoshi Y. Cytochrome P450-mediated metabolism of estrogen and its regulation in human. Cancer Letters 227(2005) 115-124.
41. The Writing Group for the PEPI Trial. Effects of Estrogen or Estrogen/Progestin Regimens on Heart Disease Risk Factors in Postmenopausal Women. JAMA. 1995;273(3):199-208.
42. Manson JE, Hsia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med. 2003;349(6):523-534.
43. Brownley KA, Hinderliter AL, West SG, et al. Cardiovascular effects of 6 months of hormone replacement therapy versus placebo: Differences associated with years since menopause. American Journal of Obstetrics & Gynecology. 2004;190:1052-1058.
44. Seely EW, Brosnihan KB, Jeunemaitre X, et al. Effects of conjugated oestrogen and droloxifene on the renin-angiotensin system, blood pressure and renal blood flow in postmenopausal women. Clinical Endocrinology. 2004;60:315-321.
45. Sumino H, Ichikawa S, Kumakura H, et al. Effects of hormone replacement therapy on office and ambulatory blood pressure in Japanese hypertensive postmenopausal women. Hypertens Res. 2003;26(5):369-376.
46. Tamama K, Sumino H, Ichikawa S, et al. Hormone replacement therapy causes a decrease in hepatocyte growth factor in hypertensive women. J Hypertens. 2003;21(6):1151-1156.
47.0 Ichikawa J, Sumino H, Ichikawa S, Ozaki M. Different effects of transdermal and oral hormone replacement therapy on the renin-angiotensin system, plasma bradykinin level, and blood pressure of normotensive postmenopausal women. Am J Hypertens. 2006;19(7):744-749.
48. MacGregor A. Estrogen replacement and migraine aura. Headache. 1999;39:674-678.
49.MacGregor EA. Estrogen replacement and migraine. Maturitas.2009;63:51-55.
50. Clinical Overview in Support of Estrogen-Containing Hormone Therapy Products CDS Revisions, 14-Apr-2011.
51. Karosi T, Sziklai I. Etiopathogenesis of otosclerosis. Eur Arch Otorhinolaryngol. 2010;267:1337–1349.
52. Horner KC. The effect of sex hormones on bone metabolism of the otic capsule – an overview.
Hearing Research.2009; 252:56–60.
53. Justification Document: Hepatic hemangiomas.
54. Justification document: Endometriosis.
55. Revised for consistency with Estrogen-Progestin Combination Hormone Therapy CDS.
56. Justification Document: Hypocalcemia.
57. Justification Document: Hypothyroidism.
58. Stewart D. Effect of Premarin vaginal cream on latex condoms (US). Wyeth-Ayerst GTR-22769, 1993.
59. Stewart D. Effect of Premarin vaginal cream on latex condoms (UK). Wyeth-Ayerst GTR-22770, 1993.
60. Gardner DK, Rayburn WF. Drug Therapy in Obstetrics and Gynecology. Drugs in Breast Milk. Connecticut. Appleton-Century-Crofts;1982. p.175-196.
61. Justification Document: Pediatric use.
62. Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of conjugated equine estrogen on stroke in the Women’s Health Initiative. Circulation. 2006;113:2425-2434.
63. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA 2004 Jun 23/30;291(24):2947-58.
64. Speroff L, Glass R, Kase N. Hormone biosynthesis, metabolism, and mechanism of action (Chap.2 ). In: Mitchell C, editor. Clinical Gynecologic Endocrinology and Infertility. 6th ed. Baltimore, MD: Lippincott Williams and Wilkins; 1999. p.45.
65. Cover Note Supporting Core Data Sheet: Determination of Frequencies, dated 13 Jun 2008.
66. Justification for a safety labeling decision for Conjugated Estrogens: Leukorrhea, 03 July 2007.
67. Justification for a safety labeling decision for Conjugated Estrogens: Gynecomastia in males, 17 July 2007.
68.Justification for a safety labeling decision for Conjugated Estrogens: Ischemic Colitis.
69. Justification for a safety labeling decision Conjugated Estrogens: Exacerbation of Chorea.
70. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA 2004 Jun 23/30;291(24):2947-58.
71. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
72. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
73. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
74. Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The women’s health initiative randomized controlled trial. JAMA. 2004;291(14):1701-1712.
75. Justification Document: Products Containing Conjugated Equine Estrogens: Adverse reactions: Superficial thrombophlebitis.
76. Hulley S, Furberg C, Barrett-Conner E, et al. Noncardiovascular disease outcomes during 6.8 years of hormone therapy. JAMA 2002;288(1):58-66.
77. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA 2004 Jun 23/30;291(24):2947-58.
78. Justification Document: Products Containing Conjugated Equine Estrogens: Adverse reactions: Fibrocystic breast changes.
79. Justification for a safety labeling decision for Conjugated Estrogens: Meningioma.
80. Jhawar BS, Fuchs CS, Colditz GA, Stampfer MJ. Sex steroid hormone exposures and risk for meningioma. J Neurosurg. 2003;99:848-853.
81. Justification Document: Hepatic hemangiomas.
82. Justification for a safety labeling decision for Conjugated Estrogens: Hypersensitivity.
83. Justification Document: Angioedema.
84. Justification Document: Conjugated estrogens and conjugated estrogens with medroxyprogesterone (MPA): Hypocalcemia, 03-July-2001.
85. Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: The Women’s Health Initiative. Arch Intern Med. 2006 Feb 13;166:357-365.
86. Justification Document: CONJUGATED ESTROGENS (all combinations): Adverse Reactions: Increased Triglycerides.
87. CSR-67635, Version 1.1. Interim Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
88. CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
89. Justification Document: Dysmenorrhea.
90. Justification for a safety labeling decision for Conjugated Estrogens: Leukorrhea.
91. Justification for a safety labeling decision for Conjugated Estrogens: Gyneomastia in males.
92. Justification Document: Conjugated Estrogens Vaginal Cream: Endometrial hyperplasia/endometrial cancer.
93.Justification for a safety labeling decision for Conjugated Estrogens: Ischemic Colitis.
94. Justification for a safety labeling decision for Conjugated Estrogens: Ischemic Colitis.
Justification Document: Conjugated Estrogens Vaginal Cream: Nervousness, Mood Disturbances, Irritability.
95. Justification for a safety labeling decision for Conjugated Estrogens: Exacerbation of Chorea.
96. Justification Document: Conjugated Estrogens Vaginal Cream: Nervousness, Mood Disturbances, Irritability.
97. Justification Document: Conjugated Estrogens Vaginal Cream: Nervousness, Mood Disturbances, Irritability.
98. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
99. Hulley S, Furberg C, Barrett-Conner E, et al. Noncardiovascular disease outcomes during 6.8 years of hormone therapy. JAMA 2002;288(1):58-66.
100. Justification Document: Conjugated Estrogens Vaginal Cream: Vaginitis, vaginal discharge.
101. Justification for a safety decision for Conjugated Estrogens: Ovarian cancer, 01-Aug-2007.
102. Justification Document: Products Containing Conjugated Equine Estrogens: Adverse reactions: Fibrocystic breast changes.
103. Justification Document: Conjugated Estrogens Vaginal Cream: Endometrial hyperplasia/endometrial cancer.
104. Justification Document: Hepatic hemangiomas.
105. Jhawar BS, Fuchs CS, Colditz GA, Stampfer MJ. Sex steroid hormone exposures and risk for meningioma. J Neurosurg. 2003;99:848-853.
106. Justification Document: Angioedema.
107. Justification for a safety labeling decision for conjugated estrogens: Hypersensitivity, 01-August-2007.
108. Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: The Women’s Health Initiative. Arch Intern Med. 2006 Feb 13;166:357-365.
109. Justification Document: CONJUGATED ESTROGENS (all combinations): Adverse Reactions: Increased Triglycerides.
110. Justification Document: Conjugated Estrogens Vaginal Cream: Increased blood pressure.
111. Wentz AC. Congenital anomalies and intersexuality. In: Brown CL, ed. Novak’s Textbook of Gynecology. 11th ed. Baltimore, MD: Williams & Wilkins; 1988:140-141.
112. Justification for a safety labeling decision Conjugated Estrogens: Overdose.
113. Komm, BS, Bodine PVN. Regulation of bone cell function by estrogens. In: R. Marcus, D. Feldman, and J. Kelsey, eds. Osteoporosis, 2nd Edition. Academic Press: 2001. p.305-337.
114. Harris, H.A. Estrogen receptor beta: recent lessons from in vivo studies. Molecular Endocrinology. 2007;21:1-13.
115. Interim Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth GMR-38605, May 2000.
116. Interim Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth GMR-38605, May 2000.
117. Interim Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth GMR-38605, May 2000.
118. CSR-67635, Version 1.1. Interim Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis. Section 12.0, Discussion and Overall Conclusions.
119. CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
120. CSR-67635, Version 1.1. Interim Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
121. CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis. Table 10-1: Number (%) of Subjects Reporting Adverse Events Treatment Emergent = 5% Only During the Double-Blind Phase.
122. CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
123. CSR-71991, Version 1.2. Final Report: Efficacy and safety of 2 low-dose regimens of conjugated estrogen cream administered vaginally in postmenopausal women with atrophic vaginitis.
124. Wyeth study (Protocol 0713S5-413-NA, Amendment 2), Efficacy and Safety of 2 Low-Dose Regimens of Conjugated Estrogen Cream Administered Vaginally in Postmenopausal Women With Atrophic Vaginitis. Dated 12-Dec-2006.
125. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
126. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
127. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
128. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
129. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
130. Final Report: A Prospective, Double-Blind, Randomized Study of the Safety and Efficacy of Lower Doses of Premarin and Medroxyprogesterone Acetate in Postmenopausal Women. Wyeth CSR-41303, Jun 2001.
131. Lin T, Kirkland R, Kirkland J. Adult height in girls with Turner syndrome treated with low-dose estrogens and androgens. Ann Pharmacother. 1994:28:570-571.
132. Lanes R, Gunzcler P, Esaa S, Martinis R, Villaroel O, Weisinger J. Decreased bone mass despite long-term estrogen replacement therapy in young women with Turner’s syndrome and previously normal bone density. Fertil Steril. 1999(5) 896-899.
133. Guttman H, Weiner Z, Nikolski E, Ish-Shalom S. Itskovitz-Eldor J, Aviram M, et al. Choosing an oestrogen replacement therapy in young adult women with Turner syndrome. Clinical Endocrinology. 2001;54(2):159-164.
134. Pinheiro VS, Gallicchio CT, Alves STF, Guimaraes MN. Longitudinal Study of Liver Enzymes and Serum Levels of Estradiol During Hormonal replacement Therapy in Patients with Turner Syndrome. The Endocrinologist. 2007;17(1):13-16.
135. Chernausek SD, Attie KM, Cara JF, Rosenfeld RG, Frante J, Genentech, Inc., Collaborative Study Group. Growth Hormone Therapy of Turner Syndrome: The Impact of Age of Estrogen Replacement on Final Height. Journal of Clinical Endocrinology & Metabolism. 2000;85(7):2439-2445.
136. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
137. Stefanick ML, Anderson GL, Margolis KL, et al. Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. JAMA. 2006 April 12;295:1647-1657.
138. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogens in
postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized
Controlled Trial. JAMA. 2004 April 14;291(14):1701-1712.
139. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
140. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
141. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
142. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: Results from the Women’s Health Initiative Randomized Trial. J Bone Min Resear. 2006;21(6):817-828.
143. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogens in
postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized
Controlled Trial. JAMA. 2004 April 14;291(14):1701-1712.
144. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogens in
postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized
Controlled Trial. JAMA. 2004 April 14;291(14):1701-1712.
145. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
146. Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: The Women’s Health Initiative. Arch Intern Med. 2006;166:357-365.
147. Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: The Women’s Health Initiative. Arch Intern Med. 2006;166:357-365.
148. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
149. Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of conjugated equine estrogen on stroke in the Women’s Health Initiative. Circulation. 2006;113:2425-2434.
150. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
151. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
152. Stefanick ML, Anderson GL, Margolis KL, et al. Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. JAMA. 2006;295(14):1647-1657.
153. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized Controlled Trial. JAMA. 2004;291(14):1701-1712.154. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: Results from the Women’s Health Initiative Randomized Trial. J Bone Min Resear. 2006;21(6):817-828.
155. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: Results from the Women’s Health Initiative Randomized Trial. J Bone Min Resear. 2006;21(6):817-828.
156. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: Results from the Women’s Health Initiative Randomized Trial. J Bone Min Resear. 2006;21(6):817-828.
157. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: Results from the Women’s Health Initiative Randomized Trial. J Bone Min Resear. 2006;21(6):817-828.
158. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized Controlled Trial. JAMA. 2004;291(14):1701-1712.
159. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
160. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-1477.
161. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA. 2007;297(13):1465-1477.
162. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA. 2007;297(13):1465-1477.
163. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
164. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
165. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166:772-780.
166. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogens in
postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized
Controlled Trial. JAMA. 2004 April 14;291(14):1701-1712.
167. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogens in
postmenopausal women with hysterectomy: The Women’s Health Initiative Randomized
Controlled Trial. JAMA. 2004 April 14;291(14):1701-1712.
168. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: results from the women’s health initiative randomized trial. J Bone Min Resear. 2006;21(6):817-828.
169. Jackson RD, Wactawski-Wende J, LaCroix AZ, et al. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: results from the women’s health initiative randomized trial. J Bone Min Resear. 2006;21(6):817-828.
170. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA. 2007;297(13):1465-1477.
171. Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA. 2007;297(13):1465-1477.
172. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA. 2004;291(24):2947-2958.
173. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. JAMA. 2004;291(24):2947-2958.
174. Final Report: A Single Dose Bioavailability Study of a New Formulation of Premarin (0.625 mg) Compared With a Reference Tablet in Healthy, Postmenopausal Women. Wyeth CSR-56298, Jan 2005.
175. Bhavnani BR. Pharmacokinetics and pharmacodynamics of conjugated equine estrogens: chemistry and metabolism. Proc. Soc. Exper. Biol. Med. 1998;217: 6-16.
176. Bhavnani BR. Pharmacokinetics and pharmacodynamics of conjugated equine estrogens: chemistry and metabolism. Proc. Soc. Exper. Biol. Med. 1998;217: 6-16.
177. Johnson RN, Masserano RP, Kho BT. Steady-state urinary excretion method for determining bioequivalence of conjugated estrogen products. J. Pharmaceut. Sci.1978;67 (9):1218-1224.
PFIZER S.A.S.