
OLMETEC
OLMESARTÁN
Tabletas
Caja , 30 Tabletas recubiertas
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Principio activo: Olmesartán medoxomil 20 o 40 mg.
INDICACIONES: El Olmesartán Medoxomil está indicado para el tratamiento de la hipertensión arterial esencial.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a cualquiera de los excipientes.
Niños menores de 18 años.
Las pacientes que queden embarazadas y los lactantes deben suspender el uso de Olmesartán Medoxomil lo antes posible, a menos que no se pueda encontrar una alternativa a un fármaco que actúe sobre el sistema renina-angiotensina.
No administre de manera concomitante aliskireno con Olmesartán Medoxomil en pacientes con diabetes y/o en pacientes con insuficiencia renal moderara a severa.
EMBARAZO Y LACTANCIA
Embarazo: El uso de fármacos que actúan de manera directa en el sistema renina-angiotensina durante el segundo y tercer trimestre de embarazo ha sido asociado con lesión fetal, incluso la muerte. Las pacientes que quedan embarazadas mientras usan Olmesartán Medoxomil deben suspender el tratamiento lo antes posible.
Lactancia:
No se sabe si el Olmesartán Medoxomil se excreta en la leche materna, pero el Olmesartán se secreta en bajas concentraciones en la leche de ratas lactantes. Por la posibilidad de efectos adversos en el lactante, se debe decidir si se suspende la lactancia natural o se descontinúa el fármaco.
EFECTOS INDESEABLES
Experiencia en estudios clínicos: En los estudios clínicos con Olmesartán Medoxomil se reporta mareo como efecto frecuente (incidencia >1% y <10%).
Experiencia posterior al lanzamiento: En la experiencia posterior al lanzamiento, las reacciones farmacológicas adversas reportadas como muy raras (incidencia <0.01%) son: Edema periférico, cefalea, tos, dolor abdominal, náusea, vómito, diarrea, enteropatía tipo esprúe, reacción anafiláctica, rash, prurito, angioedema, insuficiencia renal aguda, aumento de enzimas hepáticas, aumento de creatinina sanguínea, hiperpotasemia, mialgia y condiciones asténicas tales como astenia, fatiga, letargo, malestar.
INTERACCIONES
Uso con aliskireno: No administre aliskireno en forma concomitante con Olmesartán Medoxomil en pacientes con diabetes (véase Indicaciones), ya que el uso de terapia combinada se asocia con un mayor riesgo de hipotensión, hiperpotasemia y alteraciones en la función renal (incluida la insuficiencia renal aguda) en comparación con la monoterapia.
Medicamentos antiinflamatorios no esteroideos (AINE): Los AINE y los bloqueadores del receptor de la angiotensina (BRA) pueden actuar sinérgicamente al disminuir la filtración glomerular. El uso concomitante de AINE y BRA puede aumentar el riesgo de empeoramiento de la función renal.
Además, el efecto antihipertensivo de los BRA, incluido el Olmesartán, puede verse atenuado por los AINE, incluidos los inhibidores selectivos de COX2.
Uso con clorhidrato de colesevelam: La administración concomitante del agente secuestrante del ácido biliar clorhidrato de colesevelam reduce la exposición sistémica y la concentración plasmática máxima de Olmesartán. La administración de Olmesartán por lo menos 4 horas antes del clorhidrato de colesevelam disminuyó el efecto de la interacción de los medicamentos (véase Efectos indeseables).
INTERACCIONES: No se observaron interacciones farmacocinéticas significativas en estudios en los que el Olmesartán Medoxomil se administró al mismo tiempo que digoxina o warfarina en voluntarios sanos. La biodisponibilidad de Olmesartán no se afectó en forma significativa con un antiácido (hidróxido de aluminio y magnesio). El Olmesartán Medoxomil no se metaboliza por acción del sistema citocromo P450 y no tiene efectos en las enzimas P450; por tanto, no se espera que tenga interacciones con fármacos que inhiben, inducen o son metabolizados por estas enzimas.
Interacciones medicamentosas con el agente secuestrante del ácido biliar colesevelam: La administración concomitante de 40 mg de Olmesartán Medoxomil y 3750 mg de clorhidrato de colesevelam en sujetos sanos produjo una reducción del 28% en la Cmáx y del 39% en la ABC del Olmesartán. Se observaron efectos menores, una reducción del 4% y del 15% en la Cmáx y la ABC, respectivamente, cuando se administró Olmesartán Medoxomil 4 horas antes del clorhidrato de colesevelam (véase Advertencias y precauciones).
DATOS PRECLÍNICOS DE SEGURIDAD: Los estudios preclínicos de carcinogenicidad no revelaron un riesgo de importancia clínica para los humanos.
En estudios reproductivos en ratas, el Olmesartán Medoxomil no afectó la fertilidad. Al que igual que con otros antagonistas del receptor para angiotensina II, la supervivencia de la descendencia se redujo después de la exposición a Olmesartán Medoxomil y se observó dilatación de la pelvis renal después de la exposición de las hembras en etapa avanzada del embarazo y la lactancia. En común con otros agentes antihipertensivos, el Olmesartán Medoxomil resultó ser más tóxico para conejas gestantes que para ratas gestantes; sin embargo, no hubo indicación de un efecto tóxico para el feto.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá, D.C., Colombia.
FARMACOLOGÍA CLÍNICA
Propiedades farmacodinámicas: La angiotensina II es el principal agente presor del sistema renina-angiotensina, con efectos que incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca y reabsorción renal de sodio. El Olmesartán bloquea los efectos vasoconstrictores de la angiotensina II por bloqueo selectivo de la unión de angiotensina II con los receptores AT1 en el músculo liso vascular. Por lo tanto, su acción es independiente de la vía de síntesis de la angiotensina II.
Las dosis orales de Olmesartán Medoxomil entre 2.5 y 40 mg inhibieron la respuesta presora a la infusión exógena de angiotensina I.
Las concentraciones plasmáticas de angiotensina I, angiotensina II y la actividad plasmática de la renina aumentaron después de la administración única o repetida de Olmesartán Medoxomil a sujetos sanos o pacientes hipertensos. La administración de Olmesartán Medoxomil tuvo poco efecto en los niveles plasmáticos de aldosterona.
En estudios clínicos con pacientes hipertensos, el tratamiento con Olmesartán Medoxomil produjo un descenso en la presión sanguínea arterial dependiente de la dosis. El efecto reductor de la presión sanguínea del Olmesartán Medoxomil con un régimen de una administración al día se mantuvo durante el intervalo de dosificación de 24 horas. La eficacia del Olmesartán Medoxomil, con o sin hidroclorotiazida adicionada en caso necesario, se mantuvo hasta por un año, por lo menos. No hubo evidencia de hipertensión de rebote después de un año de la interrupción del tratamiento.
El Olmesartán Medoxomil fue efectivo para disminuir la presión sanguínea independientemente del género, edad o raza, aunque el efecto pareció un poco menor en pacientes de raza negra (por lo general una población con niveles bajos de renina).
Farmacocinética
Absorción y distribución: Después de la administración oral, Olmesartán Medoxomil se metaboliza rápidamente hasta su metabolito con actividad farmacológica, Olmesartán. Se observó que la biodisponibilidad absoluta promedio de Olmesartán en formulación de tableta es cercana a 26%.
La concentración plasmática máxima promedio de Olmesartán se alcanza unas 2 horas después de la administración oral de Olmesartán Medoxomil, y las concentraciones plasmáticas de Olmesartán aumentan en forma más o menos lineal con al aumentar la dosis oral única o repetida dentro del intervalo terapéutico.
Los alimentos no afectan la biodisponibilidad de Olmesartán.
No se han observado diferencias de relevancia clínica en la farmacocinética de Olmesartán relacionadas con el género.
El Olmesartán tiene un alto porcentaje de unión con proteínas (99%). El volumen de distribución promedio después de la administración intravenosa está entre 16 y 29 litros.
En las ratas, Olmesartán cruzó pobremente la barrera hematoencefálica, si la cruzó. El Olmesartán cruzó la barrera placentaria en ratas y se distribuyó en el feto. Olmesartán se distribuyó en la leche de ratas, con niveles bajos.
Metabolismo y eliminación: Después de la conversión rápida y completa de Olmesartán Medoxomil en Olmesartán durante la absorción, el Olmesartán no se metaboliza. Cerca del 30 a 50% del fármaco absorbido sistemáticamente se excreta en la orina, el resto se excreta en las heces (vía biliar).
Según el origen étnico, la vida media de eliminación terminal de Olmesartán varió entre 6 y 15 horas. El estado estable se alcanzó después de las primeras dosis y no hubo evidencia de acumulación adicional con la dosificación repetida. La eliminación renal fue cercana a 0.5-0.7 L por hora.
Farmacocinética en poblaciones especiales
Ancianos: En pacientes caucásicos, el área bajo la curva (ABC) en el estado estable aumentó en cerca de 33% en pacientes ancianos. Estos incrementos en la biodisponibilidad correspondieron a disminuciones en la eliminación renal de cerca de 30% en ancianos.
Daño renal: En pacientes con insuficiencia renal, las concentraciones séricas de Olmesartán se elevaron en comparación con sujetos que tenían función renal normal. Después de la administración repetida, el ABC casi se triplicó en pacientes con daño renal grave (depuración de creatinina <20 ml/min).
No se ha estudiado la farmacocinética de Olmesartán en pacientes que se someten a hemodiálisis.
Daño hepático. El ABC promedio de Olmesartán después de la administración oral única a pacientes con daño hepático moderado aumentó en cerca de 48% en comparación con los controles sanos (grupo total) o en cerca de 60%, cuando se comparó sólo con controles pareados.
ADVERTENCIAS Y PRECAUCIONES
Embarazo y lactancia: Véase Contraindicaciones acerca del uso en el embarazo y lactancia.
Pacientes con deficiencia de volumen o sal y pacientes con activación del sistema renina-angiotensina: En pacientes con sistema renina-angiotensina activado, como aquellos con deficiencia de volumen y/o sal (p. ej., los que reciben tratamiento con dosis altas de diuréticos), puede haber hipotensión sintomática después de iniciar el tratamiento con Olmesartán Medoxomil.
Alteración de la función renal
En pacientes cuya función renal depende sobre todo de la actividad del sistema renina-angiotensina, el tratamiento con fármacos que afectan este sistema se relaciona con azotemia, oliguria y raras veces, con insuficiencia renal aguda.
Existe un mayor riesgo de insuficiencia renal cuando los pacientes con estenosis arterial renal bilateral (o estenosis de la arteria de un solo riñón funcional) se tratan con medicamentos que afectan el sistema renina-angiotensina.
Enteropatía tipo esprúe: Se ha informado diarrea crónica, severa con pérdida de peso importante en pacientes tratados con Olmesartán Medoxomil, de meses a años después de la iniciación del tratamiento con el medicamento. Biopsias intestinales de los pacientes a menudo demostraron atrofia de las vellosidades. Si un paciente presenta estos síntomas durante el tratamiento con Olmesartán Medoxomil, excluya otras etiologías. Considere la interrupción de la administración del Olmesartán Medoxomil en los casos en que no se haya identificado ninguna otra etiología.
DOSIS Y ADMINISTRACIÓN
Dosis usual en adultos: La dosis usual recomendada de Olmesartán Medoxomil está entre 10 y 40 mg una vez al día, ajustada de acuerdo con la necesidad del paciente. Si es necesario, puede usarse al mismo tiempo otro tratamiento antihipertensivo con el Olmesartán Medoxomil para lograr el control de la presión sanguínea.
Ancianos: No se recomienda ajuste en la dosis inicial para los pacientes geriátricos.
Daño renal: La dosis de Olmesartán Medoxomil se debe individualizar en pacientes con daño renal.
No hay experiencia en el uso de Olmesartán Medoxomil en pacientes que requieren diálisis. (Véase más Información sobre el daño renal).
Daño hepático: No se recomienda ajuste en la dosis inicial en pacientes con daño hepático leve a moderado.
Niños: No se ha establecido la seguridad y eficacia del Olmesartán Medoxomil en niños.
SOBREDOSIS: Sólo se dispone de datos limitados relevantes a la sobredosis de Olmesartán Medoxomil en humanos. El efecto más probable de la sobredosis es la hipotensión. En caso de sobredosis, el tratamiento debe ser de soporte.
No se dispone de información sobre la capacidad para eliminar al Olmesartán por diálisis.
DESCRIPCIÓN: El Olmesartán Medoxomil es un profármaco que se hidroliza hasta el metabolito activo Olmesartán durante la absorción en el tubo digestivo. El Olmesartán es un antagonista selectivo del receptor para angiotensina II del subtipo AT1.
El nombre químico del Olmesartán Medoxomil es (5-metil-2-oxo-1,3-dioxolén-4-il)metil-4-(1-hidroxi-1-metiletil)-2-propil-1[[2’-(1H-tetrazol-5-il)-1,1’-bifenil-4-il]metil]1H-imidazol-5-carboxilato. Una alternativa es describirlo como “2-3,dihidroxi-2-butenil 4-(1-hidroxi-1-metiletil)-2-propil-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol-5-carboxilato, 2,3-carbonato cíclico”.
Su fórmula empírica es C29H30N6O6 y su fórmula estructural es:
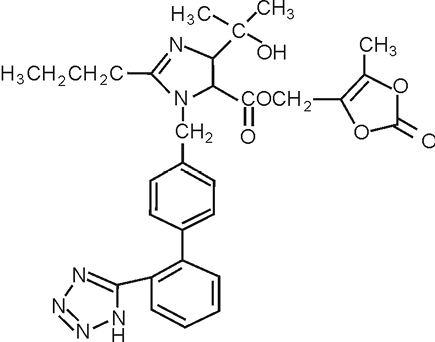
PRESENTACIÓN: OLMETEC 20 mg Tabletas recubiertas (Reg. San. INVIMA 2005M-0004686). OLMETEC 40 mg Tabletas recubiertas (Reg. San. INVIMA 2005M-0004688).
Título del Documento del Producto: Olmesartán Medoxomil
Fecha de CDS que reemplaza: Julio de 2013
Fecha efectiva: Septiembre de 2013
Versión de CDS: 8.0
PFIZER S.A.S.