
OLMETEC HCT
HIDROCLOROTIAZIDA, OLMESARTÁN
Tabletas recubiertas
Caja , 30 Tabletas recubiertas , 20/12.5 Miligramos
Caja , 30 Tabletas recubiertas , 40/12.5 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Principio activo: Olmesartán medoxomilo/hidroclorotiazida (20 mg/12,5 mg y 40 mg/12.5 mg)
INDICACIONES: Olmesartán medoxomilo-hidroclorotiazida está indicado en el tratamiento de la hipertensión arterial esencial
INFORMACIÓN FARMACÉUTICA
Incompatibilidades: No aplica.
Vida útil: 24 meses.
Precauciones especiales de almacenamiento: Temperatura no mayor a 30°C.
Naturaleza y contenido del recipente: Blister aluminio/aluminio (laminado poliamida/aluminio/PVC/aluminio)
Instrucciones de uso, manejo y desecho: No requerimientos especiales.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá, D.C., Colombia.
PROPIEDADES FARMACOCINÉTICAS: La administración concomitante de Olmesartán Medoxomilo e hidroclorotiazida no tuvo efectos de relevancia clínica en la farmacocinética de cualquiera de los componentes en sujetos sanos.
Absorción y distribución
Olmesartán medoxomilo: Después de la administración oral, Olmesartán Medoxomilo se metaboliza rápidamente hasta su metabolito con actividad farmacológica, Olmesartán. La biodisponibilidad absoluta promedio de Olmesartán a partir de una formulación en tableta es cercana a 26%.
La concentración plasmática máxima promedio de Olmesartán se alcanza 2 horas después de la administración oral de Olmesartán Medoxomilo; las concentraciones plasmáticas de Olmesartán aumentan en forma más o menos lineal conforme se incrementan las dosis orales únicas o repetidas en el intervalo terapéutico.
Los alimentos no tienen un efecto de relevancia clínica en la biodisponibilidad de Olmesartán.
No se han observado diferencias de relevancia clínica en la farmacocinética de Olmesartán relacionadas con el género.
Olmesartán mantiene un alto porcentaje de unión con proteínas plasmáticas (>99%). El volumen de distribución promedio después de la administración intravenosa está entre 16 y 29 litros.
En ratas, Olmesartán cruzó pobremente la barrera hematoencefálica, si la cruzó. Olmesartán cruzó la barrera placentaria en ratas y se distribuyó en el feto. Olmesartán se distribuyó en la leche de ratas, con niveles bajos.
Hidroclorotiazida: Después de la administración de Olmesartán Medoxomilo e hidroclorotiazida combinados, la mediana de tiempo hasta las concentraciones máximas de hidroclorotiazida fue 1.5 a 2 horas después de la administración. El 68% de la hidroclorotiazida está unido a proteínas en el plasma y su volumen de distribución aparente es de 0.83 a 1.14 L/Kg.
Metabolismo y eliminación
Olmesartán medoxomilo: Después de la conversión rápida y completa de Olmesartán Medoxomilo en Omesartán durante la absorción, éste no se metaboliza más. Cerca del 30% a 50% del fármaco absorbido sistemáticamente se excreta en la orina, el resto se excreta en las heces (por vía biliar).
Según el origen étnico, la vida media de eliminación terminal de Olmesartán varió entre 6 y 15 horas. El estado estable se alcanzó después de las primeras dosis y no hubo acumulación adicional evidente con las dosis repetidas. La eliminación renal aproximada fue 0.5-0.7 litros por hora.
Hidroclorotiazida: Los humanos no metabolizan la hidroclorotiazida y se excreta casi toda por vía urinaria sin cambios. Cerca del 60% de la dosis se elimina como fármaco intacto antes de 48 horas. La eliminación renal es de 250 a 300 ml/min. La vida media de eliminación final de la hidroclorotiazida es de 10 a 15 horas.
Farmacocinética en poblaciones especiales
Ancianos: En pacientes caucásicos, el área bajo la curva (ABC) del Olmesartán en estado estable se incrementó en cerca de 33% en los pacientes geriátricos. Estos aumentos en la biodisponibilidad correspondieron a reducciones en la eliminación renal cercanas a 30% en los ancianos.
Insuficiencia renal: En pacientes con insuficiencia renal, las concentraciones séricas de Olmesartán se elevaron en comparación con los sujetos que tenían función renal normal. Después de las dosis repetidas, el ABC casi se triplicó en pacientes con insuficiencia renal grave (depuración de creatinina <20 ml/min).
No se ha estudiado la farmacocinética de Olmesartán en pacientes que se someten a hemodiálisis.
Insuficiencia hepática. El ABC promedio de Olmesartán después de una dosis oral única en pacientes con insuficiencia hepática moderada aumentó en cerca de 48% en comparación con los controles sanos (grupo total), y en cerca de 60% en comparación con los controles equiparados.
CONTRAINDICACIONES: Hipersensibilidad a los principios activos, a cualquiera de los excipientes o pacientes hipersensibles a las sustancias derivadas de sulfonamida, embarazo lactancia y niños menores de 18 años.
Olmesartán Medoxomilo-hidroclorotiazida está contraindicado en pacientes hipersensibles a cualquier componente activo o inactivo de la tableta (véase Farmacología clínica) o que son hipersensibles a otras sustancias derivadas de la sulfonamida (ya que la hidroclorotiazida es un fármaco derivado de la sulfonamida).
Olmesartán Medoxomilo-hidroclorotiazida está contraindicado en pacientes con anuria por el componente hidroclorotiazida.
Las pacientes que quedan embarazadas deben suspender el uso de Olmesartán Medoxomilo-hidroclorotiazida lo antes posible, a menos que no se pueda encontrar una alternativa de un fármaco que actúe en el sistema renina-angiotensina (véase Contraindicaciones).
EMBARAZO Y LACTANCIA
Embarazo: No hay experiencia con el uso de Olmesartán Medoxomilo-hidroclorotiazida en mujeres embarazadas. Los estudios en ratones y ratas usando combinaciones de Olmesartán medoxomilo-hidroclorotiazida no indican un efecto teratogénico, pero se observó toxicidad fetal en ratas. Las tiazidas cruzan la barrera placentaria y aparecen en sangre del cordón. Pueden causar trastornos electrolíticos fetales y otras reacciones posibles que se han observado en adultos. Hay informes de casos de trombocitopenia neonatal, o ictericia fetal o neonatal durante el tratamiento materno con tiazidas.
Si se produce un embarazo durante el tratamiento, Olmesartán Medoxomilo-hidroclorotiazida se debe suspender lo antes posible.
Lactancia: No se sabe si Olmesartán se excreta en la leche materna en humanos, pero sí se excreta en bajas concentraciones en la leche de ratas lactantes. Las tiazidas aparecen en la leche materna. Por la posibilidad de efectos adversos en el lactante, se debe decidir si se suspende la lactancia materna o se suspende el fármaco.
EFECTOS INDESEABLES
Olmesartán medoxomilo-hidroclorotiazida: En estudios clínicos, la frecuencia general de eventos adversos con Olmesartán Medoxomilo-hidroclorotiazida fue similar a la del placebo. El índice de suspensión por eventos adversos con Olmesartán Medoxomilo-hidroclorotiazida fue bajo (2%) y no mayor que el del placebo.
Se reportó mareo más a menudo con Olmesartán Medoxomilo- hidroclorotiazida que con placebo.
Hallazgos de laboratorio: En estudios clínicos, fueron raros los cambios de importancia clínica en los parámetros de laboratorio estándar que se relacionaron con Olmesartán Medoxomilo-hidroclorotiazida.
Se observaron aumentos menores en los valores promedio de ácido úrico, nitrógeno ureico en sangre y creatinina, así como descensos menores en los valores promedio de hemoglobina y hematócrito durante el tratamiento con Olmesartán Medoxomilo-hidroclorotiazida.
Olmesartán medoxomilo
Experiencia en estudios clínicos: Con frecuencia se reporta mareo (incidencia =1% y <10%) en estudios clínicos con Olmesartán Medoxomilo.
En la experiencia posterior al lanzamiento, las reacciones farmacológicas adversas que se reportaron muy rara vez (incidencia <0.01%) son: edema periférico, cefalea, tos, dolor abdominal, náusea, vómito, diarrea, reacción anafiláctica, rash, prurito, angioedema, insuficiencia renal aguda, aumento de enzimas hepáticas, aumento de creatinina sanguínea, hiperpotasemia, mialgia y condiciones asténicas tales como astenia, fatiga, letargo, malestar.
Hidroclorotiazida: Los eventos adversos reportados con otras preparaciones de hidroclorotiazida son los siguientes:
Trastornos del sistema digestivo: Irritación gástrica, sialoadenitis, pancreatitis.
Trastornos hepatobiliares: Ictericia (ictericia colestásica intrahepática).
Trastornos oculares: Xantopsía, visión borrosa transitoria.
Trastornos del sistema hemático y linfático: Leucopenia, agranulocitosis, trombocitopenia, anemia aplásica, anemia hemolítica.
Trastornos de la piel y tejido subcutáneo: Reacciones de fotosensibilidad, urticaria, vasculitis necrosante (vasculitis, vasculitis cutánea), reacciones anafilácticas, necrólisis tóxica epidérmica.
Trastornos generales: Fiebre.
Trastornos del sistema respiratorio: Dificultad respiratoria (incluso neumonitis y edema pulmonar).
Trastornos renales y urinarios: Disfunción renal, nefritis intersticial.
Trastornos musculoesqueléticos: Espasmos musculares, debilidad.
Trastornos del sistema nervioso: Inquietud.
Hallazgos de laboratorio: Hiperglicemia, glucosuria, hiperuricemia, desequilibrio de electrólitos (incluida hiponatremia e hipopotasemia), aumentos en el colesterol y triglicéridos.
INTERACCIONES
Generales
Otros agentes antihipertensivos: El efecto reductor de la presión sanguínea de Olmesartán Medoxomilo-hidroclorotiazida se puede aumentar con el uso concomitante de otros medicamentos antihipertensivos.
Olmesartán medoxomilo: Hasta la fecha no se han reportado interacciones farmacológicas de relevancia clínica con Olmesartán Medoxomilo.
Hidroclorotiazida
Alcohol, barbitúricos o narcóticos: Puede haber potenciación de la hipotensión ortostática.
Fármacos antidiabéticos (agentes orales e insulina): Es probable que se necesite un ajuste en la dosis del fármaco antidiabético (véase Dosis y administración).
Resinas de colestiramina y colestipol: La absorción de hidroclorotiazida se altera en presencia de las resinas de intercambio aniónico.
Corticoesteroides y ACTH: Los pacientes que toman corticoesteroides o ACTH tienen mayor riesgo de hipopotasemia (véase Dosis y administración).
Aminas presoras (p. ej., noradrenalina = norepinefrina): Es probable que disminuya el efecto de las aminas presoras.
Relajantes del músculo esquelético no despolarizantes (p. ej., tubocurarina): El efecto de los relajantes musculares esqueléticos no despolarizantes se puede potenciar con la hidroclorotiazida.
Litio: La eliminación renal del litio disminuye por las tiazidas y por consiguiente, aumenta el riesgo de toxicidad por litio. Por lo tanto, no se recomienda el uso de Olmesartán Medoxomilo-hidroclorotiazida y litio (véase Dosis y administración). Si es necesario usar la combinación, se recomienda la vigilancia cuidadosa de los niveles de litio.
Agentes antiinflamatorios no esteroideos: La administración de un fármaco antiinflamatorio no esteroideo puede reducir los efectos diuréticos, natriuréticos y antihipertensivos de los diuréticos tiazídicos en algunos pacientes.
INTERACCIONES: No se observaron interacciones farmacocinéticas significativas en estudios en los que se administró Olmesartán Medoxomilo al mismo tiempo que digoxina o warfarina en voluntarios sanos. La biodisponibilidad de Olmesartán no se alteró en forma significativa por antiácidos (hidróxido de aluminio y magnesio). El Olmesartán Medoxomilo no se metaboliza por acción del sistema citocromo P450 y no tiene efectos en las enzimas P450; por tanto, no se esperan interacciones con fármacos que inhiben, inducen o se metabolizan por estas enzimas.
DATOS PRECLÍNICOS DE SEGURIDAD: El potencial tóxico de las combinaciones Olmesartán Medoxomilo-hidroclorotiazida se evaluó en estudios de toxicidad con dosis orales repetidas hasta por seis meses en ratas y perros. La mayoría de los efectos observados se debieron a la actividad farmacológica de la combinación y no hubo hallazgos que descartaran la administración en humanos en el nivel de dosis terapéuticas.
La combinación Olmesartán Medoxomilo-hidroclorotiazida en proporción 20:12.5 tuvo resultados negativos en la prueba de mutación bacteriana inversa hasta con la máxima concentración en placa recomendada para las pruebas estándar. Olmesartán Medoxomilo e hidroclorotiazida se probaron en forma individual y combinados en proporciones de 40:12.5, 20:12.5 y 10:12.5 para evaluar su actividad clastogénica en la prueba in vivo de alteración cromosómica en pulmón de hámster chino. Como se esperaba, se observó una respuesta positiva para cada componente y para la combinación. Sin embargo, no se detectó sinergismo en la actividad clastogénica entre Olmesartán Medoxomilo e hidroclorotiazida con ninguna de las combinaciones proporcionales. Olmesartán Medoxomilo-hidroclorotiazida en proporción 20:12.5 administrado por vía oral tuvo resultados negativos en la prueba in vivo de micronúcleo de eritrocitos en médula ósea de ratón con dosis de hasta 1935 mg/kg de Olmesartán Medoxomilo más 1209 mg/kg de hidroclorotiazida.
No se investigó el potencial carcinogénico de Olmesartán Medoxomilo-hidroclorotiazida, ya que no hubo evidencia de efectos carcinogénicos relevantes de los dos componentes individuales en las condiciones relevantes para el uso clínico.
No hubo evidencia de teratogenicidad en ratones o ratas tratados con combinaciones de Olmesartán Medoxomilo-hidroclorotiazida. Como se esperaba con esta clase de fármaco, se observó toxicidad fetal en ratas, demostrada por la disminución significativa en el peso corporal fetal cuando se administraron combinaciones de Olmesartán Medoxomilo-hidroclorotiazida durante la gestación (véase Contraindicaciones).
No se han realizado estudios sobre los efectos de Olmesartán Medoxomilo-hidroclorotiazida en la fertilidad, pero los estudios con los componentes individuales no mostraron efectos adversos en la fertilidad de roedores.
FARMACOLOGÍA CLÍNICA
Propiedades farmacodinámicas: Olmesartán Medoxomilo es un antagonista potente y selectivo del receptor para angiotensina II con actividad por vía oral. La angiotensina II, es el principal agente presor del sistema renina-angiotensina, cuyos efectos incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca y reabsorción renal de sodio. El Olmesartán bloquea los efectos vasoconstrictores de la angiotensina II mediante el bloqueo selectivo de la unión de angiotensina II con el receptor AT1 en el músculo liso vascular. Por lo tanto, su acción es independiente de la ruta de síntesis de la angiotensina II.
Las dosis orales de Olmesartán Medoxomilo de 2.5 a 40 mg inhibieron la respuesta presora a la infusión de angiotensina I exógena.
Las concentraciones plasmáticas de angiotensina I, angiotensina II y la actividad plasmática de la renina aumentaron después de la administración única o repetida de Olmesartán Medoxomilo a sujetos sanos o pacientes hipertensos. La administración de Olmesartán Medoxomilo tuvo poco efecto en los niveles plasmáticos de aldosterona.
Hidroclorotiazida es un diurético tiazídico. El mecanismo del efecto antihipertensivo de los diuréticos tiazídicos no es completamente conocido. Las tiazidas afectan los mecanismos tubulares renales de reabsorción de electrólitos, lo que aumenta directamente la excreción de sodio y cloro en cantidades aproximadamente equivalentes. La acción diurética de la hidroclorotiazida reduce el volumen plasmático, aumenta la actividad plasmática de la renina e incrementa la secreción de aldosterona, con aumentos consecuentes en la pérdida urinaria de potasio y bicarbonato, y descenso del potasio sérico. El vínculo entre renina y aldosterona depende de la angiotensina II y por lo tanto la coadministración de un antagonista del receptor para angiotensina II tiende a revertir la pérdida de potasio relacionada con los diuréticos tiazídicos. Con la hidroclorotiazida, el inicio de la diuresis ocurre en unas 2 horas y el efecto máximo ocurre unas 4 horas después de la dosis, pero su acción persiste durante 6 a 12 horas aproximadamente.
La combinación de Olmesartán Medoxomilo e hidroclorotiazida produce reducciones aditivas de la presión sanguínea que casi siempre aumentan con la dosis de cada componente. El retiro del tratamiento con Olmesartán Medoxomilo, con o sin tratamiento concomitante con hidroclorotiazida, no causó hipertensión de rebote.
ADVERTENCIAS Y PRECAUCIONES
Pacientes con deficiencia de volumen o sal: En pacientes con sistema renina-angiotensina activado, como los que tienen deficiencia de volumen y/o sal (p. ej., quienes reciben dosis altas de diuréticos), puede haber hipotensión sintomática después de iniciar el tratamiento con Olmesartán Medoxomilo-hidroclorotiazida.
Alteración de la función renal: En pacientes cuya función renal depende sobre todo de la actividad del sistema renina-angiotensina (p. ej., pacientes con insuficiencia cardiaca congestiva severa), el tratamiento con fármacos que afectan este sistema se relaciona con azotemia, oliguria o raras veces, insuficiencia renal aguda.
Hay un mayor riesgo de insuficiencia renal cuando los pacientes con estenosis arterial renal bilateral (o estenosis de la arteria renal del único riñón funcional) se tratan con medicamentos que afectan al sistema renina-angiotensina.
No se recomiendan los diuréticos tiazídicos cuando hay enfermedad renal grave. En pacientes con enfermedad renal, las tiazidas pueden desencadenar azotemia.
Insuficiencia hepática: Las alteraciones menores en el equilibrio de líquido y electrólitos durante el tratamiento con tiazidas pueden desencadenar el coma hepático en pacientes con disfunción hepática o enfermedad hepática progresiva.
Reacciones de hipersensibilidad: Pueden ocurrir reacciones de hipersensibilidad a la hidroclorotiazida en pacientes con o sin antecedentes de alergia o asma bronquial, pero son más probables en pacientes con este antecedente.
Lupus eritematoso sistémico: Se ha reportado que los diuréticos tiazídicos causan exacerbación o activación del lupus eritematoso sistémico.
Litio: No se recomienda el uso de litio combinado con diuréticos (véase Advertencias y precauciones).
Efectos metabólicos y endocrinos: El tratamiento con tiazidas puede afectar la tolerancia a la glucosa. Es probable que en pacientes diabéticos sea necesario hacer ajustes en la insulina o agentes hipoglicémicos orales (véase Advertencias y precauciones). La diabetes mellitus latente puede hacerse manifiesta durante el tratamiento con tiazidas.
El tratamiento con diuréticos tiazídicos se relaciona con aumentos en los niveles de colesterol y triglicéridos.
Es posible que haya hiperuricemia o se desencadene un cuadro franco de gota en algunos sujetos que reciben terapias con tiazidas.
Desequilibrio electrolítico: Como en cualquier paciente que recibe tratamiento diurético, se deben medir los electrólitos séricos a intervalos apropiados.
Las tiazidas, incluida la hidroclorotiazida, pueden causar desequilibrio de líquidos y electrólitos (incluida hipopotasemia, hiponatremia y alcalosis hipoclorémica). Los signos o síntomas de advertencia del desequilibrio de líquido o electrólitos incluyen sequedad de la boca, sed, debilidad, letargo, somnolencia, inquietud, dolor muscular o calambres, fatiga muscular, hipotensión, oliguria, taquicardia y trastornos gastrointestinales, como náusea y vómito.
El uso de diuréticos tiazídicos puede causar hipopotasemia, sobre todo en pacientes con cirrosis hepática, en los que presentan diuresis enérgica, en pacientes con ingesta oral insuficiente de electrólitos y en pacientes que reciben tratamiento concomitante con corticosteroides u hormona adrenocorticotrópica (ACTH, por sus siglas en inglés).
Por lo general, la deficiencia de cloro es leve y no requiere tratamiento.
Las tiazidas pueden reducir la excreción urinaria de calcio y causar un aumento intermitente y ligero de calcio sérico en ausencia de trastornos conocidos en el metabolismo del calcio. La hipercalcemia marcada puede ser evidencia de hiperparatiroidismo oculto. Se deben suspender las tiazidas antes de realizar pruebas de función paratiroidea.
Está demostrado que las tiazidas aumentan la excreción urinaria de magnesio, lo cual puede causar hipomagnesemia.
DOSIS Y ADMINISTRACIÓN
Dosis usual en adultos: Olmesartán Medoxomilo-hidroclorotiazida se administra una vez al día, con o sin alimentos, a pacientes cuya presión sanguínea no se controla adecuadamente con Olmesartán Medoxomilo o hidroclorotiazida solos.
Cuando sea clínicamente apropiado, se puede considerar el cambio directo del tratamiento con un solo fármaco a la combinación fija. Se recomienda valorar la dosis de los componentes individuales.
Ancianos: No se recomienda ajustes en la dosis inicial para pacientes geriátricos.
Insuficiencia renal: Se puede usar la individualización del tratamiento dentro de los regímenes de dosificación usuales de Olmesartán Medoxomilo-hidroclorotiazida en pacientes con daño renal cuya depuración de creatinina es mayor de 30 ml/min. El Olmesartán Medoxomilo-hidroclorotiazida no se recomienda para pacientes con enfermedad renal más severa (depuración de creatinina <30 ml/min).
Insuficiencia hepática: No es necesario el ajuste de la dosis inicial en pacientes con insuficiencia hepática.
Niños: No se ha establecido la seguridad y eficacia de Olmesartán Medoxomilo-hidroclorotiazida en niños y adolescentes hasta los 18 años de edad.
SOBREDOSIS: No se cuenta con información específica sobre los efectos o tratamiento de la sobredosis con Olmesartán Medoxomilo-hidroclorotiazida. Sólo se dispone de datos limitados relevantes de la sobredosis de Olmesartán Medoxomilo en humanos. El efecto más probable de la sobredosis con Olmesartán Medoxomilo es la hipotensión. La sobredosis de hidroclorotiazida causa deficiencia de electrólitos (hipopotasemia, hipocloremia) y deshidratación a causa de la diuresis excesiva. Los signos y síntomas más frecuentes de sobredosis son náusea y somnolencia. La hipopotasemia puede acentuar las arritmias cardiacas relacionadas con el uso concomitante de glucósidos digitálicos. En caso de sobredosis con Olmesartán Medoxomilo-hidroclorotiazida, el tratamiento debe ser de soporte.
No se cuenta con información sobre la capacidad para dializar el Olmesartán o la hidroclorotiazida.
DESCRIPCIÓN: Olmesartán Medoxomilo-hidroclorotiazida es una combinación de dosis fija del antagonista selectivo del receptor para angiotensina II (subtipo AT1) Olmesartán Medoxomilo y el diurético tiazídico hidroclorotiazida.
Olmesartán medoxomilo: El nombre químico del Olmesartán Medoxomilo es (5-metil-2-oxo-1,3-dioxolen-4-il)metil-4-(1-hidroxi-1-metiletil)-2-propil-1[[2’-(1H-tetrazol-5-il)-1,1’-bifenil-4-il]metil]1H-imidazol-5-carboxilato. Una alternativa es describirlo como “2-3,dihidroxi-2-butenil 4-(1-hidroxi-1-metiletil)-2-propil-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol-5-carboxilato, 2,3-carbonato cíclico”.
Su fórmula empírica es C29H30N6O6 y su fórmula estructural es:
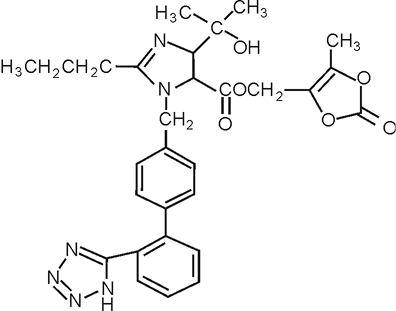
El Olmesartán medoxomilo es un profármaco que se hidroliza durante la absorción en el tubo digestivo hasta el metabolito activo olmesartán (véase Efectos indeseables).
Hidroclorotiazida: La descripción química de la hidroclorotiazida es 1,1 dióxido de 6-cloro-3,4-dihidro-2H-1,2,4-benzotiadiacina-7-sulfonamida.
Su fórmula empírica es C7H8ClN3O4S2 y su fórmula estructural es:
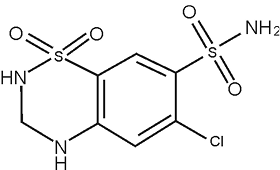
PRESENTACIÓN: OLMETEC HCT 20 mg, 12.5 mg Tabletas Recubiertas (Reg. San. INVIMA 2005M-0004689). OLMETEC HCT 40 mg, 12.5 mg Tabletas recubiertas (Reg. San. INVIMA 2005M-0004687)
Título del Documento del Producto: Olmesartán Medoxomilo/Hidroclorotiazida
Fecha de CDS que reemplaza: 25 de Abril de 2009
Fecha efectiva de CDS: 27 de Enero del 2011
Versión CDS: 5.0
PFIZER S.A.S.