
OFEV
NINTEDANIB
Cápsulas blandas
Caja, 60 Cápsulas, 100 mg
Caja, 60 Cápsulas, 150 mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: OFEV® 100 mg, CÁPSULAS Blandas: 1 cápsula contiene 100 mg de nintedanib (= base libre) correspondiente a 120,4 mg de 1H-Indol-6-ácido carboxílico, 2,3-dihidro-3-[[[4-[metil[(4-metil-1-piperazinil)acetil] amino]fenil] amino]fenilmetilen]-2-oxo-, metil éster, (3Z)-, etanosulfonato (1:1) (= nintedanib esilato).
OFEV® 150 mg, CÁPSULAS Blandas: 1 CÁPSULA contiene 150 mg de nintedanib (= base libre) correspondiente a 180,6 mg de 1H-Indol-6-ácido carboxílico, 2,3-dihidro-3-[[[4-[metil[(4-metil-1-piperazinil)acetil]amino]fenil]amino]fenilmetilen]-2-oxo-, metil éster, (3Z)-, etanosulfonato (1:1) (= nintedanib esilato).
INDICACIONES: OFEV® está indicado para el tratamiento de la fibrosis pulmonar idiopática (FPI) y para reducir la velocidad de progresión de la enfermedad.
OFEV® también está indicado para el tratamiento de “otras enfermedades pulmonares intersticiales (ILD) crónicas fibrosantes con fenotipo progresivo”
USO EN POBLACIONES ESPECÍFICAS:
• Fertilidad, Embarazo y Lactancia:
Anticoncepción: Nintedanib puede causar daño fetal (véase la sección Toxicología). Debe advertirse a las mujeres con potencial reproductivo que eviten quedar embarazadas mientras reciben tratamiento con OFEV® y que deben usar métodos anticonceptivos altamente eficaces al inicio, durante el tratamiento con OFEV® y hasta cumplidos al menos 3 meses desde la última dosis de este fármaco. El nintedanib no afecta en gran medida la exposición plasmática del etinilestradiol ni del levonorgestrel (véase la sección Farmacocinética). La eficacia de los anticonceptivos hormonales orales puede verse comprometida por los vómitos y/o la diarrea u otros trastornos que afecten la absorción. Debe recomendarse a las mujeres que usan anticonceptivos hormonales orales y que experimenten estos trastornos que usen una alternativa anticonceptiva altamente eficaz.
Embarazo: No existe información sobre el uso de OFEV® en las mujeres embarazadas; sin embargo, los estudios preclínicos en animales han confirmado la toxicidad para la reproducción con este fármaco (véase la sección Toxicología). Dado que nintedanib puede causar daño fetal también en los seres humanos, este fármaco no debe ser utilizado durante el embarazo (véase la sección Contraindicaciones), y deben realizarse pruebas de embarazo antes del inicio del tratamiento con OFEV® y durante el tratamiento, según corresponda.
Se debe indicar a las pacientes que deben notificar a su médico o farmacéutico si quedaran embarazadas durante el tratamiento con OFEV®.
Si la paciente quedara embarazada mientras está recibiendo OFEV®, debe interrumpirse el tratamiento y la paciente deberá ser asesorada sobre el potencial riesgo para el feto.
Lactancia: No existe información sobre la eliminación de nintedanib y sus metabolitos en la leche humana.
Los estudios preclínicos indicaron que se segregaron pequeñas cantidades de nintedanib y sus metabolitos (≤ 0,5% de la dosis administrada) en la leche de las ratas en período de lactancia.
No se puede excluir la posibilidad de un riesgo para los neonatos/lactantes. Debe suspenderse la lactancia durante el tratamiento con OFEV®.
Fertilidad: Sobre la base de las investigaciones preclínicas, no existe evidencia de que este fármaco afecte la fertilidad masculina (véase la sección Toxicología) [40]. A partir de los estudios de toxicidad de administración crónica y subcrónica, no existe evidencia de que la fertilidad en las ratas hembras se vea afectada en un nivel de exposición sistémica comparable al observado con la dosis recomendada máxima en los seres humanos (MRHD), de 150 mg dos veces al día (véase la sección Toxicología).
PROPIEDADES FARMACOLÓGICAS: Grupo farmacoterapéutico: Agentes antineoplásicos - Inhibidores de la proteína cinasa de tirosina.
Código ATC: L01XE31
Mecanismo de acción: Nintedanib es una molécula pequeña que actúa como inhibidor de la cinasa de tirosina cuya acción comprende los receptores del factor de crecimiento derivado de plaquetas (PDGFR) α y β, los receptores del factor de crecimiento fibroblástico (FGFR) 1-3 y los receptores del factor de crecimiento del endotelio vascular (VEGFR) 1-3. Además, nintedanib inhibe las cinasas de Lck, Lyn, Src y CSF1R. Nintedanib se une competitivamente al sitio de unión a ATP de estas cinasas y bloquea las cascadas de señalización intracelular que, según se ha demostrado, están involucradas en la patogenia de la remodelación del tejido fibrótico en las enfermedades pulmonares intersticiales.
Efectos farmacodinámicos:
Ensayos clínicos
Eficacia en el estudio pivote de fase III LUME-Lung 1
Fibrosis pulmonar idiopática (FPI): La eficacia clínica de OFEV® ha sido estudiada en pacientes con FPI en dos estudios aleatorizados, doble ciego, comparativos con placebo, de fase III, con idéntico diseño (INPULSIS1 e INPULSIS2). Los pacientes fueron aleatorizados en una proporción de 3:2 a recibir tratamiento con OFEV® 150 mg o placebo dos veces al día durante 52 semanas.
El criterio de valoración primario fue la tasa anual de disminución de la capacidad vital forzada (CVF). Los criterios de valoración secundarios clave fueron el cambio respecto del nivel inicial en el puntaje total del Cuestionario Respiratorio St. George (SGRQ) a las 52 semanas y el tiempo hasta la primera exacerbación aguda de la FPI.
Tasa anual de disminución de la CVF: La tasa anual de disminución de la CVF (en mL) se redujo significativamente en los pacientes que recibieron OFEV®, en comparación con los pacientes que recibieron placebo. El efecto del tratamiento fue concordante en ambos estudios. Véase la Tabla 2 para consultar los resultados de los estudios en forma individual y combinados.
|
Tabla 2. Tasa anual de disminución de la CVF (mL) en los estudios INPULSIS-1, INPULSIS-2 y sus datos combinados - Conjunto tratado |
||||||
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 e INPULSIS-2 combinados |
||||
|
Placebo |
OFEV®150 mg dos veces al día |
Placebo |
OFEV®150 mg dos veces al día |
Placebo |
OFEV®150 mg dos veces al día |
|
|
Cantidad de pacientes analizados |
204 |
309 |
219 |
329 |
423 |
638 |
|
Tasa1 (SE) de disminución a lo largo de 52 semanas |
-239,9 (18,71) |
-114,7 (15,33) |
-207,3 (19,31) |
-113,6 (15,73) |
-223,5 (13,45) |
-113,6 (10,98) |
|
Comparación frente al placebo |
||||||
|
Diferencias1 |
125,3 |
93,7 |
109,9 |
|||
|
IC del 95% |
(77,7; 172,8) |
(44,8; 142,7) |
(75,9; 144,0) |
|||
|
Valor p |
< 0,0001 |
0,0002 |
< 0,0001 |
|||
|
1 Estimada sobre la base de un modelo de regresión de coeficientes aleatorios. |
||||||
La robustez del efecto de OFEV® en la reducción de la tasa anual de disminución de la CVF fue confirmada en todos los análisis de sensibilidad previamente especificados.
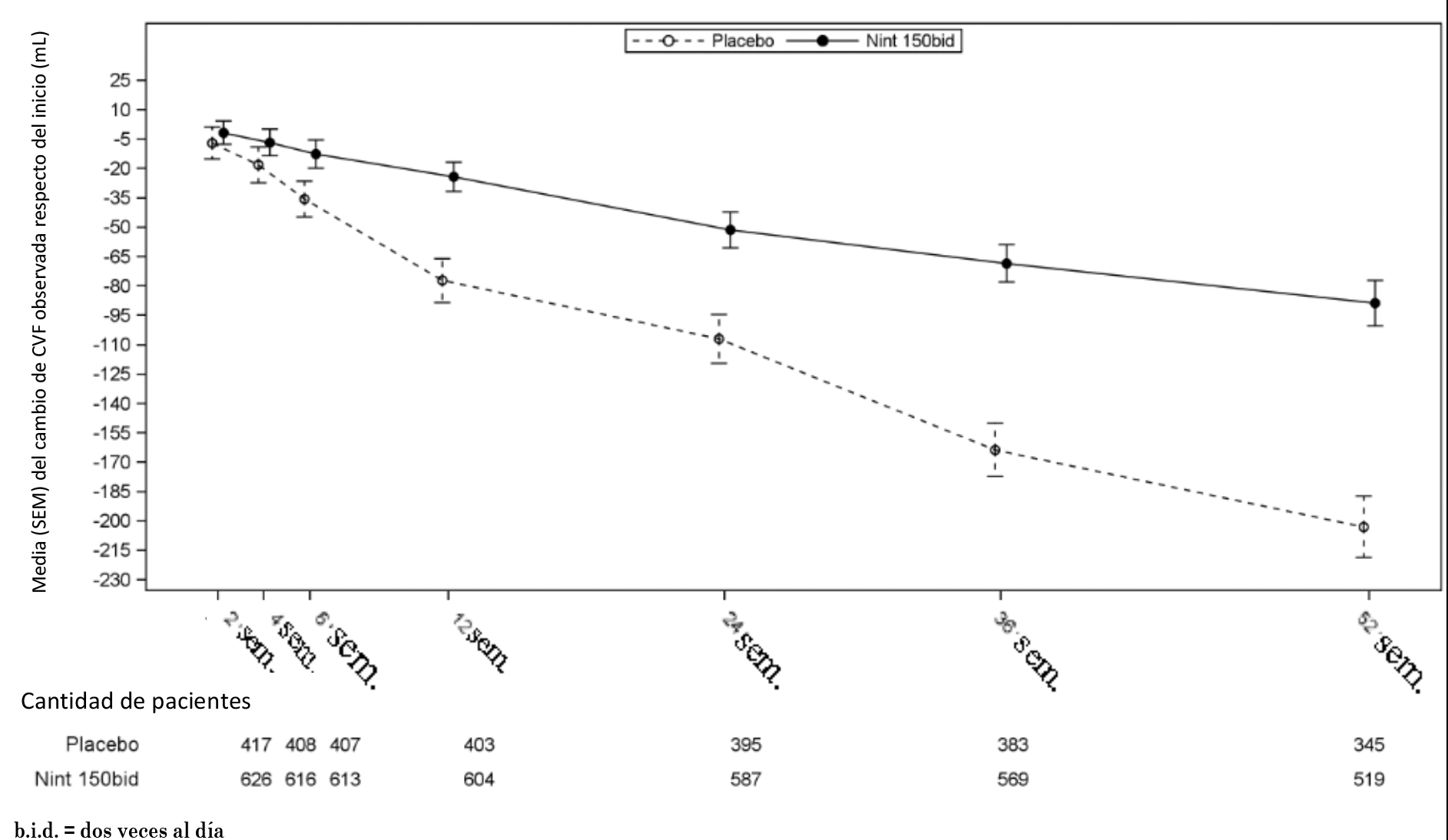
Asimismo, se observaron efectos similares en otros criterios de valoración de la función pulmonar, p. ej., cambio respecto del nivel inicial en la CVF a la semana 52 y los análisis de respondedores por CVF que confirman también los efectos de OFEV® en la ralentización de la progresión de la enfermedad. Véase la Figura 1 para conocer la evolución del cambio respecto del nivel inicial a lo largo del tiempo en ambos grupos de tratamiento, sobre la base del análisis de datos combinados de los estudios INPULSIS-1 e INPULSIS-2.
Figura 1. Media (SEM) del cambio respecto del nivel inicial (mL) en la CVF observada a lo largo del tiempo en los estudios INPULSIS-1 e INPULSIS-2 combinados
Análisis de respondedores por CVF: En ambos estudios INPULSIS, la proporción de respondedores por CVF, definidos como pacientes con una disminución absoluta en el % de la CVF previsto de no más del 5% (un umbral indicativo del creciente riesgo de mortalidad en la FPI), fue significativamente más alto en el grupo de OFEV® en comparación con el grupo placebo. Se observaron resultados similares en los análisis en los que se utilizó un umbral conservador del 10%. Véase la Tabla 3 para conocer los resultados de los estudios en forma individual y combinados.
|
Tabla 3. Proporción de respondedores por CVF a las 52 semanas en los estudios INPULSIS-1, INPULSIS-2 y sus datos combinados - Conjunto tratado |
||||||
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 e INPULSIS-2combinados |
||||
|
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
|
|
Cantidad de pacientes analizados |
204 |
309 |
219 |
329 |
423 |
638 |
|
Umbral del 5% |
||||||
|
Cantidad (%) de respondedores por CVF1 |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53,0) |
|
Comparación frente al placebo |
||||||
|
Cociente de probabilidades (OR) |
1,85 |
1,79 |
1,84 |
|||
|
IC del 95% |
(1,28; 2,66) |
(1,26; 2,55) |
(1,43; 2,36) |
|||
|
Valor p2 |
0,0010 |
0,0011 |
< 0,0001 |
|||
|
Umbral del 10% |
||||||
|
Cantidad (%) de respondedores por CVF1 |
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
|
Comparación frente al placebo |
||||||
|
Cociente de probabilidades (OR) |
1,91 |
1,29 |
1,58 |
|||
|
IC del 95% |
(1,32; 2,79) |
(0,89; 1,86) |
(1,21; 2,05) |
|||
|
Valor p2 |
0,0007 |
0,1833 |
0,0007 |
|||
|
1 Los pacientes respondedores son aquellos que no presentan ninguna disminución absoluta mayor del 5% o mayor del 10% en el % de CVF previsto, dependiendo del umbral y con una evaluación de la CVF a las 52 semanas. 2 Sobre la base de una regresión logística. |
||||||
Tiempo hasta la progresión (≥ 10% disminución absoluta en el % de CVF previsto o muerte): En los dos estudios INPULSIS, el riesgo de progresión se redujo en una magnitud estadísticamente significativa en los pacientes tratados con OFEV® en comparación con aquellos tratados con placebo. En el análisis combinado, el valor de HR fue 0,60, lo que indicó una reducción del 40% en el riesgo de progresión para los pacientes tratados con OFEV® en comparación con aquellos tratados con placebo; véase la Tabla 4.
|
Tabla 4. Frecuencia de pacientes con una disminución absoluta de ≥ 10% en el porcentaje de CVF previsto o muerte dentro de un lapso de 52 semanas y tiempo hasta la progresión en los estudios INPULSIS-1, INPULSIS-2 y sus datos combinados - Conjunto tratado [9] |
||||||
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 e INPULSIS-2 combinados |
||||
|
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
|
|
Cantidad de pacientes en riesgo |
204 |
309 |
219 |
329 |
423 |
638 |
|
Pacientes con eventos, N (%) |
83 (40,7) |
75 (24,3) |
92 (42,0) |
98 (29,8) |
175 (41,4) |
173 (27,1) |
|
Comparación frente al placebo1 |
||||||
|
Valor p2 |
0,0001 |
0,0054 |
< 0,0001 |
|||
|
Cociente de riesgos (HR)3 |
0,53 |
0,67 |
0,60 |
|||
|
IC del 95% |
(0,39; 0,72) |
(0,51; 0,89) |
(0,49; 0,74) |
|||
|
1 Sobre la base de los datos recabados hasta los 372 días (52 semanas + margen de 7 días). 2 Sobre la base de una prueba de rango logarítmico. 3 Sobre la base de un modelo de regresión de Cox. |
||||||
Cambio respecto del nivel inicial en el puntaje total del SGRQ a la semana 52. El puntaje total del Cuestionario Respiratorio St. George (SGRQ), que mide la calidad de vida relacionada con la salud (HRQoL), se analizó a las 52 semanas. En el estudio INPULSIS-2, los pacientes que recibieron placebo tuvieron un mayor incremento respecto del nivel inicial en el puntaje total del SGRQ en comparación con los pacientes que recibieron OFEV® 150 mg dos veces al día. El deterioro de la HRQoL fue menor en el grupo tratado con OFEV®; la diferencia entre los grupos de tratamiento fue estadísticamente significativa (-2,69; IC del 95%: -4,95, -0,43; p = 0,0197).
En el estudio INPULSIS-1, el incremento respecto del nivel inicial en el puntaje total del SGRQ en la semana 52 fue comparable entre OFEV® y placebo (diferencia entre los grupos de tratamiento: -0,05, IC del 95%: -2,50, 2,40; p = 0,9657). En el análisis combinado de los estudios INPULSIS, la media estimada del cambio entre el nivel inicial y la semana 52 en el puntaje total de SGRQ fue menor en el grupo tratado con OFEV® (3,53) que en el grupo tratado con placebo (4,96), con una diferencia entre los grupos de tratamiento de -1,43 (IC del 95%: -3,09, 0,23; p = 0,0923). En conjunto, el efecto de OFEV® sobre la calidad de vida relacionada con la salud medida por el puntaje total de SGRQ es modesto, lo que indica un menor grado de empeoramiento en comparación con el placebo.
Tiempo hasta la primera exacerbación aguda de la FPI: En el estudio INPULSIS-2, el riesgo de la primera exacerbación aguda de la FPI a lo largo de 52 semanas se redujo significativamente en los pacientes que recibieron OFEV® en comparación con aquellos que recibieron placebo; en el estudio INPULSIS-1, no hubo ninguna diferencia entre los grupos de tratamiento. En el análisis combinado de los estudios INPULSIS, se observó un riesgo numéricamente menor de una primera exacerbación aguda en los pacientes que recibieron OFEV® en comparación con aquellos que recibieron placebo. Véase la Tabla 5 para analizar los resultados de los estudios en forma individual y combinados.
|
Tabla 5. Tiempo hasta la primera exacerbación aguda a lo largo de 52 semanas sobre la base de los eventos informados por el investigador en los estudios INPULSIS1 e INPULSIS2, y sus datos combinados Conjunto tratado |
||||||
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 e INPULSIS-2 combinados |
||||
|
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
|
|
Cantidad de pacientes en riesgo |
204 |
309 |
219 |
329 |
423 |
638 |
|
Pacientes con eventos, N (%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
|
Comparación frente al placebo1 |
||||||
|
Valor p2 |
0,6728 |
0,0050 |
0,0823 |
|||
|
Cocientede riesgos (HR)3 |
1,15 |
0,38 |
0,64 |
|||
|
IC del 95% |
(0,54; 2,42) |
(0,19; 0,77) |
(0,39; 1,05) |
|||
|
1 Sobre la base de los datos recabados hasta los 372 días (52 semanas + margen de 7 días). 2Sobre la base de una prueba de rango logarítmico. 3Sobre la base de un modelo de regresión de Cox. |
||||||
Todos los eventos adversos de exacerbación aguda de la FPI informados por el investigador fueron adjudicados por un comité de adjudicación con cegamiento. Se llevó a cabo un análisis de sensibilidad previamente especificado del tiempo hasta la primera exacerbación aguda de la FPI “confirmada” o “sospechada” sobre la base de los datos combinados. La frecuencia de pacientes con al menos 1 exacerbación adjudicada producida dentro de las 52 semanas fue más baja en el grupo de OFEV® (1,9% de los pacientes) que en el grupo placebo (5,7% de los pacientes). El análisis del tiempo hasta el evento de los eventos de exacerbación adjudicados realizado sobre la base de los datos combinados arrojó un HR de 0,32 (IC del 95% 0,16, 0,65; p = 0,0010). Esto indica que el riesgo de tener una primera exacerbación aguda de la FPI fue significativamente más bajo desde el punto de vista estadístico en el grupo tratado con OFEV® que en el grupo tratado con placebo en cualquiera de los momentos de medición.
Análisis de la supervivencia: En el análisis combinado previamente especificado de los datos de supervivencia de los estudios INPULSIS, la mortalidad general a lo largo de 52 semanas fue más baja en el grupo tratado con OFEV® (5,5%) en comparación con el grupo tratado con placebo (7,8%). El análisis del tiempo hasta la muerte arrojó un HR de 0,70 (IC del 9 % 0,43, 1,12; p = 0,1399). Los resultados de todos los criterios de valoración de supervivencia (como la mortalidad durante el tratamiento y la mortalidad por causas respiratorias) evidenciaron una diferencia numérica sistemática a favor de OFEV® (véase la Tabla 6).
|
Tabla 6: Mortalidad por cualquier causa a lo largo de 52 semanas en los estudios INPULSIS-1, INPULSIS-2 y sus datos combinados - Conjunto tratado |
||||||
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 e INPULSIS-2 combinados |
||||
|
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
Placebo |
OFEV® 150 mg dos veces al día |
|
|
Cantidad de pacientes en riesgo |
204 |
309 |
219 |
329 |
423 |
638 |
|
Pacientes con eventos, N (%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
|
Comparación frente al placebo1 |
||||||
|
Valor p2 |
0,2880 |
0,2995 |
0,1399 |
|||
|
Cociente de riesgos (HR)3 |
0,63 |
0,74 |
0,70 |
|||
|
IC del 95% |
(0,29; 1,36) |
(0,40; 1,35) |
(0,43; 1,12) |
|||
|
1 Sobre la base de los datos recabados hasta los 372 días (52 semanas + margen de 7 días). 2 Sobre la base de una prueba de rango logarítmico. 3 Sobre la base de un modelo de regresión de Cox. |
||||||
Evidencia de aval de los resultados del estudio de fase II (1199.30) con OFEV® 150 mg dos veces al día. El estudio aleatorizado, doble ciego, comparativo con placebo, de búsqueda de dosis, de fase II en el que se incluyó un grupo de dosis de OFEV® de 150 mg dos veces al día aportó evidencia adicional de la eficacia.
El criterio de valoración primario, la tasa de disminución de la CVF a lo largo de 52 semanas, registró su valor más bajo en el grupo de tratamiento con OFEV® (-0,060 litro/año, N=84) que en el grupo de tratamiento con placebo (-0,190 litro/año, N=83). La diferencia estimada entre los grupos de tratamiento fue 0,131 litro/año (IC del 95%: 0,027; 0,235). Esta diferencia entre los grupos de tratamiento alcanzó la significancia estadística nominal (p = 0,0136).
La media estimada del cambio respecto del nivel inicial en el puntaje total del SGRQ a las 52 semanas fue 5,46 para el placebo, lo que indica un empeoramiento de la calidad de vida relacionada con la salud y de -0,66 para OFEV®, lo cual indica una calidad de vida relacionada con la salud estable. La diferencia media estimada para OFEV® en comparación con el placebo fue -6,12 (IC del 95%: -10,57, -1,67; p = 0,0071).
La cantidad de pacientes con exacerbaciones agudas de la FPI a lo largo de 52 semanas fue más baja en el grupo de OFEV® (2,3%, N = 86) en comparación con el grupo placebo (13,8%, N = 87). El cociente de riesgos (HR) estimado de OFEV® frente al placebo fue 0,16 (IC del 95%: 0,04, 0,71; p = 0,0054).
Tratamiento a largo plazo con OFEV® en pacientes con FPI (INPULSIS-ON): Un estudio de extensión abierto de OFEV® incluyó 734 pacientes con FPI. Algunos pacientes fueron tratados con OFEV® durante más de 5 años. Los pacientes que completaron el período de tratamiento de 52 semanas en el estudio INPULSIS recibieron tratamiento abierto con OFEV® en el estudio de extensión INPULSIS®-ON. La mediana del tiempo de exposición para los pacientes tratados con OFEV® en ambos estudios, INPULSIS e INPULSIS-ON, fue de 44,7 meses (rango 11,9-68,3). La tasa anual ajustada de disminución de la CVF a lo largo de 192 semanas fue -135,1 (5,8) mL/año en todos los pacientes tratados y fue concordante con la tasa anual de disminución de la CVF en los pacientes tratados con OFEV® en los estudios INPULSIS de fase III (-113,6 mL por año). El perfil de eventos adversos de OFEV® en INPULSIS®-ON fue similar al de los estudios de fase III INPULSIS.
Pacientes con FPI con deterioro de la función pulmonar avanzado (INSTAGE): En un estudio doble ciego, aleatorizado, de grupos paralelos se evaluó la eficacia y la seguridad de OFEV® coadministrado con sildenafilo oral, en comparación con el tratamiento con OFEV® solo, en 273 pacientes con FPI y deterioro de la función pulmonar avanzado (DLCO < 35% estimado) durante 24 semanas.
La disminución de la CVF en los pacientes tratados OFEV® solo fue concordante con la disminución de la CVF en los pacientes con menor avance de la enfermedad y tratados con OFEV® en los estudios de fase III INPULSIS. La adición de sildenafilo a OFEV® no brindó un beneficio significativo en términos de calidad de vida vs. la monoterapia de OFEV®. El perfil de seguridad y tolerabilidad de OFEV® en los pacientes con FPI con deterioro de la función pulmonar avanzado fue concordante con el observado en los estudios de fase III INPULSIS. El perfil de eventos adversos de la combinación de OFEV® y sildenafilo fue coherente con el perfil de seguridad establecido de cada componente, sin aumento de los eventos adversos serios o mortales en comparación con la monoterapia de OFEV®
Datos adicionales del estudio clínico de fase IV INJOURNEY con OFEV® 150 mg dos veces al día y agregado de pirfenidona: Se investigó el tratamiento concomitante con OFEV® y pirfenidona en un estudio clínico abierto, aleatorizado, exploratorio de 150 mg de OFEV® dos veces al día con agregado de pirfenidona (con ajuste de dosis a 801 mg tres veces al día) en comparación con monoterapia de OFEV® 150 mg dos veces al día, en un total de 105 pacientes aleatorizados durante 12 semanas. El criterio de valoración primario fue el porcentaje de pacientes con eventos adversos gastrointestinales desde el inicio del estudio hasta la semana 12. Los eventos adversos gastrointestinales fueron frecuentes y coherentes con el perfil de seguridad establecido de cada componente. Los eventos adversos más frecuentes fueron diarrea, náuseas y vómitos, los cuales fueron informados por 20 (37,7%) versus 16 (31,4%), 22 (41,5%) versus 6 (11,8%) y 15 (28,3%) versus 6 (11,8%) pacientes tratados con la combinación de pirfenidona agregado a OFEV® en comparación con la monoterapia de nintedanib, respectivamente.
La media (SE) de cambios absolutos desde el inicio en la CVF a la semana 12 fue de -13,3 (17,4) mL en los pacientes tratados con nintedanib y agregado de pirfenidona (n=48), en comparación con -40,9 (31,4) mL en los pacientes tratados con monoterapia de nintedanib (n=44).
Otras enfermedades pulmonares intersticiales (ILD) crónicas fibrosantes con fenotipo progresivo: Se ha estudiado la eficacia clínica de OFEV® en pacientes con ILD crónica fibrosante con fenotipo progresivo en un estudio doble ciego, aleatorizado, comparativo con placebo, de fase III (INBUILD). Se excluyó a los pacientes con FPI. Los pacientes con diagnóstico clínico de ILD crónica fibrosante fueron seleccionados en función del nivel de fibrosis (> 10% de características de fibrosis) según tomografía computada de alta resolución (HRCT) y si presentaban signos clínicos de progresión. Un total de 663 pacientes fueron aleatorizados (1:1) a recibir OFEV® 150 mg dos veces al día o placebo equivalente por al menos 52 semanas. La mediana de exposición a OFEV® durante todo el estudio fue de 17,4 meses y la media de exposición a OFEV® durante todo el estudio fue de 15,6 meses. La aleatorización se estratificó de acuerdo con el nivel de fibrosis identificado mediante las lecturas centrales de una HRTC. Cuatrocientos doce pacientes que presentaron patrones fibróticos compatibles con neumonía intersticial usual (UIP) en la HRTC y 251 pacientes con otros patrones fibróticos observados en la HRCT fueron aleatorizados. Se establecieron dos poblaciones principales para los análisis de este estudio: todos los pacientes (la población total) y los pacientes que presentaron patrones fibróticos compatibles con UIP en la HRCT. Los pacientes con otros patrones fibróticos determinados por la HRCT representaron la población “complementaria”.
El criterio de valoración primario fue la tasa anual de disminución de la capacidad vital forzada (CVF) (expresada en mL) a lo largo de 52 semanas. Los criterios de valoración secundarios clave fueron el cambio absoluto respecto del nivel inicial en el puntaje total del Cuestionario de King sobre enfermedades pulmonares intersticiales difusas (K-BILD) en la semana 52, el tiempo transcurrido hasta la primera exacerbación aguda de la ILD o la muerte durante un período de 52 semanas y el tiempo transcurrido hasta la muerte durante un período de 52 semanas.
La media de edad de los pacientes (desvío estándar [SD, mín-máx) fue de 65,8 (9,8; 27-87) años y la media del porcentaje de la CVF previsto fue 69,0%. Los diagnósticos clínicos subyacentes de ILD de los grupos representados en el estudio fueron neumonitis por hipersensibilidad (26,1%), ILD autoinmunitarias (25,6%), neumonía intersticial idiopática no específica (18,9%), neumonía intersticial idiopática inclasificable (17,2%) y otras ILD (12,2%).
Tasa anual de disminución de la CVF. La tasa anual de disminución de la CVF (expresada en mL) a lo largo de 52 semanas se redujo considerablemente en 107,0 mL en los pacientes en tratamiento con OFEV® respecto de los pacientes que recibieron placebo (Tabla 7); esto equivalió a un efecto relativo del tratamiento del 57,0%.
|
Tabla 7. Tasa anual de disminución de la CVF (mL) a lo largo de 52 semanas |
||
|
Placebo |
OFEV® 150 mg dos veces al día |
|
|
Cantidad de pacientes analizados |
331 |
332 |
|
Tasa1 (SE) de disminución a lo largo de 52 semanas |
-187,8 (14,8) |
-80,8 (15,1) |
|
Comparación frente al placebo Diferencia1 |
107,0 |
|
|
IC del 95% |
(65,4; 148,5) |
|
|
Valor p |
< 0,0001 |
|
|
1 Basado en un modelo de regresión de coeficientes aleatorios con efectos categóricos fijos del tratamiento, patrones en HRCT, efectos fijos y continuos del tiempo, CVF inicial [expresada en mL], incluidas las interacciones de tratamiento por tiempo y de nivel inicial por tiempo. |
||
Se observaron resultados similares en las poblaciones principales de pacientes con HRCT con patrones fibróticos compatibles con UIP: la tasa anual de disminución de la CVF fue -211,1 mL/año en el grupo placebo (n = 206) y -82,9 mL/año en el grupo en tratamiento con OFEV® (n = 206). La diferencia entre los grupos de tratamiento fue 128,2 mL/año (IC del 95%: 70,8, 185,6; p < 0,0001). Asimismo, el efecto del tratamiento fue constante en la población complementaria que presentó otros patrones fibróticos en la HRCT. La tasa anual de disminución de la CVF fue -154,2 mL/año en el grupo placebo (n = 125) y -79,0 mL/año en el grupo de tratamiento con OFEV® (n = 126). La diferencia entre los grupos de tratamiento fue 75,2 mL/año (IC del 9 %: 15,5; 135,0) con un valor p nominal < 0,05 (p = 0,014). (Figura 2).
Figura 2. Diagrama de bosque de la tasa anual de disminución de la CVF (expresada en mL) de las poblaciones de pacientes durante 52 semanas
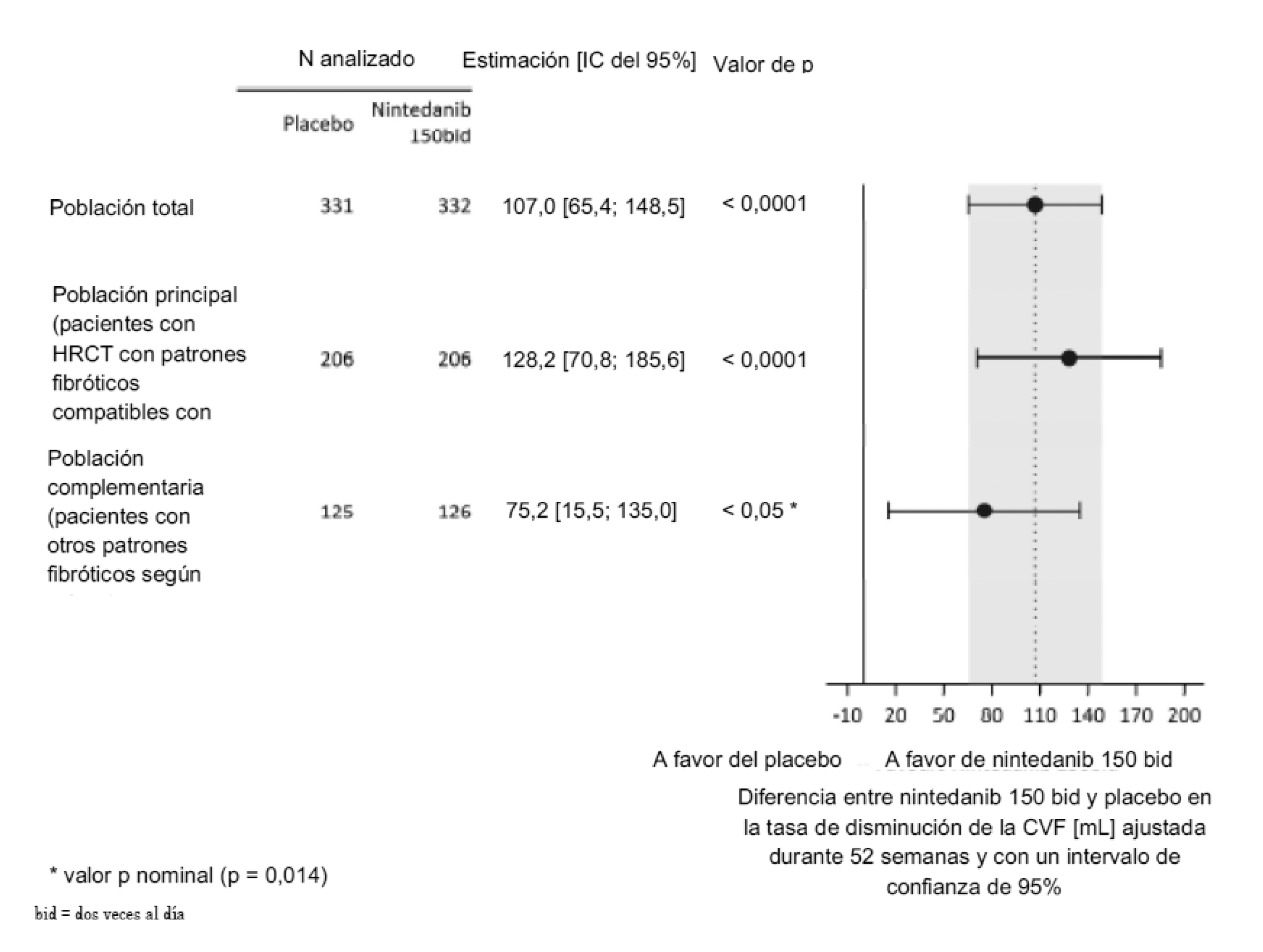
La robustez del efecto de OFEV® en la reducción de la tasa anual de disminución de la CVF quedó confirmada en todos los análisis de sensibilidad previamente especificados y se observaron resultados uniformes en todos los subgrupos previamente especificados (p. ej., género, grupo etario, raza, porcentaje inicial de la CVF previsto y diagnóstico clínico subyacente original de ILD en los grupos).
En la Figura 3 se observa la evolución con el tiempo del cambio en la CVF inicial en los grupos de tratamiento.
Figura 3. Media (SEM) del cambio respecto del nivel inicial (mL) en la CVF observada a lo largo de 52 semanas
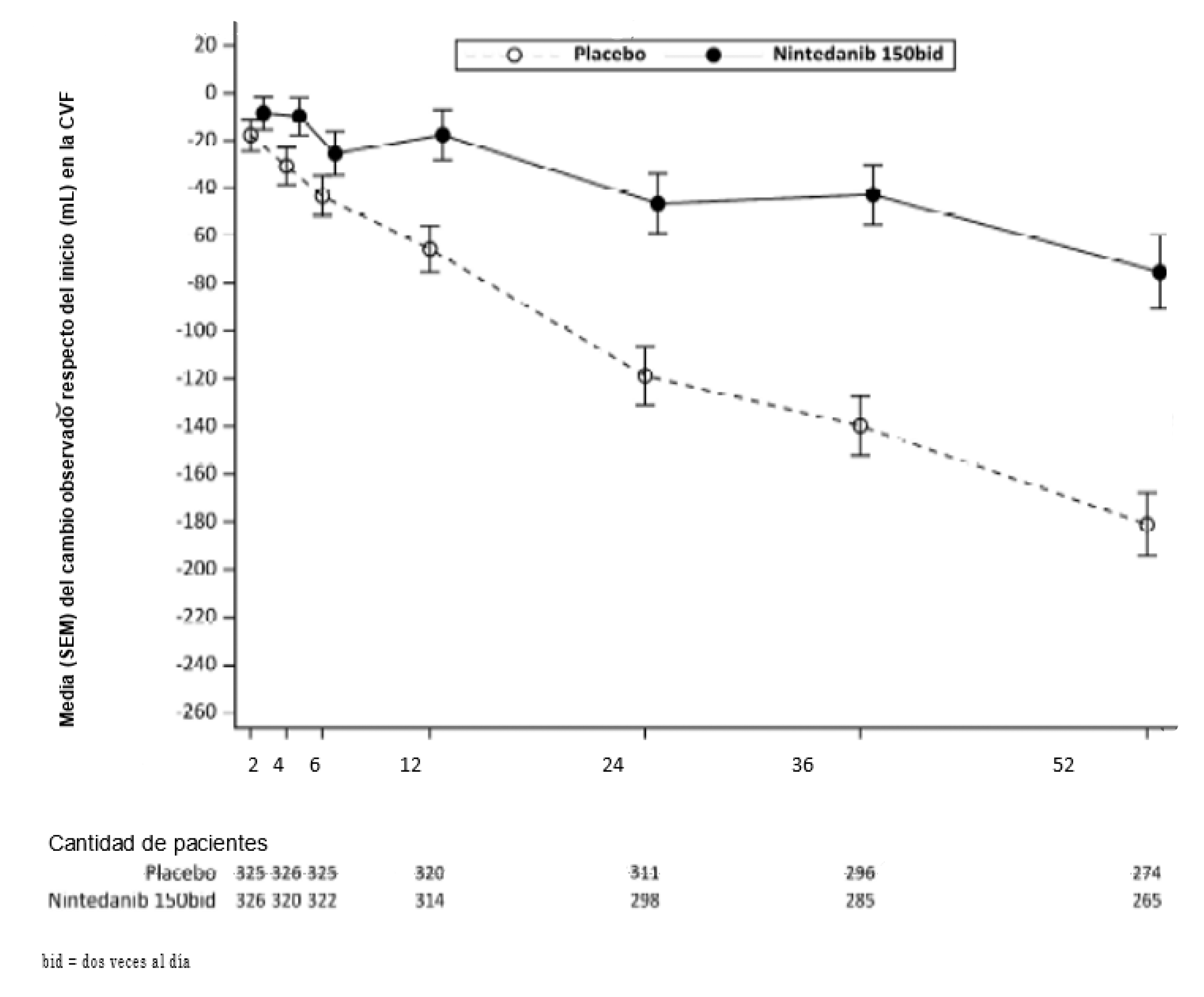
Asimismo, se observaron efectos favorables de OFEV® sobre el cambio absoluto respecto del nivel inicial de la media ajustada del porcentaje de la CVF previsto en la semana 52. El cambio absoluto respecto del nivel inicial de la media ajustada del porcentaje de la CVF previsto en la semana 52 fue inferior en el grupo de tratamiento con nintedanib (-2,62%) que en el grupo placebo (-5,86%). La diferencia en la media ajustada entre los grupos de tratamiento fue 3,24 (IC del 95%: 2,09; 4,40, p nominal < 0,0001).
Análisis de respondedores por CVF. La proporción de respondedores por CVF, definida como los pacientes con una disminución relativa en el porcentaje de la CVF previsto que no supera el 5%, fue superior en el grupo de tratamiento con OFEV® que en el grupo placebo. Se observaron resultados similares en análisis que utilizaron un umbral del 10% (Tabla 8)
|
Tabla 8 Proporción de respondedores por CVF en la semana 52 del estudio INBUILD |
||
|
Placebo |
OFEV® 150 mg dos veces por día |
|
|
Cantidad de pacientes analizados |
331 |
332 |
|
Umbral del 5% |
||
|
Cantidad (%) de respondedores por CVF1 |
104 (31,4) |
158 (47,6) |
|
Comparación con placebo |
||
|
Cociente de probabilidades2 |
2,01 |
|
|
IC del 95% |
(1,46; 2,76) |
|
|
Placebo |
OFEV® 150 mg dos veces por día |
|
|
Valor p nominal |
< 0,0001 |
|
|
Umbral del 10% |
||
|
Cantidad (%) de respondedores por CVF1 |
169 (51,1) |
197 (59,3) |
|
Comparación con placebo |
||
|
Cociente de probabilidades2 |
1,42 |
|
|
IC del 95% |
(1,04; 1,94) |
|
|
Valor p nominal |
0,0268 |
|
|
1 Los pacientes respondedores son aquellos cuya disminución relativa no es superior a 5% o a 10% del porcentaje de la CVF previsto en función del umbral y que cuentan con una evaluación de la CVF a las 52 semanas (los pacientes con datos faltantes en la semana 52 se consideraron no respondedores). 2 En base a un modelo de regresión logística con la covariable continua porcentaje inicial de la CVF previsto y la covariable binaria HRCT. |
||
Tiempo transcurrido hasta la primera exacerbación aguda de la ILD o la muerte. La proporción de pacientes que presentaron al menos un primer episodio de exacerbación aguda de la ILD o murieron durante el transcurso de 52 semanas fue 7,8% en el grupo de tratamiento con OFEV® y 9,7% en el grupo placebo. El riesgo de sufrir un primer episodio de exacerbación aguda de la ILD o la muerte fue inferior en número en el grupo que recibía tratamiento con OFEV® que en el de placebo: HR 0,80 (IC del 95%: 0,48, 1,34; p nominal = 0,3948).
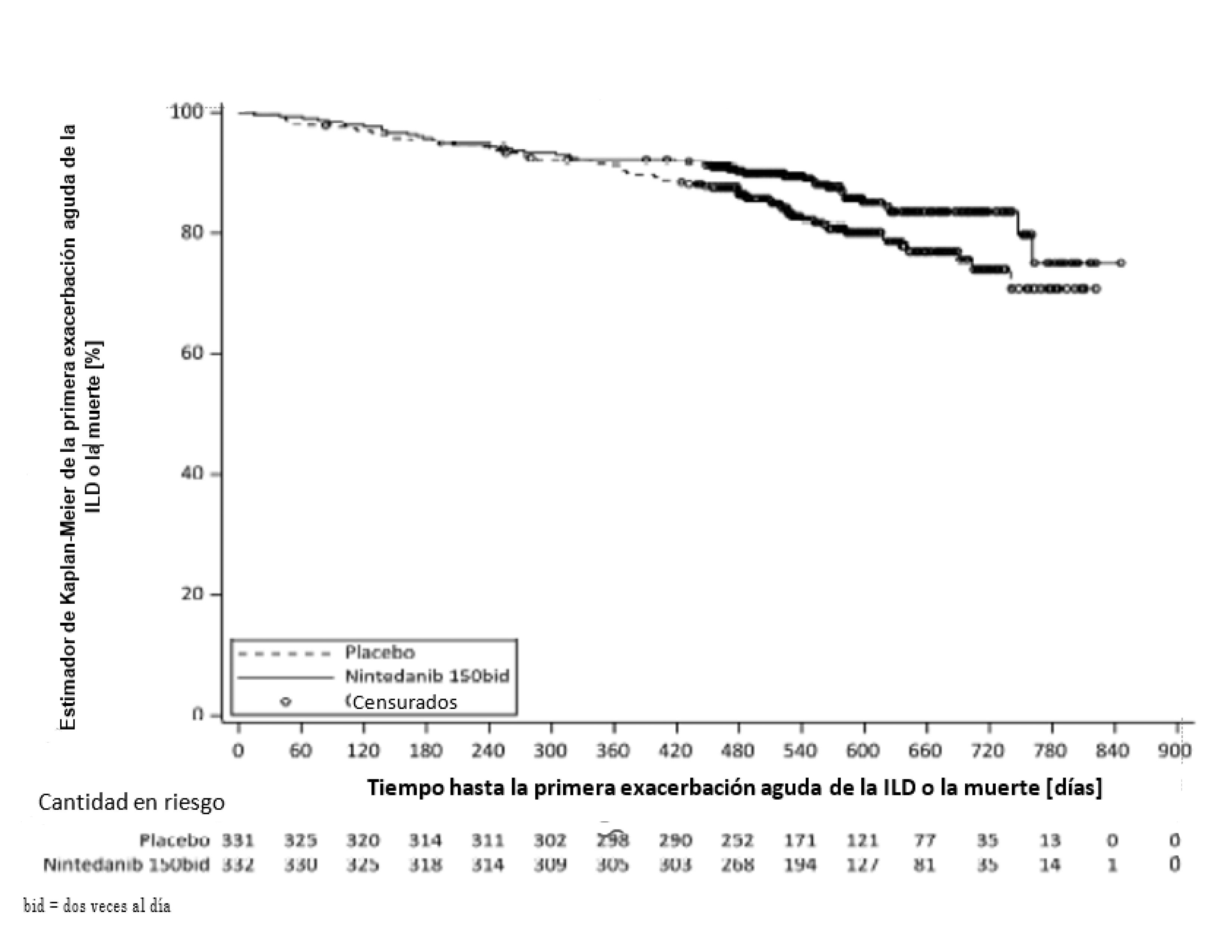
A partir del análisis de los datos de todo el estudio, se observó que el riesgo de padecer una primera exacerbación aguda de la ILD o la muerte disminuyó aún más en el grupo en tratamiento con OFEV® que en el grupo placebo: el HR fue 0,67 (IC del 95%: 0,46, 0,98; p nominal = 0,0387); esto indica una disminución del 33% en el riesgo de sufrir una primera exacerbación aguda de la ILD o la muerte en los pacientes tratados con OFEV® en comparación con los que recibieron el placebo (Figura 4).
Figura 4. Estimador de tiempo de Kaplan-Meier hasta la primera exacerbación aguda de la ILD o la muerte durante todo el estudio
Análisis de supervivencia. La proporción de pacientes que murieron durante 52 semanas fue 4,8% en el grupo de tratamiento con OFEV® en comparación con 5,1% en el grupo placebo. El HR fue 0,94 (IC del 95%: 0,47; 1,86; p nominal = 0,8544).
De acuerdo con el análisis de los datos de todo el estudio, el riesgo de muerte fue inferior en el grupo de tratamiento con OFEV® que en el grupo placebo. El HR fue 0,78 (IC del 95%: 0,50; 1,21; p nominal = 0,2594). Esto indica una reducción del 22% en el riesgo de muerte entre los pacientes tratados con OFEV® respecto de los que recibieron el placebo.
Tiempo hasta la progresión (≥ 10% disminución absoluta en el % de CVF previsto) o la muerte. En el estudio INBUILD, el riesgo de progresión (≥ 10% disminución absoluta en el % de CVF previsto) o de muerte se redujo en los pacientes tratados con OFEV®. La proporción de pacientes que presentaron un episodio a lo largo de 52 semanas fue 25,6% en el grupo de tratamiento con OFEV® y 37,5% en el grupo placebo. El HR fue 0,65 (IC del 95%: 0,49, 0,85; p nominal = 0,0017).
De acuerdo con el análisis de los datos de todo el estudio, la proporción de pacientes que experimentó un episodio de progresión (≥ 10% disminución absoluta en el % de CVF previsto) o la muerte fue 40,4% en el grupo de tratamiento con OFEV® y 54,7% en el grupo placebo. El HR fue 0,66 (IC del 95%: 0,53; 0,83; p nominal = 0,0003). Esto indica una reducción del 34% en el riesgo de progresión (≥ 10% disminución absoluta en el % de CVF previsto) o la muerte entre los pacientes tratados con OFEV® en comparación con los que recibieron placebo.
Calidad de vida. En el estudio INBUILD, se midió la calidad de vida relacionada con la salud a las 52 semanas por medio de:
• cambio absoluto respecto del nivel inicial del puntaje total del Cuestionario de King sobre enfermedades pulmonares intersticiales difusas (K-BILD) (rango de 0 a 100; los puntajes más altos indican un mejor estado de salud)
• cambio absoluto respecto del nivel inicial del puntaje correspondiente al síntoma disnea de Viviendo con fibrosis pulmonar (L-PF) (rango de 0 a 100; los puntajes más altos indican un mayor deterioro)
• cambio absoluto respecto del nivel inicial del puntaje correspondiente al síntoma tos de Viviendo con fibrosis pulmonar (L-PF) (rango de 0 a 100; los puntajes más altos indican un mayor deterioro)
El cambio de la media ajustada respecto del valor inicial en el puntaje total de K-BILD en la semana 52 fue 0,79 unidades en el grupo placebo y 0,55 en el grupo de tratamiento con OFEV®. La diferencia entre los grupos de tratamiento fue 1,34 (IC del 95%: -0,31; 2,98; p nominal: 0,1115).
El cambio absoluto de la media ajustada respecto del nivel inicial del puntaje correspondiente al síntoma disnea de L-PF en la semana 52 fue 4,28 en el grupo de tratamiento con OFEV® en comparación con 7,81 en el grupo placebo. La diferencia en la media ajustada entre los grupos a favor de OFEV® fue 3,53 (IC del 95%: -6,14, -0,92; p nominal = 0,0081). El cambio absoluto de la media ajustada respecto del nivel inicial del puntaje correspondiente al síntoma tos de L-PF en la semana 52 fue 1,84 en el grupo de tratamiento con OFEV® en comparación con 4,25 en el grupo placebo. La diferencia en la media ajustada entre los grupos a favor de OFEV® fue -6,09 (IC del 95%: -9,65, -2,53; p nominal = 0,0008).
Efecto sobre el intervalo QT: Se efectuaron y se analizaron mediciones de QT/QTc a partir de un estudio específico en el cual se comparó la monoterapia de nintedanib frente a la monoterapia de sunitinib en pacientes con carcinoma renal. En este estudio, dosis únicas orales de 200 mg de nintedanib y dosis múltiples orales de 200 mg de nintedanib administradas dos veces al día durante 15 días no prolongaron el intervalo QTcF.
Población pediátrica: No se han llevado a cabo estudios clínicos en niños ni adolescentes.
Farmacocinetica: La farmacocinética (PK) de nintedanib puede considerarse lineal en relación con el tiempo (es decir, los datos de las dosis únicas pueden extrapolarse a datos de dosis múltiples). La acumulación observada tras la administración de dosis múltiples fue de 1,04 veces para la Cmáx y de 1,38 veces para el AUCτ. Las concentraciones valle de nintedanib se mantuvieron estables durante más de un añoAbsorción. Nintedanib alcanzó las concentraciones plasmáticas máximas aproximadamente 2-4 horas después de la administración por vía oral como cápsulas de gelatina blanda en estado posprandial (rango: 0,5-8 horas;. La biodisponibilidad absoluta de una dosis de 100 mg fue 4,69% (IC del 90%: 3,615-6,078) en voluntarios sanos. La absorción y la biodisponibilidad se ven reducidas por los efectos de los transportadores y por un grado sustancial de metabolismo de primer paso.
La proporcionalidad a la dosis se demostró a través del incremento de la exposición a nintedanib (rango de dosis de 50-450 mg una vez al día y de 150-300 mg dos veces al día). Las concentraciones plasmáticas en estado de equilibrio dinámico se lograron dentro de un lapso de administración de una semana como máximo.
Tras la ingesta de alimentos, la exposición a nintedanib se incrementó aproximadamente un 20% en comparación con la administración en ayunas (IC: 95,3-152,5%) y la absorción fue más lenta (mediana de tmáx; en ayunas: 2,00 horas; en estado posprandial: 3,98 horas)
Distribución: Nintedanib sigue una cinética de disposición como mínimo bifásica. Tras la infusión intravenosa, se observó un importante volumen de distribución (Vss: 1050 L, 45,0% gCV).
El grado de unión a las proteínas de nintedanib observado in vitro en el plasma humano fue elevado, con una fracción ligada del 97,8%. Se considera que la albúmina sérica es la principal proteína de unión [91]. Nintedanib se distribuye preferentemente en el plasma, con una relación sangre:plasma de 0,869.
Biotransformación: La reacción metabólica prevalente en el caso de nintedanib es la escisión hidrolítica por esterasas, que conduce a la formación de la fracción ácido libre BIBF 1202. BIBF 1202 luego es glucuronizado por las enzimas UGT (a saber, UGT 1A1, UGT 1A7, UGT 1A8 y UGT 1A10) con la consecuente transformación en el BIBF 1202 glucurónido. Sólo un grado mínimo de la biotransformación de nintedanib estuvo relacionada con las vías del CYP, y CYP 3A4 fue la enzima predominante en dicho proceso. El principal metabolito dependiente de CYP no pudo ser detectado en el plasma en el estudio de absorción, distribución, metabolismo y eliminación (ADME) en humanos. In vitro, el metabolismo dependiente de CYP representó aproximadamente un 5% en comparación con alrededor de un 25% en el caso de la escisión de ésteres.
Eliminación: La depuración plasmática total tras la administración por infusión intravenosa fue elevada (CL: 1390 mL/min, 28,8% gCV). La eliminación urinaria del principio activo inalterado dentro de las 48 horas fue de aproximadamente el 0,05% de la dosis (gCV 31,5%) tras la administración por vía oral, y de aproximadamente el 1,4% de la dosis (gCV 24,2%) tras la administración por vía intravenosa; la depuración renal fue 20 mL/min (gCV 32,6%). La principal vía de eliminación de la radioactividad relacionada con el fármaco tras la administración por vía oral de [14C] nintedanib fue la excreción fecal/biliar (93,4% de la dosis, gCV 2,61%). La contribución de la eliminación renal a la depuración total fue baja (0,649% de la dosis, gCV 26,3%). La recuperación total se consideró completa (superior al 90%) dentro de los 4 días subsiguientes a la administración [97]. La vida media terminal de nintedanib fue de entre 10 y 15 horas (% gCV aprox. 50%)
Relación exposición-respuesta: Los análisis de exposición-respuesta de los pacientes con FPI, otras ILD crónicas fibrosantes con fenotipo progresivo y SSc-ILD indicaron una relación pseudo Emáx entre la exposición y la tasa de disminución anual de la CVF con un EC50 de alrededor de 3 ng/mL (error estándar relativo: alrededor de 55%). Para fines comparativos, la mediana de las concentraciones valle de nintedanib observadas para 150 mg dos veces por día de OFEV® fue de aproximadamente 10 ng/mL.
En lo que respecta a la seguridad, aparentemente hubo una relación débil entre la exposición plasmática a nintedanib y las elevaciones de los niveles de ALT y/o AST. La dosis real administrada podría ser un mejor predictor del riesgo de desarrollar diarrea de cualquier intensidad, incluso aunque no se pueda descartar la exposición plasmática como un factor de riesgo determinante (véase la sección Advertencias y precauciones especiales).
Factores intrínsecos y extrínsecos:
Poblaciones especiales: Las propiedades farmacocinéticas de nintedanib fueron similares en los voluntarios sanos, en los pacientes con FPI, pacientes con otras ILD crónicas fibrosantes con fenotipo progresivo, pacientes con SSc-ILD y en los pacientes oncológicos. Sobre la base de los resultados de los análisis de farmacocinética poblacional y las investigaciones descriptivas, la exposición a nintedanib no se vio influenciada por el sexo (con corrección para peso corporal), la existencia de una insuficiencia renal leve o moderada (estimada sobre la base del depuración de creatinina), la presencia de metástasis hepáticas, el puntaje de estado funcional ECOG, el consumo de alcohol ni el genotipo de P-gp.
Los análisis de farmacocinética poblacional indicaron efectos moderados sobre la exposición a nintedanib dependientes de la edad, el peso corporal y la raza (véase a continuación). Sobre la base de la elevada variabilidad entre individuos de la exposición que se observó en los estudios clínicos, estos efectos no se consideran clínicamente relevantes. (Véase la sección Advertencias y precauciones especiales).
Edad: La exposición a nintedanib se incrementó en forma lineal en función de la edad. Los valores de AUCτ,ss evidenciaron una reducción del 16% para un paciente de 45 años (percentil 5) y se incrementaron a razón de un 13% para un paciente de 76 años (percentil 95) respecto de un paciente con una mediana de edad de 62 años. El rango de edad cubierto por el análisis fue de 29 a 85 años; aproximadamente el 5% de la población era mayor de 75 años. No se han efectuado estudios en poblaciones pediátricas.
Peso corporal: Se observó una correlación inversa entre el peso corporal y la exposición a nintedanib. Los valores de AUCτ,ss se incrementaron a razón de un 25% para un paciente de 50 kg (percentil 5) y se redujeron a razón de un 19% para un paciente de 100 kg (percentil 95) respecto de un paciente con una mediana de peso de 71,5 kg.
Raza: La exposición media de la población a nintedanib fue 33-50% más alta en los pacientes procedentes de China, Taiwán e India y un 16% más alta en los pacientes japoneses, en tanto que fue 16-22% más baja en los pacientes de Corea, en comparación con los caucásicos (con corrección para peso corporal).
Los datos obtenidos a partir de sujetos de raza negra fueron muy limitados, pero se ubicaron dentro del mismo rango que aquellos de los sujetos caucásicos.
Insuficiencia hepática: En un estudio específico de dosis única de fase I en el que se tomó como blanco a sujetos sanos, la exposición a nintedanib, considerando tanto la Cmáx como el AUC, fue 2,2 veces mayor en voluntarios con insuficiencia hepática leve (Child Pugh A; IC del 90% de la Cmáx: 1,3-3,7; IC del 90% del AUC: 1,2-3,8, respectivamente). En voluntarios con insuficiencia hepática moderada (Child Pugh B), la exposición fue 7,6 veces mayor en términos de la Cmáx (IC del 90%: 4,4-13,2) y 8,7 veces mayor en términos del AUC (IC del 90%: 5,7-13,1), respectivamente, en comparación con pacientes sanos. No se estudiaron sujetos con insuficiencia hepática grave (Child Pugh C).
Tratamiento concomitante con pirfenidona: Se investigó el tratamiento concomitante de OFEV® con pirfenidona en un estudio específico de farmacocinética realizado en pacientes con FPI. El grupo 1 recibió una única dosis de 150 mg de OFEV® antes y después del ajuste ascendente de la dosis a 801 mg de pirfenidona tres veces al día en estado de equilibrio dinámico. El grupo 2 recibió tratamiento con 801 mg de pirfenidona tres veces al día en estado de equilibrio dinámico y se realizó una determinación del perfil farmacocinético antes y después de, al menos, 7 días de tratamiento concomitante con 150 mg de OFEV® dos veces al día. En el grupo 1, las proporciones ajustadas de la media geométrica (intervalo de confianza (IC) del 90%) fueron 93% (57%-151%) y 96% (70%-131%) para la Cmáx y el AUC0-tz de nintedanib, respectivamente (n=12). En el grupo 2, las proporciones ajustadas de la media geométrica (IC del 90%) fueron 97% (86%-110%) y 95% (86%-106%) para la Cmáx,ss y el AUCτ,ss de pirfenidona, respectivamente (n=12).
En base a estos resultados, no hay evidencia de la existencia de interacciones medicamentosas farmacocinéticas relevantes entre nintedanib y pirfenidona cuando estos fármacos se administran como tratamiento combinado.
Tratamiento concomitante con bosentán: Se investigó el tratamiento concomitante de OFEV® con bosentán en un estudio específico de farmacocinética realizado en voluntarios sanos. Los sujetos recibieron una única dosis de 150 mg de OFEV® antes y después de dosis múltiples de 125 mg de bosentán dos veces al día en estado de equilibrio dinámico. Las proporciones ajustadas de la media geométrica (intervalo de confianza (IC) del 90%) fueron 103% (86%-124%) y 99% (91%-107%) para la Cmáx y el AUC0-tz de nintedanib, respectivamente (n=13), lo cual indica que la coadministración de nintedanib y bosentán no alteró la farmacocinética de nintedanib.
Tratamiento concomitante con anticonceptivos hormonales orales: En un estudio farmacocinético específico, pacientes de sexo femenino con SSc-ILD recibieron una dosis única de una combinación de 30 μg de etinilestradiol y 150 μg de levonorgestrel antes y después de la administración de 150 mg de nintedanib dos veces al día durante al menos 10 días. Las proporciones ajustadas de la media geométrica (intervalo de confianza (IC) del 90%) fueron 117% (108%-127%; Cmáx) y 101% (93%-111%; AUC0-tz) para etinilestradiol y 101% (90%-113%; Cmáx) y 96% (91%-102%; AUC0-tz) para levonorgestrel, respectivamente (n=15); lo cual indica que la coadministración de nintedanib no tiene efecto relevante en la exposición plasmática del etinilestradiol ni del lovonorgestrel.
Potencial de interacciones medicamentosas:
Metabolismo: No es dable esperar que se produzcan interacciones medicamentosas entre nintedanib y los sustratos del CYP, los inhibidores del CYP o los inductores del CYP, ya que nintedanib, BIBF 1202 y el glucurónido BIBF 1202 no evidenciaron efectos de inhibición ni de inducción de las enzimas del CYP en los ensayos preclínicos y nintedanib no fue metabolizado en un grado relevante por las enzimas del CYP.
Transporte: Nintedanib es un sustrato de la P-gp. Para el potencial de interacción de nintedanib con este transportador, véase la sección Interacciones. Se ha comprobado que nintedanib no es un sustrato ni un inhibidor de OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 o MRP-2 in vitro. Nintedanib tampoco fue un sustrato de la proteína de resistencia al cáncer de mama (BCRP). Solo se observó un débil potencial inhibidor sobre OCT-1, BCRP y P-gp in vitro, el cual se considera de escasa relevancia clínica. Lo mismo aplica a nintedanib en cuanto a ser un sustrato de OCT-1
CONTRAINDICACIONES: OFEV® está contraindicado en pacientes con hipersensibilidad conocida a nintedanib, al maní o a la soja o a cualquiera de sus excipientes (véase el ANEXO Composición del Producto).
OFEV® está contraindicado durante el embarazo (véanse las secciones Embarazo, lactancia y fertilidad, Toxicología).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIA: No se han llevado a cabo estudios de los efectos de este fármaco sobre la capacidad para conducir vehículos y operar maquinaria.
Debe indicarse a los pacientes que deben tener precaución al conducir vehículos u operar maquinaria durante el tratamiento con OFEV®.
REACCIONES ADVERSAS: Resumen del perfil de seguridad: OFEV® ha sido estudiado en estudios clínicos en los que participaron 1529 pacientes cicafibrosis pulmonar idiopática (FPI), 663 pacientes con otras enfermedades pulmonares intersticiales (ILD) crónicas fibrosantes con fenotipo progresivo y 576 pacientes con enfermedad pulmonar intersticial asociada a esclerosis sistémica (SSc-ILD).
Los datos de seguridad que se brindan a continuación están basados doslo siguiente:
• Dos estudios aleatorizadoño doble ciegdoscomparativos con placebo, de fatesIII, en los que se comparó el tratamiento con OFEV® 150 mg dos veces al de acontra placebo durante 52 semanas (INPULSIS-1 e INPULSIS-2)an en los que participaron 1061 pacientes con FPI.
• Un estudio aleatorizado, doble ciego, comparativo con placebo, de fase III en el que se comparó el tratamiento con OFEV® 150 mg dos veces al día contra placebo durante al menos 52 semanas en 663 pacientes con otras ILD crónicas fibrosantes con fenotipo progresivo (INBUILD).
• Un estudio aleatorizado, doble ciego, comparativo con placebo, de fase III, en el que se comparó el tratamiento con OFEV® 150 mg dos veces al día contra placebo durante al menos 52 semanas y en el que participaron 576 pacientes con SSc-ILD (SENSCIS).
• Los datos observados duranodola experiencia posterior a la comercializaciónos
En los estudios clínicos, las reacciones adversas asociadas con el uso de OFEV® informados con mayor frecuencia fueron diarrea, náuseas y vómitos, dolor abdominal, disminución del apetito, descenso de pesoiónaumento de las enzimas hepáticas.
El perfil de seguridad de OFEV® en un estudio de extensión a largo plazo en pacientes con FPI, tratados durante un período de 1 a más de 5 años, fue concordante con el observado en los estudios de fase III (véase la sección Estudios clínicos).
Para el manejo de las reacciones adversas seleccionadas véase la sección Advertencias y precauciones especiales.
|
Tabla 1. Resumen tabulado de reacciones adversas |
|
|
Terminología de la clasificación por sistema y órgano del MedDRA |
Reacciones adversas de nintedanib |
|
Trastornos gastrointestinales |
Diarrea Vómitos Náuseas Dolor abdominal Pancreatitis |
|
Trastornos hepatobiliares |
Lesión hepática producida por medicamentos • Aumento de las enzimas hepáticas • Aumento de la alanina aminotransferasa (ALT) • Aumento de la aspartato aminotransferasa (AST) • Aumento de la fosfatasa alcalina en sangre (ALKP) • Aumento de la gamma glutamiltransferasa (GGT) • Hiperbilirrubinemia |
|
Trastornos vasculares |
Hipertensión Sangrado1,2 |
|
Trastornos de la sangre y del sistema linfático |
Trombocitopenia |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito Descenso de peso |
|
Trastornos de la piel y del tejido subcutáneo |
Exantema Prurito Alopecia |
|
Trastornos del sistema nervioso |
Cefalea |
|
Trastornos renales y urinarios |
Proteinuria2) |
|
1) El término representa un grupo de eventos que describen un concepto médico más amplio que una única afección o término preferente del MedDRA. 2) Los eventos hemorrágicos serios y no serios, algunos de los cuales resultaron mortales, se han observado en el período posterior a la comercialización. |
|
INTERACCIONES: Glicoproteína P (P-gp): Nintedanib es un sustrato de la P-gp (véase la sección Farmacocinética). La coadministración con ketoconazol, un inhibidor potente de la P-gp, incrementó la exposición a nintedanib por un factor de 1,61 sobre la base del AUC y por un factor de 1,83 sobre la base de la Cmáx en un estudio de interacciones medicamentosas específico.
En un estudio de interacciones medicamentosas realizado con rifampicina, un potente inductor de la P-gp, la exposición a nintedanib se redujo a un 50,3% sobre la base del AUC y a un 60,3% sobre la base de la Cmáx ante la coadministración con rifampicina en comparación con la administración de nintedanib solo.
Si se coadministran junto con OFEV®, los inhibidores potentes de la P-gp (p. ej., ketoconazol o eritromicina) pueden incrementar la exposición a nintedanib. En tales casos, debe implementarse un control estrecho de los pacientes a fin de determinar la tolerabilidad a nintedanib. El manejo de los efectos secundarios puede requerir la reducción de la dosis o bien la suspensión temporaria o definitiva del tratamiento con OFEV® (véase la sección Posología y administración). Los inductores potentes de la P-gp (p. ej., rifampicina, carbamazepina, fenitoína y hierba de San Juan) pueden reducir la exposición a nintedanib. Debe considerarse la elección de otra medicación concomitante alternativa que tenga un potencial de inducción de la P-gp nulo o mínimo.
Alimentos: Se recomienda que OFEV® se administre con alimentos (véase la sección Farmacocinética).
Enzimas del citocromo (CYP): Sólo una pequeña parte de la biotransformación de nintedanib involucró las vías del CYP. Nintedanib y sus metabolitos, la fracción ácido libre BIBF 1202 y su glucurónido BIBF 1202 glucurónido, no inhibieron ni indujeron las enzimas del CYP en los estudios preclínicos (véase la sección Farmacocinética). Por lo tanto, se considera que la probabilidad de que se produzcan interacciones medicamentosas con nintedanib basadas en el metabolismo del CYP es baja.
Coadministración con otros fármacos: La coadministración de nintedanib junto ces.bosentán no alteró la farmacocinética de nintedanib (véase la sección Farmacocinética).
La coadministración de nintedanib junto con anticonceptivos hormonales orales no alteró la farmacocinética de los anticonceptivos hormonales orales en ningún grado relevante [35] (véase la sección Farmacocinética).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Riesgo de hipertensión, alteración del intervalo QT y reacciones de hipersensibilidad.
• Trastornos gastrointestinales:
Diarrea: En los estudios clínicos (véase la sección Estudios clínicos), la diarrea fue el evento gastrointestinal informado con mayor frecuencia. En la mayoría de los pacientes, el evento fue de intensidad leve a moderada y se produjo dentro de los primeros 3 meses de tratamiento. En los estudios INPULSIS realizados en pacientes con FPI, se informó diarrea en el 62,4% versus el 18,4% de los pacientes tratados con OFEV® y placebo, respectivamente. La diarrea condujo a una reducción de la dosis de OFEV® en el 10,7% de los pacientes y a la interrupción de OFEV® en el 4,4% de los pacientes. En el estudio INBUILD realizado en pacientes con otras ILD crónicas fibrosantes con fenotipo progresivo, se informó diarrea en el 66,9% versus el 23,9% de los pacientes tratados con OFEV® y placebo, respectivamente. La diarrea condujo a una reducción de la dosis de OFEV® en el 16,0% de los pacientes y a la interrupción del tratamiento con OFEV® en el 5,7% de los pacientes. En el estudio SENSCIS realizado en pacientes con SSc-ILD, se informó diarrea en el 75,7% versus el 31,6% de los pacientes tratados con OFEV® y placebo, respectivamente. La diarrea condujo a una reducción de la dosis de OFEV® en el 22,2% de los pacientes y a la interrupción de OFEV® en el 6,9% de los pacientes. (véase la sección Reacciones adversas).
La diarrea debe tratarse ante la aparición de los primeros síntomas con hidratación adecuada y coesmedicamentos antidiarreicos, p. ej., loperamida, y puede requerir la reducción de la dosis o la interrupción del tratamiento. El tratamiento con OFEV® podrá reanudarse en una dosis reducida (100 mg dos veces al día) o en la dosis completa (150 mg dos veces al día). En el caso de que persista un cuadro de diarrea grave a pesar del tratamiento sintomático, deberá interrumpirse el tratamiento con OFEV®.
Náuseas y vómitos: Las náuseas y los vómitos fueron eventos adversos informados con frecuencia (véase la secció Reacciones adversas). En la mayoría de los pacientes con náuseas y vómitos, el evento fue de intensidad leve a moderada. En los estudios INPULSIS, las náuseas condujeron a la interrupcióibdel tratamiento con OFEV® en el 2,0% de los pacientos y los vómitos condujeron a la interrupción de este fármaco en el 0,8% de los pacientes. En el estudio INBUILD, la frecuencia de náuseas y vómitos que causaron la interrupción de tratamiento con OFEV® fue de 0,3% y 0,9% respectivamente. En el estudio SENSCIS, la frecuencia de náuseas y vómitos que causaron la interrupción del tratamiento con OFEV® fue del 2,1% y 1,4%, respectivamente.
Si los síntomas persisten a pesar de haberse instaurado un tratamiento de soporte adecuado (lo que incluye tratamiento antiemético), puede ser necesario implementar una reducción de la dosis o la interrupción del tratamiento. El tratamiento podrá reanudarse en una dosis reducida (100 mg dos veces al día) o en la dosis completa (150 mg dos veces al día). Ante la presencia de síntomas graves que persistan, deberá interrumpirse el tratamiento con OFEV®.
La diarrea y los vómitos pueden producir deshidratación con o sin desequilibrio electrolítico, lo que podría conducir a un deterioro de la función ren.
Función hepática: La seguridad y la eficacia de OFEV® no han sido estudiadas en pacientes con insuficiencia hepática moderada (Child Pugh B) o grave (Child Pugh C). Por lo tanto, no se recomienda el tratamiento con OFEV® en dichos pacientes.
Sobre la base de que existe una mayor exposición, es posible que los pacientes con insuficiencia hepática leve (Child Pugh A) corran más riesgos de sufrir eventos adversos. Los pacientes con insuficiencia hepática leve (Child Pugh A) deben tratarse con una dosis reducida de OFEV® (véanse las secciones Posología y administración, Farmacocinética).
Se han observado casos de lesión hepática producida por medicamentos con el tratamiento con nintedanib. En el período posterior a la comercialización, se han informado casos serios y casos no serios ddolesión hepática producida por el medicamento, incluscolesión hepática grave con desenlace mortal. La mayoría de los eventos hepáticos ocurren dentro de los primeros tres meses de tratamiento. Por lo tanto, deben determinarse los niveles de bilirrubina y transaminasas hepáticas al iniciarse el tratamiento con OFEV®, a intervalos periódicos durante los primeros tres meses de tratamiento y luego a intervalos periódicos (p. ej., en cada visita del paciente) o según esté clínicamente indicadesEl aumento de las enzimas hepáticas (ALT, AST, ALKP, gamma glutamiltransferasa (GGT)) y de los valores de bilirrubina fueron reversibles con la reducción de la dosis o la interrupción del tratamiento, en la mayoría de los casos.
En el caso de detectarsesaumento de las transaminasas (AST o ALT) > 3 veces el límite normal superior (ULN), se recomienda la reducción de la dosis o la interrupción del tratamiento con OFEV® y el monitoreo estrecho del paciente. Una vez que las transaminasas hayan retornado a los valoreesiniciales, el tratamiento con OFEV® podrá incrementarse nuevamente a la dosis completa (150 mg dos veces al día) o bien reiniciarse en una dosis reducida (100 mg dos veces al día), que luego podrá incrementarse hasta llegar a la dosis complea. (véase la sección Posología y administracida). Si algnao desestos aumentos en los parámetros de la función hepática estuviera asocidao con signos o síntomas clínicos de lesión hepática, p. ej., ictericia, deberá interrumpirse en forma definitiva el tratamiento con OFEV®. Deben investigarse las causas alternativas deslos aumentos de las enzimas hepáticas.
Los pacientes con bajo peso corporal (< 65 kg), los de raza asiática y las mujeres tienen un mayor riesgo desaumento de las enzimas hepáticas.
La exposición a nintedanib se incrementó de manera lineal en función de la edad de los pacientes, lo que también puede dar lugar a un mayor riesgo de desarrollaesaumento de las enzimas hepáticas (véase la sección Farmacocinética).
Se recomienda un monitoreo estrecho en los pacientes que presenten estos factores de riesgo.
Hemorragia: La inhibición del VEGFR podría estar asociada con un mayor riesgo de sangrado.
En los estudioISclínicos con OFEV®, la frecuencia de pacientes que tuvieron eventos adversos de sangrado fue ligeramente más alta edolos pacientes tratados con OFEV (o fue similar entre los grupos de tratamiento (OFEV® 10n % versus placeb (7).% para INPULSIS; OFEV® 11,1% versus placebo 12,7% para INBUILD; OFEV® 11,1% versus placebo 8,3% para SENSCIS) La epistaxis no seria fue el evento hemorrágice.informado con mayor frecuencia. Los eventos hemorrágicos serios se produjeron con frecuencias bajas en los 2 grupos de tratamiento (OFEV® 1,3% versus placeo: 1. % para INPULSIS; OFEV® 0,9% versus placebo 1,5% para INBUILD; OFEV® 1,4% versus placebo 0,7% para SENSCIS).
Los pacientes que tenían un riesgo conocido de sangrado, lo que incluye a los pacientes con una predisposición hereditaria al sangrado o los pacientes que estaban recibiendo una dosis completa de tratamiento anticoagulante, no fueron incluidos en los estudioISclínicos. Por lo tanto, el tratamiento con OFEV® en estos pacientes podrá implementarse únicamente en el caso de que el beneficio previsto supere el potencial riesgo implicado. En el período posterior a la comercialización, se han observado eventos hemorrágicos serios y no serios, algunos de los cuales resultaron mortales.
Eventos tromboembólicos arteriales: Los pacientes con antecedentes recientes de infarto de miocardio o accidente cerebrovascular fueron excluidos de los estudioibclínicos. En los estudios clínicos, los eventos tromboembólicos arteriales fueron eventos infrecuentes (OFEV® 2,5% versus placebo 0,7% para INPULSIS; OFEV® 0,9% versus placebo 0,9% para INBUILD; OFEV® 0,7% versus placebo 0,7% para SENSCIS). En los estudios INPULSIS, un porcentaje mayor de pacientes experimentó infartos de miocardio en el grupo de tratamiento con OFEV® (1,6%) en comparación con el grupo placebo (0,5%), mientras que los eventos adversos que reflejan una cardiopatía isquémica estuvieron equilibrados entre el grupo tratado con OFEV® y el grupo tratado con placebo. En los estudios INBUILD y SENSCIS, el infarto de miocardio se observó con frecuencia baja: OFEV® 0,9% versus placebo 0,9% para INBUILD; OFEV® 0% versus placebo 0,7% para SENSCIS.
Debe tenerse precaución al tratar pacientes con riesgo cardiovascular incrementado, lo que incluye arteriopatía coronaria conocida. Debe considerarse la interrupción del tratamiento en los pacientes que desarrollen signos o síntomas de isquemia aguda de miocarda.
Tromboembolia venosa: En los estudioISclínicos, no se observó ningún riesgdomayor de tromboembolia venosa en los pacientes tratados con OFEV®. Debido al mecanismo de acción de nintedanib, los pacientes podrían tener un mayor riesgo de padecer eventos tromboembólicos.
Perforaciones gastrointestinales: En los estudios clínicos, no se observó ningún riesgdomayor de perforación gastrointestinal en los pacientes tratados con OFEV®. Debido al mecanismo de acción de nintedanib, los pacientes podrían tener un mayor riesgo de padecer eventos de perforación gastrointestinal. Se han informado casos de perforaciones gastrointestinales (algunos mortales) en el período posterior a la comercializacin. [30; 31]. Debe tenerse especial cuidado al tratar a pacientes con una cirugía abdominal previa, antecedentes recientes de perforación de un órgano hueco, antecedentes de úlcera péptica, enfermedad diverticular o que estén recibiendo tratamiento concomitante con corticosteroides o AINE [3]. Por lo tanto, debe dejarse transcurrir un mínimo de 4 semanas luego de una cirugía mayor, lo que incluye una cirugía abdominal, antes de iniciar la administración de OFEV®. El tratamiento con OFEV® debe suspenderse definitivamente en los pacientes que desarrollen una perforación gastrointestinal.
Proteinuria de rango nefrótico: Después de la comercialización se consignaron muy pocos casos de proteinuria de rango nefrótico. Los hallazgos histológicos de los casos individuales fueron coherentes con microangiopatía glomerular con o sin trombos renales. Se observó reversión de los síntomas tras discontinuar la OFEV®. Se debe considerar la interrupción del tratamiento en pacientes que desarrollen signos o síntomas de síndrome nefrótico.
Complicaciones de la cicatrización de las heridas: Sobre la base de su mecanismo de acción, nintedanib podría dificultar ll cicatrización normal de las heridas. No se observó un aumento de la frecuencia de problemas de cicatrización de las heridas en los estudios clínicos. No se llevó a cabo ningún estudio específico en el que se investigara el efecto de nintedanib sobre la cicatrización de las heridas. Por lo tanto, el tratamiento con OFEV® debe ser iniciado, o reanudado en el caso de haber sido suspendido por una intervención quirúrgica, tras la confirmación de una correcta cicatrización de las heridas sobre la base del criterio clínico.
POSOLOGÍA Y ADMINISTRACIÓN: El tratamiento debe ser iniciado por médicos con experiencia en el diagnóstico y el tratamiento de las afecciones para las cuales OFEV® está indicado. La dosis recomendada de OFEV® es 150 mg dos veces al día administrada con un intervalo de aproximadamente 12 horas entre sí.
No debe excederse la dosis diaria máxima recomendada de 300 mg.
Ajustes de la dosis: Además de la instauración de tratamiento sintomático, en el caso de corresponder, el manejo de las reacciones adversas (véanse las secciones Advertencias y precauciones especiales, Reacciones adversas) de OFEV® podría incluir la reducción de la dosis y la interrupción temporaria de la administración del fármaco hasta que la reacción adversa en cuestión se haya resuelto a un nivel que permita la continuación del tratamiento. El tratamiento con OFEV® podrá reanudarse con la dosis completa (150 mg dos veces al día) o con una dosis reducida (100 mg dos veces al día). Si el paciente no tolera el régimen de 100 mg dos veces al día, debe interrumpirse el tratamiento con OFEV®.
En el caso de interrupciones a raíz de elevaciones de las transaminasas (AST o ALT) > 3 veces el límite normal superior (ULN), una vez que las transaminasas hayan retornado a los valores iniciales, el tratamiento con OFEV® podrá reiniciarse en una dosis reducida (100 mg dos veces al día), que luego podrá incrementarse hasta llegar a la dosis completa (150 mg dos veces al día). (véanse las secciones Advertencias y precauciones especiales, Reacciones adversas).
• Poblaciones especiales:
Población pediátrica: La seguridad y la eficacia de OFEV® en pacientes pediátricos no han sido estudiadas en estudios clínicos.
Pacientes de edad avanzada (≥ 65 años): No se observaron diferencias en general en lo que respecta a la seguridad y la eficacia en los pacientes de edad avanzada en comparación con los pacientes menores de 65 años. No se requiere ajuste de la dosis inicial en función de la edad del paciente (véase la sección Farmacocinética)
Raza: Sobre la base de los análisis de farmacocinética poblacional, no se requiere a priori ningún ajuste de la dosis de OFEV® (véanse las secciones Poblaciones especiales, Advertencias y precauciones especiales, Farmacocinética). Son limitados los datos de seguridad disponibles en relación con los pacientes de raza negra.
Peso corporal: Sobre la base de los análisis de farmacocinética poblacional, no se requiere a priori ningún ajuste de la dosis de OFEV® (véase la sección Farmacocinética).
Insuficiencia renal: Menos del 1% de una dosis única de nintedanib se elimina a través de los riñones (véase la sección Farmacocinética). No se requiere un ajuste de la dosis inicial en los pacientes con insuficiencia renal leve a moderada. La seguridad, la eficacia y la farmacocinética de nintedanib no han sido estudiadas en pacientes con insuficiencia renal grave (depuración de creatinina: CrCL < 30 mL/min)
Insuficiencia hepática: Nintedanib se elimina primordialmente a través de la excreción por vía biliar/fecal (> 90%). La exposición aumentó en pacientes con insuficiencia hepática (Child Pugh A, Child Pugh B; véase la sección Farmacocinética).
En pacientes con insuficiencia hepática leve (Child Pugh A), la dosis recomendada de OFEV® es 100 mg dos veces al día con un intervalo de aproximadamente 12 horas entre sí.
Debe considerarse la interrupción o suspensión del tratamiento para el manejo de las reacciones adversas en pacientes con insuficiencia hepática leve (Child Pugh A).
La seguridad y la eficacia de nintedanib no han sido investigadas en pacientes con insuficiencia hepática clasificada como Child Pugh B o C. No se recomienda el tratamiento con OFEV® en los pacientes con insuficiencia hepática moderada (Child Pugh B) o grave (Child Pugh C); véase la sección Farmacocinética.
Modo de administración: Las cápsulas de OFEV® deben tomarse por vía oral, preferentemente con alimentos; deben tragarse enteras con agua y no deben masticarse ni triturarse.
SOBREDOSIS: No existe ningún antídoto ni tratamiento específico para la sobredosis de OFEV®. La dosis única más alta de nintedanib administrada en los estudios de fase I fue 450 mg una vez al día. Asimismo, 2 pacientes del programa de oncología tuvieron una sobredosis de un máximo de 600 mg dos veces al día (b.i.d.) durante un total de hasta ocho días. Los eventos adversos observados fueron coherentes con el perfil de seguridad conocido de nintedanib, es decir, aumento de las enzimas hepáticas y síntomas gastrointestinales. Ambos pacientes se recuperaron de dichas reacciones adversas.
En los estudios INPULSIS, un paciente fue expuesto inadvertidamente a una dosis de 600 mg diarios durante un total de 21 días. Hubo un evento adverso no serio (nasofaringitis) que se produjo y se resolvió durante el período de administración de la dosis incorrecta, sin que se observara el inicio de otros eventos informados.
En el caso de una sobredosis, debe interrumpirse el tratamiento y deben iniciarse medidas de soporte generales según corresponda.
TOXICOLOGÍA:
Toxicología general: Los estudios de toxicidad de dosis únicas en ratas y en ratones indicaron un bajo potencial de toxicidad aguda para nintedanib. En los estudios de toxicología de dosis repetidas en ratas, los efectos adversos (p. ej., engrosamiento de las placas epifisarias, lesiones de los incisivos) estuvieron mayormente relacionados con el mecanismo de acción (es decir, inhibición del VEGFR-2) de nintedanib. Estos cambios son efectos conocidos de otros inhibidores del VEGFR-2 y pueden considerarse efectos de la clase farmacológica.
Se observó un cuadro de diarrea y vómitos acompañado de una disminución del consumo de alimentos y descenso del peso corporal en los estudios de toxicidad efectuados en no roedores.
No hubo evidencia de elevación de las enzimas hepáticas en ratas, perros ni monos Cynomolgus. Las elevaciones leves de las enzimas hepáticas que no se debieron a efectos adversos serios, como la diarrea, se observaron únicamente en los monos Rhesus.
Toxicidad para la reproducción: Un estudio de fertilidad masculina y desarrollo embrionario temprano en ratas que abarcó hasta la fase de implantación no reveló ningún efecto sobre la fertilidad masculina ni el aparato reproductor de los machos.
En las ratas, se observó letalidad embriofetal y efectos teratogénicos en niveles de exposición inferiores a la exposición humana, con la dosis recomendada máxima en los seres humanos (MRHD) de 150 mg dos veces al día. También se observaron efectos sobre el desarrollo del esqueleto axial y sobre el desarrollo de las grandes arterias en niveles de exposición subterapéuticos.
En los conejos, se observó letalidad embriofetal y efectos teratogénicos comparables a los detectados en las ratas con una exposición ligeramente superior a la de las ratas
En las ratas, se observó la eliminación de pequeñas cantidades de nintedanib radiomarcado y/o sus metabolitos en la leche (≤ 0,5% de la dosis administrad.)
A partir de los estudios de carcinogenia de 2 años de duración realizados en ratones y ratas, no surgió evidencia alguna de un potencial carcinogénico de nintedanib.
Los estudios de genotoxicidad no indicaron ningún potencial mutagénico para nintedanib.
• Composición del producto: OFEV®
|
1 cápsula contiene 100 mg de nintedanib (= base libre) |
Texto consignado en la etiqueta (sección Advertencias y precauciones o de acuerdo con los requisitos locales) |
|
Excipientes |
|
|
Lecitina de soja (E322) |
OFEV® contiene lecitina de soja. Si usted es alérgico al maní o a la soja, no utilice este medicamento. |
|
1 cápsula contiene 150 mg de nintedanib (= base libre) |
Texto consignado en la etiqueta (sección Advertencias y precauciones o de acuerdo con los requisitos locales) |
|
Excipientes |
|
|
Lecitina de soja (E322) |
OFEV® contiene lecitina de soja. Si usted es alérgico al maní o a la soja, no utilice este medicamento. |
Frecuencias de reacciones adversas: OFEV®
Categorías de frecuencia:
• Muy frecuente: ≥1/10
• Frecuente: ≥1/100 - <1/10
• Poco frecuente: ≥1/1000 - <1/100
• Rara: ≥1/10000 - <1/1000
• Muy rara: <1/10000
• Desconocida: no pueden estimarse a partir de los datos disponibles
Nota: Las categorías de frecuencia mencionadas anteriormente se basan en los lineamientos de SmPC de la UE (septiembre de 2009). Por consiguiente, en países fuera de la Unión Europea, es posible que sean apropiadas otras definiciones.
|
Tabla 12. OFEV: Categorización de frecuencias de reacciones adversas al medicamento en pacientes con FPI, otras ILD fibrosantes crónicas con fenotipo progresivo y Ssc-ILD |
||||
|
Terminología de la clasificación por sistema y órgano del MedDRA |
Reacciones adversas de nintedanib según el término literal de la CCDSTP del MedDRA (versión 16.1) |
Categoría de frecuencia según los lineamientos de SmPC de la UE |
||
|
FPI |
Otras ILD crónicas fibrosantes con fenotipo progresivo |
SSc-ILD |
||
|
Trastornos de la sangre y del sistema linfático |
Trombocitopenia |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito |
Frecuente |
Muy frecuente |
Frecuente |
|
Descenso de peso |
Frecuente |
Frecuente |
Frecuente |
|
|
Trastornos vasculares |
Hipertensión |
Poco frecuente |
Frecuente |
Frecuente |
|
Sangrado1 |
Frecuente |
Frecuente |
Frecuente |
|
|
Trastornos gastrointestinales |
Diarrea |
Muy frecuente |
Muy frecuente |
Muy frecuente |
|
Náuseas |
Muy frecuente |
Muy frecuente |
Muy frecuente |
|
|
Dolor abdominal |
Muy frecuente |
Muy frecuente |
Muy frecuente |
|
|
Vómitos |
Frecuente |
Muy frecuente |
Muy frecuente |
|
|
Pancreatitis |
Poco frecuente |
Poco frecuente |
Desconocida |
|
|
Trastornos hepatobiliares |
Lesión hepática producida por medicamentos |
Poco frecuente |
Frecuente |
Poco frecuente |
|
Elevación de las enzimas hepáticas |
Muy frecuente |
Muy frecuente |
Muy frecuente |
|
|
Elevación de la alanina aminotransferasa |
Frecuente |
Muy frecuente |
Frecuente |
|
|
Elevación de la aspartato aminotransferasa |
Frecuente |
Frecuente |
Frecuente |
|
|
Elevación de la gamma glutamiltransferasa |
Frecuente |
Frecuente |
Frecuente |
|
|
Elevación de la fosfatasa alcalina en sangre |
Poco frecuentes |
Frecuentes |
Frecuentes |
|
|
Hiperbilirrubinemia |
Poco frecuente |
Poco frecuente |
Desconocida |
|
|
Trastornos de la piel y del tejido subcutáneo |
Exantema |
Frecuente |
Frecuente |
Poco frecuente |
|
Prurito |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
|
Alopecia |
Poco frecuente |
Poco frecuente |
Desconocida |
|
|
Trastornos del sistema nervioso |
Cefalea |
Frecuente |
Frecuente |
Frecuente |
|
Trastornos renales y urinarios |
Proteinuria |
Poco frecuente |
Poco frecuente |
Desconocida |
|
1Excepcionalmente LLT |
||||
PRESENTACIÓN: OFEV® 100 mg: Caja por 60 cápsulas (Reg. San. No. INVIMA 2017M-0017965)
OFEV® 150 mg: Caja por 60 cápsulas (Reg. San. No. INVIMA 2017M-0017966).
¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (+601) 319 91 00
, e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A.
Versión 20 del 07 de octubre de 2020